Zestoretic 5/12.5g/mg Lisinopril Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zestoretic en hoe wordt het gebruikt?
Zestoretic is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hypertensie (hoge bloeddruk) en vochtretentie te behandelen. Zestoretic 5 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Het is niet bekend of Zestoretic 5 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Zestoretic 5 mg?
Zestoretic kan ernstige bijwerkingen veroorzaken, waaronder:
- licht in het hoofd voelen,
- oogpijn of problemen met het gezichtsvermogen,
- weinig of geen plassen,
- zwakheid,
- slaperigheid,
- rusteloos voelen,
- koorts ,
- rillingen,
- keelpijn,
- zweertjes in de mond,
- moeite met slikken,
- geel worden van de huid en ogen (geelzucht),
- misselijkheid,
- braken,
- tintelend gevoel,
- pijn op de borst,
- onregelmatige hartslag of fladderend in uw borst,
- verlies van beweging,
- beenkrampen,
- constipatie,
- extreme dorst,
- meer plassen,
- gevoelloosheid of tintelingen,
- spier zwakte,
- hoofdpijn,
- verlies of coördinatie, en
- onvast voelen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zestoretic zijn:
- hoesten
- hoofdpijn
- duizeligheid
- zich moe voelen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zestoretic. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ZESTORETIC.
- Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken. Zien WAARSCHUWINGEN Foetale toxiciteit.
OMSCHRIJVING
ZESTORETIC® (Lisinopril en Hydrochloorthiazide) combineert een angiotensine-converterende enzymremmer, lisinopril, en een diureticum, hydrochloorthiazide.
Lisinopril, een synthetisch peptidederivaat, is een orale langwerkende angiotensineconverterende enzymremmer. Het wordt chemisch beschreven als (S)-1-[N2-(1-carboxy-3-fenylpropyl)-L-lysyl]-L-prolinedihydraat. De empirische formule is C21H31N3O5. 2H2O en zijn structuurformule is:
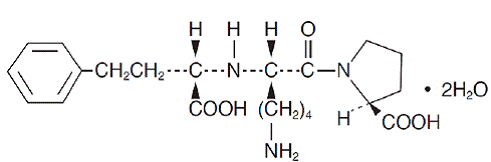
Lisinopril is een wit tot gebroken wit, kristallijn poeder met een molecuulgewicht van 441,53. Het is oplosbaar in water, matig oplosbaar in methanol en praktisch onoplosbaar in ethanol.
Hydrochloorthiazide is 6-chloor-3,4-dihydro-2H-1,2,4-benzothiadiazine-7-sulfonamide 1,1-dioxide. De empirische formule is C7H8ClN3O4S2 en de structuurformule is:
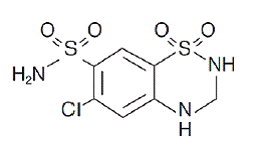
Hydrochloorthiazide is een wit of praktisch wit kristallijn poeder met een molecuulgewicht van 297,72, dat enigszins oplosbaar is in water, maar goed oplosbaar is in natriumhydroxide-oplossing.
ZESTORETIC 5 mg is beschikbaar voor oraal gebruik in drie tabletcombinaties van lisinopril met hydrochloorthiazide: ZESTORETIC 10-12,5 met 10 mg lisinopril en 12,5 mg hydrochloorthiazide; ZESTORETIC 20Referentie 12,5 bevat 20 mg lisinopril en 12,5 mg hydrochloorthiazide; en ZESTORETIC 20-25 met 20 mg lisinopril en 25 mg hydrochloorthiazide.
inactieve ingredienten
10-12,5 tabletten - calciumfosfaat, magnesiumstearaat, mannitol, rood ijzeroxide, maïszetmeel, geel ijzeroxide.
20-12,5 tabletten - calciumfosfaat, magnesiumstearaat, mannitol, maïszetmeel.
20-25 tabletten - calciumfosfaat, magnesiumstearaat, mannitol, rood ijzeroxide, maïszetmeel, geel ijzeroxide.
INDICATIES
ZESTORETIC is geïndiceerd voor de behandeling van hypertensie, om de bloeddruk te verlagen. Het verlagen van de bloeddruk verlaagt het risico op fatale en niet-fatale cardiovasculaire gebeurtenissen, voornamelijk beroertes en myocardinfarcten. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een groot aantal verschillende farmacologische klassen, waaronder lisinopril en hydrochloorthiazide.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan 1 medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van het Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
Deze vaste-dosiscombinaties zijn niet geïndiceerd voor initiële therapie (zie: DOSERING EN ADMINISTRATIE ).
Bij het gebruik van ZESTORETIC moet rekening worden gehouden met het feit dat captopril, een angiotensineconverterende enzymremmer, agranulocytose heeft veroorzaakt, met name bij patiënten met een nierfunctiestoornis of collageen-vaatziekte, en dat de beschikbare gegevens onvoldoende zijn om aan te tonen dat lisinopril geen vergelijkbaar risico (Zie WAARSCHUWINGEN ).
Bij het overwegen van het gebruik van ZESTORETIC mg moet worden opgemerkt dat ACE-remmers in verband zijn gebracht met een hoger percentage angio-oedeem bij negroïde patiënten dan bij niet-negroïde patiënten (zie WAARSCHUWINGEN , Lisinopril ).
DOSERING EN ADMINISTRATIE
Lisinopril monotherapie is een effectieve behandeling van hypertensie in eenmaal daagse doses van 10 mg tot 80 mg, terwijl hydrochloorthiazide monotherapie effectief is in doses van 12,5 mg per dag tot 50 mg per dag. In klinische onderzoeken naar combinatietherapie met lisinopril/hydrochloorthiazide met doses lisinopril van 10 mg tot 80 mg en doses hydrochloorthiazide van 6,25 mg tot 50 mg, namen de antihypertensieve responspercentages over het algemeen toe met toenemende dosis van een van beide componenten.
De bijwerkingen (zie WAARSCHUWINGEN ) van lisinopril zijn over het algemeen zeldzaam en schijnbaar onafhankelijk van de dosis; die van hydrochloorthiazide zijn een mengsel van dosisafhankelijke verschijnselen (voornamelijk hypokaliëmie) en dosisonafhankelijke verschijnselen (bijv. pancreatitis), waarbij de eerste veel vaker voorkomt dan de laatste. Therapie met elke combinatie van lisinopril en hydrochloorthiazide kan gepaard gaan met een of beide dosisonafhankelijke of dosisafhankelijke bijwerkingen, maar toevoeging van lisinopril in klinische onderzoeken deed de hypokaliëmie die normaal bij diuretica wordt gezien, afzwakken.
Om dosisafhankelijke bijwerkingen te minimaliseren, is het gewoonlijk aangewezen om pas met combinatietherapie te beginnen nadat een patiënt het gewenste effect met monotherapie niet heeft bereikt.
Dosistitratie op basis van klinisch effect
Een patiënt bij wie de bloeddruk niet voldoende onder controle kan worden gebracht met lisinopril of hydrochloorthiazide als monotherapie, kan worden overgezet op lisinopril/HCTZ 10/12.5 of lisinopril/HCTZ 20/12.5, afhankelijk van de huidige monotherapiedosis. Verdere verhogingen van een of beide componenten moeten afhangen van de klinische respons waarbij de bloeddruk wordt gemeten met het interdoseringsinterval om er zeker van te zijn dat er op dat moment een adequaat antihypertensief effect is. De dosis hydrochloorthiazide mag over het algemeen niet worden verhoogd tot 2 tot 3 weken zijn verstreken. Na toevoeging van het diureticum kan het mogelijk zijn om de dosis lisinopril te verlagen. Patiënten bij wie de bloeddruk voldoende onder controle is met 25 mg hydrochloorthiazide per dag, maar die bij deze behandeling een significant kaliumverlies ervaren, kan een vergelijkbare of betere bloeddrukcontrole bereiken zonder verstoring van de elektrolytenhuishouding als ze worden overgeschakeld op lisinopril/HCTZ 10/12.5.
Bij patiënten die momenteel worden behandeld met een diureticum, kan af en toe symptomatische hypotensie optreden na de aanvangsdosis lisinopril. Het diureticum moet, indien mogelijk, gedurende twee tot drie dagen worden stopgezet voordat de behandeling met lisinopril wordt gestart om de kans op hypotensie te verminderen (zie WAARSCHUWINGEN ). Als de bloeddruk van de patiënt niet onder controle wordt gebracht met alleen lisinopril, kan de behandeling met diuretica worden hervat.
Als het diureticum niet kan worden gestaakt, moet een aanvangsdosis van 5 mg lisinopril worden gebruikt onder medisch toezicht gedurende ten minste twee uur en totdat de bloeddruk gedurende ten minste een extra uur gestabiliseerd is (zie WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
Gelijktijdige toediening van ZESTORETIC met kaliumsupplementen, kaliumzoutvervangers of kaliumsparende diuretica kan leiden tot verhogingen van het serumkalium (zie PREVENTIEVE MAATREGELEN ).
Vervangingstherapie
De combinatie kan de getitreerde afzonderlijke componenten vervangen.
Gebruik bij nierinsufficiëntie
Behandelingsschema's met lisinopril/HCTZ hoeven geen rekening te houden met de nierfunctie zolang de creatinineklaring van de patiënt >30 ml/min/1,7 m2 is (serumcreatinine ongeveer ≤ 3 mg/dl of 265 μmol/l). Bij patiënten met een ernstiger nierfunctiestoornis hebben lisdiuretica de voorkeur boven thiaziden, daarom wordt lisinopril/HCTZ niet aanbevolen (zie WAARSCHUWINGEN , Anafylactoïde reacties tijdens blootstelling aan membraan ).
HOE GELEVERD
ZESTORETIC 10-12.5 tabletten: Perzikkleurige, ronde, biconvexe, niet-omhulde tabletten met de inscriptie "141" aan de ene kant en "ZESTORETIC" aan de andere kant, worden geleverd in flessen van 90 tabletten ( NDC 52427-435-90) en flesjes van 100 tabletten ( NDC 52427-435-01).
ZESTORETIC 20-12,5 tabletten : Witte, ronde, biconvexe, niet-omhulde tabletten met de inscriptie "142" aan de ene kant en "ZESTORETIC" aan de andere kant, worden geleverd in flessen van 90 tabletten ( NDC 52427-436-90) en flesjes van 100 tabletten ( NDC 52427-436-01).
ZESTORETIC 20-25 tabletten Perzikkleurige, ronde, biconvexe, niet-omhulde tabletten met de inscriptie “145” aan de ene kant en “ZESTORETIC” aan de andere kant, worden geleverd in flessen van 90 tabletten ( NDC 52427-43790) en flesjes van 100 tabletten ( NDC 52427-437-01).
Opslag
Bewaren bij een gecontroleerde kamertemperatuur, 20-25 ° C (68-77 ° F) (zie USP). Beschermen tegen overmatig licht en vochtigheid.
Gedistribueerd door: Almatica Pharma, Inc. Pine Brook, NJ 07058 VS. Herzien: juli 2017.
BIJWERKINGEN
ZESTORETIC 12,5 gmg is beoordeeld op veiligheid bij 930 patiënten, waaronder 100 patiënten die gedurende 50 weken of langer werden behandeld.
In klinische onderzoeken met ZESTORETIC zijn geen bijwerkingen waargenomen die specifiek zijn voor dit combinatiegeneesmiddel. Bijwerkingen die zijn opgetreden, zijn beperkt gebleven tot die welke eerder zijn gemeld met lisinopril of hydrochloorthiazide.
De meest voorkomende klinische bijwerkingen in gecontroleerde onderzoeken (inclusief open-label extensies) met elke combinatie van lisinopril en hydrochloorthiazide waren: duizeligheid (7,5%), hoofdpijn (5,2%), hoesten (3,9%), vermoeidheid (3,7%) en orthostatische effecten (3,2%) die allemaal vaker voorkwamen dan bij met placebo behandelde patiënten. Over het algemeen waren de bijwerkingen mild en van voorbijgaande aard, maar zie: WAARSCHUWINGEN met betrekking tot angio-oedeem en overmatige hypotensie of syncope. Bij 4,4% van de patiënten moest de behandeling worden stopgezet vanwege bijwerkingen, voornamelijk vanwege duizeligheid, hoesten, vermoeidheid en spierkrampen.
Bijwerkingen die optreden bij meer dan één procent van de patiënten die werden behandeld met lisinopril plus hydrochloorthiazide in gecontroleerde klinische onderzoeken, worden hieronder weergegeven.
Percentage patiënten in gecontroleerde onderzoeken
Klinische bijwerkingen die optreden bij 0,3% tot 1,0% van de patiënten in gecontroleerde onderzoeken en zeldzamere, ernstige, mogelijk geneesmiddelgerelateerde voorvallen die zijn gemeld tijdens marketingervaringen, worden hieronder vermeld:
Lichaam als geheel: Pijn op de borst, buikpijn, syncope, ongemak op de borst, koorts, trauma, virusinfectie. Cardiovasculair: Hartkloppingen, orthostatische hypotensie. spijsvertering: Gastro-intestinale krampen, droge mond, constipatie, brandend maagzuur. Musculoskeletaal: Rugpijn, schouderpijn, kniepijn, rugpijn, spierpijn, voetpijn. Nerveus/psychiatrisch: Verminderd libido, duizeligheid, depressie, slaperigheid. Ademhaling: Verkoudheid, verstopte neus, griep, bronchitis, faryngeale pijn, dyspneu, longcongestie, chronische sinusitis, allergische rhinitis, faryngeaal ongemak. Huid: Blozen, pruritus, huidontsteking, diaforese, cutaan pseudolymfoom. Speciale zintuigen: Wazig zien, tinnitus, otalgie. Urogenitaal: Urineweginfectie.
Angio-oedeem: Angio-oedeem van het gezicht, extremiteiten, lippen, tong, glottis en/of strottenhoofd is gemeld (zie WAARSCHUWINGEN ).
In zeldzame gevallen is tijdens postmarketingervaring intestinaal angio-oedeem gemeld.
Hypotensie: In klinische onderzoeken traden bijwerkingen met betrekking tot hypotensie als volgt op: hypotensie (1,4%), orthostatische hypotensie (0,5%), andere orthostatische effecten (3,2%). Bovendien trad syncope op bij 0,8% van de patiënten (zie: WAARSCHUWINGEN ).
Hoesten: Zien PREVENTIEVE MAATREGELEN - Hoesten .
Resultaten van klinische laboratoriumtests
Serumelektrolyten
(Zien PREVENTIEVE MAATREGELEN ).
Creatinine, bloedureumstikstof
Bij patiënten met essentiële hypertensie die met ZESTORETIC werden behandeld, werden lichte omkeerbare verhogingen van bloedureumstikstof en serumcreatinine waargenomen. Meer uitgesproken verhogingen zijn ook gemeld en kwamen vaker voor bij patiënten met nierarteriestenose (zie: PREVENTIEVE MAATREGELEN ).
Serum Urinezuur, Glucose, Magnesium, Cholesterol, Triglyceriden En Calcium
(Zien PREVENTIEVE MAATREGELEN ).
Hemoglobine en hematocriet
Kleine verlagingen van hemoglobine en hematocriet (gemiddelde verlagingen van respectievelijk ongeveer 0,5 g% en 1,5 vol%) kwamen vaak voor bij hypertensieve patiënten die werden behandeld met ZESTORETIC 5 mg, maar waren zelden van klinisch belang, tenzij een andere oorzaak van anemie naast elkaar bestond. In klinische onderzoeken stopte 0,4% van de patiënten met de behandeling vanwege bloedarmoede.
Leverfunctietest
Zelden zijn verhogingen van leverenzymen en/of serumbilirubine opgetreden. (Zien WAARSCHUWINGEN , Leverfalen ).
Andere bijwerkingen die met de afzonderlijke componenten zijn gemeld, worden hieronder vermeld:
Lisinopril
In klinische onderzoeken werden bijwerkingen die optraden met lisinopril ook gezien met ZESTORETIC. Bovendien, en sinds lisinopril op de markt is, zijn de volgende bijwerkingen gemeld met lisinopril en moeten deze worden beschouwd als mogelijke bijwerkingen voor ZESTORETIC: Lichaam als geheel: Anafylactoïde reacties (zie WAARSCHUWINGEN , Anafylactoïde reacties tijdens blootstelling aan membraan ), malaise, oedeem, gezichtsoedeem, pijn, bekkenpijn, flankpijn, koude rillingen; Cardiovasculair: Hartstilstand, myocardinfarct of cerebrovasculair accident, mogelijk secundair aan overmatige hypotensie bij patiënten met een hoog risico (zie WAARSCHUWINGEN , Hypotensie ), longembolie en -infarct, verergering van hartfalen, aritmieën (waaronder tachycardie, ventriculaire tachycardie, atriale tachycardie, atriale fibrillatie, bradycardie en premature ventriculaire contracties), angina pectoris, voorbijgaande ischemische aanvallen, paroxysmale nachtelijke bloeddruk, perifere, verminderde oedeem, vasculitis; spijsvertering: Pancreatitis, hepatitis (hepatocellulaire of cholestatische geelzucht) (zie: WAARSCHUWINGEN , Leverfalen ), gastritis, anorexia, winderigheid, verhoogde speekselvloed; Endocrien: Diabetes mellitus, ongepaste secretie van antidiuretisch hormoon; Hematologische: Zeldzame gevallen van beenmergdepressie, hemolytische anemie, leukopenie/neutropenie en trombocytopenie zijn gemeld waarbij een causaal verband met lisinopril niet kan worden uitgesloten; Metabolisch: Jicht, gewichtsverlies, uitdroging, vochtophoping, gewichtstoename; Musculoskeletaal: Artritis, artralgie, nekpijn, heuppijn, gewrichtspijn, beenpijn, armpijn, lumbago; Zenuwstelsel/psychiatrisch: Ataxie, geheugenstoornis, tremor, slapeloosheid, beroerte, nervositeit, verwardheid, perifere neuropathie (bijv. paresthesie, dysesthesie), spasme, hypersomnie, prikkelbaarheid; stemmingswisselingen (inclusief depressieve symptomen); hallucinaties; Ademhaling: Kwaadaardige longneoplasmata, bloedspuwing, longoedeem, longinfiltraten, bronchospasme, astma, pleurale effusie, longontsteking, eosinofiele pneumonitis, piepende ademhaling, orthopneu, pijnlijke ademhaling, epistaxis, laryngitis, sinusitis, phrinitis, borstkas, abnormaal Huid: Urticaria, alopecia, herpes zoster, lichtgevoeligheid, huidlaesies, huidinfecties, pemphigus, erytheem, psoriasis, zeldzame gevallen van andere ernstige huidreacties, waaronder toxische epidermale necrolyse en Stevens-Johnson-syndroom (causaal verband is niet vastgesteld); Speciale zintuigen: Visueel verlies, diplopie, fotofobie, smaakverandering, reukstoornis; Urogenitaal: Acuut nierfalen, oligurie, anurie, uremie, progressieve azotemie, nierfunctiestoornis (zie: PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ), pyelonefritis, dysurie, pijn in de borst.
Diversen
Er is een symptoomcomplex gemeld dat een positieve ANA, een verhoogde bezinkingssnelheid van erytrocyten, artralgie/artritis, myalgie, koorts, vasculitis, eosinofilie en leukocytose kan omvatten. Huiduitslag, lichtgevoeligheid of andere dermatologische verschijnselen kunnen alleen of in combinatie met deze symptomen optreden.
Hydrochloorthiazide
Lichaam als geheel: Zwakheid; spijsvertering: Anorexia, maagirritatie, krampen, geelzucht (intrahepatische cholestatische geelzucht) (zie WAARSCHUWINGEN , Leverfalen ), pancreatitis, sialoadenitis, constipatie; Hematologische: Leukopenie, agranulocytose, trombocytopenie, aplastische anemie, hemolytische anemie; Musculoskeletaal: Spierspasmen; Zenuwstelsel/psychiatrisch: Rusteloosheid; nier: Nierfalen, nierdisfunctie, interstitiële nefritis (zie: WAARSCHUWINGEN ); Huid: Erythema multiforme inclusief Stevens-Johnson syndroom, exfoliatieve dermatitis inclusief toxische epidermale necrolyse, alopecia; Speciale zintuigen: Xanthopsia; Overgevoeligheid: Purpura, lichtgevoeligheid, urticaria, necrotiserende angiitis (vasculitis en cutane vasculitis), ademnood inclusief pneumonitis en longoedeem, anafylactische reacties.
DRUG-INTERACTIES
Lisinopril
Hypotensie -Patiënten op diuretische therapie
Patiënten die diuretica gebruiken en vooral degenen bij wie de diuretische therapie recentelijk is ingesteld, kunnen af en toe een overmatige bloeddrukdaling ervaren na het starten van de therapie met lisinopril. De mogelijkheid van hypotensieve effecten met lisinopril kan worden geminimaliseerd door ofwel het diureticum stop te zetten of de zoutinname te verhogen voordat de behandeling met lisinopril wordt gestart. Als het nodig is om het diureticum voort te zetten, start dan de behandeling met lisinopril in een dosis van 5 mg per dag en zorg voor nauw medisch toezicht na de initiële dosis gedurende ten minste twee uur en totdat de bloeddruk gedurende ten minste een extra uur gestabiliseerd is (zie WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE ). Wanneer een diureticum wordt toegevoegd aan de behandeling van een patiënt die lisinopril krijgt, wordt gewoonlijk een bijkomend antihypertensief effect waargenomen (zie DOSERING EN ADMINISTRATIE ).
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, waaronder selectieve COX-2-remmers, en ACE-remmers, waaronder lisinopril, leiden tot een verslechtering van de nierfunctie. , inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die behandeld worden met lisinopril en NSAID's.
Het antihypertensieve effect van ACE-remmers, waaronder lisinopril, kan worden afgezwakt door NSAID's.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie.
Aan de VA NEPHRON-studie namen 1448 patiënten deel met type 2-diabetes, verhoogde urine-albuminto-creatinineverhouding en verlaagde geschatte glomerulaire filtratiesnelheid (GFR 30 tot 89,9 ml/min), gerandomiseerd naar lisinopril of placebo op een achtergrond van therapie met losartan en gevolgd ze voor een mediaan van 2,2 jaar. Patiënten die de combinatie van losartan en lisinopril kregen, kregen geen extra voordeel in vergelijking met monotherapie voor het gecombineerde eindpunt van afname van GFR, eindtoestand nierziekte of overlijden, maar ervoeren een verhoogde incidentie van hyperkaliëmie en acuut nierletsel in vergelijking met de monotherapiegroep .
Vermijd in het algemeen gecombineerd gebruik van RAS-remmers, controleer nauwgezet de bloeddruk, nierfunctie en elektrolyten bij patiënten die ZESTORETIC en andere middelen die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met ZESTORETIC bij patiënten met diabetes. Vermijd het gebruik van aliskiren met ZESTORETIC 5 mg bij patiënten met een nierfunctiestoornis (GFR
Andere agenten
Lisinopril is gelijktijdig gebruikt met nitraten en/of digoxine zonder aanwijzingen voor klinisch significante nadelige interacties. Er deden zich geen significante klinisch belangrijke farmacokinetische interacties voor wanneer lisinopril gelijktijdig werd gebruikt met propranolol, digoxine of hydrochloorthiazide. De aanwezigheid van voedsel in de maag verandert de biologische beschikbaarheid van lisinopril niet.
Middelen die serumkalium verhogen
Lisinopril vermindert kaliumverlies veroorzaakt door diuretica van het thiazidetype. Het gebruik van lisinopril met kaliumsparende diuretica (bijv. spironolacton, eplerenon, triamtereen of amiloride), kaliumsupplementen of kaliumbevattende zoutvervangers kan leiden tot significante verhogingen van het serumkalium. Als gelijktijdig gebruik van deze middelen is geïndiceerd, vanwege aangetoonde hypokaliëmie, moeten ze daarom met voorzichtigheid worden gebruikt en met frequente controle van het serumkalium.
Lithium
Lithiumtoxiciteit is gemeld bij patiënten die lithium gelijktijdig kregen met geneesmiddelen die natriumeliminatie veroorzaken, waaronder ACE-remmers. Lithiumtoxiciteit was gewoonlijk reversibel na stopzetting van lithium en de ACE-remmer. Het wordt aanbevolen de serumlithiumspiegels regelmatig te controleren als lisinopril gelijktijdig met lithium wordt toegediend.
mTOR-remmers (zoogdierdoelwit van rapamycine)
Patiënten die gelijktijdig worden behandeld met een ACE-remmer en een mTOR-remmer (bijv. temsirolimus, sirolimus, everolimus) kunnen een verhoogd risico lopen op angio-oedeem. (zien WAARSCHUWINGEN )
Neprilysine-remmers
Patiënten die gelijktijdig neprilysineremmers gebruiken, lopen mogelijk een verhoogd risico op angio-oedeem. (zien WAARSCHUWINGEN )
Hydrochloorthiazide
Bij gelijktijdige toediening kunnen de volgende geneesmiddelen een wisselwerking hebben met thiazidediuretica.
Alcohol, barbituraten of verdovende middelen -potentiëring van orthostatische hypotensie kan optreden.
Antidiabetica (orale middelen en insuline) - aanpassing van de dosering van het antidiabetica kan nodig zijn.
Andere antihypertensiva -additief effect of potentiëring.
Colestyramine- en colestipolharsen - Absorptie van hydrochloorthiazide is verstoord in aanwezigheid van anionenuitwisselingsharsen. Enkelvoudige doses van colestyramine of colestipolharsen binden het hydrochloorthiazide en verminderen de absorptie uit het maagdarmkanaal met respectievelijk tot 85% en 43%.
Corticosteroïden, ACTH -verergerde elektrolytdepletie, met name hypokaliëmie.
Pressoramines (bijv. noradrenaline) - mogelijk verminderde respons op pressoramines, maar niet voldoende om het gebruik ervan uit te sluiten.
Skeletspierverslappers, niet-depolariserend (bijv. tubocurarine) -mogelijk verhoogde respons op de spierverslapper.
Lithium - mag over het algemeen niet samen met diuretica worden gegeven. Diuretica verminderen de renale klaring van lithium en verhogen het risico op lithiumtoxiciteit. Raadpleeg de bijsluiter voor lithiumpreparaten voordat u dergelijke preparaten met ZESTORETIC gebruikt.
Steroïdeloze ontstekingsremmers Bij sommige patiënten kan de toediening van een niet-steroïde anti-inflammatoir middel de diuretische, natriuretische en antihypertensieve effecten van lis-, kaliumsparende en thiazidediuretica verminderen. Daarom moet, wanneer ZESTORETIC en niet-steroïde anti-inflammatoire middelen gelijktijdig worden gebruikt, de patiënt nauwlettend worden geobserveerd om te bepalen of het gewenste effect van ZESTORETIC 5 mg wordt bereikt.
Goud
Nitritoïde reacties (symptomen zijn onder meer blozen in het gezicht, misselijkheid, braken en hypotensie) zijn zelden gemeld bij patiënten die werden behandeld met injecteerbaar goud (natriumaurothiomalaat) en gelijktijdige behandeling met ACE-remmers, waaronder ZESTORETIC.
WAARSCHUWINGEN
Lisinopril
Anafylactoïde en mogelijk gerelateerde reacties
Vermoedelijk omdat angiotensine-converterende enzymremmers het metabolisme van eicosanoïden en polypeptiden, inclusief endogeen bradykinine, beïnvloeden, kunnen patiënten die ACE-remmers (inclusief ZESTORETIC) krijgen, onderhevig zijn aan een verscheidenheid aan bijwerkingen, waarvan sommige ernstig.
Hoofd- en nekangio-oedeem
Angio-oedeem van het gezicht, de extremiteiten, de lippen, de tong, de glottis en/of het strottenhoofd is gemeld bij patiënten die werden behandeld met angiotensine-converterende enzymremmers, waaronder lisinopril. Dit kan op elk moment tijdens de behandeling optreden. ACE-remmers zijn in verband gebracht met een hoger percentage angio-oedeem bij negroïde patiënten dan bij niet-negroïde patiënten. ZESTORETIC 12,5 gmg dient onmiddellijk te worden gestaakt en de juiste therapie en monitoring dienen te worden gegeven totdat de klachten en symptomen volledig en aanhoudend zijn verdwenen. Zelfs in die gevallen waarbij alleen de tong gezwollen is, zonder ademnood, kunnen patiënten langdurige observatie nodig hebben, aangezien behandeling met antihistaminica en corticosteroïden mogelijk niet voldoende is. Zeer zelden zijn gevallen van overlijden gemeld als gevolg van angio-oedeem geassocieerd met larynxoedeem of tongoedeem. Patiënten met betrokkenheid van de tong, glottis of larynx zullen waarschijnlijk luchtwegobstructie ervaren, vooral degenen met een voorgeschiedenis van luchtwegchirurgie. Wanneer er sprake is van betrokkenheid van de tong, glottis of strottenhoofd, waarschijnlijk luchtwegobstructie veroorzaken, subcutane epinefrine-oplossing 1:1000 (0,3 ml tot 0,5 ml) en/of maatregelen die nodig zijn om ervoor te zorgen dat een open luchtweg onmiddellijk wordt verstrekt (zie ONGEWENSTE REACTIES) .
Patiënten die gelijktijdig een ACE-remmer en mTOR-therapie (zoogdierdoelwit van rapamycine)-remmer (bijv. temsirolimus, sirolimus, everolimus) of een neprilysine-remmer krijgen, lopen mogelijk een verhoogd risico op angio-oedeem (zie PREVENTIEVE MAATREGELEN ).
Intestinaal angio-oedeem
Intestinaal angio-oedeem is gemeld bij patiënten die werden behandeld met ACE-remmers. Deze patiënten vertoonden buikpijn (met of zonder misselijkheid of braken); in sommige gevallen was er geen voorgeschiedenis van angio-oedeem in het gezicht en waren de C-1-esterasespiegels normaal. Het angio-oedeem werd gediagnosticeerd door procedures, waaronder CT-scan of echografie van de buik, of tijdens een operatie, en de symptomen verdwenen na het stoppen met de ACE-remmer. Intestinaal angio-oedeem moet worden opgenomen in de differentiële diagnose van patiënten met ACE-remmers die buikpijn hebben.
Patiënten met een voorgeschiedenis van angio-oedeem dat geen verband houdt met behandeling met een ACE-remmer, kunnen een verhoogd risico lopen op angio-oedeem wanneer ze een ACE-remmer krijgen (zie INDICATIES en CONTRA-INDICATIES ).
Anafylactoïde reacties tijdens desensibilisatie
Twee patiënten die een desensibiliserende behandeling met hymenoptera-gif ondergingen terwijl ze ACE-remmers kregen, kregen levensbedreigende anafylactoïde reacties.
Bij dezelfde patiënten werden deze reacties vermeden toen tijdelijk geen ACE-remmers werden gebruikt, maar ze kwamen weer terug bij onbedoeld hernieuwd gebruik.
Anafylactoïde reacties tijdens blootstelling aan membraan
Thiazidebevattende combinatieproducten worden niet aanbevolen bij patiënten met ernstige nierfunctiestoornissen. Plotselinge en mogelijk levensbedreigende anafylactoïde reacties zijn gemeld bij sommige patiënten die werden gedialyseerd met high-flux membranen (bijv. AN69®**) en gelijktijdig werden behandeld met een ACE-remmer. Bij dergelijke patiënten moet de dialyse onmiddellijk worden stopgezet en moet een agressieve therapie voor anafylactoïde reacties worden gestart. Symptomen zijn in deze situaties niet verlicht door antihistaminica. Bij deze patiënten moet het gebruik van een ander type dialysemembraan of een andere klasse antihypertensiva worden overwogen. Anafylactoïde reacties zijn ook gemeld bij patiënten die lipoproteïne-aferese met lage dichtheid ondergingen met absorptie van dextraansulfaat.
Hypotensie en gerelateerde effecten
Overmatige hypotensie werd zelden gezien bij patiënten met ongecompliceerde hypertensie, maar is een mogelijk gevolg van het gebruik van lisinopril bij personen met een zout-/volumedepletie, zoals degenen die krachtig worden behandeld met diuretica of dialysepatiënten (zie DRUG-INTERACTIES en ONGEWENSTE REACTIES ).
Syncope is gemeld bij 0,8 procent van de patiënten die ZESTORETIC kregen. Bij patiënten met hypertensie die alleen lisinopril kregen, was de incidentie van syncope 0,1 procent. De totale incidentie van syncope kan worden verminderd door een juiste titratie van de afzonderlijke componenten (zie: DRUG-INTERACTIES , ONGEWENSTE REACTIES en DOSERING EN ADMINISTRATIE ).
Bij patiënten met ernstig congestief hartfalen, met of zonder geassocieerde nierinsufficiëntie, is overmatige hypotensie waargenomen en kan gepaard gaan met oligurie en/of progressieve azotemie, en zelden met acuut nierfalen en/of overlijden. Vanwege de mogelijke bloeddrukdaling bij deze patiënten, moet de behandeling onder zeer nauw medisch toezicht worden gestart. Dergelijke patiënten moeten de eerste twee weken van de behandeling nauwlettend worden gevolgd en telkens wanneer de dosis lisinopril en/of diureticum wordt verhoogd. Soortgelijke overwegingen gelden voor patiënten met ischemische hart- of cerebrovasculaire ziekte bij wie een overmatige bloeddrukdaling kan leiden tot een myocardinfarct of cerebrovasculair accident.
Als hypotensie optreedt, moet de patiënt in rugligging worden geplaatst en, indien nodig, een intraveneuze infusie van een normale zoutoplossing krijgen. Een voorbijgaande hypotensieve respons is geen contra-indicatie voor verdere doses die gewoonlijk zonder problemen kunnen worden gegeven zodra de bloeddruk is gestegen na volumevergroting.
Leukopenie/Neutropenie/Agranulocytose
Van een andere angiotensine-converterende enzymremmer, captopril, is aangetoond dat het agranulocytose en beenmergdepressie veroorzaakt, zelden bij ongecompliceerde patiënten maar vaker bij patiënten met nierinsufficiëntie, vooral als ze ook een collageen-vaatziekte hebben. De beschikbare gegevens uit klinische onderzoeken met lisinopril zijn onvoldoende om aan te tonen dat lisinopril geen agranulocytose in vergelijkbare mate veroorzaakt. Marketingervaring heeft zeldzame gevallen van leukopenie/neutropenie en beenmergdepressie aan het licht gebracht waarbij een causaal verband met lisinopril niet kan worden uitgesloten. Periodieke controle van het aantal witte bloedcellen bij patiënten met collageenvaatziekte en nierziekte moet worden overwogen.
Leverfalen
Zelden zijn ACE-remmers in verband gebracht met een syndroom dat begint met cholestatische geelzucht of hepatitis en zich ontwikkelt tot fulminante levernecrose en (soms) overlijden. Het mechanisme van dit syndroom wordt niet begrepen. Patiënten die ACE-remmers krijgen en die geelzucht of duidelijke verhogingen van leverenzymen ontwikkelen, moeten stoppen met de ACE-remmer en passende medische follow-up krijgen.
Foetale toxiciteit
Zwangerschap Categorie D
Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ZESTORETIC. Deze bijwerkingen worden meestal geassocieerd met het gebruik van deze geneesmiddelen in het tweede en derde trimester van de zwangerschap. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Passende behandeling van maternale hypertensie tijdens de zwangerschap is belangrijk om de resultaten voor zowel moeder als foetus te optimaliseren.
In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus. Voer seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Als oligohydramnion wordt waargenomen, stop dan met ZESTORETIC, tenzij dit als levensreddend voor de moeder wordt beschouwd. Afhankelijk van de week van de zwangerschap kan foetaal testen aangewezen zijn. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen. Observeer nauwkeurig zuigelingen met een geschiedenis van in utero blootstelling aan ZESTORETIC voor hypotensie, oligurie en hyperkaliëmie. (Zien VOORZORGSMAATREGELEN, pediatrisch gebruik ).
Er werden geen teratogene effecten van lisinopril waargenomen in onderzoeken met drachtige ratten, muizen en konijnen. Op basis van mg/kg waren de gebruikte doses tot 625 keer (bij muizen), 188 keer (bij ratten) en 0,6 keer (bij konijnen) de maximaal aanbevolen dosis voor de mens.
Lisinopril en hydrochloorthiazide
Teratogeniteitsstudies werden uitgevoerd bij muizen en ratten met tot 90 mg/kg/dag lisinopril (56 keer de maximaal aanbevolen dosis voor de mens) in combinatie met 10 mg/kg/dag hydrochloorthiazide (2,5 keer de maximaal aanbevolen dosis voor de mens). Maternale of foetotoxische effecten werden niet gezien bij muizen met de combinatie. Bij ratten trad een verminderde gewichtstoename van de moeder en een verminderd foetaal gewicht op tot 3/10 mg/kg/dag (de laagste geteste dosis). Geassocieerd met het verminderde foetale gewicht was een vertraging in foetale ossificatie. Het verminderde foetale gewicht en de vertraging in foetale ossificatie werden niet gezien bij dieren die zoutoplossing kregen en 90/10 mg/kg/dag kregen.
Bij gebruik tijdens de zwangerschap, tijdens het tweede en derde trimester, kunnen ACE-remmers letsel en zelfs de dood van de zich ontwikkelende foetus veroorzaken. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ZESTORETIC 5 mg ( Zie Lisinopril, foetale toxiciteit ).
Hydrochloorthiazide
Acute bijziendheid en secundair geslotenhoekglaucoom
Hydrochloorthiazide, een sulfonamide, kan een idiosyncratische reactie veroorzaken, resulterend in acute voorbijgaande bijziendheid en acuut geslotenhoekglaucoom. Symptomen zijn onder meer een acuut begin van verminderde gezichtsscherpte of oculaire pijn en treden meestal op binnen enkele uren tot weken na aanvang van het geneesmiddel. Onbehandeld acuut geslotenhoekglaucoom kan leiden tot permanent verlies van het gezichtsvermogen. De primaire behandeling is om zo snel mogelijk te stoppen met hydrochloorthiazide. Als de intraoculaire druk ongecontroleerd blijft, moeten mogelijk onmiddellijke medische of chirurgische behandelingen worden overwogen. Risicofactoren voor het ontwikkelen van acuut geslotenhoekglaucoom kunnen een voorgeschiedenis van sulfonamide- of penicilline-allergie zijn.
Teratogene effecten
Voortplantingsstudies bij konijnen, muizen en ratten bij doses tot 100 mg/kg/dag (50 maal de dosis voor de mens) toonden geen bewijs van externe afwijkingen van de foetus als gevolg van hydrochloorthiazide. Hydrochloorthiazide toegediend in een onderzoek met twee nesten bij ratten in doses van 4 mg/kg/dag tot 5,6 mg/kg/dag (ongeveer 1 tot 2 maal de gebruikelijke dagelijkse dosis voor de mens) had geen invloed op de vruchtbaarheid en veroorzaakte geen geboorteafwijkingen bij de nakomelingen. Thiaziden passeren de placentabarrière en komen voor in navelstrengbloed.
Nietteratogene effecten
Deze kunnen foetale of neonatale geelzucht, trombocytopenie en mogelijk andere bijwerkingen bij volwassenen omvatten.
Hydrochloorthiazide
Thiaziden moeten met voorzichtigheid worden gebruikt bij ernstige nieraandoeningen. Bij patiënten met nierziekte kunnen thiaziden azotemie veroorzaken. Cumulatieve effecten van het geneesmiddel kunnen optreden bij patiënten met een verminderde nierfunctie.
Thiaziden dienen met voorzichtigheid te worden gebruikt bij patiënten met een verminderde leverfunctie of progressieve leverziekte, aangezien kleine veranderingen in de vocht- en elektrolytenhuishouding een levercoma kunnen veroorzaken.
Overgevoeligheidsreacties kunnen optreden bij patiënten met of zonder een voorgeschiedenis van allergie of bronchiale astma.
De mogelijkheid van exacerbatie of activering van systemische lupus erythematodes is gemeld.
Lithium mag over het algemeen niet samen met thiaziden worden gegeven (zie DRUG-INTERACTIES , Lisinopril en hydrochloorthiazide ).
PREVENTIEVE MAATREGELEN
Algemeen
Lisinopril
Aortastenose/hypertrofische cardiomyopathie
Zoals met alle vaatverwijders, dient lisinopril met voorzichtigheid te worden gegeven aan patiënten met een obstructie in het uitstroomkanaal van de linker hartkamer.
Verminderde nierfunctie
Als gevolg van de remming van het renine-angiotensine-aldosteronsysteem kunnen veranderingen in de nierfunctie worden verwacht bij gevoelige personen. Bij patiënten met ernstig congestief hartfalen bij wie de nierfunctie kan afhangen van de activiteit van het renine-angiotensine-aldosteronsysteem, kan behandeling met angiotensine-converterende enzymremmers, waaronder lisinopril, gepaard gaan met oligurie en/of progressieve azotemie en zelden met acute renale mislukking en/of overlijden.
Bij hypertensieve patiënten met unilaterale of bilaterale nierarteriestenose kunnen verhogingen van bloedureumstikstof en serumcreatinine optreden. Ervaring met een andere angiotensine-converterende enzymremmer suggereert dat deze verhogingen gewoonlijk reversibel zijn na stopzetting van de behandeling met lisinopril en/of diuretica. Bij dergelijke patiënten moet de nierfunctie tijdens de eerste paar weken van de behandeling worden gecontroleerd.
Sommige hypertensieve patiënten zonder duidelijke reeds bestaande niervaatziekte hebben een verhoging van het bloedureum en het serumcreatinine ontwikkeld, gewoonlijk gering en van voorbijgaande aard, vooral wanneer lisinopril gelijktijdig met een diureticum werd gegeven. Dit komt vaker voor bij patiënten met een reeds bestaande nierfunctiestoornis. Dosisverlaging van lisinopril en/of stopzetting van het diureticum kan nodig zijn.
Evaluatie van de hypertensieve patiënt moet altijd een beoordeling van de nierfunctie omvatten (zie DOSERING EN TOEDIENING ).
Hyperkaliëmie
In klinische onderzoeken trad hyperkaliëmie (serumkalium hoger dan 5,7 mEq/L) op bij ongeveer 1,4 procent van de hypertensieve patiënten die werden behandeld met lisinopril plus hydrochloorthiazide. In de meeste gevallen waren dit geïsoleerde waarden die verdwenen ondanks voortgezette therapie. Hyperkaliëmie was geen oorzaak van stopzetting van de therapie. Risicofactoren voor de ontwikkeling van hyperkaliëmie zijn onder meer nierinsufficiëntie, diabetes mellitus en het gelijktijdig gebruik van kaliumsparende diuretica, kaliumsupplementen en/of kaliumbevattende zoutvervangers. Hyperkaliëmie kan ernstige, soms fatale aritmieën veroorzaken. ZESTORETIC moet met voorzichtigheid of helemaal niet worden gebruikt met deze middelen en met frequente controle van het serumkalium (zie: DRUG-INTERACTIES ).
Hoesten
Vermoedelijk als gevolg van de remming van de afbraak van endogeen bradykinine, is bij alle ACE-remmers aanhoudende niet-productieve hoest gemeld, die bijna altijd verdwijnt na stopzetting van de therapie. Bij de differentiële diagnose van hoest moet rekening worden gehouden met door ACE-remmers geïnduceerde hoest.
Chirurgie/anesthesie
Bij patiënten die een grote operatie ondergaan of tijdens anesthesie met middelen die hypotensie veroorzaken, kan lisinopril de vorming van angiotensine II, secundair aan compenserende renineafgifte, blokkeren. Als hypotensie optreedt en wordt geacht het gevolg te zijn van dit mechanisme, kan dit worden gecorrigeerd door volume-expansie.
Hydrochloorthiazide
Periodieke bepaling van serumelektrolyten om een mogelijke verstoring van de elektrolytenbalans te detecteren, moet met geschikte tussenpozen worden uitgevoerd.
Alle patiënten die met thiazide worden behandeld, moeten worden geobserveerd op klinische tekenen van een verstoorde vocht- of elektrolytenbalans: namelijk hyponatriëmie, hypochloremische alkalose en hypokaliëmie. Serum- en urine-elektrolytbepalingen zijn met name belangrijk wanneer de patiënt overmatig braakt of parenterale vloeistoffen krijgt. Waarschuwingssignalen of symptomen van een verstoorde vocht- en elektrolytenbalans, ongeacht de oorzaak, zijn onder meer een droge mond, dorst, zwakte, lethargie, slaperigheid, rusteloosheid, verwardheid, toevallen, spierpijn of -krampen, spiervermoeidheid, hypotensie, oligurie, tachycardie en gastro-intestinale stoornissen zoals misselijkheid en braken.
Hypokaliëmie kan optreden, vooral bij stevige diurese, wanneer er sprake is van ernstige cirrose of na langdurige therapie.
Interferentie met een adequate orale inname van elektrolyten zal ook bijdragen aan hypokaliëmie. Hypokaliëmie kan hartritmestoornissen veroorzaken en kan ook de reactie van het hart op de toxische effecten van digitalis (bijv. verhoogde ventriculaire prikkelbaarheid) sensibiliseren of versterken. Omdat lisinopril de aanmaak van aldosteron vermindert, vermindert gelijktijdige behandeling met lisinopril het door diuretica geïnduceerde kaliumverlies (zie DRUG-INTERACTIES , Middelen die serumkalium verhogen ).
Hoewel een chloridetekort over het algemeen mild is en meestal geen specifieke behandeling vereist, behalve in buitengewone omstandigheden (zoals bij lever- of nierziekte), kan chloridevervanging nodig zijn bij de behandeling van metabole alkalose.
Verdunningshyponatriëmie kan optreden bij oedemateuze patiënten bij warm weer; geschikte therapie is waterbeperking, in plaats van toediening van zout, behalve in zeldzame gevallen wanneer de hyponatriëmie levensbedreigend is. Bij daadwerkelijke zoutuitputting is een geschikte vervanging de therapie van keuze.
Bij bepaalde patiënten die met thiazide worden behandeld, kan hyperurikemie optreden of kan uitgesproken jicht optreden.
Bij diabetespatiënten kunnen dosisaanpassingen van insuline of orale bloedglucoseverlagende middelen nodig zijn. Hyperglykemie kan optreden bij thiazidediuretica. Zo kan latente diabetes mellitus zich manifesteren tijdens de behandeling met thiazide.
De antihypertensieve effecten van het geneesmiddel kunnen worden versterkt bij patiënten die postsympathectomie hebben ondergaan.
Als progressieve nierinsufficiëntie duidelijk wordt, overweeg dan om de behandeling met diuretica te staken of stop te zetten.
Van thiaziden is aangetoond dat ze de urinaire excretie van magnesium verhogen; dit kan leiden tot hypomagnesiëmie.
Thiaziden kunnen de uitscheiding van calcium via de urine verminderen. Thiaziden kunnen intermitterende en lichte verhoging van het serumcalcium veroorzaken bij afwezigheid van bekende stoornissen van het calciummetabolisme. Duidelijke hypercalciëmie kan wijzen op verborgen hyperparathyreoïdie. Het gebruik van thiaziden moet worden stopgezet voordat tests voor de bijschildklierfunctie worden uitgevoerd.
Verhoogde cholesterol- en triglyceridenspiegels kunnen in verband worden gebracht met behandeling met thiazidediuretica.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Lisinopril en hydrochloorthiazide
Lisinopril in combinatie met hydrochloorthiazide was niet mutageen in een microbiële mutageentest met Salmonella typhimurium (Ames-test) of Escherichia coli met of zonder metabole activering of in een voorwaartse mutatietest met Chinese hamsterlongcellen. Lisinopril en hydrochloorthiazide veroorzaakten geen enkelstrengige DNA-breuken in een in vitro rattenhepatocytentest met alkalische elutie. Bovendien veroorzaakte het geen toename van chromosomale afwijkingen in een in vitro test in ovariumcellen van Chinese hamsters of in een in vivo onderzoek in beenmerg van muizen.
Lisinopril
Er was geen bewijs van een tumorverwekkend effect wanneer lisinopril gedurende 105 weken werd toegediend aan mannelijke en vrouwelijke ratten in doses tot 90 mg/kg/dag (ongeveer 56 of 9 keer* de maximale dagelijkse dosis voor de mens, gebaseerd op lichaamsgewicht en lichaamsoppervlak). gebied, respectievelijk). Er was geen bewijs van carcinogeniteit wanneer lisinopril gedurende 92 weken werd toegediend aan (mannelijke en vrouwelijke) muizen in doses tot 135 mg/kg/dag (ongeveer 84 maal* de maximaal aanbevolen dagelijkse dosis voor de mens). Deze dosis was 6,8 keer de maximale dosis voor de mens op basis van het lichaamsoppervlak bij muizen.
*Berekeningen gaan uit van een menselijk gewicht van 50 kg en een menselijk lichaamsoppervlak van 1,62 m2.
Lisinopril was niet mutageen in de Ames microbiële mutagene test met of zonder metabolische activering. Het was ook negatief in een voorwaartse mutatietest met longcellen van Chinese hamsters. Lisinopril veroorzaakte geen enkelstrengs DNA-breuken in een in vitro rattenhepatocytentest met alkalische elutie. Bovendien veroorzaakte lisinopril geen toename van chromosomale afwijkingen in een in vitro test in ovariumcellen van Chinese hamsters of in een in vivo onderzoek in beenmerg van muizen.
Er waren geen nadelige effecten op de reproductieprestaties bij mannelijke en vrouwelijke ratten die werden behandeld met maximaal 300 mg/kg/dag lisinopril. Deze dosis is 188 maal en 30 maal de maximale dagelijkse dosis voor de mens, gebaseerd op respectievelijk mg/kg en mg/m2.
Hydrochloorthiazide
Twee jaar durende voedingsstudies bij muizen en ratten, uitgevoerd onder auspiciën van het National Toxicology Program (NTP), brachten geen bewijs aan het licht van een carcinogeen potentieel van hydrochloorthiazide bij vrouwelijke muizen (in doses tot ongeveer 600 mg/kg/dag) of bij mannelijke muizen. en vrouwelijke ratten (in doses tot ongeveer 100 mg/kg/dag). Deze doses zijn 150 maal en 12 maal voor muizen en 25 maal en 4 maal voor ratten de maximale dagelijkse dosis voor de mens gebaseerd op respectievelijk mg/kg en mg/m2. Het NTP vond echter dubbelzinnig bewijs voor hepatocarcinogeniteit bij mannelijke muizen.
Hydrochloorthiazide was in vitro niet genotoxisch in de Ames-mutageniteitstest van Salmonella typhimurium-stammen TA 98, TA 100, TA 1535, TA 1537 en TA 1538 en in de Chinese Hamster Ovary (CHO)-test voor chromosomale afwijkingen, of in vivo in testen met muis kiemcelchromosomen, Chinese hamsterbeenmergchromosomen en het geslachtsgebonden recessieve letale eigenschapsgen van Drosophila. Positieve testresultaten werden alleen verkregen in de in vitro CHO Sister Chromatid Exchange (clastogeniciteit) en in de Mouse Lymphoma Cell (mutageniteit) assays, met gebruikmaking van concentraties van hydrochloorthiazide van 43 mcg/ml tot 1300 mcg/ml, en in de Aspergillus nidulans nondisjunction assay in een niet gespecificeerde concentratie.
Hydrochloorthiazide had geen nadelige effecten op de vruchtbaarheid van muizen en ratten van beide geslachten in onderzoeken waarbij deze soorten via hun dieet werden blootgesteld aan doses tot respectievelijk 100 mg/kg en 4 mg/kg vóór de conceptie en tijdens de dracht . Bij muizen is deze dosis 25 maal en 2 maal de maximale dagelijkse dosis voor de mens, gebaseerd op respectievelijk mg/kg en mg/m2. Bij ratten is deze dosis 1 maal en 0,2 maal de maximale dagelijkse dosis voor de mens, gebaseerd op respectievelijk mg/kg en mg/m2.
Moeders die borstvoeding geven
Het is niet bekend of lisinopril wordt uitgescheiden in de moedermelk. Melk van zogende ratten bevat echter radioactiviteit na toediening van 14C-lisinopril. In een ander onderzoek was lisinopril aanwezig in rattenmelk in niveaus die vergelijkbaar waren met de plasmaconcentraties bij de moederdieren. Thiaziden komen voor in moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen door ACE-remmers en hydrochloorthiazide, moet worden besloten of de borstvoeding moet worden gestaakt en/of dat ZESTORETIC 12,5 g mg moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
Pasgeborenen met een geschiedenis van blootstelling in de baarmoeder aan ZESTORETIC
Als oligurie of hypotensie optreedt, richt de aandacht dan op ondersteuning van de bloeddruk en nierperfusie. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen. Lisinopril, dat de placenta passeert, is met enig klinisch voordeel uit de neonatale circulatie verwijderd door peritoneale dialyse, en kan theoretisch worden verwijderd door wisseltransfusie, hoewel er geen ervaring is met de laatste procedure.
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met ZESTORETIC mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering. Evaluatie van de hypertensieve patiënt moet altijd een beoordeling van de nierfunctie omvatten.
OVERDOSERING
Er is geen specifieke informatie beschikbaar over de behandeling van overdosering met ZESTORETIC. De behandeling is symptomatisch en ondersteunend. De therapie met ZESTORETIC 12,5 g mg moet worden stopgezet en de patiënt moet nauwlettend worden geobserveerd. Voorgestelde maatregelen omvatten het opwekken van braken en/of maagspoeling, en correctie van uitdroging, elektrolytenonbalans en hypotensie door middel van vastgestelde procedures.
Lisinopril
Na een enkelvoudige orale dosis van 20 g/kg trad geen letaliteit op bij ratten en de dood trad op bij een van de 20 muizen die dezelfde dosis kregen. De meest waarschijnlijke manifestatie van overdosering zou hypotensie zijn, waarvoor de gebruikelijke behandeling een intraveneuze infusie van een normale zoutoplossing zou zijn.
Lisinopril kan worden verwijderd door hemodialyse (zie: WAARSCHUWINGEN , Anafylactoïde reactie tijdens membraanblootstelling ).
Hydrochloorthiazide
Orale toediening van een enkele orale dosis van 10 g/kg aan muizen en ratten was niet dodelijk. De meest voorkomende tekenen en symptomen die worden waargenomen, zijn die veroorzaakt door elektrolytdepletie (hypokaliëmie, hypochloremie, hyponatriëmie) en uitdroging als gevolg van overmatige diurese. Als ook digitalis is toegediend, kan hypokaliëmie hartritmestoornissen verergeren.
CONTRA-INDICATIES
ZESTORETIC 12,5 gmg is gecontra-indiceerd bij patiënten die overgevoelig zijn voor dit product en bij patiënten met een voorgeschiedenis van angio-oedeem als gevolg van eerdere behandeling met een angiotensine-converterende enzymremmer en bij patiënten met erfelijk of idiopathisch angio-oedeem. Vanwege de hydrochloorthiazidecomponent is dit product gecontra-indiceerd bij patiënten met anurie of overgevoeligheid voor andere van sulfonamide afgeleide geneesmiddelen.
ZESTORETIC 12,5 gmg is gecontra-indiceerd in combinatie met een neprilysineremmer (bijv. sacubitril). Dien ZESTORETIC 5 mg niet toe binnen 36 uur na overschakeling op of van sacubitril/valsartan, een neprilysineremmer (zie WAARSCHUWINGEN ).
Dien aliskiren niet gelijktijdig toe met ZESTORETIC bij patiënten met diabetes (zie: DRUG-INTERACTIES ).
KLINISCHE FARMACOLOGIE
Lisinopril en hydrochloorthiazide
Als gevolg van zijn diuretische effecten verhoogt hydrochloorthiazide de plasmarenine-activiteit, verhoogt het de aldosteronsecretie en verlaagt het serumkalium. Toediening van lisinopril blokkeert de renine-angiotensine-aldosteron-as en heeft de neiging om het kaliumverlies dat gepaard gaat met het diureticum om te keren.
In klinische onderzoeken was de mate van bloeddrukverlaging die werd waargenomen met de combinatie van lisinopril en hydrochloorthiazide ongeveer additief. De combinatie ZESTORETIC 10-12.5 werkte even goed bij zwarte en blanke patiënten. De combinaties ZESTORETIC 20-12.5 en ZESTORETIC 20-25 leken iets minder effectief bij negroïde patiënten, maar er werden relatief weinig negroïde patiënten onderzocht. Bij de meeste patiënten hield het antihypertensieve effect van ZESTORETIC ten minste 24 uur aan.
In een gerandomiseerde, gecontroleerde vergelijking waren de gemiddelde antihypertensieve effecten van ZESTORETIC 20-12.5 en ZESTORETIC 20-25 vergelijkbaar, wat suggereert dat veel patiënten die adequaat reageren op de laatste combinatie onder controle kunnen worden gebracht met ZESTORETIC 20-12.5 (zie DOSERING EN ADMINISTRATIE ).
Gelijktijdige toediening van lisinopril en hydrochloorthiazide heeft weinig of geen effect op de biologische beschikbaarheid van beide geneesmiddelen. De combinatietablet is bio-equivalent aan gelijktijdige toediening van de afzonderlijke entiteiten.
Lisinopril
Werkingsmechanisme
Lisinopril remt angiotensine-converting enzyme (ACE) bij mensen en dieren. ACE is een peptidyldipeptidase dat de omzetting van angiotensine I in de vaatvernauwende stof, angiotensine II, katalyseert. Angiotensine II stimuleert ook de aldosteronsecretie door de bijnierschors. Remming van ACE resulteert in verlaagd plasma-angiotensine II, wat leidt tot verminderde vasopressoractiviteit en tot verminderde aldosteronsecretie. Deze laatste verlaging kan resulteren in een kleine verhoging van het serumkalium. Verwijdering van de negatieve feedback van angiotensine II op de reninesecretie leidt tot verhoogde plasmarenine-activiteit. Bij hypertensieve patiënten met een normale nierfunctie die tot 24 weken met alleen lisinopril werden behandeld, was de gemiddelde stijging van het serumkalium minder dan 0,1 mEq/l; ongeveer 15 procent van de patiënten had echter een toename van meer dan 0,5 mEq/L en ongeveer zes procent had een afname van meer dan 0,5 mEq/L. In hetzelfde onderzoek vertoonden patiënten die werden behandeld met lisinopril plus een thiazidediureticum in wezen geen verandering in serumkalium (zie PREVENTIEVE MAATREGELEN ).
ACE is identiek aan kininase, een enzym dat bradykinine afbreekt. Of verhoogde niveaus van bradykinine, een krachtig vasodepressor-peptide, een rol spelen bij de therapeutische effecten van lisinopril, moet nog worden opgehelderd.
Hoewel aangenomen wordt dat het mechanisme waardoor lisinopril de bloeddruk verlaagt voornamelijk de onderdrukking van het renine-angiotensine-aldosteronsysteem is, is lisinopril antihypertensief, zelfs bij patiënten met hypertensie met een laag reninegehalte. Hoewel lisinopril in alle onderzochte rassen antihypertensief was, hadden negroïde hypertensieve patiënten (meestal een populatie met lage reninehypertensieven) een kleinere gemiddelde respons op lisinopril monotherapie dan niet-negroïde patiënten.
Farmacokinetiek en metabolisme
Na orale toediening van lisinopril treden piekserumconcentraties op binnen ongeveer 7 uur. Dalende serumconcentraties vertonen een verlengde terminale fase die niet bijdraagt aan de accumulatie van het geneesmiddel. Deze terminale fase vertegenwoordigt waarschijnlijk een verzadigbare binding aan ACE en is niet evenredig met de dosis. Lisinopril lijkt niet gebonden te zijn aan andere serumeiwitten.
Lisinopril wordt niet gemetaboliseerd en wordt onveranderd in de urine uitgescheiden. Op basis van urinaire recuperatie is de gemiddelde mate van absorptie van lisinopril ongeveer 25 procent, met een grote interindividuele variabiliteit (6% tot 60%) bij alle geteste doses (5 mg tot 80 mg). De absorptie van lisinopril wordt niet beïnvloed door de aanwezigheid van voedsel in het maagdarmkanaal.
Na meervoudige dosering vertoont lisinopril een effectieve accumulatiehalfwaardetijd van 12 uur.
Een gestoorde nierfunctie vermindert de eliminatie van lisinopril, dat voornamelijk via de nieren wordt uitgescheiden, maar deze afname wordt alleen klinisch belangrijk wanneer de glomerulaire filtratiesnelheid lager is dan 30 ml/min. Boven deze glomerulaire filtratiesnelheid is de eliminatiehalfwaardetijd weinig veranderd. Bij een grotere stoornis nemen de piek- en dalspiegels van lisinopril echter toe, neemt de tijd tot de piekconcentratie toe en wordt de tijd om steady-state te bereiken verlengd. Oudere patiënten hebben gemiddeld (ongeveer verdubbeld) hogere bloedspiegels en oppervlakte onder de plasmaconcentratie-tijdcurve (AUC) dan jongere patiënten (zie DOSERING EN ADMINISTRATIE ). In een farmacokinetisch onderzoek met meerdere doses bij oudere versus jonge hypertensieve patiënten die de combinatie lisinopril/hydrochloorthiazide gebruikten, nam de AUC bij oudere patiënten met ongeveer 120% toe voor lisinopril en met ongeveer 80% voor hydrochloorthiazide. Lisinopril kan worden verwijderd door hemodialyse.
Studies bij ratten geven aan dat lisinopril de bloed-hersenbarrière slecht passeert. Meerdere doses lisinopril bij ratten leiden niet tot accumulatie in weefsels; melk van zogende ratten bevat echter radioactiviteit na toediening van 14C-lisinopril. Door autoradiografie van het hele lichaam werd radioactiviteit gevonden in de placenta na toediening van gelabeld geneesmiddel aan zwangere ratten, maar er werd geen radioactiviteit gevonden bij de foetussen.
farmacodynamiek
Toediening van lisinopril aan patiënten met hypertensie resulteert in een verlaging van de bloeddruk in liggende en staande houding in ongeveer dezelfde mate zonder compenserende tachycardie. Symptomatische orthostatische hypotensie wordt gewoonlijk niet waargenomen, hoewel het kan voorkomen en verwacht moet worden bij patiënten met volume- en/of zoutdepletie (zie WAARSCHUWINGEN ).
Bij de meeste onderzochte patiënten trad een uur na orale toediening van een individuele dosis lisinopril een antihypertensieve activiteit op, waarbij de maximale bloeddrukdaling na zes uur werd bereikt.
Bij sommige patiënten kan een behandeling van twee tot vier weken nodig zijn om een optimale bloeddrukverlaging te bereiken.
Bij de aanbevolen enkelvoudige dagelijkse doses bleven de bloeddrukverlagende effecten gedurende ten minste 24 uur na toediening behouden, hoewel het effect na 24 uur aanzienlijk kleiner was dan het effect zes uur na toediening.
De antihypertensieve effecten van lisinopril hielden aan tijdens langdurige therapie. Abrupt stoppen met lisinopril is niet in verband gebracht met een snelle stijging van de bloeddruk; noch met een significante overschrijding van de bloeddruk voor de behandeling.
In hemodynamische onderzoeken bij patiënten met essentiële hypertensie ging de bloeddrukverlaging gepaard met een vermindering van de perifere arteriële weerstand met weinig of geen verandering in het hartminuutvolume en in de hartslag. In een onderzoek bij negen hypertensieve patiënten was er na toediening van lisinopril een toename van de gemiddelde renale bloedstroom die niet significant was. Gegevens uit verschillende kleine onderzoeken zijn inconsistent met betrekking tot het effect van lisinopril op de glomerulaire filtratiesnelheid bij hypertensieve patiënten met een normale nierfunctie, maar suggereren dat eventuele veranderingen niet groot zijn.
Bij patiënten met renovasculaire hypertensie is aangetoond dat lisinopril goed wordt verdragen en effectief is bij het onder controle houden van de bloeddruk (zie PREVENTIEVE MAATREGELEN ).
Hydrochloorthiazide
Het mechanisme van het antihypertensieve effect van thiaziden is niet bekend. Thiaziden hebben gewoonlijk geen invloed op de normale bloeddruk.
Hydrochloorthiazide is een diureticum en antihypertensivum. Het beïnvloedt het distale renale tubulaire mechanisme van de reabsorptie van elektrolyten. Hydrochloorthiazide verhoogt de uitscheiding van natrium en chloride in ongeveer gelijke hoeveelheden. Natriurese kan gepaard gaan met enig verlies van kalium en bicarbonaat.
Na oraal gebruik begint de diurese binnen twee uur, piekt in ongeveer vier uur en duurt ongeveer 6 tot 12 uur.
Hydrochloorthiazide wordt niet gemetaboliseerd maar wordt snel door de nieren uitgescheiden. Wanneer plasmaspiegels gedurende ten minste 24 uur zijn gevolgd, is waargenomen dat de plasmahalfwaardetijd varieert tussen 5,6 en 14,8 uur. Ten minste 61 procent van de orale dosis wordt binnen 24 uur onveranderd geëlimineerd. Hydrochloorthiazide passeert de placenta, maar niet de bloed-hersenbarrière.
PATIËNT INFORMATIE
Angio-oedeem
Angio-oedeem, inclusief larynxoedeem, kan op elk moment optreden tijdens de behandeling met angiotensine-converterende enzymremmers, waaronder ZESTORETIC. Patiënten moeten zo worden geadviseerd en verteld om onmiddellijk alle tekenen of symptomen die op angio-oedeem wijzen (zwelling van gezicht, ledematen, ogen, lippen, tong, moeite met slikken of ademen) te melden en om geen geneesmiddelen meer te gebruiken totdat ze de voorschrijvende arts hebben geraadpleegd.
Symptomatische hypotensie
Patiënten moeten worden gewaarschuwd om duizeligheid te melden, vooral tijdens de eerste paar dagen van de behandeling. Als daadwerkelijke syncope optreedt, moet de patiënten worden verteld om het medicijn te staken totdat ze de voorschrijvende arts hebben geraadpleegd.
Alle patiënten moeten worden gewaarschuwd dat overmatige transpiratie en uitdroging kunnen leiden tot een buitensporige daling van de bloeddruk als gevolg van een vermindering van het vochtvolume. Andere oorzaken van volumedepletie, zoals braken of diarree, kunnen ook leiden tot een daling van de bloeddruk; patiënten moeten worden geadviseerd hun arts te raadplegen.
Hyperkaliëmie
Patiënten moeten worden verteld geen zoutvervangers te gebruiken die kalium bevatten zonder hun arts te raadplegen.
Leukopenie/neutropenie
Patiënten moeten worden verteld dat ze elke indicatie van een infectie (bijv. keelpijn, koorts) die een teken kan zijn van leukopenie/neutropenie, onmiddellijk moeten melden.
Zwangerschap
Vrouwelijke patiënten in de vruchtbare leeftijd moeten worden geïnformeerd over de gevolgen van blootstelling aan ZESTORETIC tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Patiënten moeten worden gevraagd zwangerschappen zo snel mogelijk aan hun arts te melden.
OPMERKING: Zoals met veel andere geneesmiddelen, is bepaald advies aan patiënten die worden behandeld met ZESTORETIC 12,5 g mg gerechtvaardigd. Deze informatie is bedoeld om te helpen bij een veilig en effectief gebruik van dit medicijn. Het is geen onthulling van alle mogelijke nadelige of beoogde effecten.
