Procardia 30mg Nifedipine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Procardia 30 mg en hoe wordt het gebruikt?
Procardia is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van pijn op de borst (angina), hoge bloeddruk (hypertensie) en pulmonale hypertensie. Procardia 30 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Procardia behoort tot een klasse geneesmiddelen die calciumkanaalblokkers worden genoemd; Calciumkanaalblokkers, dihydrophyridine.
Het is niet bekend of Procardia veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Procardia?
Procardia kan ernstige bijwerkingen veroorzaken, waaronder:
- koorts,
- keelpijn,
- brandende ogen,
- huid pijn,
- rode of paarse huiduitslag met blaarvorming en vervelling,
- verergering van pijn op de borst,
- bonzende hartslagen,
- fladderend in je borst,
- duizeligheid,
- zwelling in uw handen of benen,
- pijn in de bovenbuik, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Procardia 30 mg zijn:
- zwelling,
- blozen (warmte, roodheid of tintelend gevoel),
- hoofdpijn,
- duizeligheid,
- misselijkheid,
- brandend maagzuur, en
- zich zwak of moe voelen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Procardia. Vraag uw arts of apotheker om meer informatie.
OMSCHRIJVING
PROCARDIA® (nifedipine) is een middel tegen angina dat behoort tot een klasse van farmacologische middelen, de calciumkanaalblokkers. Nifedipine is 3,5-pyridinedicarbonzuur, 1,4-dihydro-2,6-dimethyl-4-(2-nitrofenyl)-, dimethylester, C17H18N2O6, en heeft de structuurformule:
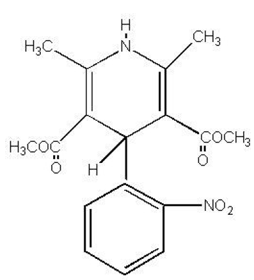
Nifedipine is een gele kristallijne stof, praktisch onoplosbaar in water maar oplosbaar in ethanol. Het heeft een molecuulgewicht van 346,3. PROCARDIA-capsules zijn geformuleerd als zachte gelatinecapsules voor orale toediening, die elk 10 mg nifedipine bevatten.
Inerte ingrediënten in de formulering zijn: glycerine; pepermunt olie; polyethyleenglycol; zachte gelatinecapsules (die Geel 6 bevatten en mogelijk rood ijzeroxide en andere inerte ingrediënten bevatten); en water. De capsules van 10 mg bevatten ook sacharine-natrium.
INDICATIES
Vasospastische angina
PROCARDIA (nifedipine) is geïndiceerd voor de behandeling van vasospastische angina, bevestigd door een van de volgende criteria: 1) klassiek patroon van angina in rust vergezeld van ST-segmentverhoging, 2) angina of kransslagaderspasme veroorzaakt door ergonovine, of 3) angiografisch aangetoond kransslagader spasme. Bij die patiënten die angiografie hebben ondergaan, is de aanwezigheid van een significante gefixeerde obstructieve ziekte niet onverenigbaar met de diagnose van vasospastische angina, op voorwaarde dat aan de bovenstaande criteria wordt voldaan. PROCARDIA 30 mg kan ook worden gebruikt wanneer de klinische presentatie een mogelijke vasospastische component suggereert, maar waar vasospasme niet is bevestigd, bijv. wanneer pijn een variabele drempel heeft bij inspanning of wanneer angina ongevoelig is voor nitraten en/of adequate doses bètablokkers.
Chronische stabiele angina (klassieke inspanning-geassocieerde angina)
PROCARDIA 30 mg is geïndiceerd voor de behandeling van chronische stabiele angina (inspanningsgerelateerde angina) zonder tekenen van vasospasme bij patiënten die symptomatisch blijven ondanks adequate doses bètablokkers en/of organische nitraten of die deze middelen niet kunnen verdragen.
Bij chronische stabiele angina (inspanningsgerelateerde angina) was PROCARDIA effectief in gecontroleerde onderzoeken met een duur van maximaal acht weken bij het verminderen van de frequentie van angina en het verhogen van de inspanningstolerantie, maar de bevestiging van aanhoudende effectiviteit en evaluatie van de veiligheid op lange termijn bij deze patiënten zijn onvolledig. .
Gecontroleerde onderzoeken bij kleine aantallen patiënten suggereren dat gelijktijdig gebruik van PROCARDIA 30 mg en bètablokkers gunstig kan zijn bij patiënten met chronische stabiele angina, maar de beschikbare informatie is niet voldoende om met vertrouwen de effecten van gelijktijdige behandeling te voorspellen, vooral bij patiënten met een aangetaste linkerventrikelfunctie of hartgeleidingsstoornissen. Bij het starten van een dergelijke gelijktijdige therapie moet de bloeddruk nauwlettend worden gecontroleerd, aangezien ernstige hypotensie kan optreden door de gecombineerde effecten van de geneesmiddelen. (Zien WAARSCHUWINGEN .)
DOSERING EN ADMINISTRATIE
De dosering van PROCARDIA 30 mg die nodig is om angina pectoris te onderdrukken en die door de patiënt kan worden verdragen, moet worden bepaald door middel van titratie. Overmatige doses kunnen leiden tot hypotensie.
De therapie moet worden gestart met de capsule van 10 mg. De startdosering is één capsule van 10 mg, in zijn geheel doorgeslikt, 3 maal per dag. Het gebruikelijke effectieve dosisbereik is driemaal daags 10-20 mg. Sommige patiënten, vooral die met tekenen van coronaire hartspasmen, reageren alleen op hogere doses, frequentere toediening of beide. Bij dergelijke patiënten kunnen doses van drie- of viermaal daags 20-30 mg effectief zijn. Doses boven 120 mg per dag zijn zelden nodig. Meer dan 180 mg per dag wordt niet aanbevolen.
In de meeste gevallen moet de titratie van PROCARDIA plaatsvinden over een periode van 7-14 dagen, zodat de arts de respons op elk dosisniveau kan beoordelen en de bloeddruk kan controleren alvorens over te gaan tot hogere doses.
Als de symptomen dit rechtvaardigen, kan de titratie sneller verlopen, op voorwaarde dat de patiënt regelmatig wordt beoordeeld. Op basis van het fysieke activiteitsniveau, de aanvalsfrequentie en de sublinguale nitroglycerineconsumptie van de patiënt, kan de dosis PROCARDIA 30 mg worden verhoogd van 10 mg driemaal daags tot 20 mg driemaal en vervolgens tot 30 mg driemaal daags gedurende een periode van drie dagen.
Bij gehospitaliseerde patiënten die nauwlettend worden geobserveerd, kan de dosis worden verhoogd in stappen van 10 mg gedurende perioden van vier tot zes uur om pijn en aritmieën als gevolg van ischemie onder controle te houden. Een enkele dosis mag zelden hoger zijn dan 30 mg.
Vermijd gelijktijdige toediening van nifedipine met grapefruitsap (zie: KLINISCHE FARMACOLOGIE en DRUG-INTERACTIES ).
Er is geen "rebound-effect" waargenomen na stopzetting van PROCARDIA. Als stopzetting van PROCARDIA echter noodzakelijk is, suggereert gedegen klinische praktijk dat de dosering geleidelijk moet worden verlaagd onder nauwlettend toezicht van een arts.
Gelijktijdige toediening met andere anti-angineuze geneesmiddelen
Sublinguaal nitroglycerine kan naar behoefte worden ingenomen voor de beheersing van acute manifestaties van angina, met name tijdens PROCARDIA-titratie. Zien DRUG-INTERACTIES , voor informatie over gelijktijdige toediening van PROCARDIA 30 mg met bètablokkers of langwerkende nitraten.
HOE GELEVERD
PROCARDIA zachte gelatinecapsules worden geleverd in:
Flessen van 100: 10 mg ( NDC 0069-2600-66)
De capsules moeten worden beschermd tegen licht en vocht en worden bewaard bij een gecontroleerde kamertemperatuur, 59 ° tot 77 ° F (15 ° tot 25 ° C) in de originele verpakking van de fabrikant.
Gedistribueerd door: Pfizer Labs, Division of Pfizer Inc, NY, NY 10017. Herzien: juli 2016
BIJWERKINGEN
In gecontroleerde onderzoeken met meerdere doses in de Verenigde Staten en in andere landen waarin spontaan bijwerkingen werden gemeld, waren bijwerkingen frequent maar over het algemeen niet ernstig en vereisten zelden stopzetting van de behandeling of dosisaanpassing. De meeste waren verwachte gevolgen van de vaatverwijdende effecten van PROCARDIA.
Er is ook een grote ongecontroleerde ervaring bij meer dan 2100 patiënten in de Verenigde Staten. De meeste patiënten hadden vasospastische of resistente angina pectoris en ongeveer de helft kreeg gelijktijdige behandeling met bèta-adrenerge blokkers. De meest voorkomende bijwerkingen waren:
Incidentie Ongeveer 10%
Cardiovasculair: perifeer oedeem
Centraal zenuwstelsel: duizeligheid of licht gevoel in het hoofd
Gastro-intestinaal: misselijkheid
Systemisch: hoofdpijn en blozen, zwakte
Incidentie Ongeveer 5%
Cardiovasculair: voorbijgaande hypotensie
Incidentie 2% of minder
Cardiovasculair: hartkloppingen
Ademhaling: verstopte neus en borst, kortademigheid
Gastro-intestinaal: diarree, constipatie, krampen, winderigheid
Musculoskeletaal: ontsteking, gewrichtsstijfheid, spierkrampen
Centraal zenuwstelsel: beven, zenuwachtigheid, zenuwachtigheid, slaapstoornissen, wazig zien, evenwichtsproblemen
Ander: dermatitis, pruritus, urticaria, koorts, zweten, koude rillingen, seksuele problemen
Incidentie Ongeveer 0,5%
Cardiovasculair: syncope (meestal bij initiële dosering en/of verhoging van de dosis), erytromelalgie
Incidentie minder dan 0,5%
Hematologische: trombocytopenie, bloedarmoede, leukopenie, purpura
Gastro-intestinaal: allergische hepatitis
Gezicht en keel: angio-oedeem (meestal orofaryngeaal oedeem met ademhalingsmoeilijkheden bij enkele patiënten), gingivale hyperplasie
CNS: depressie, paranoïde syndroom
Speciale zintuigen: voorbijgaande blindheid op het hoogtepunt van de plasmaspiegel, tinnitus
Urogenitaal: nocturie, polyurie
Ander: artritis met ANA (+), exfoliatieve dermatitis, gynaecomastie
Musculoskeletaal: spierpijn
Verschillende van deze bijwerkingen lijken dosisgerelateerd te zijn. Perifeer oedeem trad op bij ongeveer één op de 25 patiënten bij doses van minder dan 60 mg per dag en bij ongeveer één op de acht patiënten bij 120 mg per dag of meer. Voorbijgaande hypotensie, over het algemeen van lichte tot matige ernst en die zelden stopzetting van de behandeling vereiste, trad op bij een van de 50 patiënten bij een dosering van minder dan 60 mg per dag en bij een van de 20 patiënten bij een dosering van 120 mg per dag of meer.
Zeer zelden ging de introductie van de behandeling met PROCARDIA 30 mg gepaard met een toename van angina pectoris, mogelijk als gevolg van geassocieerde hypotensie. Voorbijgaand eenzijdig verlies van gezichtsvermogen is ook opgetreden.
Bovendien werden bij deze patiënten ernstigere bijwerkingen waargenomen, die niet gemakkelijk te onderscheiden waren van het natuurlijke beloop van de ziekte. Het blijft echter mogelijk dat sommige of veel van deze gebeurtenissen drugsgerelateerd waren. Myocardinfarct trad op bij ongeveer 4% van de patiënten en congestief hartfalen of longoedeem bij ongeveer 2%. Ventriculaire aritmieën of geleidingsstoornissen kwamen elk voor bij minder dan 0,5% van de patiënten.
In een subgroep van meer dan 1000 patiënten die PROCARDIA 30 mg kregen met gelijktijdige bètablokkertherapie, waren het patroon en de incidentie van bijwerkingen niet verschillend van die van de hele groep met PROCARDIA (nifedipine) behandelde patiënten. (Zien PREVENTIEVE MAATREGELEN .)
In een subgroep van ongeveer 250 patiënten met de diagnose congestief hartfalen en angina pectoris (ongeveer 10% van de totale patiëntenpopulatie), kwamen duizeligheid of een licht gevoel in het hoofd, perifeer oedeem, hoofdpijn of blozen elk voor bij één op de acht patiënten. Hypotensie trad op bij ongeveer één op de 20 patiënten. Syncope trad op bij ongeveer één op de 250 patiënten. Een myocardinfarct of symptomen van congestief hartfalen traden elk op bij ongeveer één op de 15 patiënten. Atriale of ventriculaire ritmestoornissen kwamen elk voor bij ongeveer één op de 150 patiënten.
Tijdens postmarketingervaring zijn er zeldzame meldingen geweest van exfoliatieve dermatitis veroorzaakt door nifedipine. Er zijn zeldzame meldingen geweest van exfoliatieve of bulleuze huidbijwerkingen (zoals erythema multiforme, Stevens-Johnson-syndroom en toxische epidermale necrolyse) en fotosensitiviteitsreacties. Acute gegeneraliseerde exanthemateuze pustulosis is ook gemeld.
DRUG-INTERACTIES
Bèta-adrenerge blokkers
(Zien AANWIJZINGEN EN GEBRUIK en WAARSCHUWINGEN .) Ervaring bij meer dan 1400 patiënten in een niet-vergelijkend klinisch onderzoek heeft aangetoond dat gelijktijdige toediening van PROCARDIA 30 mg en bètablokkers gewoonlijk goed wordt verdragen, maar er zijn incidentele literatuurrapporten die suggereren dat de combinatie de kans op congestief hartfalen kan vergroten, ernstige hypotensie of verergering van angina.
Langwerkende nitraten
PROCARDIA 30 mg kan veilig samen met nitraten worden toegediend, maar er zijn geen gecontroleerde onderzoeken geweest om de anti-angineuze werkzaamheid van deze combinatie te evalueren.
Digitalis
Aangezien er geïsoleerde meldingen zijn van patiënten met verhoogde digoxinespiegels en aangezien er een mogelijke interactie is tussen digoxine en nifedipine, wordt aanbevolen om de digoxinespiegels te controleren bij het starten, aanpassen en stopzetten van nifedipine om mogelijke over- of onderdigitalisering te voorkomen. .
kinidine
Er zijn zeldzame meldingen geweest van een interactie tussen kinidine en nifedipine (met een verlaagde plasmaspiegel van kinidine).
Coumarine anticoagulantia
Er zijn zeldzame meldingen geweest van een verhoogde protrombinetijd bij patiënten die cumarine-anticoagulantia gebruikten aan wie PROCARDIA werd toegediend. De relatie met de PROCARDIA-therapie is echter onzeker.
cimetidine
Een onderzoek bij zes gezonde vrijwilligers heeft een significante toename aangetoond van de piekplasmaspiegels van nifedipine (80%) en de oppervlakte onder de curve (74%) na een kuur van een week met cimetidine van 1000 mg per dag en nifedipine van 40 mg per dag. dag. Ranitidine veroorzaakte kleinere, niet-significante stijgingen. Het effect kan worden gemedieerd door de bekende remming van cimetidine op hepatisch cytochroom P-450, het enzymsysteem dat waarschijnlijk verantwoordelijk is voor het first-pass-metabolisme van nifedipine. Als behandeling met nifedipine wordt gestart bij een patiënt die momenteel cimetidine krijgt, wordt voorzichtige titratie geadviseerd.
Nifedipine wordt gemetaboliseerd door CYP3A4. Gelijktijdige toediening van nifedipine met fenytoïne, een inductor van CYP3A4, verlaagt de systemische blootstelling aan nifedipine met ongeveer 70%. Vermijd gelijktijdige toediening van nifedipine met fenytoïne of een bekende CYP3A4-inductor of overweeg een alternatieve antihypertensieve therapie.
CYP3A-remmers zoals fluconazol, itraconazol, claritromycine, erytromycine, nefazodon, fluoxetine, saquinavir, indinavir en nelfinavir kunnen bij gelijktijdige toediening leiden tot een verhoogde blootstelling aan nifedipine. Zorgvuldige monitoring en dosisaanpassing kunnen nodig zijn; overweeg om nifedipine te starten in de laagst beschikbare dosis als het gelijktijdig met deze medicijnen wordt gegeven.
Andere interacties
Grapefruit SAP
Gelijktijdige toediening van nifedipine met grapefruitsap resulteerde in een ongeveer verdubbeling van de AUC en Cmax van nifedipine zonder verandering in de halfwaardetijd. De verhoogde plasmaconcentraties zijn hoogstwaarschijnlijk het gevolg van remming van CYP 3A4-gerelateerd first-pass-metabolisme. Vermijd inname van grapefruit en grapefruitsap tijdens het gebruik van nifedipine.
WAARSCHUWINGEN
Overmatige hypotensie
Hoewel het hypotensieve effect van PROCARDIA 30 mg bij de meeste patiënten bescheiden is en goed wordt verdragen, hebben incidentele patiënten overmatige en slecht verdragen hypotensie gehad. Deze reacties zijn meestal opgetreden tijdens de initiële titratie of op het moment van daaropvolgende opwaartse dosisaanpassing. Hoewel patiënten zelden overmatige hypotensie hebben ervaren met alleen PROCARDIA 30 mg, kan dit vaker voorkomen bij patiënten die gelijktijdig worden behandeld met bètablokkers. Hoewel niet goedgekeurd voor dit doel, zijn PROCARDIA en andere nifedipine-capsules met onmiddellijke afgifte gebruikt (oraal en sublinguaal) voor acute verlaging van de bloeddruk. Verschillende goed gedocumenteerde rapporten beschrijven gevallen van ernstige hypotensie, myocardinfarct en overlijden wanneer nifedipine met onmiddellijke afgifte op deze manier werd gebruikt. PROCARDIA-capsules mogen niet worden gebruikt voor de acute verlaging van de bloeddruk.
Ernstige hypotensie en/of verhoogde behoefte aan vochtvolume zijn gemeld bij patiënten die PROCARDIA 30 mg kregen samen met een bètablokker en die een bypassoperatie van de kransslagader ondergingen met behulp van een hoge dosis fentanylanesthesie. De interactie met hoge doses fentanyl lijkt te wijten te zijn aan de combinatie van PROCARDIA en een bètablokker, maar de mogelijkheid dat deze kan optreden met alleen PROCARDIA 30 mg, met lage doses fentanyl, bij andere chirurgische procedures of met andere narcotische analgetica kan niet worden uitgesloten. uitgesloten. Bij met PROCARDIA behandelde patiënten bij wie een operatie met een hoge dosis fentanylanesthesie wordt overwogen, moet de arts zich bewust zijn van deze mogelijke problemen en, als de toestand van de patiënt het toelaat, moet er voldoende tijd (ten minste 36 uur) worden gegeven om PROCARDIA 30 mg uit de het lichaam voorafgaand aan de operatie.
Verhoogde angina en/of myocardinfarct
Zelden hebben patiënten, vooral degenen met ernstige obstructieve coronaire hartziekte, een goed gedocumenteerde verhoogde frequentie, duur en/of ernst van angina of acuut myocardinfarct ontwikkeld bij het starten met PROCARDIA 30 mg of op het moment van dosisverhoging. Het mechanisme van dit effect is niet vastgesteld.
Verschillende goed gecontroleerde, gerandomiseerde onderzoeken bestudeerden het gebruik van nifedipine met onmiddellijke afgifte bij patiënten die net een hartinfarct hadden gehad. In geen van deze onderzoeken leek nifedipine met onmiddellijke afgifte enig voordeel te bieden. In sommige van de onderzoeken hadden patiënten die nifedipine met onmiddellijke afgifte kregen significant slechtere resultaten dan patiënten die placebo kregen. PROCARDIA 30 mg capsules mogen niet worden toegediend binnen de eerste of twee weken na een myocardinfarct, en ze moeten ook worden vermeden bij een acuut coronair syndroom (wanneer een infarct dreigt).
Gebruik bij essentiële hypertensie
PROCARDIA 30 mg en andere nifedipine-capsules met onmiddellijke afgifte zijn ook gebruikt voor de langetermijncontrole van essentiële hypertensie, hoewel PROCARDIA 30 mg-capsules voor dit doel niet zijn goedgekeurd en er geen goed gecontroleerde onderzoeken zijn uitgevoerd om een geschikte dosis of dosisinterval te bepalen voor een dergelijke behandeling. PROCARDIA 30 mg capsules mogen niet worden gebruikt voor de beheersing van essentiële hypertensie.
Intrekking van bètablokker
Patiënten die recentelijk zijn gestopt met bètablokkers, kunnen een ontwenningssyndroom ontwikkelen met verhoogde angina, waarschijnlijk gerelateerd aan een verhoogde gevoeligheid voor catecholamines. Het starten van de behandeling met PROCARDIA 30 mg zal dit optreden niet voorkomen en het kan worden verwacht dat het dit verergert door reflexmatige afgifte van catecholamine teweeg te brengen. Er zijn incidentele meldingen geweest van toegenomen angina in een setting van ontwenning van bètablokkers en het starten van PROCARDIA. Het is belangrijk om bètablokkers indien mogelijk af te bouwen, in plaats van ze abrupt te stoppen voordat u met PROCARDIA begint.
Congestief hartfalen
Zelden hebben patiënten, meestal degenen die een bètablokker krijgen, hartfalen ontwikkeld na het starten met PROCARDIA. Patiënten met een strakke aortastenose lopen mogelijk een groter risico op een dergelijk voorval, aangezien het ontlastende effect van PROCARDIA 30 mg naar verwachting minder gunstig zal zijn voor deze patiënten, vanwege hun vaste impedantie om over de aortaklep te stromen.
PREVENTIEVE MAATREGELEN
Algemeen
Hypotensie
Omdat PROCARDIA de perifere vasculaire weerstand verlaagt, wordt een zorgvuldige controle van de bloeddruk tijdens de eerste toediening en titratie van PROCARDIA 30 mg aanbevolen. Nauwkeurige observatie wordt met name aanbevolen voor patiënten die al medicijnen gebruiken waarvan bekend is dat ze de bloeddruk verlagen. (Zien WAARSCHUWINGEN .)
Perifeer oedeem
Mild tot matig perifeer oedeem, meestal geassocieerd met arteriële vasodilatatie en niet te wijten aan linkerventrikeldisfunctie, komt voor bij ongeveer één op de tien patiënten die worden behandeld met PROCARDIA (nifedipine). Dit oedeem komt voornamelijk voor in de onderste ledematen en reageert meestal op diuretische therapie. Bij patiënten bij wie de angina wordt gecompliceerd door congestief hartfalen, moet ervoor worden gezorgd dat dit perifere oedeem wordt onderscheiden van de effecten van toenemende linkerventrikeldisfunctie.
Laboratorium testen
Zeldzame, meestal voorbijgaande, maar soms significante verhogingen van enzymen zoals alkalische fosfatase, CPK, LDH, SGOT en SGPT zijn waargenomen. De relatie met PROCARDIA-therapie is in de meeste gevallen onzeker, maar in sommige gevallen waarschijnlijk. Deze laboratoriumafwijkingen zijn zelden in verband gebracht met klinische symptomen; er is echter melding gemaakt van cholestase met of zonder geelzucht. Zeldzame gevallen van allergische hepatitis zijn gemeld.
PROCARDIA 30 mg vermindert, net als andere calciumantagonisten, de bloedplaatjesaggregatie in vitro. Beperkte klinische onderzoeken hebben bij sommige PROCARDIA-patiënten een matige maar statistisch significante afname van de bloedplaatjesaggregatie en een toename van de bloedingstijd aangetoond. Men denkt dat dit een functie is van de remming van calciumtransport door het bloedplaatjesmembraan. Er is geen klinische betekenis voor deze bevindingen aangetoond.
Positieve directe Coombs-test met/zonder hemolytische anemie is gemeld, maar een causaal verband tussen toediening van PROCARDIA en positiviteit van deze laboratoriumtest, inclusief hemolyse, kon niet worden vastgesteld.
Hoewel PROCARDIA 30 mg veilig is gebruikt bij patiënten met nierdisfunctie en waarvan is gemeld dat het een gunstig effect heeft, zijn in bepaalde gevallen zeldzame, omkeerbare verhogingen van BUN en serumcreatinine gemeld bij patiënten met reeds bestaande chronische nierinsufficiëntie. De relatie met de PROCARDIA-therapie is in de meeste gevallen onzeker, maar in sommige gevallen waarschijnlijk.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Nifedipine werd gedurende twee jaar oraal toegediend aan ratten en bleek niet kankerverwekkend te zijn. Wanneer nifedipine vóór de paring aan ratten werd gegeven, veroorzaakte het een verminderde vruchtbaarheid bij een dosis van ongeveer 5 keer de maximaal aanbevolen dosis voor de mens. Er is een literatuurrapport over een omkeerbare vermindering van het vermogen van menselijk sperma, verkregen van een beperkt aantal onvruchtbare mannen die de aanbevolen doses nifedipine gebruiken, om zich in vitro te binden aan een eicel en deze te bevruchten. In vivo mutageniteitsstudies waren negatief.
Zwangerschap
Van nifedipine is aangetoond dat het teratogene bevindingen veroorzaakt bij ratten en konijnen, waaronder digitale anomalieën die vergelijkbaar zijn met die gerapporteerd voor fenytoïne. Er is gemeld dat digitale anomalieën optreden bij andere leden van de dihydropyridine-klasse en mogelijk het gevolg zijn van een aangetaste bloedstroom in de baarmoeder. Toediening van nifedipine ging gepaard met een verscheidenheid aan embryotoxische, placentotoxische en foetotoxische effecten, waaronder onvolgroeide foetussen (ratten, muizen, konijnen), ribmisvormingen (muizen), gespleten gehemelte (muizen), kleine placenta's en onderontwikkelde chorionvlokken (apen), embryonale en foetale sterfte (ratten, muizen, konijnen) en langdurige zwangerschap/verminderde neonatale overleving (ratten; niet geëvalueerd bij andere soorten). Op basis van mg/kg waren alle doses die verband hielden met de teratogene embryotoxische of foetotoxische effecten bij dieren (5 tot 50 keer) hoger dan de maximaal aanbevolen dosis voor de mens van 120 mg/dag. Op basis van mg/m² waren sommige doses hoger en andere lager dan de maximaal aanbevolen dosis voor de mens, maar ze lagen allemaal binnen een orde van grootte daarvan. De doses geassocieerd met placentotoxische effecten bij apen waren gelijk aan of lager dan de maximaal aanbevolen dosis voor de mens op basis van mg/m².
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. PROCARDIA mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico.
Borstvoeding
Nifedipine wordt overgedragen via de moedermelk. PROCARDIA mag alleen tijdens het geven van borstvoeding worden gebruikt als het potentiële voordeel opweegt tegen het potentiële risico.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld. Gebruik bij pediatrische patiënten wordt niet aanbevolen.
Geriatrisch gebruik
Leeftijd lijkt een significant effect te hebben op de farmacokinetiek van nifedipine. De klaring is verminderd, wat resulteert in een hogere AUC bij ouderen. Deze veranderingen zijn niet het gevolg van veranderingen in de nierfunctie (zie: KLINISCHE FARMACOLOGIE , Farmacokinetiek ).
OVERDOSERING
Ervaring met overdosering van nifedipine is beperkt. Over het algemeen vereist overdosering met nifedipine die leidt tot uitgesproken hypotensie, actieve cardiovasculaire ondersteuning, inclusief monitoring van de cardiovasculaire en respiratoire functie, verhoging van extremiteiten en oordeelkundig gebruik van calciuminfusie, bloeddrukverhogende middelen en vloeistoffen. De klaring van nifedipine zou naar verwachting langer duren bij patiënten met een verminderde leverfunctie. Aangezien nifedipine sterk eiwitgebonden is, zal dialyse waarschijnlijk geen voordeel opleveren; plasmaferese kan echter gunstig zijn.
CONTRA-INDICATIES
Bekende overgevoeligheidsreactie op PROCARDIA.
KLINISCHE FARMACOLOGIE
PROCARDIA is een calciumion-influxremmer (slow-channel blocker of calciumion-antagonist) en remt de transmembraaninflux van calciumionen in hartspier en glad spierweefsel. De contractiele processen van hartspier en vasculaire gladde spieren zijn afhankelijk van de beweging van extracellulaire calciumionen in deze cellen via specifieke ionenkanalen. PROCARDIA 30 mg remt selectief de instroom van calciumionen door het celmembraan van hartspier en vasculaire gladde spieren zonder de serumcalciumconcentraties te veranderen.
Werkingsmechanisme
De precieze manier waarop deze remming angina verlicht, is niet volledig vastgesteld, maar omvat ten minste de volgende twee mechanismen:
Ontspanning en preventie van coronaire hartspasmen
PROCARDIA verwijdt de belangrijkste kransslagaders en kransslagaders, zowel in normale als ischemische regio's, en is een krachtige remmer van kransslagaderspasmen, zowel spontaan als door ergonovine veroorzaakt. Deze eigenschap verhoogt de myocardiale zuurstofafgifte bij patiënten met coronaire hartspasmen en is verantwoordelijk voor de effectiviteit van PROCARDIA 30 mg bij vasospastische (Prinzmetal- of variant) angina. Of dit effect een rol speelt bij klassieke angina is niet duidelijk, maar studies naar inspanningstolerantie hebben geen toename aangetoond van het maximale inspanningsdruk-product, een algemeen aanvaarde maatstaf voor zuurstofgebruik. Dit suggereert dat, in het algemeen, verlichting van spasmen of verwijding van kransslagaders geen belangrijke factor is bij klassieke angina.
Vermindering van zuurstofgebruik
PROCARDIA verlaagt regelmatig de arteriële druk in rust en bij een bepaald inspanningsniveau door de perifere arteriolen te verwijden en de totale perifere weerstand (afterload) waartegen het hart werkt te verminderen. Deze ontlading van het hart vermindert het energieverbruik van het myocard en de zuurstofbehoefte en verklaart waarschijnlijk de effectiviteit van PROCARDIA bij chronische stabiele angina.
Farmacokinetiek en metabolisme
PROCARDIA wordt snel en volledig geabsorbeerd na orale toediening. Het geneesmiddel is 10 minuten na orale toediening in serum detecteerbaar en piekbloedspiegels treden op in ongeveer 30 minuten. De biologische beschikbaarheid is evenredig met de dosis van 10 tot 30 mg; de halfwaardetijd verandert niet significant met de dosis. Er is weinig verschil in relatieve biologische beschikbaarheid wanneer PROCARDIA-capsules oraal worden gegeven en ofwel heel worden doorgeslikt, gebeten en ingeslikt, of gebeten en sublinguaal vastgehouden. Het doorslikken van de capsule voorafgaand aan het doorslikken resulteert echter in iets eerdere plasmaconcentraties (27 ng/ml 10 minuten na 10 mg) dan wanneer de capsules intact worden doorgeslikt. PROCARDIA 30 mg is sterk gebonden aan serumeiwitten. PROCARDIA wordt grotendeels omgezet in inactieve metabolieten en ongeveer 80 procent van PROCARDIA 30 mg en metabolieten worden via de nieren uitgescheiden. De eliminatiehalfwaardetijd van nifedipine is ongeveer twee uur. Aangezien leverbiotransformatie de belangrijkste route is voor de dispositie van nifedipine, kan de farmacokinetiek veranderen bij patiënten met chronische leverziekte. Patiënten met een leverfunctiestoornis (levercirrose) hebben een langere dispositiehalfwaardetijd en een hogere biologische beschikbaarheid van nifedipine dan gezonde vrijwilligers. De mate van serumeiwitbinding van nifedipine is hoog (92-98%). De eiwitbinding kan sterk verminderd zijn bij patiënten met nier- of leverinsufficiëntie.
Na intraveneuze toediening was de klaring van nifedipine bij oudere gezonde proefpersonen met 33% afgenomen in vergelijking met jonge gezonde proefpersonen.
Hemodynamiek
Net als andere langzame-kanaalblokkers oefent PROCARDIA een negatief inotroop effect uit op geïsoleerd myocardweefsel. Dit wordt zelden of nooit gezien bij intacte dieren of mensen, waarschijnlijk vanwege reflexreacties op de vaatverwijdende effecten. Bij de mens veroorzaakt PROCARDIA 30 mg verminderde perifere vaatweerstand en een daling van de systolische en diastolische druk, meestal bescheiden (5-10 mm Hg systolisch), maar soms groter. Er is meestal een kleine toename van de hartslag, een reflexreactie op vasodilatatie. Metingen van de hartfunctie bij patiënten met een normale ventriculaire functie hebben over het algemeen een kleine toename van de hartindex gevonden zonder grote effecten op de ejectiefractie, linker ventriculaire einddiastolische druk (LVEDP) of volume (LVEDV). Bij patiënten met een verminderde ventriculaire functie hebben de meeste acute onderzoeken een toename van de ejectiefractie en een afname van de linkerventrikelvuldruk aangetoond.
Elektrofysiologische effecten
Hoewel PROCARDIA, net als andere leden van zijn klasse, de functie van de sinusknoop en de atrioventriculaire geleiding in geïsoleerde myocardpreparaten vermindert, zijn dergelijke effecten niet waargenomen in onderzoeken bij intacte dieren of bij de mens. In formele elektrofysiologische onderzoeken, voornamelijk bij patiënten met normale geleidingssystemen, had PROCARDIA 30 mg niet de neiging om de atrioventriculaire geleiding te verlengen, de hersteltijd van de sinusknoop te verlengen of de sinusfrequentie te vertragen.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN secties.
