Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Coreg 25 mg en hoe wordt het gebruikt?
Coreg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hartfalen en hoge bloeddruk (hypertensie) te behandelen. Coreg 25 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Coreg behoort tot een klasse geneesmiddelen die bètablokkers, alfa-activiteit, wordt genoemd.
Het is niet bekend of Coreg 25 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Coreg?
Coreg kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- langzame of onregelmatige hartslagen,
- koud gevoel of gevoelloosheid in uw vingers of tenen,
- pijn op de borst,
- droge hoest,
- piepende ademhaling,
- beklemming op de borst,
- zwelling,
- snelle gewichtstoename,
- kortademigheid voelen,
- verhoogde dorst,
- meer plassen,
- droge mond, en
- fruitige ademgeur
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Coreg 6,25 mg zijn:
- duizeligheid,
- trage hartslagen,
- diarree,
- gewichtstoename,
- droge ogen, en
- moeite met het gebruik van contactlenzen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Coreg. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
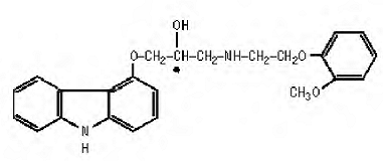
Carvedilol is een niet-selectieve β-adrenerge blokker met α1-blokkerende activiteit. Het is (±)-1(Carbazol-4-yloxy)-3-[[2-(o-methoxyfenoxy)ethyl]amino]-2-propanol. Carvedilol is een racemisch mengsel met de volgende structuur:
COREG 6,25 mg is een witte, ovale, filmomhulde tablet die 3,125 mg, 6,25 mg, 12,5 mg of 25 mg carvedilol bevat. De tabletten van 6,25 mg, 12,5 mg en 25 mg zijn TILTAB-tabletten. Inactieve ingrediënten bestaan uit colloïdaal siliciumdioxide, crospovidon, hypromellose, lactose, magnesiumstearaat, polyethyleenglycol, polysorbaat 80, povidon, sucrose en titaniumdioxide.
Carvedilol is een wit tot gebroken wit poeder met een molecuulgewicht van 406,5 en een molecuulformule C24H26N2O4. Het is vrij oplosbaar in dimethylsulfoxide; oplosbaar in methyleenchloride en methanol; matig oplosbaar in 95% ethanol en isopropanol; enigszins oplosbaar in ethylether; en praktisch onoplosbaar in water, maagvloeistof (gesimuleerd, TS, pH 1,1) en darmvloeistof (gesimuleerd, TS zonder pancreatine, pH 7,5).
INDICATIES
Hartfalen
COREG is geïndiceerd voor de behandeling van licht tot ernstig chronisch hartfalen van ischemische of cardiomyopathische oorsprong, meestal naast diuretica, ACE-remmers en digitalis, om de overleving te verhogen en ook om het risico op ziekenhuisopname te verminderen [zie DRUG-INTERACTIES , Klinische studies ].
Linkerventrikeldisfunctie na een myocardinfarct
COREG is geïndiceerd om de cardiovasculaire mortaliteit te verminderen bij klinisch stabiele patiënten die de acute fase van een myocardinfarct hebben overleefd en een linkerventrikelejectiefractie hebben van minder dan of gelijk aan 40% (met of zonder symptomatisch hartfalen) [zie Klinische studies ].
Hypertensie
COREG 25 mg is geïndiceerd voor de behandeling van essentiële hypertensie [zie Klinische studies ]. Het kan alleen of in combinatie met andere antihypertensiva worden gebruikt, met name diuretica van het thiazidetype [zie DRUG-INTERACTIES ].
DOSERING EN ADMINISTRATIE
COREG moet met voedsel worden ingenomen om de absorptiesnelheid te vertragen en de incidentie van orthostatische effecten te verminderen.
Hartfalen
DOSERING MOET TIJDENS DE OPTITRATIE WORDEN GENDIVIDUALISEERD EN NAUWKEURIG GECONTROLEERD DOOR EEN ARTS. Voordat met COREG 12,5 mg wordt gestart, wordt aanbevolen om het vasthouden van vocht tot een minimum te beperken. De aanbevolen startdosering van COREG is 3,125 mg tweemaal daags gedurende 2 weken. Indien getolereerd, kan de dosis van patiënten worden verhoogd tot 6,25, 12,5 en 25 mg tweemaal daags met opeenvolgende tussenpozen van ten minste 2 weken. Patiënten moeten op lagere doses worden gehandhaafd als hogere doses niet worden verdragen. Een maximale dosis van 50 mg tweemaal daags is toegediend aan patiënten met licht tot matig hartfalen die meer dan 85 kg wegen.
Patiënten moeten erop worden gewezen dat het starten van de behandeling en (in mindere mate) dosisverhogingen binnen het eerste uur na toediening gepaard kunnen gaan met voorbijgaande symptomen van duizeligheid of licht gevoel in het hoofd (en zelden syncope). Tijdens deze perioden dienen patiënten situaties zoals autorijden of gevaarlijke taken te vermijden, waarbij symptomen kunnen leiden tot letsel. Vaatverwijdende symptomen vereisen vaak geen behandeling, maar het kan nuttig zijn om de dosering van COREG 6,25 mg te scheiden van die van de ACE-remmer of om de dosis van de ACE-remmer tijdelijk te verlagen. De dosis COREG 12,5 mg mag niet worden verhoogd totdat de symptomen van verergering van hartfalen of vasodilatatie zijn gestabiliseerd.
Vochtretentie (met of zonder voorbijgaande verergering van symptomen van hartfalen) moet worden behandeld door een verhoging van de dosis diuretica.
De dosis COREG moet worden verlaagd als patiënten bradycardie ervaren (hartslag lager dan 55 slagen per minuut).
Episoden van duizeligheid of vochtretentie tijdens het starten van COREG 3,12 mg kunnen over het algemeen worden behandeld zonder stopzetting van de behandeling en sluiten een daaropvolgende succesvolle titratie van of een gunstige respons op carvedilol niet uit.
Linkerventrikeldisfunctie na een myocardinfarct
DOSERING MOET GENDIVIDUALISEERD WORDEN EN GECONTROLEERD TIJDENS OP-TITRATIE. Behandeling met COREG kan worden gestart als een klinische of poliklinische patiënt en moet worden gestart nadat de patiënt hemodynamisch stabiel is en vochtretentie tot een minimum is beperkt. Het wordt aanbevolen om met COREG 3,12 mg te beginnen met 6,25 mg tweemaal daags en na 3 tot 10 dagen, op basis van verdraagbaarheid, te verhogen tot 12,5 mg tweemaal daags en vervolgens opnieuw tot de streefdosis van 25 mg tweemaal daags. Een lagere startdosering kan worden gebruikt (3,125 mg tweemaal daags) en/of de snelheid van optitratie kan worden vertraagd indien klinisch geïndiceerd (bijv. als gevolg van lage bloeddruk of hartslag, of vochtretentie). Patiënten moeten op lagere doses worden gehandhaafd als hogere doses niet worden verdragen. Het aanbevolen doseringsschema hoeft niet te worden gewijzigd bij patiënten die tijdens de acute fase van het myocardinfarct behandeld zijn met een IV of orale -blokker.
Hypertensie
DOSERING MOET GENDIVIDUALISEERD ZIJN. De aanbevolen startdosering van COREG 6,25 mg is tweemaal daags 6,25 mg. Als deze dosis wordt verdragen, moet de staande systolische druk, gemeten ongeveer 1 uur na toediening als richtlijn, worden gehandhaafd gedurende 7 tot 14 dagen, en vervolgens zo nodig worden verhoogd tot 12,5 mg tweemaal daags, op basis van de dalbloeddruk, opnieuw met staande systolische druk 1 uur na dosering als richtlijn voor tolerantie. Deze dosis moet ook gedurende 7 tot 14 dagen worden gehandhaafd en kan vervolgens naar boven worden bijgesteld tot tweemaal daags 25 mg indien dit wordt verdragen en nodig is. Het volledige antihypertensieve effect van COREG 6,25 mg wordt binnen 7 tot 14 dagen waargenomen. De totale dagelijkse dosis mag niet hoger zijn dan 50 mg.
Gelijktijdige toediening met een diureticum zal naar verwachting additieve effecten veroorzaken en de orthostatische component van carvedilol versterken.
Leverfunctiestoornis
COREG 25 mg mag niet worden gegeven aan patiënten met ernstige leverinsufficiëntie [zie CONTRA-INDICATIES ].
HOE GELEVERD
Dosering en sterke punten
De witte, ovale, filmomhulde tabletten zijn verkrijgbaar in de volgende sterktes:
- 3.125 mg – gegraveerd met “39” en “SB”
- 6,25 mg – gegraveerd met “4140” en “SB”
- 12,5 mg – gegraveerd met “4141” en “SB”
- 25 mg – gegraveerd met “4142” en “SB”
Opslag en behandeling
De witte, ovale, filmomhulde tabletten zijn verkrijgbaar in de volgende sterktes:
- 3.125 mg – gegraveerd met “39” en “SB”
- 6,25 mg – gegraveerd met “4140” en “SB”
- 12,5 mg – gegraveerd met “4141” en “SB”
- 25 mg – gegraveerd met “4142” en “SB”
De tabletten van 6,25 mg, 12,5 mg en 25 mg zijn TILTAB-tabletten.
- 3.125 mg flessen van 100: NDC 0007-4139-20
- 6,25 mg flessen van 100: NDC 0007-4140-20
- 12,5 mg flessen van 100: NDC 0007-4141-20
- 25 mg flesjes van 100: NDC 0007-4142-20
Bewaren beneden 30°C (86°F). Beschermen tegen vocht. Doseer in een strakke, lichtbestendige container.
Gefabriceerd voor: GlaxoSmithKline Research Triangle Park, NC 27709. Herzien: september 2017.
BIJWERKINGEN
Ervaring in klinische studies
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
COREG 25 mg is beoordeeld op veiligheid bij proefpersonen met hartfalen (licht, matig en ernstig), bij proefpersonen met linkerventrikeldisfunctie na een myocardinfarct en bij proefpersonen met hypertensie. Het waargenomen bijwerkingenprofiel was consistent met de farmacologie van het geneesmiddel en de gezondheidsstatus van de proefpersonen in de klinische onderzoeken. De bijwerkingen die voor elk van deze patiëntenpopulaties zijn gemeld, worden hieronder weergegeven. Uitgesloten zijn bijwerkingen die als te algemeen worden beschouwd om informatief te zijn, en bijwerkingen die redelijkerwijs niet verband houden met het gebruik van het geneesmiddel omdat ze verband hielden met de aandoening die wordt behandeld of die zeer vaak voorkomen bij de behandelde populatie. De frequenties van bijwerkingen waren over het algemeen vergelijkbaar in demografische subgroepen (mannen en vrouwen, ouderen en niet-ouderen, zwarten en niet-zwarten).
Hartfalen
COREG 12,5 mg is beoordeeld op veiligheid bij hartfalen bij meer dan 4.500 proefpersonen wereldwijd, van wie er meer dan 2.100 deelnamen aan placebogecontroleerde klinische onderzoeken. Ongeveer 60% van de totale behandelde populatie in placebogecontroleerde klinische onderzoeken ontving COREG 3,12 mg gedurende ten minste 6 maanden en 30% ontving COREG gedurende ten minste 12 maanden. In de COMET-studie werden 1.511 proefpersonen met licht tot matig hartfalen behandeld met COREG tot 5,9 jaar (gemiddeld: 4,8 jaar). Zowel in klinische onderzoeken in de VS bij licht tot matig hartfalen, waarbij COREG 3,12 mg in dagelijkse doses tot 100 mg (n = 765) werd vergeleken met placebo (n = 437), als in een multinationaal klinisch onderzoek bij ernstig hartfalen (COPERNICUS ) die COREG in dagelijkse doses tot 50 mg (n = 1.156) vergeleek met placebo (n = 1.133), de stopzettingspercentages voor bijwerkingen waren vergelijkbaar bij carvedilol en placebo-patiënten. In placebogecontroleerde klinische onderzoeken was duizeligheid de enige oorzaak van het staken van meer dan 1% en vaker voorkwamen bij carvedilol (1,3% bij carvedilol, 0,6% bij placebo in de COPERNICUS-studie).
Tabel 1 toont bijwerkingen die zijn gemeld bij proefpersonen met licht tot matig hartfalen die deelnamen aan Amerikaanse placebogecontroleerde klinische onderzoeken en met ernstig hartfalen die deelnamen aan het COPERNICUS-onderzoek. Getoond worden bijwerkingen die vaker voorkwamen bij met geneesmiddel behandelde proefpersonen dan met placebo behandelde proefpersonen met een incidentie van meer dan 3% bij proefpersonen die werden behandeld met carvedilol, ongeacht de causaliteit. De mediane blootstelling aan medicatie in het onderzoek was 6,3 maanden voor zowel carvedilol- als placebopatiënten in de onderzoeken naar licht tot matig hartfalen en 10,4 maanden in de onderzoeken met patiënten met ernstig hartfalen. Het bijwerkingenprofiel van COREG 3,12 mg dat werd waargenomen in het COMET-langetermijnonderzoek was over het algemeen vergelijkbaar met dat waargenomen in de Amerikaanse onderzoeken naar hartfalen.
Hartfalen en kortademigheid werden ook gemeld in deze onderzoeken, maar de percentages waren gelijk aan of hoger bij proefpersonen die placebo kregen.
De volgende bijwerkingen werden gemeld met een frequentie van meer dan 1% maar minder dan of gelijk aan 3% en vaker met COREG 3,12 mg in ofwel de Amerikaanse placebogecontroleerde onderzoeken bij proefpersonen met licht tot matig hartfalen of bij proefpersonen met ernstig hartfalen in de COPERNICUS-studie.
Incidentie groter dan 1% tot minder dan of gelijk aan 3%
Lichaam als geheel: Allergie, malaise, hypovolemie, koorts, beenoedeem.
Cardiovasculair: Vochtoverbelasting, orthostatische hypotensie, verergerde angina pectoris, AV-blok, hartkloppingen, hypertensie.
Centraal en perifeer zenuwstelsel: Hypesthesie, duizeligheid, paresthesie.
Gastro-intestinaal: Melena, parodontitis.
Lever en galwegen: SGPT verhoogd, SGOT verhoogd.
Metabool en voedingswaarde: Hyperurikemie, hypoglykemie, hyponatriëmie, verhoogde alkalische fosfatase, glycosurie, hypervolemie, diabetes mellitus, GGT verhoogd, gewichtsverlies, hyperkaliëmie, verhoogd creatinine.
Musculoskeletaal: Spierkrampen.
Bloedplaatjes, bloedingen en stolling: Protrombine verlaagd, purpura, trombocytopenie.
Psychiatrisch: Slaperigheid.
Reproductief, man: Impotentie.
Speciale zintuigen: Wazig zicht.
Urinewegen: Nierinsufficiëntie, albuminurie, hematurie.
Linkerventrikeldisfunctie na een myocardinfarct
COREG is beoordeeld op veiligheid bij overlevenden van een acuut myocardinfarct met linkerventrikeldisfunctie in de CAPRICORN-studie waarbij 969 proefpersonen betrokken waren die COREG 6,25 mg kregen en 980 die placebo kregen. Ongeveer 75% van de proefpersonen kreeg COREG 25 mg gedurende ten minste 6 maanden en 53% ontving COREG 12,5 mg gedurende ten minste 12 maanden. De proefpersonen werden gemiddeld 12,9 maanden en 12,8 maanden behandeld met respectievelijk COREG 12,5 mg en placebo.
De meest voorkomende bijwerkingen die werden gemeld met COREG 25 mg in de CAPRICORN-studie waren consistent met het profiel van het geneesmiddel in de Amerikaanse hartfalenstudies en de COPERNICUS-studie. De enige aanvullende bijwerkingen die in CAPRICORN bij meer dan 3% van de proefpersonen en vaker bij carvedilol werden gemeld, waren dyspneu, bloedarmoede en longoedeem. De volgende bijwerkingen werden gemeld met een frequentie van meer dan 1% maar minder dan of gelijk aan 3% en vaker met COREG: griepsyndroom, cerebrovasculair accident, perifere vasculaire aandoening, hypotonie, depressie, gastro-intestinale pijn, artritis en jicht. De totale percentages van stopzettingen als gevolg van bijwerkingen waren vergelijkbaar in beide groepen proefpersonen. In deze database was hypotensie de enige oorzaak van stopzetting van meer dan 1% en vaker voorkwam bij carvedilol (1,5% op carvedilol, 0,2% op placebo).
Hypertensie
COREG is beoordeeld op veiligheid bij hypertensie bij meer dan 2.193 proefpersonen in klinische onderzoeken in de VS en bij 2.976 proefpersonen in internationale klinische onderzoeken. Ongeveer 36% van de totale behandelde populatie kreeg COREG gedurende ten minste 6 maanden. De meeste bijwerkingen die tijdens de behandeling met COREG 25 mg werden gemeld, waren van lichte tot matige ernst. In door de VS gecontroleerde klinische onderzoeken die COREG 12,5 mg in doses tot 50 mg (n = 1142) rechtstreeks vergeleken met placebo (n = 462), stopte 4,9% van de proefpersonen die COREG 6,25 mg kregen vanwege bijwerkingen versus 5,2% van de placebo-patiënten. Hoewel er geen algemeen verschil was in stopzettingspercentages, kwamen stopzettingen vaker voor in de carvedilolgroep voor orthostatische hypotensie (1% versus 0). De totale incidentie van bijwerkingen in placebogecontroleerde onderzoeken in de VS nam toe met toenemende COREG-dosis. Voor individuele bijwerkingen kon dit alleen worden onderscheiden voor duizeligheid, die in frequentie toenam van 2% tot 5% naarmate de totale dagelijkse dosis toenam van 6,25 mg naar 50 mg.
Tabel 2 toont bijwerkingen in Amerikaanse placebogecontroleerde klinische onderzoeken voor hypertensie die optraden met een incidentie van meer dan of gelijk aan 1%, ongeacht de causaliteit en die vaker voorkwamen bij met geneesmiddelen behandelde proefpersonen dan met placebo behandelde proefpersonen.
Dyspnoe en vermoeidheid werden ook gemeld in deze onderzoeken, maar de percentages waren gelijk aan of hoger bij proefpersonen die placebo kregen.
De volgende bijwerkingen die hierboven niet zijn beschreven, werden gemeld als mogelijk of waarschijnlijk gerelateerd aan COREG 25 mg in wereldwijde open of gecontroleerde onderzoeken met COREG 12,5 mg bij personen met hypertensie of hartfalen.
Incidentie groter dan 0,1% tot minder dan of gelijk aan 1%
Cardiovasculair: Perifere ischemie, tachycardie.
Centraal en perifeer zenuwstelsel m: Hypokinesie.
Gastro-intestinaal: Bilirubinemie, verhoogde leverenzymen (0,2% van de patiënten met hypertensie en 0,4% van de patiënten met hartfalen werd stopgezet met de behandeling vanwege toename van leverenzymen) (zie Postmarketingervaring ].
Psychiatrisch: Nervositeit, slaapstoornis, verergerde depressie, verminderde concentratie, abnormaal denken, paroniria, emotionele labiliteit.
Ademhalingssysteem: Astma [zie CONTRA-INDICATIES ].
Reproductief, man: Verminderd libido.
Huid en aanhangsels: Pruritus, erythemateuze huiduitslag, maculopapulaire huiduitslag, psoriaforme huiduitslag, fotosensitiviteitsreactie.
Speciale zintuigen: Tinnitus.
Urinewegen: De mictiefrequentie nam toe.
Autonoom zenuwstelsel: Droge mond, toegenomen zweten.
Metabool en voedingswaarde: Hypokaliëmie, hypertriglyceridemie.
Hematologische: Bloedarmoede, leukopenie.
De volgende voorvallen werden gemeld bij minder dan of gelijk aan 0,1% van de proefpersonen en zijn mogelijk belangrijk: volledig AV-blok, bundeltakblok, myocardischemie, cerebrovasculaire aandoening, convulsies, migraine, neuralgie, parese, anafylactoïde reactie, alopecia, exfoliatieve dermatitis, geheugenverlies, GI-bloeding, bronchospasme, longoedeem, verminderd gehoor, respiratoire alkalose, verhoogd BUN, verlaagd HDL, pancytopenie en atypische lymfocyten.
Laboratoriumafwijkingen
Tijdens behandeling met COREG zijn omkeerbare verhogingen van serumtransaminasen (ALAT of ASAT) waargenomen. De percentages van transaminaseverhogingen (2 tot 3 keer de bovengrens van normaal) waargenomen tijdens gecontroleerde klinische onderzoeken waren over het algemeen vergelijkbaar tussen proefpersonen die werden behandeld met COREG en die behandeld met placebo. Met COREG zijn echter verhogingen van transaminase waargenomen, bevestigd door hernieuwde behandeling. In een langetermijn, placebogecontroleerd onderzoek bij ernstig hartfalen, hadden proefpersonen die werden behandeld met COREG 25 mg lagere waarden voor levertransaminasen dan proefpersonen die werden behandeld met placebo, mogelijk omdat verbeteringen in de hartfunctie veroorzaakt door COREG 6,25 mg leidden tot minder levercongestie en/of of verbeterde leverbloedstroom.
COREG 25 mg is niet in verband gebracht met klinisch significante veranderingen in serumkalium, totaal triglyceriden, totaal cholesterol, HDL-cholesterol, urinezuur, bloedureumstikstof of creatinine. Er werden geen klinisch relevante veranderingen waargenomen in nuchtere serumglucose bij hypertensieve patiënten; nuchtere serumglucose werd niet geëvalueerd in de klinische onderzoeken naar hartfalen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van COREG na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen
Aplastische bloedarmoede.
Immuunsysteemaandoeningen
Overgevoeligheid (bijv. anafylactische reacties, angio-oedeem, urticaria).
Nier- en urinewegaandoeningen
Urine-incontinentie.
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen
Interstitiële pneumonitis.
Huid- en onderhuidaandoeningen
Stevens-Johnson-syndroom, toxische epidermale necrolyse, erythema multiforme.
DRUG-INTERACTIES
CYP2D6-remmers en slechte metaboliseerders
Interacties van carvedilol met krachtige remmers van het CYP2D6-iso-enzym (zoals kinidine, fluoxetine, paroxetine en propafenon) zijn niet onderzocht, maar verwacht wordt dat deze geneesmiddelen de bloedspiegels van de R(+)-enantiomeer van carvedilol verhogen [zie KLINISCHE FARMACOLOGIE ]. Retrospectieve analyse van bijwerkingen in klinische onderzoeken toonde aan dat slechte 2D6-metaboliseerders een hogere mate van duizeligheid hadden tijdens optitratie, vermoedelijk als gevolg van vaatverwijdende effecten van de hogere concentraties van de α-blokkerende R(+)-enantiomeer.
Hypotensieve middelen
Patiënten die een -blokker gebruiken en een geneesmiddel dat catecholamines kan afbreken (bijv. reserpine en monoamineoxidaseremmers) moeten nauwlettend worden geobserveerd op tekenen van hypotensie en/of ernstige bradycardie.
Gelijktijdige toediening van clonidine met een -blokker kan hypotensie en bradycardie veroorzaken. Wanneer gelijktijdige behandeling met een -blokker en clonidine moet worden stopgezet, moet eerst de β-blokker worden gestaakt. De behandeling met clonidine kan dan enkele dagen later worden stopgezet door de dosering geleidelijk te verlagen.
Cyclosporine
Bij 21 niertransplantatiepatiënten die leden aan chronische vasculaire afstoting, werden na het starten van de behandeling met carvedilol een bescheiden stijging van de gemiddelde dalconcentraties van ciclosporine waargenomen. Bij ongeveer 30% van de proefpersonen moest de dosis ciclosporine worden verlaagd om de ciclosporineconcentraties binnen het therapeutische bereik te houden, terwijl bij de rest geen aanpassing nodig was. Gemiddeld voor de groep was de dosis ciclosporine bij deze proefpersonen met ongeveer 20% verlaagd. Vanwege de grote interindividuele variabiliteit in de vereiste dosisaanpassing, wordt aanbevolen de ciclosporineconcentraties nauwlettend te controleren na het starten van de carvediloltherapie en de dosis ciclosporine indien nodig aan te passen.
Digitalis Glycosiden
Zowel digitalisglycosiden als β-blokkers vertragen de atrioventriculaire geleiding en verlagen de hartslag. Gelijktijdig gebruik kan het risico op bradycardie verhogen. Digoxineconcentraties worden met ongeveer 15% verhoogd wanneer digoxine en carvedilol gelijktijdig worden toegediend. Daarom wordt een verhoogde controle van digoxine aanbevolen bij het starten, aanpassen of stopzetten van COREG [zie: KLINISCHE FARMACOLOGIE ].
Inductoren/remmers van levermetabolisme
Rifampicine verlaagde de plasmaconcentraties van carvedilol met ongeveer 70% [zie: KLINISCHE FARMACOLOGIE ]. Cimetidine verhoogde de AUC met ongeveer 30% maar veroorzaakte geen verandering in Cmax [zie KLINISCHE FARMACOLOGIE ].
Amiodaron
Amiodaron en zijn metaboliet desethylamiodaron, remmers van CYP2C9 en P-glycoproteïne verhoogden de concentraties van de S(-)-enantiomeer van carvedilol met minstens een factor 2 [zie KLINISCHE FARMACOLOGIE ]. De gelijktijdige toediening van amiodaron of andere CYP2C9-remmers zoals fluconazol met COREG kan de -blokkerende activiteit versterken, wat resulteert in een verdere vertraging van de hartslag of hartgeleiding. Patiënten moeten worden geobserveerd op tekenen van bradycardie of hartblok, vooral wanneer het ene middel wordt toegevoegd aan een reeds bestaande behandeling met het andere.
Calciumkanaalblokkers
Geleidingsstoornis (zelden met hemodynamisch compromis) is waargenomen bij gelijktijdige toediening van COREG 25 mg met diltiazem. Net als bij andere bètablokkers, wordt het aanbevolen om ECG en bloeddruk te controleren als COREG 25 mg wordt toegediend met calciumkanaalblokkers van het type verapamil of diltiazem.
Insuline of orale hypoglykemie
Bètablokkers kunnen het bloedsuikerverlagende effect van insuline en orale hypoglykemieën versterken. Daarom wordt bij patiënten die insuline of orale hypoglykemieën gebruiken, regelmatige controle van de bloedglucose aanbevolen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Anesthesie
Als de behandeling met COREG perioperatief moet worden voortgezet, moet bijzondere aandacht worden besteed aan het gebruik van anesthetica die de myocardiale functie onderdrukken, zoals ether, cyclopropaan en trichloorethyleen [zie OVERDOSERING ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Stopzetting van de therapie
Patiënten met coronaire hartziekte, die worden behandeld met COREG, dienen te worden geadviseerd de therapie niet abrupt te staken. Ernstige exacerbatie van angina en het optreden van myocardinfarct en ventriculaire aritmieën zijn gemeld bij patiënten met angina na abrupt staken van de behandeling met bètablokkers. De laatste 2 complicaties kunnen optreden met of zonder voorafgaande verergering van de angina pectoris. Net als bij andere -blokkers, moeten de patiënten, wanneer stopzetting van COREG gepland is, zorgvuldig worden geobserveerd en geadviseerd om lichamelijke activiteit tot een minimum te beperken. COREG moet indien mogelijk gedurende 1 tot 2 weken worden stopgezet. Als de angina verergert of zich acute coronaire insufficiëntie ontwikkelt, wordt aanbevolen om COREG onmiddellijk te hervatten, in ieder geval tijdelijk. Omdat coronaire hartziekte vaak voorkomt en mogelijk niet wordt herkend, kan het verstandig zijn om de behandeling met COREG 3,12 mg niet abrupt te staken, zelfs niet bij patiënten die alleen worden behandeld voor hypertensie of hartfalen.
Bradycardie
In klinische onderzoeken veroorzaakte COREG 25 mg bradycardie bij ongeveer 2% van de proefpersonen met hypertensie, 9% van de proefpersonen met hartfalen en 6,5% van de proefpersonen met een myocardinfarct en linkerventrikeldisfunctie. Als de hartslag onder de 55 slagen per minuut zakt, moet de dosering worden verlaagd.
Hypotensie
In klinische onderzoeken met voornamelijk licht tot matig hartfalen traden hypotensie en orthostatische hypotensie op bij 9,7% en syncope bij 3,4% van de proefpersonen die COREG kregen, vergeleken met respectievelijk 3,6% en 2,5% van de placebopatiënten. Het risico op deze voorvallen was het hoogst tijdens de eerste 30 dagen van dosering, overeenkomend met de optitratieperiode en was een reden voor stopzetting van de behandeling bij 0,7% van de proefpersonen die COREG 12,5 mg kregen, vergeleken met 0,4% van de placebopatiënten. In een langetermijn, placebogecontroleerd onderzoek bij ernstig hartfalen (COPERNICUS), traden hypotensie en orthostatische hypotensie op bij 15,1% en syncope bij 2,9% van de patiënten met hartfalen die COREG kregen, vergeleken met respectievelijk 8,7% en 2,3% van de placebopatiënten. Deze gebeurtenissen waren een reden voor stopzetting van de therapie bij 1,1% van de proefpersonen die COREG kregen, vergeleken met 0,8% van de placebo-patiënten.
Orthostatische hypotensie trad op bij 1,8% en syncope bij 0,1% van de patiënten met hypertensie, voornamelijk na de aanvangsdosis of op het moment van dosisverhoging en was een reden voor stopzetting van de behandeling bij 1% van de proefpersonen.
In de CAPRICORN-studie met overlevenden van een acuut myocardinfarct trad hypotensie of orthostatische hypotensie op bij 20,2% van de proefpersonen die COREG kregen, vergeleken met 12,6% van de placebopatiënten. Syncope werd gemeld bij respectievelijk 3,9% en 1,9% van de proefpersonen. Deze gebeurtenissen waren een reden voor stopzetting van de behandeling bij 2, 5% van de proefpersonen die COREG kregen, vergeleken met 0, 2% van de placebo-patiënten.
Beginnend met een lage dosis, toediening met voedsel en geleidelijke optitratie zou de kans op syncope of overmatige hypotensie moeten verminderen [zie DOSERING EN ADMINISTRATIE ]. Tijdens het starten van de therapie moet de patiënt worden gewaarschuwd om situaties zoals autorijden of gevaarlijke taken te vermijden, die letsel kunnen veroorzaken als syncope optreedt.
Hartfalen/vochtretentie
Verergering van hartfalen of vochtretentie kan optreden tijdens optitratie van carvedilol. Als dergelijke symptomen optreden, moeten de diuretica worden verhoogd en mag de Carvedilol-dosis niet worden verhoogd totdat de klinische stabiliteit weer is hersteld (zie DOSERING EN ADMINISTRATIE ]. Af en toe is het nodig om de Carvedilol-dosis te verlagen of tijdelijk te staken. Dergelijke episodes sluiten een latere succesvolle titratie van of een gunstige respons op carvedilol niet uit. In een placebogecontroleerd onderzoek bij proefpersonen met ernstig hartfalen werd verergering van hartfalen gedurende de eerste 3 maanden in vergelijkbare mate gemeld met carvedilol en met placebo. Wanneer de behandeling langer dan 3 maanden werd voortgezet, werd verergering van hartfalen minder vaak gemeld bij proefpersonen die werden behandeld met carvedilol dan bij placebo. Verergering van hartfalen, waargenomen tijdens langdurige therapie, is waarschijnlijker gerelateerd aan de onderliggende ziekte van de patiënt dan aan behandeling met carvedilol.
Niet-allergisch bronchospasme
Patiënten met bronchospastische aandoeningen (bijv. chronische bronchitis, emfyseem) mogen in het algemeen geen bètablokkers krijgen. COREG kan echter met voorzichtigheid worden gebruikt bij patiënten die niet reageren op andere antihypertensiva of deze niet kunnen verdragen. Als COREG wordt gebruikt, is het verstandig om de kleinste effectieve dosis te gebruiken, zodat remming van endogene of exogene -agonisten wordt geminimaliseerd.
In klinische onderzoeken met proefpersonen met hartfalen werden proefpersonen met bronchospastische ziekte opgenomen als ze geen orale of inhalatiemedicatie nodig hadden om hun bronchospastische ziekte te behandelen. Bij dergelijke patiënten wordt het gebruik van carvedilol met voorzichtigheid aanbevolen. De doseringsaanbevelingen moeten nauwgezet worden gevolgd en de dosis moet worden verlaagd als er tekenen van bronchospasme worden waargenomen tijdens optitratie.
Glycemische controle bij diabetes type 2
In het algemeen kunnen bètablokkers enkele van de manifestaties van hypoglykemie maskeren, met name tachycardie. Niet-selectieve bètablokkers kunnen door insuline geïnduceerde hypoglykemie versterken en het herstel van serumglucosespiegels vertragen. Patiënten met spontane hypoglykemie of diabetespatiënten die insuline of orale hypoglykemische middelen krijgen, dienen te worden gewaarschuwd voor deze mogelijkheden.
Bij patiënten met hartfalen en diabetes kan behandeling met carvedilol leiden tot verergering van hyperglykemie, die reageert op intensivering van hypoglykemische therapie. Het wordt aanbevolen om de bloedglucose te controleren wanneer de Carvedilol-dosering wordt gestart, aangepast of stopgezet. Er zijn geen onderzoeken uitgevoerd om de effecten van carvedilol op de glykemische controle bij patiënten met diabetes en hartfalen te onderzoeken.
In een studie die was opgezet om de effecten van carvedilol op de glykemische controle te onderzoeken bij een populatie met milde tot matige hypertensie en goed onder controle gebrachte diabetes mellitus type 2, had carvedilol geen nadelig effect op de glykemische controle, gebaseerd op HbA1c-metingen [zie Klinische studies ].
Perifere vaatziekte
Bètablokkers kunnen symptomen van arteriële insufficiëntie versnellen of verergeren bij patiënten met perifere vaatziekte. Voorzichtigheid is geboden bij dergelijke personen.
Verslechtering van de nierfunctie
In zeldzame gevallen heeft het gebruik van carvedilol bij patiënten met hartfalen geleid tot een verslechtering van de nierfunctie. Risicopatiënten blijken patiënten te zijn met een lage bloeddruk (systolische bloeddruk lager dan 100 mm Hg), ischemische hartziekte en diffuse vasculaire ziekte, en/of onderliggende nierinsufficiëntie. De nierfunctie keerde terug naar de uitgangswaarde toen Carvedilol werd stopgezet. Bij patiënten met deze risicofactoren wordt aanbevolen de nierfunctie te controleren tijdens optitratie van carvedilol en het gebruik van het geneesmiddel te staken of de dosering te verlagen als de nierfunctie verslechtert.
Zware operatie
Chronisch toegediende -blokkerende therapie mag niet routinematig worden stopgezet voorafgaand aan een grote operatie; het verminderde vermogen van het hart om te reageren op reflexadrenerge stimuli kan echter de risico's van algemene anesthesie en chirurgische procedures vergroten.
Thyrotoxicose
-adrenerge blokkade kan klinische tekenen van hyperthyreoïdie maskeren, zoals tachycardie. Plotselinge stopzetting van de β-blokkade kan worden gevolgd door een verergering van de symptomen van hyperthyreoïdie of kan een schildklierstorm veroorzaken.
feochromocytoom
Bij patiënten met feochromocytoom moet een bètablokker worden gestart voordat een bètablokker wordt gebruikt. Hoewel Carvedilol zowel α- als β-blokkerende farmacologische activiteiten heeft, is er geen ervaring met het gebruik ervan bij deze aandoening. Daarom is voorzichtigheid geboden bij de toediening van carvedilol aan patiënten die verdacht worden van feochromocytoom.
Prinzmetal's variant Angina
Middelen met niet-selectieve β-blokkerende activiteit kunnen pijn op de borst veroorzaken bij patiënten met Prinzmetal-variant angina. Er is geen klinische ervaring met Carvedilol bij deze patiënten, hoewel de -blokkerende activiteit dergelijke symptomen kan voorkomen. Voorzichtigheid is echter geboden bij de toediening van carvedilol aan patiënten die verdacht worden van Prinzmetal-variant angina.
Risico op anafylactische reactie
Tijdens het gebruik van bètablokkers kunnen patiënten met een voorgeschiedenis van ernstige anafylactische reactie op een verscheidenheid aan allergenen reactiever zijn op herhaalde blootstelling, hetzij per ongeluk, diagnostisch of therapeutisch. Dergelijke patiënten reageren mogelijk niet op de gebruikelijke doses epinefrine die worden gebruikt om allergische reacties te behandelen.
Intraoperatief Floppy Iris-syndroom
Intraoperatief Floppy Iris Syndroom (IFIS) is waargenomen tijdens cataractchirurgie bij sommige patiënten die werden behandeld met alfa-1-blokkers (COREG is een alfa/bètablokker). Deze variant van het kleine-pupilsyndroom wordt gekenmerkt door de combinatie van een slappe iris die opzwelt als reactie op intraoperatieve irrigatiestromen, progressieve intraoperatieve miosis ondanks preoperatieve dilatatie met standaard mydriatica, en mogelijke verzakking van de iris naar de phaco-emulsificatie-incisies. De oogarts van de patiënt moet voorbereid zijn op mogelijke aanpassingen aan de chirurgische techniek, zoals het gebruik van irishaken, irisdilatatieringen of visco-elastische stoffen. Het lijkt geen voordeel te hebben om te stoppen met de behandeling met alfa-1-blokkers voorafgaand aan een cataractoperatie.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Patiënten die COREG gebruiken, moeten worden geïnformeerd over het volgende:
- Patiënten dienen COREG met voedsel in te nemen.
- Patiënten mogen het gebruik van COREG 25 mg niet onderbreken of stopzetten zonder advies van een arts.
- Patiënten met hartfalen moeten hun arts raadplegen als ze tekenen of symptomen ervaren van verergering van hartfalen, zoals gewichtstoename of toenemende kortademigheid.
- Patiënten kunnen een bloeddrukdaling ervaren bij het staan, wat leidt tot duizeligheid en, in zeldzame gevallen, flauwvallen. Patiënten moeten gaan zitten of liggen wanneer deze symptomen van een verlaagde bloeddruk optreden.
- Bij duizeligheid of vermoeidheid moeten patiënten autorijden of gevaarlijke taken vermijden.
- Patiënten dienen een arts te raadplegen als ze duizeligheid of flauwvallen ervaren, voor het geval de dosering moet worden aangepast.
- Diabetespatiënten dienen elke verandering in de bloedsuikerspiegel aan hun arts te melden.
- Dragers van contactlenzen kunnen verminderde traanproductie ervaren.
COREG 25 mg, COREG 3,12 mg CR en TILTAB zijn handelsmerken die eigendom zijn van of in licentie zijn gegeven aan de GSK-bedrijvengroep.
Het andere vermelde merk is een handelsmerk dat eigendom is van of in licentie is gegeven aan de eigenaar en is geen eigendom van of in licentie gegeven aan de GSK-bedrijvengroep. De maker van dit merk is niet gelieerd aan en onderschrijft de GSK-groep van bedrijven of haar producten niet.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In 2-jarige studies uitgevoerd bij ratten die carvedilol kregen in doses tot 75 mg per kg per dag (12 maal de MRHD als mg per m2) of bij muizen die tot 200 mg per kg per dag (16 maal de MRHD als mg per dag) kregen. m2), carvedilol had geen kankerverwekkend effect.
Carvedilol was negatief wanneer het werd getest in een reeks genotoxiciteitstests, waaronder de Ames- en de CHO/HGPRT-tests voor mutageniteit en de in vitro hamstermicronucleus- en in vivo humane lymfocytceltests voor clastogeniteit.
In een gecombineerd onderzoek naar vruchtbaarheid/ontwikkeling/postnatale toxiciteit kregen ratten gedurende 2 weken vóór het paren en door paren, dracht en spenen Carvedilol (12, 60, 300 mg per kg per dag) oraal via een sonde en gedurende 62 weken. dagen voorafgaand aan en door de paring voor mannen. Bij een dosering van 300 mg per kg per dag (groter dan of gelijk aan 50 maal de MRHD als mg per m2) was carvedilol toxisch voor volwassen ratten (sedatie, verminderde gewichtstoename) en werd geassocieerd met een verminderd aantal succesvolle paringen, langdurige paartijd, minder corpora lutea en implantaten per moederdier, minder levende pups per nest en vertragingen in fysieke groei/ontwikkeling. Het niveau zonder effect voor openlijke toxiciteit en verminderde vruchtbaarheid was 60 mg per kg per dag (10 maal de MRHD als mg per m2).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens over het gebruik van COREG 12,5 mg bij zwangere vrouwen zijn onvoldoende om te bepalen of er geneesmiddelgerelateerde risico's zijn op nadelige ontwikkelingsresultaten. Er zijn risico's voor de moeder en de foetus verbonden aan slecht gecontroleerde hypertensie tijdens de zwangerschap. Het gebruik van bètablokkers tijdens het derde trimester van de zwangerschap kan het risico op hypotensie, bradycardie, hypoglykemie en ademhalingsdepressie bij de pasgeborene verhogen [ zie Klinische overwegingen ]. In reproductiestudies bij dieren waren er geen aanwijzingen voor nadelige ontwikkelingsresultaten bij klinisch relevante doses [ zie gegevens ]. Orale toediening van carvedilol aan zwangere ratten tijdens de organogenese resulteerde in post-implantatieverlies, verminderd foetaal lichaamsgewicht en een verhoogde frequentie van vertraagde foetale skeletontwikkeling bij maternale toxische doses die 50 maal de maximaal aanbevolen dosis voor de mens (MRHD) waren. Bovendien resulteerde orale toediening van carvedilol aan drachtige konijnen tijdens de organogenese in verhoogd post-implantatieverlies bij doses van 25 keer de MRHD [ zie gegevens ].
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en complicaties bij de bevalling (bijvoorbeeld een keizersnede en postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Pasgeborenen van vrouwen met hypertensie die tijdens het derde trimester van de zwangerschap met bètablokkers worden behandeld, lopen mogelijk een verhoogd risico op hypotensie, bradycardie, hypoglykemie en ademhalingsdepressie. Observeer pasgeborenen op symptomen van hypotensie, bradycardie, hypoglykemie en ademhalingsdepressie en behandel dienovereenkomstig.
Gegevens
Dierlijke gegevens
Studies uitgevoerd bij ratten en konijnen die carvedilol kregen tijdens de foetale organogenese lieten een verhoogd post-implantatieverlies zien bij ratten bij een maternale toxische dosis van 300 mg per kg per dag (50 maal de MRHD als mg per m2) en bij konijnen (in afwezigheid van maternale toxiciteit) bij doses van 75 mg per kg per dag (25 maal de MRHD als mg per m2). Bij de ratten was er ook een afname van het foetale lichaamsgewicht bij 300 mg per kg per dag (50 keer de MRHD als mg per m2) gepaard gaand met een verhoogde incidentie van foetussen met vertraagde skeletontwikkeling. Bij ratten was het niveau zonder effect voor embryofoetale toxiciteit 60 mg per kg per dag (10 maal de MRHD als mg per m2); bij konijnen was dit 15 mg per kg per dag (5 maal de MRHD als mg per m2). In een pre- en postnatale ontwikkelingsstudie bij ratten die carvedilol kregen toegediend vanaf de late dracht tot aan de lactatie, werd een verhoogde embryo-letaliteit waargenomen bij een maternale toxische dosis van 200 mg per kg per dag (ongeveer 32 maal de MRHD als mg per m2), en sterfte van jongen en vertragingen in fysieke groei/ontwikkeling werden waargenomen bij 60 mg per kg per dag (10 maal de MRHD als mg per m2) in afwezigheid van maternale toxiciteit. De no-effect level was 12 mg per kg per dag (2 maal de MRHD als mg per m2). Carvedilol was aanwezig in foetaal rattenweefsel.
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens over de aanwezigheid van carvedilol in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Carvedilol is aanwezig in de melk van zogende ratten. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan COREG en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van COREG 3,12 mg of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De effectiviteit van COREG 3,12 mg bij patiënten jonger dan 18 jaar is niet vastgesteld.
In een dubbelblind onderzoek werden 161 kinderen (gemiddelde leeftijd: 6 jaar; bereik: 2 maanden tot 17 jaar; 45% jonger dan 2 jaar) met chronisch hartfalen [NYHA klasse II-IV, linkerventrikelejectiefractie minder dan 40% voor kinderen met een systemische linker ventrikel (LV), en matig-ernstige ventriculaire disfunctie kwalitatief door echo voor die met een systemische ventrikel die geen LV was] die standaard achtergrondbehandeling kregen, werden gerandomiseerd naar placebo of naar 2 dosisniveaus Carvedilol. Deze dosisniveaus produceerden een placebogecorrigeerde hartslagverlaging van 4 tot 6 hartslagen per minuut, wat een indicatie is van -blokkade-activiteit. Blootstelling bleek lager te zijn bij pediatrische proefpersonen dan bij volwassenen. Na 8 maanden follow-up was er geen significant effect van de behandeling op de klinische resultaten. Bijwerkingen in deze studie die voorkwamen bij meer dan 10% van de met COREG behandelde proefpersonen en bij tweemaal het percentage van met placebo behandelde proefpersonen waren pijn op de borst (17% versus 6%), duizeligheid (13% versus 2%) en dyspneu ( 11% versus 0%).
Geriatrisch gebruik
Van de 765 proefpersonen met hartfalen gerandomiseerd naar COREG 6,25 mg in klinische onderzoeken in de VS, was 31% (235) 65 jaar of ouder en 7,3% (56) 75 jaar of ouder. Van de 1.156 proefpersonen die waren gerandomiseerd naar COREG 3,12 mg in een langdurige, placebogecontroleerde studie bij ernstig hartfalen, was 47% (547) 65 jaar of ouder en 15% (174) was 75 jaar of ouder. Van de 3.025 proefpersonen die COREG 6,25 mg kregen in onderzoeken naar hartfalen wereldwijd, was 42% 65 jaar of ouder.
Van de 975 proefpersonen met een myocardinfarct gerandomiseerd naar COREG in de CAPRICORN-studie, was 48% (468) 65 jaar of ouder en 11% (111) 75 jaar of ouder.
Van de 2.065 hypertensieve proefpersonen in Amerikaanse klinische onderzoeken naar werkzaamheid of veiligheid die werden behandeld met COREG 25 mg, was 21% (436) 65 jaar of ouder. Van de 3.722 proefpersonen die COREG kregen in klinische onderzoeken naar hypertensie die wereldwijd werden uitgevoerd, was 24% 65 jaar of ouder.
Met uitzondering van duizeligheid bij hypertensieve proefpersonen (incidentie 8,8% bij ouderen versus 6% bij jongere proefpersonen), werden er geen algemene verschillen in veiligheid of werkzaamheid waargenomen (zie afbeeldingen 2 en 4) tussen de oudere proefpersonen en jongere proefpersonen in elk van de deze populaties. Evenzo hebben andere gerapporteerde klinische ervaringen geen verschillen in respons tussen ouderen en jongere proefpersonen aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
OVERDOSERING
Overdosering kan ernstige hypotensie, bradycardie, hartinsufficiëntie, cardiogene shock en hartstilstand veroorzaken. Ademhalingsproblemen, bronchospasmen, braken, bewustzijnsverlies en gegeneraliseerde aanvallen kunnen ook voorkomen.
De patiënt moet in rugligging worden gelegd en, waar nodig, onder observatie worden gehouden en op de intensive care worden behandeld. De volgende middelen kunnen worden toegediend:
Voor overmatige bradycardie : Atropine, 2 mg IV.
Ter ondersteuning van de cardiovasculaire functie glucagon, 5 tot 10 mg IV snel gedurende 30 seconden, gevolgd door een continue infusie van 5 mg per uur; sympathicomimetica (dobutamine, isoprenaline, adrenaline) in doseringen volgens lichaamsgewicht en effect.
Als perifere vasodilatatie domineert, kan het nodig zijn adrenaline of noradrenaline toe te dienen met continue controle van de bloedsomloop. Voor therapieresistente bradycardie moet pacemakertherapie worden uitgevoerd. Voor bronchospasmen moeten β-sympathicomimetica (als aerosol of IV) of aminofylline IV worden gegeven. In het geval van epileptische aanvallen wordt een langzame IV-injectie van diazepam of clonazepam aanbevolen.
OPMERKING: In het geval van ernstige intoxicatie met symptomen van shock, moet de behandeling met antidota worden voortgezet gedurende een voldoende lange periode die overeenkomt met de halfwaardetijd van 7 tot 10 uur van carvedilol.
Gevallen van overdosering met COREG 3,12 mg alleen of in combinatie met andere geneesmiddelen zijn gemeld. De ingenomen hoeveelheden waren in sommige gevallen groter dan 1.000 milligram. Symptomen die werden ervaren waren onder meer lage bloeddruk en hartslag. Standaard ondersteunende behandeling werd gegeven en individuen herstelden.
CONTRA-INDICATIES
COREG 25 mg is gecontra-indiceerd bij de volgende aandoeningen:
- Bronchiale astma of gerelateerde bronchospastische aandoeningen. Sterfgevallen door status astmaticus zijn gemeld na enkelvoudige doses COREG.
- Tweede- of derdegraads AV-blok.
- Ziek sinus syndroom.
- Ernstige bradycardie (tenzij er een permanente pacemaker is aangebracht).
- Patiënten met cardiogene shock of die gedecompenseerd hartfalen hebben die het gebruik van intraveneuze inotrope therapie nodig hebben. Dergelijke patiënten moeten eerst worden gespeend van intraveneuze therapie voordat met COREG wordt begonnen.
- Patiënten met ernstige leverinsufficiëntie.
- Patiënten met een voorgeschiedenis van een ernstige overgevoeligheidsreactie (bijv. Stevens-Johnson-syndroom, anafylactische reactie, angio-oedeem) op een bestanddeel van dit geneesmiddel of op andere geneesmiddelen die carvedilol bevatten.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
COREG 3,12 mg is een racemisch mengsel waarin niet-selectieve β-adrenoreceptorblokkerende activiteit aanwezig is in de S(-)-enantiomeer en α1-adrenerge blokkerende activiteit aanwezig is in zowel R(+)- als S(-)-enantiomeren met een gelijke potentie. COREG 6,25 mg heeft geen intrinsieke sympathicomimetische activiteit.
farmacodynamiek
Hartfalen
De basis voor de gunstige effecten van COREG bij hartfalen is niet vastgesteld.
Twee placebogecontroleerde onderzoeken vergeleken de acute hemodynamische effecten van COREG met basislijnmetingen bij 59 en 49 proefpersonen met NYHA klasse II-IV hartfalen die diuretica, ACE-remmers en digitalis kregen. Er waren significante verlagingen van de systemische bloeddruk, pulmonale arteriële druk, pulmonale capillaire wiggedruk en hartslag. De initiële effecten op het hartminuutvolume, de slagvolume-index en de systemische vaatweerstand waren klein en variabel.
In deze onderzoeken werden hemodynamische effecten opnieuw gemeten na 12 tot 14 weken. COREG 25 mg verminderde significant de systemische bloeddruk, pulmonale arteriedruk, rechter atriumdruk, systemische vasculaire weerstand en hartslag, terwijl de slagvolume-index werd verhoogd.
Van de 839 proefpersonen met hartfalen van NYHA klasse II-III die gedurende 26 tot 52 weken werden behandeld in 4 placebogecontroleerde onderzoeken in de VS, nam de gemiddelde linkerventrikelejectiefractie (EF) gemeten met radionuclideventriculografie toe met 9 EF-eenheden (%) bij proefpersonen die COREG 6,25 kregen mg en met 2 EF-eenheden bij placebopatiënten bij een streefdosis van 25 tot 50 mg tweemaal daags. De effecten van carvedilol op de ejectiefractie waren gerelateerd aan de dosis. Doses van 6,25 mg tweemaal daags, 12,5 mg tweemaal daags en 25 mg tweemaal daags werden geassocieerd met placebogecorrigeerde verhogingen in EF van respectievelijk 5 EF-eenheden, 6 EF-eenheden en 8 EF-eenheden; elk van deze effecten was nominaal statistisch significant.
Linkerventrikeldisfunctie na een myocardinfarct
De basis voor de gunstige effecten van COREG 25 mg bij patiënten met linkerventrikeldisfunctie na een acuut myocardinfarct is niet vastgesteld.
Hypertensie
Het mechanisme waardoor -blokkade een antihypertensief effect veroorzaakt, is niet vastgesteld.
-adrenoreceptorblokkerende activiteit is aangetoond in dier- en mensstudies, waaruit blijkt dat carvedilol (1) het hartminuutvolume bij normale proefpersonen vermindert, (2) inspannings- en/of isoproterenol-geïnduceerde tachycardie vermindert en (3) orthostatische reflextachycardie vermindert. Een significant -adrenoreceptorblokkerend effect wordt gewoonlijk waargenomen binnen 1 uur na toediening van het geneesmiddel.
1-adrenoreceptorblokkerende activiteit is aangetoond in studies bij mensen en dieren, waaruit blijkt dat carvedilol (1) de pressoreffecten van fenylefrine afzwakt, (2) vasodilatatie veroorzaakt en (3) de perifere vaatweerstand vermindert. Deze effecten dragen bij aan de verlaging van de bloeddruk en worden gewoonlijk binnen 30 minuten na toediening van het geneesmiddel waargenomen.
Door de α1-receptorblokkerende activiteit van carvedilol wordt de bloeddruk meer verlaagd in staande dan in rugligging, en kunnen symptomen van orthostatische hypotensie (1,8%) optreden, waaronder zeldzame gevallen van syncope. Na orale toediening, wanneer orthostatische hypotensie is opgetreden, was deze van voorbijgaande aard en komt het soms voor wanneer COREG wordt toegediend met voedsel in de aanbevolen startdosis en titratiestappen nauwkeurig worden gevolgd [zie DOSERING EN ADMINISTRATIE ].
Bij hypertensieve patiënten met een normale nierfunctie verminderden therapeutische doses COREG de renale vasculaire weerstand zonder verandering in glomerulaire filtratiesnelheid of renale plasmastroom. Veranderingen in de uitscheiding van natrium, kalium, urinezuur en fosfor bij hypertensieve patiënten met een normale nierfunctie waren vergelijkbaar na COREG en placebo.
COREG 3,12 mg heeft weinig effect op plasmacatecholamines, plasma-aldosteron of elektrolytspiegels, maar het vermindert de plasmarenine-activiteit aanzienlijk wanneer het gedurende ten minste 4 weken wordt gegeven. Het verhoogt ook de niveaus van atriale natriuretische peptide.
Farmacokinetiek
COREG wordt snel en uitgebreid geabsorbeerd na orale toediening, met een absolute biologische beschikbaarheid van ongeveer 25% tot 35% als gevolg van een significante mate van first-pass metabolisme. Na orale toediening varieert de schijnbare gemiddelde terminale eliminatiehalfwaardetijd van carvedilol in het algemeen van 7 tot 10 uur. De bereikte plasmaconcentraties zijn evenredig met de toegediende orale dosis. Bij toediening met voedsel wordt de absorptiesnelheid vertraagd, zoals blijkt uit een vertraging in de tijd om piekplasmaspiegels te bereiken, zonder significant verschil in mate van biologische beschikbaarheid. Inname van COREG met voedsel zou het risico op orthostatische hypotensie moeten minimaliseren.
Carvedilol wordt uitgebreid gemetaboliseerd. Na orale toediening van radioactief gelabeld carvedilol aan gezonde vrijwilligers, was carvedilol slechts verantwoordelijk voor ongeveer 7% van de totale radioactiviteit in plasma, gemeten aan de hand van de oppervlakte onder de curve (AUC). Minder dan 2% van de dosis werd onveranderd in de urine uitgescheiden. Carvedilol wordt voornamelijk gemetaboliseerd door oxidatie van aromatische ringen en glucuronidering.
De oxidatieve metabolieten worden verder gemetaboliseerd door conjugatie via glucuronidering en sulfatering. De metabolieten van carvedilol worden voornamelijk via de gal uitgescheiden in de feces. Demethylering en hydroxylering aan de fenolring produceren 3 actieve metabolieten met β-receptorblokkerende activiteit. Op basis van preklinische onderzoeken is de 4'-hydroxyfenylmetaboliet ongeveer 13 keer krachtiger dan carvedilol voor -blokkade.
Vergeleken met carvedilol vertonen de 3 actieve metabolieten een zwakke vaatverwijdende activiteit. Plasmaconcentraties van de actieve metabolieten zijn ongeveer een tiende van die waargenomen voor carvedilol en hebben een farmacokinetiek die vergelijkbaar is met die van de ouder.
Carvedilol ondergaat stereoselectief first-pass-metabolisme met plasmaspiegels van R(+)-carvedilol die ongeveer 2 tot 3 keer hoger zijn dan die van S(-)-carvedilol na orale toediening aan gezonde proefpersonen. De gemiddelde schijnbare terminale eliminatiehalfwaardetijden voor R(+)-carvedilol variëren van 5 tot 9 uur, vergeleken met 7 tot 11 uur voor de S(-)-enantiomeer.
De primaire P450-enzymen die verantwoordelijk zijn voor het metabolisme van zowel R(+) als S(-)-carvedilol in humane levermicrosomen waren CYP2D6 en CYP2C9 en in mindere mate CYP3A4, 2C19, 1A2 en 2E1. Aangenomen wordt dat CYP2D6 het belangrijkste enzym is in de 4'- en 5'-hydroxylering van carvedilol, met een mogelijke bijdrage van 3A4. Aangenomen wordt dat CYP2C9 van primair belang is in de O-methyleringsroute van S(-)-carvedilol.
Carvedilol is onderhevig aan de effecten van genetisch polymorfisme met slechte metaboliseerders van puinoquin (een marker voor cytochroom P450 2D6) die 2 tot 3 keer hogere plasmaconcentraties van R(+)-carvedilol vertonen in vergelijking met snelle metaboliseerders. Daarentegen zijn plasmaspiegels van S(-)-carvedilol slechts met ongeveer 20% tot 25% verhoogd bij trage metaboliseerders, wat aangeeft dat dit enantiomeer in mindere mate wordt gemetaboliseerd door cytochroom P450 2D6 dan R(+)-carvedilol. De farmacokinetiek van carvedilol lijkt niet anders te zijn bij trage metaboliseerders van S-mefenytoïne (patiënten met een tekort aan cytochroom P450 2C19).
Carvedilol is voor meer dan 98% gebonden aan plasma-eiwitten, voornamelijk met albumine. De plasma-eiwitbinding is binnen het therapeutische bereik onafhankelijk van de concentratie. Carvedilol is een basische, lipofiele verbinding met een steady-state distributievolume van ongeveer 115 l, wat wijst op een substantiële distributie in extravasculaire weefsels. De plasmaklaring varieert van 500 tot 700 ml/min.
Specifieke populaties
Hartfalen
Steady-state plasmaconcentraties van carvedilol en zijn enantiomeren stegen proportioneel over het dosisbereik van 6,25 tot 50 mg bij personen met hartfalen. In vergelijking met gezonde proefpersonen hadden proefpersonen met hartfalen verhoogde gemiddelde AUC- en Cmax-waarden voor carvedilol en zijn enantiomeren, waarbij tot 50% tot 100% hogere waarden werden waargenomen bij 6 proefpersonen met NYHA klasse IV hartfalen. De gemiddelde schijnbare terminale eliminatiehalfwaardetijd voor carvedilol was vergelijkbaar met die waargenomen bij gezonde proefpersonen.
geriatrische
De plasmaspiegels van carvedilol zijn gemiddeld ongeveer 50% hoger bij ouderen dan bij jonge proefpersonen. Leverfunctiestoornis In vergelijking met gezonde proefpersonen vertonen patiënten met een ernstige leverfunctiestoornis (cirrose) een 4- tot 7-voudige toename van Carvedilol-spiegels. Carvedilol is gecontra-indiceerd bij patiënten met een ernstige leverfunctiestoornis.
Nierfunctiestoornis
Hoewel carvedilol voornamelijk door de lever wordt gemetaboliseerd, is gemeld dat de plasmaconcentraties van carvedilol verhoogd zijn bij patiënten met een nierfunctiestoornis. Op basis van gemiddelde AUC-gegevens werden ongeveer 40% tot 50% hogere plasmaconcentraties van carvedilol waargenomen bij proefpersonen met hypertensie en matige tot ernstige nierfunctiestoornis in vergelijking met een controlegroep van proefpersonen met hypertensie en een normale nierfunctie. Het bereik van de AUC-waarden was echter vergelijkbaar voor beide groepen. Veranderingen in de gemiddelde piekplasmaspiegels waren minder uitgesproken, ongeveer 12% tot 26% hoger bij personen met een verminderde nierfunctie.
In overeenstemming met zijn hoge mate van plasma-eiwitbinding, lijkt carvedilol niet significant te worden geklaard door hemodialyse.
Geneesmiddel-geneesmiddelinteracties
Aangezien carvedilol een aanzienlijk oxidatief metabolisme ondergaat, kunnen het metabolisme en de farmacokinetiek van carvedilol worden beïnvloed door inductie of remming van cytochroom P450-enzymen.
Amiodaron
In een farmacokinetisch onderzoek uitgevoerd bij 106 Japanse proefpersonen met hartfalen, resulteerde gelijktijdige toediening van kleine oplaad- en onderhoudsdoses amiodaron met carvedilol in een ten minste 2-voudige verhoging van de steady-state dalconcentraties van S(-)-carvedilol [zie DRUG-INTERACTIES ].
cimetidine
In een farmacokinetisch onderzoek bij 10 gezonde mannelijke proefpersonen verhoogde cimetidine (1.000 mg per dag) de steady-state AUC van carvedilol met 30% zonder verandering in Cmax [zie DRUG-INTERACTIES ].
Digoxine
Na gelijktijdige toediening van carvedilol (25 mg eenmaal daags) en digoxine (0,25 mg eenmaal daags) gedurende 14 dagen, waren de steady-state AUC en dalconcentraties van digoxine verhoogd met respectievelijk 14% en 16% bij 12 proefpersonen met hypertensie [zie DRUG-INTERACTIES ].
Glyburide
Bij 12 gezonde proefpersonen resulteerde de gecombineerde toediening van carvedilol (25 mg eenmaal daags) en een enkele dosis glyburide niet in een klinisch relevante farmacokinetische interactie voor beide verbindingen.
Hydrochloorthiazide
Een enkelvoudige orale dosis Carvedilol 25 mg veranderde de farmacokinetiek van een enkelvoudige orale dosis hydrochloorthiazide 25 mg niet bij 12 proefpersonen met hypertensie. Evenzo had hydrochloorthiazide geen effect op de farmacokinetiek van carvedilol.
rifampicijn
In een farmacokinetisch onderzoek uitgevoerd bij 8 gezonde mannelijke proefpersonen, verlaagde rifampicine (600 mg per dag gedurende 12 dagen) de AUC en Cmax van carvedilol met ongeveer 70% [zie DRUG-INTERACTIES ].
torsemide
In een onderzoek met 12 gezonde proefpersonen leidde de gecombineerde orale toediening van carvedilol 25 mg eenmaal daags en torsemide 5 mg eenmaal daags gedurende 5 dagen niet tot significante verschillen in hun farmacokinetiek in vergelijking met toediening van de geneesmiddelen alleen.
Warfarine
Carvedilol (12,5 mg tweemaal daags) had geen effect op de steady-state protrombinetijdverhoudingen en veranderde de farmacokinetiek van R(+)- en S(-)-warfarine niet na gelijktijdige toediening met warfarine bij 9 gezonde vrijwilligers.
Klinische studies
Hartfalen
In placebogecontroleerde onderzoeken met carvedilol werden in totaal 6.975 proefpersonen met licht tot ernstig hartfalen geëvalueerd.
Licht tot matig hartfalen
Carvedilol werd onderzocht in 5 multicenter, placebogecontroleerde onderzoeken en in 1 actief gecontroleerd onderzoek (COMET-onderzoek) met proefpersonen met licht tot matig hartfalen.
Vier Amerikaanse multicenter, dubbelblinde, placebogecontroleerde onderzoeken namen 1.094 proefpersonen op (696 gerandomiseerd naar carvedilol) met NYHA klasse II-III hartfalen en een ejectiefractie kleiner dan of gelijk aan 0,35. De overgrote meerderheid gebruikte digitalis, diuretica en een ACE-remmer bij aanvang van het onderzoek. Patiënten werden toegewezen aan de proeven op basis van inspanningsvermogen. Aan een dubbelblind, placebogecontroleerd onderzoek tussen Australië en Nieuw-Zeeland namen 415 proefpersonen deel (de helft gerandomiseerd naar carvedilol) met minder ernstig hartfalen. Alle protocollen waren exclusief proefpersonen die naar verwachting een harttransplantatie zouden ondergaan tijdens de 7,5 tot 15 maanden dubbelblinde follow-up. Alle gerandomiseerde proefpersonen hadden een kuur van 2 weken met carvedilol 6,25 mg tweemaal daags verdragen.
In elke studie was er een primair eindpunt, ofwel progressie van hartfalen (1 Amerikaanse studie) of inspanningstolerantie (2 Amerikaanse studies die voldeden aan de inschrijvingsdoelen en de Australië-Nieuw-Zeeland studie). Er waren veel secundaire eindpunten gespecificeerd in deze onderzoeken, waaronder NYHA-classificatie, globale beoordelingen van patiënten en artsen en cardiovasculaire ziekenhuisopname. Andere analyses die niet prospectief gepland waren, omvatten de som van sterfgevallen en totale cardiovasculaire ziekenhuisopnames. In situaties waarin de primaire eindpunten van een onderzoek geen significant voordeel van de behandeling laten zien, is het toekennen van significantiewaarden aan de andere resultaten complex, en dergelijke waarden moeten voorzichtig worden geïnterpreteerd.
De resultaten van de onderzoeken in de VS en Australië en Nieuw-Zeeland waren als volgt:
Vertraging van de progressie van hartfalen
Een multicenter onderzoek in de VS (366 proefpersonen) had als primair eindpunt de som van cardiovasculaire mortaliteit, cardiovasculaire ziekenhuisopname en aanhoudende toename van medicatie voor hartfalen. De progressie van hartfalen was gedurende een gemiddelde follow-up van 7 maanden met 48% verminderd (P = 0,008).
In de proef tussen Australië en Nieuw-Zeeland werden de sterfte en het totale aantal ziekenhuisopnames in 18 tot 24 maanden met ongeveer 25% verminderd. In de 3 grootste Amerikaanse onderzoeken werden sterfte en totale ziekenhuisopnames verminderd met 19%, 39% en 49%, nominaal statistisch significant in de laatste 2 onderzoeken. De resultaten tussen Australië en Nieuw-Zeeland waren statistisch op het randje.
Functionele maatregelen
Geen van de multicenter-onderzoeken had de NYHA-classificatie als primair eindpunt, maar al dergelijke onderzoeken hadden het als secundair eindpunt. Er was op zijn minst een trend in de richting van verbetering in de NYHA-klasse in alle onderzoeken. Inspanningstolerantie was het primaire eindpunt in 3 onderzoeken; in geen enkele werd een statistisch significant effect gevonden.
Subjectieve maatregelen
De gezondheidsgerelateerde kwaliteit van leven, gemeten met een standaardvragenlijst (een primair eindpunt in 1 onderzoek), werd niet beïnvloed door carvedilol. De globale beoordelingen van patiënten en onderzoekers lieten echter in de meeste onderzoeken een significante verbetering zien.
Sterfte
De dood was in geen enkele studie een vooraf gespecificeerd eindpunt, maar werd in alle studies geanalyseerd. Over het algemeen was in deze 4 Amerikaanse onderzoeken de mortaliteit verminderd, nominaal significant in 2 onderzoeken.
Het COMET-proces
In deze dubbelblinde studie werden 3.029 proefpersonen met NYHA klasse II-IV hartfalen (linkerventrikelejectiefractie kleiner dan of gelijk aan 35%) gerandomiseerd om ofwel carvedilol (streefdosis: 25 mg tweemaal daags) of metoprolol met onmiddellijke afgifte te krijgen. tartraat (streefdosis: 50 mg tweemaal daags). De gemiddelde leeftijd van de proefpersonen was ongeveer 62 jaar, 80% was man en de gemiddelde linkerventrikelejectiefractie bij baseline was 26%. Ongeveer 96% van de proefpersonen had NYHA klasse II of III hartfalen. Gelijktijdige behandeling omvatte diuretica (99%), ACE-remmers (91%), digitalis (59%), aldosteronantagonisten (11%) en "statine" lipidenverlagende middelen (21%). De gemiddelde duur van de follow-up was 4,8 jaar. De gemiddelde dosis carvedilol was 42 mg per dag.
De studie had 2 primaire eindpunten: mortaliteit door alle oorzaken en de samenstelling van overlijden plus ziekenhuisopname om welke reden dan ook. De resultaten van COMET zijn weergegeven in tabel 3 hieronder. Mortaliteit door alle oorzaken droeg het grootste deel van het statistische gewicht en was de belangrijkste bepalende factor voor de grootte van het onderzoek. De mortaliteit door alle oorzaken was 34% bij de proefpersonen die werden behandeld met carvedilol en 40% in de groep met metoprolol met onmiddellijke afgifte (P = 0,0017; hazard ratio = 0,83, 95% BI: 0,74 tot 0,93). Het effect op de mortaliteit was voornamelijk te wijten aan een vermindering van cardiovasculaire sterfte. Het verschil tussen de 2 groepen met betrekking tot het samengestelde eindpunt was niet significant (P = 0,122). De geschatte gemiddelde overleving was 8,0 jaar met carvedilol en 6,6 jaar met metoprolol met directe afgifte.
Het is niet bekend of deze formulering van metoprolol in welke dosis dan ook of deze lage dosis metoprolol in welke formulering dan ook enig effect heeft op de overleving of ziekenhuisopname bij patiënten met hartfalen. Dit onderzoek verlengt dus de tijd waarin carvedilol voordelen vertoont op overleving bij hartfalen, maar het is geen bewijs dat carvedilol de uitkomst verbetert ten opzichte van de formulering van metoprolol (TOPROL-XL) met voordelen bij hartfalen.
Ernstig hartfalen (COPERNICUS)
In een dubbelblind onderzoek (COPERNICUS) waren 2.289 proefpersonen met hartfalen in rust of met minimale inspanning en linkerventrikelejectiefractie minder dan 25% (gemiddeld 20%), ondanks digitalis (66%), diuretica (99%) en ACE-remmers (89%), werden gerandomiseerd naar placebo of carvedilol. Carvedilol werd getitreerd van een startdosis van 3,125 mg tweemaal daags tot de maximaal verdraagbare dosis of tot 25 mg tweemaal daags gedurende een periode van minimaal 6 weken. De meeste proefpersonen bereikten de streefdosis van 25 mg. De proef werd uitgevoerd in Oost- en West-Europa, de Verenigde Staten, Israël en Canada. Gelijkaardige aantallen proefpersonen per groep (ongeveer 100) trokken zich terug tijdens de titratieperiode.
Het primaire eindpunt van de studie was mortaliteit door alle oorzaken, maar ook de oorzaak-specifieke mortaliteit en het risico op overlijden of ziekenhuisopname (totaal, cardiovasculair [CV] of hartfalen [HF]) werden onderzocht. De zich ontwikkelende onderzoeksgegevens werden gevolgd door een datamonitoringcommissie en sterfteanalyses werden aangepast voor deze meerdere looks. De studie werd stopgezet na een mediane follow-up van 10 maanden vanwege een waargenomen vermindering van de mortaliteit met 35% (van 19,7% per patiëntjaar op placebo tot 12,8% op carvedilol; hazard ratio 0,65, 95% BI: 0,52 tot 0,81, P = 0,0014, aangepast) (zie figuur 1). De resultaten van COPERNICUS worden weergegeven in Tabel 4.
Figuur 1. Overlevingsanalyse voor COPERNICUS (Intent-to-Treat) 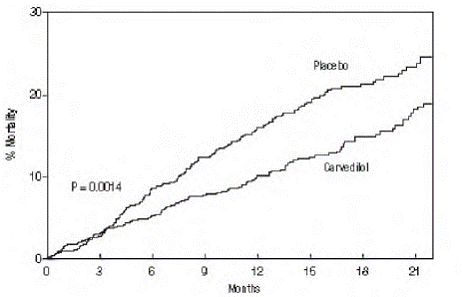
Het effect op de mortaliteit was voornamelijk het resultaat van een verlaging van het aantal gevallen van plotselinge dood bij proefpersonen zonder verergering van hartfalen.
De globale beoordelingen van de patiënten, waarbij met carvedilol behandelde proefpersonen werden vergeleken met placebo, waren gebaseerd op vooraf gespecificeerde, periodieke zelfbeoordelingen van de patiënt met betrekking tot de vraag of de klinische status na de behandeling verbetering, verslechtering of geen verandering vertoonde in vergelijking met baseline. Proefpersonen die werden behandeld met carvedilol vertoonden significante verbeteringen in globale beoordelingen in vergelijking met degenen die behandeld werden met placebo in COPERNICUS.
In het protocol stond ook dat ziekenhuisopnames beoordeeld zouden worden. Minder proefpersonen op COREG 6,25 mg dan op placebo werden om welke reden dan ook gehospitaliseerd (372 versus 432, P = 0,0029), om cardiovasculaire redenen (246 versus 314, P = 0,0003) of voor verergering van hartfalen (198 versus 268, P = 0,0001 ).
COREG 6,25 mg had een consistent en gunstig effect op mortaliteit door alle oorzaken, evenals op de gecombineerde eindpunten van mortaliteit door alle oorzaken plus ziekenhuisopname (totaal, CV of voor hartfalen) in de totale onderzoekspopulatie en in alle onderzochte subgroepen, inclusief mannen en vrouwen, ouderen en niet-bejaarden, zwarten en niet-zwarten, en diabetici en niet-diabetici (zie figuur 2).
Figuur 2. Effecten op sterfte voor subgroepen in COPERNICUS 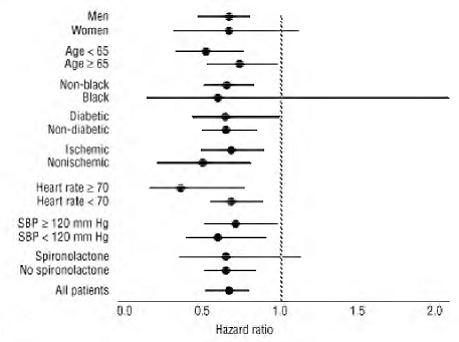
Linkerventrikeldisfunctie na een myocardinfarct
CAPRICORN was een dubbelblind onderzoek waarin carvedilol en placebo werden vergeleken bij 1.959 proefpersonen met een recent myocardinfarct (binnen 21 dagen) en een linkerventrikelejectiefractie van minder dan of gelijk aan 40%, met (47%) of zonder symptomen van hartfalen. Proefpersonen die carvedilol kregen, kregen tweemaal daags 6,25 mg, getitreerd zoals getolereerd tot tweemaal daags 25 mg. De proefpersonen moesten een systolische bloeddruk hebben van meer dan 90 mm Hg, een hartslag bij zitten van meer dan 60 slagen per minuut en geen contra-indicatie voor het gebruik van bètablokkers. Behandeling van het indexinfarct omvatte aspirine (85%), IV of orale -blokkers (37%), nitraten (73%), heparine (64%), trombolytica (40%) en acute angioplastiek (12%). Achtergrondbehandeling omvatte ACE-remmers of angiotensinereceptorblokkers (97%), anticoagulantia (20%), lipidenverlagende middelen (23%) en diuretica (34%). Kenmerken van de baselinepopulatie omvatten een gemiddelde leeftijd van 63 jaar, 74% man, 95% blank, gemiddelde bloeddruk 121/74 mm Hg, 22% met diabetes en 54% met een voorgeschiedenis van hypertensie. De gemiddelde bereikte dosering van carvedilol was 20 mg tweemaal daags; gemiddelde duur van de follow-up was 15 maanden.
De mortaliteit door alle oorzaken was 15% in de placebogroep en 12% in de carvedilolgroep, wat wijst op een risicoreductie van 23% bij personen die werden behandeld met carvedilol (95% BI: 2% tot 40%, P = 0,03), zoals weergegeven in figuur 3. De effecten op de mortaliteit in verschillende subgroepen zijn weergegeven in figuur 4. Bijna alle sterfgevallen waren cardiovasculair (die met 25% werden verminderd door carvedilol), en de meeste van deze sterfgevallen waren plotseling of gerelateerd aan pompfalen (beide soorten sterfgevallen waren verminderd door Carvedilol). Een ander eindpunt van de studie, totale mortaliteit en ziekenhuisopname door alle oorzaken, liet geen significante verbetering zien.
Er was ook een significante vermindering van 40% in fataal of niet-fataal myocardinfarct waargenomen in de groep die werd behandeld met carvedilol (95% BI: 11% tot 60%, P = 0,01). Een vergelijkbare vermindering van het risico op een myocardinfarct werd ook waargenomen in een meta-analyse van placebogecontroleerde onderzoeken met carvedilol bij hartfalen.
Figuur 3. Overlevingsanalyse voor CAPRICORN (Intent-to-Treat) 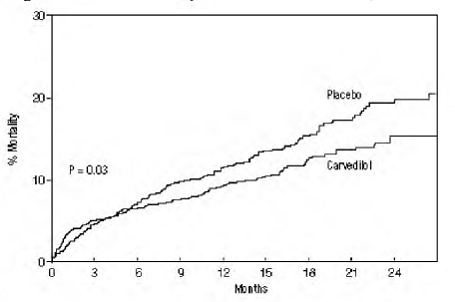
Figuur 4. Effecten op sterfte voor subgroepen in STEENBOK 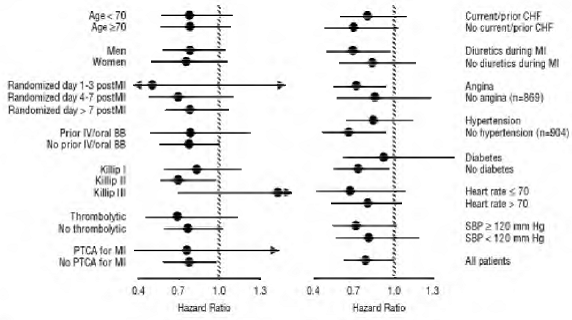
Hypertensie
COREG 25 mg werd bestudeerd in 2 placebogecontroleerde onderzoeken waarbij gebruik werd gemaakt van een tweemaal daagse dosering in totale dagelijkse doses van 12,5 tot 50 mg. In deze en andere onderzoeken was de startdosis niet hoger dan 12,5 mg. Bij 50 mg per dag verlaagde COREG de bloeddruk tijdens het zitten (12 uur) met ongeveer 9/5,5 mm Hg; bij 25 mg per dag was het effect ongeveer 7,5/3,5 mm Hg. Vergelijkingen van dal-tot-piek bloeddruk toonden een dal-tot-piek ratio voor bloeddrukrespons van ongeveer 65%. De hartslag daalde met ongeveer 7,5 slagen per minuut bij 50 mg per dag. Over het algemeen waren de reacties, net als bij andere bètablokkers, kleiner bij zwarte personen dan bij niet-zwarte proefpersonen. Er waren geen leeftijds- of geslachtsgerelateerde verschillen in respons.
Het maximale antihypertensieve effect trad 1 tot 2 uur na een dosis op. De dosisgerelateerde bloeddrukrespons ging gepaard met een dosisgerelateerde toename van bijwerkingen [zie: ONGEWENSTE REACTIES ].
Hypertensie met diabetes mellitus type 2
In een dubbelblinde studie (GEMINI) werd COREG 25 mg, toegevoegd aan een ACE-remmer of angiotensine-receptorblokker, geëvalueerd in een populatie met milde tot matige hypertensie en goed onder controle gebrachte type 2 diabetes mellitus. Het gemiddelde HbA1c bij baseline was 7,2%. COREG werd getitreerd tot een gemiddelde dosis van 17,5 mg tweemaal daags en gedurende 5 maanden gehandhaafd. COREG had geen nadelig effect op de glykemische controle, gebaseerd op HbA1c-metingen (gemiddelde verandering vanaf baseline van 0,02%, 95% BI: -0,06 tot 0,10, P = NS) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
PATIËNT INFORMATIE
COREG (Co-REG) (carvedilol) Tabletten
Lees de patiëntinformatie die bij COREG wordt geleverd voordat u het begint te gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of uw behandeling. Als u vragen heeft over COREG 3,12 mg, neem dan contact op met uw arts of apotheker.
Wat is COREG 3.12 mg?
COREG is een receptgeneesmiddel dat behoort tot een groep geneesmiddelen die “bètablokkers” worden genoemd. COREG 6,25 mg wordt, vaak in combinatie met andere geneesmiddelen, gebruikt voor de volgende aandoeningen:
- om patiënten met bepaalde soorten hartfalen te behandelen
- om patiënten te behandelen die een hartaanval hebben gehad waarbij de pompfunctie van het hart verslechterde
- voor de behandeling van patiënten met hoge bloeddruk (hypertensie)
COREG is niet goedgekeurd voor gebruik bij kinderen jonger dan 18 jaar.
Wie mag COREG niet gebruiken?
Gebruik COREG 6,25 mg niet als u:
- ernstig hartfalen heeft en in het ziekenhuis wordt opgenomen op de intensive care of bepaalde intraveneuze medicijnen nodig heeft die de bloedsomloop ondersteunen (inotrope medicijnen).
- zijn vatbaar voor astma of andere ademhalingsproblemen.
- een trage hartslag heeft of een hart dat een slag overslaat (onregelmatige hartslag).
- leverproblemen hebben.
- zijn allergisch voor een van de ingrediënten in COREG. Het actieve ingrediënt is carvedilol. Zie het einde van deze bijsluiter voor een lijst van alle ingrediënten in COREG.
Wat moet ik mijn arts vertellen voordat ik COREG inneem?
Vertel uw arts over al uw medische aandoeningen, ook als u:
- astma of andere longproblemen heeft (zoals bronchitis of emfyseem).
- problemen heeft met de bloedstroom in uw voeten en benen (perifere vaatziekte). COREG 3,12 mg kan sommige van uw symptomen verergeren.
- suikerziekte hebben.
- schildklierproblemen hebben.
- een aandoening heeft die feochromocytoom wordt genoemd.
- ernstige allergische reacties heeft gehad.
- zwanger bent of probeert zwanger te worden. Het is niet bekend of COREG veilig is voor uw ongeboren baby. U en uw arts moeten praten over de beste manier om uw hoge bloeddruk tijdens de zwangerschap onder controle te houden.
- zijn borstvoeding. Het is niet bekend of COREG in uw moedermelk terechtkomt. Praat met uw arts over de beste manier om uw baby te voeden als u COREG gebruikt.
- zijn ingepland voor een operatie en zullen anesthetica krijgen.
- zijn gepland voor een cataractoperatie en COREG hebben gebruikt of momenteel nemen.
- medicijnen op recept of vrij verkrijgbare medicijnen, vitamines en kruidensupplementen gebruikt. COREG en bepaalde andere geneesmiddelen kunnen elkaar beïnvloeden en ernstige bijwerkingen veroorzaken. COREG 3,12 mg kan de werking van andere geneesmiddelen beïnvloeden. Ook kunnen andere geneesmiddelen de werking van COREG 25 mg beïnvloeden.
Houd een lijst bij van alle medicijnen die u gebruikt. Laat deze lijst aan uw arts en apotheker zien voordat u met een nieuw geneesmiddel begint.
Hoe moet ik COREG gebruiken?
Het is belangrijk dat u uw geneesmiddel elke dag inneemt zoals voorgeschreven door uw arts. Als u plotseling stopt met het innemen van COREG, kunt u pijn op de borst krijgen en/of een hartaanval krijgen. Als uw arts besluit dat u moet stoppen met het innemen van COREG 6,25 mg, kan uw arts uw dosis gedurende een bepaalde periode langzaam verlagen voordat hij volledig stopt.
- Neem COREG precies zoals voorgeschreven. Uw arts zal u vertellen hoeveel tabletten u moet innemen en hoe vaak. Om mogelijke bijwerkingen tot een minimum te beperken, kan uw arts beginnen met een lage dosis en vervolgens de dosis langzaam verhogen.
- Stop niet met het innemen van COREG en verander de hoeveelheid COREG die u neemt niet zonder overleg met uw arts.
- Vertel het uw arts als u aankomt of moeite heeft met ademhalen terwijl u COREG gebruikt.
- Neem COREG in met voedsel.
- Als u een dosis COREG 3,12 mg bent vergeten, neem uw dosis dan in zodra u eraan denkt, tenzij het tijd is om uw volgende dosis in te nemen. Neem uw volgende dosis op het gebruikelijke tijdstip. Neem geen 2 doses tegelijk.
- Als u te veel COREG 25 mg heeft ingenomen, neem dan onmiddellijk contact op met uw arts of het antigifcentrum.
Wat moet ik vermijden tijdens het gebruik van COREG 3,12 mg?
- COREG kan ervoor zorgen dat u zich duizelig, moe of flauw voelt. Bestuur geen auto, gebruik geen machines of doe niets waarvoor u alert moet zijn als u deze symptomen heeft.
Wat zijn mogelijke bijwerkingen van COREG?
- Lage bloeddruk (die duizeligheid of flauwvallen kan veroorzaken als u opstaat). Als dit gebeurt, ga dan meteen zitten of liggen en vertel het uw arts.
- Vermoeidheid. Als u zich moe of duizelig voelt, mag u niet autorijden, machines gebruiken of iets doen waarvoor u alert moet zijn.
- Langzame hartslag.
- Veranderingen in uw bloedsuikerspiegel. Als u diabetes heeft, vertel het uw arts als u veranderingen in uw bloedsuikerspiegel heeft.
- COREG kan enkele van de symptomen van een lage bloedsuikerspiegel verbergen, vooral een snelle hartslag.
- COREG kan de symptomen van hyperthyreoïdie (overactieve schildklier) maskeren.
- Verergering van ernstige allergische reacties.
- Zeldzame maar ernstige allergische reacties (inclusief netelroos of zwelling van het gezicht, lippen, tong en/of keel die ademhalings- of slikproblemen kunnen veroorzaken) zijn opgetreden bij patiënten die COREG gebruikten. Deze reacties kunnen levensbedreigend zijn.
Andere bijwerkingen van COREG zijn kortademigheid, gewichtstoename, diarree en minder tranen of droge ogen die hinderlijk worden als u contactlenzen draagt.
Bel uw arts als u bijwerkingen heeft die u storen of niet weggaan.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA1088.
Hoe moet ik COREG 6,25 mg bewaren?
- Bewaar COREG bij minder dan 86 ° F (30 ° C). Houd de tabletten droog.
- Gooi COREG die verouderd of niet meer nodig is, veilig weg.
- Houd COREG 6,25 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over COREG
Geneesmiddelen worden soms voorgeschreven voor andere aandoeningen dan beschreven in de patiëntenbijsluiters. Gebruik COREG 3,12 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef COREG niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze folder vat de belangrijkste informatie over COREG samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over COREG 6,25 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in COREG?
Actief bestanddeel: Carvedilol.
Inactieve ingrediënten: colloïdaal siliciumdioxide, crospovidon, hypromellose, lactose, magnesiumstearaat, polyethyleenglycol, polysorbaat 80, povidon, sucrose en titaniumdioxide.
Carvedilol-tabletten zijn er in de volgende sterktes: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Wat is hoge bloeddruk (hypertensie)?
Bloeddruk is de kracht van het bloed in uw bloedvaten wanneer uw hart klopt en wanneer uw hart rust. Je hebt een hoge bloeddruk als de kracht te veel is. Hoge bloeddruk zorgt ervoor dat het hart harder moet werken om bloed door het lichaam te pompen en veroorzaakt schade aan bloedvaten. COREG kan uw bloedvaten helpen ontspannen, zodat uw bloeddruk lager is. Geneesmiddelen die de bloeddruk verlagen, kunnen uw kans op een beroerte of een hartaanval verkleinen.
