Benicar 10mg, 20mg, 40mg Olmesartan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Benicar 40 mg en hoe wordt het gebruikt?
Benicar is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hoge bloeddruk (hypertensie) te behandelen. Benicar 10 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Benicar is een angiotensine II-receptorblokker of ARB's.
Het is niet bekend of Benicar veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Benicar 40 mg?
Benicar kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid
- weinig of geen plassen
- zwelling in uw handen of voeten
- misselijkheid
- zwakheid
- tintelend gevoel
- pijn op de borst
- snelle of onregelmatige hartslag
- verlies van beweging
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Benicar zijn:
- duizeligheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Benicar. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Wanneer zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met Benicar 40 mg (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Geneesmiddelen die direct op de renine-angiotens in het systeem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
OMSCHRIJVING
Olmesartan medoxomil, een prodrug, wordt tijdens absorptie uit het maagdarmkanaal gehydrolyseerd tot olmesartan. Olmesartan is een selectieve AT1-subtype angiotensine II-receptorantagonist.
Olmesartan medoxomil wordt chemisch beschreven als 2,3-dihydroxy-2-butenyl 4-(1 hydroxy-1-methylethyl)-2-propyl-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol- 5 carboxylaat, cyclisch 2,3-carbonaat.
De empirische formule is C29H30N6O6 en de structuurformule is:
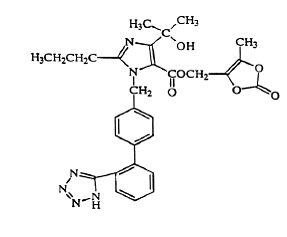
Olmesartan medoxomil is een wit tot licht geelachtig wit poeder of kristallijn poeder met een molecuulgewicht van 558,59. Het is praktisch onoplosbaar in water en matig oplosbaar in methanol. Benicar 20 mg is beschikbaar voor oraal gebruik als filmomhulde tabletten die 5 mg, 20 mg of 40 mg olmesartan medoxomil en de volgende inactieve ingrediënten bevatten: hydroxypropylcellulose, hypromellose, lactosemonohydraat, laag-gesubstitueerde hydroxypropylcellulose, magnesiumstearaat, microkristallijne cellulose , talk, titaandioxide en (alleen 5 mg) geel ijzeroxide.
INDICATIES
Benicar 40 mg is geïndiceerd voor de behandeling van hypertensie bij volwassenen en kinderen van zes jaar en ouder, om de bloeddruk te verlagen. Het verlagen van de bloeddruk vermindert het risico op fatale en niet-fatale cardiovasculaire voorvallen, voornamelijk beroertes en myocardinfarcten. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een grote verscheidenheid aan farmacologische klassen, waaronder de klasse waartoe dit medicijn voornamelijk behoort. Er zijn geen gecontroleerde onderzoeken die risicovermindering met Benicar aantonen.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan één medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van het Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
Het kan alleen of in combinatie met andere antihypertensiva worden gebruikt.
DOSERING EN ADMINISTRATIE
Hypertensie bij volwassenen
Dosering moet worden geïndividualiseerd. De gebruikelijke aanbevolen startdosering van Benicar 20 mg is eenmaal daags 20 mg bij gebruik als monotherapie bij patiënten die geen volumecontract hebben. Voor patiënten die na 2 weken therapie een verdere verlaging van de bloeddruk nodig hebben, kan de dosis Benicar worden verhoogd tot 40 mg. Doses boven 40 mg lijken geen groter effect te hebben. Tweemaal daagse dosering biedt geen voordeel ten opzichte van dezelfde totale dosis die eenmaal daags wordt gegeven.
Voor patiënten met mogelijke uitputting van het intravasculaire volume (bijv. patiënten die worden behandeld met diuretica, in het bijzonder die met een verminderde nierfunctie), start Benicar onder strikt medisch toezicht en overweeg het gebruik van een lagere startdosis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypertensie bij kinderen (6 jaar en ouder)
Dosering moet worden geïndividualiseerd. Voor kinderen die tabletten kunnen slikken, is de gebruikelijke aanbevolen startdosering van Benicar 10 mg eenmaal daags voor patiënten die 20 tot
Het gebruik van Benicar 10 mg bij kinderen WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Voor kinderen die geen tabletten kunnen slikken, kan dezelfde dosis worden gegeven met een geïmproviseerde suspensie zoals hieronder beschreven [zie: KLINISCHE FARMACOLOGIE ]. Volg de onderstaande instructies voor het bereiden van suspensies om Benicar als suspensie toe te dienen.
Bereiding van suspensie (voor 200 ml van een suspensie van 2 mg / ml)
Voeg 50 ml gezuiverd water toe aan een amberkleurige polyethyleentereftalaat (PET) fles met twintig Benicar 20 mg tabletten en laat dit minimaal 5 minuten staan. Schud de container minimaal 1 minuut en laat de suspensie minimaal 1 minuut staan. Herhaal 1 minuut schudden en 1 minuut staan nog vier keer. Voeg 100 ml ORA-Sweet® en 50 ml ORA-Plus®* toe aan de suspensie en schud goed gedurende minstens 1 minuut. De suspensie moet worden gekoeld bij 2-8°C (36-46°F) en kan maximaal 4 weken worden bewaard. Schud de suspensie goed voor elk gebruik en plaats onmiddellijk terug in de koelkast.
HOE GELEVERD
Doseringsvormen en sterke punten
- 5 mg gele, ronde, filmomhulde tabletten zonder breukgleuf met de inscriptie Sankyo aan de ene kant en C12 aan de andere kant
- 20 mg witte, ronde, filmomhulde tabletten zonder breukgleuf met de inscriptie Sankyo aan de ene kant en C14 aan de andere kant
- 40 mg witte, ovale, filmomhulde tabletten zonder breukgleuf met de inscriptie Sankyo aan de ene kant en C15 aan de andere kant
Opslag en behandeling
Benicar wordt geleverd als gele, ronde, filmomhulde tabletten zonder breukgleuf die 5 mg olmesartan medoxomil bevatten, als witte, ronde, filmomhulde tabletten zonder breuklijn die 20 mg olmesartan medoxomil bevatten, en als witte, ovale tabletten. , filmomhulde tabletten zonder breukstreep die 40 mg olmesartan medoxomil bevatten. Tabletten hebben de inscriptie Sankyo aan de ene kant en C12, C14 of C15 aan de andere kant van respectievelijk de 5, 20 en 40 mg tabletten.
Tabletten worden als volgt geleverd:
Opslag
Bewaren bij 20-25 ° C (68-77 ° F) [zie USP-gecontroleerde kamertemperatuur].
Gefabriceerd voor Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Herzien: okt 2019
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
Hypertensie bij volwassenen
Benicar is beoordeeld op veiligheid bij meer dan 3825 patiënten/proefpersonen, waaronder meer dan 3275 patiënten die werden behandeld voor hypertensie in gecontroleerde onderzoeken. Deze ervaring omvatte ongeveer 900 patiënten die gedurende ten minste 6 maanden werden behandeld en meer dan 525 gedurende ten minste 1 jaar. De voorvallen waren over het algemeen mild, van voorbijgaande aard en hadden geen verband met de dosis Benicar.
Analyse van geslacht, leeftijd en rasgroepen liet geen verschillen zien tussen Benicar 40 mg en met placebo behandelde patiënten. Het percentage stopzettingen als gevolg van bijwerkingen in alle onderzoeken met hypertensieve patiënten was 2,4% (dwz 79/3278) van de patiënten die werden behandeld met Benicar 40 mg en 2,7% (dwz 32/1179) van de controlepatiënten. In placebogecontroleerde onderzoeken was duizeligheid de enige bijwerking die optrad bij meer dan 1% van de patiënten die werden behandeld met Benicar 20 mg en met een hogere incidentie versus placebo (3% versus 1%).
Gezichtsoedeem werd gemeld bij vijf patiënten die Benicar kregen. Angio-oedeem is gemeld bij angiotensine II-antagonisten.
Pediatrische hypertensie
Er werden geen relevante verschillen vastgesteld tussen het profiel van bijwerkingen voor pediatrische patiënten in de leeftijd van 1 tot 16 jaar en het profiel dat eerder werd gerapporteerd voor volwassen patiënten.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld tijdens postmarketingervaring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: Asthenie, angio-oedeem, anafylactische reacties
Gastro-intestinaal: Braken, spruwachtige enteropathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Metabole en voedingsstoornissen: Hyperkaliëmie
Musculoskeletaal: Rabdomyolyse
Urogenitaal systeem: Acuut nierfalen, verhoogde creatininespiegels in het bloed
Huid en aanhangsels: Alopecia, pruritus, urticaria
Gegevens van één gecontroleerd onderzoek en een epidemiologisch onderzoek hebben gesuggereerd dat een hoge dosis olmesartan het cardiovasculaire (CV) risico bij diabetespatiënten kan verhogen, maar de algemene gegevens zijn niet overtuigend. De gerandomiseerde, placebogecontroleerde, dubbelblinde ROADMAP-studie (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) onderzocht het gebruik van olmesartan, 40 mg per dag, vs. placebo bij patiënten met type 2 diabetes mellitus, normoalbuminurie en bij ten minste één extra risicofactor voor CV ziekte. De studie bereikte zijn primaire eindpunt, vertraagde aanvang van microalbuminurie, maar olmesartan had geen gunstig effect op de afname van de glomerulaire filtratiesnelheid (GFR). Er was een bevinding van verhoogde CV mortaliteit (vastgestelde plotselinge hartdood, fataal myocardinfarct, fatale beroerte, overlijden door revascularisatie) in de olmesartangroep vergeleken met de placebogroep (15 olmesartan vs. 3 placebo, HR 4,9, 95% betrouwbaarheidsinterval [BI ], 1.4, 17), maar het risico op niet-fataal myocardinfarct was lager met olmesartan (HR 0,64, 95% BI 0,35, 1,18).
De epidemiologische studie omvatte patiënten van 65 jaar en ouder met een totale blootstelling van > 300.000 patiëntjaren. In de subgroep van diabetespatiënten die gedurende > 6 maanden een hoge dosis olmesartan (40 mg/d) kregen, bleek er een verhoogd risico op overlijden te zijn (HR 2,0, 95% BI 1,1; 3,8) vergeleken met vergelijkbare patiënten die andere angiotensinereceptorblokkers. Daarentegen bleek het gebruik van hoge doses olmesartan bij niet-diabetische patiënten geassocieerd te zijn met een verlaagd risico op overlijden (HR 0,46, 95% BI 0,24, 0,86) in vergelijking met vergelijkbare patiënten die andere angiotensinereceptorblokkers gebruikten. Er werden geen verschillen waargenomen tussen de groepen die lagere doses olmesartan kregen in vergelijking met andere angiotensineblokkers of de groepen die
Over het algemeen geven deze gegevens aanleiding tot bezorgdheid over een mogelijk verhoogd CV-risico in verband met het gebruik van hoge doses olmesartan bij diabetespatiënten. Er zijn echter zorgen over de geloofwaardigheid van de bevinding van een verhoogd CV-risico, met name de observatie in de grote epidemiologische studie voor een overlevingsvoordeel bij niet-diabetici van een omvang die vergelijkbaar is met de nadelige bevinding bij diabetici.
DRUG-INTERACTIES
Middelen die serumkalium verhogen
Gelijktijdig gebruik van olmesartan met andere middelen die het renine-angiotensinesysteem blokkeren, kaliumsparende diuretica (bijv. spironolacton, triamtereen, amiloride), kaliumsupplementen, zoutvervangers die kalium bevatten of andere geneesmiddelen die de kaliumspiegels kunnen verhogen (bijv. heparine) kunnen leiden tot verhogingen van het serumkalium. Als comedicatie noodzakelijk wordt geacht, is controle van het serumkalium aan te raden.
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, inclusief selectieve COX-2-remmers, met angiotensine II-receptorantagonisten, waaronder olmesartan medoxomil, leiden tot verslechtering nierfunctie, inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die olmesartan medoxomil en NSAID's krijgen.
Het antihypertensieve effect van angiotensine II-receptorantagonisten, waaronder olmesartan medoxomil, kan worden afgezwakt door NSAID's, waaronder selectieve COX-2-remmers.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie. De meeste patiënten die de combinatie van twee RAS-remmers krijgen, hebben geen extra voordeel ten opzichte van monotherapie. Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die Benicar en andere middelen gebruiken die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met Benicar bij patiënten met diabetes [zie: CONTRA-INDICATIES ]. Vermijd het gebruik van aliskiren met Benicar 40 mg bij patiënten met een nierfunctiestoornis (GFR
Lithium
Verhogingen van de serumlithiumconcentraties en lithiumtoxiciteit zijn gemeld tijdens gelijktijdige toediening van lithium met angiotensine II-receptorantagonisten, waaronder BENICAR. Controleer de serumlithiumspiegels tijdens gelijktijdig gebruik.
Colesevelam Hydrochloride
Gelijktijdige toediening van galzuurbindend middel colesevelamhydrochloride vermindert de systemische blootstelling en piekplasmaconcentratie van olmesartan. Toediening van olmesartan ten minste 4 uur voorafgaand aan colesevelamhydrochloride verminderde het geneesmiddelinteractie-effect. Overweeg om olmesartan minstens 4 uur voor de dosis colesevelamhydrochloride toe te dienen [zie: KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Foetale toxiciteit
Benicar 10 mg kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem (RAS) tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met Benicar [zie Gebruik bij specifieke populaties ].
Morbiditeit bij zuigelingen
Het gebruik van Benicar bij kinderen jonger dan 1 jaar wordt niet aanbevolen. Geneesmiddelen die direct inwerken op het renine-angiotensine-aldosteronsysteem (RAAS) kunnen effecten hebben op de ontwikkeling van onvolgroeide nieren [zie Gebruik bij specifieke populaties ].
Hypotensie bij patiënten met volume- of zoutdepletie
Bij patiënten met een geactiveerd renine-angiotensine-aldosteronsysteem, zoals patiënten met volume- en/of zoutdepletie (bijv. patiënten die worden behandeld met hoge doses diuretica), kan symptomatische hypotensie worden verwacht na het starten van de behandeling met Benicar. Start de behandeling onder strikt medisch toezicht en overweeg om met een lagere dosis te beginnen. Als hypotensie optreedt, plaats de patiënt dan in rugligging en geef, indien nodig, een intraveneuze infusie van een normale zoutoplossing [zie DOSERING EN ADMINISTRATIE ]. Een voorbijgaande hypotensieve respons is geen contra-indicatie voor verdere behandeling, die gewoonlijk zonder problemen kan worden voortgezet zodra de bloeddruk is gestabiliseerd.
Verminderde nierfunctie
Als gevolg van de remming van het renine-angiotensine-aldosteronsysteem kunnen veranderingen in de nierfunctie worden verwacht bij gevoelige personen die met Benicar worden behandeld. Bij patiënten bij wie de nierfunctie kan afhangen van de activiteit van het renine-angiotensinaldosteronsysteem (bijv. patiënten met ernstig congestief hartfalen), is behandeling met angiotensineconverterend enzym (ACE)-remmers en angiotensinereceptorantagonisten in verband gebracht met oligurie en/of progressieve azotemie. en zelden met acuut nierfalen en/of overlijden. Soortgelijke resultaten kunnen worden verwacht bij patiënten die met Benicar worden behandeld [zie: DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES , Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
In onderzoeken naar ACE-remmers bij patiënten met unilaterale of bilaterale nierarteriestenose zijn verhogingen van serumcreatinine of bloedureumstikstof (BUN) gemeld. Benicar is niet langdurig gebruikt bij patiënten met unilaterale of bilaterale nierarteriestenose, maar vergelijkbare resultaten kunnen worden verwacht.
Sprue-achtige enteropathie
Ernstige, chronische diarree met aanzienlijk gewichtsverlies is gemeld bij patiënten die olmesartan maanden tot jaren na de start van het geneesmiddel gebruikten. Intestinale biopsieën van patiënten vertoonden vaak villeuze atrofie. Als een patiënt deze symptomen ontwikkelt tijdens de behandeling met olmesartan, sluit dan andere etiologieën uit. Overweeg alternatieve antihypertensieve therapie in gevallen waarin geen andere etiologie is vastgesteld.
Hyperkaliëmie
Serumkalium moet worden gecontroleerd bij patiënten die Benicar krijgen. Geneesmiddelen die het renine-angiotensinesysteem remmen, kunnen hyperkaliëmie veroorzaken. Risicofactoren voor de ontwikkeling van hyperkaliëmie zijn onder meer nierinsufficiëntie, diabetes mellitus en het gelijktijdig gebruik van kaliumsparende diuretica, kaliumsupplementen en/of kaliumbevattende zoutvervangers [zie DRUG-INTERACTIES ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Olmesartan medoxomil was niet carcinogeen bij toediening via de voeding aan ratten gedurende maximaal 2 jaar. De hoogste geteste dosis (2000 mg/kg/dag) was, op basis van mg/m2, ongeveer 480 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 40 mg/dag. Twee carcinogeniteitsstudies uitgevoerd bij muizen, een 6 maanden durende maagsondestudie bij de p53 knock-out muis en een 6 maanden durende voedingstoedieningsstudie bij de Hras2 transgene muis, in doses tot 1000 mg/kg/dag (ongeveer 120 maal de MRHD) , bleek geen bewijs van een carcinogeen effect van olmesartan medoxomil.
Zowel olmesartan medoxomil als olmesartan testten negatief in de in vitro Syrische hamsterembryoceltransformatietest en vertoonden geen bewijs van genetische toxiciteit in de Ames-test (bacteriële mutageniteit). Beide bleken echter chromosomale afwijkingen in gekweekte cellen in vitro (Chinese hamsterlong) te induceren en testten positief op thymidinekinasemutaties in de in vitro muislymfoomtest. Olmesartan medoxomil testte in vivo negatief op mutaties in de MutaMouse-darm en -nier en op clastogeniciteit in het beenmerg van muizen (micronucleustest) bij orale doses tot 2000 mg/kg (olmesartan niet getest).
De vruchtbaarheid van ratten werd niet beïnvloed door toediening van olmesartan medoxomil in doseringen van wel 1000 mg/kg/dag (240 maal de MRHD) in een onderzoek waarin met de dosering werd begonnen 2 (vrouwelijke) of 9 (mannelijke) weken voorafgaand aan de paring.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Benicar 10 mg kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. In reproductiestudies bij dieren resulteerde behandeling met Benicar tijdens de organogenese in verhoogde embryofoetale toxiciteit bij ratten bij doses die lager waren dan die welke voor de moeder toxisch waren.
Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met Benicar. Overweeg alternatieve antihypertensiva tijdens de zwangerschap.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2%–4% en 15%–20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en complicaties bij de bevalling (bijvoorbeeld een keizersnede en postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Oligohydramnion bij zwangere vrouwen die geneesmiddelen gebruiken die het renine-angiotensinesysteem beïnvloeden in het tweede en derde trimester van de zwangerschap kan het volgende tot gevolg hebben: verminderde foetale nierfunctie leidend tot anurie en nierfalen, foetale longhypoplasie, skeletdeformaties, waaronder schedelhypoplasie, hypotensie en dood. Voer bij patiënten die Benicar 20 mg gebruiken tijdens de zwangerschap seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Foetale testen kunnen geschikt zijn, op basis van de week van de zwangerschap. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen.
Observeer nauwkeurig zuigelingen met een geschiedenis van in utero blootstelling aan Benicar 40 mg voor hypotensie, oligurie en hyperkaliëmie. Bij pasgeborenen met een voorgeschiedenis van in utero blootstelling aan Benicar, indien oligurie of hypotensie optreedt, maatregelen nemen om een adequate bloeddruk en nierperfusie te handhaven. Wisseltransfusies of dialyse kunnen nodig zijn om hypotensie om te keren en de nierfunctie te ondersteunen.
Gegevens
Dierlijke gegevens
Er werden geen teratogene effecten waargenomen wanneer olmesartan medoxomil werd toegediend aan drachtige ratten in orale doses tot 1000 mg/kg/dag (240 maal de maximaal aanbevolen dosis voor de mens (MRHD) op basis van mg/m2) of drachtige konijnen bij orale doses tot 1 mg/kg/dag (de helft van de MRHD op basis van mg/m2; hogere doses konden niet worden beoordeeld op effecten op de ontwikkeling van de foetus omdat ze dodelijk waren voor de diëten). Bij ratten werden significante dalingen van het geboortegewicht van de jongen en gewichtstoename waargenomen bij doses 1,6 mg/kg/dag, en vertragingen in ontwikkelingsmijlpalen (vertraagde scheiding van oorschelp, uitbarsting van onderste snijtanden, verschijnen van buikhaar, indalen van testikels, en scheiding van oogleden) en dosisafhankelijke verhogingen van de incidentie van dilatatie van het nierbekken werden waargenomen bij doses 8 mg/kg/dag. De dosis zonder waargenomen effect voor ontwikkelingstoxiciteit bij ratten is 0,3 mg/kg/dag, ongeveer een tiende van de MRHD van 40 mg/dag.
Borstvoeding
Risico Samenvatting
Er is geen informatie over de aanwezigheid van olmesartan in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Olmesartan wordt in lage concentratie uitgescheiden in de melk van zogende ratten (zie: Gegevens ). Vanwege het potentieel voor nadelige effecten op de zuigeling, moet worden besloten of de borstvoeding moet worden gestaakt of dat het medicijn moet worden gestaakt, rekening houdend met het belang van het medicijn voor de moeder.
Gegevens
Aanwezigheid van olmesartan in melk werd waargenomen na een enkele orale toediening van 5 mg/kg [14C] olmesartan medoxomil aan zogende ratten.
Pediatrisch gebruik
De antihypertensieve effecten van Benicar werden geëvalueerd in één gerandomiseerd, dubbelblind klinisch onderzoek bij pediatrische patiënten van 1 tot 16 jaar [zie Klinische studies ]. De farmacokinetiek van Benicar werd geëvalueerd bij pediatrische patiënten van 1 tot 16 jaar [zie: KLINISCHE FARMACOLOGIE ]. Benicar 10 mg werd over het algemeen goed verdragen door pediatrische patiënten en het bijwerkingenprofiel was vergelijkbaar met dat beschreven voor volwassenen.
Het is niet aangetoond dat Benicar 20 mg effectief is voor hypertensie bij kinderen jonger dan 6 jaar.
Het gebruik van Benicar bij kinderen jonger dan 1 jaar wordt niet aanbevolen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Het renine-angiotensine-aldosteronsysteem (RAAS) speelt een cruciale rol bij de ontwikkeling van de nieren. Het is aangetoond dat RAAS-blokkade leidt tot abnormale nierontwikkeling bij zeer jonge muizen. Het toedienen van geneesmiddelen die direct inwerken op het renine-angiotensine-aldosteronsysteem (RAAS) kan de normale nierontwikkeling veranderen.
Geriatrisch gebruik
Van het totale aantal hypertensieve patiënten die Benicar kregen in klinische onderzoeken, was meer dan 20% 65 jaar en ouder, terwijl meer dan 5% 75 jaar en ouder was. Er werden geen algemene verschillen in werkzaamheid of veiligheid waargenomen tussen oudere patiënten en jongere patiënten. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten [zie KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Verhogingen van de AUC0-∞ en Cmax werden waargenomen bij patiënten met een matige leverfunctiestoornis in vergelijking met die bij gematchte controlepersonen, met een toename van de AUC van ongeveer 60%. Er wordt geen aanpassing van de initiële dosering aanbevolen voor patiënten met een matige tot duidelijke leverfunctiestoornis [zie: KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Patiënten met nierinsufficiëntie hebben verhoogde serumconcentraties van olmesartan in vergelijking met patiënten met een normale nierfunctie. Na herhaalde dosering was de AUC ongeveer verdrievoudigd bij patiënten met een ernstige nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Zwarte patiënten
Het antihypertensieve effect van Benicar 10 mg was kleiner bij negroïde patiënten (meestal een populatie met een laag reninegehalte), zoals is waargenomen bij ACE-remmers, bètablokkers en andere angiotensinereceptorblokkers.
OVERDOSERING
Er zijn beperkte gegevens beschikbaar over overdosering bij mensen. De meest waarschijnlijke verschijnselen van overdosering zijn hypotensie en tachycardie; bradycardie kan optreden als parasympathische (vagale) stimulatie optreedt. Als symptomatische hypotensie optreedt, start dan een ondersteunende behandeling. De dialyseerbaarheid van olmesartan is niet bekend.
CONTRA-INDICATIES
Dien aliskiren niet gelijktijdig toe met Benicar 20 mg bij patiënten met diabetes [zie: DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Angiotensine II wordt gevormd uit angiotensine I in een reactie die wordt gekatalyseerd door het angiotensineconverterende enzym (ACE, kininase II). Angiotensine II is het belangrijkste pressormiddel van het renine-angiotensinesysteem, met effecten zoals vasoconstrictie, stimulatie van de synthese en afgifte van aldosteron, hartstimulatie en renale reabsorptie van natrium. Olmesartan blokkeert de vaatvernauwende effecten van angiotensine II door selectief de binding van angiotensine II aan de AT1-receptor in vasculaire gladde spieren te blokkeren. De werking ervan is daarom onafhankelijk van de routes voor de synthese van angiotensine II.
Een AT2-receptor wordt ook in veel weefsels gevonden, maar het is niet bekend dat deze receptor geassocieerd is met cardiovasculaire homeostase. Olmesartan heeft een meer dan 12.500 maal grotere affiniteit voor de AT1-receptor dan voor de AT2-receptor.
Blokkade van het renine-angiotensinesysteem met ACE-remmers, die de biosynthese van angiotensine II uit angiotensine I remmen, is een mechanisme van veel geneesmiddelen die worden gebruikt om hypertensie te behandelen. ACE-remmers remmen ook de afbraak van bradykinine, een reactie die ook door ACE wordt gekatalyseerd. Omdat olmesartan medoxomil ACE (kininase II) niet remt, heeft het geen invloed op de respons op bradykinine. Of dit verschil klinisch relevant is, is nog niet bekend.
Blokkade van de angiotensine II-receptor remt de negatieve regelgevende feedback van angiotensine II op de renine-uitscheiding, maar de resulterende verhoogde plasma-renine-activiteit en circulerende angiotensine II-spiegels overwinnen het effect van olmesartan op de bloeddruk niet.
farmacodynamiek
Benicar-doses van 2,5 mg tot 40 mg remmen de pressoreffecten van angiotensine I-infusie. De duur van het remmende effect was gerelateerd aan de dosis, waarbij doses Benicar >40 mg een remming van >90% gaven na 24 uur.
De plasmaconcentraties van angiotensine I en angiotensine II en de plasmarenineactiviteit (PRA) nemen toe na enkelvoudige en herhaalde toediening van Benicar 10 mg aan gezonde proefpersonen en hypertensieve patiënten. Herhaalde toediening van maximaal 80 mg Benicar had een minimale invloed op de aldosteronspiegels en geen effect op het serumkalium.
Farmacokinetiek
Absorptie
Olmesartan medoxomil wordt snel en volledig biologisch geactiveerd door esterhydrolyse tot olmesartan tijdens absorptie vanuit het maagdarmkanaal.
Benicar-tabletten en de suspensieformulering bereid uit Benicar-tabletten zijn bio-equivalent [zie: DOSERING EN ADMINISTRATIE ].
De absolute biologische beschikbaarheid van olmesartan is ongeveer 26%. Na orale toediening wordt de piekplasmaconcentratie (Cmax) van olmesartan na 1 tot 2 uur bereikt. Voedsel heeft geen invloed op de biologische beschikbaarheid van olmesartan. Benicar kan met of zonder voedsel worden toegediend.
Verdeling
Het distributievolume van olmesartan is ongeveer 17 l. Olmesartan is sterk gebonden aan plasma-eiwitten (99%) en dringt niet door in de rode bloedcellen. De eiwitbinding is constant bij plasmaconcentraties van olmesartan die ruim boven het bereik liggen dat wordt bereikt met de aanbevolen doses.
Bij ratten passeerde olmesartan de bloed-hersenbarrière slecht of helemaal niet. Olmesartan passeerde de placentabarrière bij ratten en werd gedistribueerd naar de foetus. Olmesartan werd bij ratten in lage concentraties in de melk gedistribueerd.
Metabolisme en uitscheiding
Na de snelle en volledige omzetting van olmesartan medoxomil in olmesartan tijdens absorptie, vindt er vrijwel geen verdere metabolisering van olmesartan plaats. De totale plasmaklaring van olmesartan is 1,3 l/u, met een renale klaring van 0,6 l/u. Ongeveer 35% tot 50% van de geabsorbeerde dosis wordt teruggevonden in de urine, terwijl de rest wordt uitgescheiden in de feces via de gal.
Olmesartan lijkt bifasisch te worden geëlimineerd met een terminale eliminatiehalfwaardetijd van ongeveer 13 uur. Olmesartan vertoont een lineaire farmacokinetiek na enkelvoudige orale doses tot 320 mg en meervoudige orale doses tot 80 mg. Steady-state spiegels van olmesartan worden binnen 3 tot 5 dagen bereikt en er treedt geen accumulatie in plasma op bij eenmaal daagse dosering.
Specifieke populaties
Geriatrische patiënten
De farmacokinetiek van olmesartan is onderzocht bij ouderen (≥65 jaar). Over het algemeen waren de maximale plasmaconcentraties van olmesartan vergelijkbaar bij jonge volwassenen en ouderen. Bij ouderen werd bij herhaalde dosering een bescheiden accumulatie van olmesartan waargenomen; AUCss, τ was 33% hoger bij oudere patiënten, wat overeenkomt met een verlaging van ongeveer 30% in CLR [zie DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Pediatrische patiënten
De farmacokinetiek van olmesartan is onderzocht bij pediatrische hypertensieve patiënten in de leeftijd van 1 tot 16 jaar. De klaring van olmesartan bij pediatrische patiënten was vergelijkbaar met die bij volwassen patiënten indien aangepast aan het lichaamsgewicht [zie: Gebruik bij specifieke populaties ].
De farmacokinetiek van olmesartan is niet onderzocht bij pediatrische patiënten jonger dan 1 jaar [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Mannelijke en vrouwelijke patiënten
Er werden kleine verschillen waargenomen in de farmacokinetiek van olmesartan bij vrouwen in vergelijking met mannen. De AUC en Cmax waren 10-15% hoger bij vrouwen dan bij mannen.
Patiënten met leverinsufficiëntie
Verhogingen van de AUC0-∞ en Cmax werden waargenomen bij patiënten met een matige leverfunctiestoornis in vergelijking met die bij gematchte controlepersonen, met een toename van de AUC van ongeveer 60% [zie DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Patiënten met nierinsufficiëntie
Bij patiënten met nierinsufficiëntie waren de serumconcentraties van olmesartan verhoogd in vergelijking met patiënten met een normale nierfunctie. Na herhaalde dosering was de AUC ongeveer verdrievoudigd bij patiënten met een ernstige nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Geneesmiddelinteractiestudies
Galzuur-sequestreermiddel Colesevelam
Gelijktijdige toediening van 40 mg olmesartan medoxomil en 3750 mg colesevelam hydrochloride bij gezonde proefpersonen resulteerde in 28% verlaging van de Cmax en 39% verlaging van de AUC van olmesartan. Minder effecten, respectievelijk 4% en 15% verlaging van Cmax en AUC, werden waargenomen wanneer olmesartan medoxomil 4 uur voorafgaand aan colesevelamhydrochloride werd toegediend [zie DRUG-INTERACTIES ].
Andere onderzoeken
Er zijn geen significante geneesmiddelinteracties gemeld in onderzoeken waarin olmesartan medoxomil gelijktijdig werd toegediend met digoxine of warfarine bij gezonde vrijwilligers.
De biologische beschikbaarheid van olmesartan werd niet significant veranderd door de gelijktijdige toediening van antacida [Al(OH)3/Mg(OH)2].
Olmesartan medoxomil wordt niet gemetaboliseerd door het cytochroom P450-systeem en heeft geen effect op P450-enzymen; dus worden geen interacties verwacht met geneesmiddelen die die enzymen remmen, induceren of door deze enzymen worden gemetaboliseerd.
Klinische studies
Hypertensie bij volwassenen
De antihypertensieve effecten van Benicar 10 mg zijn aangetoond in zeven placebogecontroleerde onderzoeken bij doses variërend van 2,5 mg tot 80 mg gedurende 6 tot 12 weken, waarbij elk een statistisch significante verlaging van de piek- en dalbloeddruk liet zien. In totaal werden 2693 patiënten (2145 Benicar; 548 placebo) met essentiële hypertensie onderzocht. Benicar 40 mg eenmaal daags verlaagde de diastolische en systolische bloeddruk. De respons was dosisgerelateerd, zoals weergegeven in de volgende grafiek. Een dosis van Benicar van 20 mg per dag geeft een verlaging van de bloeddruk in zittende houding (BP) ten opzichte van placebo van ongeveer 10/6 mmHg en een dosis van 40 mg per dag geeft een verlaging van de bloeddruk in zittende vorm van ongeveer 12/7 mmHg ten opzichte van placebo. Benicar 10 mg doses hoger dan 40 mg hadden weinig bijkomend effect. Het antihypertensieve effect trad binnen 1 week in en was na 2 weken grotendeels manifest.
Benicar 40 mg dosisrespons Placebo-aangepaste verlaging van de bloeddruk (mmHg) 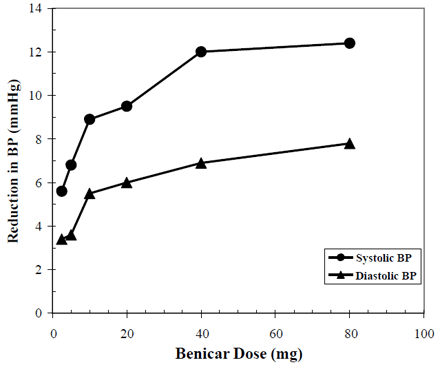
Bovenstaande gegevens zijn afkomstig uit zeven placebogecontroleerde onderzoeken (2145 Benicar-patiënten, 548 placebo-patiënten). Het bloeddrukverlagende effect bleef gedurende de periode van 24 uur behouden met Benicar eenmaal daags, met dal-tot-piekverhoudingen voor de systolische en diastolische respons tussen 60 en 80%.
Het bloeddrukverlagende effect van Benicar 40 mg, met en zonder hydrochloorthiazide, hield aan bij patiënten die tot 1 jaar werden behandeld. Er waren geen aanwijzingen voor tachyfylaxie tijdens langdurige behandeling met Benicar of een rebound-effect na abrupt staken van olmesartan medoxomil na 1 jaar behandeling.
Het antihypertensieve effect van Benicar was vergelijkbaar bij mannen en vrouwen en bij patiënten ouder en jonger dan 65 jaar. Het effect was kleiner bij negroïde patiënten (meestal een populatie met een laag reninegehalte), zoals is waargenomen bij ACE-remmers, bètablokkers en andere angiotensinereceptorblokkers. Benicar had een extra bloeddrukverlagend effect bij toevoeging aan hydrochloorthiazide.
Er zijn geen onderzoeken met Benicar die een vermindering van het cardiovasculaire risico bij patiënten met hypertensie aantonen, maar ten minste één farmacologisch vergelijkbaar geneesmiddel heeft dergelijke voordelen aangetoond.
Pediatrische hypertensie
De antihypertensieve effecten van Benicar 40 mg bij pediatrische patiënten werden geëvalueerd in een gerandomiseerde, dubbelblinde studie met 302 hypertensieve patiënten in de leeftijd van 6 tot 16 jaar. De onderzoekspopulatie bestond uit een volledig zwarte cohort van 112 patiënten en een cohort van gemengd ras van 190 patiënten, waaronder 38 zwarte patiënten. De etiologie van de hypertensie was voornamelijk essentiële hypertensie (87% van het zwarte cohort en 67% van het gemengde cohort). Patiënten die 20 tot
In hetzelfde onderzoek kregen 59 patiënten van 1 tot 5 jaar die 5 kg wogen, 0,3 mg/kg Benicar 10 mg eenmaal daags gedurende drie weken in een open-label fase en werden vervolgens gerandomiseerd naar Benicar of placebo in een dubbelblinde fase. Aan het einde van de tweede week van stopzetting was de gemiddelde systolische/diastolische bloeddruk bij dal 3/3 mmHg lager in de groep die was gerandomiseerd naar Benicar; dit verschil in bloeddruk was niet statistisch significant (95% BI -2 tot 7/-1 tot 7).
PATIËNT INFORMATIE
Zwangerschap
Adviseer vrouwelijke patiënten in de vruchtbare leeftijd over de gevolgen van blootstelling aan Benicar 20 mg tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Vertel patiënten om zwangerschappen zo snel mogelijk aan hun arts te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven geen borstvoeding te geven tijdens de behandeling met BENICAR [zie: Gebruik bij specifieke populaties ].
Hyperkaliëmie
Adviseer patiënten om geen kaliumsupplementen of zoutvervangers te gebruiken die kalium bevatten zonder hun zorgverlener te raadplegen [zie DRUG-INTERACTIES ].
