Aceon 2mg, 4mg, 8mg Perindopril Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Aceon 4 mg en hoe wordt het gebruikt?
Aceon 8 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hoge bloeddruk (hypertensie) en stabiele coronaire hartziekte (CAD) te behandelen. Aceon kan alleen of met andere medicijnen worden gebruikt.
Aceon behoort tot een klasse geneesmiddelen die ACE-remmers worden genoemd.
Het is niet bekend of Aceon veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Aceon 4 mg?
Aceon kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- zwakheid,
- langzame of onregelmatige hartslag,
- flauwvallen,
- misselijkheid,
- braken,
- verlies van eetlust,
- buikpijn,
- geel worden van ogen of huid (geelzucht),
- donkere urine, en
- ernstige duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Aceon 2 mg zijn:
- duizeligheid,
- duizeligheid,
- vermoeidheid, en
- droge hoest
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Aceon. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ACEON 4 mg. WAARSCHUWINGEN EN VOORZORGSMAATREGELEN
- Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken. WAARSCHUWINGEN EN VOORZORGSMAATREGELEN
OMSCHRIJVING
ACEON® (perindopril erbumine) tabletten bevatten het tert-butylaminezout van perindopril, de ethylester van een niet-sulfhydryl angiotensine-converting enzyme (ACE) -remmer. Perindopril erbumine wordt chemisch beschreven als (2S,3DS,7DS)-1-[(S)-N-[(S)-1-Carboxy-butyl]alanyl]hexahydro-2-indolinecarbonzuur, 1-ethylester, verbinding met tert-butylamine (1:1). De moleculaire formule is C19H32N2O5C4H11N. De structuurformule is:
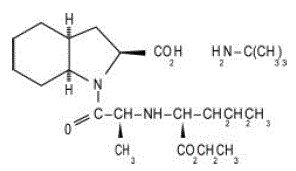
Perindopril erbumine is een wit, kristallijn poeder met een molecuulgewicht van 368,47 (vrij zuur) of 441,61 (zoutvorm). Het is goed oplosbaar in water (60% w/w), alcohol en chloroform.
Perindopril is de vrije zuurvorm van perindopril erbumine, is een prodrug en wordt in vivo gemetaboliseerd door hydrolyse van de estergroep om perindoprilaat te vormen, de biologisch actieve metaboliet.
ACEON is verkrijgbaar in sterktes van 2 mg, 4 mg en 8 mg voor orale toediening. Naast perindopril erbumine bevat elke tablet de volgende inactieve ingrediënten: colloïdaal silica (hydrofoob), lactose, magnesiumstearaat en microkristallijne cellulose. De tabletten van 4 mg en 8 mg bevatten ook ijzeroxide.
INDICATIES
Hypertensie
ACEON is geïndiceerd voor de behandeling van patiënten met essentiële hypertensie. ACEON kan alleen worden gebruikt of samen met andere klassen antihypertensiva, met name thiazidediuretica, worden gegeven.
Stabiele coronaire hartziekte
ACEON 8 mg is geïndiceerd voor de behandeling van patiënten met stabiele coronaire hartziekte om het risico op cardiovasculaire mortaliteit of niet-fataal myocardinfarct te verminderen. ACEON kan worden gebruikt met een conventionele behandeling voor de behandeling van coronaire hartziekte, zoals antibloedplaatjes-, antihypertensiva of lipidenverlagende therapie.
DOSERING EN ADMINISTRATIE
Hypertensie
Gebruik bij ongecompliceerde hypertensieve patiënten
Bij patiënten met essentiële hypertensie is de aanbevolen startdosis 4 mg eenmaal per dag. De dosis kan naar behoefte worden getitreerd tot maximaal 16 mg per dag. Het gebruikelijke onderhoudsdoseringsbereik is 4 mg tot 8 mg, toegediend als een enkele dagelijkse dosis of in twee verdeelde doses.
Gebruik bij oudere patiënten
De aanbevolen startdosering van ACEON 4 mg voor ouderen is 4 mg per dag, verdeeld over één of twee doses. Ervaring met ACEON is beperkt bij ouderen bij doses hoger dan 8 mg. Doseringen hoger dan 8 mg moeten worden toegediend met zorgvuldige bloeddrukcontrole en dosistitratie [zie: Gebruik bij specifieke populaties ].
Gebruik met diuretica
Bij patiënten die momenteel worden behandeld met een diureticum, kan symptomatische hypotensie optreden na de aanvangsdosis ACEON. Overweeg om de dosis diureticum te verlagen voordat u met ACEON begint [zie: DRUG-INTERACTIES ].
Stabiele coronaire hartziekte
Bij patiënten met stabiele coronaire hartziekte dient ACEON 4 mg te worden gegeven in een aanvangsdosis van 4 mg eenmaal daags gedurende 2 weken, en vervolgens, indien getolereerd, te worden verhoogd tot een onderhoudsdosis van 8 mg eenmaal daags. Bij oudere patiënten (ouder dan 70 jaar) moet ACEON worden gegeven als een dosis van 2 mg eenmaal daags in de eerste week, gevolgd door 4 mg eenmaal daags in de tweede week en 8 mg eenmaal daags als onderhoudsdosis, indien verdragen.
Dosisaanpassing bij nierfunctiestoornis en dialyse
De eliminatie van perindoprilaat is verminderd bij patiënten met een nierfunctiestoornis. ACEON wordt niet aanbevolen bij patiënten met een creatinineklaring
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten zijn langwerpig met aan één kant een breukstreep.
De tablet van 2 mg is wit en heeft aan de kant zonder breuk de inscriptie "ACN 2".
De tablet van 4 mg is roze en heeft aan de kant zonder breuk de inscriptie "ACN 4".
De 8 mg-tablet is zalmkleurig en heeft aan de niet-gescoorde zijde de inscriptie "ACN 8".
Opslag en behandeling
Tabletten zijn langwerpig met aan één kant een breukstreep.
Buiten bereik van kinderen bewaren.
Bewaren bij een gecontroleerde kamertemperatuur van 20 ° tot 25 ° C (68 ° tot 77 ° F) (zie USP). Beschermen tegen vocht.
Bel voor meer informatie onze afdeling medische communicatie gratis op 888-985-7657.
Gefabriceerd door: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 VS. Herzien: september 2017
BIJWERKINGEN
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Ervaring met klinische proeven
De volgende bijwerkingen worden elders in de etikettering besproken:
- Anafylactoïde reacties, waaronder angio-oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Neutropenie en agranulocytose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verminderde nierfunctie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hyperkaliëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hoesten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Hypertensie
ACEON 4 mg is beoordeeld op veiligheid bij ongeveer 3.400 patiënten met hypertensie in Amerikaanse en buitenlandse klinische onderzoeken. De hier gepresenteerde gegevens zijn gebaseerd op resultaten van de 1.417 met ACEON behandelde patiënten die deelnamen aan de Amerikaanse klinische onderzoeken. Meer dan 220 van deze patiënten werden gedurende ten minste een jaar behandeld met ACEON® (perindopril erbumine).
In placebogecontroleerde klinische onderzoeken in de VS was de incidentie van voortijdige stopzetting van de therapie als gevolg van bijwerkingen 6,5% bij patiënten die werden behandeld met ACEON 2 mg en 6,7% bij patiënten die werden behandeld met placebo. De meest voorkomende oorzaken waren hoesten, hoofdpijn, asthenie en duizeligheid.
Van de 1.012 patiënten in placebogecontroleerde Amerikaanse onderzoeken was de totale frequentie van gemelde bijwerkingen vergelijkbaar bij patiënten die met ACEON werden behandeld en bij patiënten die met placebo werden behandeld (ongeveer 75% in elke groep). De enige bijwerkingen waarvan de incidentie op ACEON 4 mg ten minste 2% hoger was dan op placebo waren hoesten (12% vs. 4,5%) en rugpijn (5,8% vs. 3,1%).
Duizeligheid werd niet vaker gemeld in de perindoprilgroep (8,2%) dan in de placebogroep (8,5%), maar de kans nam toe met de dosis, wat wijst op een causaal verband met perindopril.
Stabiele coronaire hartziekte
Perindopril is beoordeeld op veiligheid in EUROPA, een dubbelblind, placebogecontroleerd onderzoek bij 12.218 patiënten met stabiel coronair vaatlijden. Het totale percentage van stopzetting was ongeveer 22% op geneesmiddel en placebo. De meest voorkomende medische redenen voor het staken van de behandeling, die vaker voorkwamen met perindopril dan met placebo, waren hoesten, geneesmiddelintolerantie en hypotensie.
Postmarketingervaring
Vrijwillige meldingen van bijwerkingen bij patiënten die ACEON gebruiken en die zijn ontvangen sinds de introductie op de markt en waarvan het oorzakelijk verband met ACEON 8 mg onbekend is, zijn onder meer: hartstilstand, eosinofiele pneumonitis, neutropenie/agranulocytose, pancytopenie, anemie (inclusief hemolytische en aplastische), trombocytopenie, acute nierfalen, nefritis, leverfalen, geelzucht (hepatocellulair of cholestatisch), symptomatische hyponatriëmie, bulleuze pemfigoïd, pemphigus, acute pancreatitis, vallen, psoriasis, exfoliatieve dermatitis en een syndroom dat kan bestaan uit: artralgie/artritis, vasculitis, serositis, myalgie, koorts huiduitslag of andere dermatologische verschijnselen, een positief antinucleair antilichaam (ANA), leukocytose, eosinofilie of een verhoogde erytrocytsedimentatiesnelheid (ESR).
Resultaten van klinische laboratoriumtests
hematologie
Kleine verlagingen van hemoglobine en hematocriet komen vaak voor bij hypertensieve patiënten die worden behandeld met ACEON 8 mg, maar zijn zelden van klinisch belang. In gecontroleerde klinische onderzoeken werd bij geen enkele patiënt de behandeling stopgezet vanwege de ontwikkeling van bloedarmoede. Leukopenie (inclusief neutropenie) werd waargenomen bij 0,1% van de patiënten in klinische onderzoeken in de VS [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Leverfunctietest
Verhogingen van ALAT (1,6% ACEON versus 0,9% placebo) en ASAT (0,5% ACEON 2 mg versus 0,4% placebo) zijn waargenomen in placebogecontroleerde klinische onderzoeken. De verhogingen waren over het algemeen licht en van voorbijgaande aard en verdwenen na stopzetting van de behandeling.
DRUG-INTERACTIES
diuretica
Patiënten die diuretica gebruiken, en vooral degenen die recentelijk zijn gestart, kunnen af en toe een overmatige verlaging van de bloeddruk ervaren na het starten van de behandeling met ACEON. De mogelijkheid van hypotensieve effecten kan worden geminimaliseerd door ofwel de dosis van het diureticum te verlagen of te stoppen, ofwel de zoutinname te verhogen voordat de behandeling met perindopril wordt gestart. Als de diuretische therapie niet kan worden gewijzigd, zorg dan voor nauw medisch toezicht bij de eerste dosis ACEON, gedurende ten minste twee uur en totdat de bloeddruk nog een uur gestabiliseerd is [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De snelheid en mate van absorptie en eliminatie van perindopril worden niet beïnvloed door gelijktijdige diuretica. De biologische beschikbaarheid van perindoprilaat werd echter verminderd door diuretica en dit ging gepaard met een afname van de plasma-ACE-remming.
Kaliumsupplementen en kaliumsparende diuretica
ACEON 8 mg kan het serumkalium verhogen vanwege het vermogen om de aldosteronproductie te verminderen. Het gebruik van kaliumsparende diuretica (spironolacton, amiloride, triamtereen en andere), kaliumsupplementen of andere geneesmiddelen die het serumkalium kunnen verhogen (indomethacine, heparine, ciclosporine en andere) kunnen het risico op hyperkaliëmie verhogen. Controleer daarom, als gelijktijdig gebruik van dergelijke middelen is geïndiceerd, het serumkalium van de patiënt regelmatig.
Lithium
Verhoogd serumlithium en symptomen van lithiumtoxiciteit zijn gemeld bij patiënten die gelijktijdig worden behandeld met lithium en een ACE-remmer. Frequente controle van de serumlithiumconcentratie wordt aanbevolen. Het gebruik van een diureticum kan het risico op lithiumtoxiciteit verder verhogen.
Goud
Nitritoïde reacties (symptomen zijn onder meer blozen in het gezicht, misselijkheid, braken en hypotensie) zijn zelden gemeld bij patiënten die werden behandeld met injecteerbaar goud (natriumaurothiomalaat) en gelijktijdige behandeling met ACE-remmers, waaronder ACEON.
Digoxine
Een gecontroleerd farmacokinetisch onderzoek heeft geen effect aangetoond op de plasmaconcentraties van digoxine bij gelijktijdige toediening met ACEON, maar een effect van digoxine op de plasmaconcentratie van perindopril/perindoprilaat is niet uitgesloten.
Gentamicine
Diergegevens hebben de mogelijkheid van interactie tussen perindopril en gentamicine gesuggereerd. Dit is echter niet onderzocht in studies bij mensen.
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, waaronder selectieve COX-2-remmers, en ACE-remmers, waaronder perindopril, leiden tot een verslechtering van de nierfunctie. , inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die behandeld worden met perindopril en NSAID's.
Het antihypertensieve effect van ACE-remmers, waaronder perindopril, kan worden afgezwakt door NSAID's, waaronder selectieve COX-2-remmers.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie. De meeste patiënten die de combinatie van twee RAS-remmers krijgen, hebben geen extra voordeel ten opzichte van monotherapie. Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die ACEON 2 mg gebruiken en andere middelen die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met ACEON 8 mg bij patiënten met diabetes. Vermijd het gebruik van aliskiren met ACEON 2 mg bij patiënten met een nierfunctiestoornis (GFR
mTOR-remmers
Patiënten die gelijktijdig een behandeling met mTOR-remmers (zoogdierdoelwit van rapamycine) gebruiken, lopen mogelijk een verhoogd risico op angio-oedeem (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Neprilysine-remmer
Patiënten die gelijktijdig neprilysineremmers gebruiken, lopen mogelijk een verhoogd risico op angio-oedeem. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Anafylactoïde en mogelijk gerelateerde reacties
Vermoedelijk omdat angiotensine-converterende enzymremmers het metabolisme van eicosanoïden en polypeptiden beïnvloeden, inclusief endogeen bradykinine, kunnen patiënten die ACE-remmers (inclusief ACEON) krijgen, onderhevig zijn aan een verscheidenheid aan bijwerkingen, waarvan sommige ernstig. Zwarte patiënten die ACE-remmers krijgen, hebben een hogere incidentie van angio-oedeem in vergelijking met niet-zwarte patiënten.
Hoofd- en nekangio-oedeem
Angio-oedeem van het gezicht, extremiteiten, lippen, tong, glottis of strottenhoofd is gemeld bij patiënten die werden behandeld met ACE-remmers, waaronder ACEON (0,1% van de patiënten die met ACEON werden behandeld in klinische onderzoeken in de VS). Angio-oedeem geassocieerd met betrokkenheid van de tong, glottis of strottenhoofd kan fataal zijn. Beëindig in dergelijke gevallen de behandeling met ACEON onmiddellijk en observeer totdat de zwelling verdwijnt. Wanneer betrokkenheid van de tong, glottis of strottenhoofd waarschijnlijk luchtwegobstructie veroorzaakt, dien dan onmiddellijk de juiste therapie toe, zoals subcutane epinefrine-oplossing 1:1000 (0,3 tot 0,5 ml).
Patiënten die gelijktijdig een behandeling met een mTOR-remmer (bijv. temsirolimus) of een neprilysine-remmer krijgen, kunnen een verhoogd risico lopen op angio-oedeem (zie DRUG-INTERACTIES ].
Intestinaal angio-oedeem
Intestinaal angio-oedeem is gemeld bij patiënten die werden behandeld met ACE-remmers. Deze patiënten vertoonden buikpijn (met of zonder misselijkheid of braken); in sommige gevallen was er geen voorgeschiedenis van angio-oedeem in het gezicht en waren de C-1-esterasespiegels normaal. Het angio-oedeem werd gediagnosticeerd door procedures, waaronder CT-scan of echografie van de buik, of tijdens een operatie, en de symptomen verdwenen na het stoppen met de ACE-remmer. Intestinaal angio-oedeem moet worden opgenomen in de differentiële diagnose van patiënten met ACE-remmers die buikpijn hebben.
Hypotensie
ACEON 4 mg kan symptomatische hypotensie veroorzaken. ACEON is in placebogecontroleerde onderzoeken in de VS in verband gebracht met hypotensie bij 0,3% van de patiënten met ongecompliceerde hypertensie. Symptomen gerelateerd aan orthostatische hypotensie werden gemeld bij nog eens 0,8% van de patiënten.
Symptomatische hypotensie komt het meest voor bij patiënten met een volume- of zoutdepletie als gevolg van langdurige behandeling met diuretica, zoutarm dieet, dialyse, diarree of braken [zie DOSERING EN ADMINISTRATIE ].
ACE-remmers kunnen overmatige hypotensie veroorzaken en kunnen gepaard gaan met oligurie of azotemie, en zelden met acuut nierfalen en overlijden. Bij patiënten met ischemische hartziekte of cerebrovasculaire ziekte kan een overmatige bloeddrukdaling leiden tot een myocardinfarct of een cerebrovasculair accident.
Bij patiënten met een risico op overmatige hypotensie, moet de behandeling met ACEON worden gestart onder zeer nauw medisch toezicht. Patiënten moeten de eerste twee weken van de behandeling nauwlettend worden gevolgd en telkens wanneer de dosis ACEON 2 mg en/of diureticum wordt verhoogd.
Als overmatige hypotensie optreedt, moet de patiënt onmiddellijk in rugligging worden gelegd en, indien nodig, worden behandeld met een intraveneuze infusie van fysiologische zoutoplossing. De behandeling met ACEON 4 mg kan gewoonlijk worden voortgezet na herstel van het volume en de bloeddruk.

Neutropenie/Agranulocytose
ACE-remmers zijn in verband gebracht met agranulocytose en beenmergdepressie, het vaakst bij patiënten met nierinsufficiëntie, met name patiënten met een collageenvaatziekte zoals systemische lupus erythematosus of sclerodermie.
Foetale toxiciteit
Zwangerschap Categorie D
Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ACEON 4 mg [zie Gebruik bij specifieke populaties ].
Verminderde nierfunctie
Als gevolg van de remming van het renine-angiotensine-aldosteronsysteem kunnen veranderingen in de nierfunctie worden verwacht bij gevoelige personen. De nierfunctie moet periodiek worden gecontroleerd bij patiënten die ACEON krijgen [zie: DOSERING EN ADMINISTRATIE ], [zien DRUG-INTERACTIES ].
Bij patiënten met ernstig congestief hartfalen, waarbij de nierfunctie kan afhangen van de activiteit van het renine-angiotensinaldosteronsysteem, kan behandeling met ACE-remmers, waaronder ACEON, gepaard gaan met oligurie, progressieve azotemie en, in zeldzame gevallen, acuut nierfalen en overlijden.
Bij hypertensieve patiënten met unilaterale of bilaterale nierarteriestenose kunnen verhogingen van bloedureumstikstof en serumcreatinine optreden; gewoonlijk reversibel na stopzetting van de ACE-remmer. Bij dergelijke patiënten moet de nierfunctie tijdens de eerste paar weken van de behandeling worden gecontroleerd.
Sommige met ACEON behandelde patiënten hebben lichte en voorbijgaande verhogingen van bloedureumstikstof en serumcreatinine ontwikkeld, vooral bij patiënten die gelijktijdig met een diureticum werden behandeld.
Hyperkaliëmie
Verhogingen van het serumkalium zijn waargenomen bij sommige patiënten die werden behandeld met ACE-remmers, waaronder ACEON. De meeste gevallen waren geïsoleerde enkelvoudige waarden die niet klinisch relevant leken en zelden een reden waren voor ontwenning. Risicofactoren voor de ontwikkeling van hyperkaliëmie zijn onder meer nierinsufficiëntie, diabetes mellitus en het gelijktijdig gebruik van middelen zoals kaliumsparende diuretica, kaliumsupplementen en/of kaliumbevattende zoutvervangers [zie DRUG-INTERACTIES ].
Serumkalium moet periodiek worden gecontroleerd bij patiënten die ACEON krijgen.
Hoesten
Vermoedelijk vanwege de remming van de afbraak van endogeen bradykinine, is bij alle ACE-remmers aanhoudende niet-productieve hoest gemeld, die over het algemeen verdwijnt na stopzetting van de therapie. Overweeg door ACE-remmers geïnduceerde hoest bij de differentiële diagnose van hoest.
Leverfalen
Zelden zijn ACE-remmers in verband gebracht met een syndroom dat begint met cholestatische geelzucht en zich ontwikkelt tot fulminante levernecrose en soms tot de dood. Het mechanisme van dit syndroom wordt niet begrepen. Patiënten die ACE-remmers krijgen en die geelzucht of duidelijke verhogingen van leverenzymen ontwikkelen, moeten stoppen met de ACE-remmer en passende medische follow-up krijgen.
Chirurgie/anesthesie
Bij patiënten die een operatie ondergaan of tijdens anesthesie met middelen die hypotensie veroorzaken, kan ACEON de vorming van angiotensine II blokkeren die anders zou optreden als gevolg van compenserende renineafgifte. Hypotensie die aan dit mechanisme kan worden toegeschreven, kan worden gecorrigeerd door volume-expansie.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
kankerverwekkendheid
Er is geen bewijs van carcinogeen effect waargenomen in onderzoeken bij ratten en muizen wanneer perindopril werd toegediend in doseringen tot 20 keer (mg/kg) of 2 tot 4 keer (mg/m2) de maximale voorgestelde klinische doses (16 mg/dag) voor 104 weken.
Mutagenese
Er werd geen genotoxisch potentieel gedetecteerd voor ACEON, perindoprilaat en andere metabolieten in verschillende in vitro en in vivo onderzoeken, waaronder de Ames-test, de Saccharomyces cerevisiae D4-test, gekweekte menselijke lymfocyten, TK ± muislymfoomtest, micronucleustests bij muizen en ratten en Chinese hamsters beenmerg test.
Aantasting van de vruchtbaarheid
Er was geen significant effect op de reproductieprestaties of vruchtbaarheid bij ratten die tot 30 keer (mg/kg) of 6 keer (mg/m2) de voorgestelde maximale klinische dosering van ACEON 2 mg kregen tijdens de periode van spermatogenese bij mannetjes of oogenese en dracht bij vrouwen.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie D [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met ACEON. Deze bijwerkingen worden meestal geassocieerd met het gebruik van deze geneesmiddelen in het tweede en derde trimester van de zwangerschap. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva.
Passende behandeling van maternale hypertensie tijdens de zwangerschap is belangrijk om de resultaten voor zowel moeder als foetus te optimaliseren.
In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus. Voer seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Als oligohydramnion wordt waargenomen, stop dan met ACEON 2 mg, tenzij het als levensreddend voor de moeder wordt beschouwd. Afhankelijk van de week van de zwangerschap kan foetaal testen aangewezen zijn. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen. Observeer nauwkeurig zuigelingen met een geschiedenis van in utero blootstelling aan ACEON voor hypotensie, oligurie en hyperkaliëmie [zie Pediatrisch gebruik ].
Radioactiviteit was detecteerbaar bij foetussen na toediening van 14C-perindopril aan zwangere ratten.
Moeders die borstvoeding geven
Melk van zogende ratten bevatte radioactiviteit na toediening van 14C-perindopril. Het is niet bekend of perindopril wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer ACEON wordt gegeven aan moeders die borstvoeding geven.
Pediatrisch gebruik
Pasgeborenen met een geschiedenis van blootstelling in de baarmoeder aan ACEON
Als oligurie of hypotensie optreedt, richt de aandacht dan op ondersteuning van de bloeddruk en nierperfusie. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen. Perindopril, dat de placenta passeert, kan in theorie op deze manier uit de neonatale circulatie worden verwijderd, maar beperkte ervaring heeft niet aangetoond dat een dergelijke verwijdering centraal staat bij de behandeling van deze zuigelingen.
De veiligheid en werkzaamheid van ACEON 8 mg bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Het gemiddelde bloeddrukeffect van perindopril was iets kleiner bij patiënten ouder dan 60 dan bij jongere patiënten, hoewel het verschil niet significant was. De plasmaconcentraties van zowel perindopril als perindoprilaat waren verhoogd bij oudere patiënten in vergelijking met concentraties bij jongere patiënten. Er waren geen duidelijke toenamen van bijwerkingen bij oudere patiënten, met uitzondering van duizeligheid en mogelijk huiduitslag.
Begin met een lage dosis en titreer indien nodig langzaam. Controleer op duizeligheid vanwege de kans op vallen.
Ervaring met ACEON 8 mg bij oudere patiënten bij dagelijkse doses hoger dan 8 mg is beperkt.
Nierfunctiestoornis
Aanpassing van de dosering kan nodig zijn bij patiënten met nierinsufficiëntie [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
De biologische beschikbaarheid van perindoprilaat is verhoogd bij patiënten met een verminderde leverfunctie [zie: KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Bij dieren waren doses van perindopril tot 2500 mg/kg bij muizen, 3000 mg/kg bij ratten en 1600 mg/kg bij honden niet dodelijk. Ervaringen uit het verleden waren schaars, maar suggereerden dat overdosering met andere ACE-remmers ook redelijk goed werd verdragen door mensen. De meest waarschijnlijke manifestatie is hypotensie en de behandeling moet symptomatisch en ondersteunend zijn. De therapie met de ACE-remmer moet worden stopgezet en de patiënt moet worden geobserveerd. Uitdroging, verstoring van de elektrolytenbalans en hypotensie moeten volgens vaste procedures worden behandeld.
Van de gemelde gevallen van overdosering met perindopril hadden patiënten van wie bekend was dat ze een dosis van 80 mg tot 120 mg hadden ingenomen, geassisteerde beademing en ondersteuning van de bloedsomloop nodig. Een andere patiënt ontwikkelde onderkoeling, circulatiestilstand en stierf na inname van maximaal 180 mg perindopril. De interventie voor een overdosis perindopril kan krachtige ondersteuning vereisen.
Laboratoriumbepalingen van de serumspiegels van perindopril en zijn metabolieten zijn niet algemeen beschikbaar, en dergelijke bepalingen hebben in ieder geval geen bewezen rol bij de behandeling van een overdosis perindopril.
Er zijn geen gegevens beschikbaar die fysiologische manoeuvres suggereren (bijv. manoeuvres om de pH van de urine te veranderen) die de eliminatie van perindopril en zijn metabolieten zouden kunnen versnellen. Perindopril kan worden verwijderd door hemodialyse, met een klaring van 52 ml/min voor perindopril en 67 ml/min voor perindoprilaat.
Angiotensine II zou vermoedelijk kunnen dienen als een specifiek antagonistisch tegengif bij de behandeling van een overdosis perindopril, maar angiotensine II is in wezen niet beschikbaar buiten verspreide onderzoeksfaciliteiten. Omdat het hypotensieve effect van perindopril wordt bereikt door vasodilatatie en effectieve hypovolemie, is het redelijk om een overdosis perindopril te behandelen door infusie van een normale zoutoplossing.
CONTRA-INDICATIES
ACEON® (perindopril erbumine) is gecontra-indiceerd bij patiënten waarvan bekend is dat ze overgevoelig zijn (inclusief angio-oedeem) voor dit product of voor een andere ACE-remmer. ACEON 4 mg is ook gecontra-indiceerd bij patiënten met erfelijk of idiopathisch angio-oedeem.
Dien aliskiren niet gelijktijdig toe met ACEON bij patiënten met diabetes. [zien DRUG-INTERACTIES ]
ACEON is gecontra-indiceerd in combinatie met neprilysineremmer (bijv. sacubitril). Dien ACEON 8 mg niet toe binnen 36 uur na overschakeling op of van sacubitril/valsartan, een neprilysineremmer (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
ACEON® (perindopril erbumine) is een pro-drug voor perindoprilaat, dat ACE remt bij mensen en dieren. Aangenomen wordt dat het mechanisme waardoor perindoprilaat de bloeddruk verlaagt voornamelijk de remming van de ACE-activiteit is. ACE is een peptidyldipeptidase dat de omzetting van het inactieve decapeptide, angiotensine I, in de vasoconstrictor, angiotensine II, katalyseert. Angiotensine II is een krachtige perifere vasoconstrictor, die de aldosteronsecretie door de bijnierschors stimuleert en negatieve feedback geeft op de reninesecretie. Remming van ACE resulteert in verlaagd plasma-angiotensine II, wat leidt tot verminderde vasoconstrictie, verhoogde plasmarenine-activiteit en verminderde aldosteronsecretie. Dit laatste resulteert in diurese en natriurese en kan gepaard gaan met een kleine verhoging van het serumkalium.
ACE is identiek aan kininase II, een enzym dat bradykinine afbreekt. Of verhoogde niveaus van bradykinine, een krachtig vasodepressor-peptide, een rol spelen bij de therapeutische effecten van ACEON 4 mg, moet nog worden opgehelderd.
Hoewel wordt aangenomen dat het belangrijkste mechanisme van perindopril bij bloeddrukverlaging via het renine-angiotensinaldosteronsysteem verloopt, hebben ACE-remmers enig effect, zelfs bij schijnbare hypertensie met een laag renine. Perindopril is onderzocht bij relatief weinig negroïde patiënten, gewoonlijk een populatie met een laag reninegehalte, en de gemiddelde respons van diastolische bloeddruk op perindopril was ongeveer de helft van de respons die werd gezien bij niet-negroïde patiënten, een bevinding die overeenkomt met eerdere ervaring met andere ACE-remmers.
farmacodynamiek
Na toediening van perindopril wordt ACE geremd op een dosis- en bloedconcentratie-gerelateerde manier, waarbij de maximale remming van 80 tot 90% bereikt wordt door 8 mg gedurende 10 tot 12 uur. Vierentwintig uur ACE-remming is ongeveer 60% na deze doses. De mate van ACE-remming die door een bepaalde dosis wordt bereikt, lijkt in de loop van de tijd af te nemen (de ID50 neemt toe). De pressorrespons op een angiotensine I-infusie wordt verminderd door perindopril, maar dit effect is niet zo persistent als het effect op ACE; er is ongeveer 35% remming 24 uur na een dosis van 12 mg.
Farmacokinetiek
Absorptie
Orale toediening van ACEON resulteert in piekplasmaconcentraties die optreden na ongeveer 1 uur. De absolute orale biologische beschikbaarheid van perindopril is ongeveer 75%. Na absorptie wordt ongeveer 30 tot 50% van het systemisch beschikbare perindopril gehydrolyseerd tot zijn actieve metaboliet, perindoprilaat, met een gemiddelde biologische beschikbaarheid van ongeveer 25%. Piekplasmaconcentraties van perindoprilaat worden 3 tot 7 uur na toediening van perindopril bereikt. Orale toediening van ACEON 8 mg met voedsel verlaagt de snelheid of mate van absorptie van perindopril niet significant in vergelijking met nuchtere toestand. De mate van biotransformatie van perindopril tot de actieve metaboliet, perindoprilaat, is echter met ongeveer 43% verminderd, wat resulteert in een verlaging van de plasma-ACE-remmingscurve van ongeveer 20%, waarschijnlijk klinisch niet significant. In klinische onderzoeken werd perindopril over het algemeen toegediend in een niet-nuchtere toestand.
Met 4 mg, 8 mg en 16 mg doses ACEON, stijgen de Cmax en AUC van perindopril en perindoprilaat op een dosisproportionele manier na zowel een enkelvoudige orale dosering als bij steady state tijdens een eenmaal daags meervoudig doseringsschema.
Verdeling
Ongeveer 60% van het circulerende perindopril is gebonden aan plasma-eiwitten en slechts 10 tot 20% van perindoprilaat is gebonden. Daarom worden geneesmiddelinteracties gemedieerd door effecten op eiwitbinding niet verwacht.
Metabolisme en eliminatie
Na orale toediening vertoont perindopril een farmacokinetiek met meerdere compartimenten, waaronder een diep weefselcompartiment (ACE-bindingsplaatsen). De gemiddelde halfwaardetijd van perindopril geassocieerd met het grootste deel van de eliminatie ervan is ongeveer 0,8 tot 1 uur.
Perindopril wordt uitgebreid gemetaboliseerd na orale toediening, waarbij slechts 4 tot 12% van de dosis onveranderd in de urine wordt teruggevonden. Er zijn zes metabolieten geïdentificeerd die het resultaat zijn van hydrolyse, glucuronidering en cyclisatie via dehydratie. Deze omvatten de actieve ACE-remmer, perindoprilaat (gehydrolyseerd perindopril), perindopril en perindoprilaatglucuroniden, gedehydrateerd perindopril en de diastereo-isomeren van gedehydrateerd perindoprilaat. Bij mensen blijkt leveresterase verantwoordelijk te zijn voor de hydrolyse van perindopril.
De actieve metaboliet, perindoprilaat, vertoont ook een farmacokinetiek met meerdere compartimenten na orale toediening van ACEON. De vorming van perindoprilaat verloopt geleidelijk, met piekplasmaconcentraties tussen 3 en 7 uur. De daaropvolgende afname van de plasmaconcentratie vertoont een schijnbare gemiddelde halfwaardetijd van 3 tot 10 uur voor het grootste deel van de eliminatie, met een verlengde terminale eliminatiehalfwaardetijd van 30 tot 120 uur als gevolg van langzame dissociatie van perindoprilaat van plasma/weefsel ACE-binding plaatsen. Bij herhaalde orale eenmaal daagse toediening van perindopril accumuleert perindoprilaat ongeveer 1,5 tot 2 keer en bereikt het steady-state plasmaspiegels in 3 tot 6 dagen. De klaring van perindoprilaat en zijn metabolieten is bijna uitsluitend renaal.
Ouderen
De plasmaconcentraties van zowel perindopril als perindoprilaat bij oudere patiënten (ouder dan 70 jaar) zijn ongeveer tweemaal zo hoog als die waargenomen bij jongere patiënten, wat zowel een verhoogde omzetting van perindopril in perindoprilaat als een verminderde renale excretie van perindoprilaat weerspiegelt (zie DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Hartfalen
De klaring van perindoprilaat is verminderd bij patiënten met congestief hartfalen, wat resulteert in een 40% hogere AUC van het dosisinterval.
Nierfunctiestoornis
Bij perindoprildoses van 2 mg tot 4 mg neemt de AUC van perindoprilaat toe met een afnemende nierfunctie. Bij een creatinineklaring van 30 tot 80 ml/min is de AUC ongeveer het dubbele van die bij 100 ml/min. Wanneer de creatinineklaring onder 30 ml/min daalt, neemt de AUC meer uitgesproken toe.
Bij een beperkt aantal onderzochte patiënten varieerde de perindoprilklaring door dialyse van ongeveer 40 tot 80 ml/min. De klaring van perindoprilaat door dialyse varieerde van ongeveer 40 tot 90 ml/min [zie: DOSERING EN ADMINISTRATIE ].
Leverfunctiestoornis
De biologische beschikbaarheid van perindoprilaat is verhoogd bij patiënten met een verminderde leverfunctie. De plasmaconcentraties van perindoprilaat bij patiënten met een gestoorde leverfunctie waren ongeveer 50% hoger dan die waargenomen bij gezonde proefpersonen of hypertensieve patiënten met een normale leverfunctie.
Klinische studies
Hypertensie
In placebogecontroleerde onderzoeken naar monotherapie met perindopril (2 mg tot 16 mg eenmaal daags) bij patiënten met een gemiddelde bloeddruk van ongeveer 150/100 mm Hg, had 2 mg weinig effect, maar doses van 4 mg tot 16 mg verlaagden de bloeddruk. De doses van 8 mg en 16 mg waren niet van elkaar te onderscheiden en beide hadden een groter effect dan de dosis van 4 mg. In deze onderzoeken gaven doses van 8 mg en 16 mg per dag liggende, dalbloeddrukverlagingen van 9 tot 15/5 tot 6 mm Hg. Wanneer eenmaal daagse en tweemaal daagse dosering werden vergeleken, was het tweemaal daagse doseringsregime over het algemeen iets beter, maar met niet meer dan ongeveer 0,5 mm Hg tot 1 mm Hg. Na doses perindopril van 2 mg tot 16 mg waren de dalgemiddelde systolische en diastolische bloeddrukeffecten ongeveer 75 tot 100% van de piekeffecten.
De effecten van perindopril op de bloeddruk waren vergelijkbaar wanneer het alleen werd gegeven of op een achtergrond van 25 mg hydrochloorthiazide. Over het algemeen trad het effect van perindopril onmiddellijk op, waarbij de effecten gedurende enkele weken licht toenamen.
Formele interactiestudies van ACEON® (perindopril erbumine) zijn niet uitgevoerd met andere antihypertensiva dan thiaziden. Beperkte ervaring in gecontroleerde en ongecontroleerde onderzoeken waarbij ACEON 2 mg gelijktijdig werd toegediend met een calciumkanaalblokker, een lisdiureticum of drievoudige therapie (bètablokker, vasodilatator en een diureticum), suggereert geen onverwachte interacties. Over het algemeen hebben ACE-remmers minder dan additieve effecten wanneer ze worden gegeven met bèta-adrenerge blokkers, vermoedelijk omdat beide gedeeltelijk werken via het renine-angiotensinesysteem.
In ongecontroleerde onderzoeken bij patiënten met insulineafhankelijke diabetes leek perindopril de glykemische controle niet te beïnvloeden. Bij langdurig gebruik werd bij deze patiënten geen effect op de eiwituitscheiding via de urine waargenomen.
De werkzaamheid van ACEON 4 mg werd niet beïnvloed door geslacht en was minder werkzaam bij negroïde patiënten dan bij niet-negroïde patiënten. Bij oudere patiënten (ouder dan of gelijk aan 60 jaar) was het gemiddelde bloeddrukeffect iets kleiner dan bij jongere patiënten, hoewel het verschil niet significant was.
Stabiele coronaire hartziekte
Het EURopese onderzoek naar de reductie van cardiale gebeurtenissen met perindopril bij stabiele coronaire hartziekte (EUROPA) was een multicenter, gerandomiseerde, dubbelblinde en placebo-gecontroleerde studie die werd uitgevoerd bij 12.218 patiënten met aanwijzingen voor stabiele coronaire hartziekte zonder klinisch hartfalen. Patiënten hadden bewijs van coronaire hartziekte gedocumenteerd door eerder myocardinfarct meer dan 3 maanden vóór screening, coronaire revascularisatie meer dan 6 maanden vóór screening, angiografische aanwijzingen van stenose (ten minste 70% vernauwing van één of meer belangrijke kransslagaders) of positieve stress test bij mannen met een voorgeschiedenis van pijn op de borst. Na een aanloopperiode van 4 weken waarin alle patiënten perindopril 2 mg tot 8 mg kregen, werden de patiënten willekeurig toegewezen aan perindopril 8 mg eenmaal daags (n=6.110) of een overeenkomende placebo (n=6.108). De gemiddelde follow-up was 4,2 jaar. De studie onderzocht de langetermijneffecten van perindopril op de tijd tot het eerste voorval van cardiovasculaire mortaliteit, niet-fataal myocardinfarct of hartstilstand bij patiënten met stabiele coronaire hartziekte.
De gemiddelde leeftijd van de patiënten was 60 jaar; 85% was man, 92% slikte bloedplaatjesremmers, 63% slikte -blokkers en 56% onderging lipidenverlagende therapie. De EUROPA-studie toonde aan dat perindopril het relatieve risico voor de primaire eindpuntgebeurtenissen significant verminderde (tabel 1). Dit gunstige effect is grotendeels toe te schrijven aan een vermindering van het risico op een niet-fataal myocardinfarct. Dit gunstige effect van perindopril op de primaire uitkomst was duidelijk na ongeveer een jaar behandeling (Figuur 1). De uitkomst was vergelijkbaar in alle vooraf gedefinieerde subgroepen naar leeftijd, onderliggende ziekte of gelijktijdige medicatie (Figuur 2).
Afbeelding 1. Tijd tot eerste optreden van primair eindpunt 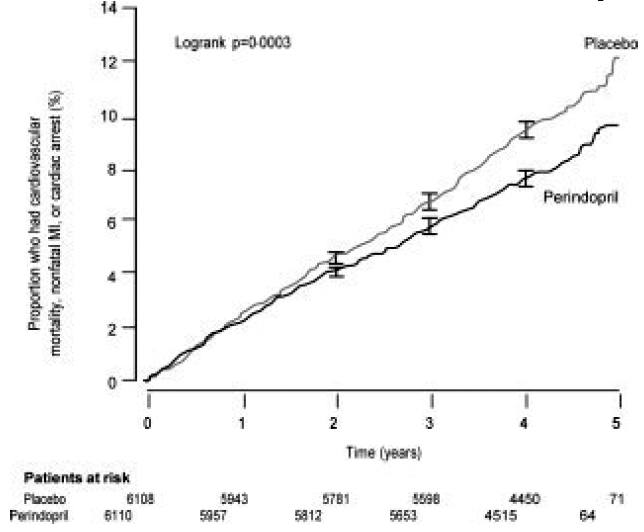
Afbeelding 2. Gunstig effect van behandeling met perindopril op het primaire eindpunt in vooraf gedefinieerde subgroepen 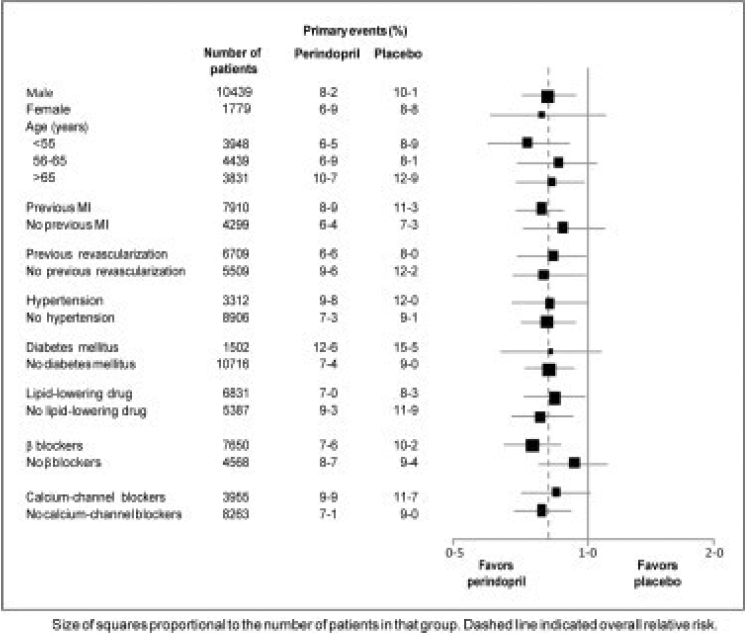
PATIËNT INFORMATIE
Vrouwelijke patiënten in de vruchtbare leeftijd moeten worden geïnformeerd over de gevolgen van blootstelling aan ACEON 2 mg tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Patiënten moeten worden gevraagd zwangerschappen zo snel mogelijk aan hun arts te melden.
Vertel patiënten dat ze elke indicatie van infectie (bijv. keelpijn, koorts) die een teken van neutropenie kunnen zijn, onmiddellijk moeten melden.
