Cozaar 25mg, 50mg, 100mg Losartan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Cozaar 50 mg en hoe wordt het gebruikt?
Cozaar is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hoge bloeddruk (hypertensie) te behandelen, het risico op een beroerte te verlagen bij bepaalde mensen met hartaandoeningen en diabetische zenuwpijn (neuropathie). Cozaar 100 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Cozaar 25 mg behoort tot een klasse geneesmiddelen die angiotensine II-receptorantagonist (ARB's) wordt genoemd.
Het is niet bekend of Cozaar 25 mg veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Cozaar 100 mg?
Cozaar 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- pijn of een branderig gevoel bij het plassen,
- misselijkheid,
- zwakheid,
- tintelend gevoel,
- pijn op de borst,
- onregelmatige hartslagen,
- verlies van bewegingen,
- weinig of geen plassen,
- snelle gewichtstoename, en
- zwelling in uw handen, voeten of enkels
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Cozaar zijn:
- duizeligheid,
- rugpijn, en
- verkoudheidsverschijnselen (verstopte neus, niezen, keelpijn)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cozaar. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met COZAAR. Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OMSCHRIJVING
COZAAR (kaliumlosartan) is een angiotensine II-receptorblokker die inwerkt op het AT1-receptorsubtype. Kaliumlosartan, een niet-peptidemolecuul, wordt chemisch beschreven als 2-butyl-4-chloor-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol-5-methanolmonokaliumzout.
De empirische formule is C22H22ClKN6O en de structuurformule is:
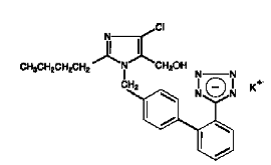
Kaliumlosartan is een wit tot gebroken wit vrijstromend kristallijn poeder met een molecuulgewicht van 461,01. Het is vrij oplosbaar in water, oplosbaar in alcoholen en slecht oplosbaar in gewone organische oplosmiddelen, zoals acetonitril en methylethylketon. Oxidatie van de 5-hydroxymethylgroep op de imidazoolring resulteert in de actieve metaboliet van losartan.
COZAAR 100 mg is verkrijgbaar als tabletten voor orale toediening die 25 mg, 50 mg of 100 mg kaliumlosartan en de volgende inactieve ingrediënten bevatten: microkristallijne cellulose, waterhoudende lactose, gepregelatiniseerd zetmeel, magnesiumstearaat, hydroxypropylcellulose, hypromellose en titaniumdioxide.
COZAAR 25 mg, 50 mg en 100 mg tabletten bevatten kalium in de volgende hoeveelheden: respectievelijk 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) en 8,48 mg (0,216 mEq). COZAAR 25 mg, COZAAR 50 mg en COZAAR 100 mg kunnen ook carnaubawas bevatten.
INDICATIES
Hypertensie
COZAAR® is geïndiceerd voor de behandeling van hypertensie bij volwassenen en pediatrische patiënten van 6 jaar en ouder, om de bloeddruk te verlagen. Het verlagen van de bloeddruk verlaagt het risico op fatale en niet-fatale cardiovasculaire (CV) gebeurtenissen, voornamelijk beroertes en myocardinfarct. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een groot aantal verschillende farmacologische klassen, waaronder losartan.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan 1 medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van het Joint National Committeeon Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, van verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de drugs, dat is grotendeels verantwoordelijk voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en van dergelijke patiënten wordt verwacht dat ze er baat bij hebben van een agressievere behandeling tot een doel voor een lagere bloeddruk.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
COZAAR kan met andere antihypertensiva worden toegediend.
Hypertensieve patiënten met linkerventrikelhypertrofie
COZAAR 25 mg is geïndiceerd om het risico op een beroerte te verminderen bij patiënten met hypertensie en linkerventrikelhypertrofie, maar er zijn aanwijzingen dat dit voordeel niet van toepassing is op zwarte patiënten [zie Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ] .
Nefropathie bij type 2 diabetespatiënten
COZAAR is geïndiceerd voor de behandeling van diabetische nefropathie met een verhoogd serumcreatinine en proteïnurie (urine-albumine/creatinineverhouding ≥ 300 mg/g) bij patiënten met type 2-diabetes en een voorgeschiedenis van hypertensie. In deze populatie vermindert COZAAR 50 mg de snelheid van progressie van nefropathie, zoals gemeten door het optreden van een verdubbeling van het serumcreatinine of terminale nierziekte (noodzaak van dialyse of niertransplantatie) [zie Klinische studies ] .
DOSERING EN ADMINISTRATIE
Hypertensie
Hypertensie bij volwassenen
De gebruikelijke startdosering van COZAAR 50 mg is eenmaal daags 50 mg. De dosering kan naar behoefte worden verhoogd tot een maximale dosis van 100 mg eenmaal daags om de bloeddruk onder controle te houden [zie: Klinische studies ] . Een startdosis van 25 mg wordt aanbevolen voor patiënten met mogelijke intravasculaire depletie (bijv. bij behandeling met diuretica).
Pediatrische hypertensie
De gebruikelijke aanbevolen startdosering is 0,7 mg per kg eenmaal daags (tot 50 mg in totaal), toegediend als tablet of suspensie [zie Bereiding van suspensie (voor 200 ml van een suspensie van 2,5 mg / ml) ] .De dosering moet worden aangepast aan de reactie van de bloeddruk. Doses hoger dan 1,4 mg per kg (of meer dan 100 mg) per dag zijn niet onderzocht bij pediatrische patiënten [zie: KLINISCHE FARMACOLOGIE , Klinische studies en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] .
COZAAR wordt niet aanbevolen bij pediatrische patiënten jonger dan 6 jaar of bij pediatrische patiënten met een geschatte glomerulaire filtratiesnelheid van minder dan 30 ml/min/1,73 m2 [zie Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE en Klinische studies ] .
Hypertensieve patiënten met linkerventrikelhypertrofie
De gebruikelijke startdosering is eenmaal daags 50 mg COZAAR. Hydrochloorthiazide 12,5 mg per dag moet worden toegevoegd en/of de dosis COZAAR moet worden verhoogd tot 100 mg eenmaal per dag, gevolgd door een verhoging van hydrochloorthiazide tot 25 mg eenmaal per dag op basis van de bloeddrukrespons (zie Klinische studies ] .
Nefropathie bij type 2 diabetespatiënten
De gebruikelijke startdosering is eenmaal daags 50 mg. De dosis moet worden verhoogd tot eenmaal daags 100 mg op basis van de bloeddrukrespons [zie: Klinische studies ] .
Doseringsaanpassingen bij patiënten met leverinsufficiëntie
Bij patiënten met een lichte tot matige leverfunctiestoornis is de aanbevolen startdosering van COZAAR 25 mg eenmaal daags. COZAAR is niet onderzocht bij patiënten met een ernstige leverfunctiestoornis [zie: Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ] .
Bereiding van suspensie (voor 200 ml van een suspensie van 2,5 mg / ml)
Voeg 10 ml gezuiverd water USP toe aan een 8 ounce (240 ml) amberkleurige polyethyleentereftalaat (PET) fles met tien 50 mg COZAAR-tabletten. Onmiddellijk minstens 2 minuten schudden. Laat het concentraat 1 uur staan en schud vervolgens 1 minuut om de tabletinhoud te verspreiden. Bereid afzonderlijk een 50/50 volumetrisch mengsel van Ora-Plus™ en Ora-Sweet SF™. Voeg 190 ml van het 50/50 Ora-Plus™/Ora-Sweet SF™-mengsel toe aan de tablet en de watersuspensie in de PET-fles en schud gedurende 1 minuut om de ingrediënten te verspreiden. De suspensie moet worden gekoeld bij 2-8°C (36-46°F) en kan maximaal 4 weken worden bewaard. Schud de suspensie voor elk gebruik en plaats onmiddellijk terug in de koelkast.
HOE GELEVERD
Doseringsvormen en sterke punten
- COZAAR 100 mg, 25 mg, zijn witte, ovale, filmomhulde tabletten met aan één zijde code 951.
- COZAAR, 50 mg, zijn witte, ovale, filmomhulde tabletten met aan de ene kant code 952 en aan de andere kant een breukstreep.
- COZAAR 25 mg, 100 mg, zijn witte, druppelvormige, filmomhulde tabletten met aan één zijde code 960.
Opslag en behandeling
COZAAR is een witte filmomhulde tablet die als volgt wordt geleverd:
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP-gecontroleerde kamertemperatuur]. Houd de container goed gesloten. Bescherm tegen licht.
Gefabriceerd voor: Organon LLC, een dochteronderneming van ORGANON & Co., Jersey City, NJ 07302, VS. Herzien: oktober 2021.
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Hypertensie
COZAAR is beoordeeld op veiligheid bij meer dan 3300 volwassen patiënten die werden behandeld voor essentiële hypertensie en in totaal 4058 patiënten/proefpersonen. Meer dan 1200 patiënten werden gedurende meer dan 6 maanden behandeld en meer dan 800 gedurende meer dan een jaar.
Behandeling met COZAAR 25 mg werd goed verdragen met een totale incidentie van bijwerkingen die vergelijkbaar was met die van placebo. In gecontroleerde klinische onderzoeken trad stopzetting van de therapie voor bijwerkingen op bij 2,3% van de patiënten die werden behandeld met COZAAR 25 mg en bij 3,7% van de patiënten die placebo kregen. In 4 klinische onderzoeken met meer dan 1000 patiënten met verschillende doses (10-150 mg) kaliumlosartan en meer dan 300 patiënten die placebo kregen, waren de bijwerkingen die optraden bij ≥2% van de patiënten die werden behandeld met COZAAR 25 mg en vaker dan placebo: duizeligheid (3 % vs. 2%), infectie van de bovenste luchtwegen (8% vs. 7%), verstopte neus (2% vs. 1%) en rugpijn (2% vs. 1%).
De volgende minder vaak voorkomende bijwerkingen zijn gemeld:
Bloed- en lymfestelselaandoeningen: Bloedarmoede.
Psychische stoornissen: Depressie.
Zenuwstelselaandoeningen: Slaperigheid, hoofdpijn, slaapstoornissen, paresthesie, migraine.
Oor- en labyrintaandoeningen: Duizeligheid, oorsuizen.
Hartaandoeningen: Hartkloppingen, syncope, atriale fibrillatie, CVA.
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: Dyspneu.
Maagdarmstelselaandoeningen: Buikpijn, constipatie, misselijkheid, braken.
Huid- en onderhuidaandoeningen: Urticaria, pruritus, huiduitslag, lichtgevoeligheid.
Skeletspierstelsel- en bindweefselaandoeningen: Myalgie, artralgie.
Voortplantingsstelsel- en borstaandoeningen: Impotentie.
Algemene aandoeningen en toedieningsplaatsstoornissen: Oedeem.
Hoesten
Aanhoudende droge hoest (met een incidentie van enkele procenten) is in verband gebracht met het gebruik van ACE-remmers en kan in de praktijk een reden zijn om de behandeling met ACE-remmers te staken. Er werden twee prospectieve, dubbelblinde, gerandomiseerde, gecontroleerde onderzoeken met parallelle groepen uitgevoerd om de effecten van losartan op de incidentie van hoestpatiënten met hypertensie die hoesten hadden tijdens behandeling met een ACE-remmer te beoordelen. Patiënten die typische ACE-remmer hoesten hadden wanneer ze werden uitgedaagd met lisinopril, van wie de hoest verdween met placebo, werden gerandomiseerd naar losartan 50 mg, lisinopril 20 mg of placebo (één studie, n=97) of 25 mg hydrochloorthiazide (n=135). De dubbelblinde behandelingsperiode duurde maximaal 8 weken. De incidentie van hoest wordt weergegeven in tabel 1 hieronder.
Deze onderzoeken tonen aan dat de incidentie van hoest geassocieerd met therapie met losartan, in een populatie die allemaal hoest had geassocieerd met therapie met ACE-remmers, vergelijkbaar is met die geassocieerd met hydrochloorthiazide- of placebotherapie.
Gevallen van hoest, waaronder positieve nieuwe provocaties, zijn gemeld bij het gebruik van losartan tijdens postmarketingervaring.
Hypertensieve patiënten met linkerventrikelhypertrofie
In de Losartan Intervention for Endpoint (LIFE)-studie waren de bijwerkingen met COZAAR 100 mg vergelijkbaar met de bijwerkingen die eerder werden gemeld voor patiënten met hypertensie.
Nefropathie bij type 2 diabetespatiënten
In de Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan (RENAAL)-studie onder 1513 patiënten die werden behandeld met COZAAR 100 mg orplacebo, was de totale incidentie van gemelde bijwerkingen vergelijkbaar voor de twee groepen. Stopzetting van COZAAR vanwege bijwerkingen was vergelijkbaar met placebo (19% voor COZAAR 100 mg, 24% voor placebo). De bijwerkingen, ongeacht de geneesmiddelrelatie, die werden gemeld met een incidentie van ≥4% van de patiënten die werden behandeld met COZAAR 50 mg en die optraden met een verschil van ≥2% in de losartangroep versus placebo tegen een achtergrond van conventionele antihypertensiva, waren asthenie/vermoeidheid, pijn op de borst , hypotensie, orthostatische hypotensie, diarree, bloedarmoede, hyperkaliëmie, hypoglykemie, rugpijn, spierzwakte en urineweginfectie.
Postmarketingervaring
De volgende aanvullende bijwerkingen zijn gemeld tijdens postmarketingervaring met COZAAR. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om hun frequentie betrouwbaar in te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen:
spijsvertering: Hepatitis.
Algemene aandoeningen en toedieningsplaatsvoorwaarden: Malaise.
Hematologische: Trombocytopenie.
Overgevoeligheid: Angio-oedeem, waaronder zwelling van het strottenhoofd en de glottis, die luchtwegobstructie en/of zwelling van het gezicht, de lippen, de keelholte en/of de tong veroorzaakt, is zelden gemeld bij patiënten die met losartan werden behandeld; sommige van deze patiënten hadden eerder angio-oedeem gehad met andere geneesmiddelen, waaronder ACE-remmers. Vasculitis, waaronder Henoch-Schönlein purpura, is gemeld. Anafylactische reacties zijn gemeld.
Metabolisch en voeding: Hyponatriëmie.
Musculoskeletaal: Rabdomyolyse.
Zenuwstelselaandoeningen: Dysgeusie.
Huid: Erytrodermie.
DRUG-INTERACTIES
Middelen die serumkalium verhogen
Gelijktijdige toediening van losartan met andere geneesmiddelen die de serumkaliumspiegels verhogen, kan leiden tot hyperkaliëmie. Controleer het serumkalium bij dergelijke patiënten.
Lithium
Verhogingen van de serumlithiumconcentraties en lithiumtoxiciteit zijn gemeld tijdens gelijktijdige toediening van lithium met angiotensine II-receptorantagonisten. Controleer de serumlithiumspiegels tijdens gelijktijdig gebruik.
Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) inclusief selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, inclusief selectieve COX-2-remmers, met angiotensine II-receptorantagonisten (inclusief losartan) leiden tot een verslechtering van de nierfunctie, inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die met losartan en NSAID's worden behandeld.
Het antihypertensieve effect van angiotensine II-receptorantagonisten, waaronder losartan, kan worden afgezwakt door NSAID's, waaronder selectieve COX-2-remmers.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, syncope, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie.
De Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) studie nam 1448 patiënten op met diabetes type 2, verhoogde urine-albumine-tot-creatinine-ratio en verlaagde geschatte glomerulaire filtratiesnelheid (GFR 30 tot 89,9 ml/min), gerandomiseerd naar lisinopril of placebo tegen een achtergrond van therapie met losartan en volgde ze gedurende een mediaan van 2,2 jaar. Patiënten die de combinatie van losartan en lisinopril kregen, kregen geen bijkomend voordeel in vergelijking met monotherapie voor het gecombineerde eindpunt van afname van GFR, nierziekte in het eindstadium of overlijden, maar ervoeren een verhoogde incidentie van hyperkaliëmie en acuut nierletsel in vergelijking met de monotherapiegroep.
Bij de meeste patiënten is er geen voordeel in verband gebracht met het gelijktijdig gebruik van twee RAS-remmers. Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die COZAAR 100 mg en andere middelen gebruiken die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met COZAAR 100 mg bij patiënten met diabetes. Vermijd het gebruik van aliskiren met COZAAR bij patiënten met een nierfunctiestoornis (GFR
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Foetale toxiciteit
COZAAR kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met COZAAR 100 mg [zie Gebruik bij specifieke populaties ] .
Hypotensie bij patiënten met volume- of zoutverarming
Bij patiënten met een geactiveerd renine-angiotensinesysteem, zoals patiënten met volume- of zoutdepletie (bijv. patiënten die worden behandeld met hoge doses diuretica), kan symptomatische hypotensie optreden na het starten van de behandeling met COZAAR. Corrigeer volume- of zoutdepletie voorafgaand aan toediening van COZAAR [zie DOSERING EN ADMINISTRATIE ] .
Verslechtering van de nierfunctie
Veranderingen in de nierfunctie, waaronder acuut nierfalen, kunnen worden veroorzaakt door geneesmiddelen die het renine-angiotensinesysteem remmen en door diuretica. Patiënten bij wie de nierfunctie gedeeltelijk kan afhangen van de activiteit van het renine-angiotensinesysteem (bijv. patiënten met nierarteriestenose, chronische nierziekte, ernstig congestief hartfalen of volumedepletie) lopen mogelijk een bijzonder risico op het ontwikkelen van acuut nierfalen op COZAAR. Controleer de nierfunctie periodiek bij deze patiënten. Overweeg om de behandeling te staken of stop te zetten bij patiënten die een klinisch significante afname van de nierfunctie ontwikkelen op COZAAR [zie: DRUG-INTERACTIES en Gebruik bij specifieke populaties ] .
Hyperkaliëmie
Controleer regelmatig het serumkalium en behandel het op de juiste manier. Dosisverlaging of stopzetting van COZAAR 25 mg kan nodig zijn [zie: ONGEWENSTE REACTIES ] .
Gelijktijdig gebruik van andere geneesmiddelen die het serumkalium kunnen verhogen, kan leiden tot hyperkaliëmie [zie: DRUG-INTERACTIES ] .
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering (Patiëntinformatie) te lezen.
Zwangerschap
Adviseer vrouwelijke patiënten in de vruchtbare leeftijd over de gevolgen van blootstelling aan COZAAR 100 mg tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Vertel patiënten om zwangerschappen zo snel mogelijk aan hun arts te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ] .
Kaliumsupplementen
Adviseer patiënten die COZAAR krijgen om geen kaliumsupplementen of zoutvervangers te gebruiken die kalium bevatten zonder hun zorgverlener te raadplegen [zie: DRUG-INTERACTIES ] .
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Kaliumlosartan was niet carcinogeen bij toediening in maximaal verdraagbare doseringen aan ratten en muizen gedurende respectievelijk 105 en 92 weken. Vrouwelijke ratten die de hoogste dosis kregen (270 mg/kg/dag) hadden een iets hogere incidentie van acinair adenoom van de pancreas. De maximaal getolereerde doseringen (270 mg/kg/dag bij ratten, 200 mg/kg/dag bij muizen) gaven systemische blootstellingen aan losartan en zijn farmacologisch actieve metaboliet die ongeveer 160 en 90 keer (ratten) en 30 en 15 keer (muizen) waren. de blootstelling van een mens van 50 kg die 100 mg per dag krijgt.
Kaliumlosartan was negatief in de microbiële mutagenese- en V-79-tests op mutagenese van zoogdiercellen en in de in vitro alkalische elutie- en in vitro en in vivo chromosomale aberratietesten. Bovendien vertoonde de actieve metaboliet geen bewijs van genotoxiciteit in de microbiële mutagenese, in vitro alkalische elutie en in vitro chromosomale aberratie-assays.
Vruchtbaarheid en reproductievermogen werden niet beïnvloed in onderzoeken met mannelijke ratten die orale doses kaliumlosartan tot ongeveer 150 mg/kg/dag kregen. De toediening van toxische doseringsniveaus bij vrouwen (300/200 mg/kg/dag) ging gepaard met een significante (p
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
COZAAR kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met COZAAR (zie: Klinische overwegingen ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en bevallingscomplicaties (bijvoorbeeld een keizersnede, postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Oligohydramnion bij zwangere vrouwen die geneesmiddelen gebruiken die het renine-angiotensinesysteem in het tweede en derde trimester van de zwangerschap beïnvloeden, kan leiden tot het volgende: verminderde foetale nierfunctie leidend tot anurie en nierfalen, foetale longhypoplasie, skeletdeformaties, waaronder schedelhypoplasie, hypotensie , en de dood. In het ongewone geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, moet de moeder op de hoogte worden gebracht van het mogelijke risico voor de foetus.
Voer bij patiënten die COZAAR gebruiken tijdens de zwangerschap seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Foetale testen kunnen geschikt zijn, op basis van de week van de zwangerschap. Als oligohydramnion wordt waargenomen, stop dan met COZAAR 50 mg, tenzij dit als levensreddend voor de moeder wordt beschouwd. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen.
Observeer nauwkeurig pasgeborenen met een geschiedenis van in utero blootstelling aan COZAAR voor hypotensie, oligurie en hyperkaliëmie. Bij pasgeborenen met een voorgeschiedenis van in utero blootstelling aan COZAAR 100 mg, als oligurie of hypotensie optreedt, moet de bloeddruk en nierperfusie worden ondersteund. Wisseltransfusies of dialyse kunnen nodig zijn om de hypotensie om te keren en de nierfunctie te vervangen.
Gegevens
Dierlijke gegevens
Kaliumlosartan werd oraal toegediend aan ratten tijdens de periode van late dracht tot lactatie (Draagdag 15 tot en met lactatiedag 20) in doses van 10, 25 en 100 mg/kg/dag. Van kaliumlosartan is aangetoond dat het bijwerkingen veroorzaakt bij rattenfoetussen en pasgeborenen, waaronder een verminderd lichaamsgewicht, vertraagde lichamelijke en gedragsontwikkeling, mortaliteit en niertoxiciteit. Met uitzondering van neonatale gewichtstoename (die werd beïnvloed bij doses van slechts 10 mg/kg/dag), overschreden de doses die met deze effecten gepaard gingen meer dan 25 mg/kg/dag (ongeveer driemaal de maximaal aanbevolen dosis voor de mens van 100 mg per mg /m basis). Deze bevindingen worden toegeschreven aan blootstelling aan geneesmiddelen in de late zwangerschap en tijdens borstvoeding. Tijdens de late zwangerschap en in de melk van de rat bleken significante niveaus van losartan en zijn actieve metaboliet aanwezig te zijn in het foetale plasma van de rat.
Borstvoeding
Risico Samenvatting
Het is niet bekend of losartan wordt uitgescheiden in de moedermelk, maar er is aangetoond dat er significante niveaus van losartan en zijn actieve metaboliet aanwezig zijn in rattenmelk. Vanwege het potentieel voor nadelige effecten op de zuigeling, moet worden besloten of de borstvoeding moet worden gestaakt of dat het medicijn moet worden gestaakt, rekening houdend met het belang van het medicijn voor de moeder.
Pediatrisch gebruik
Antihypertensieve effecten van COZAAR zijn vastgesteld bij hypertensieve pediatrische patiënten in de leeftijd van 6 tot 16 jaar. De veiligheid en werkzaamheid zijn niet vastgesteld bij pediatrische patiënten jonger dan 6 jaar of bij pediatrische patiënten met een glomerulaire filtratiesnelheid DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE en Klinische studies ] .
Geriatrisch gebruik
Van het totale aantal patiënten dat COZAAR 25 mg kreeg in gecontroleerde klinische onderzoeken naar hypertensie, waren 391 patiënten (19%) 65 jaar en ouder, terwijl 37 patiënten (2%) 75 jaar en ouder waren. In een gecontroleerd klinisch onderzoek naar nierbescherming bij type 2-diabetespatiënten met proteïnurie waren 248 patiënten (33%) 65 jaar en ouder. In een gecontroleerd klinisch onderzoek naar de vermindering van het gecombineerde risico op cardiovasculair overlijden, beroerte en myocardinfarct bij hypertensieve patiënten met linkerventrikelhypertrofie waren 2857 patiënten (62%) 65 jaar en ouder, terwijl 808 patiënten (18%) 75 jaar en ouder waren . Er werden geen algemene verschillen in effectiviteit of veiligheid waargenomen tussen deze patiënten en jongere patiënten, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Ras
In de LIFE-studie hadden negroïde patiënten met hypertensie en linkerventrikelhypertrofie die werden behandeld met atenolol een lager risico om het primaire samengestelde eindpunt te ervaren in vergelijking met negroïde patiënten die werden behandeld met COZAAR (beide gelijktijdig behandeld met hydrochloorthiazide bij de meeste patiënten). Het primaire eindpunt was het eerste optreden van een beroerte, myocardinfarct of cardiovasculair overlijden, geanalyseerd met behulp van een intention-to-treat (ITT)-benadering. In de subgroep van negroïde patiënten (n=533, 6% van de patiënten in de LIFE-studie), waren er 29 primaire eindpunten bij 263 patiënten die atenolol kregen (11%, 26 per 1000 patiëntjaren) en 46 primaire eindpunten bij 270 patiënten (17% , 42 per 1000 patiëntjaren) op COZAAR. Deze bevinding kon niet worden verklaard op basis van verschillen in de populaties anders dan ras of op enige onbalans tussen behandelingsgroepen. Bovendien waren de bloeddrukdalingen in beide behandelingsgroepen consistent tussen zwarte en niet-zwarte patiënten. Gezien de moeilijkheid om subset-verschillen in grote onderzoeken te interpreteren, kan niet worden geweten of het waargenomen verschil het gevolg is van toeval. Het LIFE-onderzoek levert echter geen bewijs dat de voordelen van COZAAR 100 mg op het verminderen van het risico op cardiovasculaire voorvallen bij hypertensieve patiënten met linkerventrikelhypertrofie van toepassing zijn op negroïde patiënten [zie Klinische studies ] .
Nierfunctiestoornis
Patiënten met nierinsufficiëntie hebben verhoogde plasmaconcentraties van losartan en zijn actieve metaboliet in vergelijking met patiënten met een normale nierfunctie. Er is geen dosisaanpassing nodig bij patiënten met een nierfunctiestoornis, tenzij een patiënt met een nierfunctiestoornis ook een volumedepletie heeft [zie: DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ] .
Leverfunctiestoornis
De aanbevolen startdosering van COZAAR is 25 mg bij patiënten met een lichte tot matige leverfunctiestoornis. Na orale toediening aan patiënten met een lichte tot matige leverfunctiestoornis, waren de plasmaconcentraties van losartan en zijn actieve metaboliet respectievelijk 5 keer en 1,7 keer zo hoog als bij gezonde vrijwilligers. COZAAR is niet onderzocht bij patiënten met een ernstige leverfunctiestoornis [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ] .
OVERDOSERING
Aanzienlijke letaliteit werd waargenomen bij muizen en ratten na orale toediening van respectievelijk 1000 mg/kg en 2000 mg/kg, ongeveer 44 en 170 maal de maximaal aanbevolen dosis voor de mens op basis van mg/m2.
Er zijn beperkte gegevens beschikbaar met betrekking tot overdosering bij mensen. De meest waarschijnlijke manifestatie van overdosering zou hypotensie en tachycardie zijn; bradycardie kan optreden door parasympathische (vagale) stimulatie. Als symptomatische hypotensie optreedt, moet een ondersteunende behandeling worden ingesteld.
Noch losartan, noch zijn actieve metaboliet kan worden verwijderd door hemodialyse.
CONTRA-INDICATIES
COZAAR 50 mg is gecontra-indiceerd:
- Bij patiënten die overgevoelig zijn voor een van de bestanddelen van dit product.
- Voor gelijktijdige toediening met aliskiren bij patiënten met diabetes.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Angiotensine II [gevormd uit angiotensine I in een reactie die wordt gekatalyseerd door angiotensineconverterend enzym (ACE, kininase II)] is een krachtige vasoconstrictor, het primaire vasoactieve hormoon van het renine-angiotensinesysteem, en een belangrijke component in de pathofysiologie van hypertensie. Het stimuleert ook de aldosteronsecretie door de bijnierschors. Losartan en zijn belangrijkste actieve metaboliet blokkeren de vaatvernauwende en aldosteron-afscheidende effecten van angiotensine II door selectief de binding van angiotensine II aan de AT1-receptor die in veel weefsels wordt aangetroffen (bijv. vasculaire gladde spieren, bijnieren) te blokkeren. Er is ook een AT1-receptor die in veel weefsels wordt aangetroffen, maar het is niet bekend dat deze geassocieerd is met cardiovasculaire homeostase. Noch losartan, noch zijn belangrijkste actieve metaboliet vertoont enige gedeeltelijke agonistische activiteit op de AT1-receptor, en beide hebben een veel grotere affiniteit (ongeveer 1000-voudig) voor de AT1-receptor dan voor de AT1-receptor. In vitro bindingsonderzoeken geven aan dat losartan een onomkeerbare, competitieve remmer van de AT1-receptor is. De actieve metaboliet is 10 tot 40 keer krachtiger in gewicht dan losartan en lijkt een reversibele, niet-competitieve remmer van de AT1-receptor te zijn.
Noch losartan, noch zijn actieve metaboliet remt ACE (kininase II, het enzym dat angiotensine I omzet in angiotensine II en bradykinine afbreekt), noch binden ze aan of blokkeren ze andere hormoonreceptoren of ionkanalen waarvan bekend is dat ze belangrijk zijn bij de cardiovasculaire regulatie.
farmacodynamiek
Losartan remt het pressoreffect van angiotensine II (evenals angiotensine I) infusies. Een dosis van 100 mg remt het pressoreffect met ongeveer 85% op de piek, waarbij 25-40% remming 24 uur aanhoudt. Verwijdering van de negatieve feedback van angiotensine II veroorzaakt een verdubbeling tot verdrievoudiging van de plasmarenine-activiteit en bijgevolg een stijging van de plasmaconcentratie van angiotensine II bij hypertensieve patiënten. Losartan heeft geen invloed op de respons op bradykinine, terwijl ACE-remmers de respons op bradykinine verhogen. De plasmaconcentraties van aldosteron dalen na toediening van losartan. Ondanks het effect van losartan op de aldosteronsecretie, werd zeer weinig effect op serumkalium waargenomen.
Het effect van losartan is binnen een week substantieel aanwezig, maar in sommige onderzoeken trad het maximale effect na 3-6 weken op. In langdurige follow-upstudies (zonder placebocontrole) bleek het effect van losartan tot een jaar aan te houden. Er is geen duidelijk rebound-effect na abrupt stoppen met losartan. In gecontroleerde onderzoeken was er in wezen geen verandering in de gemiddelde hartslag bij met losartan behandelde patiënten.
Farmacokinetiek
Absorptie
Na orale toediening wordt losartan goed geabsorbeerd en ondergaat het een aanzienlijk first-pass-metabolisme. De systemische biologische beschikbaarheid van losartan is ongeveer 33%. De gemiddelde piekconcentraties van losartan en zijn actieve metaboliet worden bereikt in respectievelijk 1 uur en 3-4 uur. Hoewel de maximale plasmaconcentraties van losartan en zijn actieve metaboliet ongeveer gelijk zijn, is de AUC (area under the curve) van de metaboliet ongeveer 4 keer zo groot als die van losartan. Een maaltijd vertraagt de absorptie van losartan en verlaagt de Cmax, maar heeft slechts geringe effecten op de AUC van losartan of op de AUC van de metaboliet (~10% afname). De farmacokinetiek van losartan en zijn actieve metaboliet is lineair met orale doses losartan tot 200 mg en verandert niet in de loop van de tijd.
Verdeling
Het distributievolume van losartan en de actieve metaboliet is respectievelijk ongeveer 34 liter en 12 liter. Zowel losartan als zijn actieve metaboliet zijn in hoge mate gebonden aan plasma-eiwitten, voornamelijk albumine, met plasmavrije fracties van respectievelijk 1,3% en 0,2%. De plasma-eiwitbinding is constant over het concentratiebereik dat wordt bereikt met de aanbevolen doses. Studies bij ratten geven aan dat losartan de bloed-hersenbarrière slecht of helemaal niet passeert.
Metabolisme
Losartan is een oraal actief middel dat een aanzienlijk first-pass-metabolisme ondergaat door cytochroom P450-enzymen. Het wordt gedeeltelijk omgezet in een actieve carbonzuurmetaboliet die verantwoordelijk is voor het grootste deel van het angiotensine II-receptorantagonisme dat volgt op de behandeling met losartan. Ongeveer 14% van een oraal toegediende dosis losartan wordt omgezet in de actieve metaboliet. Naast de actieve carbonzuurmetaboliet worden verschillende inactieve metabolieten gevormd. In vitro-onderzoeken geven aan dat cytochroom P450 2C9 en 3A4 betrokken zijn bij de biotransformatie van losartan naar zijn metabolieten.
Eliminatie
De totale plasmaklaring van losartan en de actieve metaboliet is respectievelijk ongeveer 600 ml/min en 50 ml/min, met een renale klaring van respectievelijk ongeveer 75 ml/min en 25 ml/min. De terminale halfwaardetijd van losartan is ongeveer 2 uur en van de metaboliet ongeveer 6-9 uur. Na een enkelvoudige orale toediening van losartan wordt ongeveer 4% van de dosis onveranderd in de urine uitgescheiden en ongeveer 6% wordt als actieve metaboliet in de urine uitgescheiden. Uitscheiding via de gal draagt bij tot de eliminatie van losartan en zijn metabolieten. Na oraal 14C-gelabeld losartan wordt ongeveer 35% van de radioactiviteit teruggevonden in de urine en ongeveer 60% in de feces. Na een intraveneuze dosis 14C-gelabeld losartan wordt ongeveer 45% van de radioactiviteit teruggevonden in de urine en 50% in de feces. Noch losartan, noch zijn metaboliet accumuleert inplasma bij herhaalde eenmaaldaagse dosering.
Specifieke populaties
pediatrisch
Farmacokinetische parameters na meervoudige doses losartan (gemiddelde dosis 0,7 mg/kg, bereik 0,36 tot 0,97 mg/kg) als tablet bij 25 hypertensieve patiënten in de leeftijd van 6 tot 16 jaar worden weergegeven in tabel 4 hieronder. De farmacokinetiek van losartan en zijn actieve metaboliet was over het algemeen vergelijkbaar in de onderzochte leeftijdsgroepen en vergelijkbaar met historische farmacokinetische gegevens bij volwassenen. De belangrijkste farmacokinetische parameters bij volwassenen en kinderen worden weergegeven in de onderstaande tabel.
De biologische beschikbaarheid van de suspensieformulering werd vergeleken met losartantabletten bij gezonde volwassenen. De suspensie en tablet zijn vergelijkbaar wat betreft hun biologische beschikbaarheid met betrekking tot zowel losartan als de actieve metaboliet [zie DOSERING EN ADMINISTRATIE ] .
Geriatrisch en geslacht
De farmacokinetiek van losartan is onderzocht bij ouderen (65-75 jaar) en bij beide geslachten. Plasmaconcentraties van losartan en zijn actieve metaboliet zijn vergelijkbaar bij oudere en jonge hypertensieve patiënten. De plasmaconcentraties van losartan waren ongeveer tweemaal zo hoog bij vrouwelijke hypertensiva als bij mannelijke hypertensiva, maar de concentraties van de actieve metaboliet waren vergelijkbaar bij mannen en vrouwen. Er is geen dosisaanpassing nodig [zie DOSERING EN ADMINISTRATIE ] .
Ras
Farmacokinetische verschillen als gevolg van ras zijn niet onderzocht [zie: Gebruik bij specifieke populaties ] .
Nierinsufficiëntie
Na orale toediening zijn de plasmaconcentraties en AUC's van losartan en zijn actieve metaboliet verhoogd met 50-90% bij patiënten met lichte (creatinineklaring van 50 tot 74 ml/min) of matige (creatinineklaring 30 tot 49 ml/min) nierinsufficiëntie . In deze studie was de renale klaring met 55-85% verminderd voor zowel losartan als zijn actieve metaboliet bij patiënten met lichte of matige nierinsufficiëntie. Noch losartan, noch zijn actieve metaboliet kunnen door hemodialyse worden verwijderd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ] .
Leverinsufficiëntie
Na orale toediening aan patiënten met lichte tot matige alcoholische levercirrose waren de plasmaconcentraties van losartan en zijn actieve metaboliet respectievelijk 5 keer en ongeveer 1,7 keer die bij jonge mannelijke vrijwilligers. In vergelijking met normale proefpersonen was de totale plasmaklaring van losartan-patiënten met leverinsufficiëntie ongeveer 50% lager en was de orale biologische beschikbaarheid ongeveer verdubbeld. Gebruik een startdosering van 25 mg voor patiënten met een lichte tot matige leverfunctiestoornis. COZAAR 50 mg is niet onderzocht bij patiënten met een ernstige leverfunctiestoornis [zie: DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ] .
Geneesmiddelinteracties
Er zijn geen klinisch significante geneesmiddelinteracties gevonden in onderzoeken naar kaliumlosartan met hydrochloorthiazide, digoxine, warfarine, cimetidine en fenobarbital. Er is echter aangetoond dat rifampicine de AUC van losartan en zijn actieve metaboliet met respectievelijk 30% en 40% verlaagt. Fluconazol, een remmer van cytochroomP450 2C9, verlaagde de AUC van de actieve metaboliet met ongeveer 40%, maar verhoogde de AUC van losartan met ongeveer 70% na meervoudige doses. De omzetting van losartan naar zijn actieve metaboliet na intraveneuze toediening wordt niet beïnvloed door ketoconazol, een remmer van P450 3A4. De AUC van de actieve metaboliet na oraal losartan werd niet beïnvloed door erytromycine, een remmer van P450 3A4, maar de AUC van losartan was met 30% verhoogd.
De farmacodynamische gevolgen van gelijktijdig gebruik van losartan en remmers van P450 2C9 zijn niet onderzocht. Bij proefpersonen die de toactieve metaboliet losartan niet metaboliseren, is aangetoond dat ze een specifiek, zeldzaam defect hebben in cytochroom P450 2C9. Deze gegevens suggereren dat de omzetting van losartan in zijn actieve metaboliet voornamelijk wordt gemedieerd door P450 2C9 en niet door P450 3A4.
Klinische studies
Hypertensie
Hypertensie bij volwassenen
De antihypertensieve effecten van COZAAR 25 mg werden voornamelijk aangetoond in 4 placebogecontroleerde onderzoeken van 6 tot 12 weken met doseringen van 10 tot 150 mg per dag bij patiënten met een baseline diastolische bloeddruk van 95-115. De onderzoeken maakten vergelijkingen mogelijk van twee doses (50-100 mg/dag) als eenmaal daagse of tweemaal daagse regimes, vergelijkingen van piek- en daleffecten en vergelijkingen van de respons per geslacht, leeftijd en ras. Drie aanvullende onderzoeken onderzochten de antihypertensieve effecten van losartan en hydrochloorthiazide in combinatie.
De 4 onderzoeken naar monotherapie met losartan omvatten in totaal 1075 patiënten gerandomiseerd naar verschillende doses losartan en 334 naar placebo. De doses van 10 en 25 mg produceerden enig effect op piekmomenten (6 uur na dosering), maar kleine en inconsistente dalreacties (24 uur). Doses van 50, 100 en 150 mg eenmaal daags gaven statistisch significante systolische/diastolische gemiddelde verlagingen van de bloeddruk, vergeleken met placebo in het bereik van 5,5-10,5/3,5-7,5 mmHg, waarbij de dosis van 150 mg geen groter effect gaf dan 50- 100mg. Een tweemaaldaagse dosering van 50-100 mg/dag gaf consistent grotere dalresponsen dan een eenmaaldaagse dosering bij dezelfde totale dosis. Piekeffecten (6 uur) waren uniform, maar matig, groter dan daleffecten, met een dal-tot-piekverhouding voor systolische en diastolische responsen van respectievelijk 50-95% en 60-90%.
Toevoeging van een lage dosis hydrochloorthiazide (12,5 mg) aan losartan 50 mg eenmaal daags resulteerde in placebo-gecorrigeerde bloeddrukdalingen van 15,5/9,2 mmHg.
Analyse van leeftijds-, geslachts- en rassubgroepen van patiënten toonde aan dat mannen en vrouwen, en patiënten ouder dan 65 jaar, over het algemeen vergelijkbare reacties hadden. COZAAR 25 mg was effectief bij het verlagen van de bloeddruk, ongeacht het ras, hoewel het effect iets minder was bij negroïde patiënten (meestal een populatie met een laag reninegehalte).
Pediatrische hypertensie
Het antihypertensieve effect van losartan werd onderzocht in één studie met 177 hypertensieve pediatrische patiënten van 6 tot 16 jaar oud. Kinderen die DOSERING EN ADMINISTRATIE . De meerderheid van de kinderen had hypertensie geassocieerd met nier- en urogenitale ziekte. De zittende diastolische bloeddruk (SiDBP) bij deelname aan het onderzoek was hoger dan het 95e percentielniveau voor de leeftijd, het geslacht en de lengte van de patiënt. Na drie weken verlaagde losartan de systolische en diastolische bloeddruk, gemeten bij het dal, op een dosisafhankelijke manier. In het algemeen verlaagden de twee hogere doses (25 tot 50 mg bij patiënten
Hypertensieve patiënten met linkerventrikelhypertrofie
De LIFE-studie was een multinationale, dubbelblinde studie waarin COZAAR 50 mg en atenolol werden vergeleken bij 9193 hypertensieve patiënten met ECG-gedocumenteerde linkerventrikelhypertrofie. Patiënten met een myocardinfarct of beroerte binnen zes maanden voorafgaand aan randomisatie werden uitgesloten. Patiënten werden gerandomiseerd om eenmaal daags COZAAR 50 mg of atenolol 50 mg te krijgen. Als de streefbloeddruk (
Van de gerandomiseerde patiënten waren 4963 (54%) vrouw en 533 (6%) zwart. De gemiddelde leeftijd was 67 met 5704 (62%) leeftijd ≥65. Bij aanvang hadden 1195 (13%) diabetes, 1326 (14%) hadden geïsoleerde systolische hypertensie, 1469 (16%) hadden coronaire hartziekte en 728 (8%) hadden cerebrovasculaire ziekte. De gemiddelde bloeddruk bij aanvang was 174/98 mmHg in beide behandelingsgroepen. De gemiddelde duur van de follow-up was 4,8 jaar. Aan het einde van de studie of bij het laatste bezoek vóór een primair eindpunt, slikte 77% van de met COZAAR 50 mg behandelde groep en 73% van de met atenolol behandelde groep nog steeds onderzoeksmedicatie. Van de patiënten die nog steeds onderzoeksmedicatie gebruikten, waren de gemiddelde doses COZAAR en atenolol beide ongeveer 80 mg/dag, en 15% nam atenolol of losartan als monotherapie, terwijl 77% ook hydrochloorthiazide kreeg (met een gemiddelde dosis van 20 mg/dag in elke groep). Bloeddrukverlaging gemeten bij het dal was vergelijkbaar voor beide behandelingsgroepen, maar de bloeddruk werd niet op een ander moment van de dag gemeten. Aan het einde van de studie of bij het laatste bezoek vóór een primair eindpunt was de gemiddelde bloeddruk 144,1/81,3 mmHg voor de met COZAAR behandelde groep en 145,4/80,9 mmHg voor de met atenolol behandelde groep; het verschil in systolische bloeddruk (SBP) van 1,3 mmHg was significant (p
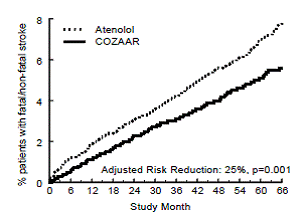
Het primaire eindpunt was het eerste optreden van cardiovasculair overlijden, niet-fatale beroerte of niet-fataal myocardinfarct. Patiënten met niet-fatale voorvallen bleven in het onderzoek, zodat ook het eerste voorval van elk type werd onderzocht, zelfs als het niet het eerste voorval was (bv. een beroerte na een eerste myocardinfarct zou worden meegeteld bij de analyse van een beroerte). Behandeling met COZAAR 50 mg resulteerde in een vermindering van 13% (p=0,021) van het risico op het primaire eindpunt in vergelijking met de atenololgroep (zie figuur 1 en tabel 3); dit verschil was voornamelijk het gevolg van een effect op fatale en niet-fatale beroerte. Behandeling met COZAAR verminderde het risico op een beroerte met 25% ten opzichte van atenolol (p=0,001) (zie figuur 2 en tabel 3 ).
Figuur 1: Kaplan-Meier-schattingen van het primaire eindpunt van de tijd tot cardiovasculaire dood, niet-fatale beroerte of niet-fataal myocardinfarct in de groepen die werden behandeld met COZAAR 100 mg en atenolol. De risicoreductie is aangepast voor de Framingham-risicoscore bij aanvang en het niveau van elektrocardiografische linkerventrikelhypertrofie
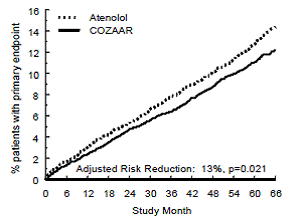
Figuur 2: Kaplan-Meier-schattingen van de tijd tot fatale/niet-fatale beroerte in de groepen behandeld met COZAAR 50 mg en atenolol. De risicoreductie is aangepast voor baselineFramingham-risicoscore en niveau van elektrocardiografische linkerventrikelhypertrofie
Tabel 3 toont de resultaten voor het primaire samengestelde eindpunt en de individuele eindpunten. Het primaire eindpunt was het eerste optreden van een beroerte, myocardinfarct of cardiovasculair overlijden, geanalyseerd met behulp van een ITT-benadering. De tabel toont het aantal gebeurtenissen voor elk onderdeel op twee verschillende manieren. De componenten van het primaire eindpunt (als eerste gebeurtenis) tellen alleen de gebeurtenissen die het primaire eindpunt definiëren, terwijl de secundaire eindpunten alle eerste gebeurtenissen van een bepaald type tellen, ongeacht of ze zijn voorafgegaan door een ander type gebeurtenis.
Hoewel de LIFE-studie de voorkeur gaf aan COZAAR boven atenolol met betrekking tot het primaire eindpunt (p=0,021), is dit resultaat afkomstig van een enkele studie en is daarom minder overtuigend dan het verschil tussen COZAAR en placebo. Hoewel het niet direct wordt gemeten, is het verschil tussen COZAAR en placebo overtuigend omdat er aanwijzingen zijn dat atenolol zelf effectief is (versus placebo) bij het verminderen van cardiovasculaire voorvallen, waaronder beroerte, bij hypertensieve patiënten.
Andere klinische eindpunten van de LIFE-studie waren: totale mortaliteit, ziekenhuisopname wegens hartfalen of angina pectoris, coronaire of perifere revascularisatieprocedures en gereanimeerde hartstilstand. Er waren geen significante verschillen in de percentages van deze eindpunten tussen de COZAAR- en atenololgroepen.
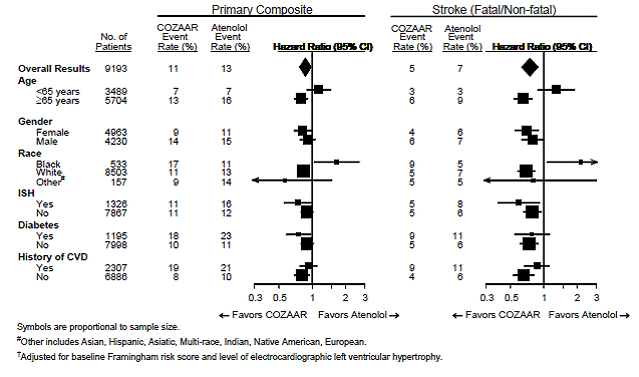
Voor het primaire eindpunt en beroerte worden de effecten van COZAAR 25 mg bij patiëntensubgroepen gedefinieerd door leeftijd, geslacht, ras en aan- of afwezigheid van geïsoleerde systolische hypertensie (ISH), diabetes en voorgeschiedenis van hart- en vaatziekten (CVD) weergegeven in Afbeelding 3 hieronder. . Subgroepanalyses kunnen moeilijk te interpreteren zijn en het is niet bekend of deze werkelijke verschillen of toevalseffecten vertegenwoordigen.
Afbeelding 3: Primaire eindpuntgebeurtenissen† binnen demografische subgroepen
Nefropathie bij type 2 diabetespatiënten
De RENAAL-studie was een gerandomiseerde, placebogecontroleerde, dubbelblinde, multicenter studie die wereldwijd werd uitgevoerd bij 1513 patiënten met diabetes type 2 met nefropathie (gedefinieerd als serumcreatinine 1,3 tot 3,0 mg/dl bij vrouwen of mannen ≤60 kg en 1,5 tot 3,0 mg /dL bij mannen >60 kg en proteïnurie [urine-albumine/creatinineverhouding ≥300 mg/g]).
Patiënten werden gerandomiseerd om eenmaal daags 50 mg COZAAR of placebo te krijgen tegen een achtergrond van conventionele antihypertensieve therapie met uitzondering van ACE-remmers en angiotensine II-antagonisten. Na een maand kregen de onderzoekers de instructie om het onderzoeksgeneesmiddel te titreren tot 100 mg eenmaal daags als de dalbloeddrukdoelstelling (140/90 mmHg) niet werd bereikt. In totaal ontving 72% van de patiënten de dagelijkse dosis van 100 mg meer dan 50% van de tijd dat ze het onderzoeksgeneesmiddel gebruikten. Omdat het onderzoek was opgezet om een gelijke bloeddrukcontrole in beide groepen te bereiken, konden in beide groepen zo nodig andere antihypertensiva (diuretica, calciumkanaalblokkers, alfa- of bètablokkers en centraal werkende middelen) worden toegevoegd. Patiënten werden gevolgd voor een gemiddelde duur van 3,4 jaar.
De onderzoekspopulatie was divers met betrekking tot ras (Aziatisch 16,7%, Zwart 15,2%, Hispanic 18,3%, Blank 48,6%). In totaal was 63,2% van de patiënten mannen en 66,4% was jonger dan 65 jaar. Bijna alle patiënten (96,6%) hadden een voorgeschiedenis van hypertensie en de patiënten namen deel aan de studie met een gemiddeld serumcreatinine van 1,9 mg/dl en een gemiddelde proteïnurie (urine-albumine/creatinine) van 1808 mg/g bij aanvang.
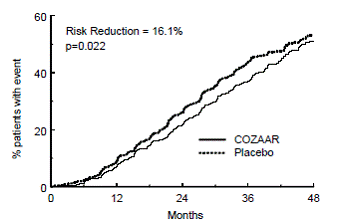
Het primaire eindpunt van het onderzoek was de tijd tot het eerste optreden van een van de volgende voorvallen: verdubbeling van het serumcreatinine, terminale nierziekte (ESRD) (noodzaak van dialyse of transplantatie) of overlijden. Behandeling met COZAAR resulteerde in een risicoreductie van 16% in dit eindpunt (zie figuur 4 en tabel 4). Behandeling met COZAAR verminderde ook het optreden van aanhoudende verdubbeling van serumcreatinine met 25% en ESRD met 29% als afzonderlijke eindpunten, maar had geen effect op de totale mortaliteit (zie tabel 4).
De gemiddelde bloeddruk bij baseline was 152/82 mmHg voor COZAAR plus conventionele antihypertensiva en 153/82 mmHg voor placebo plus conventionele antihypertensiva. Aan het einde van het onderzoek was de gemiddelde bloeddruk 143/76 mmHg voor de met COZAAR 100 mg behandelde groep en 146/77 mmHg voor de met placebo behandelde groep.
Figuur 4: Kaplan-Meier-curve voor het primaire samengestelde eindpunt van verdubbeling van serumcreatinine, nierziekte in het eindstadium (noodzaak voor dialyse of transplantatie) of overlijden
De secundaire eindpunten van het onderzoek waren verandering in proteïnurie, verandering in de snelheid van progressie van nierziekte en de samenstelling van morbiditeit en mortaliteit door cardiovasculaire oorzaken (ziekenhuisopname voor hartfalen, myocardinfarct, revascularisatie, beroerte, ziekenhuisopname voor onstabiele angina of cardiovasculaire in vergelijking met placebo, verminderde COZAAR de proteïnurie significant met gemiddeld 34%, een effect dat duidelijk was binnen 3 maanden na het starten van de therapie, en verminderde significant de snelheid van afname van de glomerulaire filtratiesnelheid tijdens het onderzoek met 13%, zoals gemeten door het omgekeerde van de serumcreatinineconcentratie. Er was geen significant verschil in de incidentie van het samengestelde eindpunt van cardiovasculaire morbiditeit en mortaliteit.
De gunstige effecten van COZAAR werden waargenomen bij patiënten die ook andere antihypertensiva gebruikten (angiotensine II-receptorantagonisten en angiotensineconverterende enzymremmers waren niet toegestaan), orale bloedglucoseverlagende middelen en lipideverlagende middelen.
Voor het primaire eindpunt en ESRD worden de effecten van COZAAR bij patiëntensubgroepen gedefinieerd op basis van leeftijd, geslacht en ras weergegeven in tabel 5 hieronder. Subgroepanalyses kunnen moeilijk te interpreteren zijn en het is niet bekend of deze werkelijke verschillen of toevalseffecten vertegenwoordigen.
PATIËNT INFORMATIE
COZAAR® (CO-zar) (losartan-kaliumtabletten) 25 mg, 50 mg, 100 mg
Lees de patiënteninformatie die bij COZAAR wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze bijsluiter is geen vervanging voor een gesprek met uw arts over uw toestand en behandeling.
Wat is de belangrijkste informatie die ik over COZAAR moet weten?
- COZAAR kan een ongeboren baby schaden of overlijden.
- Praat met uw arts over andere manieren om uw bloeddruk te verlagen als u van plan bent zwanger te worden.
- Als u zwanger wordt terwijl u COZAAR gebruikt, vertel dit dan onmiddellijk aan uw arts.
Wat is COZAAR 100 mg?
COZAAR 100 mg is een receptgeneesmiddel dat een angiotensinereceptorblokker (ARB) wordt genoemd. Het is gebruikt:
- alleen of met andere bloeddrukgeneesmiddelen om hoge bloeddruk (hypertensie) te verlagen.
- om de kans op een beroerte te verlagen bij patiënten met hoge bloeddruk en een hartprobleem dat linkerventrikelhypertrofie wordt genoemd. COZAAR kan zwarte patiënten met dit probleem niet helpen.
- om de verergering van diabetische nierziekte (nefropathie) te vertragen bij patiënten met type 2-diabetes die hoge bloeddruk hebben of hebben gehad.
COZAAR 25 mg is niet onderzocht bij kinderen jonger dan 6 jaar of bij kinderen met bepaalde nierproblemen.
Hoge bloeddruk (hypertensie) Bloeddruk is de kracht in uw bloedvaten wanneer uw hart klopt en wanneer uw hart rust. U heeft een hoge bloeddruk wanneer de kracht te veel is. COZAAR 25 mg kan uw bloedvaten helpen ontspannen, zodat uw bloeddruk lager wordt.
Linkerventrikelhypertrofie (LVH) is een vergroting van de wanden van de linkerkamer van het hart (de belangrijkste pompkamer van het hart). LVH kan door verschillende dingen gebeuren. Hoge bloeddruk is de meest voorkomende oorzaak van LVH.
Type 2 diabetes met nefropathie . Diabetes type 2 is een vorm van diabetes die vooral bij volwassenen voorkomt. Als u diabetische nefropathie heeft, betekent dit dat uw nieren niet goed werken vanwege schade door de diabetes.
Wie mag COZAAR 100 mg niet gebruiken?
- Gebruik COZAAR 25 mg niet als u allergisch bent voor een van de bestanddelen van COZAAR . Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in COZAAR.
- Gebruik COZAAR niet als u diabetes heeft en het geneesmiddel aliskiren gebruikt om de bloeddruk te verlagen.
Wat moet ik mijn arts vertellen voordat ik COZAAR 50 mg inneem?
Vertel uw arts over al uw medische aandoeningen, ook als u:
- zwanger bent of van plan bent zwanger te worden. Zien " Wat is de belangrijkste informatie die ik moet weten over COZAAR 25 mg? "
- geven borstvoeding . Het is niet bekend of COZAAR 50 mg in uw moedermelk terechtkomt. U moet ervoor kiezen om COZAAR 50 mg in te nemen of borstvoeding te geven, maar niet beide.
- veel overgeven of veel diarree hebben
- leverproblemen hebben
- nierproblemen hebben
Vertel uw arts over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. COZAAR en bepaalde andere geneesmiddelen kunnen met elkaar interageren. Vertel het uw arts vooral als u het volgende gebruikt:
- kaliumsupplementen
- zoutvervangers die kalium bevatten
- andere geneesmiddelen die het serumkalium kunnen verhogen
- plaspillen (diuretica)
- lithium (een geneesmiddel dat wordt gebruikt om een bepaald soort depressie te behandelen)
- geneesmiddelen die worden gebruikt om pijn en artritis te behandelen, de zogenaamde niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), waaronder COX-2-remmers
- andere geneesmiddelen om de bloeddruk te verlagen
Hoe moet ik COZAAR 25 mg innemen?
- Gebruik COZAAR 100 mg precies zoals uw arts heeft voorgeschreven. Uw arts kan uw dosis indien nodig wijzigen.
- COZAAR 50 mg kan met of zonder voedsel worden ingenomen.
- Als u een dosis bent vergeten, neem deze dan in zodra u eraan denkt. Als het bijna uw volgende dosis is, neem dan de gemiste dosis niet in. Neem gewoon de volgende dosis op uw normale tijd.
- Als u te veel COZAAR heeft ingenomen, neem dan contact op met uw arts of het Antigifcentrum, of ga direct naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
Wat zijn de mogelijke bijwerkingen van COZAAR?
COZAAR 25 mg kan de volgende bijwerkingen veroorzaken die ernstig kunnen zijn:
- Verwonding of overlijden van ongeboren baby's. Zie " Wat is de belangrijkste informatie die ik over COZAAR moet weten?"
- Allergische reactie Symptomen van een allergische reactie zijn zwelling van het gezicht, de lippen, de keel of de tong. Roep onmiddellijk medische noodhulp in en stop met het innemen van COZAAR.
- Lage bloeddruk (hypotensie) . Een lage bloeddruk kan ervoor zorgen dat u zich zwak of duizelig voelt. Ga liggen als u zich zwak of duizelig voelt. Bel onmiddellijk uw arts.
- Bij mensen die al nierproblemen hebben, kunt u een verslechtering zien in hoe goed uw nieren werken. Bel uw arts als u last krijgt van zwelling in uw voeten, enkels of handen, of als u onverklaarbare gewichtstoename krijgt.
- Hoge kaliumspiegels in het bloed
De meest voorkomende bijwerkingen van COZAAR 50 mg bij mensen met hoge bloeddruk zijn:
- "verkoudheid" (infectie van de bovenste luchtwegen)
- duizeligheid
- verstopte neus
- rugpijn
De meest voorkomende bijwerkingen van COZAAR 50 mg bij mensen met diabetes type 2 met diabetische nierziekte zijn:
- diarree
- vermoeidheid
- lage bloedsuikerspiegel
- pijn op de borst
- hoog kaliumgehalte in het bloed
- lage bloeddruk
Vertel het uw arts als u een bijwerking krijgt die u hindert of die niet weggaat.
Dit is niet een volledige lijst van bijwerkingen. Vraag uw arts of apotheker om een volledige lijst.
Hoe bewaar ik COZAAR 100 mg?
- Bewaar COZAAR-tabletten bij 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Bewaar COZAAR in een goed gesloten verpakking die het geneesmiddel tegen licht beschermt.
- Houd COZAAR en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over COZAAR
Soms worden medicijnen voorgeschreven voor aandoeningen die niet in de patiëntenbijsluiter staan. Gebruik COZAAR niet voor een aandoening waarvoor het niet is voorgeschreven. Geef COZAAR niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze folder vat de belangrijkste informatie over COZAAR samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw apotheker of arts om informatie vragen over COZAAR die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in COZAAR 25mg?
Actieve ingrediënten: losartan kalium
Inactieve ingredienten:
microkristallijne cellulose, waterhoudende lactose, gepregelatiniseerd zetmeel, magnesiumstearaat, hydroxypropylcellulose, hypromellose en titaniumdioxide. COZAAR 25 mg, COZAAR 50 mg en COZAAR 100 mg kunnen ook carnaubawas bevatten.
