Adalat 10mg, 20mg, 30mg Nifedipine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Adalat en hoe wordt het gebruikt?
Adalat is een receptgeneesmiddel dat wordt gebruikt om de symptomen van pijn op de borst (angina pectoris), hoge bloeddruk (hypertensie) en pulmonale hypertensie te behandelen. Adalat 30 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Adalat 20 mg behoort tot een klasse geneesmiddelen die calciumkanaalblokkers worden genoemd; Calciumkanaalblokkers, dihydropyridine.
Het is niet bekend of Adalat 30 mg veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Adalat 10 mg?
Adalat kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling in uw gezicht of keel,
- koorts,
- keelpijn,
- brandende ogen,
- huid pijn,
- rode of paarse huiduitslag met blaarvorming en vervelling,
- verergering van pijn op de borst,
- bonzende hartslagen,
- fladderend in je borst,
- duizeligheid,
- zwelling in uw handen of onderbenen,
- pijn in de bovenbuik, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Adalat zijn:
- zwelling,
- blozen (warmte, roodheid of tintelend gevoel),
- hoofdpijn,
- duizeligheid,
- misselijkheid,
- brandend maagzuur, en
- zich zwak of moe voelen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Adalat. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Adalat® CC is een tabletdoseringsvorm met verlengde afgifte van de calciumkanaalblokker nifedipine. Nifedipine is 3,5-pyridinedicarbonzuur, 1,4-dihydro-2,6-dimethyl-4-(2-nitrofenyl)-dimethylester, C17H18N2O6, en heeft de structuurformule:
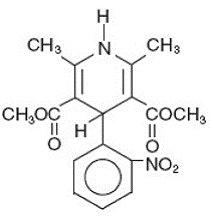
Nifedipine is een gele kristallijne stof, praktisch onoplosbaar in water maar oplosbaar in ethanol. Het heeft een molecuulgewicht van 346,3. Adalat CC-tabletten bestaan uit een externe laag en een interne kern. Beide bevatten nifedipine, de vacht als formulering met langzame afgifte en de kern als formulering met snelle afgifte. Adalat CC-tabletten bevatten ofwel: 30, 60 of 90 mg nifedipine voor eenmaal daagse orale toediening.
Inerte ingrediënten in de formulering zijn: hydroxypropylcellulose, lactose, maïszetmeel, crospovidon, microkristallijne cellulose, siliciumdioxide en magnesiumstearaat. De inerte ingrediënten in de filmcoating voor Adalat 30 mg CC 30 en 60 zijn: hypromellose, polyethyleenglycol, ijzeroxide en titaniumdioxide. De inerte ingrediënten in de filmcoating voor Adalat 20 mg CC 90 zijn: hypromellose, polyethyleenglycol en ijzeroxide
INDICATIES
Adalat 10 mg CC is geïndiceerd voor de behandeling van hypertensie. Het kan alleen of in combinatie met andere antihypertensiva worden gebruikt.
DOSERING EN ADMINISTRATIE
De dosering moet worden aangepast aan de behoeften van elke patiënt. Het wordt aanbevolen om Adalat 20 mg CC eenmaal daags oraal op een lege maag toe te dienen. Adalat 10 mg CC is een doseringsvorm met verlengde afgifte en tabletten moeten heel worden doorgeslikt, niet gebeten of verdeeld. Over het algemeen moet de titratie plaatsvinden over een periode van 7-14 dagen, beginnend met 30 mg eenmaal daags. Opwaartse titratie moet gebaseerd zijn op therapeutische werkzaamheid en veiligheid. De gebruikelijke onderhoudsdosering is 30 mg tot 60 mg eenmaal daags. Titratie naar doses hoger dan 90 mg per dag wordt niet aanbevolen.
Als stopzetting van Adalat 30 mg CC noodzakelijk is, suggereert goede klinische praktijk dat de dosering geleidelijk moet worden verlaagd onder nauwlettend toezicht van een arts.
Gelijktijdige toediening van nifedipine met grapefruitsap moet worden vermeden (zie: KLINISCHE FARMACOLOGIE en PREVENTIEVE MAATREGELEN ).
Voorzichtigheid is geboden bij het toedienen van Adalat CC om er zeker van te zijn dat de doseringsvorm met verlengde afgifte is voorgeschreven.
HOE GELEVERD
Adalat CC Tabletten met verlengde afgifte worden geleverd als ronde filmomhulde tabletten van 30 mg, 60 mg en 90 mg. De verschillende sterktes zijn als volgt te onderscheiden:
Adalat® CC-tabletten worden geleverd in:
De tabletten moeten worden beschermd tegen licht en vocht en bewaard beneden 30 °C (86 °F). Doseer in strakke, lichtbestendige containers.
Gefabriceerd voor: Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Gefabriceerd in Duitsland. Herzien: december 2015
BIJWERKINGEN
Bijwerkingen
De incidentie van bijwerkingen tijdens behandeling met Adalat CC in doses tot 90 mg per dag werd afgeleid uit multicenter placebogecontroleerde klinische onderzoeken bij 370 hypertensieve patiënten. Atenolol 50 mg eenmaal daags werd gelijktijdig gebruikt bij 187 van de 370 patiënten die Adalat CC kregen en bij 64 van de 126 patiënten die placebo kregen. Alle bijwerkingen die werden gemeld tijdens de behandeling met Adalat 30 mg CC werden getabelleerd, onafhankelijk van hun oorzakelijk verband met medicatie.
De meest voorkomende bijwerking die werd gemeld bij Adalat 10 mg CC was perifeer oedeem. Dit was dosisgerelateerd en de frequentie was 18% met Adalat 30 mg CC 30 mg per dag, 22% met Adalat 30 mg CC 60 mg per dag en 29% met Adalat 10 mg CC 90 mg per dag versus 10% met placebo.
Andere vaak voorkomende bijwerkingen die in de bovengenoemde placebogecontroleerde onderzoeken zijn gemeld, zijn onder meer:
Wanneer de frequentie van bijwerkingen met Adalat 20 mg CC en placebo vergelijkbaar is, kan geen causaal verband worden vastgesteld.
De volgende bijwerkingen werden gemeld met een incidentie van 3% of minder in dagelijkse doses tot 90 mg:
Lichaam als geheel/systemisch: pijn op de borst, pijn in de benen
Centraal zenuwstelsel: paresthesie, duizeligheid
dermatologisch: uitslag
Gastro-intestinaal: constipatie
Musculoskeletaal: beenkrampen
Ademhaling: epistaxis, rhinitis
Urogenitaal: impotentie, urinaire frequentie
Andere gemelde bijwerkingen met een incidentie van minder dan 1,0% waren:
Lichaam als geheel/systemisch: allergische reactie, asthenie, cellulitis, substernale pijn op de borst, koude rillingen, gezichtsoedeem, abnormale laboratoriumtest, malaise, nekpijn, bekkenpijn, pijn, fotosensitiviteitsreactie Cardiovasculair: atriale fibrillatie, bradycardie, hartstilstand, extrasystole, hypotensie, migraine, hartkloppingen , flebitis, orthostatische hypotensie, tachycardie, cutane angiectasen
Centraal zenuwstelsel: angst, verwardheid, verminderd libido, depressie, hypertonie, hypesthesie, slapeloosheid, slaperigheid
dermatologisch: angio-oedeem, petechiale uitslag, pruritus, zweten
Gastro-intestinaal: buikpijn, diarree, droge mond, dysfagie, dyspepsie, oprispingen, oesofagitis, flatulentie, gastro-intestinale stoornis, gastro-intestinale bloeding, GGT verhoogd, tandvleesaandoening, tandvleesbloeding, braken
Hematologische: eosinofilie, lymfadenopathie
Metabolisch: jicht, gewichtsverlies
Musculoskeletaal: artralgie, artritis, gewrichtsaandoening, myalgie, myasthenie
Ademhaling: dyspnoe, toegenomen hoest, rillingen, faryngitis, stridor
Speciale zintuigen: abnormaal zicht, amblyopie, conjunctivitis, diplopie, oogaandoening, oogbloeding, tinnitus
Urogenitaal/reproductief: dysurie, nierstenen, nocturie, stuwing van de borsten, polyurie, urogenitale aandoening, erectiestoornissen (ED)
De volgende bijwerkingen zijn zelden gemeld bij patiënten die nifedipine in vachtkern of andere formuleringen kregen: allergene hepatitis, alopecia, anafylactische reactie, anemie, artritis met ANA (+), depressie, erytromelalgie, exfoliatieve dermatitis, koorts, gingivale hyperplasie, gynaecomastie, hyperglykemie, geelzucht, leukopenie, stemmingswisselingen, spierkrampen, nervositeit, paranoïde syndroom, purpura, beverigheid, slaapstoornissen, Stevens-Johnson-syndroom, syncope, smaakverstoring, trombocytopenie, toxische epidermale necrolyse, voorbijgaande blindheid op het hoogtepunt van de plasmaspiegel, tremor en netelroos.
DRUG-INTERACTIES
Nifedipine wordt voornamelijk geëlimineerd door metabolisme en is een substraat van CYP3A. Remmers en inductoren van CYP3A kunnen de blootstelling aan nifedipine en bijgevolg de gewenste en ongewenste effecten beïnvloeden. In vitro en in vivo gegevens wijzen erop dat nifedipine het metabolisme kan remmen van geneesmiddelen die substraten zijn van CYP3A, waardoor de blootstelling aan andere geneesmiddelen toeneemt. Nifedipine is een vasodilatator en gelijktijdige toediening van andere geneesmiddelen die de bloeddruk beïnvloeden, kan leiden tot farmacodynamische interacties.
CYP3A-remmers
CYP3A-remmers zoals ketoconazol, fluconazol, itraconazol, claritromycine, erytromycine (azitromycine, hoewel structureel verwant aan de klasse van het macrolide-antibioticum, heeft geen klinisch relevante CYP3A4-remming), grapefruit, nefazodon, fluoxetine, saquinavir ritonavir, indinavir kunnen resulteren, en bij een verhoogde blootstelling aan nifedipine bij gelijktijdige toediening. Zorgvuldige monitoring en dosisaanpassing kunnen nodig zijn; overweeg om nifedipine te starten in de laagst beschikbare dosis als het gelijktijdig met deze medicijnen wordt gegeven.
Sterke CYP3A-inductoren
Sterke CYP3A-inductoren, zoals rifampicine, rifabutine, fenobarbital, fenytoïne, carbamazepine en sint-janskruid verminderen de biologische beschikbaarheid en werkzaamheid van nifedipine; daarom mag nifedipine niet worden gebruikt in combinatie met sterke CYP3A-inductoren zoals rifampicine (zie CONTRA-INDICATIES ).
Cardiovasculaire geneesmiddelen
Antiaritmica
kinidine: Kinidine is een substraat van CYP3A en het is aangetoond dat het CYP3A in vitro remt. Gelijktijdige toediening van meerdere doses kinidinesulfaat, 200 mg driemaal daags en nifedipine, 20 mg driemaal daags, verhoogde de Cmax en AUC van nifedipine bij gezonde vrijwilligers met respectievelijk factoren van 2,30 en 1,37. De hartslag in het eerste interval na toediening van het geneesmiddel was verhoogd tot 17,9 slagen/minuut. De blootstelling aan kinidine was niet significant veranderd in aanwezigheid van nifedipine. Monitoring van de hartslag en, indien nodig, aanpassing van de nifedipinedosis worden aanbevolen wanneer kinidine wordt toegevoegd aan een behandeling met nifedipine.
Flecaïnide: Er is te weinig ervaring met de gelijktijdige toediening van Tambocor met nifedipine om gelijktijdig gebruik aan te bevelen.
Calciumkanaalblokkers
Diltiazem: Voorbehandeling van gezonde vrijwilligers met 30 mg of 90 mg driemaal daags diltiazem po verhoogde de AUC van nifedipine na een enkelvoudige dosis van 20 mg nifedipine met respectievelijk factoren van 2,2 en 3,1. De overeenkomstige Cmax-waarden van nifedipine stegen met respectievelijk een factor 2,0 en 1,7. Voorzichtigheid is geboden bij gelijktijdige toediening van diltiazem en nifedipine en een verlaging van de dosis nifedipine moet worden overwogen.
verapamil: Verapamil, een CYP3A-remmer, kan het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een verlaging van de dosis nifedipine moet worden overwogen.
ACE-remmers
Benazepril: Bij gezonde vrijwilligers die een enkelvoudige dosis van 20 mg nifedipine ER en benazepril 10 mg kregen, waren de plasmaconcentraties van benazeprilaat en nifedipine in aanwezigheid en afwezigheid van elkaar niet statistisch significant verschillend. Een hypotensief effect werd alleen gezien na gelijktijdige toediening van de twee geneesmiddelen. Het tachycardeffect van nifedipine werd verzwakt in aanwezigheid van benazepril.
Angiotensine-II-blokkers
Irbesartan: In vitro-onderzoeken laten een significante remming zien van de vorming van geoxideerde irbesartanmetabolieten door nifedipine. In klinische onderzoeken had gelijktijdige toediening van nifedipine echter geen effect op de farmacokinetiek van irbesartan.
Candesartan: Er zijn geen significante geneesmiddelinteracties gemeld in onderzoeken met candesartan cilexitil samen met nifedipine. Omdat candesartan niet significant wordt gemetaboliseerd door het cytochroom P450-systeem en bij therapeutische concentraties geen effect heeft op cytochroom P450-enzymen, worden geen interacties verwacht met geneesmiddelen die deze enzymen remmen of erdoor worden gemetaboliseerd.
Bètablokkers
Adalat 10 mg CC werd goed verdragen wanneer het werd toegediend in combinatie met bètablokkers bij 187 hypertensieve patiënten in een placebogecontroleerd klinisch onderzoek. Er zijn echter incidentele literatuurrapporten die suggereren dat de combinatie van nifedipine en bèta-adrenerge blokkerende geneesmiddelen de kans op congestief hartfalen, ernstige hypotensie of verergering van angina bij patiënten met hart- en vaatziekten kan vergroten. Klinische controle wordt aanbevolen en een dosisaanpassing van nifedipine moet worden overwogen.
Timolol: Hypotensie is waarschijnlijker als dihydropryridine-calciumantagonisten zoals nifedipine gelijktijdig met timolol worden toegediend.
Centrale Alpha1-Blockers
Doxazosine: Gezonde vrijwilligers die deelnamen aan een interactiestudie met meerdere doses doxazosine en nifedipine kregen 2 mg doxazosine eenmaal daags alleen of gecombineerd met 20 mg nifedipine ER bid Gelijktijdige toediening van nifedipine resulteerde in een verlaging van de AUC en Cmax van doxazosine tot 83% en 86% van de waarden in de afwezigheid van respectievelijk nifedipine. In aanwezigheid van doxazosine waren de AUC en Cmax van nifedipine verhoogd met respectievelijk een factor 1,13 en 1,23. Vergeleken met nifedipine monotherapie was de bloeddruk lager in aanwezigheid van doxazosine. De bloeddruk moet worden gecontroleerd wanneer doxazosine gelijktijdig wordt toegediend met nifedipine, en dosisverlaging van nifedipine moet worden overwogen.
Digitalis
Digoxine: De gelijktijdige toediening van nifedipine en digoxine kan leiden tot een verminderde klaring, wat resulteert in een verhoging van de plasmaconcentraties van digoxine. Aangezien er geïsoleerde meldingen zijn van patiënten met verhoogde digoxinespiegels en er een mogelijke interactie is tussen digoxine en Adalat CC, wordt aanbevolen de digoxinespiegels te controleren bij het starten, aanpassen en staken van Adalat 10 mg CC om mogelijke over- of onder- digitalisering.
antitrombotica
Coumarines: Er zijn zeldzame meldingen geweest van een verlengde protrombinetijd bij patiënten die cumarine-anticoagulantia gebruikten en aan wie nifedipine werd toegediend. De relatie met nifedipinetherapie is echter onzeker.
Bloedplaatjesaggregatieremmers
Clopidogrel: Er werden geen klinisch significante farmacodynamische interacties waargenomen bij gelijktijdige toediening van clopidrogrel met nifedipine.
Tirofiban: Gelijktijdige toediening van nifedipine veranderde de blootstelling aan tirofiban niet in belangrijke mate.
Ander
Diuretica, PDE5-remmers, alfa-methyldopa: Nifedipine kan het bloeddrukverlagende effect van deze gelijktijdig toegediende middelen versterken.
Niet-cardiovasculaire geneesmiddelen
antischimmelmiddelen
Ketoconazol, itraconazol en fluconazol zijn CYP3A-remmers en kunnen het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een dosisverlaging van nifedipine moet worden overwogen.
Antisecretoire geneesmiddelen
Omeprazol: Bij gezonde vrijwilligers die een enkelvoudige dosis van 10 mg nifedipine kregen, waren de AUC en Cmax van nifedipine na voorbehandeling met omeprazol 20 mg eenmaal daags gedurende 8 dagen 1,26 en 0,87 maal die na voorbehandeling met placebo. Voorbehandeling met of gelijktijdige toediening van omeprazol had geen invloed op het effect van nifedipine op bloeddruk of hartslag. De impact van omeprazol op nifedipine is waarschijnlijk niet klinisch relevant.
Pantoprazol: Bij gezonde vrijwilligers veranderde de blootstelling aan geen van beide geneesmiddelen significant in aanwezigheid van het andere geneesmiddel.
ranitidine: Vijf onderzoeken bij gezonde vrijwilligers onderzochten de impact van meerdere ranitidinedoses op de farmacokinetiek van enkelvoudige of meervoudige doseringen van nifedipine. Twee studies onderzochten de impact van gelijktijdig toegediend ranitidine op de bloeddruk bij hypertensieve personen op nifedipine. Gelijktijdige toediening van ranitidine had geen relevante effecten op de blootstelling aan nifedipine die de bloeddruk of hartslag beïnvloedde bij normotensieve of hypertensieve personen.
Cimetidine: Vijf onderzoeken bij gezonde vrijwilligers onderzochten de impact van meerdere cimetidinedoses op de farmacokinetiek van enkelvoudige of meervoudige doseringen van nifedipine. Twee studies onderzochten de impact van gelijktijdig toegediende cimetidine op de bloeddruk bij hypertensieve personen op nifedipine. Bij normotensieve proefpersonen die enkelvoudige doses van 10 mg of meervoudige doses tot 20 mg nifedipine driemaal daags alleen of samen met cimetidine tot 1000 mg/dag kregen, waren de AUC-waarden van nifedipine in aanwezigheid van cimetidine tussen 1,52 en 2,01 maal die in de afwezigheid van cimetidine. De Cmax-waarden van nifedipine in aanwezigheid van cimetidine werden verhoogd met factoren tussen 1,60 en 2,02. De toename van de blootstelling aan nifedipine door cimetidine ging gepaard met relevante veranderingen in bloeddruk of hartslag bij normotensieve proefpersonen. Hypertensieve patiënten die 10 mg eenmaal daags nifedipine alleen of in combinatie met cimetidine 1000 mg eenmaal daags kregen, ondervonden ook relevante veranderingen in bloeddruk wanneer cimetidine werd toegevoegd aan nifedipine. De interactie tussen cimetidine en nifedipine is klinisch relevant en de bloeddruk moet worden gecontroleerd en een verlaging van de dosis nifedipine moet worden overwogen.
Cisapride: Gelijktijdige toediening van cisapride en nifedipine kan leiden tot verhoogde plasmaconcentraties van nifedipine.
Antibacteriële geneesmiddelen
Quinupristine/Dalfopristine: In vitro onderzoek naar geneesmiddelinteracties heeft aangetoond dat quinupristine/dalfopristine het CYP3A-metabolisme van nifedipine significant remt. Gelijktijdige toediening van quinupristine/dalfopristine en nifedipine (herhaalde orale dosis) aan gezonde vrijwilligers verhoogde de AUC en Cmax voor nifedipine met respectievelijk een factor 1,44 en 1,18, vergeleken met nifedipine monotherapie. Bij gelijktijdige toediening van quinupristine/dalfopristine met nifedipine moet de bloeddruk worden gecontroleerd en moet een verlaging van de dosis nifedipine worden overwogen.
Erytromycine: Erytromycine, een CYP3A-remmer, kan het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een verlaging van de dosis nifedipine moet worden overwogen.
Antituberculaire geneesmiddelen
rifampicine: Sterke CYP3A-inductoren, zoals rifampicine, rifapentine en rifabutine, verminderen de biologische beschikbaarheid van nifedipine, wat de werkzaamheid van nifedipine kan verminderen; daarom mag nifedipine niet worden gebruikt in combinatie met sterke CYP3A-inductoren zoals rifampicine (zie CONTRA-INDICATIES ). De impact van meerdere orale doses van 600 mg rifampicine op de farmacokinetiek van nifedipine na een enkelvoudige orale dosis van 20 mg nifedipinecapsule werd geëvalueerd in een klinisch onderzoek. Twaalf gezonde mannelijke vrijwilligers kregen een enkele orale dosis van 20 mg nifedipine capsule op studiedag 1. Vanaf studiedag 2 kregen de proefpersonen 600 mg rifampicine eenmaal daags gedurende 14 dagen. Op onderzoeksdag 15 werd een tweede enkelvoudige orale dosis van 20 mg nifedipine capsule toegediend samen met de laatste dosis rifampicine. Vergeleken met studiedag 1, verminderde 14 dagen voorbehandeling met rifampicine de Cmax en AUC van gelijktijdig toegediend nifedipine met gemiddeld respectievelijk 95% en 97%.

Antivirale geneesmiddelen
Amprenavir, atanazavir, delavirine, fosamprinavir, indinavir, nelfinavir en ritonavir, als CYP3A-remmers, kunnen het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen. Voorzichtigheid is geboden en klinische monitoring van patiënten wordt aanbevolen.
CZS-medicijnen
Nefazodon, een CYP3A-remmer, kan het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een verlaging van de dosis nifedipine moet worden overwogen.
Fluoxetine, een CYP3A-remmer, kan het metabolisme van nifedipine remmen en de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een verlaging van de dosis nifedipine moet worden overwogen.
Valproïnezuur kan de blootstelling aan nifedipine verhogen tijdens gelijktijdige behandeling. De bloeddruk moet worden gecontroleerd en een dosisverlaging van nifedipine moet worden overwogen.
Fenytoïne, Fenobarbital en Carbamazepine: Nifedipine wordt gemetaboliseerd door CYP3A. Gelijktijdige toediening van nifedipine 10 mg capsule en 60 mg nifedipine omhulseltablet met fenytoïne, een inductor van CYP3A, verlaagde de AUC en Cmax van nifedipine met ongeveer 70%. Fenobarbital en carbamazepine zijn ook inductoren van CYP3A. Alternatieve antihypertensieve therapie moet worden overwogen bij patiënten die fenytoïne, fenobarbital en carbamazepine gebruiken.
Anti-emetische medicijnen
Dolasetron: Bij patiënten die dolasetron oraal of intraveneus en nifedipine gebruikten, werd geen effect aangetoond op de klaring van hydrodolasetron.
Immunosuppressieve geneesmiddelen
Tacrolimus: Het is aangetoond dat tacrolimus wordt gemetaboliseerd via het CYP3A-systeem. Van nifedipine is aangetoond dat het het metabolisme van tacrolimus in vitro remt. Transplantatiepatiënten op tacrolimus en nifedipine hadden 26% tot 38% lagere doses nodig dan patiënten die geen nifedipine kregen. Nifedipine kan de blootstelling aan tacrolimus verhogen. Bij gelijktijdige toediening van nifedipine met tacrolimus moeten de bloedconcentraties van tacrolimus worden gecontroleerd en moet een verlaging van de dosis tacrolimus worden overwogen.
Sirolimus: Een enkelvoudige dosis van 60 mg nifedipine en een enkelvoudige dosis van 10 mg sirolimus drank werden toegediend aan 24 gezonde vrijwilligers. Klinisch significante farmacokinetische geneesmiddelinteracties werden niet waargenomen.
Glucoseverlagende medicijnen
Pioglitazon: Gelijktijdige toediening van pioglitazon gedurende 7 dagen met 30 mg nifedipine ER eenmaal per dag oraal toegediend gedurende 4 dagen aan mannelijke en vrouwelijke vrijwilligers resulteerde in kleinste-kwadratengemiddelde (90% BI) waarden voor onveranderd nifedipine van 0,83 (0,73-0,95) voor Cmax en 0,88 ( 0,80-0,96) voor AUC ten opzichte van nifedipine monotherapie. Gezien de grote variabiliteit van de farmacokinetiek van nifedipine is de klinische betekenis van deze bevinding niet bekend.
Rosiglitazon: Gelijktijdige toediening van rosiglitazon (4 mg tweemaal daags) bleek geen klinisch relevant effect te hebben op de farmacokinetiek van nifedipine.
Metformine: Een interactiestudie met metformine en nifedipine met een enkelvoudige dosis bij normale gezonde vrijwilligers toonde aan dat gelijktijdige toediening van nifedipine de plasmametformine Cmax en AUC met respectievelijk 20% en 9% verhoogde en de hoeveelheid metformine die in de urine werd uitgescheiden, verhoogde. Tmax en halfwaardetijd werden niet beïnvloed. Nifedipine lijkt de absorptie van metformine te verbeteren.
Miglitol: Er werd geen effect van miglitol op de farmacokinetiek en farmacodynamiek van nifedipine waargenomen.
Repaglinide: Gelijktijdige toediening van 10 mg nifedipine met een enkele dosis van 2 mg repaglinide (na 4 dagen nifedipine 10 mg driemaal daags en repaglinide 2 mg driemaal daags) resulteerde in onveranderde AUC- en Cmax-waarden voor beide geneesmiddelen.
Acarbose: Nifedipine heeft de neiging hyperglykemie te veroorzaken en kan leiden tot verlies van glucoseregulatie. Als nifedipine gelijktijdig wordt toegediend met acarbose, moeten de bloedglucosespiegels zorgvuldig worden gecontroleerd en moet een dosisaanpassing van nifedipine worden overwogen.
Geneesmiddelen die de voedselopname verstoren
Orlistat: Bij 17 proefpersonen met een normaal gewicht die orlistat 120 mg driemaal daags gedurende 6 dagen kregen, veranderde orlistat de biologische beschikbaarheid van 60 mg nifedipine (tabletten met verlengde afgifte) niet.
Voedingssupplementen
Grapefruit SAP: Bij gezonde vrijwilligers verhoogde een enkele dosis gelijktijdige toediening van 250 ml pompelmoessap met dubbele sterkte en 10 mg nifedipine de AUC en Cmax met respectievelijk een factor van 1,35 en 1,13. Inname van herhaalde doses grapefruitsap (5 x 200 ml in 12 uur) na toediening van 20 mg nifedipine ER verhoogde de AUC en Cmax van nifedipine met een factor 2. Grapefruitsap moet worden vermeden door patiënten die nifedipine gebruiken. De inname van grapefruitsap moet ten minste 3 dagen voordat patiënten met nifedipine worden gestart, worden gestopt.
kruiden
Sint-janskruid: Sint-janskruid is een inductor van CYP3A en kan de blootstelling aan nifedipine verminderen. Bij patiënten bij wie behandeling met sint-janskruid noodzakelijk is, moet een alternatieve antihypertensieve therapie worden overwogen.
CYP2D6-sondegeneesmiddel
Debrisoquine: Bij gezonde vrijwilligers veranderde voorbehandeling met nifedipine 20 mg driemaal daags gedurende 5 dagen de metabolische verhouding van hydroxydebrisoquine tot puinoquine gemeten in de urine na een enkelvoudige dosis van 10 mg puinoquine. Het is dus onwaarschijnlijk dat nifedipine in vivo het metabolisme remt van andere geneesmiddelen die substraten zijn van CYP2D6.
WAARSCHUWINGEN
Overmatige hypotensie
Hoewel het hypotensieve effect van nifedipine bij de meeste patiënten bescheiden is en goed wordt verdragen, hebben incidentele patiënten overmatige en slecht verdragen hypotensie gehad. Deze reacties traden gewoonlijk op tijdens de initiële titratie of op het moment van daaropvolgende opwaartse dosisaanpassing, en zijn waarschijnlijker bij patiënten die gelijktijdig bètablokkers gebruiken.
Ernstige hypotensie en/of verhoogde behoefte aan vochtvolume zijn gemeld bij patiënten die capsules met directe afgifte kregen samen met een bètablokker en die een bypassoperatie van de kransslagader ondergingen met behulp van een hoge dosis fentanyl-anesthesie. De interactie met hoge doses fentanyl lijkt het gevolg te zijn van de combinatie van nifedipine en een bètablokker, maar de mogelijkheid dat deze kan optreden met alleen nifedipine, met lage doses fentanyl, bij andere chirurgische procedures of met andere narcotische analgetica kan niet worden uitgesloten. uitgesloten. Bij met nifedipine behandelde patiënten bij wie een operatie met een hoge dosis fentanyl-anesthesie wordt overwogen, moet de arts zich bewust zijn van deze mogelijke problemen en, als de toestand van de patiënt het toelaat, moet er voldoende tijd (ten minste 36 uur) worden gegeven om nifedipine uit de huid te wassen. het lichaam voorafgaand aan de operatie.
Verhoogde angina en/of myocardinfarct
Zelden hebben patiënten, vooral degenen met ernstige obstructieve coronaire hartziekte, een goed gedocumenteerde verhoogde frequentie, duur en/of ernst van angina of acuut myocardinfarct ontwikkeld bij het starten met nifedipine of op het moment van dosisverhoging. Het mechanisme van dit effect is niet vastgesteld.
Beta-Blocker Intrekking
Als u stopt met een bètablokker, is het belangrijk om de dosis, indien mogelijk, af te bouwen in plaats van abrupt te stoppen voordat u met nifedipine begint. Patiënten die recentelijk zijn gestopt met bètablokkers, kunnen een ontwenningssyndroom ontwikkelen met verhoogde angina, waarschijnlijk gerelateerd aan een verhoogde gevoeligheid voor catecholamines. Het starten van een behandeling met nifedipine zal dit optreden niet voorkomen en het is soms gemeld dat het dit verergert.
Congestief hartfalen
Zelden hebben patiënten (meestal terwijl ze een bètablokker kregen) hartfalen ontwikkeld na het starten met nifedipine. Patiënten met een strakke aortastenose lopen mogelijk een groter risico op een dergelijk voorval, aangezien het ontladende effect van nifedipine naar verwachting minder gunstig zou zijn voor deze patiënten, vanwege hun vaste impedantie om over de aortaklep te stromen.
PREVENTIEVE MAATREGELEN
Algemeen
Hypotensie
Omdat nifedipine de perifere vaatweerstand verlaagt, wordt aangeraden de bloeddruk tijdens de eerste toediening en titratie van Adalat CC zorgvuldig te controleren. Nauwkeurige observatie wordt met name aanbevolen voor patiënten die al medicijnen gebruiken waarvan bekend is dat ze de bloeddruk verlagen (zie: WAARSCHUWINGEN ).
Perifeer oedeem
Mild tot matig perifeer oedeem treedt dosisafhankelijk op bij Adalat CC. Het placebo-afgetrokken percentage is ongeveer 8% bij 30 mg, 12% bij 60 mg en 19% bij 90 mg per dag. Dit oedeem is een gelokaliseerd fenomeen, waarvan wordt gedacht dat het verband houdt met vasodilatatie van afhankelijke arteriolen en kleine bloedvaten en niet te wijten is aan linkerventrikeldisfunctie of gegeneraliseerde vochtretentie. Bij patiënten bij wie de hypertensie gecompliceerd is door congestief hartfalen, dient men voorzichtig te zijn om dit perifere oedeem te onderscheiden van de effecten van toenemende linkerventrikeldisfunctie.
Gebruik bij patiënten met cirrose
De klaring van nifedipine is verminderd en de systemische blootstelling verhoogd bij patiënten met cirrose. Het is niet bekend hoe de systemische blootstelling kan veranderen bij patiënten met een matige of ernstige leverfunctiestoornis. Zorgvuldige monitoring en dosisverlaging kunnen nodig zijn; overweeg de behandeling te starten met de laagst beschikbare dosis.
Laboratorium testen
Zeldzame, meestal voorbijgaande, maar soms significante verhogingen van enzymen zoals alkalische fosfatase, CPK, LDH, SGOT en SGPT zijn waargenomen. De relatie met nifedipinetherapie is in de meeste gevallen onzeker, maar in sommige gevallen waarschijnlijk. Deze laboratoriumafwijkingen zijn zelden in verband gebracht met klinische symptomen; er is echter melding gemaakt van cholestase met of zonder geelzucht. Een kleine toename (
Nifedipine vermindert, net als andere calciumantagonisten, de bloedplaatjesaggregatie in vitro. Beperkte klinische onderzoeken hebben bij sommige nifedipinepatiënten een matige maar statistisch significante afname van de bloedplaatjesaggregatie en een toename van de bloedingstijd aangetoond. Men denkt dat dit een functie is van de remming van calciumtransport door het bloedplaatjesmembraan. Er is geen klinische betekenis voor deze bevindingen aangetoond.
Positieve directe Coombs-test met of zonder hemolytische anemie is gemeld, maar een causaal verband tussen toediening van nifedipine en positiviteit van deze laboratoriumtest, inclusief hemolyse, kon niet worden vastgesteld.
Hoewel nifedipine veilig is gebruikt bij patiënten met nierdisfunctie en waarvan is gemeld dat het in bepaalde gevallen een gunstig effect heeft, zijn zeldzame omkeerbare verhogingen van BUN en serumcreatinine gemeld bij patiënten met reeds bestaande chronische nierinsufficiëntie. De relatie met nifedipinetherapie is in de meeste gevallen onzeker, maar in sommige gevallen waarschijnlijk.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Nifedipine werd gedurende twee jaar oraal toegediend aan ratten en bleek niet kankerverwekkend te zijn. Bij toediening aan ratten voorafgaand aan de paring veroorzaakte nifedipine verminderde vruchtbaarheid bij een dosis van ongeveer 30 maal de maximaal aanbevolen dosis voor de mens. Er is een literatuurrapport over een omkeerbare vermindering van het vermogen van menselijk sperma, verkregen van een beperkt aantal onvruchtbare mannen die de aanbevolen doses nifedipine gebruiken, om zich in vitro te binden aan een eicel en deze te bevruchten. In vivo mutageniteitsstudies waren negatief.
Zwangerschap
Zwangerschap Categorie C
Bij knaagdieren, konijnen en apen is aangetoond dat nifedipine een verscheidenheid aan embryotoxische, placentotoxische, teratogene en foetotoxische effecten heeft, waaronder onvolgroeide foetussen (ratten, muizen en konijnen), digitale anomalieën (ratten en konijnen), ribmisvormingen (muizen), gespleten gehemelte (muizen), kleine placenta's en onderontwikkelde chorionvlokken (apen), embryonale en foetale sterfte (ratten, muizen en konijnen), verlengde zwangerschap (ratten; niet geëvalueerd bij andere soorten) en verminderde neonatale overleving (ratten; niet geëvalueerd in andere soorten). Op basis van mg/kg of mg/m² zijn sommige van de doses die verband houden met deze verschillende effecten hoger dan de maximaal aanbevolen dosis voor de mens en sommige zijn lager, maar ze liggen allemaal binnen een orde van grootte ervan.
De digitale anomalieën die worden waargenomen bij aan nifedipine blootgestelde konijnenjongen zijn opvallend vergelijkbaar met die waargenomen bij pups die zijn blootgesteld aan fenytoïne, en deze zijn op hun beurt vergelijkbaar met de falangeale misvormingen die de meest voorkomende misvorming zijn die wordt gezien bij menselijke kinderen met in utero blootstelling aan fenytoïne.
Op basis van het beschikbare klinische bewijs is geen specifiek prenataal risico vastgesteld. Er is echter een toename gemeld van perinatale asfyxie, keizersnede, vroeggeboorte en intra-uteriene groeivertraging.
Bij zwangere vrouwen moet de bloeddruk zorgvuldig worden gecontroleerd wanneer nifedipine wordt toegediend in combinatie met IV magnesiumsulfaat, vanwege de mogelijkheid van een overmatige bloeddrukdaling die de moeder en de foetus zou kunnen schaden.
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen.
Moeders die borstvoeding geven
Nifedipine wordt uitgescheiden in de moedermelk. Moeders die borstvoeding geven, wordt geadviseerd hun baby's geen borstvoeding te geven tijdens het gebruik van het medicijn.
Pediatrisch gebruik
De veiligheid en werkzaamheid van Adalat 30 mg CC bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Hoewel kleine farmacokinetische onderzoeken een verhoogde halfwaardetijd en verhoogde Cmax en AUC hebben aangetoond (zie: KLINISCHE FARMACOLOGIE : Farmacokinetiek en metabolisme ), omvatten klinische onderzoeken met nifedipine niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Patiënten met galactose-intolerantie
Aangezien dit geneesmiddel lactose bevat, mogen patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, Lapp-lactasedeficiëntie of glucose-galactosemalabsorptie dit geneesmiddel niet gebruiken.
OVERDOSERING
Ervaring met overdosering van nifedipine is beperkt. Symptomen die gepaard gaan met ernstige overdosering met nifedipine zijn onder meer bewustzijnsverlies, bloeddrukdaling, hartritmestoornissen, metabole acidose, hypoxie, cardiogene shock met longoedeem. Over het algemeen vereist overdosering met nifedipine die leidt tot uitgesproken hypotensie, actieve cardiovasculaire ondersteuning, waaronder controle van de cardiovasculaire en respiratoire functie, verhoging van extremiteiten, oordeelkundig gebruik van calciuminfusie, bloeddrukverhogende middelen en vloeistoffen. Na orale inname is een grondige maagspoeling aangewezen, eventueel in combinatie met irrigatie van de dunne darm. In gevallen van overdosering van een product met vertraagde afgifte zoals nifedipine, moet de eliminatie zo volledig mogelijk zijn, ook uit de dunne darm, om de daaropvolgende absorptie van de werkzame stof te voorkomen. Extra vloeistof of volume moet met voorzichtigheid worden toegediend vanwege het risico op vloeistofoverbelasting.
De klaring van nifedipine zou naar verwachting langer duren bij patiënten met een verminderde leverfunctie. Aangezien nifedipine sterk eiwitgebonden is, zal dialyse waarschijnlijk geen voordeel opleveren; plasmaferese kan echter gunstig zijn.
Er is één geval gemeld van massale overdosering met tabletten van een andere formulering van nifedipine met verlengde afgifte. De belangrijkste effecten van inname van ongeveer 4800 mg nifedipine bij een jonge man die zelfmoord probeerde te plegen als gevolg van door cocaïne veroorzaakte depressie waren aanvankelijke duizeligheid, hartkloppingen, blozen en nervositeit. Binnen enkele uren na inname ontwikkelden zich misselijkheid, braken en algemeen oedeem. Er was geen significante hypotensie bij presentatie, 18 uur na inname. Bloedchemieafwijkingen bestonden uit een milde, voorbijgaande verhoging van serumcreatinine en bescheiden verhogingen van LDH en CPK, maar normale SGOT. De vitale functies bleven stabiel, er werden geen elektrocardiografische afwijkingen opgemerkt en de nierfunctie keerde binnen 24 tot 48 uur terug naar normaal met alleen routinematige ondersteunende maatregelen. Er werden geen langdurige gevolgen waargenomen.
Het effect van een eenmalige inname van 900 mg nifedipine-capsules bij een depressieve angina-patiënt op tricyclische antidepressiva was bewustzijnsverlies binnen 30 minuten na inname en ernstige hypotensie, die reageerde op calciuminfusie, pressormiddelen en vochtvervanging. Een verscheidenheid aan ECG-afwijkingen werd gezien bij deze patiënt met een voorgeschiedenis van bundeltakblok, waaronder sinusbradycardie en verschillende gradaties van AV-blok. Deze dicteerden de profylactische plaatsing van een tijdelijke ventriculaire pacemaker, maar verdwenen verder spontaan. Bij deze patiënt werd aanvankelijk significante hyperglykemie gezien, maar de plasmaglucosespiegels normaliseerden snel zonder verdere behandeling.
Een jonge hypertensieve patiënt met gevorderd nierfalen nam in één keer 280 mg nifedipine-capsules in, met als gevolg duidelijke hypotensie die reageerde op calciuminfusie en vloeistoffen. Er werden geen AV-geleidingsafwijkingen, aritmieën of uitgesproken veranderingen in de hartslag waargenomen, noch was er enige verdere verslechtering van de nierfunctie.
Bradycardiale hartritmestoornissen kunnen symptomatisch worden behandeld met -sympathicomimetica, en bij levensbedreigende bradycardiestoornissen van het hartritme kan tijdelijke pacemakertherapie raadzaam zijn.
CONTRA-INDICATIES
Gelijktijdige toediening met sterke P450-inductoren, zoals rifampicine, is gecontra-indiceerd omdat de werkzaamheid van nifedipinetabletten aanzienlijk kan worden verminderd. (Zien DRUG-INTERACTIES )
Nifedipine mag niet worden gebruikt in geval van cardiogene shock.
Adalat is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor een van de bestanddelen van de tablet.
KLINISCHE FARMACOLOGIE
Nifedipine is een calciumion-influxremmer (slow-channel blocker of calciumion-antagonist) die de transmembraaninflux van calciumionen in vasculaire gladde spieren en hartspier remt. De contractiele processen van vasculaire gladde spieren en hartspier zijn afhankelijk van de beweging van extracellulaire calciumionen in deze cellen via specifieke ionenkanalen. Nifedipine remt selectief de instroom van calciumionen door het celmembraan van vasculaire gladde spieren en hartspier zonder de serumcalciumconcentraties te veranderen.
Werkingsmechanisme
Het mechanisme waarmee nifedipine de arteriële bloeddruk verlaagt, omvat perifere arteriële vasodilatatie en bijgevolg een verlaging van de perifere vasculaire weerstand. De verhoogde perifere vasculaire weerstand, een onderliggende oorzaak van hypertensie, is het gevolg van een toename van de actieve spanning in de vasculaire gladde spieren. Studies hebben aangetoond dat de toename van actieve spanning een toename van cytosolvrij calcium weerspiegelt.
Nifedipine is een perifere arteriële vasodilatator die direct inwerkt op vasculaire gladde spieren. De binding van nifedipine aan spanningsafhankelijke en mogelijk door receptoren bediende kanalen in vasculaire gladde spieren resulteert in een remming van de calciuminstroom via deze kanalen. Opslag van intracellulair calcium in vasculaire gladde spieren is beperkt en dus afhankelijk van de instroom van extracellulair calcium om contractie te laten plaatsvinden. De vermindering van de calciuminstroom door nifedipine veroorzaakt arteriële vasodilatatie en verminderde perifere vasculaire weerstand, wat resulteert in een verlaagde arteriële bloeddruk.
Farmacokinetiek en metabolisme
Nifedipine wordt volledig geabsorbeerd na orale toediening. De biologische beschikbaarheid van nifedipine als Adalat CC ten opzichte van nifedipine met onmiddellijke afgifte ligt tussen 84% en 89%. Na inname van Adalat CC-tabletten in nuchtere toestand, pieken de plasmaconcentraties na ongeveer 2,5-5 uur met een tweede kleine piek of schouder die duidelijk wordt op ongeveer 6-12 uur na de dosis. De eliminatiehalfwaardetijd van nifedipine toegediend als Adalat CC is ongeveer 7 uur in tegenstelling tot de bekende 2 uur eliminatiehalfwaardetijd van nifedipine toegediend als capsule met onmiddellijke afgifte.
Wanneer Adalat CC wordt toegediend als veelvouden van tabletten van 30 mg over een dosisbereik van 30 mg tot 90 mg, is de oppervlakte onder de curve (AUC) dosisproportioneel; de piekplasmaconcentratie voor de dosis van 90 mg gegeven als 3 x 30 mg is echter 29% hoger dan voorspeld op basis van de doses van 30 mg en 60 mg.
Twee Adalat CC-tabletten van 30 mg kunnen worden verwisseld met een Adalat CC-tablet van 60 mg. Drie 30 mg Adalat CC-tabletten resulteren echter in aanzienlijk hogere Cmax-waarden dan die na een enkele 90 mg Adalat 20 mg CC-tablet. Drie tabletten van 30 mg mogen daarom niet worden beschouwd als onderling verwisselbaar met een tablet van 90 mg.
Een eenmaal daagse dosering van Adalat CC onder nuchtere omstandigheden resulteert in verminderde fluctuaties in de plasmaconcentratie van nifedipine in vergelijking met drievoudige dosering met nifedipine-capsules met onmiddellijke afgifte. De gemiddelde piekplasmaconcentratie van nifedipine na een 90 mg Adalat 30 mg CC-tablet, toegediend in nuchtere toestand, is ongeveer 115 ng/ml. Wanneer Adalat CC onmiddellijk na een vetrijke maaltijd wordt gegeven aan gezonde vrijwilligers, is er een gemiddelde toename van 60% in de piekplasmaconcentratie van nifedipine, een verlenging van de tijd tot piekconcentratie, maar geen significante verandering in de AUC. Plasmaconcentraties van nifedipine wanneer Adalat 20 mg CC wordt ingenomen na een vette maaltijd, resulteren in iets lagere pieken in vergelijking met dezelfde dagelijkse dosis van de formulering met onmiddellijke afgifte die in drie verdeelde doses wordt toegediend. Dit kan gedeeltelijk zijn omdat Adalat CC minder biologisch beschikbaar is dan de formulering met onmiddellijke afgifte.
Nifedipine wordt uitgebreid gemetaboliseerd tot zeer in water oplosbare, inactieve metabolieten die 60% tot 80% van de dosis vertegenwoordigen die in de urine wordt uitgescheiden. Alleen sporen (minder dan 0,1% van de dosis) van de onveranderde vorm kunnen in de urine worden gedetecteerd. De rest wordt uitgescheiden in de feces in gemetaboliseerde vorm, hoogstwaarschijnlijk als gevolg van uitscheiding via de gal.
Nifedipine wordt gemetaboliseerd via het cytochroom P450 3A4-systeem. Geneesmiddelen waarvan bekend is dat ze dit enzymsysteem remmen of induceren, kunnen de first-pass of klaring van nifedipine veranderen.
Er zijn geen onderzoeken uitgevoerd met Adalat 30 mg CC bij patiënten met nierfalen; er zijn echter geen significante veranderingen in de farmacokinetiek van nifedipine-capsules met onmiddellijke afgifte gemeld bij patiënten die hemodialyse of chronische ambulante peritoneale dialyse ondergaan. Aangezien de absorptie van nifedipine uit Adalat CC kan worden gewijzigd door nierziekte, is voorzichtigheid geboden bij de behandeling van dergelijke patiënten.
Omdat nifedipine wordt gemetaboliseerd via het cytochroom P450 3A4-systeem, kan de farmacokinetiek ervan veranderen bij patiënten met chronische leverziekte. Adalat 20 mg CC is niet onderzocht bij patiënten met een leveraandoening; bij patiënten met een leverfunctiestoornis (levercirrose) heeft nifedipine echter een langere eliminatiehalfwaardetijd en een hogere biologische beschikbaarheid dan bij gezonde vrijwilligers.
De mate van eiwitbinding van nifedipine is hoog (92%-98%). De eiwitbinding kan sterk verminderd zijn bij patiënten met nier- of leverinsufficiëntie.
Na toediening van Adalat 30 mg CC aan gezonde oudere mannen en vrouwen (leeftijd > 60 jaar) is de gemiddelde Cmax 36% hoger en de gemiddelde plasmaconcentratie 70% hoger dan bij jongere patiënten.
Bij gezonde proefpersonen was de eliminatiehalfwaardetijd van een andere formulering van nifedipine met aanhoudende afgifte langer bij oudere proefpersonen (6,7 uur) vergeleken met jonge proefpersonen (3,8 uur) na orale toediening. Een verminderde klaring werd ook waargenomen bij ouderen (348 ml/min) in vergelijking met jonge proefpersonen (519 ml/min) na intraveneuze toediening.
Gelijktijdige toediening van nifedipine met grapefruitsap resulteert in een tot 2-voudige toename van de AUC en Cmax als gevolg van remming van het CYP3A-gerelateerd first-pass metabolisme. Inname van grapefruit en grapefruitsap moet worden vermeden tijdens het gebruik van nifedipine.
Klinische studies
Adalat 10 mg CC veroorzaakte dosisgerelateerde verlagingen van de systolische en diastolische bloeddruk, zoals aangetoond in twee dubbelblinde, gerandomiseerde, placebogecontroleerde onderzoeken waarin meer dan 350 patiënten werden behandeld met Adalat CC 30, 60 of 90 mg eenmaal daags gedurende 6 weken. In de eerste studie werd Adalat 10 mg CC als monotherapie gegeven en in de tweede studie werd Adalat 20 mg CC toegevoegd aan een bètablokker bij patiënten die niet onder controle waren met alleen een bètablokker. De gemiddelde dalwaarde (24 uur na dosis) bloeddrukresultaten van deze onderzoeken worden hieronder weergegeven:
GEMIDDELDE VERLAGINGEN IN DE TROUGH REGISTRATIE BLOEDDRUK (mmHg) SYSTOLISCH/DIASTOLISCH
De dal/piek-ratio's geschat op basis van 24-uurs bloeddrukmeting varieerden van 41% -78% voor diastolische en 46% -91% voor systolische bloeddruk.
Hemodynamiek
Net als andere langzame-kanaalblokkers oefent nifedipine een negatief inotroop effect uit op geïsoleerd myocardweefsel. Dit wordt zelden of nooit gezien bij intacte dieren of mensen, waarschijnlijk vanwege reflexreacties op de vaatverwijdende effecten. Bij de mens verlaagt nifedipine de perifere vasculaire weerstand, wat leidt tot een daling van de systolische en diastolische druk, meestal minimaal bij normotensieve vrijwilligers (minder dan 5-10 mm Hg systolisch), maar soms groter. Met Adalat 30 mg CC gaan deze bloeddrukdalingen niet gepaard met een significante verandering in de hartslag. Hemodynamische onderzoeken naar de formulering van nifedipine met onmiddellijke afgifte bij patiënten met een normale ventriculaire functie hebben over het algemeen een kleine toename van de hartindex gevonden zonder grote effecten op de ejectiefractie, de linker ventriculaire einddiastolische druk (LVEDP) of het volume (LVEDV). Bij patiënten met een verminderde ventriculaire functie hebben de meeste acute onderzoeken een toename van de ejectiefractie en een afname van de linkerventrikelvuldruk aangetoond.
Elektrofysiologische effecten
Hoewel nifedipine, net als andere leden van zijn klasse, een lichte onderdrukking van de functie van de sinusknoop en atrioventriculaire geleiding veroorzaakt in geïsoleerde myocardpreparaten, zijn dergelijke effecten niet waargenomen in onderzoeken bij intacte dieren of bij de mens. In formele elektrofysiologische onderzoeken, voornamelijk bij patiënten met normale geleidingssystemen, had nifedipine, toegediend als de capsule met onmiddellijke afgifte, niet de neiging om de atrioventriculaire geleiding of de hersteltijd van de sinusknoop te verlengen, of om de sinusfrequentie te vertragen.
PATIËNT INFORMATIE
Adalat CC is een tablet met verlengde afgifte en moet heel worden doorgeslikt en op een lege maag worden ingenomen. Het mag niet met voedsel worden toegediend. De tabletten niet kauwen, verdelen of fijnmaken.
