Catapres 100mcg Clonidine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Catapres en hoe wordt het gebruikt?
Catapres is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van symptomen van hoge bloeddruk, aandachtstekortstoornis met hyperactiviteit (ADHD) en pijn bij kanker. Catapres 100mcg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Catapres 100mcg behoort tot een klasse geneesmiddelen die Alpha2-agonisten, centraal werkende, ADHD-agentia worden genoemd.
Het is niet bekend of Catapres 100mcg veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Catapres?
Catapres kan ernstige bijwerkingen veroorzaken, waaronder:
- ontwenningsverschijnselen,
- nervositeit,
- agitatie,
- hoofdpijn,
- tremor, en
- snelle stijging van de bloeddruk
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Catapres 100mcg zijn:
- droge mond,
- duizeligheid,
- slaperigheid,
- vermoeidheid,
- constipatie,
- hoofdpijn,
- misselijkheid, en
- moeite met slapen (slapeloosheid)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Catapres. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Catapres® (clonidinehydrochloride, USP) is een centraal werkend alfa-agonist hypotensief middel dat verkrijgbaar is als tabletten voor orale toediening in drie doseringssterkten: 0, 1 mg, 0, 2 mg en 0, 3 mg. De tablet van 0,1 mg komt overeen met 0,087 mg van de vrije base.
De inactieve ingrediënten zijn colloïdaal siliciumdioxide, maïszetmeel, dibasisch calciumfosfaat, FD & C Yellow No. 6, gelatine, glycerine, lactose en magnesiumstearaat. De Catapres 0,1 mg tablet bevat ook FD&C Blue No.1 en FD&C Red No.3.
Clonidinehydrochloride is een imidazolinederivaat en bestaat als een mesomere verbinding. De chemische naam is 2-(2,6-dichloorfenylamino)-2-imidazolinehydrochloride. Het volgende is de structuurformule:
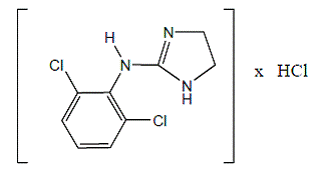 C9H9Cl2N3 · HCl Mol. gewicht 266.56
C9H9Cl2N3 · HCl Mol. gewicht 266.56 Clonidinehydrochloride is een geurloze, bittere, witte, kristallijne stof die oplosbaar is in water en alcohol.
INDICATIES
CATAPRES-tabletten zijn geïndiceerd voor de behandeling van hypertensie. CATAPRES-tabletten kunnen alleen of gelijktijdig met andere antihypertensiva worden gebruikt.
DOSERING EN ADMINISTRATIE
volwassenen
De dosis Catapres® (clonidine hydrochloride, USP) tabletten moet worden aangepast aan de individuele bloeddrukrespons van de patiënt. Het volgende is een algemene gids voor het beheer ervan.
Initiële dosis
Tablet van 0,1 mg tweemaal daags (ochtend en bedtijd). Oudere patiënten kunnen baat hebben bij een lagere aanvangsdosis.
Onderhoudsdosis
Verdere verhogingen van 0,1 mg per dag kunnen indien nodig met wekelijkse tussenpozen worden gemaakt totdat de gewenste respons is bereikt. Door het grootste deel van de orale dagelijkse dosis voor het slapengaan in te nemen, kunnen voorbijgaande effecten van een droge mond en slaperigheid worden geminimaliseerd. De meest gebruikte therapeutische doses varieerden van 0,2 mg tot 0,6 mg per dag, verdeeld over verschillende doses. Studies hebben aangetoond dat 2,4 mg de maximale effectieve dagelijkse dosis is, maar zo hoge doses zijn zelden gebruikt.
Nierfunctiestoornis
Patiënten met nierinsufficiëntie kunnen baat hebben bij een lagere aanvangsdosis. Patiënten moeten zorgvuldig worden gecontroleerd. Aangezien slechts een minimale hoeveelheid clonidine wordt verwijderd tijdens routinematige hemodialyse, is het niet nodig om aanvullende clonidine te geven na dialyse.
HOE GELEVERD
Catapres® (clonidine hydrochloride, USP) tabletten worden als volgt geleverd:
Bewaren bij 25°C (77°F); excursies toegestaan tot 15°-30°C (59°-86°F) [zien USP-gecontroleerde kamertemperatuur ].
Doseer in een strakke, lichtbestendige container.
Gedistribueerd door: Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 VS. Gefabriceerd door: Boehringer Ingelheim Promeco SA de CV, Mexico City, Mexico. Licentie van: Boehringer Ingelheim, International GmbH, Medische vragen richten aan: (800) 542-6257 of (800) 459-9906. Herzien: mei 2012
BIJWERKINGEN
De meeste bijwerkingen zijn mild en hebben de neiging om af te nemen bij voortzetting van de therapie. De meest voorkomende (die dosisgerelateerd lijken te zijn) zijn een droge mond, die optreedt bij ongeveer 40 van de 100 patiënten; slaperigheid, ongeveer 33 op 100; duizeligheid, ongeveer 16 op 100; constipatie en sedatie, elk ongeveer 10 op 100.
De volgende minder frequente bijwerkingen zijn ook gemeld bij patiënten die CATAPRES 100mcg-tabletten kregen, maar in veel gevallen kregen patiënten gelijktijdig medicatie en is er geen causaal verband vastgesteld.
Lichaam als geheel: Vermoeidheid, koorts, hoofdpijn, bleekheid, zwakte en ontwenningssyndroom. Ook werden een zwak positieve Coombs-test en een verhoogde gevoeligheid voor alcohol gerapporteerd.
Cardiovasculair: Bradycardie, congestief hartfalen, elektrocardiografische afwijkingen (dwz sinusknooparrest, junctionele bradycardie, hoge mate van AV-blok en aritmieën), orthostatische symptomen, hartkloppingen, Raynaud-fenomeen, syncope en tachycardie. Gevallen van sinusbradycardie en atrioventriculair blok zijn gemeld, zowel met als zonder gelijktijdig gebruik van digitalis.
Centraal zenuwstelsel: Agitatie, angst, delirium, waanvoorstellingen, hallucinaties (inclusief visuele en auditieve), slapeloosheid, mentale depressie, nervositeit, andere gedragsveranderingen, paresthesie, rusteloosheid, slaapstoornis en levendige dromen of nachtmerries.
Dermatologisch: Alopecia, angioneurotisch oedeem, netelroos, pruritus, huiduitslag en urticaria.
Gastro-intestinaal: Buikpijn, anorexia, constipatie, hepatitis, malaise, milde voorbijgaande afwijkingen in leverfunctietesten, misselijkheid, parotitis, pseudo-obstructie (inclusief colon pseudo-obstructie), speekselklierpijn en braken.
Urogenitaal: Verminderde seksuele activiteit, moeite met plassen, erectiestoornissen, verlies van libido, nocturie en urineretentie.
Hematologische: Trombocytopenie.
Metabolisch: Gynaecomastie, voorbijgaande verhoging van bloedglucose of serumcreatinefosfokinase en gewichtstoename.
Musculoskeletaal: Krampen in de benen en spier- of gewrichtspijn.
Oro-otolaryngeaal: Droogheid van het neusslijmvlies.
Oogheelkundig: Accommodatiestoornis, wazig zien, verbranding van de ogen, verminderde tranenvloed en droge ogen.
DRUG-INTERACTIES
Clonidine kan de CZS-depressieve effecten van alcohol, barbituraten of andere kalmerende middelen versterken. Als een patiënt die clonidinehydrochloride krijgt, ook tricyclische antidepressiva gebruikt, kan het hypotensieve effect van clonidine worden verminderd, waardoor een verhoging van de dosis clonidine nodig is. Als een patiënt die clonidine krijgt ook neuroleptica gebruikt, kunnen orthostatische regulatiestoornissen (bijv. orthostatische hypotensie, duizeligheid, vermoeidheid) worden geïnduceerd of verergerd.
Controleer de hartslag bij patiënten die clonidine gelijktijdig krijgen met middelen waarvan bekend is dat ze de sinusknoopfunctie of AV-knoopgeleiding beïnvloeden, bijv. digitalis, calciumkanaalblokkers en bètablokkers. Sinusbradycardie resulterend in ziekenhuisopname en het inbrengen van een pacemaker is gemeld in verband met het gelijktijdig gebruik van clonidine met diltiazem of verapamil.
Amitriptyline in combinatie met clonidine versterkt de manifestatie van cornea-laesies bij ratten (zie: Toxicologie ).
Op basis van observaties bij patiënten in een staat van alcoholische delirium is gesuggereerd dat hoge intraveneuze doses clonidine het aritmogene potentieel (QT-verlenging, ventriculaire fibrillatie) van hoge intraveneuze doses haloperidol kunnen verhogen. Causaal verband en relevantie voor clonidine orale tabletten zijn niet vastgesteld.
WAARSCHUWINGEN
Opname
Patiënten dienen te worden geïnstrueerd de behandeling niet te staken zonder overleg met hun arts. Plotselinge stopzetting van de behandeling met clonidine heeft in sommige gevallen geleid tot symptomen zoals nervositeit, opwinding, hoofdpijn en tremor, vergezeld van of gevolgd door een snelle stijging van de bloeddruk en verhoogde catecholamineconcentraties in het plasma. De waarschijnlijkheid van dergelijke reacties op het staken van de behandeling met clonidine lijkt groter te zijn na toediening van hogere doses of voortzetting van gelijktijdige behandeling met bètablokkers en daarom wordt in deze situaties speciale voorzichtigheid geadviseerd. Zeldzame gevallen van hypertensieve encefalopathie, cerebrovasculaire accidenten en overlijden zijn gemeld na stopzetting van clonidine. Als de behandeling met CATAPRES-tabletten wordt stopgezet, moet de arts de dosis geleidelijk in 2 tot 4 dagen verlagen om ontwenningsverschijnselen te voorkomen.
Een overmatige bloeddrukstijging na stopzetting van de behandeling met CATAPRES 100mcg-tabletten kan worden teruggedraaid door orale toediening van clonidinehydrochloride of door intraveneuze fentolamine. Als de behandeling moet worden stopgezet bij patiënten die gelijktijdig een bètablokker en clonidine krijgen, moet de bètablokker enkele dagen vóór de geleidelijke stopzetting van CATAPRES 100mcg-tabletten worden stopgezet.
Omdat kinderen vaak gastro-intestinale aandoeningen hebben die tot braken leiden, kunnen ze bijzonder vatbaar zijn voor hypertensieve episodes als gevolg van abrupt onvermogen om medicatie in te nemen.
PREVENTIEVE MAATREGELEN
Algemeen
Bij patiënten die gelokaliseerde contactsensibilisatie voor Catapres-TTS® (clonidine) hebben ontwikkeld, kan voortzetting van Catapres-TTS of vervanging van orale therapie met clonidinehydrochloride gepaard gaan met de ontwikkeling van een gegeneraliseerde huiduitslag.
Bij patiënten die een allergische reactie op Catapres-TTS ontwikkelen, kan vervanging van oraal clonidinehydrochloride ook een allergische reactie veroorzaken (inclusief gegeneraliseerde huiduitslag, urticaria of angio-oedeem).
De sympatholytische werking van clonidine kan sinusknoopdisfunctie en atrioventriculair (AV) blok verergeren, vooral bij patiënten die andere sympatholytische geneesmiddelen gebruiken. Er zijn postmarketingmeldingen van patiënten met geleidingsstoornissen en/of die andere sympathicolytica gebruiken die ernstige bradycardie ontwikkelden die IV atropine, IV isoproterenol en tijdelijke hartstimulatie nodig hadden terwijl ze clonidine gebruikten.
Bij hypertensie veroorzaakt door feochromocytoom kan geen therapeutisch effect van CATAPRES 100mcg tabletten worden verwacht.
Perioperatief gebruik
Toediening van Catapres® (clonidine hydrochloride, USP) tabletten moet binnen 4 uur na de operatie worden voortgezet en zo snel mogelijk daarna worden hervat. De bloeddruk moet tijdens de operatie zorgvuldig worden gecontroleerd en indien nodig moeten aanvullende maatregelen om de bloeddruk onder controle te houden beschikbaar zijn.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Chronische toediening van clonidine via de voeding was niet carcinogeen voor respectievelijk ratten (132 weken) of muizen (78 weken), gedoseerd tot 46 of 70 keer de maximaal aanbevolen dagelijkse dosis voor de mens als mg/kg (9 of 6 keer de MRDHD op een mg/m² basis). Er was geen bewijs van genotoxiciteit in de Ames-test voor mutageniteit of de micronucleustest bij muizen voor clastogeniteit.
De vruchtbaarheid van mannelijke of vrouwelijke ratten werd niet beïnvloed door clonidinedoses tot 150 g/kg (ongeveer 3 keer MRDHD). In een afzonderlijk experiment bleek de vruchtbaarheid van vrouwelijke ratten te worden aangetast bij doseringen van 500 tot 2000 g/kg (10 tot 40 keer de orale MRDHD op basis van mg/kg; 2 tot 8 keer de MRDHD op basis van mg/m² ).
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Reproductieonderzoeken uitgevoerd bij konijnen met doses tot ongeveer 3 keer de orale maximale aanbevolen dagelijkse dosis voor de mens (MRDHD) van Catapres® (clonidine hydrochloride, USP) tabletten leverden geen bewijs op van een teratogeen of embryotoxisch potentieel bij konijnen. Bij ratten werden echter doses van slechts 1/3 van de orale MRDHD (1/15 de MRDHD op basis van mg/m²) van clonidine geassocieerd met verhoogde resorpties in een onderzoek waarin moederdieren continu werden behandeld vanaf 2 maanden voorafgaand aan de paring. . Verhoogde resorpties werden niet geassocieerd met gelijktijdige behandeling of bij hogere doseringen (tot 3 maal de orale MRDHD) wanneer de moederdieren werden behandeld op dag 6 tot 15 van de dracht. Toenames in resorptie werden waargenomen bij veel hogere doseringen (40 maal de de orale MRDHD op basis van mg/kg; 4 tot 8 keer de MRDHD op basis van mg/m²) bij muizen en ratten die werden behandeld op dag 1 tot 14 van de dracht (de laagste dosis die in het onderzoek werd gebruikt was 500 g/kg).
Er zijn geen adequate, goed gecontroleerde onderzoeken uitgevoerd bij zwangere vrouwen. Clonidine passeert de placentabarrière (zie: KLINISCHE FARMACOLOGIE , Farmacokinetiek ). Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Moeders die borstvoeding geven
Aangezien clonidinehydrochloride wordt uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer CATAPRES 100mcg-tabletten worden toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld in adequate en goed gecontroleerde onderzoeken (zie: WAARSCHUWINGEN , Opname ).
OVERDOSERING
Hypertensie kan zich vroeg ontwikkelen en kan worden gevolgd door hypotensie, bradycardie, ademhalingsdepressie, hypothermie, slaperigheid, verminderde of afwezige reflexen, zwakte, prikkelbaarheid en miosis. De frequentie van CZS-depressie kan hoger zijn bij kinderen dan bij volwassenen. Grote overdoseringen kunnen leiden tot reversibele hartgeleidingsstoornissen of ritmestoornissen, apneu, coma en toevallen. Tekenen en symptomen van overdosering treden over het algemeen op binnen 30 minuten tot twee uur na blootstelling. Slechts 0,1 mg clonidine heeft bij kinderen tekenen van toxiciteit veroorzaakt.
Er is geen specifiek antidotum voor overdosering met clonidine. Overdosering met clonidine kan resulteren in de snelle ontwikkeling van CZS-depressie; daarom wordt het opwekken van braken met ipecac-siroop niet aanbevolen. Maagspoeling kan geïndiceerd zijn na recente en/of grote innames. Toediening van actieve kool en/of een catharsis kan gunstig zijn. Ondersteunende zorg kan bestaan uit atropinesulfaat voor bradycardie, intraveneuze vloeistoffen en/of vasopressoren voor hypotensie en vaatverwijders voor hypertensie. Naloxon kan een nuttig hulpmiddel zijn voor de behandeling van door clonidine geïnduceerde ademhalingsdepressie, hypotensie en/of coma; de bloeddruk moet worden gecontroleerd, aangezien de toediening van naloxon soms heeft geleid tot paradoxale hypertensie. Het is niet waarschijnlijk dat dialyse de eliminatie van clonidine significant zal verbeteren.
De grootste overdosis die tot nu toe is gemeld, betrof een 28-jarige man die 100 mg clonidinehydrochloridepoeder had ingenomen. Deze patiënt ontwikkelde hypertensie gevolgd door hypotensie, bradycardie, apneu, hallucinaties, semicoma en premature ventriculaire contracties. De patiënt herstelde volledig na een intensieve behandeling. De plasmaconcentraties van clonidine waren 60 ng/ml na 1 uur, 190 ng/ml na 1,5 uur, 370 ng/ml na 2 uur en 120 ng/ml na 5,5 en 6,5 uur. Bij muizen en ratten is de orale LD50 van clonidine respectievelijk 206 en 465 mg/kg.
CONTRA-INDICATIES
Catapres® (clonidine hydrochloride, USP) tabletten mogen niet worden gebruikt bij patiënten met bekende overgevoeligheid voor clonidine (zie PREVENTIEVE MAATREGELEN ).
KLINISCHE FARMACOLOGIE
Clonidine stimuleert alfa-adrenoreceptoren in de hersenstam. Deze actie resulteert in een verminderde sympathische uitstroom uit het centrale zenuwstelsel en in een afname van de perifere weerstand, de renale vasculaire weerstand, de hartslag en de bloeddruk. CATAPRES 100mcg tabletten werken relatief snel. De bloeddruk van de patiënt daalt binnen 30 tot 60 minuten na een orale dosis, de maximale daling treedt op binnen 2 tot 4 uur. De nierbloedstroom en de glomerulaire filtratiesnelheid blijven in wezen onveranderd. Normale houdingsreflexen zijn intact; daarom zijn orthostatische symptomen mild en zeldzaam.
Acute onderzoeken met clonidinehydrochloride bij mensen hebben een matige afname (15% tot 20%) van het hartminuutvolume in rugligging aangetoond zonder verandering in de perifere weerstand: bij een kanteling van 45° is er een kleinere vermindering van het hartminuutvolume en een afname van perifere weerstand. Tijdens langdurige therapie heeft het hartminuutvolume de neiging terug te keren naar de controlewaarden, terwijl de perifere weerstand verminderd blijft. Vertraging van de polsslag is waargenomen bij de meeste patiënten die clonidine kregen, maar het geneesmiddel verandert de normale hemodynamische respons op inspanning niet.
Bij sommige patiënten kan tolerantie voor het antihypertensieve effect optreden, waardoor een herevaluatie van de therapie noodzakelijk is.
Andere studies bij patiënten hebben aanwijzingen opgeleverd voor een vermindering van de plasmarenineactiviteit en van de uitscheiding van aldosteron en catecholamines. De exacte relatie van deze farmacologische werkingen met het antihypertensieve effect van clonidine is niet volledig opgehelderd.
Clonidine stimuleert acuut de afgifte van groeihormoon bij zowel kinderen als volwassenen, maar veroorzaakt geen chronische verhoging van groeihormoon bij langdurig gebruik.
Farmacokinetiek
De farmacokinetiek van clonidine is dosisproportioneel in het bereik van 100 tot 600 g. De absolute biologische beschikbaarheid van clonidine bij orale toediening is 70% tot 80%. De piekplasmaspiegels van clonidine worden bereikt in ongeveer 1 tot 3 uur.
Na intraveneuze toediening vertoont clonidine een bifasische dispositie met een distributiehalfwaardetijd van ongeveer 20 minuten en een eliminatiehalfwaardetijd variërend van 12 tot 16 uur. De halfwaardetijd neemt toe tot 41 uur bij patiënten met een ernstige nierfunctiestoornis. Clonidine passeert de placentabarrière. Het is aangetoond dat het bij ratten de bloed-hersenbarrière passeert.
Na orale toediening wordt ongeveer 40% tot 60% van de geabsorbeerde dosis binnen 24 uur als onveranderd geneesmiddel in de urine teruggevonden. Ongeveer 50% van de geabsorbeerde dosis wordt gemetaboliseerd in de lever. Noch voedsel, noch het ras van de patiënt heeft invloed op de farmacokinetiek van clonidine.
Het antihypertensieve effect wordt bereikt bij plasmaconcentraties tussen ongeveer 0,2 en 2,0 ng/ml bij patiënten met een normale excretiefunctie. Een verdere stijging van de plasmaspiegels zal het antihypertensieve effect niet versterken.
Toxicologie
In verschillende onderzoeken met oraal clonidinehydrochloride werd een dosisafhankelijke toename van de incidentie en ernst van spontane retinale degeneratie gezien bij albinoratten die zes maanden of langer werden behandeld. Weefseldistributiestudies bij honden en apen lieten een concentratie van clonidine in het vaatvlies zien.
Gezien de retinale degeneratie die bij ratten werd waargenomen, werden oogonderzoeken uitgevoerd tijdens klinische onderzoeken bij 908 patiënten vóór en periodiek na de start van de clonidinetherapie. Bij 353 van deze 908 patiënten werden de oogonderzoeken uitgevoerd gedurende een periode van 24 maanden of langer. Behalve wat droge ogen werden er geen geneesmiddelgerelateerde abnormale oogheelkundige bevindingen geregistreerd en volgens gespecialiseerde tests zoals elektroretinografie en maculaire verblinding was de functie van het netvlies onveranderd.
In combinatie met amitriptyline leidde toediening van clonidinehydrochloride binnen 5 dagen tot de ontwikkeling van cornea-laesies bij ratten.
PATIËNT INFORMATIE
Patiënten dienen gewaarschuwd te worden tegen onderbreking van de behandeling met CATAPRES 100mcg tabletten zonder het advies van hun arts.
Aangezien patiënten een mogelijk kalmerend effect, duizeligheid of accommodatiestoornis kunnen ervaren bij het gebruik van clonidine, moeten patiënten worden gewaarschuwd voor activiteiten zoals het besturen van een voertuig of het bedienen van apparaten of machines. Informeer patiënten ook dat dit sedatieve effect kan worden versterkt door gelijktijdig gebruik van alcohol, barbituraten of andere kalmerende middelen.
Patiënten die contactlenzen dragen, moeten worden gewaarschuwd dat behandeling met CATAPRES-tabletten droge ogen kan veroorzaken.
