Vasotec 2.5mg, 5mg, 10mg Enalapril Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Vasotec en hoe wordt het gebruikt?
Vasotec is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van symptomen van hoge bloeddruk (hypertensie), linkerventrikeldisfunctie en congestief hartfalen. Vasotec kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Vasotec behoort tot een klasse geneesmiddelen die ACE-remmers worden genoemd.
- Het is niet bekend of Vasotec veilig en effectief is bij kinderen jonger dan 1 maand.
Wat zijn de mogelijke bijwerkingen van Vasotec 2,5 mg?
Vasotec 2,5 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- pijn op de borst,
- geel worden van de huid of ogen (geelzucht),
- weinig of geen plassen,
- koorts,
- rillingen,
- keelpijn,
- misselijkheid,
- zwakheid,
- tintelend gevoel,
- onregelmatige hartslag, en
- verlies van beweging
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Vasotec zijn:
- duizeligheid,
- vermoeidheid, en
- duizeligheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Vasotec. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met VASOTEC®.
- Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken. Zie WAARSCHUWINGEN: Foetale toxiciteit
OMSCHRIJVING
VASOTEC® (Enalaprilmaleaat) is het maleaatzout van enalapril, de ethylester van een langwerkende angiotensine-converterende enzymremmer, enalaprilaat. Enalaprilmaleaat wordt chemisch beschreven als (S)-1[N-[1-(ethoxycarbonyl)-3-fenylpropyl]-L-alanyl]-L-proline, (Z)-2-buteendioaatzout (1:1). De empirische formule is C20H28N2O5•C4H4O4 en de structuurformule is:
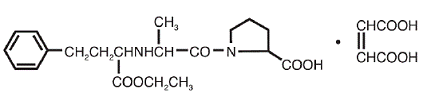
Enalaprilmaleaat is een wit tot gebroken wit, kristallijn poeder met een molecuulgewicht van 492,53. Het is matig oplosbaar in water, oplosbaar in ethanol en vrij oplosbaar in methanol.
Enalapril is een pro-drug; na orale toediening wordt het biologisch geactiveerd door hydrolyse van de ethylester tot enalaprilaat, de actieve angiotensine-converterende enzymremmer.
Enalaprilmaleaat wordt geleverd als tabletten van 2,5 mg, 5 mg, 10 mg en 20 mg voor orale toediening. Naast de werkzame stof enalaprilmaleaat bevat elke tablet de volgende inactieve ingrediënten: lactose, magnesiumstearaat, natriumbicarbonaat en zetmeel. De tabletten van 10 mg en 20 mg bevatten ook ijzeroxiden.
INDICATIES
Hypertensie
VASOTEC is geïndiceerd voor de behandeling van hypertensie.
VASOTEC is effectief alleen of in combinatie met andere antihypertensiva, met name diuretica van het thiazidetype. De bloeddrukverlagende effecten van VASOTEC 10 mg en thiaziden zijn ongeveer additief.
Hartfalen
VASOTEC is geïndiceerd voor de behandeling van symptomatisch congestief hartfalen, meestal in combinatie met diuretica en digitalis. Bij deze patiënten verbetert VASOTEC 5 mg de symptomen, verhoogt het de overleving en verlaagt het de frequentie van ziekenhuisopname (zie: KLINISCHE FARMACOLOGIE , Hartfalen , Mortaliteitsproeven voor details en beperkingen van overlevingsproeven ).
Asymptomatische linkerventrikeldisfunctie
Bij klinisch stabiele asymptomatische patiënten met linkerventrikeldisfunctie (ejectiefractie ≤ 35 procent) vermindert VASOTEC 5 mg de ontwikkelingssnelheid van openlijk hartfalen en vermindert het de incidentie van ziekenhuisopname voor hartfalen (zie KLINISCHE FARMACOLOGIE , Hartfalen , Mortaliteitsproeven voor details en beperkingen van overlevingsproeven ).
Bij het gebruik van VASOTEC 2,5 mg moet rekening worden gehouden met het feit dat een andere angiotensineconverterende enzymremmer, captopril, agranulocytose heeft veroorzaakt, met name bij patiënten met een nierfunctiestoornis of collageen-vaatziekte, en dat de beschikbare gegevens onvoldoende zijn om aan te tonen dat VASOTEC 2,5 mg niet een vergelijkbaar risico hebben (zie WAARSCHUWINGEN ).
Bij het overwegen van het gebruik van VASOTEC moet worden opgemerkt dat in gecontroleerde klinische onderzoeken ACE-remmers een effect op de bloeddruk hebben dat bij negroïde patiënten minder is dan bij niet-negroïde patiënten. Bovendien moet worden opgemerkt dat van negroïde patiënten die ACE-remmers krijgen is gemeld dat ze een hogere incidentie van angio-oedeem hebben in vergelijking met niet-negroïde patiënten (zie WAARSCHUWINGEN , Hoofd- en nekangio-oedeem ).
DOSERING EN ADMINISTRATIE
Hypertensie
Bij patiënten die momenteel worden behandeld met een diureticum, kan af en toe symptomatische hypotensie optreden na de aanvangsdosis VASOTEC. Het diureticum moet, indien mogelijk, gedurende twee tot drie dagen worden stopgezet voordat de behandeling met VASOTEC wordt gestart om de kans op hypotensie te verminderen (zie WAARSCHUWINGEN ). Als de bloeddruk van de patiënt niet onder controle kan worden gebracht met VASOTEC alleen, kan de behandeling met diuretica worden hervat.
Als het diureticum niet kan worden gestaakt, moet een aanvangsdosis van 2,5 mg worden gebruikt onder medisch toezicht gedurende ten minste twee uur en totdat de bloeddruk gedurende ten minste een extra uur is gestabiliseerd (zie WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
De aanbevolen aanvangsdosis bij patiënten die geen diuretica gebruiken, is eenmaal daags 5 mg. De dosering moet worden aangepast aan de reactie van de bloeddruk. Het gebruikelijke doseringsbereik is 10 tot 40 mg per dag, toegediend in een enkele dosis of in twee verdeelde doses. Bij sommige patiënten die eenmaal daags worden behandeld, kan het antihypertensieve effect tegen het einde van het doseringsinterval afnemen. Bij dergelijke patiënten moet een verhoging van de dosering of tweemaal daagse toediening worden overwogen. Als de bloeddruk niet onder controle wordt gebracht met VASOTEC 2,5 mg alleen, kan een diureticum worden toegevoegd. Gelijktijdige toediening van VASOTEC 5 mg met kaliumsupplementen, kaliumzoutvervangers of kaliumsparende diuretica kan leiden tot verhogingen van het serumkalium (zie PREVENTIEVE MAATREGELEN ).
Dosisaanpassing bij hypertensieve patiënten met nierinsufficiëntie
De gebruikelijke dosis enalapril wordt aanbevolen voor patiënten met een creatinineklaring van meer dan 30 ml/min (serumcreatinine tot ongeveer 3 mg/dL). Voor patiënten met een creatinineklaring van minder dan of gelijk aan 30 ml/min (serumcreatinine meer dan of gelijk aan 3 mg/dL), is de eerste dosis 2,5 mg eenmaal daags. De dosering kan naar boven worden getitreerd totdat de bloeddruk onder controle is of tot een maximum van 40 mg per dag.
Hartfalen
VASOTEC is geïndiceerd voor de behandeling van symptomatisch hartfalen, meestal in combinatie met diuretica en digitalis. In de placebogecontroleerde onderzoeken die een verbeterde overleving lieten zien, werden de patiënten getitreerd als getolereerd tot 40 mg, toegediend in twee verdeelde doses.
De aanbevolen startdosering is 2,5 mg. Het aanbevolen doseringsbereik is 2,5 tot 20 mg tweemaal daags. Doses dienen, indien getolereerd, over een periode van enkele dagen of weken naar boven te worden getitreerd. De maximale dagelijkse dosis die in klinische onderzoeken werd toegediend, was 40 mg in verdeelde doses.
Na de aanvangsdosis VASOTEC moet de patiënt gedurende ten minste twee uur onder medisch toezicht worden geobserveerd en totdat de bloeddruk gedurende ten minste een extra uur is gestabiliseerd (zie WAARSCHUWINGEN en DRUG-INTERACTIES ). Indien mogelijk moet de dosis van elk gelijktijdig diureticum worden verlaagd, wat de kans op hypotensie kan verminderen. Het optreden van hypotensie na de aanvangsdosis VASOTEC sluit niet uit dat de dosering daarna zorgvuldig wordt getitreerd met het geneesmiddel, na effectieve behandeling van de hypotensie.
Asymptomatische linkerventrikeldisfunctie
In het onderzoek dat de werkzaamheid aantoonde, werden de patiënten gestart met tweemaal daags 2,5 mg en werden ze getitreerd voor zover ze werden verdragen tot de beoogde dagelijkse dosis van 20 mg (in verdeelde doses).
Na de aanvangsdosis van VASOTEC 10 mg moet de patiënt gedurende ten minste twee uur onder medisch toezicht worden geobserveerd en totdat de bloeddruk gedurende ten minste een extra uur is gestabiliseerd (zie WAARSCHUWINGEN en DRUG-INTERACTIES ). Indien mogelijk moet de dosis van elk gelijktijdig diureticum worden verlaagd, wat de kans op hypotensie kan verminderen. Het optreden van hypotensie na de aanvangsdosis van VASOTEC 5 mg sluit een daaropvolgende zorgvuldige dosistitratie met het geneesmiddel niet uit, na effectieve behandeling van de hypotensie.
Dosisaanpassing bij patiënten met hartfalen en nierinsufficiëntie of hyponatriëmie
Bij patiënten met hartfalen die hyponatriëmie hebben (serumnatrium lager dan 130 mEq/l) of met serumcreatinine hoger dan 1,6 mg/dl, dient de therapie te worden gestart met 2,5 mg per dag onder strikt medisch toezicht (zie Hartfalen , WAARSCHUWINGEN en DRUG-INTERACTIES ). De dosis kan worden verhoogd tot 2,5 mg tweemaal daags, daarna 5 mg tweemaal daags en hoger indien nodig, gewoonlijk met tussenpozen van vier dagen of meer als er op het moment van dosisaanpassing geen sprake is van overmatige hypotensie of significante verslechtering van de nierfunctie. De maximale dagelijkse dosis is 40 mg.
Pediatrische hypertensieve patiënten
De gebruikelijke aanbevolen startdosering is 0,08 mg/kg (tot 5 mg) eenmaal daags. De dosering moet worden aangepast aan de reactie van de bloeddruk. Doses hoger dan 0,58 mg/kg (of hoger dan 40 mg) zijn niet onderzocht bij pediatrische patiënten (zie: KLINISCHE FARMACOLOGIE , Klinische farmacologie bij pediatrische patiënten ).
VASOTEC 5 mg wordt niet aanbevolen bij pasgeborenen en bij pediatrische patiënten met een glomerulaire filtratiesnelheid van minder dan 30 ml/min/1,73 m², aangezien er geen gegevens beschikbaar zijn.
Bereiding van suspensie (voor 200 ml van een suspensie van 1,0 mg / ml)
Voeg 50 ml Bicitra® toe aan een polyethyleentereftalaat (PET) fles met tien tabletten van 20 mg VASOTEC 10 mg en schud gedurende ten minste 2 minuten. Laat het concentraat 60 minuten staan. Schud het concentraat na de bewaartijd van 60 minuten nog een minuut. Voeg 150 ml Ora-Sweet SF™2 toe aan het concentraat in de PET-fles en schud de suspensie om de ingrediënten te verspreiden. De suspensie moet worden gekoeld bij 2-8°C (36-46°F) en kan maximaal 30 dagen worden bewaard. Schud de suspensie voor elk gebruik.
HOE GELEVERD
Opslag
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30°C (59-86°F) [zie USP-gecontroleerde kamertemperatuur ].
Houd de container goed gesloten.
Beschermen tegen vocht.
Doseer in een strakke container volgens USP, als het productpakket is onderverdeeld.
Gefabriceerd voor: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Gefabriceerd door: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Canada. Revisie: juli 2017.
BIJWERKINGEN
VASOTEC is beoordeeld op veiligheid bij meer dan 10.000 patiënten, waaronder meer dan 1000 patiënten die een jaar of langer werden behandeld. In gecontroleerde klinische onderzoeken met 2987 patiënten is gebleken dat VASOTEC 10 mg over het algemeen goed wordt verdragen. Voor het grootste deel waren de bijwerkingen mild en van voorbijgaande aard. In klinische onderzoeken was stopzetting van de behandeling vanwege klinische bijwerkingen vereist bij 3,3 procent van de patiënten met hypertensie en bij 5,7 procent van de patiënten met hartfalen. De frequentie van bijwerkingen was niet gerelateerd aan de totale dagelijkse dosering binnen de gebruikelijke doseringsbereiken. Bij patiënten met hypertensie was het totale percentage met VASOTEC behandelde patiënten dat bijwerkingen rapporteerde vergelijkbaar met placebo.
Hypertensie
Bijwerkingen die optreden bij meer dan één procent van de patiënten met hypertensie die werden behandeld met VASOTEC 2,5 mg in gecontroleerde klinische onderzoeken, worden hieronder weergegeven. Bij patiënten die met VASOTEC werden behandeld, was de maximale behandelingsduur drie jaar; bij met placebo behandelde patiënten was de maximale behandelingsduur 12 weken.
Hartfalen
Bijwerkingen die optreden bij meer dan één procent van de patiënten met hartfalen die worden behandeld met VASOTEC 5 mg worden hieronder weergegeven. De incidenties vertegenwoordigen de ervaringen van zowel gecontroleerde als ongecontroleerde klinische onderzoeken (maximale duur van de behandeling was ongeveer een jaar). Bij de met placebo behandelde patiënten zijn de gerapporteerde incidenties afkomstig uit de gecontroleerde onderzoeken (maximale behandelingsduur is 12 weken). Het percentage patiënten met ernstig hartfalen (NYHA-klasse IV) was respectievelijk 29 procent en 43 procent voor patiënten die werden behandeld met VASOTEC 2,5 mg en placebo.
Andere ernstige klinische bijwerkingen die zich hebben voorgedaan sinds het geneesmiddel op de markt is gebracht of bijwerkingen die optreden bij 0,5 tot 1,0 procent van de patiënten met hypertensie of hartfalen in klinische onderzoeken, worden hieronder vermeld en zijn binnen elke categorie in volgorde van afnemende ernst.
Lichaam als geheel
Anafylactoïde reacties (zie WAARSCHUWINGEN , Anafylactoïde en mogelijk gerelateerde reacties ).
Cardiovasculair
Hartstilstand; myocardinfarct of cerebrovasculair accident, mogelijk secundair aan overmatige hypotensie bij patiënten met een hoog risico (zie: WAARSCHUWINGEN , Hypotensie ); longembolie en infarct; longoedeem; ritmestoornissen waaronder atriale tachycardie en bradycardie; atriale fibrillatie; hartkloppingen, het fenomeen van Raynaud.
Spijsvertering
Ileus, pancreatitis, leverfalen, hepatitis (hepatocellulair [bewezen bij hernieuwde behandeling] of cholestatische geelzucht) (zie WAARSCHUWINGEN , Leverfalen ), melena, anorexia, dyspepsie, constipatie, glossitis, stomatitis, droge mond.
hematologisch
Zeldzame gevallen van neutropenie, trombocytopenie en beenmergdepressie.
Musculoskeletaal
Spierkrampen.
Nerveus/psychiatrisch
Depressie, verwardheid, ataxie, slaperigheid, slapeloosheid, nervositeit, perifere neuropathie (bijv. paresthesie, dysesthesie), droomafwijking.
Ademhaling
Bronchospasme, rinorroe, keelpijn en heesheid, astma, bovenste luchtweginfectie, longinfiltraten, eosinofiele pneumonitis.
Huid
Exfoliatieve dermatitis, toxische epidermale necrolyse, Stevens-Johnson-syndroom, pemphigus, herpes zoster, erythema multiforme, urticaria, pruritus, alopecia, blozen, diaforese, lichtgevoeligheid.
Speciale zintuigen
Wazig zien, smaakverandering, anosmie, oorsuizen, conjunctivitis, droge ogen, tranen.
Urogenitaal
Nierfalen, oligurie, nierfunctiestoornis (zie: PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ), flankpijn, gynaecomastie, impotentie.
Diversen
Er is een symptoomcomplex gerapporteerd dat enkele of alle van de volgende kan omvatten: een positieve ANA, een verhoogde bezinkingssnelheid van erytrocyten, artralgie/artritis, myalgie/myositis, koorts, serositis, vasculitis, leukocytose, eosinofilie, fotosensibiliteit, huiduitslag en andere dermatologische manifestaties.
Angio-oedeem
Angio-oedeem is gemeld bij patiënten die VASOTEC 2,5 mg kregen, met een hogere incidentie bij negroïde patiënten dan bij niet-negroïde patiënten. Angio-oedeem geassocieerd met larynxoedeem kan fataal zijn. Als angio-oedeem van het gezicht, extremiteiten, lippen, tong, glottis en/of strottenhoofd optreedt, moet de behandeling met VASOTEC worden gestaakt en moet onmiddellijk een geschikte therapie worden ingesteld (zie WAARSCHUWINGEN ).
Hypotensie
Bij de hypertensieve patiënten trad hypotensie op bij 0,9 procent en syncope trad op bij 0,5 procent van de patiënten na de initiële dosis of tijdens langdurige therapie. Hypotensie of syncope was een reden voor stopzetting van de therapie bij 0,1 procent van de hypertensieve patiënten. Bij patiënten met hartfalen trad hypotensie op bij 6,7 procent en syncope bij 2,2 procent van de patiënten. Hypotensie of syncope was een reden voor stopzetting van de behandeling bij 1,9 procent van de patiënten met hartfalen (zie: WAARSCHUWINGEN ).
Hoesten
Zien PREVENTIEVE MAATREGELEN , Hoesten .
Pediatrische patiënten
Het bijwerkingenprofiel voor pediatrische patiënten lijkt vergelijkbaar te zijn met dat bij volwassen patiënten.
Resultaten van klinische laboratoriumtests
Serumelektrolyten
Hyperkaliëmie (zie PREVENTIEVE MAATREGELEN ), hyponatriëmie.
Creatinine, bloedureumstikstof
In gecontroleerde klinische onderzoeken werden kleine verhogingen van bloedureumstikstof en serumcreatinine waargenomen, die reversibel waren na stopzetting van de therapie, bij ongeveer 0,2 procent van de patiënten met essentiële hypertensie die werden behandeld met alleen VASOTEC. Verhogingen komen vaker voor bij patiënten die gelijktijdig diuretica krijgen of bij patiënten met nierarteriestenose (zie PREVENTIEVE MAATREGELEN ). Bij patiënten met hartfalen die ook diuretica met of zonder digitalis kregen, werden bij ongeveer 11 procent van de patiënten verhogingen van bloedureumstikstof of serumcreatinine waargenomen, gewoonlijk reversibel na stopzetting van VASOTEC 5 mg en/of andere gelijktijdige diuretica. Verhogingen van bloedureumstikstof of creatinine waren een reden voor stopzetting bij 1,2 procent van de patiënten.
hematologie
Kleine verlagingen van hemoglobine en hematocriet (gemiddelde verlagingen van respectievelijk ongeveer 0,3 g procent en 1,0 vol procent) komen vaak voor bij patiënten met hypertensie of congestief hartfalen die worden behandeld met VASOTEC 5 mg, maar zijn zelden van klinisch belang tenzij er een andere oorzaak van anemie bestaat. In klinische onderzoeken stopte minder dan 0,1 procent van de patiënten de behandeling vanwege bloedarmoede. Hemolytische anemie, waaronder gevallen van hemolyse bij patiënten met G6PD-deficiëntie, is gemeld; een causaal verband met enalapril kan niet worden uitgesloten.
Leverfunctietest
Verhogingen van leverenzymen en/of serumbilirubine zijn opgetreden (zie: WAARSCHUWINGEN , Leverfalen ).
Neem contact op met Valeant Pharmaceuticals North America LLC op 1-800-321-4576 of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch om VERMOEDELIJKE ONGEWENSTE REACTIES te melden.
DRUG-INTERACTIES
Neprilysine-remmers
Patiënten die gelijktijdig neprilysineremmers gebruiken, lopen mogelijk een verhoogd risico op angio-oedeem. (zien WAARSCHUWINGEN )
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie. De meeste patiënten die de combinatie van twee RAS-remmers krijgen, hebben geen extra voordeel ten opzichte van monotherapie. Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die VASOTEC 2,5 mg en andere middelen gebruiken die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met VASOTEC 5 mg bij patiënten met diabetes. Vermijd het gebruik van aliskiren met VASOTEC bij patiënten met een nierfunctiestoornis (GFR
Hypotensie - Patiënten die diuretische therapie krijgen
Patiënten die diuretica gebruiken en vooral degenen bij wie de diuretische therapie recentelijk is ingesteld, kunnen af en toe een overmatige verlaging van de bloeddruk ervaren na het starten van de therapie met enalapril. De mogelijkheid van hypotensieve effecten met enalapril kan worden geminimaliseerd door ofwel het diureticum stop te zetten of de zoutinname te verhogen voordat de behandeling met enalapril wordt gestart. Als het nodig is om het diureticum voort te zetten, zorg dan voor nauw medisch toezicht na de initiële dosis gedurende ten minste twee uur en totdat de bloeddruk gedurende ten minste een extra uur gestabiliseerd is (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Middelen die renine-afgifte veroorzaken
Het antihypertensieve effect van VASOTEC 10 mg wordt versterkt door antihypertensiva die renineafgifte veroorzaken (bijv. diuretica).
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, waaronder selectieve COX-2-remmers, en ACE-remmers, waaronder enalapril, leiden tot een verslechtering van de nierfunctie, waaronder mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die enalapril- en NSAID-therapie krijgen.
In een klinisch farmacologisch onderzoek werd indomethacine of sulindac toegediend aan hypertensieve patiënten die VASOTEC kregen. In deze studie waren er geen aanwijzingen voor een afzwakking van de antihypertensieve werking van VASOTEC. Rapporten suggereren echter dat NSAID's het antihypertensieve effect van ACE-remmers kunnen verminderen.
Andere cardiovasculaire middelen
VASOTEC 10 mg is gelijktijdig gebruikt met bèta-adrenerge blokkers, methyldopa, nitraten, calciumblokkers, hydralazine, prazosine en digoxine zonder bewijs van klinisch significante nadelige interacties.
Middelen die serumkalium verhogen
VASOTEC vermindert kaliumverlies veroorzaakt door diuretica van het thiazidetype. Kaliumsparende diuretica (bijv. spironolacton, triamtereen of amiloride), kaliumsupplementen of kaliumbevattende zoutvervangers kunnen leiden tot significante verhogingen van het serumkalium. Als gelijktijdig gebruik van deze middelen is geïndiceerd vanwege aangetoonde hypokaliëmie, moeten ze daarom met voorzichtigheid worden gebruikt en met frequente controle van het serumkalium. Kaliumsparende middelen dienen over het algemeen niet te worden gebruikt bij patiënten met hartfalen die VASOTEC krijgen.
Lithium
Lithiumtoxiciteit is gemeld bij patiënten die lithium gelijktijdig kregen met geneesmiddelen die natriumeliminatie veroorzaken, waaronder ACE-remmers. Er zijn enkele gevallen van lithiumtoxiciteit gemeld bij patiënten die gelijktijdig VASOTEC en lithium kregen en deze waren reversibel na stopzetting van beide geneesmiddelen. Het wordt aanbevolen de serumlithiumspiegels regelmatig te controleren als enalapril gelijktijdig met lithium wordt toegediend.
Goud
Nitritoïde reacties (symptomen zijn onder meer blozen in het gezicht, misselijkheid, braken en hypotensie) zijn zelden gemeld bij patiënten die werden behandeld met injecteerbaar goud (natriumaurothiomalaat) en gelijktijdige behandeling met een ACE-remmer, waaronder VASOTEC.
mTOR (Mammalian Target Of Rapamycin)-remmers
Patiënten die gelijktijdig worden behandeld met een ACE-remmer en een mTOR-remmer (bijv. temsirolimus, sirolimus, everolimus) kunnen een verhoogd risico lopen op angio-oedeem (zie WAARSCHUWINGEN ).
WAARSCHUWINGEN
Anafylactoïde en mogelijk gerelateerde reacties
Vermoedelijk omdat angiotensine-converterende enzymremmers het metabolisme van eicosanoïden en polypeptiden beïnvloeden, inclusief endogeen bradykinine, kunnen patiënten die ACE-remmers (inclusief VASOTEC) krijgen, onderhevig zijn aan een verscheidenheid aan bijwerkingen, waarvan sommige ernstig.
Hoofd- en nekangio-oedeem
Angio-oedeem van het gezicht, de ledematen, de lippen, de tong, de glottis en/of het strottenhoofd is gemeld bij patiënten die werden behandeld met angiotensineconverterende enzymremmers, waaronder VASOTEC. Dit kan op elk moment tijdens de behandeling optreden. In dergelijke gevallen dient VASOTEC 2,5 mg onmiddellijk te worden gestaakt en dient te worden voorzien in geschikte therapie en monitoring totdat de klachten en symptomen volledig en aanhoudend zijn verdwenen. In gevallen waarin de zwelling beperkt bleef tot het gezicht en de lippen, is de aandoening over het algemeen verdwenen zonder behandeling, hoewel antihistaminica nuttig zijn geweest om de symptomen te verlichten. Angio-oedeem geassocieerd met larynxoedeem kan fataal zijn. Als er sprake is van betrokkenheid van de tong, glottis of strottenhoofd, die waarschijnlijk luchtwegobstructie zal veroorzaken, moet een passende therapie, bijv. mits (zien ONGEWENSTE REACTIES ).
Patiënten die gelijktijdig een ACE-remmer en mTOR-therapie (zoogdierdoelwit van rapamycine)-remmer (bijv. temsirolimus, sirolimus, everolimus) of een neprilysine-remmer krijgen, lopen mogelijk een verhoogd risico op angio-oedeem (zie PREVENTIEVE MAATREGELEN ).
Intestinaal angio-oedeem
Intestinaal angio-oedeem is gemeld bij patiënten die werden behandeld met ACE-remmers. Deze patiënten vertoonden buikpijn (met of zonder misselijkheid of braken); in sommige gevallen was er geen voorgeschiedenis van angio-oedeem in het gezicht en waren de C-1-esterasespiegels normaal. Het angio-oedeem werd gediagnosticeerd door procedures, waaronder CT-scan of echografie van de buik, of tijdens een operatie, en de symptomen verdwenen na het stoppen met de ACE-remmer. Intestinaal angio-oedeem moet worden opgenomen in de differentiële diagnose van patiënten met ACE-remmers die buikpijn hebben.
Patiënten met een voorgeschiedenis van angio-oedeem dat geen verband houdt met behandeling met een ACE-remmer, kunnen een verhoogd risico lopen op angio-oedeem terwijl ze een ACE-remmer krijgen (zie ook AANWIJZINGEN EN GEBRUIK en CONTRA-INDICATIES ).
Anafylactoïde reacties tijdens desensibilisatie
Twee patiënten die een desensibiliserende behandeling met hymenoptera-gif ondergingen terwijl ze ACE-remmers kregen, kregen levensbedreigende anafylactoïde reacties. Bij dezelfde patiënten werden deze reacties vermeden toen tijdelijk geen ACE-remmers werden gebruikt, maar ze kwamen weer terug bij onbedoeld hernieuwd gebruik.
Anafylactoïde reacties tijdens blootstelling aan membraan
Anafylactoïde reacties zijn gemeld bij patiënten die werden gedialyseerd met high-flux membranen en gelijktijdig werden behandeld met een ACE-remmer. Anafylactoïde reacties zijn ook gemeld bij patiënten die lipoproteïne-aferese met lage dichtheid ondergingen met absorptie van dextraansulfaat.
Hypotensie
Overmatige hypotensie komt zelden voor bij patiënten met ongecompliceerde hypertensie die worden behandeld met VASOTEC 5 mg alleen. Patiënten met hartfalen die VASOTEC krijgen, hebben gewoonlijk enige verlaging van de bloeddruk, vooral bij de eerste dosis, maar stopzetting van de behandeling voor aanhoudende symptomatische hypotensie is meestal niet nodig wanneer de doseringsinstructies worden gevolgd; voorzichtigheid is geboden bij het starten van de therapie (zie: DOSERING EN ADMINISTRATIE ). Patiënten met een risico op overmatige hypotensie, soms geassocieerd met oligurie en/of progressieve azotemie, en zelden met acuut nierfalen en/of overlijden, zijn onder meer patiënten met de volgende aandoeningen of kenmerken: hartfalen, hyponatriëmie, hooggedoseerde diuretische therapie, recente intensieve diurese of verhoging van de diureticumdosis, nierdialyse of ernstige volume- en/of zoutdepletie van welke etiologie dan ook. Het kan raadzaam zijn om het diureticum te elimineren (behalve bij patiënten met hartfalen), de dosis diureticum te verlagen of de zoutinname voorzichtig te verhogen voordat de behandeling met VASOTEC 10 mg wordt gestart bij patiënten met een risico op overmatige hypotensie die dergelijke aanpassingen kunnen verdragen (zie DRUG-INTERACTIES en ONGEWENSTE REACTIES ). Bij patiënten met een risico op overmatige hypotensie, moet de therapie worden gestart onder zeer nauw medisch toezicht en dergelijke patiënten moeten nauwlettend worden gevolgd gedurende de eerste twee weken van de behandeling en wanneer de dosis enalapril en/of diureticum wordt verhoogd. Soortgelijke overwegingen kunnen van toepassing zijn op patiënten met ischemische hart- of cerebrovasculaire ziekte, bij wie een overmatige bloeddrukdaling kan leiden tot een myocardinfarct of cerebrovasculair accident.
Als overmatige hypotensie optreedt, moet de patiënt in rugligging worden geplaatst en, indien nodig, een intraveneuze infusie van een normale zoutoplossing krijgen. Een voorbijgaande hypotensieve respons is geen contra-indicatie voor verdere doses VASOTEC 2,5 mg, die gewoonlijk zonder problemen kunnen worden gegeven zodra de bloeddruk is gestabiliseerd. Als zich symptomatische hypotensie ontwikkelt, kan een dosisverlaging of stopzetting van VASOTEC of gelijktijdig diureticum noodzakelijk zijn.
Neutropenie/Agranulocytose
Van een andere angiotensineconverterende enzymremmer, captopril, is aangetoond dat het agranulocytose en beenmergdepressie veroorzaakt, zelden bij ongecompliceerde patiënten, maar vaker bij patiënten met nierinsufficiëntie, vooral als ze ook een collageen-vaatziekte hebben. De beschikbare gegevens uit klinische onderzoeken met enalapril zijn onvoldoende om aan te tonen dat enalapril geen agranulocytose in vergelijkbare mate veroorzaakt. Marketingervaring heeft gevallen van neutropenie of agranulocytose aan het licht gebracht waarbij een causaal verband met enalapril niet kan worden uitgesloten. Periodieke controle van het aantal witte bloedcellen bij patiënten met collageenvaatziekte en nierziekte moet worden overwogen.
Leverfalen
Zelden zijn ACE-remmers in verband gebracht met een syndroom dat begint met cholestatische geelzucht en zich ontwikkelt tot fulminante levernecrose en (soms) overlijden. Het mechanisme van dit syndroom wordt niet begrepen. Patiënten die ACE-remmers krijgen en die geelzucht of duidelijke verhogingen van leverenzymen ontwikkelen, moeten stoppen met de ACE-remmer en passende medische follow-up krijgen.
Foetale toxiciteit
Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met VASOTEC 10 mg. Deze bijwerkingen worden meestal geassocieerd met het gebruik van deze geneesmiddelen in het tweede en derde trimester van de zwangerschap. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Passende behandeling van maternale hypertensie tijdens de zwangerschap is belangrijk om de resultaten voor zowel moeder als foetus te optimaliseren.
In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus. Voer seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Als oligohydramnion wordt waargenomen, stop dan met VASOTEC, tenzij het als levensreddend voor de moeder wordt beschouwd. Afhankelijk van de week van de zwangerschap kan foetaal testen aangewezen zijn. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen. Observeer nauwkeurig zuigelingen met een voorgeschiedenis van in utero blootstelling aan VASOTEC voor hypotensie, oligurie en hyperkaliëmie (zie PREVENTIEVE MAATREGELEN , Pediatrisch gebruik ).
Er zijn geen teratogene effecten van enalapril waargenomen in onderzoeken met drachtige ratten en konijnen. Op basis van het lichaamsoppervlak waren de gebruikte doses respectievelijk 57 keer en 12 keer de maximaal aanbevolen dagelijkse dosis voor de mens (MRHDD).
PREVENTIEVE MAATREGELEN
Algemeen
Aortastenose/hypertrofische cardiomyopathie
Zoals met alle vaatverwijders, moet enalapril met voorzichtigheid worden gegeven aan patiënten met een obstructie in het uitstroomkanaal van de linker hartkamer.
Verminderde nierfunctie
Als gevolg van de remming van het renine-angiotensine-aldosteronsysteem kunnen veranderingen in de nierfunctie worden verwacht bij gevoelige personen. Bij patiënten met ernstig hartfalen bij wie de nierfunctie kan afhangen van de activiteit van het renine-angiotensine-aldosteronsysteem, kan behandeling met angiotensineconverterende enzymremmers, waaronder VASOTEC, gepaard gaan met oligurie en/of progressieve azotemie en zelden met acuut nierfalen en /of de dood (zie DRUG-INTERACTIES ).
In klinische onderzoeken bij hypertensieve patiënten met unilaterale of bilaterale nierarteriestenose werden verhogingen van bloedureumstikstof en serumcreatinine waargenomen bij 20 procent van de patiënten. Deze verhogingen waren bijna altijd reversibel na stopzetting van de behandeling met enalapril en/of diuretica. Bij dergelijke patiënten moet de nierfunctie tijdens de eerste paar weken van de behandeling worden gecontroleerd.
Sommige patiënten met hypertensie of hartfalen zonder duidelijke reeds bestaande niervaatziekte hebben een verhoging van het bloedureum en het serumcreatinine ontwikkeld, gewoonlijk gering en van voorbijgaande aard, vooral wanneer VASOTEC gelijktijdig met een diureticum werd gegeven. Dit komt vaker voor bij patiënten met een reeds bestaande nierfunctiestoornis. Dosisverlaging en/of stopzetting van het diureticum en/of VASOTEC 5 mg kan nodig zijn.
Evaluatie van patiënten met hypertensie of hartfalen moet altijd een beoordeling van de nierfunctie omvatten (zien DOSERING EN ADMINISTRATIE ).
Hyperkaliëmie
Verhoogd serumkalium (groter dan 5,7 mEq/L) werd waargenomen bij ongeveer één procent van de hypertensieve patiënten in klinische onderzoeken. In de meeste gevallen waren dit geïsoleerde waarden die verdwenen ondanks voortgezette therapie. Hyperkaliëmie was een oorzaak van stopzetting van de therapie bij 0,28 procent van de hypertensieve patiënten. In klinische onderzoeken naar hartfalen werd hyperkaliëmie waargenomen bij 3,8 procent van de patiënten, maar dit was geen reden voor stopzetting.
Risicofactoren voor de ontwikkeling van hyperkaliëmie zijn onder meer nierinsufficiëntie, diabetes mellitus en het gelijktijdig gebruik van kaliumsparende diuretica, kaliumsupplementen en/of kaliumbevattende zoutvervangers, die met voorzichtigheid of helemaal niet moeten worden gebruikt met VASOTEC (zie DRUG-INTERACTIES ).
Hoesten
Vermoedelijk als gevolg van de remming van de afbraak van endogeen bradykinine, is bij alle ACE-remmers aanhoudende niet-productieve hoest gemeld, die altijd verdwijnt na stopzetting van de therapie. Bij de differentiële diagnose van hoest moet rekening worden gehouden met door ACE-remmers geïnduceerde hoest.
Chirurgie/anesthesie
Bij patiënten die een grote operatie ondergaan of tijdens anesthesie met middelen die hypotensie veroorzaken, kan enalapril de vorming van angiotensine II blokkeren, secundair aan compenserende renineafgifte. Als hypotensie optreedt en wordt geacht het gevolg te zijn van dit mechanisme, kan dit worden gecorrigeerd door volume-expansie.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er was geen bewijs van een tumorverwekkend effect wanneer enalapril gedurende 106 weken werd toegediend aan mannelijke en vrouwelijke ratten in doses tot 90 mg/kg/dag of gedurende 94 weken aan mannelijke en vrouwelijke muizen in doses tot 90 en 180 mg/kg/dag. dag resp. Deze doses zijn 26 keer (bij ratten en vrouwelijke muizen) en 13 keer (bij mannelijke muizen) de maximaal aanbevolen dagelijkse dosis voor de mens (MRHDD) in vergelijking op basis van het lichaamsoppervlak.
Noch enalaprilmaleaat noch het actieve dizuur was mutageen in de microbiële mutageentest van Ames met of zonder metabolische activering. Enalapril was ook negatief in de volgende genotoxiciteitsstudies: rec-assay, reverse-mutatietest met E. coli, uitwisseling van zusterchromatiden met gekweekte zoogdiercellen en de micronucleustest met muizen, evenals in een in vivo cytogeen onderzoek met muisbeenmerg .
Er waren geen nadelige effecten op de reproductieprestaties van mannelijke en vrouwelijke ratten die werden behandeld met tot 90 mg/kg/dag enalapril (26 keer de MRHDD in vergelijking op basis van het lichaamsoppervlak).
Zwangerschap
Moeders die borstvoeding geven
Enalapril en enalaprilaat zijn aangetroffen in moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen van enalapril bij zuigelingen die borstvoeding geven, moet worden besloten of de borstvoeding moet worden gestaakt of dat VASOTEC 2,5 mg moet worden gestaakt, waarbij rekening moet worden gehouden met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
Pasgeborenen met een geschiedenis van blootstelling in de baarmoeder aan VASOTEC
Als oligurie of hypotensie optreedt, richt de aandacht dan op ondersteuning van de bloeddruk en nierperfusie. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen. Enalapril, dat de placenta passeert, is met enig klinisch voordeel uit de neonatale circulatie verwijderd door peritoneale dialyse, en kan theoretisch worden verwijderd door wisseltransfusie, hoewel er geen ervaring is met de laatste procedure.
Antihypertensieve effecten van VASOTEC zijn vastgesteld bij hypertensieve pediatrische patiënten in de leeftijd van 1 maand tot 16 jaar. Het gebruik van VASOTEC 5 mg in deze leeftijdsgroepen wordt ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken met VASOTEC 2,5 mg bij pediatrische en volwassen patiënten, evenals door gepubliceerde literatuur bij pediatrische patiënten (zie KLINISCHE FARMACOLOGIE , Klinische farmacologie bij pediatrische patiënten en DOSERING EN ADMINISTRATIE ).
VASOTEC wordt niet aanbevolen bij pasgeborenen en bij pediatrische patiënten met een glomerulaire filtratiesnelheid
OVERDOSERING
Er zijn beperkte gegevens beschikbaar met betrekking tot overdosering bij mensen.
Enkelvoudige orale doses enalapril boven 1.000 mg/kg en ≥ 1.775 mg/kg werden geassocieerd met letaliteit bij respectievelijk muizen en ratten.
De meest waarschijnlijke manifestatie van overdosering zou hypotensie zijn, waarvoor de gebruikelijke behandeling een intraveneuze infusie van een normale zoutoplossing zou zijn.
Enalaprilaat kan door hemodialyse uit de algemene bloedsomloop worden verwijderd en is door peritoneale dialyse uit de neonatale bloedsomloop verwijderd (zie WAARSCHUWINGEN , Anafylactoïde reacties tijdens blootstelling aan membraan ).
CONTRA-INDICATIES
VASOTEC 2,5 mg is gecontra-indiceerd bij patiënten die overgevoelig zijn voor dit product en bij patiënten met een voorgeschiedenis van angio-oedeem als gevolg van eerdere behandeling met een angiotensineconverterende enzymremmer en bij patiënten met erfelijk of idiopathisch angio-oedeem.
Dien aliskiren niet gelijktijdig toe met VASOTEC bij patiënten met diabetes (zie: DRUG-INTERACTIES ).
VASOTEC 10 mg is gecontra-indiceerd in combinatie met een neprilysineremmer (bijv. sacubitril). Dien VASOTEC niet toe binnen 36 uur na overschakeling op of van sacubitril/valsartan, een neprilysineremmer (zie WAARSCHUWINGEN ).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Enalapril remt, na hydrolyse tot enalaprilaat, het angiotensine-converting enzyme (ACE) bij mensen en dieren. ACE is een peptidyldipeptidase dat de omzetting van angiotensine I in de vaatvernauwende stof, angiotensine II, katalyseert. Angiotensine II stimuleert ook de aldosteronsecretie door de bijnierschors. De gunstige effecten van enalapril bij hypertensie en hartfalen lijken voornamelijk het gevolg te zijn van onderdrukking van het renine-angiotensine-aldosteronsysteem. Remming van ACE resulteert in verlaagd plasma-angiotensine II, wat leidt tot verminderde vasopressoractiviteit en tot verminderde aldosteronsecretie. Hoewel de laatste afname klein is, resulteert dit in een kleine toename van het serumkalium. Bij hypertensieve patiënten die tot 48 weken met alleen VASOTEC werden behandeld, werden gemiddelde verhogingen van het serumkalium van ongeveer 0,2 mEq/L waargenomen. Bij patiënten die werden behandeld met VASOTEC 5 mg plus een thiazidediureticum, was er in wezen geen verandering in serumkalium (zie PREVENTIEVE MAATREGELEN ). Verwijdering van de negatieve feedback van angiotensine II op de reninesecretie leidt tot verhoogde plasmarenine-activiteit.
ACE is identiek aan kininase, een enzym dat bradykinine afbreekt. Of verhoogde niveaus van bradykinine, een krachtig vasodepressor-peptide, een rol spelen bij de therapeutische effecten van VASOTEC moet nog worden opgehelderd.
Hoewel aangenomen wordt dat het mechanisme waardoor VASOTEC 5 mg de bloeddruk verlaagt voornamelijk de onderdrukking van het renine-angiotensine-aldosteronsysteem is, is VASOTEC 10 mg antihypertensief, zelfs bij patiënten met hypertensie met een laag reninegehalte. Hoewel VASOTEC in alle onderzochte rassen antihypertensief was, hadden negroïde hypertensieve patiënten (meestal een populatie met lage reninehypertensie) een kleinere gemiddelde respons op enalaprilmonotherapie dan niet-negroïde patiënten.
Farmacokinetiek en metabolisme
Na orale toediening van VASOTEC treden binnen ongeveer een uur piekserumconcentraties van enalapril op. Op basis van urineterugwinning is de mate van absorptie van enalapril ongeveer 60 procent. De absorptie van enalapril wordt niet beïnvloed door de aanwezigheid van voedsel in het maagdarmkanaal. Na absorptie wordt enalapril gehydrolyseerd tot enalaprilaat, dat een krachtigere remmer van het angiotensineconverterende enzym is dan enalapril; enalaprilaat wordt slecht geabsorbeerd bij orale toediening. De piekserumconcentraties van enalaprilaat treden drie tot vier uur na een orale dosis enalaprilmaleaat op. De uitscheiding van VASOTEC vindt voornamelijk renaal plaats. Ongeveer 94 procent van de dosis wordt teruggevonden in de urine en ontlasting als enalaprilaat of enalapril. De belangrijkste componenten in urine zijn enalaprilaat, goed voor ongeveer 40 procent van de dosis, en intact enalapril. Er zijn geen aanwijzingen voor metabolieten van enalapril, behalve enalaprilaat.
Het serumconcentratieprofiel van enalaprilaat vertoont een verlengde terminale fase, die klaarblijkelijk een kleine fractie vertegenwoordigt van de toegediende dosis die aan ACE is gebonden. De gebonden hoeveelheid neemt niet toe met de dosis, wat wijst op een verzadigbare bindingsplaats. De effectieve halfwaardetijd voor accumulatie van enalaprilaat na meerdere doses enalaprilmaleaat is 11 uur. De dispositie van enalapril en enalaprilaat bij patiënten met nierinsufficiëntie is vergelijkbaar met die bij patiënten met een normale nierfunctie totdat de glomerulaire filtratiesnelheid 30 ml/min of minder is. Met een glomerulaire filtratiesnelheid ≤ 30 ml/min, nemen de piek- en dalspiegels van enalaprilaat toe, neemt de tijd tot piekconcentratie toe en kan de tijd tot steady-state worden vertraagd. De effectieve halfwaardetijd van enalaprilaat na meerdere doses enalaprilmaleaat is verlengd bij dit niveau van nierinsufficiëntie (zie DOSERING EN ADMINISTRATIE ). Enalaprilaat is dialyseerbaar met een snelheid van 62 ml/min.
Studies bij honden geven aan dat enalapril de bloed-hersenbarrière slecht of helemaal niet passeert; enalaprilaat komt niet in de hersenen. Meerdere doses enalaprilmaleaat bij ratten leiden niet tot accumulatie in weefsels. Melk van zogende ratten bevat radioactiviteit na toediening van 14C-enalaprilmaleaat. Radioactiviteit bleek de placenta te passeren na toediening van gelabeld geneesmiddel aan zwangere hamsters.
Farmacodynamiek en klinische effecten
Hypertensie
Toediening van VASOTEC aan patiënten met hypertensie waarvan de ernst varieert van licht tot ernstig, resulteert in een verlaging van de bloeddruk zowel in liggende als in staande houding, gewoonlijk zonder orthostatische component. Symptomatische orthostatische hypotensie komt daarom zelden voor, hoewel het kan worden verwacht bij patiënten met volumedepletie (zie WAARSCHUWINGEN ).
Bij de meeste onderzochte patiënten werd na orale toediening van een enkele dosis enalapril een aanvang van de antihypertensieve activiteit waargenomen na één uur, met een piekverlaging van de bloeddruk na vier tot zes uur.
Bij de aanbevolen doseringen hielden de antihypertensieve effecten gedurende ten minste 24 uur aan. Bij sommige patiënten kunnen de effecten afnemen tegen het einde van het doseringsinterval (zie: DOSERING EN ADMINISTRATIE ).
Bij sommige patiënten kan het bereiken van een optimale bloeddrukverlaging enkele weken therapie vereisen.
De antihypertensieve effecten van VASOTEC houden aan tijdens langdurige therapie. Abrupt stoppen met VASOTEC 10 mg is niet in verband gebracht met een snelle stijging van de bloeddruk.
In hemodynamische onderzoeken bij patiënten met essentiële hypertensie ging bloeddrukverlaging gepaard met een verlaging van de perifere arteriële weerstand met een toename van het hartminuutvolume en weinig of geen verandering in de hartslag. Na toediening van VASOTEC is er een toename van de renale bloedstroom; glomerulaire filtratiesnelheid is meestal onveranderd. De effecten lijken vergelijkbaar te zijn bij patiënten met renovasculaire hypertensie.
Bij gelijktijdige toediening met diuretica van het thiazidetype zijn de bloeddrukverlagende effecten van VASOTEC 5 mg ongeveer additief.
In een klinisch farmacologisch onderzoek werd indomethacine of sulindac toegediend aan hypertensieve patiënten die VASOTEC kregen. In deze studie waren er geen aanwijzingen voor een afzwakking van de antihypertensieve werking van VASOTEC (zie DRUG-INTERACTIES ).
Hartfalen
In onderzoeken bij patiënten die werden behandeld met digitalis en diuretica, resulteerde behandeling met enalapril in verminderde systemische vaatweerstand, bloeddruk, pulmonale capillaire wiggedruk en hartgrootte, en verhoogde hartminuutvolume en inspanningstolerantie. De hartslag was onveranderd of licht verlaagd en de gemiddelde ejectiefractie was onveranderd of verhoogd. Er was een gunstig effect op de ernst van hartfalen, gemeten volgens de classificatie van de New York Heart Association (NYHA), en op symptomen van kortademigheid en vermoeidheid. Hemodynamische effecten werden waargenomen na de eerste dosis en leken aan te houden in ongecontroleerde onderzoeken die wel vier maanden duurden. Effecten op inspanningstolerantie, hartgrootte en ernst en symptomen van hartfalen werden waargenomen in placebogecontroleerde onderzoeken die acht weken tot meer dan een jaar duurden.
Hartfalen, sterfteproeven
In een multicenter, placebogecontroleerd klinisch onderzoek werden 2.569 patiënten met alle graden van symptomatisch hartfalen en een ejectiefractie ≤ 35 procent gerandomiseerd naar placebo of enalapril en tot 55 maanden gevolgd (SOLVD-behandeling). Het gebruik van enalapril ging gepaard met een vermindering van 11 procent van de mortaliteit door alle oorzaken en een vermindering van 30 procent van ziekenhuisopnames voor hartfalen. Ziekten die patiënten uitsloten van deelname aan het onderzoek waren onder meer ernstige stabiele angina (>2 aanvallen/dag), hemodynamisch significante klep- of uitstroomkanaalobstructie, nierfalen (creatinine >2,5 mg/dL), cerebrovasculaire ziekte (bijv. significante halsslagaderziekte) , gevorderde longziekte, maligniteiten, actieve myocarditis en constrictieve pericarditis. Het mortaliteitsvoordeel geassocieerd met enalapril lijkt niet af te hangen van de aanwezigheid van digitalis.
Een tweede multicenteronderzoek gebruikte het SOLVD-protocol voor onderzoek van asymptomatische of minimaal symptomatische patiënten. SOLVD-Preventiepatiënten, die een linkerventrikelejectiefractie ≤ 35% hadden en geen voorgeschiedenis van symptomatisch hartfalen hadden, werden gerandomiseerd naar placebo (n=2117) of enalapril (n=2111) en werden tot 5 jaar gevolgd. De meerderheid van de patiënten in het SOLVD-Preventie-onderzoek had een voorgeschiedenis van ischemische hartziekte. Een voorgeschiedenis van een myocardinfarct was aanwezig bij 80 procent van de patiënten, actuele angina pectoris bij 34 procent en een voorgeschiedenis van hypertensie bij 37 procent. In deze populatie werd geen statistisch significant mortaliteitseffect aangetoond. Met enalapril behandelde proefpersonen hadden 32% minder eerste ziekenhuisopnames voor hartfalen en 32% minder totale ziekenhuisopnames voor hartfalen. In vergelijking met placebo ontwikkelden 32 procent minder patiënten die enalapril kregen symptomen van openlijk hartfalen. Ziekenhuisopnames om cardiovasculaire redenen werden ook verminderd. Er was een onbeduidende vermindering van ziekenhuisopnames voor welke oorzaak dan ook in de enalaprilbehandelingsgroep (respectievelijk voor enalapril vs. placebo, 1166 vs. 1201 eerste ziekenhuisopnamen, 2649 vs. 2840 totale ziekenhuisopnames), hoewel het onderzoek niet was uitgevoerd om naar een dergelijke effect.
Het SOLVD-Preventie-onderzoek was niet bedoeld om te bepalen of behandeling van asymptomatische patiënten met een lage ejectiefractie superieur zou zijn, met betrekking tot het voorkomen van ziekenhuisopname, aan nauwere follow-up en gebruik van enalapril bij de eerste tekenen van hartfalen. Echter, onder de condities van follow-up in het SOLVD-Preventie-onderzoek (elke 4 maanden in de onderzoekskliniek; persoonlijke arts indien nodig), had 68% van de patiënten op placebo die in het ziekenhuis waren opgenomen voor hartfalen geen eerdere symptomen geregistreerd die zouden hebben gesignaleerde start van de behandeling.
De SOLVD-Preventie-studie was ook niet bedoeld om aan te tonen of enalapril de progressie van onderliggende hartziekte wijzigde.
In een ander multicenter, placebogecontroleerd onderzoek (CONSENSUS) beperkt tot patiënten met NYHA klasse IV congestief hartfalen en radiografisch bewijs van cardiomegalie, werd het gebruik van enalapril geassocieerd met een verbeterde overleving. De resultaten zijn weergegeven in de volgende tabel.
In zowel de CONSENSUS- als de SOLVD-behandelingsonderzoeken kregen patiënten gewoonlijk ook digitalis, diuretica of beide.
Klinische farmacologie bij pediatrische patiënten
Een farmacokinetisch onderzoek met meerdere doses werd uitgevoerd bij 40 hypertensieve mannelijke en vrouwelijke pediatrische patiënten in de leeftijd van 2 maanden tot ≤ 16 jaar na dagelijkse orale toediening van 0,07 tot 0,14 mg/kg enalaprilmaleaat. Bij steady-state was de gemiddelde effectieve halfwaardetijd voor accumulatie van enalaprilaat 14 uur en de gemiddelde urinaire terugwinning van totaal enalapril en enalaprilaat in 24 uur was 68% van de toegediende dosis. De conversie van enalapril naar enalaprilaat lag in het bereik van 63-76%. De algemene resultaten van dit onderzoek geven aan dat de farmacokinetiek van enalapril bij hypertensieve kinderen van 2 maanden tot ≤ 16 jaar consistent is in de onderzochte leeftijdsgroepen en consistent is met farmacokinetische historische gegevens bij gezonde volwassenen.
In een klinisch onderzoek onder 110 hypertensieve pediatrische patiënten van 6 tot 16 jaar kregen patiënten die
In de bovengenoemde pediatrische onderzoeken werd enalaprilmaleaat gegeven als VASOTEC-tabletten en aan die kinderen en zuigelingen die niet in staat waren om tabletten door te slikken of die een lagere dosis nodig hadden dan beschikbaar is in tabletvorm, werd enalapril toegediend in een suspensieformulering (zie DOSERING EN ADMINISTRATIE , Voorbereiding van schorsing ).
PATIËNT INFORMATIE
Angio-oedeem
Angio-oedeem, inclusief larynxoedeem, kan op elk moment optreden tijdens de behandeling met angiotensineconverterende enzymremmers, waaronder enalapril. Patiënten moeten zo worden geadviseerd en verteld om onmiddellijk alle tekenen of symptomen die op angio-oedeem wijzen (zwelling van gezicht, ledematen, ogen, lippen, tong, moeite met slikken of ademen) te melden en om geen geneesmiddelen meer te gebruiken totdat ze de voorschrijvende arts hebben geraadpleegd.
Hypotensie
Patiënten moeten worden gewaarschuwd om duizeligheid te melden, vooral tijdens de eerste paar dagen van de behandeling. Als daadwerkelijke syncope optreedt, moet de patiënten worden verteld om het medicijn te staken totdat ze de voorschrijvende arts hebben geraadpleegd. Alle patiënten moeten worden gewaarschuwd dat overmatige transpiratie en uitdroging kunnen leiden tot een buitensporige daling van de bloeddruk als gevolg van een vermindering van het vochtvolume. Andere oorzaken van volumedepletie, zoals braken of diarree, kunnen ook leiden tot een daling van de bloeddruk; patiënten moet worden geadviseerd om de arts te raadplegen.
Hyperkaliëmie
Patiënten moeten worden verteld geen zoutvervangers te gebruiken die kalium bevatten zonder hun arts te raadplegen.
Neutropenie
Patiënten moeten worden verteld dat ze elke indicatie van infectie (bijv. keelpijn, koorts) die een teken van neutropenie kunnen zijn, onmiddellijk moeten melden.
Zwangerschap
Vrouwelijke patiënten in de vruchtbare leeftijd moeten worden geïnformeerd over de gevolgen van blootstelling aan VASOTEC tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Patiënten moeten worden gevraagd zwangerschappen zo snel mogelijk aan hun arts te melden.
OPMERKING: Zoals met veel andere geneesmiddelen, is bepaald advies aan patiënten die met enalapril worden behandeld gerechtvaardigd. Deze informatie is bedoeld om te helpen bij een veilig en effectief gebruik van dit medicijn. Het is geen onthulling van alle mogelijke nadelige of beoogde effecten.
