Minipress 1mg, 2mg Prazosin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Minipress en hoe wordt het gebruikt?
Minipress (prazosinehydrochloride) is een alfa-adrenerge blokker die wordt gebruikt voor de behandeling van hypertensie (hoge bloeddruk).
Wat zijn bijwerkingen van Minipress 2 mg?
Vaak voorkomende bijwerkingen van Minipress 1 mg zijn:
- hoofdpijn,
- slaperigheid,
- vermoeidheid,
- zwakheid,
- wazig zien,
- misselijkheid,
- braken,
- diarree, of
- constipatie terwijl uw lichaam zich aanpast aan de medicatie
Andere bijwerkingen van Minipress 2 mg zijn onder meer:
- duizeligheid of duizeligheid bij het opstaan, vooral na de eerste dosis en kort na het innemen van een dosis van het geneesmiddel tijdens de eerste week van de behandeling.
Vertel het uw arts als u ernstige bijwerkingen van Minipress 1 mg ervaart, waaronder snelle of bonzende hartslagen of borstkloppingen, het gevoel alsof u flauwvalt, moeite met ademhalen, zwelling in uw handen of voeten, of een erectie die pijnlijk is of 4 uur aanhoudt of langer.
OMSCHRIJVING
MINIPRESS® (prazosinehydrochloride), een chinazolinederivaat, is de eerste van een nieuwe chemische klasse van antihypertensiva. Het is het hydrochloridezout van 1-(4-amino-6,7-dimethoxy-2-quinazolinyl)-4-(2-furoyl)piperazine en de structuurformule is:
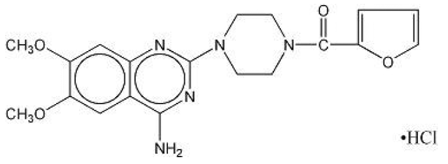
Molecuulformule C19H21N5O4•HCl
Het is een witte, kristallijne stof, enigszins oplosbaar in water en isotone zoutoplossing, en heeft een molecuulgewicht van 419,87. Elke capsule van 1 mg MINIPRESS voor oraal gebruik bevat een geneesmiddel dat overeenkomt met 1 mg vrije base.
Inerte ingrediënten in de formuleringen zijn: harde gelatinecapsules (die Blue 1, Red 3, Red 28, Red 40 en andere inerte ingrediënten kunnen bevatten); magnesium stearaat; natriumlaurylsulfaat; zetmeel; sucrose.
INDICATIES
MINIPRESS 1 mg is geïndiceerd voor de behandeling van hypertensie, om de bloeddruk te verlagen. Het verlagen van de bloeddruk vermindert het risico op fatale en niet-fatale cardiovasculaire voorvallen, voornamelijk beroertes en myocardinfarcten. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een breed scala van farmacologische klassen, waaronder dit medicijn.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan één medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van het Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
MINIPRESS kan alleen of in combinatie met andere antihypertensiva worden gebruikt, zoals diuretica of bèta-adrenerge blokkers.
DOSERING EN ADMINISTRATIE
De dosis MINIPRESS 1 mg moet worden aangepast aan de individuele bloeddrukrespons van de patiënt. Het volgende is een gids voor de administratie:
Initiële dosis
1 mg twee of drie keer per dag (zie WAARSCHUWINGEN .)
Onderhoudsdosis
De dosering kan langzaam worden verhoogd tot een totale dagelijkse dosis van 20 mg, verdeeld over verschillende doses. De meest gebruikte therapeutische doseringen varieerden van 6 mg tot 15 mg per dag in verdeelde doses. Doses hoger dan 20 mg verhogen gewoonlijk de werkzaamheid niet, maar enkele patiënten kunnen baat hebben bij verdere verhogingen tot een dagelijkse dosis van 40 mg verdeeld over meerdere doses. Na de initiële titratie kunnen sommige patiënten adequaat worden gehandhaafd op een tweemaal daags doseringsschema.
Gebruik met andere medicijnen
Wanneer een diureticum of ander antihypertensivum wordt toegevoegd, moet de dosis MINIPRESS 1 mg worden verlaagd tot driemaal daags 1 mg of 2 mg en moet de dosering worden hervat.
Gelijktijdige toediening van MINIPRESS 1 mg met een PDE-5-remmer kan leiden tot additieve bloeddrukverlagende effecten en symptomatische hypotensie; daarom moet de behandeling met PDE-5-remmers worden gestart met de laagste dosis bij patiënten die MINIPRESS gebruiken.
HOE GELEVERD
Gedistribueerd door: Pfizer Labs, Divsion of Pfizer Inc., NY, NY 10017. Herzien: februari 2015
BIJWERKINGEN
Klinische onderzoeken werden uitgevoerd bij meer dan 900 patiënten. Tijdens deze onderzoeken en de daaropvolgende marketingervaring zijn de meest voorkomende reacties geassocieerd met de behandeling met MINIPRESS: duizeligheid 10,3%, hoofdpijn 7,8%, slaperigheid 7,6%, gebrek aan energie 6,9%, zwakte 6,5%, hartkloppingen 5,3% en misselijkheid 4,9%. In de meeste gevallen zijn bijwerkingen verdwenen bij voortzetting van de behandeling of werden ze verdragen zonder verlaging van de dosis van het geneesmiddel.
Minder frequente bijwerkingen waarvan gemeld is dat ze bij 1-4% van de patiënten optreden, zijn:
Gastro-intestinaal: braken, diarree, constipatie.
Cardiovasculair: oedeem, orthostatische hypotensie, dyspneu, syncope.
Centraal zenuwstelsel: duizeligheid, depressie, nervositeit.
dermatologisch: uitslag.
Urogenitaal: urinaire frequentie.
EENT: wazig zien, rode sclera, epistaxis, droge mond, verstopte neus.
Bovendien heeft minder dan 1% van de patiënten het volgende gemeld (in sommige gevallen zijn geen exacte causale verbanden vastgesteld):
Gastro-intestinaal: abdominaal ongemak en/of pijn, afwijkingen in de leverfunctie, pancreatitis.
Cardiovasculair: tachycardie.
Centraal zenuwstelsel: paresthesie, hallucinaties.
dermatologisch: jeuk, alopecia, lichen planus.
Urogenitaal: incontinentie, impotentie, priapisme.
EENT: oorsuizen.
Ander: diaforese, koorts, positieve ANA-titer, artralgie.
Er zijn enkele meldingen van pigmentvlekken en sereuze retinopathie en enkele meldingen van het ontstaan of verdwijnen van cataract. In deze gevallen is het exacte causale verband niet vastgesteld omdat de basiswaarnemingen vaak ontoereikend waren.
In meer specifieke spleetlamp- en funduscopische onderzoeken, die adequate basisonderzoeken omvatten, zijn geen geneesmiddelgerelateerde abnormale oogheelkundige bevindingen gemeld.
Er zijn literatuurrapporten die de behandeling met MINIPRESS 1 mg associëren met een verergering van reeds bestaande narcolepsie. Een causaal verband is in deze gevallen onzeker.
Tijdens postmarketingervaring zijn de volgende bijwerkingen gemeld:
Autonoom zenuwstelsel: blozen.
Lichaam als geheel: allergische reactie, asthenie, malaise, pijn.
Cardiovasculair, Algemeen: angina pectoris, hypotensie.
Endocrien: gynaecomastie.
Hartslag/ritme: bradycardie.
Psychiatrisch: slapeloosheid.
Huid/aanhangsels: netelroos.
Vasculair (extracardiaal): vasculitis.
Visie: oogpijn.
Speciale zintuigen: Tijdens cataractchirurgie is een variant van het kleine-pupilsyndroom bekend als Intraoperatief Floppy Iris Syndroom (IFIS) gemeld in verband met therapie met alfa-1-blokkers (zie PREVENTIEVE MAATREGELEN ).
DRUG-INTERACTIES
MINIPRESS 2 mg is toegediend zonder enige nadelige geneesmiddelinteractie in beperkte klinische ervaring tot nu toe met het volgende: (1) hartglycosiden-digitalis en digoxine; (2) hypoglycemische middelen - insuline, chloorpropamide, fenformine, tolazamide en tolbutamide; (3) kalmeringsmiddelen en sedativa - chloordiazepoxide, diazepam en fenobarbital; (4) anti-allopurinol, colchicine en probenecide; (5) antiaritmica - procaïnamide, propranolol (zie: WAARSCHUWINGEN echter), en kinidine; en (6) analgetica, antipyretica en ontstekingsremmers - propoxyfeen, aspirine, indomethacine en fenylbutazon.
Het is aangetoond dat toevoeging van een diureticum of ander antihypertensivum aan MINIPRESS 2 mg een additief hypotensief effect veroorzaakt. Dit effect kan worden geminimaliseerd door de MINIPRESS-dosis te verlagen tot driemaal daags 1 tot 2 mg, door voorzichtig aanvullende antihypertensiva te introduceren en vervolgens door MINIPRESS te hervatten op basis van de klinische respons. Gelijktijdige toediening van MINIPRESS met een fosfodiësterase-5 (PDE-5)-remmer kan leiden tot additieve bloeddrukverlagende effecten en symptomatische hypotensie (zie DOSERING EN ADMINISTRATIE ).
Geneesmiddel-/laboratoriumtestinteracties
In een onderzoek bij vijf patiënten die 12 tot 24 mg prazosine per dag kregen gedurende 10 tot 14 dagen, was er een gemiddelde toename van 42% in de urinaire metaboliet van noradrenaline en een gemiddelde toename van urinaire VMA van 17%. Daarom kunnen vals-positieve resultaten optreden bij screeningtests voor feochromocytoom bij patiënten die worden behandeld met prazosine. Als een verhoogde VMA wordt gevonden, moet de behandeling met prazosine worden stopgezet en moet de patiënt na een maand opnieuw worden getest.
Laboratorium testen
In klinische onderzoeken waarin lipidenprofielen werden gevolgd, werden over het algemeen geen nadelige veranderingen waargenomen tussen de lipideniveaus vóór en na de behandeling.
WAARSCHUWINGEN
Zoals alle alfablokkers kan MINIPRESS syncope veroorzaken met plotseling bewustzijnsverlies. In de meeste gevallen wordt aangenomen dat dit het gevolg is van een overmatig posturaal hypotensief effect, hoewel af en toe de syncopalepisode is voorafgegaan door een aanval van ernstige tachycardie met hartfrequenties van 120-160 slagen per minuut. Syncopalepis odes zijn meestal opgetreden binnen 30 tot 90 minuten na de eerste dosis van het geneesmiddel; af en toe zijn ze gemeld in verband met snelle dosisverhogingen in de leeftijd of de introductie van een ander antihypertensivum in het regime van een patiënt die hoge doses MINIPRESS gebruikt. De incidentie van syncopalepisodes is ongeveer 1% bij patiënten die een aanvangsdosis van 2 mg of meer krijgen. Klinische onderzoeken die tijdens de onderzoeksfase van dit medicijn zijn uitgevoerd, suggereren dat syncopale episodes kunnen worden geminimaliseerd door de initiële dosis van het medicijn te beperken tot 1 mg, door de dosering vervolgens langzaam te verhogen en door aanvullende antihypertensiva in het regime van de patiënt te introduceren met de nodige voorzichtigheid (zie DOSERING EN TOEDIENING ). Hypotensie kan optreden bij patiënten die MINIPRESS krijgen en die ook een bètablokker zoals propranolol krijgen.
Als syncope optreedt, moet de patiënt in liggende positie worden geplaatst en zo nodig ondersteunend worden behandeld. Deze bijwerking is zelfbeperkend en komt in de meeste gevallen niet terug na de eerste behandelingsperiode of tijdens daaropvolgende dosistitratie.
Patiënten moeten altijd beginnen met de 1 mg capsules van MINIPRESS. De capsules van 2 en 5 mg zijn niet geïndiceerd voor initiële therapie.
Vaker dan bewustzijnsverlies zijn de symptomen die vaak gepaard gaan met verlaging van de bloeddruk, namelijk duizeligheid en een licht gevoel in het hoofd. De patiënt moet worden gewaarschuwd voor deze mogelijke bijwerkingen en moet worden geadviseerd welke maatregelen hij moet nemen als deze zich ontwikkelen. De patiënt moet ook worden gewaarschuwd om situaties te vermijden waarin letsel zou kunnen ontstaan als syncope optreedt tijdens de start van de behandeling met MINIPRESS 2 mg.
Priapisme
Langdurige erecties en priapisme zijn gemeld met alfa-1-blokkers, waaronder prazosine, tijdens postmarketingervaring. Zoek onmiddellijk medische hulp in het geval van een erectie die langer dan 4 uur aanhoudt. Als priapisme niet onmiddellijk wordt behandeld, kan dit leiden tot beschadiging van het penisweefsel en permanent verlies van potentie.
PREVENTIEVE MAATREGELEN
Algemeen
Intraoperatief Floppy Iris Syndroom (IFIS) is waargenomen tijdens cataractchirurgie bij sommige patiënten die werden behandeld met alfa-1-blokkers. Deze variant van het kleine-pupilsyndroom wordt gekenmerkt door de combinatie van een slappe iris die opzwelt als reactie op intraoperatieve irrigatiestromen, progressieve intraoperatieve miosis ondanks preoperatieve dilatatie met standaard mydriatica, en mogelijke verzakking van de iris naar de phaco-emulsificatie-incisies. De oogarts van de patiënt moet voorbereid zijn op mogelijke aanpassingen aan de chirurgische techniek, zoals het gebruik van irishaken, irisdilatatieringen of visco-elastische stoffen. Het lijkt geen voordeel te hebben om te stoppen met de behandeling met alfa-1-blokkers voorafgaand aan een cataractoperatie.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen carcinogeen potentieel aangetoond in een 18 maanden durend onderzoek bij ratten met MINIPRESS 1 mg in doseringen van meer dan 225 maal de gebruikelijke maximale aanbevolen dosis voor de mens van 20 mg per dag. MINIPRESS 2 mg was niet mutageen in in vivo genetische toxicologische onderzoeken. In een vruchtbaarheids- en algemeen reproductief prestatieonderzoek bij ratten, zowel mannetjes als vrouwtjes, behandeld met 75 mg/kg (225 maal de gebruikelijke maximale aanbevolen dosis voor maximale aanbevolen dosis voor de mens) niet.
In chronische onderzoeken (een jaar of langer) van MINIPRESS bij ratten en honden, traden testiculaire veranderingen op bestaande uit atrofie en necrose bij 25 mg/kg/dag (75 maal de gebruikelijke maximale aanbevolen dosis voor de mens). Er werden geen veranderingen in de testikels waargenomen bij ratten of honden bij 10 mg/kg/dag (30 maal de gebruikelijke maximale aanbevolen dosis voor de mens). Gezien de veranderingen in de testikels die bij dieren werden waargenomen, werden 105 patiënten die langdurig met MINIPRESS werden behandeld, gecontroleerd op de uitscheiding van 17 ketosteroïden en er werden geen veranderingen waargenomen die wijzen op een geneesmiddeleffect. Bovendien hadden 27 mannen die MINIPRESS 1 mg gedurende maximaal 51 maanden gebruikten geen veranderingen in de spermamorfologie die wijzen op een geneesmiddeleffect.
Gebruik tijdens de zwangerschap
Zwangerschap Categorie C. Van MINIPRESS 1 mg is aangetoond dat het geassocieerd is met een verminderde worpgrootte bij de geboorte, 1, 4 en 21 dagen oud bij ratten bij toediening van doses van meer dan 225 maal de gebruikelijke maximale aanbevolen dosis voor de mens. Er werden geen aanwijzingen voor geneesmiddelgerelateerde externe, viscerale of skeletafwijkingen van de foetus waargenomen. Er werden geen geneesmiddelgerelateerde uitwendige, viscerale of skeletafwijkingen waargenomen bij foetussen van zwangere konijnen en drachtige apen bij doses van respectievelijk meer dan 225 keer en 12 keer de gebruikelijke maximaal aanbevolen dosis voor de mens.
Het gebruik van prazosine en een bètablokker voor de beheersing van ernstige hypertensie bij 44 zwangere vrouwen bracht geen geneesmiddelgerelateerde foetale afwijkingen of bijwerkingen aan het licht. De therapie met prazosine werd gedurende 14 weken voortgezet
Prazosine is door andere onderzoekers ook alleen of in combinatie met andere hypotensiva gebruikt bij ernstige zwangerschapshypertensie. Er zijn geen foetale of neonatale afwijkingen gemeld bij het gebruik van prazosine
Er zijn geen adequate en goed gecontroleerde onderzoeken die de veiligheid van MINIPRESS bij zwangere vrouwen aantonen. MINIPRESS mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de moeder en de foetus.
Moeders die borstvoeding geven
Van MINIPRESS 1 mg is aangetoond dat het in kleine hoeveelheden wordt uitgescheiden in de moedermelk. Voorzichtigheid is geboden wanneer MINIPRESS 2 mg wordt toegediend aan een vrouw die borstvoeding geeft.
Gebruik bij kinderen
De veiligheid en werkzaamheid bij kinderen zijn niet vastgesteld.
REFERENTIES
1. Lubbe, WF en Hodge, JV: Nieuw-Zeeland Med J, 94 (691) 169-172, 1981.
2. Davey, DA, en Dommisse, J: SA Med J, 4 oktober 1980 (551-556).
OVERDOSERING
Accidentele inname van ten minste 50 mg MINIPRESS bij een tweejarig kind resulteerde in ernstige slaperigheid en depressieve reflexen. Er werd geen verlaging van de bloeddruk waargenomen. Het herstel verliep vlekkeloos.
Mocht overdosering leiden tot hypotensie, dan is ondersteuning van het cardiovasculaire systeem van eerste belang. Herstel van de bloeddruk en normalisatie van de hartslag kan worden bereikt door de patiënt in rugligging te houden. Als deze maatregel niet voldoende is, moet shock eerst worden behandeld met volume-expanders. Indien nodig moeten dan vasopressoren worden gebruikt. De nierfunctie moet worden gecontroleerd en zo nodig worden ondersteund. Laboratoriumgegevens geven aan dat MINIPRESS niet dialyseerbaar is omdat het eiwitgebonden is.
CONTRA-INDICATIES
MINIPRESS is gecontra-indiceerd bij patiënten met een bekende gevoeligheid voor chinazolines, prazosine of een van de inerte ingrediënten.
KLINISCHE FARMACOLOGIE
Het exacte mechanisme van de hypotensieve werking van prazosine is niet bekend. Prazosine veroorzaakt een afname van de totale perifere weerstand en er werd oorspronkelijk gedacht dat het een direct ontspannend effect had op vasculaire gladde spieren. Recente dierstudies hebben echter gesuggereerd dat het vaatverwijdende effect van prazosine ook verband houdt met blokkade van postsynaptische alfa-adrenoceptoren. De resultaten van experimenten met de voorpoten van honden tonen aan dat het perifere vaatverwijdende effect van prazosine voornamelijk beperkt is tot het niveau van de weerstandsvaten (arteriolen). In tegenstelling tot conventionele alfablokkers gaat de antihypertensieve werking van prazosine gewoonlijk niet gepaard met een reflextachycardie. Er is geen tolerantie waargenomen bij langdurige therapie.
Er zijn hemodynamische onderzoeken uitgevoerd bij de mens na acute toediening van een enkelvoudige dosis en tijdens langdurige onderhoudstherapie. De resultaten bevestigen dat het therapeutische effect een daling van de bloeddruk is die niet gepaard gaat met een klinisch significante verandering in het hartminuutvolume, de hartslag, de renale bloedstroom en de glomerulaire filtratiesnelheid. Er is geen meetbaar negatief chronotroop effect.
In klinische onderzoeken tot nu toe heeft prazosinehydrochloride de plasmarenine-activiteit niet verhoogd.
Bij de mens wordt de bloeddruk zowel in liggende als staande houding verlaagd. Dit effect is het meest uitgesproken op de diastolische bloeddruk.
Na orale toediening bereiken de humane plasmaconcentraties een piek na ongeveer drie uur met een plasmahalfwaardetijd van twee tot drie uur. Het medicijn is sterk gebonden aan plasma-eiwit. Onderzoeken naar biologische beschikbaarheid hebben aangetoond dat de totale absorptie ten opzichte van het geneesmiddel in een 20% alcoholische oplossing 90% is, wat resulteert in piekniveaus van ongeveer 65% van die van het geneesmiddel in oplossing. Dierstudies geven aan dat prazosinehydrochloride uitgebreid wordt gemetaboliseerd, voornamelijk door demethylering en conjugatie, en voornamelijk via gal en feces wordt uitgescheiden. Minder uitgebreide studies bij mensen suggereren een vergelijkbaar metabolisme en vergelijkbare uitscheiding bij de mens.
In klinische onderzoeken waarin lipidenprofielen werden gevolgd, werden over het algemeen geen nadelige veranderingen waargenomen tussen de lipideniveaus vóór en na de behandeling.
PATIËNT INFORMATIE
Duizeligheid of slaperigheid kan optreden na de eerste dosis van dit geneesmiddel. Vermijd autorijden of gevaarlijke taken uitvoeren gedurende de eerste 24 uur na inname van dit geneesmiddel of wanneer de dosis wordt verhoogd. Duizeligheid, een licht gevoel in het hoofd of flauwvallen kan optreden, vooral bij het opstaan vanuit een liggende of zittende positie. Langzaam opstaan kan het probleem helpen verminderen. Deze effecten kunnen ook optreden als u alcohol drinkt, lange tijd staat, sport of als het warm weer is. Wees tijdens het gebruik van MINIPRESS voorzichtig met de hoeveelheid alcohol die u drinkt. Wees ook extra voorzichtig tijdens het sporten of warm weer, of als u lang staat. Raadpleeg uw arts als u vragen heeft.
