Prinivil 2.5mg, 5mg, 10mg Lisinopril Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Prinivil 2,5 mg en hoe wordt het gebruikt?
Prinivil is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van hoge bloeddruk (hypertensie) na een hartaanval of hartfalen. Prinivil kan alleen of met andere medicijnen worden gebruikt.
- Prinivil behoort tot een klasse geneesmiddelen die ACE-remmers worden genoemd.
- Het is niet bekend of Prinivil veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Prinivil?
Prinivil kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- koorts,
- keelpijn,
- misselijkheid,
- zwakheid,
- tintelend gevoel,
- pijn op de borst,
- onregelmatige hartslagen,
- verlies van beweging,
- weinig of geen plassen,
- zwelling in uw voeten of enkels,
- zich moe voelen,
- kortademig,
- pijn in de bovenbuik,
- jeuk,
- moe gevoel,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Prinivil 5 mg zijn:
- hoofdpijn,
- duizeligheid,
- hoesten, en
- pijn op de borst
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prinivil. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Wanneer zwangerschap wordt gedetecteerd, stop dan zo snel mogelijk met PRINIVIL (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
- Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
PRINIVIL bevat lisinopril, een synthetisch peptidederivaat en een orale, langwerkende angiotensineconverterende enzymremmer. Lisinopril wordt chemisch beschreven als (S)-1-[N2-(1-carboxy-3-fenylpropyl)-Llysyl]-L-proline-dihydraat. De empirische formule is C21H31N3O5•2H2O en de structuurformule is:
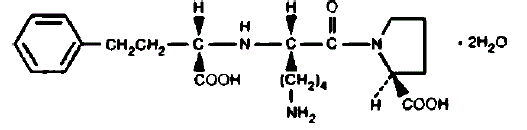
Lisinopril is een wit tot gebroken wit, kristallijn poeder met een molecuulgewicht van 441,52. Het is oplosbaar in water en matig oplosbaar in methanol en praktisch onoplosbaar in ethanol.
PRINIVIL 10 mg wordt geleverd als tabletten van 5 mg, 10 mg en 20 mg voor orale toediening. Naast het actieve ingrediënt, lisinopril, bevat elke tablet de volgende inactieve ingrediënten: calciumfosfaat, mannitol, magnesiumstearaat en zetmeel. De tabletten van 10 mg en 20 mg bevatten ook ijzeroxide.
INDICATIES
Hypertensie
PRINIVIL is geïndiceerd voor de behandeling van hypertensie bij volwassen patiënten en pediatrische patiënten van 6 jaar en ouder om de bloeddruk te verlagen. Het verlagen van de bloeddruk verlaagt het risico op fatale en niet-fatale cardiovasculaire gebeurtenissen, voornamelijk beroertes en myocardinfarcten. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een groot aantal verschillende farmacologische klassen.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan 1 medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van de Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
PRINIVIL kan alleen of met andere antihypertensiva worden toegediend [zie: Klinische studies ].
Hartfalen
PRINIVIL is geïndiceerd om tekenen en symptomen van hartfalen te verminderen bij patiënten die niet adequaat reageren op diuretica en digitalis [zie Klinische studies ].
Acuut myocardinfarct
PRINIVIL is geïndiceerd voor de vermindering van de mortaliteit bij de behandeling van hemodynamisch stabiele patiënten binnen 24 uur na een acuut myocardinfarct. Patiënten moeten, indien van toepassing, de standaard aanbevolen behandelingen krijgen, zoals trombolytica, aspirine en bètablokkers [zie: Klinische studies ].
DOSERING EN ADMINISTRATIE
Hypertensie
Aanvangstherapie bij volwassenen: De aanbevolen aanvangsdosis is 10 mg eenmaal per dag. Pas de dosering aan op basis van de bloeddrukrespons. Het gebruikelijke doseringsbereik is 20 tot 40 mg per dag, toegediend in een enkele dagelijkse dosis. Doses tot 80 mg zijn gebruikt, maar lijken geen groter effect te geven.
Gebruik met diuretica bij volwassenen
Als de bloeddruk niet onder controle wordt gebracht met alleen PRINIVIL 10 mg, kan een lage dosis van een diureticum worden toegevoegd (bijv. hydrochloorthiazide 12,5 mg).
De aanbevolen startdosering bij volwassen patiënten met hypertensie die diuretica gebruiken, is eenmaal daags 5 mg [zie DRUG-INTERACTIES ].
Pediatrische patiënten van 6 jaar en ouder met hypertensie
Voor pediatrische patiënten met een glomerulaire filtratiesnelheid >30 ml/min/1,73 m² is de aanbevolen startdosis 0,07 mg/kg eenmaal daags (tot in totaal 5 mg). De dosering moet worden aangepast aan de bloeddrukrespons tot een maximum van 0,61 mg/kg (tot 40 mg) eenmaal daags. Doses hoger dan 0,61 mg/kg (of hoger dan 40 mg) zijn niet onderzocht bij pediatrische patiënten [zie: KLINISCHE FARMACOLOGIE ].
PRINIVIL 2,5 mg wordt niet aanbevolen bij pediatrische patiënten Gebruik bij specifieke populaties en Klinische studies ].
Hartfalen
De aanbevolen startdosering voor PRINIVIL 2,5 mg, bij gebruik met diuretica en (meestal) digitalis als aanvullende therapie is 5 mg eenmaal daags. De aanbevolen startdosering bij deze patiënten met hyponatriëmie (serumnatrium
De dosis diuretica moet mogelijk worden aangepast om hypovolemie te helpen minimaliseren, wat kan bijdragen aan hypotensie [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ]. Het optreden van hypotensie na de aanvangsdosis PRINIVIL sluit een daaropvolgende zorgvuldige dosistitratie met het geneesmiddel niet uit, na effectieve behandeling van de hypotensie.
Acuut myocardinfarct
Geef bij hemodynamisch stabiele patiënten binnen 24 uur na het begin van de symptomen van een acuut myocardinfarct PRINIVIL 5 mg oraal, gevolgd door 5 mg na 24 uur, 10 mg na 48 uur en vervolgens 10 mg eenmaal daags. De dosering moet gedurende ten minste 6 weken worden voortgezet.
Start therapie met 2,5 mg bij patiënten met een lage systolische bloeddruk (100-120 mmHg) gedurende de eerste 3 dagen na het infarct [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Als hypotensie optreedt (systolische bloeddruk ≤ 100 mmHg), overweeg dan doses van 2,5 of 5 mg. Als langdurige hypotensie optreedt (systolische bloeddruk
Dosis bij patiënten met nierinsufficiëntie
Er is geen dosisaanpassing van PRINIVIL 2,5 mg nodig bij patiënten met een creatinineklaring >30 ml/min. Bij patiënten met een creatinineklaring van 10-30 ml/min, verlaag de aanvangsdosis PRINIVIL tot de helft van de gebruikelijke aanbevolen dosis (dwz hypertensie, 5 mg; hartfalen of acuut MI, 2,5 mg). Voor patiënten die hemodialyse ondergaan of een creatinineklaring Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
Voorbereiding van schorsing
Om 200 ml van een suspensie van 1,0 mg / ml te maken, voegt u 10 ml gezuiverd water USP toe aan een fles van polyethyleentereftalaat (PET) met tien tabletten van 20 mg PRINIVIL 5 mg en schudt u gedurende ten minste één minuut. Voeg 30 ml natriumcitraat en citroenzuur orale oplossing of Cytra-2 verdunningsmiddel en 160 ml Ora-Sweet SF™ toe aan het concentraat in de PET-fles en schud voorzichtig gedurende enkele seconden om de ingrediënten te verspreiden. De suspensie moet worden bewaard bij of beneden 25°C (77°F) en kan maximaal vier weken worden bewaard. Schud de suspensie voor elk gebruik.
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten PRINIVIL, 5 mg, zijn witte, ovale, samengeperste tabletten met aan de ene kant de code MSD 19 en aan de andere kant een breukstreep.
Tabletten PRINIVIL, 10 mg, zijn lichtgele, ovale, samengeperste tabletten met aan de ene kant de code MSD 106 en aan de andere kant een breukstreep.
Tabletten PRINIVIL, 20 mg, zijn perzikkleurige, ovale, samengeperste tabletten met aan de ene kant de code MSD 207 en aan de andere kant een breukstreep.
Opslag en behandeling
PRINIVIL 10 mg wordt geleverd als ovale, samengeperste tabletten met een breukstreep aan één kant.
Opslag
Bewaren bij een gecontroleerde kamertemperatuur, 15-30 ° C (59-86 ° F), en beschermen tegen vocht.
Doseer in een strakke container, als de productverpakking is onderverdeeld.
Gedistribueerd door: Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO., INC., Whitehouse Station, NJ 08889, VS. Herzien: november 2021
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Hypertensie
De volgende bijwerkingen (gebeurtenissen 2% groter op PRINIVIL 5 mg dan op placebo) werden waargenomen met PRINIVIL 2,5 mg vs placebo: hoofdpijn (5,7% vs 1,9%), duizeligheid (5,4% vs 1,9%), hoesten (3,5% vs 1,0% ).
Hartfalen
In gecontroleerde onderzoeken bij patiënten met hartfalen werd de therapie stopgezet bij 8,1% van de patiënten die 12 weken met PRINIVIL 10 mg werden behandeld, vergeleken met 7,7% van de patiënten die 12 weken met placebo werden behandeld.
De volgende bijwerkingen (gebeurtenissen die 2% groter waren op PRINIVIL 2,5 mg dan op placebo) werden waargenomen met PRINIVIL versus placebo: hypotensie (4,4% versus 0,6%), pijn op de borst (3,4% versus 1,3%).
In de ATLAS-studie [zie Klinische studies ] bij patiënten met hartfalen waren de stopzettingen voor bijwerkingen vergelijkbaar in de groepen met een lage en hoge dosis. De volgende bijwerkingen, meestal gerelateerd aan ACE-remming, werden vaker gemeld in de groep met hoge doses:
Acuut myocardinfarct
Patiënten in het GISSI-3-onderzoek, behandeld met PRINIVIL 10 mg, hadden een hogere incidentie van hypotensie (9,0% versus 3,7%) en nierdisfunctie (2,4% versus 1,1%) in vergelijking met patiënten die geen PRINIVIL gebruikten.
Andere klinische bijwerkingen die optreden bij 1% of meer van de patiënten met hypertensie of hartfalen die werden behandeld met PRINIVIL 2,5 mg in gecontroleerde klinische onderzoeken en die niet voorkomen in andere rubrieken van de etikettering, worden hieronder vermeld:
Lichaam als geheel: Vermoeidheid, asthenie, orthostatische effecten.
spijsvertering: Pancreatitis, constipatie, winderigheid, droge mond, diarree.
Hematologische: Zeldzame gevallen van beenmergdepressie, hemolytische anemie, leukopenie/neutropenie en trombocytopenie.
Endocrien: Diabetes mellitus, ongepaste secretie van antidiuretisch hormoon.
Metabolisch: Jicht
Huid: Urticaria, alopecia, lichtgevoeligheid, erytheem, blozen, diaforese, cutaan pseudolymfoom, toxische epidermale necrolyse, Stevens-Johnson-syndroom en pruritus.
Speciale zintuigen: Visusverlies, diplopie, wazig zien, tinnitus, fotofobie, smaakstoornissen, reukstoornissen.
Urogenitaal: Impotentie
Diversen: Er is een symptoomcomplex gemeld dat een positieve ANA, een verhoogde bezinkingssnelheid van erytrocyten, artralgie/artritis, myalgie, koorts, vasculitis, eosinofilie, leukocytose, paresthesie en duizeligheid kan omvatten. Huiduitslag, lichtgevoeligheid of andere dermatologische verschijnselen kunnen alleen of in combinatie met deze symptomen optreden.
Resultaten van klinische laboratoriumtests
Serum Kalium
In klinische onderzoeken trad hyperkaliëmie (serumkalium >5,7 mEq/L) op bij respectievelijk 2,2% en 4,8% van de met PRINIVIL behandelde patiënten met hypertensie en hartfalen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Creatinine, bloedureumstikstof
Bij ongeveer 2% van de patiënten met hypertensie die alleen met PRINIVIL 5 mg werden behandeld, werden lichte verhogingen van bloedureumstikstof en serumcreatinine waargenomen, die reversibel waren na stopzetting van de behandeling. Verhogingen kwamen vaker voor bij patiënten die gelijktijdig diuretica kregen en bij patiënten met nierarteriestenose [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Omkeerbare lichte verhogingen van bloedureumstikstof en serumcreatinine werden waargenomen bij 11,6% van de patiënten met hartfalen die gelijktijdig met diuretica werden behandeld. Vaak verdwenen deze afwijkingen wanneer de dosering van het diureticum werd verlaagd.
Patiënten met een acuut myocardinfarct in de GISSI-3-studie die met PRINIVIL werden behandeld, hadden een hogere incidentie (2,4% versus 1,1% bij placebo) van nierdisfunctie in het ziekenhuis en na 6 weken (verhoging van de creatinineconcentratie tot meer dan 3 mg/dL of een verdubbeling of meer van de baseline serumcreatinineconcentratie).
Hemoglobine en hematocriet
Kleine verlagingen van hemoglobine (gemiddeld 0,4 mg/dl) en hematocriet (gemiddeld 1,3%) kwamen vaak voor bij patiënten die werden behandeld met PRINIVIL 5 mg, maar waren zelden van klinisch belang bij patiënten zonder een andere oorzaak van anemie. In klinische onderzoeken stopte minder dan 0,1% van de patiënten de behandeling voor bloedarmoede.
Lever enzymen
Zelden zijn verhogingen van leverenzymen en/of serumbilirubine opgetreden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van lisinopril na goedkeuring die niet zijn opgenomen in andere rubrieken van de etikettering. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Andere reacties zijn onder meer:
Metabolisme en voedingsstoornissen
Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], gevallen van hypoglykemie bij diabetespatiënten die orale antidiabetica of insuline gebruiken [zie: DRUG-INTERACTIES ]
Zenuwstelsel en psychiatrische stoornissen
Stemmingswisselingen (inclusief depressieve symptomen), mentale verwarring
DRUG-INTERACTIES
diuretica
Het starten van PRINIVIL bij patiënten die diuretica gebruiken, kan leiden tot een overmatige verlaging van de bloeddruk. De mogelijkheid van hypotensieve effecten met PRINIVIL kan worden geminimaliseerd door het diureticum te verminderen of te staken of door de zoutinname te verhogen voordat de behandeling met PRINIVIL wordt gestart. Als dit niet mogelijk is, verlaag dan de startdosis PRINIVIL [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
PRINIVIL 2,5 mg vermindert kaliumverlies veroorzaakt door diuretica van het thiazidetype. Kaliumsparende diuretica (spironolacton, amiloride, triamtereen en andere) of andere geneesmiddelen die het serumkalium kunnen verhogen, kunnen het risico op hyperkaliëmie verhogen. Controleer daarom, als gelijktijdig gebruik van dergelijke middelen is geïndiceerd, het serumkalium van de patiënt regelmatig.
Antidiabetica
Gelijktijdige toediening van PRINIVIL 10 mg en antidiabetica (insulines, orale bloedglucoseverlagende middelen) kan een verhoogd bloedglucoseverlagend effect veroorzaken met risico op hypoglykemie.
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, waaronder selectieve COX-2-remmers, en ACE-remmers, waaronder lisinopril, leiden tot een verslechtering van de nierfunctie, waaronder mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die behandeld worden met lisinopril en NSAID's.
Het antihypertensieve effect van ACE-remmers, waaronder lisinopril, kan worden afgezwakt door NSAID's.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of directe renineremmers (zoals aliskiren) wordt in verband gebracht met een verhoogd risico op hypotensie, syncope, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie.
De Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) studie nam 1448 patiënten op met diabetes type 2, verhoogde urine-albumine-tot-creatinine-ratio en verlaagde geschatte glomerulaire filtratiesnelheid (GFR 30 tot 89,9 ml/min), gerandomiseerd naar lisinopril of placebo tegen een achtergrond van therapie met losartan en volgden deze gedurende een mediane periode van 2,2 jaar. Patiënten die de combinatie van losartan en lisinopril kregen, kregen geen extra voordeel in vergelijking met monotherapie voor het gecombineerde eindpunt van afname van GFR, nierziekte in het eindstadium of overlijden, maar ervoeren een verhoogde incidentie van hyperkaliëmie en acuut nierletsel in vergelijking met de monotherapiegroep .
Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Controleer de bloeddruk, nierfunctie en elektrolyten bij patiënten die PRINIVIL 5 mg en andere middelen gebruiken die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met PRINIVIL bij patiënten met diabetes. Vermijd het gebruik van aliskiren met PRINIVIL 2,5 mg bij patiënten met een nierfunctiestoornis (GFR
Lithium
Lithiumtoxiciteit is gemeld bij patiënten die lithium gelijktijdig kregen met geneesmiddelen die natriumeliminatie veroorzaken, waaronder ACE-remmers. Lithiumtoxiciteit was gewoonlijk reversibel na stopzetting van lithium en de ACE-remmer. Controleer de serumlithiumspiegels tijdens gelijktijdig gebruik.
Goud
Nitritoïde reacties (symptomen zijn onder meer blozen in het gezicht, misselijkheid, braken en hypotensie) zijn zelden gemeld bij patiënten die werden behandeld met injecteerbaar goud (natriumaurothiomalaat) en gelijktijdige behandeling met ACE-remmers, waaronder PRINIVIL.
Zoogdierdoelwit van rapamycine (mTOR) -remmers
Patiënten die gelijktijdig met een mTOR-remmer (bijv. temsirolimus, sirolimus, everolimus) worden behandeld, kunnen een verhoogd risico lopen op angio-oedeem (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Neprilysine-remmers
Patiënten die gelijktijdig een neprilysine-remmer (bijv. sacubitril) gebruiken, kunnen een verhoogd risico lopen op angio-oedeem (zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Foetale toxiciteit
PRINIVIL kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met PRINIVIL [zie Gebruik bij specifieke populaties ].
Angio-oedeem en anafylactoïde reacties
Angio-oedeem
Hoofd- en nekangio-oedeem
Angio-oedeem van het gezicht, ledematen, lippen, tong, glottis en/of strottenhoofd, waaronder enkele fatale reacties, zijn op enig moment tijdens de behandeling opgetreden bij patiënten die werden behandeld met angiotensineconverterende enzymremmers, waaronder PRINIVIL. Patiënten met betrokkenheid van de tong, glottis of larynx zullen waarschijnlijk luchtwegobstructie ervaren, vooral degenen met een voorgeschiedenis van luchtwegchirurgie. PRINIVIL 5 mg moet onmiddellijk worden gestaakt en er moet een geschikte therapie en controle worden gegeven totdat de tekenen en symptomen van angio-oedeem volledig en aanhoudend zijn verdwenen.
Patiënten met een voorgeschiedenis van angio-oedeem dat geen verband houdt met behandeling met een ACE-remmer, kunnen een verhoogd risico lopen op angio-oedeem terwijl ze een ACE-remmer krijgen [zie CONTRA-INDICATIES ]. ACE-remmers zijn in verband gebracht met een hoger percentage angio-oedeem bij negroïde patiënten dan bij niet-negroïde patiënten.
Patiënten die gelijktijdig een ACE-remmer en mTOR (mammalian target of rapamycin)-remmer (bijv. temsirolimus, sirolimus, everolimus) krijgen, kunnen een verhoogd risico lopen op angio-oedeem (zie DRUG-INTERACTIES ].
Patiënten die gelijktijdig met een ACE-remmer en neprilysine-remmer worden behandeld, kunnen een verhoogd risico lopen op angio-oedeem (zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
Intestinaal angio-oedeem
Intestinaal angio-oedeem is opgetreden bij patiënten die werden behandeld met ACE-remmers. Deze patiënten vertoonden buikpijn (met of zonder misselijkheid of braken); in sommige gevallen was er geen voorgeschiedenis van angio-oedeem in het gezicht en waren de C-1-esterasespiegels normaal. In sommige gevallen werd het angio-oedeem gediagnosticeerd door procedures, waaronder CT-scan of echografie van de buik, of tijdens een operatie, en de symptomen verdwenen na het stoppen met de ACE-remmer.
Anafylactoïde reacties
Anafylactoïde reacties tijdens desensibilisatie
Twee patiënten die een desensibiliserende behandeling met Hymenoptera-gif ondergingen terwijl ze ACE-remmers kregen, kregen levensbedreigende anafylactoïde reacties.
Anafylactoïde reacties tijdens dialyse
Plotselinge en mogelijk levensbedreigende anafylactoïde reacties zijn opgetreden bij sommige patiënten die werden gedialyseerd met high-flux membranen en gelijktijdig werden behandeld met een ACE-remmer. Bij dergelijke patiënten moet de dialyse onmiddellijk worden stopgezet en moet een agressieve therapie voor anafylactoïde reacties worden gestart. Symptomen zijn in deze situaties niet verlicht door antihistaminica. Bij deze patiënten moet het gebruik van een ander type dialysemembraan of een andere klasse antihypertensiva worden overwogen. Anafylactoïde reacties zijn ook gemeld bij patiënten die lipoproteïne-aferese met lage dichtheid ondergingen met absorptie van dextraansulfaat.
Verminderde nierfunctie
Controleer de nierfunctie periodiek bij patiënten die met PRINIVIL worden behandeld. Veranderingen in de nierfunctie, waaronder acuut nierfalen, kunnen worden veroorzaakt door geneesmiddelen die het renine-angiotensinesysteem remmen. Patiënten bij wie de nierfunctie gedeeltelijk kan afhangen van de activiteit van het renine-angiotensinesysteem (bijv. patiënten met nierarteriestenose, chronische nierziekte, ernstig congestief hartfalen, post-myocardinfarct of volumedepletie) kunnen een bijzonder risico lopen om acuut nierfalen op PRINIVIL. Overweeg om de behandeling te staken of stop te zetten bij patiënten die een klinisch significante afname van de nierfunctie ontwikkelen op PRINIVIL [zie: ONGEWENSTE REACTIES en DRUG-INTERACTIES ].
Hypotensie
PRINIVIL kan symptomatische hypotensie veroorzaken, soms gecompliceerd door oligurie, progressieve azotemie, acuut nierfalen of overlijden. Patiënten met een risico op overmatige hypotensie zijn onder meer patiënten met de volgende aandoeningen of kenmerken: hartfalen met een systolische bloeddruk lager dan 100 mmHg, ischemische hartziekte, cerebrovasculaire ziekte, hyponatriëmie, hoge dosis diuretica, nierdialyse of ernstige volume- en/of zoutdepletie van welke etiologie dan ook.
Start bij deze patiënten met PRINIVIL onder medisch toezicht en volg dergelijke patiënten gedurende de eerste twee weken van de behandeling en telkens wanneer de dosis PRINIVIL en/of diureticum wordt verhoogd. Vermijd het gebruik van PRINIVIL 2,5 mg bij patiënten die hemodynamisch instabiel zijn na een acuut MI.
Symptomatische hypotensie is ook mogelijk bij patiënten met ernstige aortastenose of hypertrofische cardiomyopathie.
Chirurgie/anesthesie
Bij patiënten die een grote operatie ondergaan of tijdens anesthesie met middelen die hypotensie veroorzaken, kan PRINIVIL de vorming van angiotensine II, secundair aan compenserende renineafgifte, blokkeren. Als hypotensie optreedt en wordt geacht het gevolg te zijn van dit mechanisme, kan dit worden gecorrigeerd door volume-expansie.
Hyperkaliëmie
Controleer regelmatig serumkalium bij patiënten die PRINIVIL krijgen. Geneesmiddelen die het renine-angiotensinesysteem remmen, kunnen hyperkaliëmie veroorzaken. Risicofactoren voor de ontwikkeling van hyperkaliëmie zijn onder meer nierinsufficiëntie, diabetes mellitus en het gelijktijdig gebruik van kaliumsparende diuretica, kaliumsupplementen, kaliumbevattende zoutvervangers of andere geneesmiddelen die het serumkalium kunnen verhogen (zie DRUG-INTERACTIES ].
Leverfalen
ACE-remmers zijn in verband gebracht met een syndroom dat begint met cholestatische geelzucht of hepatitis en zich ontwikkelt tot fulminante levernecrose en soms tot de dood. Het mechanisme van dit syndroom wordt niet begrepen. Patiënten die ACE-remmers krijgen en die geelzucht of duidelijke verhogingen van leverenzymen ontwikkelen, moeten stoppen met de ACE-remmer en een passende medische behandeling krijgen.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er was geen bewijs van een tumorverwekkend effect wanneer lisinopril gedurende 105 weken werd toegediend aan mannelijke en vrouwelijke ratten in doses tot 90 mg per kg per dag of gedurende 92 weken aan mannelijke en vrouwelijke muizen in doses tot 135 mg per kg per dag. Deze doses zijn respectievelijk 10 keer en 7 keer de MRHDD wanneer ze worden vergeleken op basis van het lichaamsoppervlak.
Lisinopril was niet mutageen in de Ames microbiële mutagene test met of zonder metabolische activering. Het was ook negatief in een voorwaartse mutatietest met longcellen van Chinese hamsters. Lisinopril veroorzaakte geen enkelstrengs DNA-breuken in een in vitro rattenhepatocytentest met alkalische elutie. Bovendien veroorzaakte lisinopril geen toename van chromosomale afwijkingen in een in vitro test in ovariumcellen van Chinese hamsters of in een in vivo onderzoek in beenmerg van muizen.
Er waren geen nadelige effecten op de reproductieprestaties bij mannelijke en vrouwelijke ratten die werden behandeld met maximaal 300 mg/kg/dag lisinopril (33 keer de MRHDD vergeleken met het lichaamsoppervlak).
Studies bij ratten geven aan dat lisinopril de bloed-hersenbarrière slecht passeert. Meerdere doses lisinopril bij ratten leiden niet tot accumulatie in weefsels. Melk van zogende ratten bevat radioactiviteit na toediening van 14C-lisinopril. Door autoradiografie van het hele lichaam werd radioactiviteit gevonden in de placenta na toediening van gelabeld geneesmiddel aan zwangere ratten, maar er werd geen radioactiviteit gevonden bij de foetussen.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
PRINIVIL kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met PRINIVIL 5 mg.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en complicaties bij de bevalling (bijvoorbeeld een keizersnede en postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Oligohydramnion bij zwangere vrouwen die geneesmiddelen gebruiken die het renine-angiotensinesysteem in het tweede en derde trimester van de zwangerschap beïnvloeden, kan het volgende tot gevolg hebben: verminderde foetale nierfunctie leidend tot anurie en nierfalen, foetale longhypoplasie en skeletdeformaties, waaronder schedelhypoplasie, hypotensie , en de dood. In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikte alternatieve therapie is voor geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus.
Voer bij patiënten die PRINIVIL gebruiken tijdens de zwangerschap seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Foetale testen kunnen geschikt zijn, op basis van de week van de zwangerschap. Als oligohydramnion wordt waargenomen, stop dan met PRINIVIL 10 mg, tenzij dit als levensreddend voor de moeder wordt beschouwd. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen.
Observeer nauwkeurig zuigelingen met een geschiedenis van in utero blootstelling aan PRINIVIL voor hypotensie, oligurie en hyperkaliëmie. Bij pasgeborenen met een voorgeschiedenis van in utero blootstelling aan PRINIVIL, als oligurie of hypotensie optreedt, moet de bloeddruk en nierperfusie worden ondersteund. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen.
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens beschikbaar over de aanwezigheid van lisinopril in moedermelk of de effecten van lisinopril op de zuigeling die borstvoeding krijgt of op de melkproductie. Lisinopril is aanwezig in rattenmelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk en vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen door ACE-remmers, moet de borstvoeding worden gestaakt of moet PRINIVIL worden gestaakt.
Pediatrisch gebruik
Antihypertensieve effecten en veiligheid van PRINIVIL zijn vastgesteld bij pediatrische patiënten van 6 tot 16 jaar [zie: DOSERING EN ADMINISTRATIE en Klinische studies ]. Er werden geen relevante verschillen vastgesteld tussen het bijwerkingenprofiel voor pediatrische patiënten en volwassen patiënten.
De veiligheid en werkzaamheid van PRINIVIL zijn niet vastgesteld bij pediatrische patiënten jonger dan 6 jaar of bij pediatrische patiënten met een glomerulaire filtratiesnelheid KLINISCHE FARMACOLOGIE en Klinische studies ].
Geriatrisch gebruik
Bij oudere patiënten is geen dosisaanpassing met PRINIVIL 2,5 mg nodig. In een klinisch onderzoek met PRINIVIL 10 mg bij patiënten met een myocardinfarct (GISSI-3-onderzoek) waren 4.413 (47%) 65 jaar en ouder, terwijl 1.656 (18%) 75 jaar en ouder. In deze studie stopte 4,8% van de patiënten van 75 jaar en ouder met de behandeling met PRINIVIL 5 mg vanwege nierdisfunctie versus 1,3% van de patiënten jonger dan 75 jaar. Er werden geen andere verschillen in veiligheid of werkzaamheid waargenomen tussen oudere en jongere patiënten, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Ras
ACE-remmers, waaronder PRINIVIL, hebben een effect op de bloeddruk dat bij negroïde patiënten minder is dan bij niet-negroïde patiënten.
Nierfunctiestoornis
Dosisaanpassing van PRINIVIL is vereist bij patiënten die hemodialyse ondergaan of bij wie de creatinineklaring ≤30 ml/min is. Er is geen dosisaanpassing van PRINIVIL 5 mg nodig bij patiënten met een creatinineklaring >30 ml/min [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Na een enkelvoudige orale dosis van 20 g/kg trad geen letaliteit op bij ratten en de dood trad op bij een van de 20 muizen die dezelfde dosis kregen. De meest waarschijnlijke manifestatie van overdosering zou hypotensie zijn, waarvoor de gebruikelijke behandeling een intraveneuze infusie van een normale zoutoplossing zou zijn.
Lisinopril kan worden verwijderd door hemodialyse [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CONTRA-INDICATIES
PRINIVIL 10 mg is gecontra-indiceerd bij patiënten met:
- een voorgeschiedenis van angio-oedeem of overgevoeligheid gerelateerd aan eerdere behandeling met een angiotensineconverterende enzymremmer
- erfelijk of idiopathisch angio-oedeem.
Dien aliskiren niet gelijktijdig toe met PRINIVIL 5 mg bij patiënten met diabetes [zie: DRUG-INTERACTIES ]. PRINIVIL is gecontra-indiceerd in combinatie met een neprilysineremmer (bijv. sacubitril). Dien PRINIVIL 2,5 mg niet toe binnen 36 uur na overschakeling op of van sacubitril/valsartan, een product dat een neprilysineremmer bevat (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Lisinopril remt het angiotensineconverterend enzym (ACE) bij mensen en dieren. ACE is een peptidyldipeptidase dat de omzetting van angiotensine I in de vaatvernauwende stof, angiotensine II, katalyseert. Angiotensine II stimuleert ook de aldosteronsecretie door de bijnierschors. De gunstige effecten van lisinopril bij hypertensie en hartfalen lijken voornamelijk het gevolg te zijn van onderdrukking van het renine-angiotensinaldosteronsysteem. Remming van ACE resulteert in verlaagd plasma-angiotensine II, wat leidt tot verminderde vasopressoractiviteit en tot verminderde aldosteronsecretie. Deze laatste verlaging kan resulteren in een kleine verhoging van het serumkalium. Bij hypertensieve patiënten met een normale nierfunctie die tot 24 weken met alleen PRINIVIL 10 mg werden behandeld, was de gemiddelde toename van het serumkalium ongeveer 0,1 mEq/L; ongeveer 15% van de patiënten had echter een toename van meer dan 0,5 mEq/L en ongeveer 6% had een afname van meer dan 0,5 mEq/L. In dezelfde studie hadden patiënten die tot 24 weken met PRINIVIL 2,5 mg en hydrochloorthiazide werden behandeld, een gemiddelde verlaging van het serumkalium van 0,1 mEq/l; ongeveer 4% van de patiënten had een toename van meer dan 0,5 mEq/L en ongeveer 12% had een afname van meer dan 0,5 mEq/L [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verwijdering van de negatieve feedback van angiotensine II op de reninesecretie leidt tot verhoogde plasmarenine-activiteit.
ACE is identiek aan kininase, een enzym dat bradykinine afbreekt. Of verhoogde niveaus van bradykinine, een krachtig vasodepressor-peptide, een rol spelen bij de therapeutische effecten van PRINIVIL 5 mg moet nog worden opgehelderd.
Hoewel aangenomen wordt dat het mechanisme waardoor PRINIVIL 2,5 mg de bloeddruk verlaagt voornamelijk de onderdrukking van het renine-angiotensine-aldosteronsysteem is, is PRINIVIL antihypertensief, zelfs bij patiënten met lage-reninehypertensie. Hoewel PRINIVIL 10 mg antihypertensief was in alle onderzochte rassen, hadden negroïde hypertensieve patiënten (meestal een populatie met lage reninehypertensie) een kleinere gemiddelde respons op monotherapie dan niet-negrijnse patiënten.
Gelijktijdige toediening van PRINIVIL 5 mg en hydrochloorthiazide verlaagde de bloeddruk verder bij negroïde en niet-negrijnse patiënten en enig raciale verschil in bloeddrukrespons was niet langer duidelijk.
farmacodynamiek
Hypertensie
Volwassen patiënten
Toediening van PRINIVIL aan patiënten met hypertensie resulteert in een verlaging van de bloeddruk in liggende en staande houding in ongeveer dezelfde mate zonder compenserende tachycardie. Symptomatische orthostatische hypotensie wordt meestal niet waargenomen, hoewel het kan voorkomen en verwacht moet worden bij patiënten met volume- en/of zoutdepletie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Wanneer ze samen met diuretica van het type thiazide worden gegeven, zijn de bloeddrukverlagende effecten van de twee geneesmiddelen ongeveer additief.
Bij de meeste onderzochte patiënten werd het begin van antihypertensieve activiteit gezien één uur na orale toediening van een individuele dosis PRINIVIL, met een piekverlaging van de bloeddruk na 6 uur. Hoewel een antihypertensief effect 24 uur na toediening van de aanbevolen enkelvoudige dagelijkse doses werd waargenomen, was het effect consistenter en was het gemiddelde effect in sommige onderzoeken aanzienlijk groter bij doses van 20 mg of meer dan bij lagere doses. Bij alle onderzochte doses was het gemiddelde antihypertensieve effect 24 uur na toediening echter aanzienlijk kleiner dan 6 uur na toediening.
De antihypertensieve effecten van PRINIVIL blijven behouden tijdens langdurige therapie. Plotseling staken van PRINIVIL 10 mg is niet in verband gebracht met een snelle stijging van de bloeddruk of een significante stijging van de bloeddruk in vergelijking met het niveau van voor de behandeling.
Farmacokinetiek
Volwassen patiënten
Na orale toediening van PRINIVIL treden piekserumconcentraties van lisinopril op binnen ongeveer 7 uur, hoewel er een trend was naar een kleine vertraging in de tijd die nodig was om piekserumconcentraties te bereiken bij patiënten met een acuut myocardinfarct. Dalende serumconcentraties vertonen een verlengde terminale fase die niet bijdraagt aan de accumulatie van het geneesmiddel. Deze terminale fase vertegenwoordigt waarschijnlijk een verzadigbare binding aan ACE en is niet evenredig met de dosis. Na meervoudige dosering vertoont lisinopril een effectieve halfwaardetijd van 12 uur.
Lisinopril lijkt niet gebonden te zijn aan andere serumeiwitten. Lisinopril wordt niet gemetaboliseerd en wordt onveranderd in de urine uitgescheiden. Op basis van urinaire recuperatie is de gemiddelde mate van absorptie van lisinopril ongeveer 25 procent, met een grote interindividuele variabiliteit (6-60 procent) bij alle geteste doses (5-80 mg). De absorptie van lisinopril wordt niet beïnvloed door de aanwezigheid van voedsel in het maagdarmkanaal. De absolute biologische beschikbaarheid van lisinopril is verminderd tot ongeveer 16 procent bij patiënten met stabiel NYHA klasse II-IV congestief hartfalen, en het distributievolume lijkt iets kleiner te zijn dan dat bij normale proefpersonen.
De orale biologische beschikbaarheid van lisinopril bij patiënten met een acuut myocardinfarct is vergelijkbaar met die bij gezonde vrijwilligers.
Een gestoorde nierfunctie vermindert de eliminatie van lisinopril, dat voornamelijk via de nieren wordt uitgescheiden, maar deze afname wordt alleen klinisch belangrijk wanneer de glomerulaire filtratiesnelheid lager is dan 30 ml/min. Boven deze glomerulaire filtratiesnelheid is de eliminatiehalfwaardetijd weinig veranderd. Bij een grotere stoornis nemen de piek- en dalspiegels van lisinopril echter toe, neemt de tijd tot de piekconcentratie toe en wordt de tijd om steady-state te bereiken verlengd. Oudere patiënten hebben gemiddeld (ongeveer verdubbeld) hogere bloedspiegels en oppervlakte onder de plasmaconcentratie-tijdcurve (AUC) dan jongere patiënten [zie DOSERING EN ADMINISTRATIE ]. Lisinopril kan worden verwijderd door hemodialyse.
Studies bij ratten geven aan dat lisinopril de bloed-hersenbarrière slecht passeert. Meerdere doses lisinopril bij ratten leiden niet tot accumulatie in weefsels. Melk van zogende ratten bevat radioactiviteit na toediening van 14C-lisinopril. Door autoradiografie van het hele lichaam werd radioactiviteit gevonden in de placenta na toediening van gelabeld geneesmiddel aan zwangere ratten, maar er werd geen radioactiviteit gevonden bij de foetussen.
Pediatrische patiënten
De farmacokinetiek van lisinopril is onderzocht bij 29 pediatrische hypertensieve patiënten tussen 6 jaar en 16 jaar met een glomerulaire filtratiesnelheid >30 ml/min/1,73 m². Na doses van 0,1 tot 0,2 mg/kg traden binnen 6 uur de steady-state piekplasmaconcentraties van lisinopril op en de mate van absorptie op basis van urinaire recuperatie was ongeveer 28%. Deze waarden zijn vergelijkbaar met de waarden die eerder bij volwassenen werden verkregen. De typische waarde van de orale klaring van lisinopril (systemische klaring/absolute biologische beschikbaarheid) bij een kind dat 30 kg weegt, is 10 l/u, wat evenredig toeneemt met de nierfunctie.
Klinische studies
Hypertensie
Volwassen patiënten
Bij 438 patiënten met lichte tot matige hypertensie die geen diureticum kregen, werden twee dosis-responsonderzoeken uitgevoerd met een eenmaal daags regime. De bloeddruk werd 24 uur na dosering gemeten. Bij sommige patiënten werd een antihypertensief effect van PRINIVIL gezien met 5 mg. In beide onderzoeken trad de bloeddrukverlaging echter eerder op en was deze groter bij patiënten die werden behandeld met 10, 20 of 80 mg PRINIVIL. In gecontroleerde klinische onderzoeken bij patiënten met lichte tot matige hypertensie is PRINIVIL 20-80 mg vergeleken met hydrochloorthiazide 12,5-50 mg en met atenolol 50-500 mg, en bij patiënten met matige tot ernstige hypertensie met metoprolol 100-200 mg. Het was superieur aan hydrochloorthiazide wat betreft effecten op de systolische en diastolische bloeddruk in een populatie die voor 75% blank was. PRINIVIL 10 mg was ongeveer gelijk aan atenolol en metoprolol wat betreft effecten op de diastolische bloeddruk en had iets grotere effecten op de systolische bloeddruk.
PRINIVIL had vergelijkbare effectiviteit en bijwerkingen bij jongere en oudere (>65 jaar) patiënten. Het was minder effectief bij zwarten dan bij blanken.
In hemodynamische onderzoeken met PRINIVIL 5 mg bij patiënten met essentiële hypertensie, ging bloeddrukverlaging gepaard met een verlaging van de perifere arteriële weerstand met weinig of geen verandering in het hartminuutvolume en in de hartslag. In een onderzoek bij negen hypertensieve patiënten was er na toediening van PRINIVIL 5 mg een toename van de gemiddelde nierbloedstroom die niet significant was. Gegevens uit verschillende kleine onderzoeken zijn inconsistent met betrekking tot het effect van lisinopril op de glomerulaire filtratiesnelheid bij hypertensieve patiënten met een normale nierfunctie, maar suggereren dat eventuele veranderingen niet groot zijn.
Bij patiënten met renovasculaire hypertensie is aangetoond dat PRINIVIL goed wordt verdragen en effectief is bij het verlagen van de bloeddruk [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pediatrische patiënten
In een klinisch onderzoek onder 115 hypertensieve pediatrische patiënten van 6 tot 16 jaar kregen patiënten die 1,25 mg (0,02 mg/kg). Dit effect werd bevestigd in een ontwenningsfase, waar de diastolische druk met ongeveer 9 mmHg meer steeg bij patiënten die waren gerandomiseerd naar placebo dan bij patiënten die waren gerandomiseerd om de middelste en hoge doses lisinopril te blijven gebruiken. Het dosisafhankelijke antihypertensieve effect van lisinopril was consistent in verschillende demografische subgroepen: leeftijd, Tanner-stadium, geslacht en ras. In deze studie werd lisinopril over het algemeen goed verdragen.
In de bovengenoemde pediatrische onderzoeken werd lisinopril gegeven als tabletten of in een suspensie voor kinderen en zuigelingen die niet in staat waren om tabletten door te slikken of die een lagere dosis nodig hadden dan beschikbaar is in tabletvorm [zie DOSERING EN ADMINISTRATIE ].
Hartfalen
In twee placebogecontroleerde klinische onderzoeken van 12 weken werd de toevoeging van PRINIVIL 2,5 mg tot 20 mg per dag vergeleken met alleen digitalis en diuretica. De combinatie van PRINIVIL, digitalis en diuretica verminderde de volgende tekenen en symptomen van hartfalen: oedeem, ralles, paroxismale nachtelijke dyspneu en jugularis veneuze distensie. In een van de onderzoeken verminderde de combinatie van PRINIVIL 2,5 mg, digitalis en diuretica orthopneu, de aanwezigheid van een derde hartgeluid en het aantal patiënten geclassificeerd als NYHA-klasse III en IV, en verbeterde de inspanningstolerantie. Een groot (meer dan 3000 patiënten) overlevingsonderzoek, het ATLAS-onderzoek, waarin 2,5 en 35 mg lisinopril werden vergeleken bij patiënten met systolisch hartfalen, toonde aan dat de hogere dosis lisinopril een minstens zo gunstig resultaat had als de lagere dosis. Tijdens baseline-gecontroleerde klinische onderzoeken bij patiënten die digitalis en diuretica kregen, resulteerden enkelvoudige doses PRINIVIL 5 mg in verlagingen van de pulmonale capillaire wiggedruk, systemische vasculaire weerstand en bloeddruk, vergezeld van een toename van het hartminuutvolume en geen verandering in de hartslag.
Acuut myocardinfarct
De studie van Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) was een multicenter, gecontroleerd, gerandomiseerd, niet-geblindeerd klinisch onderzoek dat werd uitgevoerd bij 19.394 patiënten met een acuut myocardinfarct (MI) die waren opgenomen op een coronaire zorgafdeling. Het werd ontworpen om de effecten te onderzoeken van kortdurende (6 weken) behandeling met lisinopril, nitraten, hun combinatie, of geen therapie op de korte termijn (6 weken) mortaliteit en op langdurig overlijden en een duidelijk verminderde hartfunctie. Hemodynamisch stabiele patiënten die zich binnen 24 uur na het begin van de symptomen presenteerden, werden gerandomiseerd, in een 2 x 2 factoriële opzet, naar 6 weken van ofwel 1) alleen PRINIVIL (n=4841), 2) alleen nitraten (n=4869), 3 ) PRINIVIL 2,5 mg plus nitraten (n=4841), of 4) open controle (n=4843). Alle patiënten kregen routinematige therapieën, waaronder trombolytica (72%), aspirine (84%) en een bètablokker (31%), indien van toepassing, die normaal wordt gebruikt bij patiënten met een acuut myocardinfarct (MI).
Het protocol sloot patiënten uit met hypotensie (systolische bloeddruk ≤100 mmHg), ernstig hartfalen, cardiogene shock en nierdisfunctie (serumcreatinine >2 mg/dl en/of proteïnurie >500 mg per 24 uur). Patiënten gerandomiseerd naar PRINIVIL 5 mg kregen 5 mg binnen 24 uur na het begin van de symptomen, 5 mg na 24 uur en daarna 10 mg per dag. Patiënten met een systolische bloeddruk van minder dan 120 mmHg bij aanvang kregen 2,5 mg PRINIVIL. Als hypotensie optrad, werd de dosis PRINIVIL 10 mg verlaagd of als ernstige hypotensie optrad, werd PRINIVIL stopgezet [zie DOSERING EN ADMINISTRATIE ].
De primaire uitkomsten van het onderzoek waren de totale mortaliteit na 6 weken en een gecombineerd eindpunt 6 maanden na het myocardinfarct, bestaande uit het aantal patiënten dat stierf, laat (dag 4) klinisch congestief hartfalen had of uitgebreide linkerventrikel had. schade gedefinieerd als ejectiefractie ≤35%, of een akinetisch-dyskinetische [AD] score ≥45%. Patiënten die PRINIVIL kregen (n=9646), alleen of met nitraten, hadden een 11% lager risico op overlijden (p=0,04) vergeleken met patiënten die geen PRINIVIL kregen (n=9672) (respectievelijk 6,4% vs. 7,2%) op 6 weken. Hoewel patiënten die gerandomiseerd waren om PRINIVIL gedurende maximaal 6 weken te krijgen, het ook numeriek beter deden op het gecombineerde eindpunt na 6 maanden, was het open karakter van de beoordeling van hartfalen, aanzienlijk verlies voor follow-up-echocardiografie en aanzienlijk overmatig gebruik van PRINIVIL 10 mg tussen 6 weken en 6 maanden in de groep gerandomiseerd naar 6 weken lisinopril, sluiten elke conclusie over dit eindpunt uit.
Patiënten met een acuut myocardinfarct, behandeld met PRINIVIL 10 mg, hadden een hogere incidentie (9,0% versus 3,7%) van aanhoudende hypotensie (systolische bloeddruk ONGEWENSTE REACTIES ].
PATIËNT INFORMATIE
OPMERKING: Deze informatie is bedoeld om te helpen bij het veilige en effectieve gebruik van dit medicijn. Het is geen onthulling van alle mogelijke nadelige of beoogde effecten.
Zwangerschap
Vertel vrouwelijke patiënten in de vruchtbare leeftijd over de gevolgen van blootstelling aan PRINIVIL 10 mg tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Vertel patiënten om zwangerschappen zo snel mogelijk aan hun arts te melden.
Angio-oedeem
Angio-oedeem, inclusief larynxoedeem, kan op elk moment optreden tijdens de behandeling met angiotensineconverterende enzymremmers, waaronder PRINIVIL. Vertel patiënten dat ze onmiddellijk alle tekenen of symptomen die op angio-oedeem wijzen (zwelling van gezicht, ledematen, ogen, lippen, tong, moeite met slikken of ademen) moeten melden en dat ze geen geneesmiddelen meer moeten innemen totdat ze de voorschrijvende arts hebben geraadpleegd.
Symptomatische hypotensie
Vertel patiënten dat ze een licht gevoel in het hoofd moeten melden, vooral tijdens de eerste paar dagen van de behandeling. Als er daadwerkelijke syncope optreedt, vertel de patiënt dan om het medicijn te staken totdat ze de voorschrijvende arts hebben geraadpleegd.
Vertel patiënten dat overmatige transpiratie en uitdroging kunnen leiden tot een overmatige bloeddrukdaling vanwege een verminderd vochtvolume. Andere oorzaken van volumedepletie, zoals braken of diarree, kunnen ook leiden tot een daling van de bloeddruk; patiënten dienovereenkomstig adviseren.
Hyperkaliëmie
Vertel patiënten om geen zoutvervangers te gebruiken die kalium bevatten zonder hun arts te raadplegen.
Hypoglykemie
Vertel diabetespatiënten die worden behandeld met orale antidiabetica of insuline die een ACE-remmer starten, om nauwlettend te controleren op hypoglykemie, vooral tijdens de eerste maand van gecombineerd gebruik [zie DRUG-INTERACTIES ].
Leukopenie/neutropenie
Vertel patiënten dat ze elke indicatie van een infectie (bijv. keelpijn, koorts) onmiddellijk moeten melden, wat een teken kan zijn van leukopenie/neutropenie.
