Avapro 150mg, 300mg Irbesartan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Avapro 300 mg en hoe wordt het gebruikt?
Avapro 300 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van hoge bloeddruk (hypertensie), zenuwpijn veroorzaakt door diabetes type 2. Avapro kan alleen of in combinatie met andere medicijnen worden gebruikt.
Avapro 300 mg behoort tot een klasse van geneesmiddelen ARB's.
Het is niet bekend of Avapro 150 mg veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Avapro 300 mg?
Avapro kan ernstige bijwerkingen veroorzaken, waaronder:
- onverklaarbare spierpijn,
- tederheid of zwakte,
- koorts,
- ongebruikelijke vermoeidheid,
- donker gekleurde urine,
- duizeligheid,
- weinig of geen plassen,
- zwelling,
- snelle gewichtstoename,
- verwardheid,
- verlies van eetlust,
- braken, en
- pijn in uw zij of onderrug
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Avapro zijn:
- diarree,
- maagzuur,
- maagklachten, en
- vermoeid gevoel
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Avapro. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met AVAPRO.
- Geneesmiddelen die direct op de renine-angiotens in het systeem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
AVAPRO (irbesartan) is een angiotensine II-receptor (AT1-subtype) antagonist.
Irbesartan is een niet-peptideverbinding, chemisch beschreven als een 2-butyl-3-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]-1,3-diazaspiro[4.4]non-1-en-4 -een.
De empirische formule is C25H28N6O en de structuurformule:
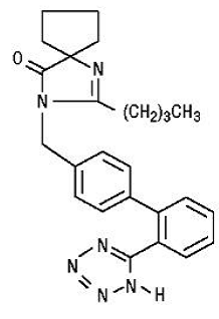
Irbesartan is een wit tot gebroken wit kristallijn poeder met een molecuulgewicht van 428,5. Het is een niet-polaire verbinding met een verdelingscoëfficiënt (octanol/water) van 10,1 bij een pH van 7,4. Irbesartan is slecht oplosbaar in alcohol en methyleenchloride en praktisch onoplosbaar in water.
AVAPRO is beschikbaar voor orale toediening in tabletten zonder breuklijn die 75 mg, 150 mg of 300 mg irbesartan bevatten. Inactieve ingrediënten zijn onder meer: lactose, microkristallijne cellulose, gepregelatiniseerd zetmeel, croscarmellosenatrium, poloxameer 188, siliciumdioxide en magnesiumstearaat.
INDICATIES
Hypertensie
AVAPRO® is geïndiceerd voor de behandeling van hypertensie, om de bloeddruk te verlagen. Het verlagen van de bloeddruk verlaagt het risico op fatale en niet-fatale cardiovasculaire (CV) gebeurtenissen, voornamelijk beroertes en myocardinfarct. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een groot aantal verschillende farmacologische klassen, waaronder dit medicijn.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan 1 medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van de Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie.
AVAPRO 300 mg kan alleen of in combinatie met andere antihypertensiva worden gebruikt.
Nefropathie bij type 2 diabetespatiënten
AVAPRO is geïndiceerd voor de behandeling van diabetische nefropathie bij patiënten met type 2 diabetes en hypertensie, een verhoogd serumcreatinine en proteïnurie (>300 mg/dag). In deze populatie vermindert AVAPRO de snelheid van progressie van nefropathie zoals gemeten door het optreden van verdubbeling van serumcreatinine of terminale nierziekte (noodzaak van dialyse of niertransplantatie) [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Algemene Overwegingen
AVAPRO kan worden toegediend met andere antihypertensiva en met of zonder voedsel.
Hypertensie
De aanbevolen startdosering van AVAPRO 300 mg is 150 mg eenmaal daags. De dosering kan naar behoefte worden verhoogd tot een maximale dosis van 300 mg eenmaal daags om de bloeddruk onder controle te houden [zie: Klinische studies ].
Nefropathie bij type 2 diabetespatiënten
De aanbevolen dosering is eenmaal daags 300 mg [zie Klinische studies ].
Dosisaanpassing bij patiënten met volume- en zoutarm
De aanbevolen aanvangsdosis is 75 mg eenmaal daags bij patiënten met depletie van intravasculair volume of zout (bijv. patiënten die krachtig worden behandeld met diuretica of hemodialyse ondergaan) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
AVAPRO 75 mg is een witte tot gebroken witte, biconvexe ovale, filmomhulde tablet met aan de ene kant een hart en aan de andere kant “2871”.
AVAPRO 150 mg is een witte tot gebroken witte, biconvexe ovale, filmomhulde tablet met aan de ene kant een hart en aan de andere kant “2872”.
AVAPRO 300 mg is een witte tot gebroken witte, biconvexe ovale, filmomhulde tablet met aan de ene kant een hart en aan de andere kant “2873”.
Opslag en behandeling
AVAPRO (irbesartan) is verkrijgbaar als witte tot gebroken witte, biconvexe ovale, filmomhulde tabletten, met aan de ene kant een hartvorm en aan de andere kant een code (zie onderstaande tabel). Flessen voor eenmalig gebruik bevatten 30 of 90 filmomhulde tabletten als volgt:
Bewaren bij 25°C (77°F); excursies toegestaan tot 15°C-30°C (59°F-86°F) [zie USP-gecontroleerde kamertemperatuur ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, EEN SANOFI-BEDRIJF. Herzien: september 2021
BIJWERKINGEN
De volgende belangrijke bijwerkingen worden elders in de etikettering beschreven:
- Hypotensie bij patiënten met volume- of zoutverarming [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verminderde nierfunctie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen. De informatie over bijwerkingen uit klinische onderzoeken biedt echter een basis voor het identificeren van de bijwerkingen die verband lijken te houden met drugsgebruik en voor het benaderen van de percentages.
Hypertensie
AVAPRO is beoordeeld op veiligheid bij meer dan 4300 patiënten met hypertensie en in totaal ongeveer 5000 proefpersonen. Deze ervaring omvat 1303 patiënten die langer dan 6 maanden werden behandeld en 407 patiënten gedurende 1 jaar of langer.
In placebogecontroleerde klinische onderzoeken werden de volgende bijwerkingen gemeld bij ten minste 1% van de patiënten die met AVAPRO werden behandeld (n=1965) en met een hogere incidentie dan bij placebo (n=641), met uitzondering van bijwerkingen die te algemeen waren om informatief te zijn en bijwerkingen die niet redelijkerwijs verband houden met het gebruik van het geneesmiddel omdat ze verband hielden met de aandoening die wordt behandeld of die zeer vaak voorkomen bij de behandelde populatie, waaronder: diarree (3% vs. 2%), dyspepsie/brandend maagzuur (2% vs. 1%) en vermoeidheid (4% versus 3%).
Het gebruik van irbesartan ging niet gepaard met een verhoogde incidentie van droge hoest, zoals gewoonlijk wordt geassocieerd met het gebruik van ACE-remmers. In placebogecontroleerde onderzoeken was de incidentie van hoesten bij met irbesartan behandelde patiënten 2,8% versus 2,7% bij patiënten die placebo kregen.
Nefropathie bij type 2 diabetespatiënten
Hyperkaliëmie
In de Irbesartan Diabetic Nephropathy Trial (IDNT) (proteïnurie ≥900 mg/dag en serumcreatinine variërend van 1,0-3,0 mg/dl) was het percentage patiënten met kalium >6 mEq/l 18,6% in de AVAPRO 300 mg-groep versus 6,0% in de placebogroep. Stopzettingen vanwege hyperkaliëmie in de AVAPRO 150 mg-groep waren 2,1% versus 0,4% in de placebogroep.
In IDNT waren de bijwerkingen vergelijkbaar met die gezien bij patiënten met hypertensie, met uitzondering van een verhoogde incidentie van orthostatische symptomen die vaker voorkwamen in de AVAPRO 150 mg versus placebogroep: duizeligheid (10,2% versus 6,0%), orthostatische duizeligheid (5,4 % vs 2,7%) en orthostatische hypotensie (5,4% vs 3,2%).
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van AVAPRO na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of om een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
netelroos; angio-oedeem (met zwelling van het gezicht, de lippen, de keelholte en/of de tong); anafylactische reactie inclusief anafylactische shock; verhoogde leverfunctietesten; geelzucht; hepatitis; hyperkaliëmie; Bloedarmoede; trombocytopenie; verhoogde CPK; oorsuizen; en hypoglykemie bij diabetespatiënten.
DRUG-INTERACTIES
Middelen die serumkalium verhogen
Gelijktijdige toediening van AVAPRO met andere geneesmiddelen die de serumkaliumspiegels verhogen, kan leiden tot hyperkaliëmie, soms ernstig. Controleer het serumkalium bij dergelijke patiënten.
Lithium
Verhogingen van de serumlithiumconcentraties en lithiumtoxiciteit zijn gemeld bij gelijktijdig gebruik van irbesartan en lithium. Controleer de lithiumspiegels bij patiënten die irbesartan en lithium krijgen.
Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) inclusief selectieve cyclo-oxygenase-2-remmers (COX-2-remmers)
Bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, kan gelijktijdige toediening van NSAID's, inclusief selectieve COX-2-remmers, met angiotensine II-receptorantagonisten (inclusief irbesartan) leiden tot een verslechtering van de nierfunctie. , inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Controleer de nierfunctie periodiek bij patiënten die behandeld worden met irbesartan en NSAID's.
Het antihypertensieve effect van angiotensine II-receptorantagonisten, waaronder irbesartan, kan worden verzwakt door NSAID's, waaronder selectieve COX-2-remmers.
Dubbele blokkade van het renine-angiotensinesysteem (RAS)
Dubbele blokkade van het RAS met angiotensinereceptorblokkers, ACE-remmers of aliskiren wordt in verband gebracht met een verhoogd risico op hypotensie, hyperkaliëmie en veranderingen in de nierfunctie (inclusief acuut nierfalen) in vergelijking met monotherapie. De meeste patiënten die de combinatie van twee RAS-remmers krijgen, hebben geen extra voordeel ten opzichte van monotherapie. Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die AVAPRO 150 mg en andere middelen gebruiken die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met AVAPRO bij patiënten met diabetes. Vermijd het gebruik van aliskiren met AVAPRO bij patiënten met een nierfunctiestoornis (GFR
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Foetale toxiciteit
AVAPRO 150 mg kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met AVAPRO [zie Gebruik bij specifieke populaties ].
Hypotensie in volume of zoutarme patiënten
Bij patiënten met een geactiveerd renine-angiotensinesysteem, zoals patiënten met volume- of zoutdepletie (bijv. patiënten die worden behandeld met hoge doses diuretica), kan symptomatische hypotensie optreden na het starten van de behandeling met AVAPRO. Corrigeer volume- of zoutdepletie voorafgaand aan toediening van AVAPRO 300 mg of gebruik een lagere startdosering [zie DOSERING EN ADMINISTRATIE ].
Verminderde nierfunctie
Veranderingen in de nierfunctie, waaronder acuut nierfalen, kunnen worden veroorzaakt door geneesmiddelen die het renine-angiotensinesysteem remmen. Patiënten bij wie de nierfunctie gedeeltelijk kan afhangen van de activiteit van het renine-angiotensinesysteem (bijv. patiënten met nierarteriestenose, chronische nierziekte, ernstig hartfalen of volumedepletie) kunnen een bijzonder risico lopen op het ontwikkelen van acuut nierfalen of overlijden op AVAPRO. Controleer de nierfunctie periodiek bij deze patiënten. Overweeg om de behandeling te staken of stop te zetten bij patiënten die een klinisch significante afname van de nierfunctie ontwikkelen op AVAPRO [zie: DRUG-INTERACTIES ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van carcinogeniteit waargenomen wanneer irbesartan werd toegediend in doseringen tot 500/1000 mg/kg/dag (respectievelijk mannetjes/vrouwtjes) bij ratten en 1000 mg/kg/dag bij muizen gedurende maximaal 2 jaar. Voor mannelijke en vrouwelijke ratten zorgde 500 mg/kg/dag voor een gemiddelde systemische blootstelling aan irbesartan (AUC 0-24 uur, gebonden plus ongebonden) van respectievelijk ongeveer 3 en 11 keer de gemiddelde systemische blootstelling bij mensen die de maximaal aanbevolen humane dosis (MRHD) van 300 mg irbesartan/dag, terwijl 1000 mg/kg/dag (alleen toegediend aan vrouwen) een gemiddelde systemische blootstelling opleverde die ongeveer 21 keer zo hoog was als die voor mensen bij de MRHD. Voor mannelijke en vrouwelijke muizen zorgde 1000 mg/kg/dag voor een blootstelling aan irbesartan die respectievelijk ongeveer 3 en 5 keer zo hoog was als de menselijke blootstelling bij 300 mg/dag.
Irbesartan was niet mutageen in een reeks in-vitrotests (Ames-microbiële test, rattenhepatocyt-DNA-reparatietest, V79-test voor voorwaartse genmutatie van zoogdiercellen). Irbesartan was negatief in verschillende tests voor de inductie van chromosomale afwijkingen (in vitro - menselijke lymfocytentest; in vivo - micronucleusonderzoek bij muizen).
Irbesartan had geen nadelige effecten op de vruchtbaarheid of het paren van mannelijke of vrouwelijke ratten bij orale doseringen ≤650 mg/kg/dag, waarbij de hoogste dosis een systemische blootstelling aan irbesartan (AUC 0-24 uur, gebonden plus ongebonden) opleverde van ongeveer 5 keer die gevonden bij mensen die de MRHD van 300 mg/dag kregen.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
AVAPRO kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte [zie Klinische overwegingen ]. De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met AVAPRO 150 mg.
Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen, ongeacht de blootstelling aan geneesmiddelen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryofoetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en bevallingscomplicaties (bijvoorbeeld een keizersnede en postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Oligohydramnion bij zwangere vrouwen die geneesmiddelen gebruiken die het renine-angiotensinesysteem beïnvloeden in het tweede en derde trimester van de zwangerschap kan het volgende tot gevolg hebben: verminderde foetale nierfunctie leidend tot anurie en nierfalen, foetale longhypoplasie, skeletdeformaties, waaronder schedelhypoplasie, hypotensie , en de dood.
In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus.
Voer seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Afhankelijk van de week van de zwangerschap kan foetaal testen aangewezen zijn. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen. Als oligohydramnion wordt waargenomen, overweeg dan een alternatieve behandeling. Houd zuigelingen met een voorgeschiedenis van in utero blootstelling aan AVAPRO nauwlettend in de gaten voor hypotensie, oligurie en hyperkaliëmie en andere symptomen van nierinsufficiëntie. Bij pasgeborenen met een voorgeschiedenis van in utero blootstelling aan AVAPRO 300 mg, als oligurie of hypotensie optreedt, richt de aandacht dan op ondersteuning van de bloeddruk en nierperfusie. Wisseltransfusie of dialyse kan nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen.
Gegevens
Dierlijke gegevens
Irbesartan passeert de placenta bij ratten en konijnen. Bij vrouwelijke ratten die irbesartan kregen voorafgaand aan de paring door dracht en lactatie in orale doses van 50, 180 of 650 mg/kg/dag (1,6 tot 21,1 maal de maximaal aanbevolen dosis voor de mens (MRHD) op basis van lichaamsoppervlak), foetussen onderzocht op Zwangerschap Dag 20 toonde een verhoogde incidentie van hydro-ureter en nierbekkencavitatie en/of afwezigheid van nierpapil in alle met irbesartan behandelde groepen. Subcutaan oedeem trad ook op bij foetussen bij maternale doses ≥180 mg/kg/dag (5,8 maal de MRHD). Deze afwijkingen traden op wanneer vrouwelijke ratten irbesartan kregen van vóór de paring tot dag 20 van de dracht, maar werden niet waargenomen bij pups postnataal in hetzelfde onderzoek, of wanneer irbesartan alleen aan drachtige ratten werd gegeven tijdens de organogenese (Draagdag 6 tot en met Dag 15 van de dracht) op orale doses van 50 tot 450 mg/kg/dag (tot 14,6 maal de MRHD). Bovendien werden geen nadelige effecten op de ontwikkeling van de nieren waargenomen bij jongen van moederdieren die irbesartan kregen vanaf dag 15 tot en met lactatiedag 24 in doses van 50, 180 of 650 mg/kg/dag (tot 21,1 maal de MRHD). Aangenomen wordt dat de waargenomen effecten late zwangerschapseffecten van het medicijn zijn. Zwangere konijnen die orale doses irbesartan van 30 mg/kg/dag kregen (1,9 keer de MRHD op basis van het lichaamsoppervlak) ondervonden een hoge mate van moedersterfte en abortus. Overlevende vrouwtjes hadden een lichte toename van vroege resorpties en een overeenkomstige afname van levende foetussen.
Radioactiviteit was aanwezig in de foetussen van ratten en konijnen tijdens de late dracht na orale doses radioactief gelabeld irbesartan.
Borstvoeding
Er zijn geen gegevens beschikbaar over de aanwezigheid van irbesartan in moedermelk, effecten op de melkproductie of de zuigeling die borstvoeding krijgt. Irbesartan of een metaboliet van irbesartan wordt uitgescheiden in de melk van zogende ratten [zie KLINISCHE FARMACOLOGIE ]. Vanwege het potentieel voor nadelige effecten op de zuigeling, wordt het gebruik van AVAPRO 150 mg bij vrouwen die borstvoeding geven niet aanbevolen.
Pediatrisch gebruik
Irbesartan bleek in een onderzoek met een dosis tot 4,5 mg/kg/dag, eenmaal daags, de bloeddruk niet effectief te verlagen bij pediatrische patiënten in de leeftijd van 6 tot 16 jaar.
AVAPRO is niet onderzocht bij pediatrische patiënten jonger dan 6 jaar.
Geriatrisch gebruik
Van de 4925 proefpersonen die AVAPRO kregen in gecontroleerde klinische onderzoeken naar hypertensie, waren 911 (18,5%) 65 jaar en ouder, terwijl 150 (3,0%) 75 jaar en ouder waren. Er werden geen algemene verschillen in werkzaamheid of veiligheid waargenomen tussen deze proefpersonen en jongere proefpersonen, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. [Zien KLINISCHE FARMACOLOGIE en Klinische studies ]
OVERDOSERING
Er zijn geen gegevens beschikbaar met betrekking tot overdosering bij mensen. Dagelijkse doses van 900 mg gedurende 8 weken werden echter goed verdragen. De meest waarschijnlijke verschijnselen van overdosering zijn naar verwachting hypotensie en tachycardie; bradycardie kan ook optreden bij overdosering. Irbesartan wordt niet verwijderd door hemodialyse.
Acute orale toxiciteitsstudies met irbesartan bij muizen en ratten gaven aan dat acute letale doses hoger waren dan 2000 mg/kg, respectievelijk ongeveer 25- en 50-voudig de MRHD (300 mg), gebaseerd op het lichaamsoppervlak.
CONTRA-INDICATIES
AVAPRO 150 mg is gecontra-indiceerd bij patiënten die overgevoelig zijn voor een bestanddeel van dit product.
Dien aliskiren niet gelijktijdig toe met AVAPRO 300 mg bij patiënten met diabetes.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Angiotensine II is een krachtige vasoconstrictor die wordt gevormd uit angiotensine I in een reactie die wordt gekatalyseerd door het angiotensineconverterende enzym (ACE, kininase II). Angiotensine II is het primaire vasoactieve hormoon van het renine-angiotensinesysteem en een belangrijke component in de pathofysiologie van hypertensie. Het stimuleert ook de aldosteronafscheiding door de bijnierschors. Irbesartan blokkeert de vaatvernauwende en aldosteron-afscheidende effecten van angiotensine II door selectieve binding aan de AT1-angiotensine II-receptor die in veel weefsels wordt aangetroffen (bijv. vasculaire gladde spieren, bijnieren). Er is ook een AT2-receptor in veel weefsels, maar deze is niet betrokken bij cardiovasculaire homeostase.
Irbesartan is een specifieke competitieve antagonist van AT1-receptoren met een veel grotere affiniteit (meer dan 8500-voudig) voor de AT1-receptor dan voor de AT2-receptor en zonder agonistische activiteit.
Blokkade van de AT1-receptor verwijdert de negatieve feedback van angiotensine II op de renine-uitscheiding, maar de resulterende verhoogde plasma-renine-activiteit en circulerend angiotensine II doen de effecten van irbesartan op de bloeddruk niet teniet.
Irbesartan remt ACE of renine niet en heeft geen invloed op andere hormoonreceptoren of ionkanalen waarvan bekend is dat ze betrokken zijn bij de cardiovasculaire regulatie van bloeddruk en natriumhomeostase.
farmacodynamiek
Bij gezonde proefpersonen veroorzaakten enkelvoudige orale doses irbesartan tot 300 mg een dosisafhankelijke remming van het pressoreffect van angiotensine II-infusies. De remming was 4 uur na orale doses van 150 mg of 300 mg compleet (100%) en de gedeeltelijke remming hield 24 uur aan (respectievelijk 60% en 40% bij 300 mg en 150 mg).
Bij hypertensieve patiënten veroorzaakt angiotensine II-receptorremming na chronische toediening van irbesartan een 1,5- tot 2-voudige stijging van de angiotensine II-plasmaconcentratie en een 2-voudige tot 3-voudige toename van de plasmareninespiegels. De plasmaconcentraties van aldosteron nemen over het algemeen af na toediening van irbesartan, maar de serumkaliumspiegels worden niet significant beïnvloed bij de aanbevolen doses.
Bij hypertensieve patiënten hadden chronische orale doses irbesartan (tot 300 mg) geen effect op de glomerulaire filtratiesnelheid, renale plasmastroom of filtratiefractie. In onderzoeken met meerdere doses bij hypertensieve patiënten waren er geen klinisch belangrijke effecten op nuchtere triglyceriden, totaal cholesterol of HDL-cholesterolconcentraties. Er was geen effect op serumurinezuur tijdens chronische orale toediening en geen uricosurisch effect.
Farmacokinetiek
Absorptie
De orale absorptie van irbesartan is snel en volledig met een gemiddelde absolute biologische beschikbaarheid van 60% tot 80%. Na orale toediening van AVAPRO worden de piekplasmaconcentraties van irbesartan 1,5 tot 2 uur na toediening bereikt. Voedsel heeft geen invloed op de biologische beschikbaarheid van irbesartan.
Irbesartan vertoont lineaire farmacokinetiek over het therapeutische dosisbereik.
Verdeling
Irbesartan is voor 90% gebonden aan serumeiwitten (voornamelijk albumine en α-zuurglycoproteïne) met een verwaarloosbare binding aan cellulaire componenten van bloed. Het gemiddelde distributievolume is 53 tot 93 liter.
Uit dieronderzoek blijkt dat radioactief gelabeld irbesartan zwak de bloed-hersenbarrière en placenta passeert. Irbesartan wordt uitgescheiden in de melk van zogende ratten.
Eliminatie
De totale plasma- en renale klaringen liggen in het bereik van respectievelijk 157 tot 176 ml/min en 3,0 tot 3,5 ml/min. De terminale eliminatiehalfwaardetijd van irbesartan is gemiddeld 11 tot 15 uur. Steady-state concentraties worden binnen 3 dagen bereikt. Beperkte accumulatie van irbesartan (
Metabolisme
Irbesartan is een oraal actief middel dat geen biotransformatie in een actieve vorm vereist. Irbesartan wordt gemetaboliseerd via glucuronideconjugatie en oxidatie. Na orale of intraveneuze toediening van Clabeled irbesartan is meer dan 80% van de circulerende plasmaradioactiviteit toe te schrijven aan onveranderd irbesartan. De primaire circulerende metaboliet is het inactieve irbesartanglucuronideconjugaat (ongeveer 6%). De overige oxidatieve metabolieten dragen niet noemenswaardig bij aan de farmacologische activiteit van irbesartan.
In vitro-onderzoeken geven aan dat irbesartan voornamelijk wordt geoxideerd door CYP2C9; metabolisme door CYP3A4 is verwaarloosbaar.
uitscheiding
Irbesartan en zijn metabolieten worden zowel via de gal als via de nieren uitgescheiden. Na orale of intraveneuze toediening van 14C-gelabeld irbesartan wordt ongeveer 20% van de radioactiviteit teruggevonden in de urine en de rest in de feces, als irbesartan of irbesartanglucuronide.
Specifieke populaties
Seks
Er zijn geen seksegerelateerde verschillen in farmacokinetiek waargenomen bij gezonde ouderen (65-80 jaar) of bij gezonde jonge proefpersonen (18-40 jaar). In onderzoeken met hypertensieve patiënten is er geen sekseverschil in halfwaardetijd of accumulatie, maar bij vrouwen zijn iets hogere plasmaconcentraties van irbesartan waargenomen (11% - 44%). Er is geen geslachtsgerelateerde dosisaanpassing nodig.
Geriatrie
Bij oudere proefpersonen (leeftijd 65-80 jaar) is de eliminatiehalfwaardetijd van irbesartan niet significant veranderd, maar de AUC- en Cmax-waarden zijn ongeveer 20% tot 50% hoger dan die van jonge proefpersonen (18-40 jaar). Bij ouderen is geen dosisaanpassing nodig.
Ras/etniciteit
Bij gezonde zwarte proefpersonen zijn de AUC-waarden van irbesartan ongeveer 25% hoger dan bij blanken; er is geen verschil in Cmax-waarden.
Nierfunctiestoornis
De farmacokinetiek van irbesartan verandert niet bij patiënten met nierinsufficiëntie of bij patiënten die hemodialyse ondergaan. Irbesartan wordt niet verwijderd door hemodialyse. Er is geen dosisaanpassing nodig bij patiënten met een lichte tot ernstige nierfunctiestoornis, tenzij een patiënt met een nierfunctiestoornis ook een volumedepletie heeft [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DOSERING EN ADMINISTRATIE ].
Leverinsufficiëntie
De farmacokinetiek van irbesartan na herhaalde orale toediening wordt niet significant beïnvloed bij patiënten met lichte tot matige levercirrose. Bij patiënten met leverinsufficiëntie is geen dosisaanpassing nodig.
Geneesmiddel-geneesmiddelinteracties
In vitro-onderzoeken laten een significante remming zien van de vorming van geoxideerde irbesartanmetabolieten met de bekende cytochroom CYP2C9-substraten/remmers sulfenazol, tolbutamide en nifedipine. In klinische onderzoeken waren de gevolgen van gelijktijdig gebruik van irbesartan op de farmacodynamiek van warfarine echter verwaarloosbaar. Op basis van in-vitrogegevens is geen interactie te verwachten met geneesmiddelen waarvan het metabolisme afhankelijk is van de cytochroom P450-iso-enzymen 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 of 3A4.
In afzonderlijke onderzoeken bij patiënten die onderhoudsdoses warfarine, hydrochloorthiazide of digoxine kregen, had toediening van irbesartan gedurende 7 dagen geen effect op de farmacodynamiek van warfarine (protrombinetijd) of de farmacokinetiek van digoxine. De farmacokinetiek van irbesartan wordt niet beïnvloed door gelijktijdige toediening van nifedipine of hydrochloorthiazide.
Klinische studies
Hypertensie
De antihypertensieve effecten van AVAPRO werden onderzocht in 7 placebogecontroleerde onderzoeken van 8 tot 12 weken bij patiënten met een baseline diastolische bloeddruk van 95 tot 110 mmHg. Doses van 1 tot 900 mg werden in deze onderzoeken opgenomen om het dosisbereik van irbesartan volledig te onderzoeken. Deze onderzoeken maakten een vergelijking mogelijk van een- of tweemaal daagse regimes van 150 mg/dag, vergelijkingen van piek- en daleffecten en vergelijkingen van de respons op geslacht, leeftijd en ras. Twee van de zeven hierboven geïdentificeerde placebogecontroleerde onderzoeken onderzochten de antihypertensieve effecten van irbesartan en hydrochloorthiazide in combinatie.
De 7 onderzoeken naar irbesartan monotherapie omvatten in totaal 1915 patiënten gerandomiseerd naar irbesartan (1-900 mg) en 611 patiënten gerandomiseerd naar placebo. Eenmaal daagse doses van 150 mg en 300 mg gaven statistisch en klinisch significante verlagingen van de systolische en diastolische bloeddruk met daleffecten (24 uur na toediening) na 6 tot 12 weken behandeling vergeleken met placebo, van ongeveer 8-10%. respectievelijk 5-6 mmHg en 8-12/5-8 mmHg. Er werd geen verdere toename van het effect waargenomen bij doseringen hoger dan 300 mg. De dosis-responsrelaties voor effecten op de systolische en diastolische druk worden getoond in figuren 1 en 2.
Figuur 1: Placebo-afgetrokken reductie in dal SeSBP; geïntegreerde analyse
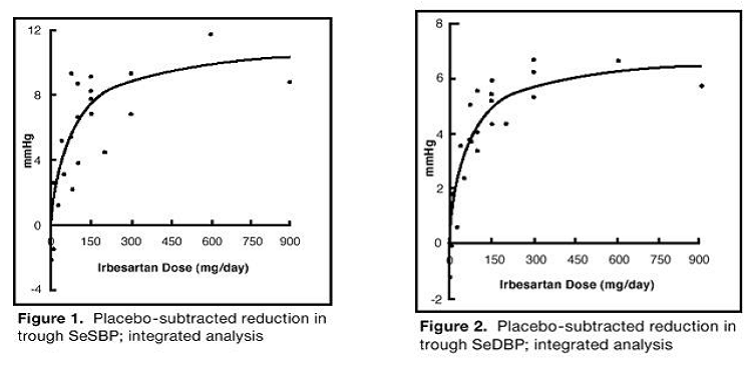
Figuur 2: Placebo-afgetrokken reductie in dal SeSBP; geïntegreerde analyse
Eenmaal daagse toediening van therapeutische doses irbesartan gaf piekeffecten na ongeveer 3 tot 6 uur en, in één ambulante bloeddrukmonitoringstudie, opnieuw rond 14 uur. Dit werd waargenomen bij zowel een eenmaal daagse als een tweemaal daagse dosering. De dal-tot-piekverhoudingen voor de systolische en diastolische respons lagen over het algemeen tussen 60% en 70%. In een continue ambulante bloeddrukmonitoringstudie gaf een eenmaal daagse dosering van 150 mg een dal- en gemiddelde 24-uursrespons die vergelijkbaar was met die waargenomen bij patiënten die tweemaal daags dezelfde totale dagelijkse dosis kregen.
In gecontroleerde onderzoeken veroorzaakte de toevoeging van irbesartan aan hydrochloorthiazidedoses van 6,25 mg, 12,5 mg of 25 mg verdere dosisgerelateerde verlagingen van de bloeddruk vergelijkbaar met die bereikt met dezelfde monotherapiedosis irbesartan. HCTZ had ook een ongeveer additief effect.
Analyse van leeftijds-, geslachts- en rassubgroepen van patiënten toonde aan dat mannen en vrouwen, en patiënten ouder dan 65 jaar, over het algemeen vergelijkbare reacties vertoonden. Irbesartan was effectief bij het verlagen van de bloeddruk, ongeacht het ras, hoewel het effect iets minder was bij negroïde personen (meestal een populatie met een laag reninegehalte).
Het effect van irbesartan is duidelijk na de eerste dosis, en het is dicht bij het volledige waargenomen effect na 2 weken. Aan het einde van een blootstelling van 8 weken was ongeveer 2/3 van het antihypertensieve effect een week na de laatste dosis nog steeds aanwezig. Rebound-hypertensie werd niet waargenomen. In gecontroleerde onderzoeken was er in wezen geen verandering in de gemiddelde hartslag bij met irbesartan behandelde patiënten.
Nefropathie bij type 2 diabetespatiënten
De Irbesartan Diabetic Nephropathy Trial (IDNT) was een gerandomiseerde, placebo- en actief-gecontroleerde, dubbelblinde, multicenter studie die wereldwijd werd uitgevoerd bij 1715 patiënten met diabetes type 2, hypertensie (SeSBP >135 mmHg of SeDBP >85 mmHg) en nefropathie (serum creatinine 1,0 tot 3,0 mg/dL bij vrouwen of 1,2 tot 3,0 mg/dL bij mannen en proteïnurie ≥900 mg/dag). Patiënten werden gerandomiseerd om eenmaal daags AVAPRO 75 mg, amlodipine 2,5 mg of een overeenkomende placebo te krijgen. De patiënten werden getitreerd naar een onderhoudsdosis van AVAPRO 300 mg of amlodipine 10 mg, zoals getolereerd. Aanvullende antihypertensiva (exclusief ACE-remmers, angiotensine II-receptorantagonisten en calciumkanaalblokkers) werden toegevoegd indien nodig om de bloeddrukdoelstelling te bereiken (≤135/85 of 10 mmHg verlaging van de systolische bloeddruk indien hoger dan 160 mmHg) voor patiënten in alle groepen .
De onderzoekspopulatie was 66,5% man, 72,9% jonger dan 65 jaar en 72% blank (Aziatische/Pacific Islander 5,0%, zwarte 13,3%, Spaanse 4,8%). De gemiddelde systolische en diastolische bloeddruk bij baseline waren respectievelijk 159 mmHg en 87 mmHg. De patiënten gingen de studie in met een gemiddelde serumcreatinine van 1,7 mg/dL en een gemiddelde proteïnurie van 4144 mg/dag.
De gemiddelde bereikte bloeddruk was 142/77 mmHg voor AVAPRO, 142/76 mmHg voor amlodipine en 145/79 mmHg voor placebo. In totaal ontving 83,0% van de patiënten de beoogde dosis irbesartan meer dan 50% van de tijd. Patiënten werden gevolgd voor een gemiddelde duur van 2,6 jaar.
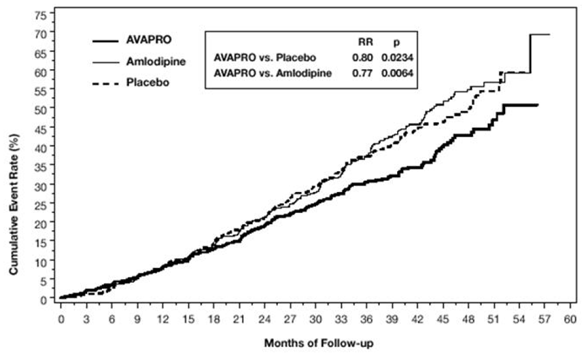
Het primaire samengestelde eindpunt was de tijd tot optreden van een van de volgende voorvallen: verdubbeling van serumcreatinine bij aanvang, eindstadium nierziekte (ESRD; gedefinieerd door serumcreatinine ≥6 mg/dl, dialyse of niertransplantatie), of overlijden . Behandeling met AVAPRO 150 mg resulteerde in een risicoreductie van 20% ten opzichte van placebo (p=0,0234) (zie figuur 3 en tabel 1). Behandeling met AVAPRO 150 mg verminderde ook het optreden van aanhoudende verdubbeling van serumcreatinine als afzonderlijk eindpunt (33%), maar had geen significant effect op ESRD alleen en geen effect op de totale mortaliteit (zie tabel 1).
Figuur 3: IDNT: Kaplan-Meier-schattingen van primair eindpunt (verdubbeling van serumcreatinine, eindstadium nierziekte of mortaliteit door alle oorzaken)
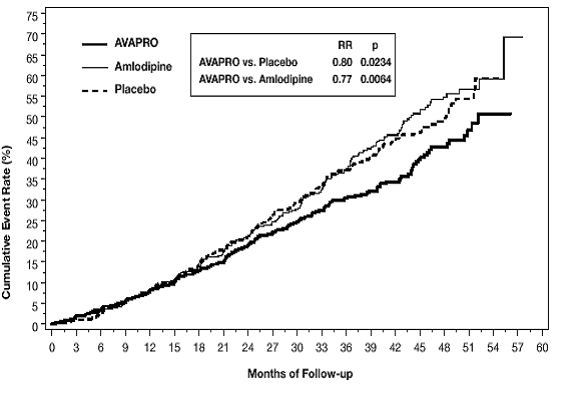
De percentages patiënten die een gebeurtenis doormaakten in de loop van het onderzoek zijn te zien in tabel 1 hieronder:
Het secundaire eindpunt van de studie was een samenstelling van cardiovasculaire mortaliteit en morbiditeit (myocardinfarct, ziekenhuisopname wegens hartfalen, beroerte met blijvende neurologische uitval, amputatie). Er waren geen statistisch significante verschillen tussen de behandelingsgroepen in deze eindpunten. Vergeleken met placebo verminderde AVAPRO 150 mg de proteïnurie significant met ongeveer 27%, een effect dat duidelijk werd binnen 3 maanden na aanvang van de therapie. AVAPRO verminderde significant de snelheid van verlies van nierfunctie (glomerulaire filtratiesnelheid), zoals gemeten door het omgekeerde van de serumcreatinineconcentratie, met 18,2%.
Tabel 2 geeft resultaten voor demografische subgroepen. Subgroepanalyses zijn moeilijk te interpreteren en het is niet bekend of deze waarnemingen echte verschillen of toevalseffecten vertegenwoordigen. Voor het primaire eindpunt werden de gunstige effecten van AVAPRO gezien bij patiënten die ook andere antihypertensiva gebruikten (angiotensine II-receptorantagonisten, angiotensine-converting-enzymremmers en calciumkanaalblokkers waren niet toegestaan), orale hypoglykemische middelen en lipide- verlagende middelen.
PATIËNT INFORMATIE
Zwangerschap
Adviseer vrouwelijke patiënten in de vruchtbare leeftijd over de gevolgen van blootstelling aan AVAPRO tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Patiënten moeten worden gevraagd zwangerschappen zo snel mogelijk aan hun arts te melden.
Kaliumsupplementen
Adviseer patiënten die AVAPRO krijgen om geen kaliumsupplementen of zoutvervangers te gebruiken die kalium bevatten zonder hun zorgverlener te raadplegen [zie: DRUG-INTERACTIES ].
