Zyvox 600mg Linezolid Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zyvox 600 mg en hoe wordt het gebruikt?
Zyvox is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van bacteriële infecties zoals longontsteking, huidinfecties en infecties die resistent zijn tegen andere antibiotica. Zyvox 600 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zyvox behoort tot een klasse geneesmiddelen die Antibiotica, Overige wordt genoemd; Oxazolidinonen.
Het is niet bekend of Zyvox veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Zyvox?
Zyvox kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling in uw gezicht of keel,
- ernstige huidreactie,
- koorts,
- keelpijn,
- brandende ogen,
- huid pijn,
- rode of paarse huiduitslag met blaarvorming en vervelling,
- zichtproblemen,
- veranderingen in uw zicht,
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- toevallen,
- zweten,
- zich angstig of bevend voelen,
- agitatie,
- hallucinaties,
- koorts,
- rillend,
- snelle hartslag,
- Spierstijfheid,
- spiertrekkingen,
- verlies van coördinatie,
- misselijkheid,
- braken,
- diarree,
- ongebruikelijke spierpijn,
- moeite met ademhalen,
- buikpijn,
- onregelmatige hartslag,
- duizeligheid,
- koud hebben,
- zich erg zwak of moe voelen,
- verwardheid,
- zweertjes in de mond,
- huidzweren,
- gemakkelijk blauwe plekken,
- ongewone bloeding,
- bleke huid,
- koude handen en voeten,
- duizeligheid, en
- kortademigheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zyvox zijn:
- misselijkheid,
- braken,
- diarree,
- milde huiduitslag,
- bloedarmoede (lage rode bloedcellen),
- hoofdpijn, en
- duizeligheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zyvox. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
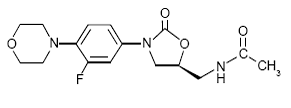
ZYVOX 600 mg IV-injectie, ZYVOX-tabletten en ZYVOX voor orale suspensie bevatten linezolid, een synthetisch antibacterieel middel uit de klasse van oxazolidinon. De chemische naam voor linezolid is (S)-N-[[3-[3-Fluor-4-(4morfolinyl)fenyl]-2-oxo-5-oxazolidinyl]methyl]-aceetamide.
De empirische formule is C16H20FN3O4. Het molecuulgewicht is 337,35 en de chemische structuur wordt hieronder weergegeven:
ZYVOX 600 mg IV-injectie wordt geleverd als een gebruiksklare steriele isotone oplossing voor intraveneuze infusie. Elke ml bevat 2 mg linezolid. Inactieve ingrediënten zijn natriumcitraat, citroenzuur en dextrose in een waterige drager voor intraveneuze toediening. Het natriumgehalte (Na+) is 0,38 mg/ml (5 mEq/300 ml zak en 1,7 mEq/100 ml zak).
ZYVOX Tablet voor orale toediening bevat 600 mg linezolid als een filmomhulde gecomprimeerde tablet. Inactieve ingrediënten zijn maïszetmeel, microkristallijne cellulose, hydroxypropylcellulose, natriumzetmeelglycolaat, magnesiumstearaat, hypromellose, polyethyleenglycol, titaniumdioxide en carnaubawas. Het natriumgehalte (Na+) is 2,92 mg per tablet van 600 mg (0,1 mEq/tablet).
ZYVOX 600 mg voor orale suspensie wordt geleverd als een korrel/poeder met sinaasappelsmaak om te vormen tot een suspensie voor orale toediening. Na constitutie bevat elke 5 ml 100 mg linezolid. Inactieve ingrediënten zijn sucrose, citroenzuur, natriumcitraat, microkristallijne cellulose en carboxymethylcellulose-natrium, aspartaam, xanthaangom, mannitol, natriumbenzoaat, colloïdaal siliciumdioxide, natriumchloride en smaakstoffen [zie PATIËNT INFORMATIE ]. Het natriumgehalte (Na+) is 8,52 mg/5 ml (0,4 mEq/5 ml).
INDICATIES
Nosocomiale pneumonie
ZYVOX is geïndiceerd voor de behandeling van nosocomiale pneumonie veroorzaakt door Staphylococcus aureus (methicillinegevoelige en resistente isolaten) of Streptococcus pneumoniae (zie Klinische studies ].
Gemeenschap verworven pneumonie
ZYVOX 600 mg is geïndiceerd voor de behandeling van buiten het ziekenhuis opgelopen pneumonie veroorzaakt door Streptococcus pneumoniae, inclusief gevallen met gelijktijdige bacteriëmie of Staphylococcus aureus (alleen methicilline-gevoelige isolaten) [zie Klinische studies ].
Gecompliceerde huid- en huidstructuurinfecties
ZYVOX 600 mg is geïndiceerd voor de behandeling van gecompliceerde huid- en huidstructuurinfecties, waaronder diabetische voetinfecties, zonder gelijktijdige osteomyelitis, veroorzaakt door Staphylococcus aureus (methicilline-gevoelige en resistente isolaten), Streptococcus pyogenes of Streptococcus agalactiae. ZYVOX is niet onderzocht bij de behandeling van decubituszweren [zie: Klinische studies ].
Ongecompliceerde huid- en huidstructuurinfecties
ZYVOX 600 mg is geïndiceerd voor de behandeling van ongecompliceerde huid- en huidstructuurinfecties veroorzaakt door Staphylococcus aureus (alleen methicilline-gevoelige isolaten) of Streptococcus pyogenes [zie Klinische studies ].
Vancomycine-resistente Enterococcus faecium-infecties
ZYVOX 600 mg is geïndiceerd voor de behandeling van vancomycine-resistente Enterococcus faecium-infecties, inclusief gevallen met gelijktijdige bacteriëmie [zie Klinische studies ].
Beperkingen van gebruik
- ZYVOX 600 mg is niet geïndiceerd voor de behandeling van Gram-negatieve infecties. Het is van cruciaal belang dat een specifieke Gram-negatieve therapie onmiddellijk wordt gestart als een gelijktijdige Gram-negatieve pathogeen is gedocumenteerd of vermoed wordt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- De veiligheid en werkzaamheid van ZYVOX 600 mg formuleringen die langer dan 28 dagen worden gegeven, zijn niet geëvalueerd in gecontroleerde klinische onderzoeken [zie Klinische studies ].
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de werkzaamheid van ZYVOX 600 mg en andere antibacteriële geneesmiddelen te behouden, mag ZYVOX alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Algemene dosering en toediening
De aanbevolen dosering voor ZYVOX 600 mg formuleringen voor de behandeling van infecties wordt beschreven in Tabel 1.
Er is geen dosisaanpassing nodig bij het overschakelen van intraveneuze naar orale toediening.
Intraveneuze toediening
ZYVOX 600 mg IV-injectie wordt geleverd in gebruiksklare infuuszakken voor eenmalig gebruik. Parenterale geneesmiddelen moeten vóór toediening visueel worden gecontroleerd op deeltjes. Controleer op minieme lekken door stevig in de zak te knijpen. Als er lekken worden gedetecteerd, gooi de oplossing dan weg, omdat de steriliteit kan worden aangetast. Bewaar de infuuszakken in de buitenverpakking tot ze klaar zijn voor gebruik. Bewaar op kamertemperatuur. Beschermen tegen bevriezing. ZYVOX 600 mg IV-injectie kan een gele kleur vertonen die in de loop van de tijd kan intensiveren zonder de potentie nadelig te beïnvloeden.
ZYVOX IV-injectie moet worden toegediend via intraveneuze infusie gedurende een periode van 30 tot 120 minuten. Gebruik deze intraveneuze infuuszak niet in serieverbindingen. Additieven mogen niet in deze oplossing worden geïntroduceerd. Als ZYVOX 600 mg IV-injectie gelijktijdig met een ander geneesmiddel moet worden gegeven, moet elk geneesmiddel afzonderlijk worden gegeven in overeenstemming met de aanbevolen dosering en toedieningsweg voor elk product. Gooi het ongebruikte deel weg.
Als dezelfde intraveneuze lijn wordt gebruikt voor opeenvolgende infusie van verschillende geneesmiddelen, moet de lijn voor en na de infusie van ZYVOX IV-injectie worden gespoeld met een infusieoplossing die compatibel is met ZYVOX 600 mg IV-injectie en met elk ander geneesmiddel dat via deze gemeenschappelijke lijn wordt toegediend .
Compatibiliteit
Compatibele intraveneuze oplossingen omvatten 0,9% natriumchloride-injectie, USP, 5% dextrose-injectie, USP en Ringer-lactaatinjectie, USP.
onverenigbaarheden
Fysieke onverenigbaarheden ontstonden wanneer ZYVOX 600 mg IV-injectie werd gecombineerd met de volgende geneesmiddelen tijdens gesimuleerde toediening op de Y-plaats: amfotericine B, chloorpromazine HCl, diazepam, pentamidine-isothionaat, erytromycine-lactobionaat, fenytoïne-natrium en trimethoprim-sulfamethoxazol. Bovendien ontstond er chemische onverenigbaarheid wanneer ZYVOX IV-injectie werd gecombineerd met ceftriaxon-natrium.
Grondwet van mondelinge schorsing
ZYVOX voor orale suspensie wordt geleverd als poeder/granulaat voor constitutie. Tik zachtjes op de fles om het poeder los te maken. Voeg in twee porties in totaal 123 ml gedestilleerd water toe. Na het toevoegen van de eerste helft krachtig schudden om al het poeder nat te maken. Voeg vervolgens de tweede helft van het water toe en schud krachtig om een uniforme suspensie te verkrijgen. Na bereiding bevat elke 5 ml van de suspensie 100 mg linezolid. Voor gebruik voorzichtig mengen door de fles 3 tot 5 keer om te keren. Niet schudden. Bewaar samengestelde suspensie bij kamertemperatuur. Gebruik binnen 21 dagen na constitutie.
HOE GELEVERD
Doseringsvormen en sterke punten
ZYVOX 600 mg IV-injectie: 200 mg/100 ml (2 mg/ml) en 600 mg/300 ml (2 mg/ml) linezolid voor eenmalig gebruik, gebruiksklare flexibele plastic infuuszakken in een omhulsel van folielaminaat.
ZYVOX 600 mg-tablet:
witte, capsulevormige, filmomhulde tablet met de inscriptie “ZYV” aan de ene kant en “600” aan de andere kant. ZYVOX 600 mg voor orale suspensie: droog, wit tot gebroken wit, granulaat/poeder met sinaasappelsmaak. Indien samengesteld zoals aangegeven, zal elke fles 150 ml van een suspensie bevatten, wat overeenkomt met het equivalent van 100 mg linezolid per 5 ml.
Opslag en behandeling
Injectie
ZYVOX 600 mg IV Injectie is beschikbaar in kant-en-klare flexibele plastic infuuszakken voor eenmalig gebruik in een folielaminaat omhulsel. De infuuszakken en -poorten zijn niet gemaakt van natuurlijk rubberlatex. De infuuszakken zijn verkrijgbaar in de volgende verpakkingsgrootten:
200 mg/100 ml (2 mg/ml) linezolid x 10 - NDC 0009-5137-04 600 mg/300 ml (2 mg/ml) linezolid x 10 - NDC 0009-5140-04
Tabletten
ZYVOX 600 mg-tabletten zijn als volgt verkrijgbaar:
600 mg (witte, capsulevormige, filmomhulde tabletten met de inscriptie “ZYV” aan de ene kant en “600” aan de andere)
20 tabletten in HDPE fles - NDC 0009-5138-02 Eenheidsdosisverpakkingen van 30 tabletten - NDC 0009-5138-03
Orale suspensie
ZYVOX voor orale suspensie is verkrijgbaar als een droge, witte tot gebroken witte korrel/poeder met sinaasappelsmaak. Indien samengesteld zoals aangegeven, zal elke fles 150 ml van een suspensie bevatten, wat overeenkomt met het equivalent van 100 mg linezolid per 5 ml. ZYVOX voor orale suspensie wordt als volgt geleverd:
100 mg/5 ml in glazen flessen van 240 ml - NDC 0009-5136-01
Opslag en behandeling
Bewaren bij 25°C (77°F). Bescherm tegen licht. Houd de flessen goed gesloten ter bescherming tegen vocht. Het wordt aanbevolen om de infuuszakken in de buitenverpakking te bewaren tot ze klaar zijn voor gebruik. Bescherm de infuuszakken tegen bevriezing.
Gedistribueerd door Pharmacia & Upjohn Co Division van Pfizer Inc, NY, NY 10017. Herzien: november 2021.
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
volwassenen
De veiligheid van ZYVOX 600 mg formuleringen werd geëvalueerd bij 2.046 volwassen patiënten die deelnamen aan zeven fase 3-comparator-gecontroleerde klinische onderzoeken, die maximaal 28 dagen werden behandeld.
Van de patiënten die werden behandeld voor ongecompliceerde huid- en huidstructuurinfecties (uSSSI's), kreeg 25,4% van de met ZYVOX behandelde patiënten en 19,6% van de met een vergelijkingsmiddel behandelde patiënten ten minste één geneesmiddelgerelateerde bijwerking. Voor alle andere indicaties ondervond 20,4% van de met ZYVOX behandelde patiënten en 14,3% van de met een vergelijkingsmiddel behandelde patiënten ten minste één geneesmiddelgerelateerde bijwerking.
Tabel 2 toont de incidentie van alle causale, tijdens de behandeling optredende bijwerkingen die zijn gemeld bij ten minste 1% van de volwassen patiënten in deze onderzoeken per dosis ZYVOX.
Van de patiënten die werden behandeld voor uSSSI's, stopte 3,5% van de met ZYVOX behandelde patiënten en 2,4% van de met een vergelijkingsmiddel behandelde patiënten de behandeling vanwege geneesmiddelgerelateerde bijwerkingen. Voor alle andere indicaties vond stopzetting van de behandeling vanwege geneesmiddelgerelateerde bijwerkingen plaats bij 2,1% van de met ZYVOX behandelde patiënten en bij 1,7% van de met een vergelijkingsmiddel behandelde patiënten. De meest gemelde geneesmiddelgerelateerde bijwerkingen die leidden tot stopzetting van de behandeling waren misselijkheid, hoofdpijn, diarree en braken.
Pediatrische patiënten
De veiligheid van ZYVOX-formuleringen werd geëvalueerd bij 215 pediatrische patiënten, variërend in leeftijd vanaf de geboorte tot 11 jaar, en bij 248 pediatrische patiënten in de leeftijd van 5 tot en met 17 jaar (146 van deze 248 waren van 5 tot en met 11 jaar en 102 waren van 12 tot 17 jaar oud). Deze patiënten werden opgenomen in twee fase 3-comparator-gecontroleerde klinische onderzoeken en werden gedurende maximaal 28 dagen behandeld. In de studie van gehospitaliseerde pediatrische patiënten (geboorte tot 11 jaar) met grampositieve infecties, die 2 op 1 werden gerandomiseerd (linezolid: vancomycine), was de mortaliteit 6,0% (13/215) in de linezolid-arm en 3,0% (3/101) in de vancomycine-arm. Gezien de ernstige onderliggende ziekte in de patiëntenpopulatie kon echter geen oorzakelijk verband worden vastgesteld.
Van de pediatrische patiënten die werden behandeld voor uSSSI's, ondervond 19,2% van de met ZYVOX behandelde patiënten en 14,1% van de met een vergelijkingsmiddel behandelde patiënten ten minste één geneesmiddelgerelateerde bijwerking. Voor alle andere indicaties ondervond 18,8% van de met ZYVOX behandelde patiënten en 34,3% van de met een comparator behandelde patiënten ten minste één geneesmiddelgerelateerde bijwerking.
Tabel 3 toont de incidentie van alle causale, tijdens de behandeling optredende bijwerkingen die zijn gemeld bij meer dan 1% van de pediatrische patiënten (en meer dan 1 patiënt) in beide behandelingsgroepen in de vergelijkende fase 3-onderzoeken.
Van de pediatrische patiënten die werden behandeld voor uSSSI's, stopte 1,6% van de met ZYVOX behandelde patiënten en 2,4% van de met een vergelijkingsmiddel behandelde patiënten de behandeling vanwege geneesmiddelgerelateerde bijwerkingen. Voor alle andere indicaties kwamen stopzettingen vanwege geneesmiddelgerelateerde bijwerkingen voor bij 0,9% van de met ZYVOX behandelde patiënten en 6,1% van de met een vergelijkingsmiddel behandelde patiënten.
Laboratoriumafwijkingen
ZYVOX is in verband gebracht met trombocytopenie bij gebruik in doses tot en met 600 mg elke 12 uur gedurende maximaal 28 dagen. In fase 3-comparator-gecontroleerde onderzoeken was het percentage volwassen patiënten dat een substantieel laag aantal bloedplaatjes ontwikkelde (gedefinieerd als minder dan 75% van de ondergrens van normaal en/of baseline) 2,4% (bereik tussen onderzoeken: 0,3 tot 10,0%) met ZYVOX 600 mg en 1,5% (bereik tussen onderzoeken: 0,4 tot 7,0%) met een comparator. In een onderzoek onder gehospitaliseerde pediatrische patiënten, variërend in leeftijd vanaf de geboorte tot 11 jaar, was het percentage patiënten dat een substantieel laag aantal bloedplaatjes ontwikkelde (gedefinieerd als minder dan 75% van de ondergrens van normaal en/of baseline) 12,9% met ZYVOX 600 mg. en 13,4% met vancomycine. In een poliklinische studie bij pediatrische patiënten in de leeftijd van 5 tot en met 17 jaar was het percentage patiënten dat een aanzienlijk laag aantal bloedplaatjes ontwikkelde 0% met ZYVOX en 0,4% met cefadroxil. Trombocytopenie geassocieerd met het gebruik van ZYVOX lijkt afhankelijk te zijn van de duur van de behandeling (in het algemeen langer dan 2 weken behandeling). Het aantal bloedplaatjes voor de meeste patiënten keerde terug naar het normale bereik/baseline tijdens de follow-upperiode. Er werden geen gerelateerde klinische bijwerkingen vastgesteld in klinische fase 3-onderzoeken bij patiënten die trombocytopenie ontwikkelden. Er werden bloedingen vastgesteld bij trombocytopenische patiënten in een programma voor gebruik van ZYVOX in compassie; de rol van linezolid bij deze gebeurtenissen kan niet worden bepaald [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Veranderingen die werden waargenomen in andere laboratoriumparameters, ongeacht de relatie tussen geneesmiddelen, lieten geen wezenlijke verschillen zien tussen ZYVOX 600 mg en de vergelijkingsmiddelen. Deze veranderingen waren over het algemeen niet klinisch significant, leidden niet tot stopzetting van de behandeling en waren reversibel. De incidentie van volwassen en pediatrische patiënten met ten minste één substantieel abnormale hematologische of serumchemiewaarde wordt weergegeven in tabellen 4, 5, 6 en 7.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van ZYVOX na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan geneesmiddelen:
- Myelosuppressie (inclusief anemie, leukopenie, pancytopenie en trombocytopenie) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]; sideroblastische bloedarmoede.
- Perifere neuropathie en optische neuropathie die soms leidt tot verlies van gezichtsvermogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Lactaatacidose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Hoewel deze meldingen voornamelijk zijn opgetreden bij patiënten die langer dan de maximaal aanbevolen duur van 28 dagen werden behandeld, zijn deze voorvallen ook gemeld bij patiënten die kortere therapiekuren kregen.
- Het serotoninesyndroom is gemeld bij patiënten die gelijktijdig serotonerge middelen kregen, waaronder antidepressiva zoals selectieve serotonineheropnameremmers (SSRI's) en opioïden, en ZYVOX (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- stuiptrekkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Anafylaxie, angio-oedeem, bulleuze huidaandoeningen waaronder ernstige cutane bijwerkingen (SCAR) zoals toxische epidermale necrolyse en Stevens-Johnson-syndroom, en overgevoeligheidsvasculitis.
- Oppervlakkige tandverkleuring en tongverkleuring zijn gemeld bij het gebruik van linezolid. De tandverkleuring was te verwijderen met professionele gebitsreiniging (handmatige ontkalking) in gevallen met bekende uitkomst.
- Hypoglykemie, inclusief symptomatische episodes [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Hyponatriëmie en/of syndroom van ongepaste secretie van antidiuretisch hormoon (SIADH) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
DRUG-INTERACTIES
Monoamineoxidaseremmers
Linezolid is een reversibele, niet-selectieve remmer van monoamineoxidase [zie: CONTRA-INDICATIES en KLINISCHE FARMACOLOGIE ].
Adrenerge en serotonerge middelen
Linezolid heeft het potentieel voor interactie met adrenerge en serotonerge middelen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Myelosuppressie
Myelosuppressie (waaronder anemie, leukopenie, pancytopenie en trombocytopenie) is gemeld bij patiënten die linezolid kregen. In gevallen waar de uitkomst bekend is, zijn de aangetaste hematologische parameters gestegen naar het niveau van voor de behandeling wanneer linezolid werd stopgezet. Het volledige bloedbeeld moet wekelijks worden gecontroleerd bij patiënten die linezolid krijgen, met name bij degenen die langer dan twee weken linezolid krijgen, degenen met reeds bestaande myelosuppressie, degenen die gelijktijdig geneesmiddelen krijgen die beenmergsuppressie veroorzaken, of degenen met een chronische infectie die eerdere of gelijktijdige antibacteriële medicamenteuze behandeling hebben gekregen. Stopzetting van de behandeling met linezolid moet worden overwogen bij patiënten die myelosuppressie ontwikkelen of verergeren.
Perifere en optische neuropathie
Perifere en optische neuropathieën zijn gemeld bij patiënten die werden behandeld met ZYVOX 600 mg, voornamelijk bij patiënten die langer dan de maximaal aanbevolen duur van 28 dagen werden behandeld. In gevallen van optische neuropathie die evolueerde naar verlies van gezichtsvermogen, werden patiënten gedurende langere perioden behandeld dan de maximaal aanbevolen duur. Wazig zien is gemeld bij sommige patiënten die minder dan 28 dagen met ZYVOX werden behandeld. Perifere en optische neuropathie is ook gemeld bij kinderen.
Als patiënten symptomen van een visuele beperking ervaren, zoals veranderingen in gezichtsscherpte, veranderingen in kleurenzien, wazig zien of gezichtsvelddefecten, wordt een onmiddellijke oogheelkundige evaluatie aanbevolen. De visuele functie moet worden gecontroleerd bij alle patiënten die ZYVOX gedurende langere perioden (≥ 3 maanden) gebruiken en bij alle patiënten die nieuwe visuele symptomen melden, ongeacht de duur van de behandeling met ZYVOX. Als perifere of optische neuropathie optreedt, moet het voortgezette gebruik van ZYVOX 600 mg bij deze patiënten worden afgewogen tegen de mogelijke risico's.
serotonine syndroom
Spontane meldingen van serotoninesyndroom, waaronder gevallen met fatale afloop, geassocieerd met de gelijktijdige toediening van ZYVOX en serotonerge middelen, waaronder antidepressiva zoals selectieve serotonineheropnameremmers (SSRI's), zijn gemeld.
Tenzij klinisch aangewezen en patiënten zorgvuldig worden geobserveerd op tekenen en/of symptomen van serotoninesyndroom of maligne neurolepticasyndroom-achtige (NMS-achtige) reacties, mag linezolid niet worden toegediend aan patiënten met carcinoïdsyndroom en/of patiënten die een van de volgende geneesmiddelen gebruiken : serotonineheropnameremmers, tricyclische antidepressiva, bupropion, buspiron, serotonine 5-HT1-receptoragonisten (triptanen) en opioïden, waaronder meperidine (zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
In sommige gevallen kan een patiënt die al een serotonerge antidepressivum of buspiron krijgt, een dringende behandeling met linezolid nodig hebben. Als er geen alternatieven voor linezolid beschikbaar zijn en de mogelijke voordelen van linezolid opwegen tegen de risico's van serotoninesyndroom of NMS-achtige reacties, moet het serotonerge antidepressivum onmiddellijk worden stopgezet en linezolid worden toegediend. De patiënt moet gedurende twee weken worden gecontroleerd (vijf weken als fluoxetine is ingenomen) of tot 24 uur na de laatste dosis linezolid, afhankelijk van wat zich het eerst voordoet. Symptomen van serotoninesyndroom of NMS-achtige reacties zijn onder meer hyperthermie, rigiditeit, myoclonus, autonome instabiliteit en veranderingen in de mentale toestand, waaronder extreme agitatie die overgaat in delirium en coma. De patiënt moet ook worden gecontroleerd op ontwenningsverschijnselen van het antidepressivum (zie de bijsluiter van het/de gespecificeerde middel(en) voor een beschrijving van de bijbehorende ontwenningsverschijnselen).
Mortaliteitsonbalans in een onderzoeksonderzoek bij patiënten met kathetergerelateerde bloedbaaninfecties, inclusief patiënten met katheterinfecties
In een open-label onderzoek bij ernstig zieke patiënten met intravasculaire kathetergerelateerde infecties werd een disbalans in mortaliteit gezien bij patiënten behandeld met linezolid in vergelijking met vancomycine/dicloxacilline/oxacilline in vergelijking met 58/363 (16,0%). ); odds ratio 1.426, 95% CI 0,970, 2.098]. Hoewel de causaliteit niet is vastgesteld, trad deze waargenomen onbalans voornamelijk op bij met linezolid behandelde patiënten bij wie ofwel Gram-negatieve pathogenen, gemengde Gram-negatieve en Gram-positieve pathogenen, of geen pathogeen werden geïdentificeerd bij aanvang, maar werd niet gezien bij patiënten met Alleen grampositieve infecties.
Linezolid is niet goedgekeurd en mag niet worden gebruikt voor de behandeling van patiënten met kathetergerelateerde bloedbaaninfecties of katheterinfecties.
Linezolid heeft geen klinische activiteit tegen Gram-negatieve pathogenen en is niet geïndiceerd voor de behandeling van Gram-negatieve infecties. Het is van cruciaal belang dat een specifieke Gram-negatieve therapie onmiddellijk wordt gestart als een gelijktijdige Gram-negatieve pathogeen is gedocumenteerd of vermoed wordt [zie INDICATIES ].
Clostridioides Difficile-geassocieerde diarree
Clostridioides difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder ZYVOX 600 mg, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibacteriële geneesmiddelen.
Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestaakt met het voortdurende gebruik van antibacteriële geneesmiddelen dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële medicamenteuze behandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Potentiële interacties die een verhoging van de bloeddruk veroorzaken
Tenzij patiënten worden gecontroleerd op mogelijke verhogingen van de bloeddruk, mag linezolid niet worden toegediend aan patiënten met ongecontroleerde hypertensie, feochromocytoom, thyreotoxicose en/of patiënten die een van de volgende soorten medicijnen gebruiken: direct en indirect werkende sympathicomimetica (bijv. pseudo-efedrine), vasopressiva (bijv. epinefrine, noradrenaline), dopaminerge middelen (bijv. dopamine, dobutamine) [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Melkzuuracidose
Lactaatacidose is gemeld bij het gebruik van ZYVOX. In gerapporteerde gevallen ondervonden patiënten herhaalde episodes van misselijkheid en braken. Patiënten die terugkerende misselijkheid of braken, onverklaarbare acidose of een laag bicarbonaatgehalte ontwikkelen terwijl ze ZYVOX krijgen, moeten onmiddellijk medisch worden onderzocht.
stuiptrekkingen
Convulsies zijn gemeld bij patiënten die behandeld werden met linezolid. In sommige van deze gevallen werd een voorgeschiedenis van toevallen of risicofactoren voor toevallen gemeld.
Hypoglykemie
Postmarketinggevallen van symptomatische hypoglykemie zijn gemeld bij patiënten met diabetes mellitus die insuline of orale bloedglucoseverlagende middelen kregen bij behandeling met linezolid, een reversibele, niet-selectieve MAO-remmer. Sommige MAO-remmers zijn in verband gebracht met hypoglykemische episodes bij diabetespatiënten die insuline of hypoglykemische middelen kregen. Hoewel een causaal verband tussen linezolid en hypoglykemie niet is vastgesteld, moeten diabetespatiënten worden gewaarschuwd voor mogelijke hypoglykemische reacties bij behandeling met linezolid.
Als hypoglykemie optreedt, kan een verlaging van de dosis insuline of orale bloedglucoseverlagende middelen, of stopzetting van orale bloedglucoseverlagende middelen, insuline of linezolid nodig zijn.
Hyponatriëmie en/of syndroom van ongepaste secretie van antidiuretisch hormoon (SIADH)
Postmarketinggevallen van hyponatriëmie en/of het syndroom van ongepaste antidiuretisch hormoonsecretie (SIADH) zijn waargenomen bij patiënten die met linezolid werden behandeld. In gemelde gevallen omvatten de tekenen en symptomen verwarring, slaperigheid, algemene zwakte en in ernstige gevallen leidden ze tot ademhalingsfalen en zelfs de dood. Controleer regelmatig de natriumspiegels in het serum bij ouderen, bij patiënten die diuretica gebruiken en bij andere patiënten met een risico op hyponatriëmie en/of SIADH tijdens het gebruik van ZYVOX. Als er tekenen en symptomen van hyponatriëmie en/of SIADH optreden, stop dan met ZYVOX 600 mg en stel passende ondersteunende maatregelen in.
Risico's bij patiënten met fenylketonurie
Fenylalanine kan schadelijk zijn voor patiënten met fenylketonurie (PKU). ZYVOX voor orale suspensie bevat fenylalanine, een bestanddeel van aspartaam. Elke 5 ml van de 100 mg/5 ml suspensie voor oraal gebruik bevat 20 mg fenylalanine. Voordat u ZYVOX 600 mg voor orale suspensie aan een patiënt met PKU voorschrijft, moet u rekening houden met de gecombineerde dagelijkse hoeveelheid fenylalanine uit alle bronnen, inclusief ZYVOX voor orale suspensie.
De andere ZYVOX-formuleringen bevatten geen fenylalanine.
Ontwikkeling van geneesmiddelresistente bacteriën
Het voorschrijven van ZYVOX bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen levenslange studies bij dieren uitgevoerd om het carcinogene potentieel van linezolid te evalueren. Noch mutageen noch clastogeen potentieel werd gevonden in een reeks tests, waaronder: tests voor mutageniteit (Ames-bacteriële reversie en CHO-celmutatie), een in vitro ongeplande DNA-synthese (UDS)-test, een in vitro chromosoomafwijkingstest in menselijke lymfocyten en een in vivo micronucleustest bij muizen.
Linezolid had geen invloed op de vruchtbaarheid of reproductieprestaties van volwassen vrouwelijke ratten die orale doses tot 100 mg/kg/dag kregen gedurende 14 dagen voorafgaand aan de paring tot en met dag 7. Het verminderde de vruchtbaarheid en reproductieprestaties bij volwassen mannelijke ratten reversibel wanneer het werd gegeven op doses ≥ 50 mg/kg/dag, met blootstellingen die ongeveer gelijk zijn aan of groter zijn dan het verwachte menselijke blootstellingsniveau (blootstellingsvergelijkingen zijn gebaseerd op AUC's). De omkeerbare effecten op de vruchtbaarheid werden gemedieerd door veranderde spermatogenese. Aangetaste spermatiden bevatten abnormaal gevormde en georiënteerde mitochondriën en waren niet levensvatbaar. Epitheelcelhypertrofie en hyperplasie in de bijbal werden waargenomen in combinatie met verminderde vruchtbaarheid. Soortgelijke epididymale veranderingen werden niet gezien bij honden.
Bij geslachtsrijpe mannelijke ratten die als jonge ratten aan het geneesmiddel werden blootgesteld, werd een licht verminderde vruchtbaarheid waargenomen na behandeling met linezolid gedurende het grootste deel van hun seksuele ontwikkeling (50 mg/kg/dag van dag 7 tot 36 jaar, en 100 mg/kg/dag van de leeftijd van 37 tot 55), met blootstellingen tot 1,7 keer hoger dan de gemiddelde AUC's die werden waargenomen bij pediatrische patiënten in de leeftijd van 3 maanden tot 11 jaar. Verminderde vruchtbaarheid werd niet waargenomen bij kortere behandelingsperioden, overeenkomend met blootstelling in utero gedurende de vroege neonatale periode (zwangerschapsdag 6 tot postnatale dag 5), neonatale blootstelling (postnatale dagen 5 tot 21), of met juveniele blootstelling (postnatale dagen 22 tot 35 ). Omkeerbare verminderingen van de beweeglijkheid van het sperma en veranderde spermamorfologie werden waargenomen bij ratten die werden behandeld van postnatale dag 22 tot 35.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens van gepubliceerde en postmarketing case-reports met linezolidgebruik bij zwangere vrouwen hebben geen geneesmiddelgeassocieerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten geïdentificeerd. Bij toediening tijdens de organogenese veroorzaakte linezolid geen misvormingen bij muizen, ratten of konijnen bij maternale blootstellingsniveaus van ongeveer 6,5 keer (muizen), equivalent aan (ratten) of 0,06 keer (konijnen) de klinische therapeutische blootstelling, gebaseerd op de AUC's. Bij muizen werd echter embryofoetale letaliteit waargenomen bij 6,5 maal de geschatte menselijke blootstelling. Wanneer vrouwelijke ratten werden gedoseerd tijdens organogenese tot en met lactatie, was de postnatale overleving van jongen verminderd bij doses die ongeveer gelijk waren aan de geschatte menselijke blootstelling op basis van AUC's (zie Gegevens ).
Het achtergrondrisico van ernstige geboorteafwijkingen en miskramen voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Gegevens
Dierlijke gegevens
Bij muizen werden embryofoetale toxiciteiten alleen waargenomen bij doses die maternale toxiciteit veroorzaakten (klinische symptomen en verminderde lichaamsgewichtstoename). Een orale dosis van 450 mg/kg/dag gegeven vanaf drachtsdag (GD) 6-16 (6,5 keer de geschatte menselijke blootstelling op basis van AUC's) correleerde met verhoogde postimplantatie-embryosterfte, inclusief totaal verlies van nest, verlaagd foetaal lichaamsgewicht en een verhoogde incidentie van ribkraakbeenfusie. Noch maternale noch embryo-foetale toxiciteit werd waargenomen bij doses tot 150 mg/kg/dag. Foetale misvormingen werden niet waargenomen.
Bij ratten werd foetale toxiciteit waargenomen bij orale toediening van 15 en 50 mg/kg/dag vanaf GD 6-17 (blootstellingen respectievelijk 0,22 keer tot ongeveer equivalent aan de geschatte menselijke blootstelling, gebaseerd op AUC's). De effecten bestonden uit een verlaagd foetaal lichaamsgewicht en verminderde ossificatie van de borstbeenbrae, een bevinding die vaak wordt gezien in verband met een verlaagd foetaal lichaamsgewicht. Foetale misvormingen werden niet waargenomen. Maternale toxiciteit, in de vorm van verminderde lichaamsgewichtstoename, werd waargenomen bij 50 mg/kg/dag.
Bij konijnen trad een verminderd foetaal lichaamsgewicht alleen op in aanwezigheid van maternale toxiciteit (klinische symptomen, verminderde lichaamsgewichtstoename en voedselconsumptie) bij toediening in een orale dosis van 15 mg/kg/dag gegeven vanaf GD 6-20 (0,06 maal de geschatte menselijke blootstelling op basis van AUC's). Foetale misvormingen werden niet waargenomen.
Wanneer vrouwelijke ratten werden behandeld met 50 mg/kg/dag (ongeveer gelijk aan de geschatte menselijke blootstelling op basis van AUC's) linezolid tijdens dracht en lactatie (GD 6 tot en met lactatiedag 20), was de overleving van de jongen verminderd op postnatale dagen 1 tot 4 Mannelijke en vrouwelijke pups die tot reproductieve leeftijd mochten rijpen, vertoonden, wanneer ze werden gedekt, een toename in pre-implantatieverlies.
Borstvoeding
Risico Samenvatting
Linezolid is aanwezig in moedermelk. Gebaseerd op gegevens uit beschikbare gepubliceerde casusrapporten, zou de dagelijkse dosis linezolid die het kind zou krijgen uit moedermelk ongeveer 6% tot 9% zijn van de aanbevolen therapeutische dosis voor zuigelingen (10 mg/kg elke 8 uur). Er is geen informatie over de effecten van linezolid op zuigelingen die borstvoeding krijgen; diarree en braken waren echter de meest voorkomende bijwerkingen die werden gemeld in klinische onderzoeken bij zuigelingen die therapeutisch linezolid kregen [zie: ONGEWENSTE REACTIES en (zie Klinische overwegingen). Er is geen informatie over de effecten van linezolid op de melkproductie. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan linezolid en mogelijke nadelige effecten op het kind dat borstvoeding krijgt van linezolid of van de onderliggende maternale aandoening.
Klinische overwegingen
Adviseer vrouwen die borstvoeding geven om een zuigeling die borstvoeding krijgt te controleren op diarree en braken.
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
mannen
Op basis van bevindingen uit onderzoeken bij ratten kan ZYVOX de vruchtbaarheid bij mannelijke patiënten omkeerbaar verminderen [zie: Niet-klinische toxicologie )].
Pediatrisch gebruik
De veiligheid en werkzaamheid van ZYVOX 600 mg voor de behandeling van pediatrische patiënten met de volgende infecties worden ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken bij volwassenen, farmacokinetische gegevens bij pediatrische patiënten en aanvullende gegevens uit een vergelijkend gecontroleerd onderzoek naar grampositieve infecties bij pediatrische patiënten variërend in leeftijd vanaf de geboorte tot 11 jaar [zie INDICATIES , KLINISCHE FARMACOLOGIE en Klinische studies ]:
- nosocomiale longontsteking
- gecompliceerde huid- en huidstructuurinfecties
- buiten het ziekenhuis opgelopen pneumonie (ook ondersteund door bewijs uit een ongecontroleerd onderzoek bij patiënten in de leeftijd van 8 maanden tot 12 jaar)
- vancomycine-resistente Enterococcus faecium-infecties
De veiligheid en werkzaamheid van ZYVOX 600 mg voor de behandeling van pediatrische patiënten met de volgende infectie zijn vastgesteld in een vergelijkend gecontroleerd onderzoek bij pediatrische patiënten in de leeftijd van 5 tot 17 jaar [zie Klinische studies ]:
- ongecompliceerde huid- en huidstructuurinfecties veroorzaakt door Staphylococcus aureus (alleen meticillinegevoelige stammen) of Streptococcus pyogenes
Farmacokinetische informatie gegenereerd bij pediatrische patiënten met ventriculoperitoneale shunts toonde variabele linezolidconcentraties in de cerebrospinale vloeistof (CSF) na enkelvoudige en meervoudige dosering van linezolid; therapeutische concentraties werden niet consistent bereikt of gehandhaafd in de liquor. Daarom wordt het gebruik van linezolid voor de empirische behandeling van pediatrische patiënten met infecties van het centrale zenuwstelsel niet aanbevolen.
De farmacokinetiek van linezolid is geëvalueerd bij pediatrische patiënten vanaf de geboorte tot 17 jaar. Over het algemeen neemt de op gewicht gebaseerde klaring van linezolid geleidelijk af met toenemende leeftijd van pediatrische patiënten. Bij premature (zwangerschapsduur DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
In beperkte klinische ervaring waren 5 van de 6 (83%) pediatrische patiënten met infecties als gevolg van Gram-positieve pathogenen met minimale remmende concentraties (MIC's) van 4 mcg/ml behandeld met ZYVOX 600 mg klinisch genezen. Pediatrische patiënten vertonen echter een grotere variabiliteit in linezolidklaring en systemische blootstelling (AUC) in vergelijking met volwassenen. Bij pediatrische patiënten met een suboptimale klinische respons, met name die met pathogenen met een MIC van 4 mcg/ml, moet rekening worden gehouden met een lagere systemische blootstelling, plaats en ernst van de infectie en de onderliggende medische aandoening bij het beoordelen van de klinische respons [zie KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ].
Geriatrisch gebruik
Van de 2.046 patiënten die werden behandeld met ZYVOX 600 mg in fase 3-comparatorgecontroleerde klinische onderzoeken, waren 589 (29%) 65 jaar of ouder en 253 (12%) 75 jaar of ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
OVERDOSERING
In geval van overdosering wordt ondersteunende zorg geadviseerd, met behoud van glomerulaire filtratie. Hemodialyse kan een snellere eliminatie van linezolid vergemakkelijken. In een klinische fase 1-studie werd ongeveer 30% van een dosis linezolid verwijderd tijdens een hemodialysesessie van 3 uur, te beginnen 3 uur nadat de dosis linezolid was toegediend. Er zijn geen gegevens beschikbaar over de verwijdering van linezolid met peritoneale dialyse of hemoperfusie. Klinische tekenen van acute toxiciteit bij dieren waren verminderde activiteit en ataxie bij ratten en braken en tremoren bij honden die werden behandeld met respectievelijk 3.000 mg/kg/dag en 2.000 mg/kg/dag.
CONTRA-INDICATIES
overgevoeligheid
ZYVOX-formuleringen zijn gecontra-indiceerd voor gebruik bij patiënten met een bekende overgevoeligheid voor linezolid of een van de andere productcomponenten.
Monoamineoxidaseremmers
Linezolid mag niet worden gebruikt bij patiënten die geneesmiddelen gebruiken die monoamineoxidasen A of B remmen (bijv. fenelzine, isocarboxazide) of binnen twee weken na inname van een dergelijk geneesmiddel.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
ZYVOX is een antibacterieel medicijn [zie Microbiologie ].
farmacodynamiek
In een gerandomiseerde, positieve en placebogecontroleerde cross-over grondige QT-studie kregen 40 gezonde proefpersonen een enkele dosis ZYVOX 600 mg toegediend via een 1 uur durende IV-infusie, een enkele ZYVOX 1200 mg dosis via een 1 uur durende IV-infusie, placebo en een enkele orale dosis positieve controle. Bij zowel de 600 mg als de 1200 mg ZYVOX 600 mg doses werd geen significant effect op het QTc-interval waargenomen bij de piekplasmaconcentratie of op enig ander moment.
Farmacokinetiek
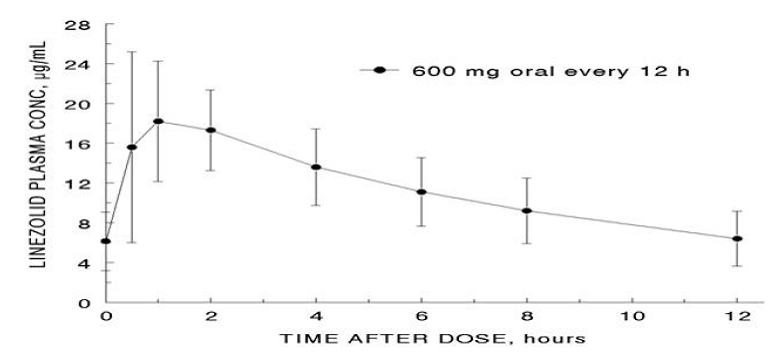
De gemiddelde farmacokinetische parameters van linezolid bij volwassenen na enkelvoudige en meervoudige orale en intraveneuze doses zijn samengevat in tabel 8. Plasmaconcentraties van linezolid bij steady-state na orale doses van 600 mg elke 12 uur worden weergegeven in afbeelding 1.
Figuur 1. Plasmaconcentraties van linezolid bij volwassenen in steady-state na orale dosering om de 12 uur (gemiddelde ± standaarddeviatie, n=16)
Absorptie
Linezolid wordt uitgebreid geabsorbeerd na orale toediening. Maximale plasmaconcentraties worden ongeveer 1 tot 2 uur na toediening bereikt en de absolute biologische beschikbaarheid is ongeveer 100%. Daarom kan linezolid oraal of intraveneus worden toegediend zonder dosisaanpassing.
Linezolid kan worden toegediend zonder rekening te houden met het tijdstip van maaltijden. De tijd om de maximale concentratie te bereiken wordt vertraagd van 1,5 uur tot 2,2 uur en de Cmax wordt met ongeveer 17% verlaagd wanneer vetrijk voedsel wordt gegeven met linezolid. De totale blootstelling gemeten als AUC0-∞ is echter onder beide omstandigheden vergelijkbaar.
Verdeling
Farmacokinetische studies bij dieren en mensen hebben aangetoond dat linezolid zich gemakkelijk verspreidt naar goed doorbloede weefsels. De plasma-eiwitbinding van linezolid is ongeveer 31% en is concentratieonafhankelijk. Het distributievolume van linezolid bij steady-state was gemiddeld 40 tot 50 liter bij gezonde volwassen vrijwilligers.
Linezolidconcentraties zijn vastgesteld in verschillende vloeistoffen van een beperkt aantal proefpersonen in fase 1-onderzoeken met vrijwilligers na meervoudige dosering van linezolid. De verhouding van linezolid in speeksel ten opzichte van plasma was 1,2 tot 1 en de verhouding van linezolid in zweet ten opzichte van plasma was 0,55 tot 1.
Metabolisme
Linezolid wordt voornamelijk gemetaboliseerd door oxidatie van de morfolinering, wat resulteert in twee inactieve ringopened carbonzuurmetabolieten: de aminoethoxyazijnzuurmetaboliet (A) en de hydroxyethylglycinemetaboliet (B). De vorming van metaboliet A wordt verondersteld te worden gevormd via een enzymatische route, terwijl metaboliet B in vitro wordt gemedieerd door een niet-enzymatisch chemisch oxidatiemechanisme. In vitro-onderzoeken hebben aangetoond dat linezolid minimaal wordt gemetaboliseerd en mogelijk wordt gemedieerd door humaan cytochroom P450. De metabole route van linezolid is echter niet volledig bekend.
uitscheiding
De niet-renale klaring is goed voor ongeveer 65% van de totale klaring van linezolid. Onder steady-state-omstandigheden verschijnt ongeveer 30% van de dosis in de urine als linezolid, 40% als metaboliet B en 10% als metaboliet A. De gemiddelde renale klaring van linezolid is 40 ml/min, wat wijst op netto tubulaire reabsorptie. Vrijwel geen linezolid verschijnt in de feces, terwijl ongeveer 6% van de dosis in de feces verschijnt als metaboliet B en 3% als metaboliet A.
Een kleine mate van niet-lineariteit in de klaring werd waargenomen bij toenemende doses linezolid, wat het gevolg lijkt te zijn van een lagere renale en niet-renale klaring van linezolid bij hogere concentraties. Het verschil in klaring was echter klein en werd niet weerspiegeld in de schijnbare eliminatiehalfwaardetijd.
Specifieke populaties
Geriatrische patiënten
De farmacokinetiek van linezolid is niet significant veranderd bij oudere patiënten (65 jaar of ouder). Daarom is dosisaanpassing voor geriatrische patiënten niet nodig.
Pediatrische patiënten
De farmacokinetiek van linezolid na een enkelvoudige intraveneuze dosis werd onderzocht bij pediatrische patiënten variërend in leeftijd vanaf de geboorte tot 17 jaar (inclusief premature en voldragen pasgeborenen), bij gezonde adolescenten in de leeftijd van 12 tot 17 jaar en bij pediatrische patiënten variërend in leeftijd van 1 week tot 12 jaar. De farmacokinetische parameters van linezolid zijn samengevat in Tabel 9 voor de onderzochte pediatrische populaties en gezonde volwassen proefpersonen na toediening van enkelvoudige intraveneuze doses.
De Cmax en het distributievolume (Vss) van linezolid zijn vergelijkbaar, ongeacht de leeftijd bij pediatrische patiënten. De plasmaklaring van linezolid varieert echter als functie van de leeftijd. Met uitsluiting van premature pasgeborenen jonger dan een week, is de klaring op basis van gewicht het snelst in de jongste leeftijdsgroepen, variërend van
Vergelijkbare gemiddelde dagelijkse AUC-waarden werden waargenomen bij pediatrische patiënten vanaf de geboorte tot 11 jaar die om de 8 uur werden gedoseerd in vergelijking met adolescenten of volwassenen die om de 12 uur werden gedoseerd. Daarom dient de dosering voor pediatrische patiënten tot 11 jaar 10 mg/kg om de 8 uur te zijn. Pediatrische patiënten van 12 jaar en ouder moeten elke 12 uur 600 mg krijgen [zie DOSERING EN ADMINISTRATIE ].
Geslacht
Vrouwen hebben een iets lager distributievolume van linezolid dan mannen. Plasmaconcentraties zijn hoger bij vrouwen dan bij mannen, wat deels te wijten is aan verschillen in lichaamsgewicht. Na een dosis van 600 mg is de gemiddelde orale klaring ongeveer 38% lager bij vrouwen dan bij mannen. Er zijn echter geen significante sekseverschillen in de gemiddelde schijnbare eliminatiesnelheidsconstante of halfwaardetijd. Daarom wordt niet verwacht dat de blootstelling aan geneesmiddelen bij vrouwen substantieel zal toenemen boven niveaus waarvan bekend is dat ze goed worden verdragen. Daarom lijkt dosisaanpassing naar geslacht niet nodig.
Nierfunctiestoornis
De farmacokinetiek van het oorspronkelijke geneesmiddel, linezolid, verandert niet bij patiënten met enige mate van nierinsufficiëntie; de twee primaire metabolieten van linezolid accumuleren echter bij patiënten met een nierfunctiestoornis, waarbij de hoeveelheid accumulatie toeneemt met de ernst van de nierfunctiestoornis (zie tabel 10). De farmacokinetiek van linezolid en zijn twee metabolieten is ook onderzocht bij patiënten met terminale nierziekte (ESRD) die hemodialyse ondergaan. In het ESRD-onderzoek kregen 14 patiënten gedurende 14,5 dagen elke 12 uur linezolid 600 mg toegediend (zie tabel 11). Omdat vergelijkbare plasmaconcentraties van linezolid worden bereikt ongeacht de nierfunctie, wordt geen dosisaanpassing aanbevolen voor patiënten met een nierfunctiestoornis. Gezien het ontbreken van informatie over de klinische betekenis van accumulatie van de primaire metabolieten, moet het gebruik van linezolid bij patiënten met een nierfunctiestoornis echter worden afgewogen tegen de mogelijke risico's van accumulatie van deze metabolieten. Zowel linezolid als de twee metabolieten worden geëlimineerd door hemodialyse. Er is geen informatie beschikbaar over het effect van peritoneale dialyse op de farmacokinetiek van linezolid. Ongeveer 30% van een dosis werd geëlimineerd in een hemodialysesessie van 3 uur, te beginnen 3 uur nadat de dosis linezolid was toegediend; daarom moet linezolid worden gegeven na hemodialyse.
Leverfunctiestoornis
De farmacokinetiek van linezolid verandert niet bij patiënten (n=7) met een lichte tot matige leverfunctiestoornis (Child-Pugh-klasse A of B). Op basis van de beschikbare informatie wordt geen dosisaanpassing aanbevolen voor patiënten met een lichte tot matige leverfunctiestoornis. De farmacokinetiek van linezolid bij patiënten met een ernstige leverfunctiestoornis is niet onderzocht.
Geneesmiddelinteracties
Geneesmiddelen gemetaboliseerd door cytochroom P450
Linezolid is geen inductor van cytochroom P450 (CYP450) bij ratten. Bovendien remt linezolid niet de activiteiten van klinisch significante humane CYP-isovormen (bijv. 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Daarom wordt niet verwacht dat linezolid de farmacokinetiek beïnvloedt van andere geneesmiddelen die door deze belangrijke enzymen worden gemetaboliseerd. Gelijktijdige toediening van linezolid verandert de farmacokinetische eigenschappen van (S)-warfarine, dat uitgebreid wordt gemetaboliseerd door CYP2C9, niet wezenlijk. Geneesmiddelen zoals warfarine en fenytoïne, die CYP2C9-substraten zijn, kunnen samen met linezolid worden gegeven zonder wijziging van het doseringsschema.
Antibacteriële geneesmiddelen
Aztreonam: De farmacokinetiek van linezolid of aztreonam verandert niet bij gelijktijdige toediening.
Gentamicine: De farmacokinetiek van linezolid of gentamicine verandert niet wanneer ze samen worden toegediend.
Antioxidanten
Het potentieel voor geneesmiddelinteracties met linezolid en de antioxidanten vitamine C en vitamine E werd onderzocht bij gezonde vrijwilligers. De proefpersonen kregen op dag 1 een orale dosis linezolid van 600 mg en op dag 8 nog een dosis linezolid van 600 mg. Op dag 2-9 kregen de proefpersonen vitamine C (1.000 mg/dag) of vitamine E (800 IE/dag). dag). De AUC0-∞ van linezolid nam met 2,3% toe bij gelijktijdige toediening met vitamine C en 10,9% bij gelijktijdige toediening met vitamine E. Er wordt geen dosisaanpassing van linezolid aanbevolen tijdens gelijktijdige toediening met vitamine C of vitamine E.
Sterke CYP 3A4-inductoren
rifampicijn
Het effect van rifampicine op de farmacokinetiek van linezolid werd geëvalueerd in een onderzoek bij 16 gezonde volwassen mannen. Vrijwilligers kregen oraal 600 mg linezolid tweemaal daags toegediend gedurende 5 doses met en zonder rifampicine 600 mg eenmaal daags gedurende 8 dagen. Gelijktijdige toediening van rifampicine met linezolid resulteerde in een afname van 21% in linezolid Cmax [90% BI, 15% - 27%] en een afname van 32% in linezolid AUC0-12 [90% BI, 27% - 37%]. De klinische betekenis van deze interactie is niet bekend. Het mechanisme van deze interactie is niet volledig begrepen en kan verband houden met de inductie van leverenzymen. Andere sterke inductoren van leverenzymen (bijv. carbamazepine, fenytoïne, fenobarbital) kunnen een vergelijkbare of kleinere afname van de blootstelling aan linezolid veroorzaken.
Monoamineoxidaseremming
Linezolid is een reversibele, niet-selectieve remmer van monoamineoxidase. Daarom heeft linezolid het potentieel voor interactie met adrenerge en serotonerge middelen.
Adrenerge middelen
Sommige personen die ZYVOX 600 mg krijgen, kunnen een omkeerbare verbetering van de pressorrespons op indirect werkende sympathicomimetica, vasopressor of dopaminerge middelen ervaren. Veelgebruikte geneesmiddelen zoals fenylpropanolamine en pseudo-efedrine zijn specifiek onderzocht. De aanvangsdoses van adrenerge middelen, zoals dopamine of epinefrine, moeten worden verlaagd en getitreerd om de gewenste respons te bereiken.
Tyramine
Een significante pressorrespons is waargenomen bij normale volwassen proefpersonen die linezolid- en tyraminedoses van meer dan 100 mg kregen. Daarom moeten patiënten die linezolid krijgen de consumptie van grote hoeveelheden voedsel of dranken met een hoog tyraminegehalte vermijden [zie PATIËNT INFORMATIE ].
Pseudo-efedrine HCl of fenylpropanolamine HCl
Een omkeerbare versterking van de pressorrespons van ofwel pseudo-efedrine HCl (PSE) of fenylpropanolamine HCl (PPA) wordt waargenomen wanneer linezolid wordt toegediend aan gezonde normotensieve proefpersonen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ]. Een soortgelijk onderzoek is niet uitgevoerd bij hypertensieve patiënten. De interactiestudies uitgevoerd bij normotensieve proefpersonen evalueerden de bloeddruk- en hartslageffecten van placebo, PPA of PSE alleen, linezolid alleen, en de combinatie van steady-state linezolid (600 mg elke 12 uur gedurende 3 dagen) met twee doses PPA ( 25 mg) of PSE (60 mg) gegeven met een tussenpoos van 4 uur. De hartslag werd door geen van de behandelingen beïnvloed. Bij beide combinatiebehandelingen was de bloeddruk verhoogd. Maximale bloeddrukniveaus werden 2 tot 3 uur na de tweede dosis PPA of PSE waargenomen en keerden 2 tot 3 uur na de piek terug naar de uitgangswaarde. De resultaten van het PPA-onderzoek volgen en tonen de gemiddelde (en bereik) maximale systolische bloeddruk in mm Hg: placebo = 121 (103 tot 158); linezolid alleen = 120 (107 tot 135); PPA alleen = 125 (106 tot 139); PPA met linezolid = 147 (129 tot 176). De resultaten van het PSE-onderzoek waren vergelijkbaar met die van het PPA-onderzoek. De gemiddelde maximale stijging van de systolische bloeddruk ten opzichte van baseline was 32 mm Hg (bereik: 20-52 mm Hg) en 38 mm Hg (bereik: 18-79 mm Hg) tijdens gelijktijdige toediening van linezolid met respectievelijk pseudo-efedrine of fenylpropanolamine.
Serotonerge middelen
dextromethorfan
De mogelijke geneesmiddelinteractie met dextromethorfan werd onderzocht bij gezonde vrijwilligers. De proefpersonen kregen dextromethorfan (twee doses van 20 mg gegeven met een tussenpoos van 4 uur) met of zonder linezolid. Er zijn geen effecten van het serotoninesyndroom (verwardheid, delirium, rusteloosheid, tremoren, blozen, diaforese, hyperpyrexie) waargenomen bij normale proefpersonen die linezolid en dextromethorfan kregen.
Microbiologie
Werkingsmechanisme
Linezolid is een synthetisch antibacterieel middel van de oxazolidinonklasse, dat klinisch bruikbaar is bij de behandeling van infecties veroorzaakt door aerobe Gram-positieve bacteriën. Het in vitro activiteitsspectrum van linezolid omvat ook bepaalde Gram-negatieve bacteriën en anaërobe bacteriën. Linezolid bindt zich aan een plaats op het bacteriële 23S-ribosomale RNA van de 50S-subeenheid en voorkomt de vorming van een functioneel 70S-initiatiecomplex, dat essentieel is voor bacteriële reproductie. De resultaten van time-kill-onderzoeken hebben aangetoond dat linezolid bacteriostatisch is tegen enterokokken en stafylokokken. Voor streptokokken bleek linezolid voor de meeste isolaten bactericide te zijn.
Weerstand
In vitro-onderzoeken hebben aangetoond dat puntmutaties in het 23S-rRNA geassocieerd zijn met linezolid-resistentie. Er zijn meldingen gepubliceerd van vancomycineresistente Enterococcus faecium die resistent worden tegen linezolid tijdens klinisch gebruik. Er zijn meldingen van Staphylococcus aureus (methicilline-resistent) die resistentie ontwikkelt tegen linezolid tijdens klinisch gebruik. De linezolidenresistentie bij deze organismen is geassocieerd met een puntmutatie in het 23S-rRNA (substitutie van thymine voor guanine op positie 2576) van het organisme. Organismen die resistent zijn tegen oxazolidinonen via mutaties in chromosomale genen die coderen voor 23S-rRNA of ribosomale eiwitten (L3 en L4) zijn over het algemeen kruisresistent tegen linezolid. Ook linezolidresistentie bij stafylokokken, gemedieerd door het enzym methyltransferase, is gemeld. Deze resistentie wordt gemedieerd door het cfr-gen (chlooramfenicol-florfenicol) dat zich op een plasmide bevindt dat overdraagbaar is tussen stafylokokken.
Interactie met andere antimicrobiële geneesmiddelen
In vitro-onderzoeken hebben additiviteit of onverschilligheid aangetoond tussen linezolid en vancomycine, gentamicine, rifampicine, imipenem-cilastatine, aztreonam, ampicilline of streptomycine.
Van linezolid is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen, zowel in vitro als bij klinische infecties [zie INDICATIES ].
Gram-positieve bacteriën
Enterococcus faecium (alleen vancomycine-resistente isolaten) Staphylococcus aureus (inclusief meticilline-resistente isolaten) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Meer dan 90% van de volgende bacteriën vertonen een in vitro MIC die kleiner is dan of gelijk is aan het linezolid-gevoelige breekpunt voor organismen van een vergelijkbaar geslacht. De veiligheid en werkzaamheid van linezolid bij de behandeling van klinische infecties veroorzaakt door deze bacteriën zijn niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Enterococcus faecalis (inclusief vancomycine-resistente isolaten) Enterococcus faecium (vancomycine-gevoelige isolaten) Staphylococcus epidermidis (inclusief methicilline-resistente isolaten) Staphylococcus haemolyticus Viridans-groep streptokokken
Gram-negatieve bacteriën
Pasteurella multocida
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Dierlijke toxicologie en/of farmacologie
De doelorganen van linezolid-toxiciteit waren vergelijkbaar bij juveniele en volwassen ratten en honden. Dosis- en tijdafhankelijke myelosuppressie, zoals aangetoond door hypocellulariteit van het beenmerg/verminderde hematopoëse, verminderde extramedullaire hematopoëse in milt en lever, en verlaagde niveaus van circulerende erytrocyten, leukocyten en bloedplaatjes zijn waargenomen in dierstudies. Lymfoïde uitputting trad op in de thymus, lymfeklieren en milt. Over het algemeen werden de lymfoïde bevindingen geassocieerd met anorexia, gewichtsverlies en onderdrukking van de toename van het lichaamsgewicht, wat mogelijk heeft bijgedragen aan de waargenomen effecten.
Bij ratten die gedurende 6 maanden oraal linezolid kregen toegediend, werd niet-reversibele, minimale tot milde axonale degeneratie van heupzenuwen waargenomen bij 80 mg/kg/dag; minimale degeneratie van de heupzenuw werd ook waargenomen bij 1 man op dit dosisniveau bij een tussentijdse necropsie van 3 maanden. Gevoelige morfologische evaluatie van perfusie-gefixeerde weefsels werd uitgevoerd om bewijs van oogzenuwdegeneratie te onderzoeken. Minimale tot matige degeneratie van de oogzenuw was duidelijk bij 2 mannelijke ratten na 6 maanden dosering, maar de directe relatie met het geneesmiddel was twijfelachtig vanwege de acute aard van de bevinding en de asymmetrische verdeling ervan. De waargenomen zenuwdegeneratie was microscopisch vergelijkbaar met spontane eenzijdige degeneratie van de oogzenuw die werd gerapporteerd bij ouder wordende ratten en kan een verergering zijn van veel voorkomende achtergrondveranderingen.
Deze effecten werden waargenomen bij blootstellingsniveaus die vergelijkbaar zijn met die waargenomen bij sommige mensen. De hematopoëtische en lymfoïde effecten waren omkeerbaar, hoewel in sommige onderzoeken de omkering onvolledig was binnen de duur van de herstelperiode.
Klinische studies
volwassenen
Nosocomiale pneumonie
Volwassen patiënten met klinisch en radiologisch gedocumenteerde nosocomiale pneumonie werden opgenomen in een gerandomiseerde, multicenter, dubbelblinde studie. Patiënten werden gedurende 7 tot 21 dagen behandeld. Eén groep kreeg elke 12 uur ZYVOX IV-injectie 600 mg en de andere groep kreeg elke 12 uur intraveneus vancomycine 1 g. Beide groepen kregen gelijktijdig aztreonam (1 tot 2 g elke 8 uur intraveneus), wat kon worden voortgezet indien klinisch geïndiceerd. Er waren 203 met linezolid behandelde en 193 vancomycine behandelde patiënten die deelnamen aan het onderzoek. Honderdtweeëntwintig (60%) met linezolid behandelde patiënten en 103 (53%) vancomycine behandelde patiënten waren klinisch evalueerbaar. De genezingspercentages bij klinisch evalueerbare patiënten waren 57% voor met linezolid behandelde patiënten en 60% voor vancomycine behandelde patiënten. De genezingspercentages bij klinisch evalueerbare patiënten met ventilator-geassocieerde pneumonie waren 47% voor met linezolid behandelde patiënten en 40% voor vancomycine behandelde patiënten. Een gemodificeerde intent-to-treat (MITT)-analyse van 94 met linezolid behandelde patiënten en 83 vancomycine behandelde patiënten omvatte proefpersonen bij wie een pathogeen vóór de behandeling was geïsoleerd. De genezingspercentages in de MITT-analyse waren 57% bij met linezolid behandelde patiënten en 46% bij met vancomycine behandelde patiënten. De genezingspercentages per pathogeen voor microbiologisch evalueerbare patiënten worden weergegeven in Tabel 12.
Gecompliceerde huid- en huidstructuurinfecties
Volwassen patiënten met klinisch gedocumenteerde gecompliceerde huid- en huidstructuurinfecties werden geïncludeerd in een gerandomiseerde, multicenter, dubbelblinde, dubbel-dummy studie waarin studiemedicatie werd vergeleken die intraveneus werd toegediend, gevolgd door orale medicatie gedurende een totale behandeling van 10 tot 21 dagen. Eén groep patiënten kreeg elke 12 uur ZYVOX IV-injectie 600 mg gevolgd door ZYVOX 600 mg tabletten 600 mg elke 12 uur; de andere groep kreeg elke 6 uur oxacilline 2 g intraveneus gevolgd door oraal dicloxacilline 500 mg elke 6 uur. Patiënten kunnen gelijktijdig aztreonam krijgen indien klinisch geïndiceerd. Er waren 400 met linezolid behandelde en 419 met oxacilline behandelde patiënten die deelnamen aan het onderzoek. Tweehonderdvijfenveertig (61%) met linezolid behandelde patiënten en 242 (58%) met oxacilline behandelde patiënten waren klinisch evalueerbaar. De genezingspercentages bij klinisch evalueerbare patiënten waren 90% bij met linezolid behandelde patiënten en 85% bij met oxacilline behandelde patiënten. Een gemodificeerde intent-to-treat (MITT)-analyse van 316 met linezolid behandelde patiënten en 313 met oxacilline behandelde patiënten omvatte proefpersonen die voldeden aan alle criteria voor deelname aan het onderzoek. De genezingspercentages in de MITT-analyse waren 86% bij met linezolid behandelde patiënten en 82% bij met oxacilline behandelde patiënten. De genezingspercentages per pathogeen voor microbiologisch evalueerbare patiënten worden weergegeven in Tabel 13.
Een afzonderlijke studie leverde aanvullende ervaring op met het gebruik van ZYVOX bij de behandeling van methicilline-resistente Staphylococcus aureus (MRSA)-infecties. Dit was een gerandomiseerde, open-label studie bij gehospitaliseerde volwassen patiënten met gedocumenteerde of vermoede MRSA-infectie.
Eén groep patiënten kreeg elke 12 uur ZYVOX IV-injectie 600 mg gevolgd door ZYVOX-tabletten 600 mg elke 12 uur. De andere groep patiënten kreeg elke 12 uur intraveneus 1 g vancomycine. Beide groepen werden gedurende 7 tot 28 dagen behandeld en konden indien klinisch geïndiceerd gelijktijdig aztreonam of gentamicine krijgen. De genezingspercentages bij microbiologisch evalueerbare patiënten met MRSA huid- en huidstructuurinfectie waren 26/33 (79%) voor met linezolid behandelde patiënten en 24/33 (73%) voor vancomycine behandelde patiënten.
Diabetische voetinfecties
Volwassen diabetespatiënten met klinisch gedocumenteerde gecompliceerde huid- en huidstructuurinfecties (“diabetische voetinfecties”) werden geïncludeerd in een gerandomiseerde (2:1 ratio), multicenter, open-label studie waarin studiemedicatie werd vergeleken die intraveneus of oraal werd toegediend voor in totaal 14 tot 28 dagen behandeling. Eén groep patiënten kreeg elke 12 uur ZYVOX 600 mg intraveneus of oraal; de andere groep kreeg ampicilline/sulbactam 1,5 tot 3 g intraveneus of amoxicilline/clavulanaat 500 tot 875 mg om de 8 tot 12 uur oraal. In landen waar ampicilline/sulbactam niet in de handel is, werd amoxicilline/clavulanaat 500 mg tot 2 g elke 6 uur gebruikt voor de intraveneuze behandeling. Patiënten in de vergelijkingsgroep konden ook intraveneus worden behandeld met 1 g vancomycine om de 12 uur als MRSA uit de voetinfectie werd geïsoleerd. Patiënten in beide behandelingsgroepen die Gram-negatieve bacillen hadden geïsoleerd van de infectieplaats, konden ook elke 8-12 uur aztreonam 1 tot 2 g intraveneus krijgen. Alle patiënten kwamen in aanmerking voor geschikte aanvullende behandelingsmethoden, zoals debridement en ontladen, zoals typisch vereist bij de behandeling van diabetische voetinfecties, en de meeste patiënten kregen deze behandelingen. Er waren 241 met linezolid behandelde en 120 met vergelijkende middelen behandelde patiënten in de intent-to-treat (ITT)-onderzoekspopulatie. Tweehonderdtwaalf (86%) met linezolid behandelde patiënten en 105 (85%) met vergelijkingsmiddel behandelde patiënten waren klinisch evalueerbaar. In de ITT-populatie waren de genezingspercentages 68,5% (165/241) bij met linezolid behandelde patiënten en 64% (77/120) bij patiënten behandeld met comparator, waarbij degenen met onbepaalde en ontbrekende resultaten als mislukkingen werden beschouwd. De genezingspercentages bij de klinisch evalueerbare patiënten (exclusief die met onbepaalde en ontbrekende uitkomsten) waren respectievelijk 83% (159/192) en 73% (74/101) bij de met linezolid en comparator behandelde patiënten. Een kritische post-hocanalyse was gericht op 121 met linezolid behandelde en 60 met comparator behandelde patiënten met een Gram-positieve pathogeen geïsoleerd uit de plaats van infectie of uit bloed, die minder aanwijzingen hadden voor onderliggende osteomyelitis dan de totale onderzoekspopulatie, en die geen verboden antimicrobiële middelen hebben gekregen. Op basis van die analyse waren de genezingspercentages 71% (86/121) bij de met linezolid behandelde patiënten en 63% (38/60) bij de met het vergelijkingsmiddel behandelde patiënten. Geen van de bovenstaande analyses is aangepast voor het gebruik van aanvullende therapieën. De genezingspercentages per pathogeen voor microbiologisch evalueerbare patiënten worden weergegeven in Tabel 14.
Vancomycine-resistente enterokokkeninfecties
Volwassen patiënten met gedocumenteerde of vermoede vancomycine-resistente enterokokkeninfectie werden opgenomen in een gerandomiseerde, multicenter, dubbelblinde studie waarin een hoge dosis ZYVOX (600 mg) werd vergeleken met een lage dosis ZYVOX (200 mg) die om de 12 uur werd gegeven. intraveneus (IV) of oraal gedurende 7 tot 28 dagen. Patiënten kunnen gelijktijdig aztreonam of aminoglycosiden krijgen. Er waren 79 patiënten gerandomiseerd naar een hoge dosis linezolid en 66 naar een lage dosis linezolid. De intent-to-treat (ITT)-populatie met gedocumenteerde vancomycine-resistente enterokokkeninfectie bij aanvang bestond uit 65 patiënten in de arm met hoge dosis en 52 in de arm met lage dosis.
De genezingspercentages voor de ITT-populatie met gedocumenteerde vancomycineresistente enterokokkeninfectie bij aanvang worden weergegeven in Tabel 15 per infectiebron. Deze genezingspercentages zijn exclusief patiënten met ontbrekende of onbepaalde resultaten. Het genezingspercentage was hoger in de arm met hoge dosis dan in de arm met lage dosis, hoewel het verschil niet statistisch significant was op het niveau van 0,05.
Pediatrische patiënten
Infecties veroorzaakt door Gram-positieve bacteriën
Een veiligheids- en werkzaamheidsonderzoek leverde ervaring op met het gebruik van ZYVOX 600 mg bij pediatrische patiënten voor de behandeling van nosocomiale pneumonie, gecompliceerde huid- en huidstructuurinfecties en andere infecties als gevolg van Gram-positieve bacteriële pathogenen, waaronder methicilline-resistente en -gevoelige Staphylococcus aureus en vancomycine-resistente Enterococcus faecium. Pediatrische patiënten variërend in leeftijd vanaf de geboorte tot 11 jaar met infecties veroorzaakt door de gedocumenteerde of vermoede Gram-positieve bacteriën werden opgenomen in een gerandomiseerde, openPage-label, vergelijkende gecontroleerde studie. Eén groep patiënten kreeg elke 8 uur ZYVOX 600 mg IV-injectie 10 mg/kg, gevolgd door ZYVOX 600 mg voor orale suspensie 10 mg/kg elke 8 uur. Een tweede groep kreeg vancomycine 10 tot 15 mg/kg intraveneus om de 6 tot 24 uur, afhankelijk van leeftijd en renale klaring. Patiënten met bevestigde VRE-infecties werden in een derde arm van het onderzoek geplaatst en kregen elke 8 uur ZYVOX 10 mg/kg intraveneus en/of oraal. Alle patiënten werden in totaal 10 tot 28 dagen behandeld en konden gelijktijdig Gram-negatieve antibacteriële geneesmiddelen krijgen indien klinisch geïndiceerd. In de intent-to-treat-populatie (ITT) werden 206 patiënten gerandomiseerd naar linezolid en 102 patiënten gerandomiseerd naar vancomycine. De genezingspercentages voor ITT, MITT en klinisch evalueerbare patiënten worden weergegeven in Tabel 16. Nadat het onderzoek was voltooid, werden 13 extra patiënten in de leeftijd van 4 dagen tot 16 jaar ingeschreven in een open-label extensie van de VRE-arm van de studie. Tabel 17 geeft klinische genezingspercentages per pathogeen voor microbiologisch evalueerbare patiënten, inclusief microbiologisch evalueerbare patiënten met vancomycine-resistente Enterococcus faecium uit de uitbreiding van dit onderzoek.
PATIËNT INFORMATIE
Belangrijke administratie-instructies
Adviseer patiënten dat ZYVOX met of zonder voedsel kan worden ingenomen.
Perifere en optische neuropathie
Adviseer patiënten om hun arts te informeren als ze veranderingen in het gezichtsvermogen ervaren tijdens het gebruik van ZYVOX [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
serotonine syndroom
Adviseer patiënten om hun arts te informeren als ze serotonerge middelen gebruiken, waaronder serotonineheropnameremmers of andere antidepressiva en opioïden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Potentiële interacties die een verhoging van de bloeddruk veroorzaken
- Adviseer patiënten om hun arts te informeren als ze een voorgeschiedenis van hypertensie hebben.
- Adviseer patiënten om grote hoeveelheden voedsel of dranken met een hoog tyraminegehalte te vermijden tijdens het gebruik van ZYVOX. Voedingsmiddelen met een hoog tyraminegehalte omvatten voedingsmiddelen die eiwitveranderingen hebben ondergaan door veroudering, fermentatie, beitsen of roken om de smaak te verbeteren, zoals oude kazen, gefermenteerd of aan de lucht gedroogd vlees, zuurkool, sojasaus, tapbieren en rode wijnen. Het tyraminegehalte van eiwitrijk voedsel kan worden verhoogd als het gedurende lange tijd wordt bewaard of als het niet goed wordt gekoeld.
- Adviseer patiënten om hun arts te informeren als ze medicijnen gebruiken die pseudo-efedrine HCl of fenylpropanolamine HCl bevatten, zoals verkoudheidsmiddelen en decongestiva [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Melkzuuracidose
Adviseer patiënten om hun arts te informeren als ze herhaalde episodes van misselijkheid of braken ervaren tijdens het gebruik van ZYVOX [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
stuiptrekkingen
Adviseer patiënten om hun arts te informeren als ze een voorgeschiedenis hebben van epileptische aanvallen of convulsies [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypoglykemie
Adviseer patiënten om hun arts te informeren als ze diabetes mellitus hebben. Hypoglykemische reacties, zoals diaforese en trillen, samen met lage bloedglucosemetingen kunnen optreden bij behandeling met linezolid. Als dergelijke reacties optreden, moeten patiënten contact opnemen met een arts of andere gezondheidswerker voor een juiste behandeling [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hyponatriëmie en/of SIADH
Adviseer patiënten met een risico op hyponatriëmie om hun arts te informeren als ze tekenen en symptomen van hyponatriëmie en/of SIADH ervaren, waaronder verwardheid, slaperigheid, algemene zwakte en ademnood [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
fenylketonurie
Adviseer patiënten met fenylketonurie (PKU) dat elke 5 ml van de 100 mg/5 ml ZYVOX voor orale suspensie 20 mg fenylalanine bevat. De andere ZYVOX 600 mg formuleringen bevatten geen fenylalanine. Fenylalanine kan schadelijk zijn voor patiënten met fenylketonurie. Neem contact op met uw arts of apotheker wanneer ZYVOX 600 mg voor orale suspensie is voorgeschreven [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Antibacteriële resistentie
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder ZYVOX, alleen mogen worden gebruikt voor de behandeling van bacteriële infecties. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer ZYVOX 600 mg wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan de effectiviteit van de onmiddellijke behandeling verminderen en de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met ZYVOX of andere antibacteriële geneesmiddelen kunnen worden behandeld.
Diarree
Diarree is een veelvoorkomend probleem dat wordt veroorzaakt door antibacteriële geneesmiddelen, dat meestal stopt wanneer het antibacteriële geneesmiddel wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibacteriële geneesmiddelen waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibacteriële geneesmiddel hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Onvruchtbaarheid
Adviseer mannelijke patiënten dat ZYVOX de vruchtbaarheid omkeerbaar kan verminderen [zie: Gebruik bij specifieke populaties ].
De etikettering van dit product is mogelijk bijgewerkt. Ga voor de meest recente voorschrijfinformatie naar www.pfizer.com.
