Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Myambutol en hoe wordt het gebruikt?
Myambutol is een receptgeneesmiddel dat wordt gebruikt om de symptomen van tuberculose te behandelen. Myambutol 400 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Myambutol behoort tot een klasse geneesmiddelen die antituberculosemiddelen worden genoemd.
Het is niet bekend of Myambutol 800 mg veilig en effectief is bij kinderen jonger dan 13 jaar.
Wat zijn de mogelijke bijwerkingen van Myambutol 800 mg?
Myambutol kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- zichtproblemen,
- verlies van gezichtsvermogen dat permanent kan zijn,
- wazig zien,
- moeite met focussen,
- verlies van gezichtsvermogen in één oog dat een uur of langer aanhoudt,
- verhoogde gevoeligheid van uw ogen voor licht,
- verlies van kleurenzicht,
- pijn bij oogbewegingen,
- pijn achter de ogen,
- nieuwe of verergerende hoest met koorts,
- gevoelloosheid van tintelingen in uw handen of voeten,
- verwardheid,
- hallucinaties,
- koorts,
- opgezwollen klieren,
- pijnlijke zweertjes in de mond,
- huidzweren,
- symptomen van verkoudheid of griep,
- algemeen ziek gevoel,
- gemakkelijk blauwe plekken of bloedingen,
- neusbloedingen,
- bloedend tandvlees,
- weinig of niet plassen,
- pijn in de bovenbuik,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- keelpijn,
- brandend in je ogen,
- huid pijn,
- rode of paarse huiduitslag die zich uitbreidt (vooral in het gezicht of bovenlichaam) en blaarvorming en vervelling veroorzaakt,
- pijn op de borst, en
- kortademigheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Myambutol zijn:
- jeuk,
- uitslag,
- gewrichtspijn,
- hoofdpijn,
- duizeligheid,
- misselijkheid,
- braken,
- buikpijn,
- indigestie, en
- verlies van eetlust
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Myambutol. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
MYAMBUTOL (ethambutolhydrochloride) is een oraal chemotherapeutisch middel dat specifiek effectief is tegen actief groeiende micro-organismen van het geslacht Mycobacterium, waaronder M. tuberculosis. De structuurformule is:
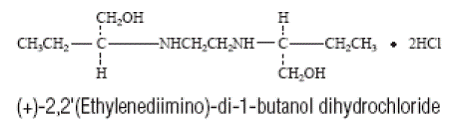
MYAMBUTOL (ethambutolhydrochloride) 100 en 400 mg tabletten bevatten de volgende inactieve ingrediënten: gelatine, hydroxypropylmethylcellulose, magnesiumstearaat, natriumlaurylsulfaat, sorbitol, stearinezuur, sucrose, titaniumdioxide en andere ingrediënten.
INDICATIES
MYAMBUTOL is geïndiceerd voor de behandeling van longtuberculose. Het mag niet worden gebruikt als het enige antituberculeuze geneesmiddel, maar moet worden gebruikt in combinatie met ten minste één ander antituberculosegeneesmiddel. Selectie van het begeleidende geneesmiddel moet gebaseerd zijn op klinische ervaring, overwegingen van vergelijkende veiligheid en geschikte in vitro gevoeligheidsonderzoeken. Bij patiënten die niet eerder een antituberculeuze therapie hebben gekregen, dwz een initiële behandeling, waren de meest gebruikte regimes de volgende:
MYAMBUTOL plus isoniazide
MYAMBUTOL 800 mg plus isoniazide plus streptomycine.
Bij patiënten die eerder een antituberculeuze therapie hebben gekregen, komt mycobacteriële resistentie tegen andere geneesmiddelen die bij de initiële therapie worden gebruikt vaak voor. Daarom moet MYAMBUTOL bij dergelijke herbehandelingspatiënten worden gecombineerd met ten minste één van de tweedelijnsgeneesmiddelen die niet eerder aan de patiënt zijn toegediend en waarvoor bacteriële gevoeligheid is aangegeven door geschikte in-vitro-onderzoeken. Antituberculeuze geneesmiddelen die met MYAMBUTOL worden gebruikt, omvatten cycloserine, ethionamide, pyrazinamide, viomycine en andere geneesmiddelen. Isoniazide, aminosalicylzuur en streptomycine zijn ook gebruikt in meerdere geneesmiddelenregimes. Afwisselende medicijnregimes zijn ook gebruikt.
DOSERING EN ADMINISTRATIE
MYAMBUTOL 200 mg mag niet alleen worden gebruikt, bij de eerste behandeling of bij herbehandeling. MYAMBUTOL 400 mg mag slechts eenmaal per 24 uur worden toegediend. De absorptie wordt niet significant veranderd door toediening met voedsel. De therapie moet in het algemeen worden voortgezet totdat bacteriologische conversie permanent is geworden en maximale klinische verbetering is opgetreden.
MYAMBUTOL wordt niet aanbevolen voor gebruik bij pediatrische patiënten jonger dan dertien jaar, aangezien er geen veilige gebruiksvoorwaarden zijn vastgesteld.
Eerste behandeling: Bij patiënten die geen eerdere antituberculeuze therapie hebben gekregen, dien MYAMBUTOL 15 mg/kg (7 mg/lb) lichaamsgewicht toe als een enkele orale dosis eenmaal per 24 uur. In de meer recente onderzoeken werd isoniazide gelijktijdig toegediend in een enkele, dagelijkse, orale dosis.
Herbehandeling: Bij patiënten die eerder een antituberculeuze therapie hebben gekregen, dien MYAMBUTOL 25 mg/kg (11 mg/lb) lichaamsgewicht toe als een enkele orale dosis eenmaal per 24 uur. Gelijktijdig ten minste één ander antituberculosegeneesmiddel toedienen waarvoor de organismen door geschikte in-vitrotests gevoelig zijn gebleken. Geschikte geneesmiddelen bestaan gewoonlijk uit geneesmiddelen die niet eerder bij de behandeling van de patiënt zijn gebruikt. Na 60 dagen toediening van MYAMBUTOL 600 mg, de dosis verlagen tot 15 mg/kg (7 mg/lb) lichaamsgewicht en eenmaal per 24 uur als een enkele orale dosis toedienen.
Gedurende de periode dat een patiënt een dagelijkse dosis van 25 mg/kg gebruikt, worden maandelijkse oogonderzoeken geadviseerd.
Zie tabel voor eenvoudige keuze van tablet(ten) met een juiste dosering.
Gewicht-dosistabel
HOE GELEVERD
Ethambutolhydrochloride-tabletten USP
100 mg – ronde, bolle, witte, filmomhulde tabletten met aan één kant E6 gegraveerd, worden als volgt geleverd:
NDC 54879-001-01 - Fles van 100 NDC 54879-001-00 - 10 Blisterverpakkingen x 10 tabletten
400 mg – ronde, bolle, witte, filmomhulde tabletten met breukgleuf, gegraveerd met E aan de linkerkant en 7 aan de rechterkant van de breukgleuf aan één kant, worden als volgt geleverd:
NDC 54879-002-01 - Fles van 100 NDC 54879-002-00 - 10 blisterverpakkingen x 10 tabletten
Bewaren bij een gecontroleerde kamertemperatuur van 20° tot 25°C (68° tot 77°F).
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088
Gefabriceerd voor en gedistribueerd door: STI Pharma, LLC Langhorne, PA 19047. Herzien maart 2013
BIJWERKINGEN
MYAMBUTOL kan een afname van de gezichtsscherpte veroorzaken, waaronder onomkeerbare blindheid, die het gevolg lijkt te zijn van optische neuritis. Optische neuropathie, waaronder optische neuritis of retrobulbaire neuritis die optreedt in samenhang met behandeling met ethambutol, kan worden gekenmerkt door een of meer van de volgende gebeurtenissen: verminderde gezichtsscherpte, scotoom, kleurenblindheid en/of gezichtsafwijking. Deze voorvallen zijn ook gemeld bij afwezigheid van een diagnose van optische of retrobulbaire neuritis.
Patiënten moeten worden geadviseerd om elke verandering van gezichtsscherpte onmiddellijk aan hun arts te melden.
De verandering in gezichtsscherpte kan eenzijdig of bilateraal zijn en daarom moet elk oog afzonderlijk worden getest en beide ogen samen. Het testen van de gezichtsscherpte moet worden uitgevoerd voordat de behandeling met MYAMBUTOL wordt gestart en periodiek tijdens de toediening van het geneesmiddel, behalve dat het maandelijks moet worden gedaan wanneer een patiënt een dosering van meer dan 15 mg per kilogram per dag gebruikt. Snellen-oogkaarten worden aanbevolen voor het testen van de gezichtsscherpte. Studies hebben aangetoond dat er duidelijke schommelingen zijn van één of twee lijnen van de Snellen-kaart in de gezichtsscherpte van veel tuberculeuze patiënten die geen MYAMBUTOL krijgen.

De volgende tabel kan nuttig zijn bij het interpreteren van mogelijke veranderingen in de gezichtsscherpte die kunnen worden toegeschreven aan MYAMBUTOL.
Over het algemeen kunnen veranderingen in de gezichtsscherpte die kleiner zijn dan die aangegeven onder "Aanzienlijk aantal lijnen" en "Verminder aantal punten" te wijten zijn aan toevalsvariatie, beperkingen van de testmethode of fysiologische variabiliteit. Omgekeerd duiden veranderingen in gezichtsscherpte die gelijk zijn aan of groter zijn dan die onder "Aanzienlijk aantal lijnen" en "Verminder aantal punten" op de noodzaak van opnieuw testen en zorgvuldige evaluatie van de visuele status van de patiënt. Als zorgvuldige evaluatie de omvang van de visuele verandering bevestigt en geen andere oorzaak aan het licht brengt, moet de behandeling met MYAMBUTOL 400 mg worden stopgezet en moet de patiënt met regelmatige tussenpozen opnieuw worden beoordeeld. Er moet worden aangenomen dat progressieve afname van de gezichtsscherpte tijdens de therapie te wijten is aan MYAMBUTOL.
Als er voorafgaand aan de behandeling een corrigerende bril wordt gebruikt, moet deze worden gedragen tijdens het testen van de gezichtsscherpte. Gedurende 1 tot 2 jaar therapie kan zich een brekingsfout ontwikkelen die gecorrigeerd moet worden om nauwkeurige testresultaten te verkrijgen. Het testen van de gezichtsscherpte door een gaatje elimineert brekingsfouten. Patiënten die een visuele afwijking ontwikkelen tijdens behandeling met MYAMBUTOL 800 mg kunnen subjectieve visuele symptomen vertonen vóór of gelijktijdig met het aantonen van afname van de gezichtsscherpte, en alle patiënten die MYAMBUTOL krijgen, moeten periodiek worden ondervraagd over wazig zien en andere subjectieve oogsymptomen.
Herstel van de gezichtsscherpte treedt over het algemeen op gedurende een periode van weken tot maanden nadat het medicijn is stopgezet. Sommige patiënten hebben MYAMBUTOL (ethambutolhydrochloride) opnieuw gekregen na een dergelijk herstel zonder herhaling van verlies van gezichtsscherpte.
Andere gemelde bijwerkingen zijn: overgevoeligheid, anafylactische/anafylactoïde reactie, dermatitis, erythema multiforme, pruritus en gewrichtspijn; anorexia, misselijkheid, braken, gastro-intestinale klachten en buikpijn; koorts, malaise, hoofdpijn en duizeligheid; mentale verwarring, desoriëntatie en mogelijke hallucinaties; trombocytopenie, leukopenie en neutropenie. Gevoelloosheid en tintelingen van de ledematen als gevolg van perifere neuritis zijn gemeld.
Verhoogde serumurinezuurspiegels treden op en precipitatie van acute jicht is gemeld. Longinfiltraten, met of zonder eosinofilie, zijn ook gemeld tijdens behandeling met MYAMBUTOL. Levertoxiciteit, inclusief dodelijke afloop, is gemeld (zie: WAARSCHUWINGEN .) Aangezien MYAMBUTOL 400 mg wordt aanbevolen voor therapie in combinatie met een of meer andere antituberculeuze geneesmiddelen, kunnen deze veranderingen verband houden met de gelijktijdige therapie. Overgevoeligheidssyndroom bestaande uit een huidreactie (zoals huiduitslag of exfoliatieve dermatitis), eosinofilie en een of meer van de volgende: hepatitis, pneumonitis, nefritis, myocarditis, pericarditis. Koorts en lymfadenopathie kunnen aanwezig zijn.
DRUG-INTERACTIES
De resultaten van een onderzoek naar gelijktijdige toediening van MYAMBUTOL (50 mg/kg) met een aluminiumhydroxide bevattend antacidum aan 13 patiënten met tuberculose toonden een verlaging van de gemiddelde serumconcentraties en de urinaire excretie van ethambutol van respectievelijk ongeveer 20% en 13%, wat suggereert dat de orale absorptie van ethambutol kan worden verminderd door deze antacidumproducten. Het wordt aanbevolen om gelijktijdige toediening van ethambutol en aluminiumhydroxidebevattende antacida te vermijden gedurende ten minste 4 uur na toediening van ethambutol.
WAARSCHUWINGEN
MYAMBUTOL 600 mg kan een vermindering van de gezichtsscherpte veroorzaken die het gevolg lijkt te zijn van optische neuritis. Dit effect kan verband houden met de dosis en de duur van de behandeling. Dit effect is over het algemeen omkeerbaar wanneer de toediening van het geneesmiddel onmiddellijk wordt stopgezet. Er is echter onomkeerbare blindheid gemeld. (Zien PREVENTIEVE MAATREGELEN en ONGEWENSTE REACTIES ).
Levertoxiciteit, waaronder dodelijke slachtoffers, zijn gemeld (zie: ONGEWENSTE REACTIES ). Er moet een baseline en periodieke beoordeling van de leverfunctie worden uitgevoerd.
PREVENTIEVE MAATREGELEN
MYAMBUTOL 800 mg ethambutolhydrochloride wordt niet aanbevolen voor gebruik bij pediatrische patiënten jonger dan dertien jaar, aangezien er geen veilige gebruiksvoorwaarden zijn vastgesteld.
Patiënten met een verminderde nierfunctie hebben een verlaging van de dosering nodig, zoals bepaald door de serumspiegels van MYAMBUTOL, aangezien de belangrijkste weg van uitscheiding van dit geneesmiddel door de nieren is.
Omdat dit medicijn nadelige effecten kan hebben op het gezichtsvermogen, moet lichamelijk onderzoek oogheelkunde, vingerperimetrie en het testen van kleurdiscriminatie omvatten. Bij patiënten met visuele defecten zoals cataracten, terugkerende ontstekingsaandoeningen van het oog, optische neuritis en diabetische retinopathie, is de evaluatie van veranderingen in gezichtsscherpte moeilijker en moet ervoor worden gezorgd dat de variaties in het gezichtsvermogen niet te wijten zijn aan de onderliggende ziektetoestanden. Bij dergelijke patiënten moet rekening worden gehouden met de relatie tussen verwachte voordelen en mogelijke visuele achteruitgang, aangezien de beoordeling van visuele veranderingen moeilijk is. (Voor aanbevolen procedures, zie de volgende paragrafen onder) ONGEWENSTE REACTIES ).
Zoals met elk krachtig medicijn, moeten baseline en periodieke beoordeling van de functies van het orgaansysteem, inclusief nier-, lever- en hematopoëtische eigenschappen, worden uitgevoerd.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C.
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Er zijn meldingen van oogafwijkingen die optreden bij baby's van vrouwen die een antituberculeuze therapie ondergaan, waaronder MYAMBUTOL. MYAMBUTOL mag alleen tijdens de zwangerschap worden gebruikt als het voordeel opweegt tegen het mogelijke risico voor de foetus.
Van MYAMBUTOL 200 mg is aangetoond dat het teratogeen is bij zwangere muizen en konijnen wanneer het in hoge doses wordt gegeven. Wanneer drachtige muizen of konijnen werden behandeld met hoge doses ethambutolhydrochloride, nam de foetale mortaliteit licht maar niet significant toe (P>0,05). Vrouwelijke ratten die werden behandeld met ethambutolhydrochloride vertoonden een lichte maar onbeduidende (P>0,05) afname in vruchtbaarheid en worpgrootte.
Bij foetussen geboren uit muizen die tijdens de zwangerschap met hoge doses MYAMBUTOL 400 mg werden behandeld, werd een lage incidentie van gespleten gehemelte, exencefalie en afwijking van de wervelkolom waargenomen. Kleine afwijkingen van de halswervel werden gezien bij pasgeboren ratten die tijdens de zwangerschap met hoge doses ethambutolhydrochloride werden behandeld. Konijnen die tijdens de zwangerschap hoge doses MYAMBUTOL kregen, baarden twee foetussen met monoftalmie, één met een verkorte rechter onderarm vergezeld van bilaterale contractuur van het polsgewricht en één met hazenlip en gespleten gehemelte.
Moeders die borstvoeding geven
MYAMBUTOL wordt uitgescheiden in de moedermelk. Het gebruik van MYAMBUTOL dient alleen te worden overwogen als het verwachte voordeel voor de moeder opweegt tegen het mogelijke risico voor het kind.
Pediatrisch gebruik
MYAMBUTOL (ethambutolhydrochloride) wordt niet aanbevolen voor gebruik bij pediatrische patiënten jonger dan dertien jaar, aangezien er geen veilige gebruiksvoorwaarden zijn vastgesteld.
Geriatrisch gebruik
Er zijn beperkte gegevens over het gebruik van ethambutol bij ouderen. Een studie met 101 patiënten van 65 jaar en ouder die meerdere geneesmiddelen tegen tuberculose kregen, omvatte 94 patiënten die ethambutol gebruikten. Er werden geen verschillen in veiligheid of verdraagbaarheid waargenomen bij deze patiënten in vergelijking met de verschillen die bij volwassenen in het algemeen werden gemeld. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
OVERDOSERING
Geen informatie verstrekt
CONTRA-INDICATIES
MYAMBUTOL is gecontra-indiceerd bij patiënten waarvan bekend is dat ze overgevoelig zijn voor dit geneesmiddel. Het is ook gecontra-indiceerd bij patiënten met bekende optische neuritis, tenzij klinisch oordeel bepaalt dat het mag worden gebruikt. MYAMBUTOL is gecontra-indiceerd bij patiënten die visuele bijwerkingen of veranderingen in het gezichtsvermogen niet kunnen waarderen en melden (bijv. jonge kinderen, bewusteloze patiënten).
KLINISCHE FARMACOLOGIE
MYAMBUTOL 600 mg bereikt, na een enkelvoudige orale dosis van 25 mg/kg lichaamsgewicht, een piek van 2 tot 5 mg/ml in serum 2 tot 4 uur na toediening. Wanneer het geneesmiddel gedurende langere tijd bij deze dosis dagelijks wordt toegediend, zijn de serumspiegels vergelijkbaar. De serumspiegel van MYAMBUTOL daalt tot 24 uur na de laatste dosis tot ondetecteerbare niveaus, behalve bij sommige patiënten met een abnormale nierfunctie. De intracellulaire concentraties van erytrocyten bereiken piekwaarden die ongeveer tweemaal zo hoog zijn als die van plasma en handhaven deze verhouding gedurende de 24 uur.
Gedurende de periode van 24 uur na orale toediening van MYAMBUTOL wordt ongeveer 50 procent van de aanvangsdosis onveranderd in de urine uitgescheiden, terwijl nog eens 8 tot 15 procent verschijnt in de vorm van metabolieten. Het belangrijkste pad van het metabolisme lijkt een initiële oxidatie van de alcohol tot een aldehydisch tussenproduct te zijn, gevolgd door omzetting in een dicarbonzuur. Van 20 tot 22 procent van de aanvangsdosis wordt als onveranderd geneesmiddel in de ontlasting uitgescheiden. Er is geen geneesmiddelaccumulatie waargenomen bij opeenvolgende enkelvoudige dagelijkse doses van 25 mg/kg bij patiënten met een normale nierfunctie, hoewel duidelijke accumulatie is aangetoond bij patiënten met nierinsufficiëntie.
MYAMBUTOL diffundeert in actief groeiende mycobacteriële cellen zoals tuberkelbacillen. MYAMBUTOL 800 mg lijkt de synthese van een of meer metabolieten te remmen, waardoor het celmetabolisme wordt aangetast, de vermenigvuldiging wordt gestopt en celdood wordt veroorzaakt. Er is geen kruisresistentie met andere beschikbare antimycobacteriële middelen aangetoond.
Van MYAMBUTOL 200 mg is aangetoond dat het effectief is tegen stammen van Mycobacterium tuberculosis, maar het lijkt niet actief te zijn tegen schimmels, virussen of andere bacteriën. Mycobacterium tuberculosis-stammen die voorheen niet aan MYAMBUTOL waren blootgesteld, waren uniform gevoelig voor concentraties van 8 mcg/ml of minder, afhankelijk van de aard van de kweekmedia. Wanneer MYAMBUTOL alleen is gebruikt voor de behandeling van tuberculose, hebben tuberkelbacillen van deze patiënten resistentie ontwikkeld tegen MYAMBUTOL (ethambutolhydrochloride) door in-vitro-gevoeligheidstests; de ontwikkeling van resistentie is onvoorspelbaar geweest en lijkt stapsgewijs te gebeuren. Er is geen kruisresistentie tussen MYAMBUTOL en andere antituberculeuze geneesmiddelen gemeld. MYAMBUTOL heeft de incidentie van het optreden van mycobacteriële resistentie tegen isoniazide verminderd wanneer beide geneesmiddelen gelijktijdig zijn gebruikt.
Een microbiologische agar-diffusietest, gebaseerd op remming van Mycobacterium smegmatis (ATCC 607), kan worden gebruikt om de concentraties van MYAMBUTOL in serum en urine te bepalen.
Dierlijke farmacologie
Toxicologische studies bij honden met hoge langdurige doses leverden aanwijzingen op voor myocardiale schade en falen, en depigmentatie van het tapetum lucidum van de ogen, waarvan de betekenis niet bekend is. Degeneratieve veranderingen in het centrale zenuwstelsel, blijkbaar niet dosisgerelateerd, zijn ook waargenomen bij honden die gedurende een langere periode ethambutolhydrochloride kregen.
Bij de resusaap verschenen neurologische symptomen na behandeling met hoge doses die dagelijks werden gegeven gedurende een periode van enkele maanden. Deze waren gecorreleerd met specifieke serumspiegels van ethambutol en met duidelijke neuroanatomische veranderingen in het centrale zenuwstelsel. Focale interstitiële carditis werd ook opgemerkt bij apen die gedurende een langere periode ethambutolhydrochloride in hoge doses kregen.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN secties.
