Vantin 200mg, 100mg Cefpodoxime Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Vantin 100 mg en hoe wordt het gebruikt?
Vantin 100 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van verschillende bacteriële infecties zoals bronchitis, longontsteking, sinusitis, faryngitis, tonsillitis, urineweginfecties, huidinfecties en gonorroe. Vantin 200 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Vantin behoort tot een klasse geneesmiddelen genaamd Caphalosporins, 3e generatie.
Het is niet bekend of Vantin veilig en effectief is bij kinderen jonger dan 2 maanden.
Wat zijn de mogelijke bijwerkingen van Vantin 200mg?
Vantin kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- koorts,
- keelpijn,
- brandend in je ogen,
- huid pijn,
- rode of paarse huiduitslag die zich uitbreidt en blaarvorming en vervelling veroorzaakt,
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- opgezwollen klieren,
- gewrichtspijn,
- algemeen ziek gevoel,
- bonzende hartslagen,
- fladderend in je borst,
- kortademigheid, en
- hartinfarct
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Vantin zijn:
- vaginale jeuk of afscheiding,
- luieruitslag bij een baby die dit geneesmiddel gebruikt,
- misselijkheid,
- braken,
- diarree,
- maagpijn, en
- hoofdpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Vantin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van VANTIN 100 mg en andere antibacteriële geneesmiddelen te behouden, mag VANTIN 100 mg alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze door bacteriën worden veroorzaakt.
OMSCHRIJVING
Cefpodoxime proxetil is een oraal toegediend, uitgebreid spectrum, semi-synthetisch antibioticum van de cefalosporineklasse. De chemische naam is (RS)-1(isopropoxycarbonyloxy) ethyl (+)-(6R,7R)-7-[2-(2-amino-4-thiazolyl)-2-{(Z)methoxyimino}acetamido]-3 -methoxymethyl-8-oxo-5-thia-1-azabicyclo [4.2.0]oct-2-een-2-carboxylaat. De empirische formule is C21H27N5O9S2 en de structuurformule wordt hieronder weergegeven:
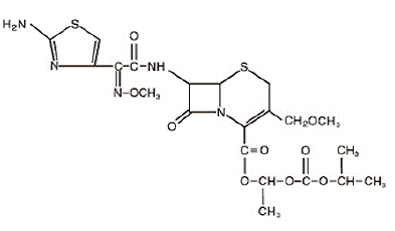
Het molecuulgewicht van cefpodoxime proxetil is 557,6.
Cefpodoxime proxetil is een prodrug; zijn actieve metaboliet is cefpodoxime. Alle doses cefpodoxime proxetil in deze bijlage worden uitgedrukt in termen van de actieve cefpodoxime-eenheid. Het medicijn wordt geleverd als filmomhulde tabletten en als gearomatiseerde korrels voor orale suspensie.
VANTIN-tabletten bevatten cefpodoxime proxetil overeenkomend met 100 mg of 200 mg cefpodoxime-activiteit en de volgende inactieve ingrediënten: carboxymethylcellulosecalcium, carnaubawas, FD&C Yellow No. 6, hydroxypropylcellulose, hypromellose, waterige lactose, magnesiumstearaat, propyleenglycol, natriumlaurylsulfaat en titaandioxide. Bovendien bevatten de 100 mg filmomhulde tabletten D&C Geel nr. 10 en de 200 mg filmomhulde tabletten FD&C Rood nr. 40.
Elke 5 ml VANTIN-suspensie voor oraal gebruik bevat cefpodoxime proxetil equivalent aan 50 mg of 100 mg cefpodoxime-activiteit na constitutie en de volgende inactieve ingrediënten: kunstmatige smaakstoffen, gebutyleerd hydroxyanisol (BHA), carboxymethylcellulose-natrium, microkristallijne cellulose, carrageen, citroenzuur, colloïdaal siliciumdioxide, croscarmellosenatrium, hydroxypropylcellulose, lactose, maltodextrine, natuurlijke smaakstoffen, propyleenglycolalginaat, natriumcitraat, natriumbenzoaat, zetmeel, sucrose en plantaardige olie.
INDICATIES
Cefpodoxime proxetil is geïndiceerd voor de behandeling van patiënten met lichte tot matige infecties veroorzaakt door gevoelige stammen van de aangewezen micro-organismen in de hieronder vermelde aandoeningen.
Aanbevolen doseringen, duur van de therapie en toepasselijke patiëntenpopulaties variëren tussen deze infecties. Zie DOSERING EN TOEDIENING voor specifieke aanbevelingen. Acute middenoorontsteking veroorzaakt door Streptococcus pneumoniae (exclusief penicilline-resistente stammen), Streptococcus pyogenes, Haemophilus influenzae (inclusief bèta-lactamase-producerende stammen) of Moraxella (Branhamella) catarrhalis (inclusief bèta-lactamase-producerende stammen).
Faryngitis en/of tonsillitis veroorzaakt door Streptococcus pyogenes.
OPMERKING: Alleen penicilline via de intramusculaire toedieningsweg is effectief gebleken bij de profylaxe van reumatische koorts. Cefpodoxime proxetil is over het algemeen effectief bij de uitroeiing van streptokokken uit de orofarynx. Er zijn echter geen gegevens beschikbaar die de werkzaamheid van cefpodoxime proxetil voor de profylaxe van daaropvolgende reumatische koorts aantonen.
Gemeenschap verworven pneumonie veroorzaakt door S. pneumoniae of H. Influenzae (inclusief bètalactamaseproducerende stammen).
Acute bacteriële exacerbatie van chronische bronchitis veroorzaakt door S. pneumoniae, H. influenzae (alleen niet-betalactamase-producerende stammen) of M. catarrhalis. Er zijn op dit moment onvoldoende gegevens om de werkzaamheid vast te stellen bij patiënten met acute bacteriële exacerbaties van chronische bronchitis veroorzaakt door bètalactamase-producerende stammen van H. influenzae.
Acute, ongecompliceerde urethrale en cervicale gonorroe veroorzaakt door Neisseria gonorrhoeae (inclusief penicillinase-producerende stammen).
Acute, ongecompliceerde ano-rectale infecties bij vrouwen als gevolg van Neisseria gonorrhoeae (inclusief penicillinase-producerende stammen).
OPMERKING: De werkzaamheid van cefpodoxim bij de behandeling van mannelijke patiënten met rectale infecties veroorzaakt door N. gonorrhoeae is niet vastgesteld. Gegevens ondersteunen het gebruik van cefpodoxime proxetil niet bij de behandeling van faryngeale infecties veroorzaakt door N. gonorrhoeae bij mannen of vrouwen.
Ongecompliceerde huid- en huidstructuurinfecties veroorzaakt door Staphylococcus aureus (inclusief penicillinase-producerende stammen) of Streptococcus pyogenes. Abcessen moeten chirurgisch worden gedraineerd zoals klinisch geïndiceerd.
OPMERKING: In klinische onderzoeken was een succesvolle behandeling van ongecompliceerde huid- en huidstructuurinfecties dosisafhankelijk. De effectieve therapeutische dosis voor huidinfecties was hoger dan die gebruikt bij andere aanbevolen indicaties. (Zien DOSERING EN ADMINISTRATIE .)
Acute maxillaire sinusitis veroorzaakt door Haemophilus influenzae (inclusief bètalactamase-producerende stammen), Streptococcus pneumoniae en Moraxella catarrhalis.
Ongecompliceerde urineweginfecties (cystitis) veroorzaakt door Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis of Staphylococcus saprophyticus.
OPMERKING: Bij het overwegen van het gebruik van cefpodoxime proxetil bij de behandeling van cystitis, moeten de lagere uitroeiingspercentages van cefpodoxime proxetil worden afgewogen tegen de hogere uitroeiingspercentages en verschillende veiligheidsprofielen van sommige andere klassen van goedgekeurde middelen. (Zien Klinische studies sectie.)
Er moeten geschikte monsters voor bacteriologisch onderzoek worden verkregen om de veroorzakende organismen te isoleren en te identificeren en om hun gevoeligheid voor cefpodoxim vast te stellen. Therapie kan worden ingesteld in afwachting van de resultaten van deze onderzoeken. Zodra deze resultaten beschikbaar zijn, moet de antimicrobiële therapie dienovereenkomstig worden aangepast.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van VANTIN 100 mg en andere antibacteriële geneesmiddelen te behouden, mag VANTIN 200 mg alleen worden gebruikt om infecties te behandelen of te voorkomen waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
(Zien AANWIJZINGEN EN GEBRUIK voor aangegeven pathogenen.)
Filmomhulde tabletten
VANTIN-tabletten moeten oraal met voedsel worden toegediend om de absorptie te verbeteren. (Zien KLINISCHE FARMACOLOGIE .)
De aanbevolen doseringen, behandelingsduur en toepasselijke patiëntenpopulatie zijn zoals beschreven in de volgende tabel:
Volwassenen en adolescenten (leeftijd 12 jaar en ouder)
Korrels voor orale suspensie
VANTIN orale suspensie kan worden gegeven zonder rekening te houden met voedsel. De aanbevolen doseringen, behandelingsduur en toepasselijke patiëntenpopulaties zijn zoals beschreven in de volgende tabel:
Volwassenen en adolescenten (leeftijd 12 jaar en ouder)
Zuigelingen en pediatrische patiënten (leeftijd 2 maanden tot 12 jaar)
Patiënten met nierfunctiestoornissen
Voor patiënten met een ernstige nierfunctiestoornis (
Als alleen het serumcreatininegehalte beschikbaar is, kan de volgende formule (op basis van geslacht, gewicht en leeftijd van de patiënt) worden gebruikt om de creatinineklaring (ml/min) te schatten. Om deze schatting geldig te laten zijn, moet het serumcreatininegehalte een stabiele nierfunctie vertegenwoordigen.
Mannetjes (ml/min): Gewicht (kg) x (140 - leeftijd)/ 72 x serumcreatinine (mg/100 ml)
Wijfjes (ml/min) : 0,85 x boven waarde
Patiënten met cirrose
De farmacokinetiek van cefpodoxim bij cirrotische patiënten (met of zonder ascites) is vergelijkbaar met die bij gezonde proefpersonen. Dosisaanpassing is bij deze populatie niet nodig.
Voorbereiding van schorsing
Grondwet Aanwijzingen voor mondelinge schorsing
Na het mengen moet de suspensie in de koelkast worden bewaard, 2° tot 8°C (36° tot 46°F). Goed schudden voor gebruik. Houd de container goed gesloten. Het mengsel kan 14 dagen worden gebruikt. Gooi het ongebruikte deel na 14 dagen weg.
HOE GELEVERD
VANTIN-tabletten zijn verkrijgbaar in de volgende sterktes (cefpodoxime-equivalent), kleuren en maten:
100 mg (lichtoranje, elliptisch, gegraveerd met U3617)
Flessen van 20 NDC 0009-3617-01 Flessen van 100 NDC 0009-3617-02 Eenheidsdosisverpakkingen van 100 NDC 0009-3617-03
200 mg (koraalrood, elliptisch, gegraveerd met U3618)
Flessen van 20 NDC 0009-3618-01 Flessen van 100 NDC 0009-3618-02
200 mg (koraalrood, elliptisch, gegraveerd met U3618)
Eenheidsdosisverpakkingen van 100 NDC 0009-3618-03
Bewaar tabletten bij een gecontroleerde kamertemperatuur van 20° tot 25°C (68° tot 77°F) [zie USP ].
Plaats de dop stevig terug na elke opening. Bescherm eenheidsdosisverpakkingen tegen overmatig vocht.
VANTIN 200 mg orale suspensie levert het equivalent van 50 mg of 100 mg cefpodoxime per suspensie van 5 ml (indien samengesteld zoals aangegeven) en is verkrijgbaar in citroencrèmesmaak in de volgende maten:
50 mg/5 ml
100 ml suspensie NDC 0009-3531-01 75 ml suspensie NDC 0009-3531-02 50 ml suspensie NDC 0009-3531-03
100 mg/5 ml
100 ml suspensie NDC 0009-3615-01 75 ml suspensie NDC 0009-3615-02 50 ml suspensie NDC 0009-3615-03
Bewaar niet-gesuspendeerde korrels bij een gecontroleerde kamertemperatuur van 20° tot 25°C (68° tot 77°F) (zie USP ].
Aanwijzingen voor het mengen staan op het etiket. Na het mengen moet de suspensie in de koelkast worden bewaard, 2° tot 8°C (36° tot 46°F). Goed schudden voor gebruik. Houd de container goed gesloten. Het mengsel kan 14 dagen worden gebruikt. Gooi het ongebruikte deel na 14 dagen weg.
Gedistribueerd door: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Herzien: aug. 2016
BIJWERKINGEN
Klinische proeven
Filmomhulde tabletten (meerdere doses)
In klinische onderzoeken met behulp van meerdere doses van cefpodoxime proxetil filmomhulde tabletten werden 4696 patiënten behandeld met de aanbevolen doseringen van cefpodoxime (100 tot 400 mg om de 12 uur). Er waren geen sterfgevallen of blijvende handicaps waarvan werd gedacht dat ze verband hielden met de toxiciteit van geneesmiddelen. Honderd negenentwintig (2,7%) patiënten stopten met de medicatie vanwege bijwerkingen die mogelijk of waarschijnlijk verband hielden met de toxiciteit van het geneesmiddel. Drieënnegentig (52%) van de 178 patiënten die de therapie staakten (al dan niet in verband met medicamenteuze behandeling), deden dit vanwege gastro-intestinale stoornissen, misselijkheid, braken of diarree. Het percentage met cefpodoxime proxetil behandelde patiënten dat stopte met het onderzoeksgeneesmiddel vanwege bijwerkingen was significant groter bij een dosis van 800 mg per dag dan bij een dosis van 400 mg per dag of bij een dosis van 200 mg per dag. Bijwerkingen die mogelijk of waarschijnlijk verband hielden met cefpodoxim in klinische onderzoeken met meerdere doses (N=4696 met cefpodoxim behandelde patiënten) waren:
Incidentie groter dan 1%
Diarree 7,0%
Diarree of dunne ontlasting waren dosisgerelateerd: afnemend van 10,4% van de patiënten die 800 mg per dag kregen tot 5,7% voor degenen die 200 mg per dag kregen. Van de patiënten met diarree had 10% C. difficile-organisme of toxine in de ontlasting. (Zien WAARSCHUWINGEN .)
Misselijkheid 3,3% Vaginale schimmelinfecties 1,0% Vulvovaginale infecties 1,3% Buikpijn 1,2% Hoofdpijn 1,0%
Incidentie minder dan 1%
Op lichaamssysteem in afnemende volgorde
Klinische studies
Bijwerkingen die mogelijk of waarschijnlijk verband houden met cefpodoxime proxetil en die bij minder dan 1% van de patiënten optraden (N=4696)
Lichaam - schimmelinfecties, opgezette buik, malaise, vermoeidheid, asthenie, koorts, pijn op de borst, rugpijn, rillingen, algemene pijn, abnormale microbiologische tests, moniliasis, abces, allergische reactie, gezichtsoedeem, bacteriële infecties, parasitaire infecties, gelokaliseerd oedeem, gelokaliseerde pijn .
Cardiovasculair - congestief hartfalen, migraine, hartkloppingen, vasodilatatie, hematoom, hypertensie, hypotensie.
spijsvertering - braken, dyspepsie, droge mond, flatulentie, verminderde eetlust, constipatie, orale moniliasis, anorexia, oprispingen, gastritis, mondzweren, gastro-intestinale aandoeningen, rectale aandoeningen, tongaandoeningen, tandaandoeningen, verhoogde dorst, orale laesies, tenesmus, droge keel, kiespijn .
Hemic en lymfatisch - Bloedarmoede.
Metabool en Nutritioneel - uitdroging, jicht, perifeer oedeem, gewichtstoename.
Musculo-skeletaal - spierpijn.
Zenuwachtig - duizeligheid, slapeloosheid, slaperigheid, angst, beverigheid, nervositeit, herseninfarct, verandering in dromen, verminderde concentratie, verwardheid, nachtmerries, paresthesie, duizeligheid.
Ademhalings - astma, hoesten, epistaxis, rhinitis, piepende ademhaling, bronchitis, dyspneu, pleurale effusie, longontsteking, sinusitis.
Huid - urticaria, uitslag, pruritus waar niet wordt aangebracht, diaforese, maculopapulaire uitslag, schimmeldermatitis, afschilfering, droge huid waar niet wordt aangebracht, haaruitval, vesiculobulleuze uitslag, zonnebrand.
Speciale zintuigen - smaakveranderingen, oogirritatie, smaakverlies, oorsuizen.
Urogenitaal - hematurie, urineweginfecties, metrorragie, dysurie, urinaire frequentie, nocturie, penisinfectie, proteïnurie, vaginale pijn.
Korrels voor orale suspensie (meerdere doses)
In klinische onderzoeken waarbij meerdere doses cefpodoxime proxetil granulaat voor orale suspensie werden gebruikt, werden 2128 pediatrische patiënten (van wie 93% jonger dan 12 jaar) behandeld met de aanbevolen doseringen cefpodoxime (10 mg/kg/dag Q 24 uur of verdeeld over Q 12 uur tot een maximale equivalente dosis voor volwassenen). Er waren geen sterfgevallen of blijvende handicaps bij geen van de patiënten in deze onderzoeken. Vierentwintig patiënten (1,1%) stopten met de medicatie vanwege bijwerkingen die mogelijk of waarschijnlijk verband hielden met het onderzoeksgeneesmiddel. In de eerste plaats waren deze stopzettingen voor gastro-intestinale stoornissen, meestal diarree, braken of huiduitslag.
Bijwerkingen die mogelijk of waarschijnlijk verband hielden met, of waarvan de relatie onbekend was met cefpodoxime proxetil voor orale suspensie in klinische onderzoeken met meervoudige doses (N=2128 patiënten behandeld met cefpodoxime) waren:
Incidentie groter dan 1%
Diarree 6,0% De incidentie van diarree bij zuigelingen en peuters (leeftijd 1 maand tot 2 jaar) was 12,8%. Luieruitslag/schimmelhuiduitslag 2,0% (inclusief moniliasis) De incidentie van luieruitslag bij zuigelingen en peuters was 8,5%. Overige huiduitslag 1,8% Braken 2,3%
Incidentie minder dan 1%
Lichaam: Lokale buikpijn, buikkramp, hoofdpijn, monilia, gegeneraliseerde buikpijn, asthenie, koorts, schimmelinfectie.
spijsvertering: Misselijkheid, monilia, anorexia, droge mond, stomatitis, pseudomembraneuze colitis.
Hemic & Lymfatisch: Trombocytose, positieve directe Coombs-test, eosinofilie, leukocytose, leukopenie, verlengde partiële tromboplastinetijd, trombocytopenische purpura.
Metabool en voedingswaarde: Verhoogde SGPT.
Musculo-skelet: Spierpijn.
Zenuwachtig: Hallucinatie, hyperkinesie, nervositeit, slaperigheid.
Ademhaling: Epistaxis, rinitis.

Huid: Huidmoniliasis, urticaria, schimmeldermatitis, acne, exfoliatieve dermatitis, maculopapulaire uitslag.
Speciale zintuigen: Smaak perversie.
Filmomhulde tabletten (enkele dosis)
In klinische onderzoeken met a enkele dosis van cefpodoxime proxetil filmomhulde tabletten werden 509 patiënten behandeld met de aanbevolen dosering cefpodoxime (200 mg). Er waren in deze onderzoeken geen sterfgevallen of blijvende handicaps die verband hielden met de toxiciteit van geneesmiddelen.
Bijwerkingen die mogelijk of waarschijnlijk verband hielden met cefpodoxime in klinische onderzoeken met een enkelvoudige dosis die in de Verenigde Staten werden uitgevoerd, waren:
Incidentie groter dan 1%
Misselijkheid 1,4% Diarree 1,2%
Incidentie minder dan 1%
Centraal zenuwstelsel: duizeligheid, hoofdpijn, syncope. Dermatologisch: uitslag. Genitale: vaginitis. Gastro-intestinaal: buikpijn. Psychiatrisch: angst.
Laboratoriumveranderingen
Significante laboratoriumveranderingen die zijn gemeld bij volwassen en pediatrische patiënten in klinische onderzoeken met cefpodoxime proxetil, ongeacht de relatie tussen geneesmiddelen, waren:
lever: Voorbijgaande verhogingen van AST (SGOT), ALT (SGPT), GGT, alkalische fosfatase, bilirubine en LDH.
Hematologische: Eosinofilie, leukocytose, lymfocytose, granulocytose, basofilie, monocytose, trombocytose, verlaagd hemoglobine, verlaagd hematocriet, leukopenie, neutropenie, lymfocytopenie, trombocytopenie, trombocytemie, positieve Coombs-test en verlengde PT en PTT.
Serumchemie: Hyperglykemie, hypoglykemie, hypoalbuminemie, hypoproteïnemie, hyperkaliëmie en hyponatriëmie.
nier: Verhogingen van BUN en creatinine.
De meeste van deze afwijkingen waren van voorbijgaande aard en niet klinisch significant.
Postmarketingervaring
De volgende ernstige bijwerkingen zijn gemeld: allergische reacties waaronder Stevens-Johnson-syndroom, toxische epidermale necrolyse, erythema multiforme en serumziekteachtige reacties, pseudomembraneuze colitis, bloederige diarree met buikpijn, colitis ulcerosa, rectorragie met hypotensie, anafylactische shock, acute leverbeschadiging, blootstelling in utero met miskraam, purpurische nefritis, longinfiltraat met eosinofilie en oogliddermatitis.
Eén overlijden werd toegeschreven aan pseudomembraneuze colitis en verspreide intravasculaire stolling.
Etikettering van de cefalosporineklasse
Naast de hierboven vermelde bijwerkingen die zijn waargenomen bij patiënten die werden behandeld met cefpodoxime proxetil, zijn de volgende bijwerkingen en gewijzigde laboratoriumtests gemeld voor antibiotica uit de cefalosporineklasse:
Bijwerkingen en abnormale laboratoriumtests: Nierdisfunctie, toxische nefropathie, leverfunctiestoornis waaronder cholestase, aplastische anemie, hemolytische anemie, serumziekte-achtige reactie, bloeding, agranulocytose en pancytopenie.
Verschillende cefalosporines zijn in verband gebracht met het veroorzaken van epileptische aanvallen, met name bij patiënten met nierinsufficiëntie wanneer de dosering niet werd verlaagd. (Zien DOSERING EN ADMINISTRATIE en OVERDOSERING .) Als er aanvallen optreden die verband houden met medicamenteuze behandeling, moet het medicijn worden stopgezet. Anticonvulsieve therapie kan worden gegeven indien klinisch geïndiceerd.
DRUG-INTERACTIES
Antacida
Gelijktijdige toediening van hoge doses antacida (natriumbicarbonaat en aluminiumhydroxide) of H2-blokkers vermindert de piekplasmaspiegels met respectievelijk 24% tot 42% en de mate van absorptie met 27% tot 32%. De absorptiesnelheid wordt niet veranderd door deze gelijktijdige medicatie. Orale anticholinergica (bijv. propantheline) vertragen de piekplasmaspiegels (47% toename van Tmax), maar hebben geen invloed op de mate van absorptie (AUC).
probenecide
Net als bij andere bètalactam-antibiotica werd de renale excretie van cefpodoxim geremd door probenecide en resulteerde dit in een toename van ongeveer 31% van de AUC en 20% van de piekplasmaspiegels van cefpodoxim.
Nefrotoxische geneesmiddelen
Hoewel nefrotoxiciteit niet is waargenomen wanneer cefpodoxime proxetil alleen werd gegeven, wordt aangeraden de nierfunctie nauwlettend te controleren wanneer cefpodoxime proxetil gelijktijdig wordt toegediend met verbindingen met een bekend nefrotoxisch potentieel.
Geneesmiddel-/laboratoriumtestinteracties
Van cefalosporines, waaronder cefpodoxime proxetil, is bekend dat ze af en toe een positieve directe Coombs-test induceren.
WAARSCHUWINGEN
VOORDAT DE THERAPIE MET CEFPODOXIME PROXETIL WORDT INGESTELD, MOET ZORGVULDIG WORDEN ONDERZOCHT OM TE BEPALEN OF DE PATINT EERDERE OVERGEVOELIGE REACTIES HEEFT GEHAD OP CEFPODOXIME, ANDERE CEPHALOSPORINEN, PENICILLINES OF ANDERE DOORGEVOELIGE REACTIES. ALS CEFPODOXIME AAN PENICILLINEGEVOELIGE PATINTEN MOET WORDEN TOEGEDIEND, MOET VOORZICHTIG WORDEN GEWEEST OMDAT DE KRUISOVERGEVOELIGHEID VAN BETA-LACTAM-ANTIBIOTICA DUIDELIJK IS GEDOCUMENTEERD EN KAN VOORKOMEN IN TOT 10% VAN PHI-OPSLAG. ALS EEN ALLERGISCHE REACTIE OP CEFPODOXIME PROXETIL OPTREEDT, STOP DAN MET HET GENEESMIDDEL. ERNSTIGE ACUTE OVERGEVOELIGHEIDSREACTIES KUNNEN BEHANDELING MET Epinefrine EN ANDERE NOODMAATREGELEN VEREISEN, WAARONDER ZUURSTOF, INTRAVENEUZE VLOEISTOFFEN, INTRAVENEUS ANTIHISTAMINE EN LUCHTWEGENBEHEER, ZOALS KLINISCH AANGEWEZEN.
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, inclusief VANTIN, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Een gezamenlijke inspanning om C. difficile te controleren bij met cefpodoxime behandelde patiënten met diarree werd ondernomen vanwege een verhoogde incidentie van diarree geassocieerd met C. difficile in vroege onderzoeken bij normale proefpersonen. C. difficile-organismen of toxine werd gemeld bij 10% van de met cefpodoxim behandelde volwassen patiënten met diarree; bij deze patiënten werd echter geen specifieke diagnose van pseudomembraneuze colitis gesteld.
Tijdens postmarketingervaring buiten de Verenigde Staten zijn meldingen ontvangen van pseudomembraneuze colitis geassocieerd met het gebruik van cefpodoxime proxetil.
PREVENTIEVE MAATREGELEN
Algemeen
Bij patiënten met een voorbijgaande of aanhoudende vermindering van de urineproductie als gevolg van nierinsufficiëntie, moet de totale dagelijkse dosis cefpodoxime proxetil worden verlaagd, omdat bij dergelijke personen hoge en langdurige serumantibioticaconcentraties kunnen optreden na de gebruikelijke doses. Cefpodoxim moet, net als andere cefalosporines, met voorzichtigheid worden toegediend aan patiënten die gelijktijdig worden behandeld met krachtige diuretica. (Zien DOSERING EN ADMINISTRATIE .)
Net als bij andere antibiotica kan langdurig gebruik van cefpodoxime proxetil leiden tot overgroei van niet-gevoelige organismen. Herhaalde evaluatie van de toestand van de patiënt is essentieel. Als tijdens de behandeling superinfectie optreedt, dienen passende maatregelen te worden genomen.
Het voorschrijven van VANTIN bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van resistente bacteriën.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Langdurige carcinogenesestudies bij dieren met cefpodoxime proxetil zijn niet uitgevoerd. Mutagenese-onderzoeken van cefpodoxime, waaronder de Ames-test zowel met als zonder metabolische activering, de chromosoomafwijkingstest, de ongeplande DNA-synthesetest, mitotische recombinatie en genconversie, de voorwaartse genmutatietest en de in vivo micronucleustest, waren allemaal negatief. Er werden geen ongewenste effecten op de vruchtbaarheid of de voortplanting waargenomen wanneer 100 mg/kg/dag of minder (2 maal de dosis voor de mens op basis van mg/m²) oraal werd toegediend aan ratten.
Zwangerschap
Teratogene effecten
Cefpodoxime proxetil was noch teratogeen noch embryocide wanneer het werd toegediend aan ratten tijdens de organogenese in doses tot 100 mg/kg/dag (2 maal de dosis voor de mens gebaseerd op mg/m²) of aan konijnen in doses tot 30 mg/kg/dag (1 -2 maal de dosis voor mensen op basis van mg/m²).
Er zijn echter geen adequate en goed gecontroleerde onderzoeken naar het gebruik van cefpodoxime proxetil bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Cefpodoxime proxetil is niet onderzocht voor gebruik tijdens de bevalling en bevalling. Behandeling mag alleen worden gegeven als dit duidelijk nodig is.
Moeders die borstvoeding geven
Cefpodoxim wordt uitgescheiden in de moedermelk. In een onderzoek bij 3 vrouwen die borstvoeding gaven, waren de concentraties cefpodoxime in moedermelk 0%, 2% en 6% van de gelijktijdige serumconcentraties 4 uur na een orale dosis cefpodoxime proxetil van 200 mg. 6 uur na toediening waren de spiegels 0%, 9% en 16% van de gelijktijdige serumspiegels. Vanwege de mogelijkheid van ernstige reacties bij zuigelingen die borstvoeding geven, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij zuigelingen jonger dan 2 maanden zijn niet vastgesteld.
Geriatrisch gebruik
Van de 3338 patiënten in klinische onderzoeken met meerdere doses cefpodoxime proxetil filmomhulde tabletten waren 521 (16%) 65 jaar en ouder, terwijl 214 (6%) 75 jaar en ouder waren. Er werden geen algemene verschillen in werkzaamheid of veiligheid waargenomen tussen oudere en jongere patiënten. Bij gezonde geriatrische proefpersonen met een normale nierfunctie was de plasmahalfwaardetijd van cefpodoxim gemiddeld 4,2 uur en de terugwinning in de urine gemiddeld 21% na toediening van een dosis van 400 mg om de 12 uur gedurende 15 dagen. Andere farmacokinetische parameters waren onveranderd ten opzichte van die waargenomen bij gezonde jongere proefpersonen.
Dosisaanpassing bij oudere patiënten met een normale nierfunctie is niet nodig.
OVERDOSERING
In acute toxiciteitsstudies bij knaagdieren veroorzaakte een enkele orale dosis van 5 g/kg geen nadelige effecten.
In het geval van een ernstige toxische reactie door overdosering, kan hemodialyse of peritoneale dialyse helpen om cefpodoxim uit het lichaam te verwijderen, vooral als de nierfunctie is aangetast.
De toxische symptomen na een overdosis bètalactam-antibiotica kunnen misselijkheid, braken, epigastrische nood en diarree omvatten.
CONTRA-INDICATIES
Cefpodoxime proxetil is gecontra-indiceerd bij patiënten met een bekende allergie voor cefpodoxim of voor de cefalosporinegroep van antibiotica.
KLINISCHE FARMACOLOGIE
Absorptie en uitscheiding
Cefpodoxime proxetil is een prodrug die wordt geabsorbeerd uit het maagdarmkanaal en wordt gedeëstereerd tot zijn actieve metaboliet, cefpodoxime. Na orale toediening van 100 mg cefpodoxime proxetil aan nuchtere proefpersonen, werd ongeveer 50% van de toegediende dosis cefpodoxim systemisch geabsorbeerd. Binnen het aanbevolen doseringsbereik (100 tot 400 mg) werd ongeveer 29 tot 33% van de toegediende dosis cefpodoxim in 12 uur onveranderd in de urine uitgescheiden. Er is een minimaal metabolisme van cefpodoxim in vivo.
Effecten van voedsel
De mate van absorptie (gemiddelde AUC) en de gemiddelde piekplasmaconcentratie namen toe wanneer filmomhulde tabletten met voedsel werden toegediend. Na een tabletdosis van 200 mg ingenomen met voedsel was de AUC 21 tot 33% hoger dan in nuchtere toestand, en de piekplasmaconcentratie was gemiddeld 3,1 mcg/ml bij gevoede proefpersonen versus 2,6 mcg/ml bij nuchtere proefpersonen. Tijd tot piekconcentratie was niet significant verschillend tussen gevoede en nuchtere proefpersonen.
Wanneer een dosis van 200 mg van de suspensie met voedsel werd ingenomen, waren de mate van absorptie (gemiddelde AUC) en gemiddelde piekplasmaconcentratie bij gevoede proefpersonen niet significant verschillend van nuchtere proefpersonen, maar de absorptiesnelheid was langzamer met voedsel (toename van 48% in Tmax).
Farmacokinetiek van Cefpodoxime Proxetil filmomhulde tabletten
Over het aanbevolen doseringsbereik (100 tot 400 mg) vertoonden de snelheid en mate van absorptie van cefpodoxim dosisafhankelijkheid; de dosisgenormaliseerde Cmax en AUC daalden met maximaal 32% bij toenemende dosis. Over het aanbevolen doseringsbereik was de Tmax ongeveer 2 tot 3 uur en de T½ varieerde van 2,09 tot 2,84 uur. De gemiddelde Cmax was 1,4 mcg/ml voor de dosis van 100 mg, 2,3 mcg/ml voor de dosis van 200 mg en 3,9 mcg/ml voor de dosis van 400 mg. Bij patiënten met een normale nierfunctie werden noch accumulatie, noch significante veranderingen in andere farmacokinetische parameters waargenomen na meerdere orale doses tot 400 mg om de 12 uur.
CEFPODOXIME-PLASMA-NIVEAUS (mcg/ml) BIJ VASTGESTELDE VOLWASSENEN NA TOEDIENING VAN FILMOMHULDE TABLET (enkele dosis)
Farmacokinetiek van Cefpodoxime Proxetil-suspensie
Bij volwassen proefpersonen produceerde een dosis van 100 mg orale suspensie een gemiddelde piekconcentratie van cefpodoxim van ongeveer 1,5 mcg/ml (bereik: 1,1 tot 2,1 mcg/ml), wat gelijk is aan wat werd gerapporteerd na toediening van de tablet van 100 mg. De tijd tot piekplasmaconcentratie en het gebied onder de plasmaconcentratie-tijdcurve (AUC) voor de orale suspensie waren ook gelijk aan die geproduceerd met filmomhulde tabletten bij volwassenen na een orale dosis van 100 mg.
De farmacokinetiek van cefpodoxim werd onderzocht bij 29 patiënten in de leeftijd van 1 tot 17 jaar. Elke patiënt kreeg een enkele orale dosis van 5 mg/kg cefpodoxime-suspensie voor oraal gebruik. Plasma- en urinemonsters werden gedurende 12 uur na dosering verzameld. De plasmaspiegels die uit dit onderzoek zijn gerapporteerd, zijn als volgt:
CEFPODOXIME PLASMA-NIVEAUS (mcg/ml) BIJ VASTGESTELDE PATINTEN (1 tot 17 JAAR) NA OPSCHORTING TOEDIENING
Verdeling
De eiwitbinding van cefpodoxime varieert van 22 tot 33% in serum en van 21 tot 29% in plasma.
Huidblaar
Na toediening van meerdere doses om de 12 uur gedurende 5 dagen van 200 mg of 400 mg cefpodoxime proxetil, was de gemiddelde maximale cefpodoximconcentratie in huidblaarvloeistof gemiddeld respectievelijk 1,6 en 2,8 mcg/ml. De cefpodoximespiegels in huidblaarvloeistof waren 12 uur na toediening gemiddeld 0,2 en 0,4 mcg/ml voor respectievelijk de 200 mg en 400 mg meervoudige dosisregimes.
Tonsillenweefsel
Na een enkelvoudige, orale 100 mg cefpodoxime proxetil filmomhulde tablet, was de gemiddelde maximale cefpodoximconcentratie in tonsilweefsel gemiddeld 0,24 mcg/g 4 uur na toediening en 0,09 mcg/g 7 uur na toediening. Er werd binnen 4 uur na toediening een evenwicht bereikt tussen plasma en tonsilweefsel. Er werd 12 uur na toediening geen detectie van cefpodoxim in tonsillair weefsel gemeld. Deze resultaten toonden aan dat de concentraties van cefpodoxime gedurende ten minste 7 uur na toediening van 100 mg cefpodoxime proxetil de MIC90 van S. pyogenes overschreden.
Longweefsel
Na een enkelvoudige, orale 200 mg cefpodoxime proxetil filmomhulde tablet was de gemiddelde maximale cefpodoximconcentratie in longweefsel gemiddeld 0,63 mcg/g 3 uur na toediening, 0,52 mcg/g 6 uur na toediening en 0,19 mcg/g 12 uur na dosering. De resultaten van dit onderzoek gaven aan dat cefpodoxime in het longweefsel doordrong en gedurende ten minste 12 uur na toediening aanhoudende geneesmiddelconcentraties produceerde op niveaus die de MIC90 voor S. pneumoniae en H. influenzae overschreden.
CSF
Adequate gegevens over CSF-spiegels van cefpodoxime zijn niet beschikbaar.
Effecten van verminderde nierfunctie
De eliminatie van cefpodoxim is verminderd bij patiënten met een matige tot ernstige nierfunctiestoornis ( PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE .) Bij proefpersonen met een lichte nierfunctiestoornis (50 tot 80 ml/min creatinineklaring) was de gemiddelde plasmahalfwaardetijd van cefpodoxime 3,5 uur. Bij proefpersonen met een matige (30 tot 49 ml/min creatinineklaring) of ernstige nierfunctiestoornis (5 tot 29 ml/min creatinineklaring) nam de halfwaardetijd toe tot respectievelijk 5,9 en 9,8 uur. Ongeveer 23% van de toegediende dosis werd uit het lichaam verwijderd tijdens een standaard hemodialyseprocedure van 3 uur.
Effect van leverfunctiestoornis (cirrose)
Bij patiënten met cirrose was de absorptie enigszins verminderd en de eliminatie onveranderd. De gemiddelde T½ van cefpodoxim en de renale klaring bij patiënten met cirrose waren vergelijkbaar met die uit onderzoeken bij gezonde proefpersonen. Ascites leek de waarden bij patiënten met cirrose niet te beïnvloeden. Bij deze patiëntenpopulatie wordt geen dosisaanpassing aanbevolen.
Farmacokinetiek bij oudere personen
Bij oudere personen hoeft de dosering niet te worden aangepast, tenzij ze een verminderde nierfunctie hebben. (Zien PREVENTIEVE MAATREGELEN .) Bij gezonde geriatrische proefpersonen was de plasmahalfwaardetijd van cefpodoxim gemiddeld 4,2 uur (vs 3,3 bij jongere proefpersonen) en gemiddeld 21% urineverlies na toediening van een dosis van 400 mg om de 12 uur. Andere farmacokinetische parameters (Cmax, AUC en Tmax) waren onveranderd ten opzichte van die waargenomen bij gezonde jonge proefpersonen.
Microbiologie
Werkingsmechanisme
Cefpodoxime is een bacteriedodend middel dat werkt door remming van de synthese van bacteriële celwanden. Cefpodoxime is werkzaam in aanwezigheid van sommige bètalactamasen, zowel penicillinasen als cefalosporinasen, van Gram-negatieve en Gram-positieve bacteriën.
Mechanisme van weerstand
Resistentie tegen cefpodoxime vindt voornamelijk plaats door hydrolyse door bètalactamase, wijziging van penicillinebindende eiwitten (PBP's) en verminderde permeabiliteit.
Van cefpodoxime is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties, zoals beschreven in de rubriek Indicaties en gebruik (1):
Gram-positieve bacteriën
Staphylococcus aureus (meticilline-gevoelige stammen, inclusief die welke penicillinasen produceren) Staphylococcus saprophyticus Streptococcus pneumoniae (exclusief penicilline-resistente isolaten) Streptococcus pyogenes
Gram-negatieve bacteriën
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (inclusief bètalactamaseproducerende isolaten) Moraxella catarrhalis Neisseria gonorrhoeae (inclusief penicillinaseproducerende isolaten)
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Ten minste 90 procent van de volgende micro-organismen vertoont een in vitro minimale remmende concentratie (MIC) die kleiner is dan of gelijk is aan het vatbare breekpunt voor cefpodoxime. De werkzaamheid van cefpodoxime bij de behandeling van klinische infecties veroorzaakt door deze micro-organismen is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Streptococcus agalactiae Streptococcus spp. (Groepen C, F, G)
Gram-negatieve bacteriën
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaërobe Gram-positieve bacteriën
Peptostreptococcus magnus
Gevoeligheidstestmethoden
Indien beschikbaar, moet het laboratorium voor klinische microbiologie de resultaten van in vitro gevoeligheidstestresultaten voor antimicrobiële geneesmiddelen die in residentiële ziekenhuizen worden gebruikt, aan de arts verstrekken als periodieke rapporten die het gevoeligheidsprofiel van nosocomiale en buiten het ziekenhuis verworven pathogenen beschrijven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële minimale remmende concentraties (MIC's) te bepalen. Deze MIC's geven schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's dienen te worden bepaald met behulp van een gestandaardiseerde testmethode. De MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 1.
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, bieden ook reproduceerbare schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte geeft een schatting van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte dient te worden bepaald met behulp van een gestandaardiseerde testmethode. Bij deze procedure worden papieren schijven geïmpregneerd met 10 mcg Cefpodoxime gebruikt om de gevoeligheid van micro-organismen voor Cefpodoxime te testen. De interpretatieve criteria voor schijfdiffusie worden gegeven in tabel 1.
Een rapport van Gevoelig geeft aan dat het antimicrobiële middel waarschijnlijk de groei van het pathogeen remt als de antimicrobiële verbinding de concentratie bereikt op de infectieplaats die nodig is om de groei van het pathogeen te remmen. Een rapport van Intermediate geeft aan dat het resultaat als dubbelzinnig moet worden beschouwd, en als het micro-organisme niet volledig vatbaar is voor alternatieve, klinisch haalbare geneesmiddelen, moet de test worden herhaald. Deze categorie impliceert mogelijke klinische toepasbaarheid op lichaamslocaties waar het medicijn fysiologisch geconcentreerd is of in situaties waar een hoge dosering van het medicijn kan worden gebruikt. Deze categorie biedt ook een bufferzone die voorkomt dat kleine ongecontroleerde technische factoren grote interpretatieverschillen veroorzaken. Een rapport van Resistant geeft aan dat het niet waarschijnlijk is dat het antimicrobiële middel de groei van het pathogeen remt als de antimicrobiële verbinding de concentraties bereikt die gewoonlijk op de infectieplaats kunnen worden bereikt; andere therapie moet worden gekozen.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de persoon die de test uitvoert te controleren en te verzekeren1,2,3. Standaard cefpodoxime-poeder moet het volgende bereik van MIC-waarden bieden zoals vermeld in tabel 2. Voor de diffusietechniek met behulp van de 10 mcg-schijf moeten de criteria in tabel 2 worden bereikt.
Klinische proeven
Cystitis
In twee dubbelblinde, 2:1 gerandomiseerde, vergelijkende onderzoeken bij volwassenen in de Verenigde Staten werd cefpodoxime proxetil vergeleken met andere bètalactamantibiotica. In deze onderzoeken werden de volgende bacteriële uitroeiingspercentages 5 tot 9 dagen na de therapie verkregen:
In deze onderzoeken waren de klinische genezingspercentages en bacteriële uitroeiingspercentages voor cefpodoxime proxetil vergelijkbaar met de vergelijkingsmiddelen; de klinische genezingspercentages en bacteriologische uitroeiingspercentages waren echter lager dan die waargenomen bij sommige andere klassen van goedgekeurde middelen voor cystitis.
Onderzoek naar acute otitis media
In gecontroleerde onderzoeken naar acute otitis media uitgevoerd in de Verenigde Staten, waar significante percentages betalactamase-producerende organismen werden gevonden, werd cefpodoxime proxetil vergeleken met cefixime. In deze onderzoeken, met behulp van zeer strikte evalueerbaarheidscriteria en microbiologische en klinische responscriteria bij de follow-up van 4 tot 21 dagen na de therapie, werden de volgende vermoedelijke bacteriële uitroeiing/klinische succesresultaten (genezen en verbeterd) verkregen.
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard - Negende editie. CLSI-document M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2012.
2. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor antimicrobiële gevoeligheidstesten; Drieëntwintigste informatief supplement, CLSI-document M100-S23. CLSI-document M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2013.
3. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor gevoeligheidstests voor antimicrobiële schijfdiffusie; Approved Standard - Elfde editie CLSI-document M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2012.
PATIËNT INFORMATIE
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder VANTIN, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer VANTIN wordt voorgeschreven om een bacteriële infectie te behandelen, moeten patiënten worden verteld dat, hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met VANTIN of andere antibacteriële geneesmiddelen kunnen worden behandeld.
Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
