Cleocin 150mg, 300mg Clindamycin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat zijn Cleocin 300 mg hydrochloride-capsules?
Cleocin Hydrochloride-capsules bevatten een antibioticum dat is geïndiceerd voor de behandeling van ernstige infecties veroorzaakt door gevoelige anaërobe bacteriën. Cleocin 150 mg hydrochloride is ook geïndiceerd voor de behandeling van ernstige infecties veroorzaakt door gevoelige stammen van streptokokken, pneumokokken en stafylokokken. Het gebruik ervan moet worden voorbehouden aan penicilline-allergische patiënten of andere patiënten voor wie, naar het oordeel van de arts, een penicilline niet geschikt is. Cleocin Hydrochloride is beschikbaar in generieke vorm.
Wat zijn bijwerkingen van Cleocin 300 mg hydrochloride-capsules?
Vaak voorkomende bijwerkingen van Cleocin Hydrochloride zijn onder meer:
- Clostridium difficile colitis,
- buikpijn,
- pseudomembraneuze colitis,
- oesofagitis,
- misselijkheid,
- braken,
- diarree,
- huiduitslag,
- netelroos,
- ernstige allergische reacties (anafylaxie),
- overgevoeligheidsreacties,
- jeuk,
- vaginale afscheiding en ongemak,
- zwelling van de huid,
- gele huid en ogen (geelzucht),
- abnormale leverfunctietesten, en
- gewrichtspijn.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van CLEOCIN 300 mg HCl en andere antibacteriële geneesmiddelen te behouden, mag CLEOCIN 300 mg HCl alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze door bacteriën worden veroorzaakt.
WAARSCHUWING
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder CLEOCIN HCl en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficle.
Omdat CLEOCIN 150 mg HCl-therapie in verband is gebracht met ernstige colitis die fataal kan eindigen, moet deze worden gereserveerd voor ernstige infecties waarbij minder giftige antimicrobiële middelen niet geschikt zijn, zoals beschreven in de AANWIJZINGEN EN GEBRUIK sectie. Het mag niet worden gebruikt bij patiënten met niet-bacteriële infecties, zoals de meeste infecties van de bovenste luchtwegen.
C. difficle produceert toxine A en B, die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficle veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het voortdurende gebruik van antibiotica dat niet is gericht tegen C. difficle. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficle en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
OMSCHRIJVING
Clindamycinehydrochloride is het gehydrateerde hydrochloridezout van clindamycine. Clindamycine is een semisynthetisch antibioticum dat wordt geproduceerd door een 7(S)-chloorsubstitutie van de 7(R)-hydroxylgroep van de moederverbinding lincomycine.
CLEOCIN HCl-capsules bevatten clindamycinehydrochloride overeenkomend met 75 mg, 150 mg of 300 mg clindamycine.
Inactieve ingrediënten: 75 mg - maïszetmeel, FD&C blauw nee. 1, FD&C geel nr. 5, gelatine, lactose, magnesiumstearaat en talk; 150 mg - maïszetmeel, FD&C blauw nr. 1, FD&C geel nr. 5, gelatine, lactose, magnesiumstearaat, talk en titaniumdioxide; 300 mg - maïszetmeel, FD&C blauw nr. 1, gelatine, lactose, magnesiumstearaat, talk en titaniumdioxide.
De structuurformule wordt hieronder weergegeven:
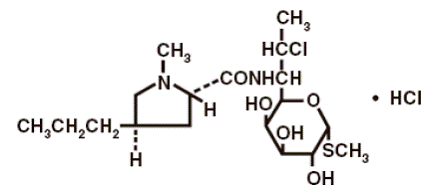
De chemische naam voor clindamycinehydrochloride is Methyl 7-chloor-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α- D-galacto-octopyranoside-monohydrochloride.
INDICATIES
Clindamycine is geïndiceerd voor de behandeling van ernstige infecties veroorzaakt door gevoelige anaërobe bacteriën.
Clindamycine is ook geïndiceerd voor de behandeling van ernstige infecties veroorzaakt door gevoelige stammen van streptokokken, pneumokokken en stafylokokken. Het gebruik ervan moet worden voorbehouden aan penicilline-allergische patiënten of andere patiënten voor wie, naar het oordeel van de arts, een penicilline niet geschikt is. Vanwege het risico op colitis, zoals beschreven in de OMKADERDE WAARSCHUWING, moet de arts, voordat hij clindamycine kiest, de aard van de infectie en de geschiktheid van minder toxische alternatieven (bijv. erytromycine) in overweging nemen.
Anaëroben: Ernstige luchtweginfecties zoals empyeem, anaërobe pneumonitis en longabces; ernstige infecties van huid en weke delen; bloedvergiftiging; intra-abdominale infecties zoals peritonitis en intra-abdominaal abces (meestal als gevolg van anaërobe organismen die in het normale maagdarmkanaal aanwezig zijn); infecties van het vrouwelijke bekken en de geslachtsorganen, zoals endometritis, niet-gonokokken tubo-ovarieel abces, cellulitis in het bekken en postoperatieve vaginale cuff-infectie.
Streptokokken: Ernstige luchtweginfecties; ernstige huid- en weke delen infecties.
Stafylokokken: Ernstige luchtweginfecties; ernstige huid- en weke delen infecties.
Pneumokokken: Ernstige luchtweginfecties.
Er moeten bacteriologische onderzoeken worden uitgevoerd om de veroorzakende organismen en hun gevoeligheid voor clindamycine te bepalen.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van CLEOCIN HCl en andere antibacteriële geneesmiddelen te behouden, mag CLEOCIN HCl alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Als tijdens de behandeling significante diarree optreedt, moet dit antibioticum worden gestaakt (zie: GEVAARLIJKE WAARSCHUWING: ).
volwassenen
Ernstige infecties - 150 tot 300 mg om de 6 uur. Ernstigere infecties - 300 tot 450 mg om de 6 uur.
Pediatrische patiënten (voor kinderen die capsules kunnen slikken):
Ernstige infecties 8 tot 16 mg/kg/dag (4 tot 8 mg/lb/dag) verdeeld over drie of vier gelijke doses. Ernstigere infecties - 16 tot 20 mg/kg/dag (8 tot 10 mg/lb/dag) verdeeld over drie of vier gelijke doses.
Om de mogelijkheid van slokdarmirritatie te voorkomen, moet CLEOCIN 300 mg HCl-capsules worden ingenomen met een vol glas water.
CLEOCIN HCl-capsules zijn niet geschikt voor kinderen die ze niet heel kunnen doorslikken. De capsules geven geen exacte mg/kg-doses, daarom kan het in sommige gevallen nodig zijn om de clindamycinepalmitaat-drank te gebruiken.
Ernstige infecties door anaërobe bacteriën worden meestal behandeld met CLEOCIN PHOSPHATE® steriele oplossing. In klinisch geschikte omstandigheden kan de arts er echter voor kiezen om de behandeling te starten of de behandeling met CLEOCIN 150 mg HCl-capsules voort te zetten.
In gevallen van β-hemolytische streptokokkeninfecties moet de behandeling gedurende ten minste 10 dagen worden voortgezet.
HOE GELEVERD
CLEOCIN HCl-capsules zijn verkrijgbaar in de volgende sterktes, kleuren en maten:
75 mg Groene Flessen van 100 NDC 0009-0331-02
150 mg Lichtblauwe en groene flessen van 100 NDC 0009-0225-02
300 mg Lichtblauwe Flessen van 100 NDC 0009-0395-14
Bewaren bij een gecontroleerde kamertemperatuur van 20° tot 25° C (68° tot 77° F) [zie USP ].
Gedistribueerd door: Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. Herzien 2017
BIJWERKINGEN
De volgende reacties zijn gemeld bij het gebruik van clindamycine.
Infecties en parasitaire aandoeningen: Clostridium difficile colitis
Gastro-intestinaal: Buikpijn, pseudomembraneuze colitis, oesofagitis, misselijkheid, braken en diarree (zie: GEVAARLIJKE WAARSCHUWING: ). Symptomen van pseudomembraneuze colitis kunnen optreden tijdens of na antibacteriële behandeling (zie: WAARSCHUWINGEN ). Slokdarmzweer is gemeld. Een onaangename of metaalachtige smaak is gemeld na orale toediening.
Overgevoeligheidsreacties: Gegeneraliseerde milde tot matige morbilliform-achtige (maculopapulaire) huiduitslag zijn de meest gemelde bijwerkingen. Vesiculobulleuze huiduitslag, evenals urticaria, zijn waargenomen tijdens medicamenteuze behandeling. Ernstige huidreacties zoals toxische epidermale necrolyse, waarvan sommige met fatale afloop, zijn gemeld (zie: WAARSCHUWINGEN ). Gevallen van acute gegeneraliseerde exanthemateuze pustulosis (AGEP), erythema multiforme, waarvan sommige lijken op het syndroom van Stevens-Johnson, anafylactische shock, anafylactische reactie en overgevoeligheid zijn ook gemeld.
Huid en slijmvliezen: Pruritus, vaginitis, angio-oedeem en zeldzame gevallen van exfoliatieve dermatitis zijn gemeld. (Zien Overgevoeligheidsreacties .)
Lever: Geelzucht en afwijkingen in leverfunctietesten zijn waargenomen tijdens behandeling met clindamycine.
nier: Hoewel er geen directe relatie tussen clindamycine en nierbeschadiging is vastgesteld, is nierdisfunctie waargenomen, zoals blijkt uit azotemie, oligurie en/of proteïnurie.
Hematopoëtisch: Voorbijgaande neutropenie (leukopenie) en eosinofilie zijn gemeld. Er zijn meldingen gedaan van agranulocytose en trombocytopenie. In geen van de voorgaande kon een directe etiologische relatie worden gelegd met gelijktijdige clindamycinetherapie.
Immuunsysteem: Geneesmiddelreacties met gevallen van eosinofilie en systemische symptomen (DRESS) zijn gemeld.
Musculoskeletaal: Er zijn gevallen van polyartritis gemeld.
DRUG-INTERACTIES
Van clindamycine is aangetoond dat het neuromusculair blokkerende eigenschappen heeft die de werking van andere neuromusculair blokkerende middelen kunnen versterken. Daarom moet het met voorzichtigheid worden gebruikt bij patiënten die dergelijke middelen krijgen.
Clindamycine wordt voornamelijk gemetaboliseerd door CYP3A4, en in mindere mate door CYP3A5, tot de belangrijkste metaboliet clindamycinesulfoxide en de minder belangrijke metaboliet N-desmethylclindamycine. Daarom kunnen remmers van CYP3A4 en CYP3A5 de plasmaconcentraties van clindamycine verhogen en kunnen inductoren van deze iso-enzymen de plasmaconcentraties van clindamycine verlagen. Controleer in aanwezigheid van sterke CYP3A4-remmers op bijwerkingen. In aanwezigheid van sterke CYP3A4-inductoren zoals rifampicine, controleren op verlies van effectiviteit.
In vitro-onderzoeken geven aan dat clindamycine CYP1A2, CYP2C9, CYP2C19, CYP2E1 of CYP2D6 niet remt en CYP3A4 slechts matig remt.
In vitro is antagonisme aangetoond tussen clindamycine en erytromycine. Vanwege de mogelijke klinische betekenis mogen deze twee geneesmiddelen niet gelijktijdig worden toegediend.
WAARSCHUWINGEN
Zien GEVAARLIJKE WAARSCHUWING:
Clostridium Difficile Geassocieerde Diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder CLEOCIN 300 mg HCl, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficle.
C. difficle produceert toxine A en B, die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficle veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het voortdurende gebruik van antibiotica dat niet is gericht tegen C. difficle. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficle en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Anafylactische en ernstige overgevoeligheidsreacties
Anafylactische shock en anafylactische reacties zijn gemeld (zie: ONGEWENSTE REACTIES ).
Ernstige overgevoeligheidsreacties, waaronder ernstige huidreacties zoals toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) en Stevens-Johnson-syndroom (SJS), sommige met fatale afloop, zijn gemeld (zie ONGEWENSTE REACTIES ).
In het geval van een dergelijke anafylactische of ernstige overgevoeligheidsreactie, de behandeling definitief stopzetten en een geschikte therapie instellen.
Er moet een zorgvuldig onderzoek worden gedaan naar eerdere gevoeligheden voor medicijnen en andere allergenen.
Gebruik bij meningitis
Aangezien clindamycine niet voldoende in de cerebrospinale vloeistof diffundeert, mag het geneesmiddel niet worden gebruikt bij de behandeling van meningitis.
PREVENTIEVE MAATREGELEN
Algemeen
Een evaluatie van de ervaring tot nu toe suggereert dat een subgroep van oudere patiënten met een bijbehorende ernstige ziekte diarree minder goed kan verdragen. Wanneer clindamycine is geïndiceerd bij deze patiënten, moeten ze zorgvuldig worden gecontroleerd op veranderingen in de darmfrequentie.
CLEOCIN 300 mg HCl moet met voorzichtigheid worden voorgeschreven aan personen met een voorgeschiedenis van gastro-intestinale aandoeningen, met name colitis.
CLEOCIN 300 mg HCl moet met voorzichtigheid worden voorgeschreven aan atopische personen.
Geïndiceerde chirurgische procedures moeten worden uitgevoerd in combinatie met antibiotische therapie.
Het gebruik van CLEOCIN 150 mg HCl resulteert af en toe in overgroei van niet-gevoelige organismen, met name gisten. Indien superinfecties optreden, dienen passende maatregelen te worden genomen, afhankelijk van de klinische situatie.
Aanpassing van de dosering van clindamycine is mogelijk niet nodig bij patiënten met een nieraandoening. Bij patiënten met een matige tot ernstige leverziekte is een verlenging van de halfwaardetijd van clindamycine gevonden. Uit onderzoeken werd echter gepostuleerd dat accumulatie zelden zou optreden als het om de acht uur werd gegeven. Daarom is dosisaanpassing bij patiënten met een leverziekte mogelijk niet nodig. Bij de behandeling van patiënten met een ernstige leverziekte moeten echter periodieke leverenzymbepalingen worden uitgevoerd.
De capsules van 75 mg en 150 mg bevatten FD&C geel nr. 5 (tartrazine), dat allergische reacties kan veroorzaken (inclusief bronchiale astma) bij bepaalde gevoelige personen. Hoewel de totale incidentie van FD&C geel nr. 5 (tartrazine) gevoeligheid in de algemene bevolking laag is, wordt het vaak gezien bij patiënten die ook overgevoeligheid voor aspirine hebben.
Het voorschrijven van CLEOCIN 150 mg HCl bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Laboratorium testen
Tijdens langdurige therapie moeten periodieke lever- en nierfunctietesten en bloedtellingen worden uitgevoerd.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen langetermijnstudies bij dieren uitgevoerd met clindamycine om het carcinogene potentieel te evalueren. Genotoxiciteitstesten die werden uitgevoerd, omvatten een micronucleustest bij ratten en een Ames Salmonella-reversietest. Beide testen waren negatief.
Vruchtbaarheidsonderzoeken bij ratten die oraal werden behandeld met maximaal 300 mg/kg/dag (ongeveer 1,6 keer de hoogste aanbevolen dosis voor volwassenen, gebaseerd op mg/m²) lieten geen effecten zien op de vruchtbaarheid of het paarvermogen.
Zwangerschap
Teratogene effecten
In klinische onderzoeken met zwangere vrouwen is de systemische toediening van clindamycine tijdens het tweede en derde trimester niet in verband gebracht met een verhoogde frequentie van aangeboren afwijkingen.
Clindamycine mag alleen tijdens het eerste trimester van de zwangerschap worden gebruikt als dit duidelijk nodig is. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen tijdens het eerste trimester van de zwangerschap. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons bij de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Reproductiestudies uitgevoerd bij ratten en muizen met orale doses clindamycine tot 600 mg/kg/dag (respectievelijk 3,2 en 1,6 maal de hoogste aanbevolen dosis voor volwassenen, gebaseerd op mg/m²) of subcutane doses clindamycine tot 250 mg/kg /dag (respectievelijk 1,3 en 0,7 maal de hoogste aanbevolen dosis voor volwassenen, gebaseerd op mg/m²) toonde geen bewijs van teratogeniteit.
Moeders die borstvoeding geven
Van clindamycine is gemeld dat het in de moedermelk voorkomt in het bereik van 0,7 tot 3,8 mcg/ml. Clindamycine kan mogelijk nadelige effecten hebben op de gastro-intestinale flora van de zuigeling. Als orale of intraveneuze clindamycine nodig is door een moeder die borstvoeding geeft, is dit geen reden om de borstvoeding te staken, maar een alternatief medicijn kan de voorkeur hebben. Controleer de zuigeling op mogelijke nadelige effecten op de gastro-intestinale flora, zoals diarree, candidiasis (spruw, luieruitslag) of zelden bloed in de ontlasting die wijst op mogelijke antibiotica-geassocieerde colitis.
De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan clindamycine en eventuele nadelige effecten op het kind dat borstvoeding krijgt van clindamycine of van de onderliggende maternale aandoening.
Pediatrisch gebruik
Wanneer CLEOCIN 300 mg HCl wordt toegediend aan pediatrische patiënten (geboorte tot 16 jaar), is passende controle van de orgaansysteemfuncties wenselijk.
Geriatrisch gebruik
Klinische onderzoeken met clindamycine omvatten niet voldoende aantallen patiënten van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten. Andere gerapporteerde klinische ervaringen wijzen er echter op dat antibiotica-geassocieerde colitis en diarree (als gevolg van Clostridium difficile) gezien in combinatie met de meeste antibiotica, vaker voorkomen bij ouderen (> 60 jaar) en ernstiger kunnen zijn. Deze patiënten moeten zorgvuldig worden gecontroleerd op de ontwikkeling van diarree.
Farmacokinetische onderzoeken met clindamycine hebben geen klinisch belangrijke verschillen aangetoond tussen jonge en oudere proefpersonen met een normale leverfunctie en een normale (aan leeftijd aangepaste) nierfunctie na orale of intraveneuze toediening.
OVERDOSERING
Significante mortaliteit werd waargenomen bij muizen bij een intraveneuze dosis van 855 mg/kg en bij ratten bij een orale of subcutane dosis van ongeveer 2618 mg/kg. Bij de muizen werden convulsies en depressie waargenomen.
Hemodialyse en peritoneale dialyse zijn niet effectief bij het verwijderen van clindamycine uit het serum.
CONTRA-INDICATIES
CLEOCIN 150 mg HCl is gecontra-indiceerd bij personen met een voorgeschiedenis van overgevoeligheid voor preparaten die clindamycine of lincomycine bevatten.
KLINISCHE FARMACOLOGIE
Menselijke farmacologie
Absorptie
Studies op serumniveau met een orale dosis van 150 mg clindamycinehydrochloride bij 24 normale volwassen vrijwilligers toonden aan dat clindamycine snel werd geabsorbeerd na orale toediening. Een gemiddelde piekserumspiegel van 2,50 mcg/ml werd in 45 minuten bereikt; serumspiegels waren gemiddeld 1,51 mcg/ml na 3 uur en 0,70 mcg/ml na 6 uur. De absorptie van een orale dosis is vrijwel volledig (90%) en de gelijktijdige toediening van voedsel verandert de serumconcentraties niet noemenswaardig; serumspiegels waren uniform en voorspelbaar van persoon tot persoon en van dosis tot dosis. Studies op serumniveau na meerdere doses CLEOCIN 150 mg HCl gedurende maximaal 14 dagen tonen geen bewijs van accumulatie of veranderd metabolisme van het geneesmiddel. Doses tot 2 gram clindamycine per dag gedurende 14 dagen werden goed verdragen door gezonde vrijwilligers, behalve dat de incidentie van gastro-intestinale bijwerkingen groter is bij de hogere doses.
Verdeling
De concentraties van clindamycine in het serum namen lineair toe met een hogere dosis. Serumspiegels overschrijden de MIC (minimale remmende concentratie) voor de meeste geïndiceerde organismen gedurende ten minste zes uur na toediening van de gewoonlijk aanbevolen doses. Clindamycine wordt wijd verspreid in lichaamsvloeistoffen en weefsels (inclusief botten). Er worden geen significante niveaus van clindamycine bereikt in de cerebrospinale vloeistof, zelfs niet in de aanwezigheid van ontstoken hersenvliezen.
Metabolisme
In vitro-onderzoeken in humane lever- en darmmicrosomen gaven aan dat clindamycine voornamelijk wordt gemetaboliseerd door Cytochroom P450 3A4 (CYP3A4), met een kleine bijdrage van CYP3A5, om clindamycinesulfoxide en een minder belangrijke metaboliet, N-desmethylclindamycine, te vormen.
uitscheiding
De gemiddelde biologische halfwaardetijd is 2,4 uur. Ongeveer 10% van de biologische activiteit wordt uitgescheiden in de urine en 3,6% in de feces; de rest wordt uitgescheiden als bio-inactieve metabolieten.
Speciale populaties
Nierfunctiestoornis
De serumhalfwaardetijd van clindamycine is licht verhoogd bij patiënten met een duidelijk verminderde nierfunctie. Hemodialyse en peritoneale dialyse zijn niet effectief bij het verwijderen van clindamycine uit het serum.
Gebruik bij ouderen
Farmacokinetische onderzoeken bij oudere vrijwilligers (61-79 jaar) en jongere volwassenen (18-39 jaar) geven aan dat leeftijd alleen de farmacokinetiek van clindamycine (klaring, eliminatiehalfwaardetijd, distributievolume en oppervlakte onder de serumconcentratie-tijdcurve) niet verandert. ) na IV toediening van clindamycinefosfaat. Na orale toediening van clindamycinehydrochloride is de eliminatiehalfwaardetijd verhoogd tot ongeveer 4,0 uur (bereik 3,4-5,1 uur) bij ouderen vergeleken met 3,2 uur (bereik 2,1 - 4,2 uur) bij jongere volwassenen. De mate van absorptie verschilt echter niet tussen leeftijdsgroepen en er is geen dosisaanpassing nodig voor ouderen met een normale leverfunctie en een normale (aan leeftijd aangepaste) nierfunctie1.
Microbiologie
Werkingsmechanisme
Clindamycine remt de bacteriële eiwitsynthese door te binden aan het 23S-RNA van de 50S-subeenheid van het ribosoom. Clindamycine is bacteriostatisch.
Weerstand
Resistentie tegen clindamycine wordt meestal veroorzaakt door modificatie van specifieke basen van het 23S-ribosomale RNA. Kruisresistentie tussen clindamycine en lincomycine is volledig. Omdat de bindingsplaatsen voor deze antibacteriële geneesmiddelen elkaar overlappen, wordt soms kruisresistentie waargenomen tussen lincosamiden, macroliden en streptogramine B. Macrolide-induceerbare resistentie tegen clindamycine komt voor in sommige isolaten van macrolide-resistente bacteriën. Macrolide-resistente isolaten van stafylokokken en bèta-hemolytische streptokokken moeten worden gescreend op inductie van clindamycineresistentie met behulp van de D-zone-test.
Antimicrobiale activiteit
Van clindamycine is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen, zowel in vitro als bij klinische infecties, zoals beschreven in de AANWIJZINGEN EN GEBRUIK sectie.
Gram-positieve bacteriën
Staphylococcus aureus (meticilline-gevoelige stammen) Streptococcus pneumoniae (penicilline-gevoelige stammen) Streptococcus pyogenes
Anaërobe bacteriën
Clostridium perfringens Fusobacterium necrophorum Fusobacterium nucleatum Peptostreptococcus anaerobius Prevotella melaninogenica
Ten minste 90% van de hieronder vermelde micro-organismen vertoont in vitro minimale remmende concentraties (MIC's) die lager zijn dan of gelijk zijn aan het voor clindamycine gevoelige MIC-breekpunt voor organismen van een soortgelijk type als weergegeven in tabel 1. De werkzaamheid van clindamycine bij de behandeling van klinische infecties veroorzaakt door deze micro-organismen zijn niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Staphylococcus epidermidis (meticilline-gevoelige stammen) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
Anaërobe bacteriën
Actinomyces israelii Clostridium clostridioforme Eggerthella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia Propionibacterium acnes
Gevoeligheidstestmethoden
Indien beschikbaar, moet het laboratorium voor klinische microbiologie cumulatieve in vitro gevoeligheidstestresultaten voor antimicrobiële geneesmiddelen die in lokale ziekenhuizen en praktijkgebieden worden gebruikt, aan de arts verstrekken als periodieke rapporten die het gevoeligheidsprofiel van nosocomiale en door de gemeenschap verworven pathogenen beschrijven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële minimale remmende concentraties (MIC's) te bepalen. Deze MIC's geven schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's dienen te worden bepaald met behulp van een gestandaardiseerde testmethode2,3 (bouillon en/of agar). De MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 1.
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, kunnen ook reproduceerbare schattingen opleveren van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte dient te worden bepaald met behulp van een gestandaardiseerde methode2,5. Deze procedure maakt gebruik van papieren schijfjes geïmpregneerd met 2 mcg clindamycine om de gevoeligheid van bacteriën voor clindamycine te testen. De schijfdiffusiebreekpunten worden gegeven in Tabel 1.
Anaërobe technieken
Voor anaërobe bacteriën kan de gevoeligheid voor clindamycine worden bepaald met een gestandaardiseerde testmethode2,4. De verkregen MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 1.
Een rapport van Vatbaar (S ) geeft aan dat het antimicrobiële geneesmiddel waarschijnlijk de groei van het pathogeen remt als het antimicrobiële geneesmiddel de concentratie bereikt die gewoonlijk op de plaats van infectie kan worden bereikt. Een rapport van Intermediair (I) geeft aan dat het resultaat als dubbelzinnig moet worden beschouwd en dat, als het micro-organisme niet volledig vatbaar is voor alternatieve, klinisch haalbare geneesmiddelen, de test moet worden herhaald. Deze categorie impliceert mogelijke klinische toepasbaarheid op lichaamslocaties waar het medicijn fysiologisch geconcentreerd is of in situaties waar een hoge dosering van het medicijn kan worden gebruikt. Deze categorie biedt ook een bufferzone die voorkomt dat kleine, ongecontroleerde technische factoren grote interpretatieverschillen veroorzaken. Een rapport van Resistant (R) geeft aan dat het niet waarschijnlijk is dat het antimicrobiële geneesmiddel de groei van het pathogeen remt als het antimicrobiële geneesmiddel de concentratie bereikt die gewoonlijk op de infectieplaats kan worden bereikt; andere therapie moet worden gekozen.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de personen die de test uitvoeren, te controleren en te garanderen.2,3,4,5 Standaard clindamycinepoeder moet de MIC-bereiken in tabel 2. Voor de schijfdiffusietechniek met behulp van de 2 mcg clindamycine-schijf moeten de criteria in tabel 2 worden bereikt.
anaëroben kunnen worden getest met ofwel bouillon-microverdunnings- of agar-verdunningsmethoden. NA=Niet van toepassing ATCC® is een gedeponeerd handelsmerk van de American Type Culture Collection
REFERENTIES
1. Smith RB, Phillips JP: Evaluatie van CLEOCIN HCl en CLEOCIN-fosfaat in een oude populatie. Upjohn TR 8147-82-9122-021, december 1982.
2. CLSI. Prestatienormen voor testen op antimicrobiële gevoeligheid: 26e druk. CLSI-supplement M100S. Wayne, PA: Instituut voor klinische en laboratoriumnormen; 2016.
3. CLSI. Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard - tiende editie. CLSI-document M07-A10. Wayne, PA: Instituut voor klinische en laboratoriumnormen; 2015.
4. CLSI. Methoden voor het testen van antimicrobiële gevoeligheid van anaërobe bacteriën; Goedgekeurde standaard achtste editie. CLSI-document M11-A8. Wayne, PA: Instituut voor klinische en laboratoriumnormen; 2012.
5. CLSI. Prestatienormen voor gevoeligheidstests voor antimicrobiële schijven; Goedgekeurde standaard - Twaalfde editie. CLSI-document M02-A12. Wayne, PA: Instituut voor klinische en laboratoriumnormen; 2015.
PATIËNT INFORMATIE
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder CLEOCIN HCl, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer CLEOCIN HCl wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet kunnen worden behandeld met CLEOCIN 150 mg HCl of andere antibacteriële geneesmiddelen.
Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
