Biaxin 250mg, 500mg Clarithromycin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Biaxin 500 mg en hoe wordt het gebruikt?
Biaxin is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van veel verschillende bacteriële infecties, waaronder maagzweren en Helicobacter pylori. Biaxin kan alleen of in combinatie met andere medicijnen worden gebruikt.
Biaxin 500 mg is een antibioticum.
Het is niet bekend of Biaxin veilig en effectief is bij kinderen jonger dan 6 maanden.
Wat zijn de mogelijke bijwerkingen van Biaxin 250 mg?
Biaxin 500 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree met bloed,
- snelle of bonzende hartslagen,
- fladderend in je borst,
- kortademigheid,
- plotselinge duizeligheid,
- verwardheid,
- ronddraaiend gevoel,
- verlies van eetlust,
- pijn in de bovenbuik,
- vermoeidheid,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van ogen en huid (geelzucht),
- weinig of geen urine,
- zwelling in uw voeten of enkels,
- zich moe voelen,
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Biaxin zijn onder meer:
- buikpijn,
- misselijkheid,
- braken,
- diarree,
- ongebruikelijke of onaangename smaak in uw mond,
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Biaxin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Claritromycine is een semi-synthetisch macrolide antimicrobieel middel voor oraal gebruik. Chemisch gezien is het 6-0methylerytromycine. De molecuulformule is C38H69NO13 en het molecuulgewicht is 747,96. De structuurformule is:
Figuur 1: Structuur van claritromycine
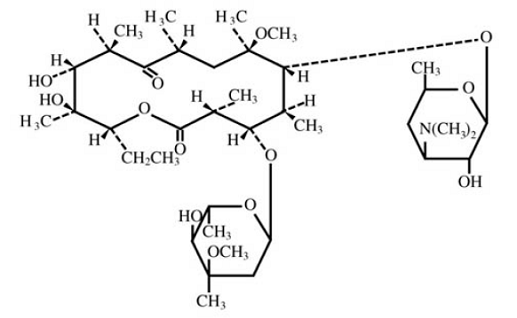
Claritromycine is een wit tot gebroken wit kristallijn poeder. Het is oplosbaar in aceton, slecht oplosbaar in methanol, ethanol en acetonitril en praktisch onoplosbaar in water.
BIAXIN is verkrijgbaar als tabletten met onmiddellijke afgifte, tabletten met verlengde afgifte en granulaat voor orale suspensie.
Elke gele ovale filmomhulde BIAXIN Filmtab-tablet met onmiddellijke afgifte (claritromycine-tabletten, USP) bevat 250 mg of 500 mg claritromycine en de volgende inactieve ingrediënten:
- 250 mg tabletten: hypromellose, hydroxypropylcellulose, croscarmellose-natrium, D&C Yellow No. 10, FD&C Blue No. 1, magnesiumstearaat, microkristallijne cellulose, povidon, gepregelatineerd zetmeel, propyleenglycol, siliciumdioxide, sorbinezuur, sorbitanmono-oleaat, stearinezuur, talk, titaandioxide en vanilline.
- 500 mg tabletten: hypromellose, hydroxypropylcellulose, colloïdaal siliciumdioxide, croscarmellosenatrium, D&C Yellow No. 10, magnesiumstearaat, microkristallijne cellulose, povidon, propyleenglycol, sorbinezuur, sorbitanmonooleaat, titaniumdioxide en vanilline.
Elke gele ovale filmomhulde BIAXIN XL Filmtab-tablet (claritromycine tabletten met verlengde afgifte) bevat 500 mg claritromycine en de volgende inactieve ingrediënten: cellulosepolymeren, D&C Yellow No. 10, lactosemonohydraat, magnesiumstearaat, propyleenglycol, sorbinezuur, sorbitan monooleaat, talk, titaandioxide en vanilline.
Elke 5 ml BIAXIN 500 mg gereconstitueerde suspensie (claritromycine voor orale suspensie, USP) bevat 125 mg of 250 mg claritromycine. Elke fles BIAXIN-granulaat bevat 1250 mg (50 ml maat), 2500 mg (50 en 100 ml maat) of 5000 mg (100 ml maat) claritromycine en de volgende inactieve ingrediënten: carbomeer, ricinusolie, citroenzuur, hypromelloseftalaat, maltodextrine, kaliumsorbaat, povidon, siliciumdioxide, sucrose, xanthaangom, titaniumdioxide en fruitsmaak.
INDICATIES
Acute bacteriële exacerbatie van chronische bronchitis
BIAXIN (Filmtab, Granules) en BIAXIN XL Filmtab zijn geïndiceerd bij volwassenen voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis of Streptococcus pneumoniae [zie AANWIJZINGEN EN GEBRUIK ].
Acute maxillaire sinusitis
BIAXIN (Filmtab, Granules) en BIAXIN 500 mg XL Filmtab (bij volwassenen) zijn geïndiceerd voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van Haemophilus influenzae, Moraxella catarrhalis of Streptococcus pneumoniae (zie AANWIJZINGEN EN GEBRUIK ].
Gemeenschap verworven pneumonie
BIAXIN (Filmtab, Granules) en BIAXIN XL Filmtab zijn aangegeven [zie AANWIJZINGEN EN GEBRUIK ] voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van:
- Haemophilus influenzae (bij volwassenen)
- Haemophilus parainfluenzae (BIAXIN 500 mg XL Filmtab bij volwassenen)
- Moraxella catarrhalis (BIAXIN 250 mg XL Filmtab bij volwassenen)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500 mg XL Filmtab [bij volwassenen]; BIAXIN Filmtab en BIAXIN granulaat [bij volwassenen en pediatrische patiënten])
Faryngitis/tonsillitis
BIAXIN 500 mg Filmtab en BIAXIN 500 mg granulaat zijn geïndiceerd voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten veroorzaakt door Streptococcus pyogenes als alternatief bij personen die geen eerstelijnsbehandeling kunnen gebruiken.
Ongecompliceerde huid- en huidstructuurinfecties
BIAXIN Filmtab en BIAXIN-granulaat zijn geïndiceerd voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van Staphylococcus aureus of Streptococcus pyogenes.
Acute otitis media
BIAXIN Filmtab en BIAXIN 250 mg granulaat zijn geïndiceerd bij pediatrische patiënten voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van Haemophilus influenzae, Moraxella catarrhalis of Streptococcus pneumoniae [zie Klinische studies ].
Behandeling en profylaxe van verspreide mycobacteriële infecties
BIAXIN 500 mg Filmtab en BIAXIN 250 mg granulaat zijn geïndiceerd voor de behandeling van milde tot matige infecties veroorzaakt door gevoelige isolaten als gevolg van Mycobacterium avium of Mycobacterium intracellulare bij patiënten met gevorderde HIV-infectie [zie Klinische studies ].
Helicobacter pylori-infectie en duodenumulcusziekte
BIAXIN 250 mg Filmtab wordt aan volwassenen gegeven in combinatie met andere geneesmiddelen zoals hieronder beschreven om H. pylori uit te roeien. Het is aangetoond dat de uitroeiing van H. pylori het risico op terugkeer van zweren in de twaalfvingerige darm vermindert [zie Klinische studies ].
- BIAXIN Filmtab in combinatie met amoxicilline en PREVACID (lansoprazol) of PRILOSEC (omeprazol) Capsules met vertraagde afgifte, als drievoudige therapie, zijn geïndiceerd voor de behandeling van patiënten met H. pylori-infectie en ulcus duodeni (actieve of vijfjarige geschiedenis van maagzweer) om H. pylori uit te roeien.
- BIAXIN 250 mg Filmtab in combinatie met PRILOSEC (omeprazol) capsules zijn geïndiceerd voor de behandeling van patiënten met een actief ulcus duodeni geassocieerd met H. pylori-infectie. Regimes die BIAXIN 250 mg Filmtab als het enige antibacteriële middel bevatten, zijn waarschijnlijker geassocieerd met de ontwikkeling van claritromycineresistentie bij patiënten bij wie de therapie faalt. Claritromycine-bevattende regimes mogen niet worden gebruikt bij patiënten met bekende of vermoede claritromycine-resistente isolaten omdat de werkzaamheid van de behandeling in deze setting verminderd is.
Beperkingen van gebruik
BIAXIN 500 mg XL Filmtab is alleen geïndiceerd voor acute maxillaire sinusitis, acute bacteriële exacerbatie van chronische bronchitis en buiten het ziekenhuis opgelopen pneumonie bij volwassenen. De werkzaamheid en veiligheid van BIAXIN 500 mg XL Filmtab bij de behandeling van andere infecties waarvoor BIAXIN Filmtab en BIAXIN-granulaat zijn goedgekeurd, zijn niet vastgesteld.
Er is resistentie tegen macroliden bij bepaalde bacteriële infecties veroorzaakt door Streptococcus pneumoniae en Staphylococcus aureus. Gevoeligheidstesten moeten worden uitgevoerd wanneer dit klinisch geïndiceerd is.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van BIAXIN en andere antibacteriële geneesmiddelen te behouden, mag BIAXIN alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Belangrijke administratie-instructies
BIAXIN Filmtab en BIAXIN 250 mg granulaat kunnen met of zonder voedsel worden gegeven.
BIAXIN XL Filmtab moet met voedsel worden ingenomen. Slik BIAXIN 500mg XL Filmtab heel; BIAXIN 500 mg XL Filmtab niet kauwen, breken of fijnmaken.
Dosering voor volwassenen
De aanbevolen doseringen van BIAXIN 250 mg Filmtab en BIAXIN 250 mg XL Filmtab voor de behandeling van lichte tot matige infecties bij volwassenen staan vermeld in Tabel 1.
Combinatiedoseringsregimes voor H. pylori-infectie
- Drievoudige therapie: BIAXIN 500 mg Filmtab/lansoprazol/amoxicilline De aanbevolen dosering voor volwassenen is 500 mg BIAXIN 500 mg Filmtab, 30 mg lansoprazol en 1 gram amoxicilline, alle gegeven elke 12 uur gedurende 10 of 14 dagen [zie AANWIJZINGEN EN GEBRUIK en Klinische studies ].
- Drievoudige therapie: BIAXIN Filmtab/omeprazol/amoxicilline De aanbevolen dosering voor volwassenen is 500 mg BIAXIN 250 mg Filmtab, 20 mg omeprazol en 1 gram amoxicilline; alle gegeven elke 12 uur gedurende 10 dagen. Bij patiënten met een zweer die aanwezig is op het moment dat de behandeling wordt gestart, wordt 18 dagen extra 20 mg omeprazol eenmaal daags aanbevolen voor de genezing van de zweer en verlichting van de symptomen [zie AANWIJZINGEN EN GEBRUIK en Klinische studies ].
- Dubbele therapie: BIAXIN 500 mg Filmtab/omeprazol De aanbevolen dosering voor volwassenen is 500 mg BIAXIN 250 mg Filmtab elke 8 uur en 40 mg omeprazol eenmaal per ochtend gedurende 14 dagen. Een extra 14 dagen omeprazol 20 mg eenmaal daags wordt aanbevolen voor de genezing van zweren en symptoomverlichting [zie: AANWIJZINGEN EN GEBRUIK en Klinische studies ].
Pediatrische dosering
De aanbevolen dagelijkse dosering is 15 mg/kg/dag verdeeld om de 12 uur gedurende 10 dagen (tot aan de dosis voor volwassenen). Raadpleeg doseringsschema's voor mycobacteriële infecties bij pediatrische patiënten voor aanvullende doseringsinformatie [zie: Doseringsschema's voor mycobacteriële infecties ].
Doseringsregimes voor mycobacteriële infecties
Voor de behandeling van gedissemineerde infectie als gevolg van Mycobacterium avium complex (MAC), worden BIAXIN Filmtab en BIAXIN 500 mg granulaat aanbevolen als de primaire middelen. BIAXIN Filmtab en BIAXIN Granules moeten worden gebruikt in combinatie met andere antimycobacteriële geneesmiddelen (bijv. ethambutol) die in vitro activiteit tegen MAC of klinisch voordeel bij MAC-behandeling hebben laten zien [zie Klinische studies ].
Volwassen patiënten
Voor de behandeling en profylaxe van mycobacteriële infecties bij volwassenen is de aanbevolen dosis BIAXIN 500 mg om de 12 uur.
Pediatrische patiënten
Voor de behandeling en profylaxe van mycobacteriële infecties bij pediatrische patiënten is de aanbevolen dosis 7,5 mg/kg elke 12 uur tot 500 mg elke 12 uur. [Zien Gebruik bij specifieke populaties en Klinische studies ].
De behandeling met BIAXIN 250 mg moet worden voortgezet als een klinische respons wordt waargenomen. BIAXIN kan worden stopgezet wanneer wordt aangenomen dat de patiënt een laag risico op gedissemineerde infectie heeft.
Dosisaanpassing bij patiënten met nierinsufficiëntie
Zie tabel 2 voor dosisaanpassing bij patiënten met matige of ernstige nierfunctiestoornis met of zonder gelijktijdige atazanavir- of ritonavir-bevattende regimes [zie DRUG-INTERACTIES ].
Doseringsaanpassing als gevolg van geneesmiddelinteracties
Verlaag de dosis BIAXIN 500 mg met 50% bij gelijktijdige toediening met atazanavir [zie DRUG-INTERACTIES ]. Dosisaanpassingen voor andere geneesmiddelen bij gelijktijdige toediening met BIAXIN 250 mg kunnen worden aanbevolen vanwege geneesmiddelinteracties [zie DRUG-INTERACTIES ].
Reconstitutie van BIAXIN-korrels
De meegeleverde BIAXIN 250 mg granulaat moet worden gereconstitueerd met water voordat BIAXIN voor orale suspensie wordt toegediend. Tabel 3 hieronder geeft de hoeveelheid water aan die moet worden toegevoegd bij het reconstitutie. Om te reconstitueren:
Goed schudden voor elk gebruik. Na het mengen bewaren bij 15° tot 30°C (59° tot 86°F) en binnen 14 dagen gebruiken. Niet in de koelkast bewaren.
HOE GELEVERD
Doseringsvormen en sterke punten
BIAXIN 500 mg is verkrijgbaar als:
- BIAXIN 250 mg Filmtab (gele ovale filmomhulde tablet):
- 250 mg: bedrukt in blauw met het "a" -logo en KT
- 500 mg: ingeslagen met het "a"-logo aan de ene kant en KL aan de andere kant
- BIAXIN XL Filmtab (gele ovale filmomhulde tablet met verlengde afgifte):
- 500 mg: bedrukt met het “a”-logo en KJ
- BIAXIN-granulaat (witte tot gebroken witte korrels vóór reconstitutie; witte tot gebroken witte ondoorzichtige suspensie na reconstitutie):
- 125 mg/5 ml-concentratie beschikbaar in flessen van 50 ml en 100 ml
- 250 mg/5 ml-concentratie beschikbaar in flessen van 50 ml en 100 ml
Opslag en behandeling
BIAXIN 250 mg Filmtab (claritromycine-tabletten, USP) wordt geleverd als gele ovale filmomhulde tabletten in de volgende verpakkingsgrootten: 250 mg tabletten: (in blauw bedrukt met het “a”-logo en KT)
Flessen van 60 ( NDC 0074-3368-60) en stripverpakkingen voor eenheidsdoses van 100 ( NDC 0074-3368-11).
Bewaar BIAXIN Filmtab 250 mg bij een gecontroleerde kamertemperatuur van 15 ° tot 30 ° C (59 ° tot 86 ° F) in een goed gesloten container. Bescherm tegen licht.
500 mg tabletten : (ingeslagen met het "a"-logo aan de ene kant en KL aan de andere kant)
Flessen van 60 ( NDC 0074-2586-60) en eenheidsdosisstripverpakkingen van 100 ( NDC 0074-2586-11).
Bewaar BIAXIN Filmtab 500 mg bij een gecontroleerde kamertemperatuur van 20 ° tot 25 ° C (68 ° tot 77 ° F) in een goed gesloten container.
BIAXIN XL Filmtab (claritromycine tabletten met verlengde afgifte) wordt geleverd als gele ovale filmomhulde tabletten in de volgende verpakkingsgrootten:
500 mg tabletten : (ingeslagen met het “a”-logo en KJ)
Flessen van 60 ( NDC 0074-3165-60), eenheidsdosisstripverpakkingen van 100 ( NDC 0074-3165-11), en BIAXIN XL PAC doos met 4 blisterverpakkingen 14 tabletten elk ( NDC 0074-3165-41).
Bewaar BIAXIN 500 mg XL Filmtab bij 20 ° tot 25 ° C (68 ° tot 77 ° F). Excursies toegestaan tot 15° tot 30°C (59° tot 86°F). [Zien USP-gecontroleerde kamertemperatuur .]
BIAXIN 500 mg korrels (claritromycine voor orale suspensie, USP) wordt geleverd als witte tot gebroken witte korrels in de volgende sterktes en maten:
Bewaar BIAXIN 500 mg granulaat beneden 25°C (77°F) in een goed gesloten container. Bewaar het gereconstitueerde BIAXIN 500 mg granulaat niet in de koelkast.
BIAXIN Filmtab 250 mg en 500 mg en BIAXIN 250 mg XL Filmtab 500 mg Mfd. door AbbVie LTD, Barceloneta, PR 00617. BIAXIN-korrels, 125 mg/5 ml en 250 mg/5 ml Mfd. door AbbVie Inc., North Chicago, IL 60064 Voor AbbVie Inc., North Chicago, IL 60064, VS Herzien: nov 2018.
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Acute overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige bijwerkingen als gevolg van gelijktijdig gebruik met andere geneesmiddelen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile Geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Exacerbatie van Myasthenia Gravis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
Op basis van gepoolde gegevens voor alle indicaties zijn de meest voorkomende bijwerkingen voor zowel volwassen als pediatrische populaties die zijn waargenomen in klinische onderzoeken buikpijn, diarree, misselijkheid, braken en dysgeusie. Ook werden dyspepsie, abnormale leverfunctietesten, anafylactische reactie, candidiasis, hoofdpijn, slapeloosheid en huiduitslag gemeld.
De volgende paragrafen geven een overzicht van de meest voorkomende bijwerkingen voor profylaxe en behandeling van mycobacteriële infecties en zweren van de twaalfvingerige darm geassocieerd met H. pylori-infectie. Over het algemeen komen deze profielen overeen met de hierboven beschreven gepoolde gegevens.
Profylaxe van mycobacteriële infecties
Bij AIDS-patiënten die gedurende lange perioden met BIAXIN werden behandeld voor profylaxe tegen M. avium, was het vaak moeilijk om bijwerkingen te onderscheiden die mogelijk verband hielden met de toediening van BIAXIN en onderliggende HIV-ziekte of bijkomende ziekte. De mediane duur van de behandeling was 10,6 maanden voor de BIAXIN-groep en 8,2 maanden voor de placebogroep.
Veranderingen in laboratoriumwaarden
Geselecteerde laboratoriumbijwerkingen die tijdens de therapie werden gemeld bij meer dan 2% van de volwassen patiënten die met BIAXIN werden behandeld in een gerandomiseerde dubbelblinde klinische studie met 682 patiënten, worden weergegeven in Tabel 5.
Bij immuungecompromitteerde patiënten die profylaxe tegen M. avium kregen, werden laboratoriumwaarden beoordeeld door die waarden buiten de ernstig abnormale waarde (dwz de extreem hoge of lage limiet) voor de gespecificeerde test te analyseren.
Behandeling van mycobacteriële infecties
De bijwerkingenprofielen voor zowel de 500 mg als de 1000 mg tweemaal daags doseringsschema's waren vergelijkbaar.
Bij AIDS-patiënten en andere immuungecompromitteerde patiënten die gedurende lange perioden met de hogere doses BIAXIN werden behandeld voor mycobacteriële infecties, was het vaak moeilijk om bijwerkingen te onderscheiden die mogelijk verband hielden met de toediening van 250 mg BIAXIN en onderliggende tekenen van hiv-ziekte of bijkomende ziekte.
De volgende analyse vat de ervaring samen tijdens de eerste 12 weken van de behandeling met BIAXIN. Gegevens worden afzonderlijk gerapporteerd voor proef 1 (gerandomiseerd, dubbelblind) en proef 2 (openlabel, compassievol gebruik) en ook gecombineerd. Bijwerkingen werden minder vaak gemeld in onderzoek 2, wat gedeeltelijk te wijten kan zijn aan verschillen in monitoring tussen de twee onderzoeken.
Bij volwassen patiënten die tweemaal daags 500 mg BIAXIN krijgen, worden de meest gemelde bijwerkingen, die mogelijk of mogelijk verband houden met het onderzoeksgeneesmiddel, met een incidentie van 5% of meer, hieronder weergegeven (Tabel 6). Ongeveer 8% van de patiënten die tweemaal daags 500 mg kregen en 12% van de patiënten die tweemaal daags 1000 mg kregen, stopten met de behandeling vanwege geneesmiddelgerelateerde bijwerkingen tijdens de eerste 12 weken van de behandeling; bijwerkingen die leidden tot stopzetting bij ten minste 2 patiënten waren misselijkheid, braken, buikpijn, diarree, huiduitslag en asthenie.
Een beperkt aantal pediatrische AIDS-patiënten is behandeld met BIAXIN-suspensie voor mycobacteriële infecties. De bijwerkingen die het vaakst werden gemeld, met uitzondering van die als gevolg van de gelijktijdige aandoeningen van de patiënt, kwamen overeen met de bijwerkingen die werden waargenomen bij volwassen patiënten.
Veranderingen in laboratoriumwaarden
In de eerste 12 weken na het starten met BIAXIN 500 mg tweemaal daags, had 3% van de patiënten SGOT-verhogingen en 2% van de patiënten had SGPT-verhogingen > 5 keer de bovengrens van normaal in onderzoek 2 (469 ingeschreven volwassen patiënten) terwijl onderzoek 1 (154 ingeschreven patiënten) hadden geen verhoging van transaminasen. Dit omvat alleen patiënten met baselinewaarden binnen het normale bereik of borderline laag.
Duodenumulcus geassocieerd met H. pylori-infectie
In klinische onderzoeken met combinatietherapie met BIAXIN 500 mg plus omeprazol en amoxicilline zijn geen bijwerkingen waargenomen die specifiek zijn voor de combinatie van deze geneesmiddelen. Bijwerkingen die zijn opgetreden, zijn beperkt tot de bijwerkingen die eerder zijn gemeld met BIAXIN 250 mg, omeprazol of amoxicilline.
De bijwerkingenprofielen worden hieronder weergegeven (Tabel 7) voor vier gerandomiseerde dubbelblinde klinische onderzoeken waarin patiënten de combinatie van BIAXIN 500 mg driemaal per dag en omeprazol 40 mg per dag kregen gedurende 14 dagen, gevolgd door omeprazol 20 mg eenmaal per dag dag, (drie onderzoeken) of 40 mg eenmaal daags (één onderzoek) gedurende nog eens 14 dagen. Van de 346 patiënten die de combinatie kregen, stopte 3,5% van de patiënten met het geneesmiddel vanwege bijwerkingen.
Veranderingen in laboratoriumwaarden
Veranderingen in laboratoriumwaarden met mogelijke klinische significantie bij patiënten die BIAXIN en omeprazol gebruiken in vier gerandomiseerde dubbelblinde onderzoeken bij 945 patiënten zijn als volgt:
lever verhoogd direct bilirubine
Minder frequente bijwerkingen waargenomen tijdens klinische onderzoeken met claritromycine
Op basis van gepoolde gegevens voor alle indicaties werden de volgende bijwerkingen waargenomen in klinische onderzoeken met claritromycine met een snelheid van minder dan 1%:
Bloed- en lymfestelselaandoeningen: Leukopenie, neutropenie, trombocytemie, eosinofilie
Hartaandoeningen: Elektrocardiogram QT verlengd, hartstilstand, atriale fibrillatie, extrasystolen, hartkloppingen
Oor- en labyrintaandoeningen: Duizeligheid, tinnitus, slechthorendheid
Maagdarmstelselaandoeningen: Stomatitis, glossitis, oesofagitis, gastro-oesofageale refluxziekte, gastritis, proctalgie, opgezette buik, constipatie, droge mond, oprispingen, flatulentie
Algemene aandoeningen en toedieningsplaatsvoorwaarden: Malaise, koorts, asthenie, pijn op de borst, koude rillingen, vermoeidheid
Lever- en galaandoeningen: Cholestase, hepatitis
Immuunsysteemaandoeningen: overgevoeligheid
Infecties en parasitaire aandoeningen: Cellulitis, gastro-enteritis, infectie, vaginale infectie
onderzoeken: Bloedbilirubine verhoogd, bloed alkalische fosfatase verhoogd, bloed lactaatdehydrogenase verhoogd, albumine globuline ratio abnormaal
Metabolisme en voedingsstoornissen: Anorexia, verminderde eetlust
Musculoskeletale en bindweefselaandoeningen: Myalgie, spierspasmen, nekstijfheid
Zenuwstelselaandoeningen: Duizeligheid, tremor, bewustzijnsverlies, dyskinesie, slaperigheid
Psychische stoornissen: Angst, nervositeit
Nier- en urinewegaandoeningen: Bloedcreatinine verhoogd, bloedureum verhoogd
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: Astma, epistaxis, longembolie
Huid- en onderhuidaandoeningen: Urticaria, bulleuze dermatitis, pruritus, hyperhidrose, maculopapuleuze huiduitslag
Gastro-intestinale bijwerkingen
In de onderzoeken naar acute exacerbatie van chronische bronchitis en acute maxillaire sinusitis werden algemene gastro-intestinale bijwerkingen gemeld door een vergelijkbaar aantal patiënten die BIAXIN 250 mg Filmtab of BIAXIN 500 mg XL Filmtab gebruikten; patiënten die BIAXIN 500 mg filmtab gebruikten, rapporteerden echter significant minder ernstige gastro-intestinale symptomen in vergelijking met patiënten die BIAXIN 250 mg Filmtab gebruikten. Bovendien hadden patiënten die BIAXIN 500 mg XL Filmtab gebruikten significant minder voortijdige stopzettingen vanwege geneesmiddelgerelateerde gastro-intestinale of abnormale smaakbijwerkingen in vergelijking met BIAXIN Filmtab.
Mortaliteit door alle oorzaken bij patiënten met coronaire hartziekte 1 tot 10 jaar na blootstelling aan BIAXIN
In één klinisch onderzoek waarin de behandeling met claritromycine werd geëvalueerd op de resultaten bij patiënten met coronaire hartziekte, werd een verhoogd risico op mortaliteit door alle oorzaken waargenomen bij patiënten die waren gerandomiseerd naar claritromycine. Claritromycine voor de behandeling van coronaire hartziekte is geen goedgekeurde indicatie. Patiënten werden gedurende 14 dagen behandeld met claritromycine of placebo en werden gedurende meerdere jaren geobserveerd op primaire uitkomstmaten (bijv. mortaliteit door alle oorzaken of niet-fatale cardiale voorvallen). waargenomen met een hazard ratio van 1,06 (95% betrouwbaarheidsinterval 0,98 tot 1,14). Bij follow-up 10 jaar na de behandeling waren er echter 866 (40%) sterfgevallen in de claritromycinegroep en 815 (37%) sterfgevallen in de placebogroep, wat neerkwam op een hazard ratio voor mortaliteit door alle oorzaken van 1,10 (95%) betrouwbaarheidsinterval 1,00 tot 1,21). Het verschil in het aantal sterfgevallen ontstond een jaar of langer na het einde van de behandeling.
De oorzaak van het verschil in sterfte door alle oorzaken is niet vastgesteld. Andere epidemiologische onderzoeken die dit risico evalueren, hebben wisselende resultaten laten zien [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van BIAXIN na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed en lymfestelsel: Trombocytopenie, agranulocytose
Hart: Ventriculaire aritmie, ventriculaire tachycardie, torsades de pointes
Oor en Labyrint: Doofheid werd voornamelijk gemeld bij oudere vrouwen en was meestal reversibel.
Gastro-intestinaal: Acute pancreatitis, tongverkleuring, tandverkleuring werden gemeld en waren gewoonlijk reversibel met professionele reiniging na stopzetting van het geneesmiddel.
Er zijn meldingen geweest van BIAXIN 250 mg XL Filmtab in de ontlasting, waarvan er vele zijn opgetreden bij patiënten met anatomische (inclusief ileostoma of colostoma) of functionele gastro-intestinale stoornissen met verkorte GI-transittijden. In verschillende meldingen zijn tabletresten opgetreden in het kader van diarree. Het wordt aanbevolen dat patiënten die tabletresten in de ontlasting ervaren en geen verbetering van hun toestand ervaren, over te schakelen op een andere claritromycineformulering (bijv. suspensie) of een ander antibacterieel geneesmiddel.
Lever- en gal: Leverfalen, geelzucht hepatocellulair. Bijwerkingen gerelateerd aan leverdisfunctie zijn gemeld met claritromycine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Infecties en parasitaire aandoeningen: Pseudomembraneuze colitis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Immuunsysteem: Anafylactische reacties, angio-oedeem
onderzoeken: Protrombinetijd verlengd, aantal witte bloedcellen verlaagd, internationaal genormaliseerde ratio verhoogd. Er is melding gemaakt van een abnormale kleur van de urine, geassocieerd met leverfalen.
Metabolisme en voeding: Hypoglykemie is gemeld bij patiënten die orale hypoglykemische middelen of insuline gebruikten.
Musculoskeletaal en bindweefsel: Myopathie rabdomyolyse werd gemeld en in sommige van de meldingen werd claritromycine gelijktijdig toegediend met statines, fibraten, colchicine of allopurinol [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zenuwstelsel: Parosmie, anosmie, ageusie, paresthesie en convulsies
Psychiatrisch: Abnormaal gedrag, verwarde toestand, depersonalisatie, desoriëntatie, hallucinatie, depressie, manisch gedrag, abnormale dromen, psychotische stoornis. Deze stoornissen verdwijnen meestal na stopzetting van het medicijn.
Nier en urine: Interstitiële nefritis, nierfalen
Huid en onderhuids weefsel: Stevens-Johnson-syndroom, toxische epidermale necrolyse, medicijnuitslag met eosinofilie en systemische symptomen (DRESS), Henoch-Schonlein-purpura, acne, acute gegeneraliseerde exanthemateuze pustulosis
Vasculair: Bloeding
DRUG-INTERACTIES
Het is bekend dat gelijktijdige toediening van BIAXIN 250 mg CYP3A remt, en een geneesmiddel dat voornamelijk door CYP3A wordt gemetaboliseerd, kan in verband worden gebracht met verhogingen van de geneesmiddelconcentraties die zowel de therapeutische als de bijwerkingen van het gelijktijdige geneesmiddel zouden kunnen verhogen of verlengen.
BIAXIN moet met voorzichtigheid worden gebruikt bij patiënten die worden behandeld met andere geneesmiddelen waarvan bekend is dat ze CYP3A-enzymsubstraten zijn, vooral als het CYP3A-substraat een smalle veiligheidsmarge heeft (bijv. carbamazepine) en/of het substraat uitgebreid wordt gemetaboliseerd door dit enzym. Pas de dosering indien nodig aan en controleer de serumconcentraties van geneesmiddelen die voornamelijk door CYP3A worden gemetaboliseerd bij patiënten die gelijktijdig claritromycine krijgen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Acute overgevoeligheidsreacties
In het geval van ernstige acute overgevoeligheidsreacties, zoals anafylaxie, Stevens-Johnson-syndroom, toxische epidermale necrolyse, geneesmiddeluitslag met eosinofilie en systemische symptomen (DRESS), Henoch-Schonlein-purpura en acute gegeneraliseerde exanthemateuze pustulose, stop dan onmiddellijk met de behandeling met BIAXIN 250 mg en passende behandeling instellen.
QT-verlenging
BIAXIN 500 mg is in verband gebracht met verlenging van het QT-interval en zeldzame gevallen van aritmie. Gevallen van torsades de pointes zijn spontaan gemeld tijdens postmarketingsurveillance bij patiënten die BIAXIN kregen. Er zijn doden gemeld.
Vermijd BIAXIN bij de volgende patiënten:
- patiënten met bekende verlenging van het QT-interval, ventriculaire hartritmestoornissen, waaronder torsades de pointes
- patiënten die geneesmiddelen krijgen waarvan bekend is dat ze het QT-interval verlengen [zie ook: CONTRA-INDICATIES ]
- patiënten met aanhoudende pro-aritmische aandoeningen zoals ongecorrigeerde hypokaliëmie of hypomagnesiëmie, klinisch significante bradycardie en bij patiënten die klasse IA (bijv. kinidine, procaïnamide, disopyramide) of klasse III (bijv. dofetilide, amiodaron, sotalol) krijgen anti-aritmica.
Oudere patiënten kunnen gevoeliger zijn voor geneesmiddelgerelateerde effecten op het QT-interval [zie: Gebruik bij specifieke populaties ].
Hepatotoxiciteit
Leverfunctiestoornissen, waaronder verhoogde leverenzymen, en hepatocellulaire en/of cholestatische hepatitis, met of zonder geelzucht, zijn gemeld met claritromycine. Deze leverfunctiestoornis kan ernstig zijn en is meestal omkeerbaar. In sommige gevallen is leverfalen met fatale afloop gemeld en dit is in het algemeen in verband gebracht met ernstige onderliggende ziekten en/of gelijktijdige medicatie. Symptomen van hepatitis kunnen anorexia, geelzucht, donkere urine, jeuk of een gevoelige buik zijn. Stop onmiddellijk met BIAXIN 500 mg als er tekenen en symptomen van hepatitis optreden.
Ernstige bijwerkingen als gevolg van gelijktijdig gebruik met andere geneesmiddelen
Geneesmiddelen gemetaboliseerd door CYP3A4
Ernstige bijwerkingen zijn gemeld bij patiënten die BIAXIN gelijktijdig met CYP3A4-substraten gebruikten. Deze omvatten colchicine-toxiciteit met colchicine; rabdomyolyse met simvastatine, lovastatine en atorvastatine; hypoglykemie en hartritmestoornissen (bijv. torsades de pointes) met disopyramide; hypotensie en acuut nierletsel met calciumkanaalblokkers gemetaboliseerd door CYP3A4 (bijv. verapamil, amlodipine, diltiazem, nifedipine). De meeste meldingen van acuut nierletsel met calciumkanaalblokkers die door CYP3A4 worden gemetaboliseerd, hadden betrekking op oudere patiënten van 65 jaar of ouder. Gebruik BIAXIN 500 mg met voorzichtigheid wanneer het gelijktijdig wordt toegediend met medicijnen die het cytochroom CYP3A4-enzym induceren. Het gebruik van BIAXIN 250 mg met simvastatine, lovastatine, ergotamine of dihydro-ergotamine is gecontra-indiceerd [zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
Colchicine
Levensbedreigende en fatale geneesmiddelinteracties zijn gemeld bij patiënten die werden behandeld met BIAXIN en colchicine. Claritromycine is een sterke CYP3A4-remmer en deze interactie kan optreden bij gebruik van beide geneesmiddelen in de aanbevolen doses. Als gelijktijdige toediening van BIAXIN en colchicine nodig is bij patiënten met een normale nier- en leverfunctie, verlaag dan de dosis colchicine. Patiënten controleren op klinische symptomen van colchicine-toxiciteit. Gelijktijdige toediening van BIAXIN 500 mg en colchicine is gecontra-indiceerd bij patiënten met nier- of leverinsufficiëntie (zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
HMG-CoA-reductaseremmers (statines)
Gelijktijdig gebruik van BIAXIN met lovastatine of simvastatine is gecontra-indiceerd (zie CONTRA-INDICATIES aangezien deze statines uitgebreid worden gemetaboliseerd door CYP3A4, en gelijktijdige behandeling met BIAXIN verhoogt hun plasmaconcentratie, wat het risico op myopathie, waaronder rabdomyolyse, verhoogt. Gevallen van rabdomyolyse zijn gemeld bij patiënten die BIAXIN gelijktijdig met deze statines gebruikten. Als behandeling met BIAXIN niet kan worden vermeden, moet de behandeling met lovastatine of simvastatine tijdens de behandeling worden gestaakt.
Wees voorzichtig bij het voorschrijven van BIAXIN 250 mg met atorvastatine of pravastatine. In situaties waarin gelijktijdig gebruik van BIAXIN met atorvastatine of pravastatine niet kan worden vermeden, mag de dosis atorvastatine niet hoger zijn dan 20 mg per dag en mag de dosis pravastatine niet hoger zijn dan 40 mg per dag. Het gebruik van een statine die niet afhankelijk is van het CYP3A-metabolisme (bijv. fluvastatine) kan worden overwogen. Het wordt aanbevolen om de laagst geregistreerde dosis voor te schrijven als gelijktijdig gebruik niet kan worden vermeden.
Orale hypoglykemische middelen/insuline
Gelijktijdig gebruik van BIAXIN 500 mg en orale bloedglucoseverlagende middelen en/of insuline kan leiden tot significante hypoglykemie. Bij bepaalde hypoglykemische geneesmiddelen, zoals nateglinide, pioglitazon, repaglinide en rosiglitazon, kan remming van het CYP3A-enzym door claritromycine een rol spelen en hypoglykemie veroorzaken bij gelijktijdig gebruik. Zorgvuldige controle van glucose wordt aanbevolen [zie DRUG-INTERACTIES ].
Quetiapine
Gebruik quetiapine en claritromycine gelijktijdig met voorzichtigheid. Gelijktijdige toediening kan leiden tot een verhoogde blootstelling aan quetiapine en quetiapine-gerelateerde toxiciteiten zoals slaperigheid, orthostatische hypotensie, veranderde bewustzijnstoestand, maligne neurolepticasyndroom en QT-verlenging. Raadpleeg de voorschrijfinformatie van quetiapine voor aanbevelingen over dosisverlaging bij gelijktijdige toediening met CYP3A4-remmers zoals claritromycine (zie DRUG-INTERACTIES ].
Orale anticoagulantia
Er is een risico op ernstige bloedingen en significante verhogingen van INR en protrombinetijd wanneer BIAXIN gelijktijdig wordt toegediend met warfarine. Controleer de INR- en protrombinetijden regelmatig terwijl patiënten gelijktijdig BIAXIN en orale anticoagulantia krijgen [zie: DRUG-INTERACTIES ].
Benzodiazepinen
Verhoogde sedatie en verlenging van de sedatie zijn gemeld bij gelijktijdige toediening van BIAXIN 250 mg en triazolobenzodiazepinen, zoals triazolam en midazolam (zie DRUG-INTERACTIES ].
Mortaliteit door alle oorzaken bij patiënten met coronaire hartziekte 1 tot 10 jaar na blootstelling aan BIAXIN
In één klinisch onderzoek waarin de behandeling met claritromycine werd geëvalueerd op de resultaten bij patiënten met coronaire hartziekte, werd een toename van het risico op mortaliteit door alle oorzaken één jaar of langer na het einde van de behandeling waargenomen bij patiënten die waren gerandomiseerd om claritromycine te krijgen.1 Claritromycine voor de behandeling van coronaire hartziekte slagaderziekte is geen goedgekeurde indicatie. De oorzaak van het verhoogde risico is niet vastgesteld. Andere epidemiologische onderzoeken die dit risico evalueren, hebben wisselende resultaten laten zien [zie ONGEWENSTE REACTIES ]. Overweeg om dit potentiële risico af te wegen tegen de voordelen van de behandeling bij het voorschrijven van BIAXIN aan patiënten bij wie een coronaire hartziekte wordt vermoed of bevestigd.
Clostridium Difficile Geassocieerde Diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder BIAXIN, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na antibacterieel gebruik. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het lopende antibacteriële gebruik dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële behandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Embryofetale toxiciteit
Claritromycine mag niet worden gebruikt bij zwangere vrouwen, behalve in klinische omstandigheden waarin geen alternatieve therapie geschikt is. Als BIAXIN 500 mg tijdens de zwangerschap wordt gebruikt, of als er zwangerschap optreedt terwijl de patiënte dit geneesmiddel gebruikt, moet de patiënt op de hoogte zijn van het mogelijke gevaar voor de foetus. Claritromycine heeft nadelige effecten aangetoond op de uitkomst van de zwangerschap en/of de embryo-foetale ontwikkeling bij apen, ratten, muizen en konijnen bij doses die plasmaspiegels produceerden die 2 keer tot 17 keer zo hoog waren als de serumspiegels die werden bereikt bij mensen die werden behandeld met de maximaal aanbevolen doses voor de mens [zie Gebruik bij specifieke populaties ].
Exacerbatie van Myasthenia Gravis
Verergering van symptomen van myasthenia gravis en nieuwe symptomen van myasthenisch syndroom zijn gemeld bij patiënten die behandeld werden met BIAXIN 250 mg.
Ontwikkeling van geneesmiddelresistente bacteriën
Het voorschrijven van BIAXIN bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
De volgende in vitro mutageniteitstesten zijn uitgevoerd met claritromycine:
- Test op salmonella/zoogdiermicrosomen
- Bacteriële geïnduceerde mutatiefrequentietest
- In vitro chromosoomafwijkingstest
- Rat hepatocyt DNA-synthese-assay
- Lymfoomtest bij muizen
- Muis dominante dodelijke studie
- Muis Micronucleus-test
Alle tests hadden negatieve resultaten, behalve de in vitro chromosoomafwijkingstest die positief was in de ene test en negatief in de andere. Daarnaast is een bacteriële reverse-mutatietest (Ames-test) uitgevoerd op claritromycinemetabolieten met negatief resultaat.
Aantasting van de vruchtbaarheid
Vruchtbaarheids- en reproductieonderzoeken hebben aangetoond dat dagelijkse doses tot 160 mg/kg/ aan mannelijke en vrouwelijke ratten geen nadelige effecten hadden op de oestruscyclus, vruchtbaarheid, bevalling of het aantal en de levensvatbaarheid van nakomelingen. Plasmaspiegels bij ratten na 150 mg/kg/dag waren tweemaal de humane serumspiegels.
Testiculaire atrofie trad op bij ratten in doses van 7 keer, bij honden in doses van 3 keer en bij apen in doses die 8 keer hoger waren dan de maximale dagelijkse dosis voor de mens (op basis van het lichaamsoppervlak).
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Claritromycine mag niet worden gebruikt bij zwangere vrouwen, behalve in klinische omstandigheden waarin geen alternatieve therapie geschikt is. Als zwangerschap optreedt tijdens het gebruik van dit medicijn, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vier teratogeniteitsstudies bij ratten (drie met orale doses en één met intraveneuze doses tot 160 mg/kg/dag toegediend tijdens de periode van belangrijke organogenese) en twee bij konijnen met orale doses tot 125 mg/kg/dag (ongeveer tweemaal de aanbevolen maximale humane dosis op basis van mg/m²) of intraveneuze doses van 30 mg/kg/dag toegediend tijdens de zwangerschapsdagen 6 tot 18 konden geen teratogeniteit van claritromycine aantonen. Twee aanvullende orale onderzoeken bij een andere rattenstam bij vergelijkbare doses en vergelijkbare omstandigheden toonden een lage incidentie van cardiovasculaire afwijkingen aan bij doses van 150 mg/kg/dag toegediend tijdens de dracht van dag 6 tot 15.
Plasmaspiegels na 150 mg/kg/dag waren tweemaal de humane serumspiegels. Vier studies bij muizen lieten een variabele incidentie van gespleten gehemelte zien na orale doses van 1000 mg/kg/dag (respectievelijk 2 en 4 maal de aanbevolen maximale dosis voor de mens gebaseerd op mg/m²) tijdens de draagtijd van 6 tot 15 dagen. gezien bij 500 mg/kg/dag. De blootstelling aan 1000 mg/kg/dag resulteerde in plasmaspiegels die 17 keer hoger waren dan de humane serumspiegels. Bij apen veroorzaakte een orale dosis van 70 mg/kg/dag foetale groeivertraging bij plasmaspiegels die tweemaal de humane serumspiegels waren.
Moeders die borstvoeding geven
Voorzichtigheid is geboden wanneer BIAXIN wordt toegediend aan vrouwen die borstvoeding geven. De ontwikkeling en gezondheidsvoordelen van voeding met moedermelk moeten worden overwogen, samen met de klinische behoefte van de moeder aan BIAXIN en eventuele nadelige effecten op het met moedermelk gevoede kind van het geneesmiddel of van de onderliggende maternale aandoening.
Claritromycine en zijn actieve metaboliet 14-hydroxyclaritromycine worden uitgescheiden in de moedermelk. Serum- en melkmonsters werden verkregen na 3 dagen behandeling, bij steady-state, uit één gepubliceerd onderzoek van 12 zogende vrouwen die BIAXIN 250 mg tweemaal daags oraal innamen. Op basis van de beperkte gegevens van dit onderzoek en uitgaande van een melkconsumptie van 150 ml/kg/dag, zou een zuigeling die uitsluitend met moedermelk wordt gevoed, naar schatting gemiddeld 136 mcg/kg/dag claritromycine en zijn actieve metaboliet krijgen met deze maternale dosering regime. Dit is minder dan 2% van de voor het gewicht van de moeder aangepaste dosis (7,8 mg/kg/dag, gebaseerd op het gemiddelde maternale gewicht van 64 kg) en minder dan 1% van de pediatrische dosis (15 mg/kg/dag) voor kinderen ouder dan 6 maanden.
Een prospectief observationeel onderzoek bij 55 zuigelingen die borstvoeding kregen van moeders die een macrolide antibacterieel middel gebruikten (6 werden blootgesteld aan claritromycine) werd vergeleken met 36 zuigelingen die borstvoeding kregen van moeders die amoxicilline gebruikten. Bijwerkingen waren vergelijkbaar in beide groepen. Bijwerkingen traden op bij 12,7% van de zuigelingen die werden blootgesteld aan macroliden en omvatten huiduitslag, diarree, verlies van eetlust en slaperigheid.
Pediatrisch gebruik
De veiligheid en werkzaamheid van BIAXIN Filmtab en BIAXIN 500 mg granulaat zijn vastgesteld voor de behandeling van de volgende aandoeningen of ziekten bij pediatrische patiënten van 6 maanden en ouder. Gebruik bij deze indicaties is gebaseerd op klinische onderzoeken bij pediatrische patiënten of adequate en goed gecontroleerde onderzoeken bij volwassenen met aanvullende farmacokinetische en veiligheidsgegevens bij pediatrische patiënten:
- Faryngitis/tonsillitis
- Gemeenschap verworven pneumonie
- Acute maxillaire sinusitis
- Acute middenoorontsteking [zie Klinische studies ]
- Ongecompliceerde huid- en huidstructuurinfecties
De veiligheid en werkzaamheid van BIAXIN 500 mg Filmtab en BIAXIN 500 mg granulaat zijn vastgesteld voor de preventie van gedissemineerde ziekte van Mycobacterium avium complex (MAC) bij pediatrische patiënten van 20 maanden en ouder met gevorderde hiv-infectie. Er zijn geen onderzoeken naar BIAXIN voor MAC-profylaxe uitgevoerd bij pediatrische populaties en de aanbevolen doses voor profylaxe zijn afgeleid van MAC-onderzoeken naar pediatrische behandelingen.
De veiligheid en werkzaamheid van BIAXIN 500 mg XL Filmtab bij de behandeling van pediatrische patiënten is niet vastgesteld.
De veiligheid en werkzaamheid van BIAXIN 250 mg bij pediatrische patiënten jonger dan 6 maanden zijn niet vastgesteld. De veiligheid van BIAXIN 500 mg is niet onderzocht bij MAC-patiënten jonger dan 20 maanden.
Geriatrisch gebruik
In een steady-state-onderzoek waarbij gezonde oudere proefpersonen (65 jaar tot 81 jaar oud) elke 12 uur 500 mg BIAXIN kregen, waren de maximale serumconcentraties en de oppervlakte onder de curve van claritromycine en 14-OH claritromycine verhoogd in vergelijking met die bereikt worden bij gezonde jonge volwassenen. Deze veranderingen in de farmacokinetiek lopen parallel met bekende leeftijdsgerelateerde dalingen van de nierfunctie. In klinische onderzoeken hadden oudere patiënten geen verhoogde incidentie van bijwerkingen in vergelijking met jongere patiënten. Overweeg dosisaanpassing bij oudere patiënten met een ernstige nierfunctiestoornis. Oudere patiënten kunnen vatbaarder zijn voor de ontwikkeling van torsades de pointes-aritmieën dan jongere patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De meeste meldingen van acuut nierletsel met calciumkanaalblokkers gemetaboliseerd door CYP3A4 (bijv. verapamil, amlodipine, diltiazem, nifedipine) hadden betrekking op oudere patiënten van 65 jaar of ouder (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vooral bij oudere patiënten zijn er meldingen geweest van colchicine-toxiciteit bij gelijktijdig gebruik van claritromycine en colchicine, waarvan sommige optraden bij patiënten met nierinsufficiëntie. Bij sommige patiënten zijn sterfgevallen gemeld [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nier- en leverfunctiestoornis
BIAXIN 500 mg wordt voornamelijk uitgescheiden via de lever en de nieren. BIAXIN kan zonder dosisaanpassing worden toegediend aan patiënten met een leverfunctiestoornis en een normale nierfunctie. In de aanwezigheid van een ernstige nierfunctiestoornis met of zonder gelijktijdige leverfunctiestoornis, kan een verlaagde dosering of verlengde doseringsintervallen echter geschikt zijn [zie DOSERING EN ADMINISTRATIE ].
REFERENTIES
1.Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. Claritromycine voor stabiele coronaire hartziekte verhoogt de mortaliteit door alle oorzaken en cardiovasculaire mortaliteit en cerebrovasculaire morbiditeit gedurende 10 jaar in de gerandomiseerde, geblindeerde klinische studie CLARICOR. Int J Cardiol 2015; 182: 459-65.
OVERDOSERING
Overdosering van BIAXIN kan gastro-intestinale symptomen veroorzaken, zoals buikpijn, braken, misselijkheid en diarree.
Behandel bijwerkingen die gepaard gaan met overdosering door de snelle eliminatie van niet-geabsorbeerd geneesmiddel en ondersteunende maatregelen. Net als bij andere macroliden wordt niet verwacht dat de BIAXIN-serumconcentraties merkbaar worden beïnvloed door hemodialyse of peritoneale dialyse.
CONTRA-INDICATIES
overgevoeligheid
BIAXIN is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor claritromycine, erytromycine of een van de macrolide antibacteriële geneesmiddelen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hartritmestoornissen
Gelijktijdige toediening van BIAXIN met cisapride en pimozide is gecontra-indiceerd [zie: DRUG-INTERACTIES ].
Er zijn postmarketingmeldingen geweest van geneesmiddelinteracties wanneer claritromycine gelijktijdig wordt toegediend met cisapride of pimozide, resulterend in hartritmestoornissen (QT-verlenging, ventriculaire tachycardie, ventriculaire fibrillatie en torsades de pointes), hoogstwaarschijnlijk als gevolg van remming van het metabolisme van deze geneesmiddelen door BIAXIN . Er zijn doden gemeld.
Cholestatische geelzucht/leverfunctiestoornis
BIAXIN is gecontra-indiceerd bij patiënten met een voorgeschiedenis van cholestatische geelzucht of leverdisfunctie geassocieerd met eerder gebruik van claritromycine.
Colchicine
Gelijktijdige toediening van BIAXIN en colchicine is gecontra-indiceerd bij patiënten met nier- of leverinsufficiëntie.
HMG-CoA-reductaseremmers
Gebruik BIAXIN niet gelijktijdig met HMG-CoA-reductaseremmers (statines) die uitgebreid worden gemetaboliseerd door CYP3A4 (lovastatine of simvastatine), vanwege het verhoogde risico op myopathie, waaronder rabdomyolyse (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Ergot-alkaloïden
Gelijktijdige toediening van claritromycine en ergotamine of dihydro-ergotamine is gecontra-indiceerd [zie DRUG-INTERACTIES ].
Contra-indicaties voor gelijktijdig toegediende geneesmiddelen
Voor informatie over contra-indicaties van andere geneesmiddelen die in combinatie met BIAXIN zijn geïndiceerd, raadpleegt u hun volledige voorschrijfinformatie (sectie contra-indicaties).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Claritromycine is een macrolide antimicrobieel geneesmiddel [zie Microbiologie ].
Farmacokinetiek
Absorptie
BIAXIN 250 mg Filmtab-tabletten met onmiddellijke afgifte
De absolute biologische beschikbaarheid van 250 mg claritromycinetabletten was ongeveer 50%. Voor een enkelvoudige dosis van 500 mg claritromycine vertraagt voedsel enigszins de aanvang van de claritromycine-absorptie, waardoor de piektijd wordt verlengd van ongeveer 2 tot 2,5 uur. Voedsel verhoogt ook de piekplasmaconcentratie van claritromycine met ongeveer 24%, maar heeft geen invloed op de mate van biologische beschikbaarheid van claritromycine. Voedsel heeft geen invloed op het begin van de vorming van de actieve metaboliet, 14-OH-claritromycine of de piekplasmaconcentratie ervan, maar vermindert de mate van metabolietvorming enigszins, wat wordt aangegeven door een afname van 11% van de oppervlakte onder de plasmaconcentratie-tijdcurve (AUC) . Daarom kan BIAXIN Filmtab zonder voedsel worden gegeven. Bij niet-nuchtere gezonde proefpersonen (mannen en vrouwen) werden piekplasmaconcentraties bereikt binnen 2 tot 3 uur na orale toediening.
BIAXIN 500 mg XL Filmtab-tabletten met verlengde afgifte
Claritromycine tabletten met verlengde afgifte zorgen voor een verlengde absorptie van claritromycine uit het maagdarmkanaal na orale toediening. In vergelijking met een gelijke totale dagelijkse dosis claritromycinetabletten met onmiddellijke afgifte, leveren claritromycinetabletten met verlengde afgifte lagere en latere steady-state piekplasmaconcentraties maar equivalente 24-uurs AUC's voor zowel claritromycine als zijn microbiologisch actieve metaboliet, 14-OH claritromycine. Hoewel de mate van vorming van 14-OH claritromycine na toediening van BIAXIN 500 mg XL Filmtab (2 x 500 mg tabletten eenmaal daags) niet wordt beïnvloed door voedsel, wordt toediening in nuchtere toestand geassocieerd met ongeveer 30% lagere AUC van claritromycine in vergelijking met toediening met voedsel . Daarom moet BIAXIN 250 mg XL Filmtab met voedsel worden ingenomen.
Figuur 2: Steady-state claritromycine-plasmaconcentratie-tijdprofielen 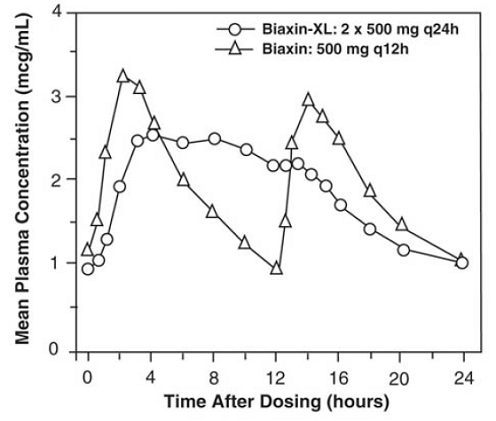
BIAXIN-korrels voor orale suspensie
Wanneer doses van 250 mg claritromycine als BIAXIN als orale suspensie werden toegediend aan nuchtere gezonde volwassen proefpersonen, werden piekplasmaconcentraties ongeveer 3 uur na toediening bereikt.
Voor volwassen patiënten is de biologische beschikbaarheid van 10 ml van de 125 mg/5 ml suspensie of 10 ml van de 250 mg/5 ml suspensie vergelijkbaar met respectievelijk een 250 mg of 500 mg tablet.
Bij volwassenen die 250 mg claritromycine als suspensie kregen (n = 22), bleek voedsel de gemiddelde piekplasmaconcentraties van claritromycine te verlagen van 1,2 (± 0,4) mcg/ml tot 1,0 (± 0,4) mcg/ml en de mate van absorptie van 7,2 (± 2,5) uur•mcg/ml tot 6,5 (± 3,7) uur•mcg/ml.
Verdeling
Claritromycine en de 14-OH-claritromycinemetaboliet worden gemakkelijk in lichaamsweefsels en -vloeistoffen verdeeld. Er zijn geen gegevens beschikbaar over penetratie van cerebrospinale vloeistof. Vanwege de hoge intracellulaire concentraties zijn de weefselconcentraties hoger dan de serumconcentraties. Voorbeelden van weefsel- en serumconcentraties worden hieronder weergegeven.
Metabolisme en eliminatie
BIAXIN 500 mg Filmtab-tabletten met onmiddellijke afgifte
Steady-state piekplasmaconcentraties van claritromycine werden bereikt binnen 3 dagen en waren ongeveer 1 mcg/ml tot 2 mcg/ml bij een dosis van 250 mg die elke 12 uur werd toegediend en 3 mcg/ml tot 4 mcg/ml bij een dosis van 500 mg die elke 12 uur werd toegediend. 8 uur tot 12 uur. De eliminatiehalfwaardetijd van claritromycine was ongeveer 3 uur tot 4 uur met 250 mg elke 12 uur, maar nam toe tot 5 uur tot 7 uur met 500 mg elke 8 uur tot 12 uur. De niet-lineariteit van de farmacokinetiek van claritromycine is gering bij de aanbevolen doses van 250 mg en 500 mg die elke 8 uur tot 12 uur worden toegediend. Bij een dosering van 250 mg om de 12 uur bereikt de belangrijkste metaboliet, 14-OH claritromycine, een maximale steady-state-concentratie van ongeveer 0,6 mcg/ml en heeft een eliminatiehalfwaardetijd van 5 uur tot 6 uur. Bij een dosering van 500 mg om de 8 uur tot 12 uur is de maximale steady-state-concentratie van 14-OH claritromycine iets hoger (tot 1 mcg/ml) en is de eliminatiehalfwaardetijd ongeveer 7 uur tot 9 uur. Bij elk van deze doseringsschema's wordt de steady-state-concentratie van deze metaboliet over het algemeen binnen 3 dagen tot 4 dagen bereikt.
Na een tablet van 250 mg om de 12 uur wordt ongeveer 20% van de dosis in de urine uitgescheiden als claritromycine, terwijl na een tablet van 500 mg om de 12 uur de urinaire excretie van claritromycine iets groter is, ongeveer 30%. Ter vergelijking: na een orale dosis van 250 mg (125 mg/5 ml) suspensie om de 12 uur wordt ongeveer 40% in de urine uitgescheiden als claritromycine. De renale klaring van claritromycine is echter relatief onafhankelijk van de dosisgrootte en benadert de normale glomerulaire filtratiesnelheid. De belangrijkste metaboliet die in de urine wordt aangetroffen, is 14-OH-claritromycine, dat nog eens 10% tot 15% van de dosis uitmaakt bij toediening van een tablet van 250 mg of 500 mg om de 12 uur.
BIAXIN 250 mg XL Filmtab-tabletten met verlengde afgifte
Bij gezonde proefpersonen werden steady-state piekplasmaconcentraties van claritromycine van ongeveer 2 mcg/ml tot 3 mcg/ml bereikt ongeveer 5 uur tot 8 uur na orale toediening van 1000 mg BIAXIN 250 mg XL Filmtab eenmaal daags; voor 14-OH claritromycine werden ongeveer 6 uur tot 9 uur na toediening steady-state piekplasmaconcentraties van ongeveer 0,8 mcg/ml bereikt. Steady-state piekplasmaconcentraties van claritromycine van ongeveer 1 mcg/ml tot 2 mcg/ml werden ongeveer 5 uur tot 6 uur na orale toediening van een enkelvoudige 500 mg BIAXIN XL Filmtab eenmaal daags bereikt; voor 14-OH claritromycine werden ongeveer 6 uur na toediening steady-state piekplasmaconcentraties van ongeveer 0,6 mcg/ml bereikt.
Steady-state piekplasmaconcentraties werden bereikt in 2 dagen tot 3 dagen en waren ongeveer 2 mcg/ml voor claritromycine en 0,7 mcg/ml voor 14-OH claritromycine wanneer doses van 250 mg van de claritromycinesuspensie om de 12 uur werden toegediend. De eliminatiehalfwaardetijd van claritromycine (3 uur tot 4 uur) en die van 14-OH claritromycine (5 uur tot 7 uur) waren vergelijkbaar met die waargenomen bij steady state na toediening van equivalente doses BIAXIN Filmtab.
Specifieke populaties voor BIAXIN Filmtab, BIAXIN 500 mg XL Filmtab en BIAXIN 250 mg granulaatformuleringen
BIAXIN-korrels voor orale suspensie bij pediatrische patiënten
Claritromycine dringt door in het middenoorvocht van pediatrische patiënten met secretoire otitis media.
Wanneer pediatrische patiënten (n = 10) een enkelvoudige orale dosis van 7,5 mg/kg BIAXIN 500 mg als orale suspensie kregen toegediend, verhoogde voedsel de gemiddelde piekplasmaconcentraties van claritromycine van 3,6 (± 1,5) mcg/ml tot 4,6 (± 2,8) mcg/ ml en de mate van absorptie van 10,0 (± 5,5) hr•mcg/ml tot 14,2 (± 9,4) hr•mcg/ml.
Bij pediatrische patiënten die antibacteriële therapie nodig hadden, resulteerde toediening van 7,5 mg/kg om de 12 uur van BIAXIN als orale suspensie in het algemeen in steady-state piekplasmaconcentraties van 3 mcg/ml tot 7 mcg/ml voor claritromycine en 1 mcg/ml tot 2 mcg/ml voor 14-OH claritromycine.
Bij hiv-geïnfecteerde pediatrische patiënten die om de 12 uur 15 mg/kg BIAXIN als orale suspensie gebruikten, varieerden de steady-state-piekconcentraties van claritromycine in het algemeen van 6 mcg/ml tot 15 mcg/ml.
HIV-infectie
Steady-state concentraties van claritromycine en 14-OH claritromycine die werden waargenomen na toediening van 500 mg doses claritromycine om de 12 uur aan volwassen patiënten met een HIV-infectie waren vergelijkbaar met die waargenomen bij gezonde vrijwilligers. Bij volwassen met HIV geïnfecteerde patiënten die om de 12 uur doses claritromycine van 500 mg of 1000 mg innamen, varieerden de Cmax-waarden van steady-state van respectievelijk 2 mcg/ml tot 4 mcg/ml en 5 mcg/ml tot 10 mcg/ml. .
Leverfunctiestoornis
De steady-state-concentraties van claritromycine bij proefpersonen met een verminderde leverfunctie verschilden niet van die bij normale proefpersonen; de 14-OH-claritromycineconcentraties waren echter lager bij de patiënten met een leverfunctiestoornis. De verminderde vorming van 14-OH-claritromycine werd ten minste gedeeltelijk gecompenseerd door een toename van de renale klaring van claritromycine bij proefpersonen met een verminderde leverfunctie in vergelijking met gezonde proefpersonen.
Nierfunctiestoornis
De farmacokinetiek van claritromycine was ook veranderd bij proefpersonen met een verminderde nierfunctie [zie: Gebruik bij specifieke populaties en DOSERING EN ADMINISTRATIE ].
Geneesmiddelinteracties
Fluconazol
Na toediening van fluconazol 200 mg per dag en claritromycine 500 mg tweemaal per dag aan 21 gezonde vrijwilligers, stegen de steady-state Cmin en AUC van claritromycine met respectievelijk 33% en 18%. De blootstelling aan claritromycine was verhoogd en de steady-state-concentraties van 14-OH-claritromycine werden niet significant beïnvloed door gelijktijdige toediening van fluconazol.
Colchicine
Wanneer een enkele dosis colchicine 0,6 mg werd toegediend met claritromycine 250 mg tweemaal daags gedurende 7 dagen, nam de colchicine Cmax toe met 197% en de AUC0-∞ nam toe met 239% in vergelijking met toediening van colchicine alleen.
Atazanavir
Na toediening van claritromycine (500 mg tweemaal daags) met atazanavir (400 mg eenmaal daags) nam de AUC van claritromycine met 94% toe, de AUC van 14-OH claritromycine met 70% en de AUC van atazanavir met 28%.
Ritonavir
Gelijktijdige toediening van claritromycine en ritonavir (n = 22) resulteerde in een toename van 77% van de AUC van claritromycine en een afname van 100% van de AUC van 14-OH-claritromycine.
Saquinavir
Na toediening van claritromycine (500 mg tweemaal daags) en saquinavir (zachte gelatinecapsules, 1200 mg driemaal daags) aan 12 gezonde vrijwilligers, namen de steady-state saquinavir AUC en Cmax toe met respectievelijk 177% en 187% in vergelijking met toediening van alleen saquinavir. De AUC en Cmax van claritromycine stegen respectievelijk met 45% en 39%, terwijl de AUC en Cmax van 14-OH claritromycine respectievelijk met 24% en 34% daalden in vergelijking met toediening met alleen claritromycine.
Didanosine
Gelijktijdige toediening van claritromycinetabletten en didanosine aan 12 met hiv geïnfecteerde volwassen patiënten leidde niet tot een statistisch significante verandering in de farmacokinetiek van didanosine.
Zidovudine
Na toediening van tweemaal daags claritromycine 500 mg tabletten met zidovudine 100 mg om de 4 uur, nam de AUC van zidovudine bij steady-state met 12% af vergeleken met toediening van alleen zidovudine (n=4). Individuele waarden varieerden van een daling van 34% tot een stijging van 14%. Wanneer claritromycinetabletten twee tot vier uur voorafgaand aan zidovudine werden toegediend, nam de steady-state Cmax van zidovudine met 100% toe, terwijl de AUC niet werd beïnvloed (n=24).
Omeprazol
Claritromycine 500 mg om de 8 uur werd gegeven in combinatie met omeprazol 40 mg per dag aan gezonde volwassen proefpersonen. De steady-state plasmaconcentraties van omeprazol waren verhoogd (Cmax, AUC0-24 en t½-stijgingen van respectievelijk 30%, 89% en 34%), door gelijktijdige toediening van claritromycine.
De plasmaspiegels van claritromycine en 14-OH-claritromycine waren verhoogd door gelijktijdige toediening van omeprazol. Voor claritromycine was de gemiddelde Cmax 10% hoger, de gemiddelde Cmin 27% hoger en de gemiddelde AUC0-8 15% hoger wanneer claritromycine werd toegediend met omeprazol dan wanneer claritromycine alleen werd toegediend. Vergelijkbare resultaten werden gezien voor 14-OH-claritromycine, de gemiddelde Cmax was 45% hoger, de gemiddelde Cmin was 57% hoger en de gemiddelde AUC0-8 was 45% hoger. De claritromycineconcentraties in het maagweefsel en het slijmvlies waren ook verhoogd bij gelijktijdige toediening van omeprazol.
Claritromycine Weefselconcentraties 2 uur na dosis (mcg/ml)/(mcg/g)
theofylline
In twee onderzoeken waarin theofylline werd toegediend met claritromycine (een theofylline-formulering met vertraagde afgifte werd gedoseerd in een dosering van 6,5 mg/kg of 12 mg/kg samen met 250 of 500 mg elke 12 uur claritromycine), de steady-state-spiegels van Cmax, Cmin, en het gebied onder de serumconcentratie-tijdcurve (AUC) van theofylline nam met ongeveer 20% toe.
midazolam
Wanneer een enkelvoudige dosis midazolam gelijktijdig werd toegediend met claritromycinetabletten (500 mg tweemaal daags gedurende 7 dagen), nam de AUC van midazolam met 174% toe na intraveneuze toediening van midazolam en met 600% na orale toediening.
Raadpleeg hun volledige voorschrijfinformatie voor informatie over andere geneesmiddelen die in combinatie met BIAXIN zijn geïndiceerd, KLINISCHE FARMACOLOGIE sectie.
Microbiologie
Werkingsmechanisme
Claritromycine oefent zijn antibacteriële werking uit door te binden aan de 50S-ribosomale subeenheid van gevoelige bacteriën, wat resulteert in remming van de eiwitsynthese.
Weerstand
De belangrijkste resistentieroutes zijn modificatie van het 23S-rRNA in de 50S-ribosomale subeenheid voor ongevoeligheid of medicijn-effluxpompen. De productie van bètalactamase zou geen effect moeten hebben op de claritromycineactiviteit.
De meeste isolaten van meticilline-resistente en oxacilline-resistente stafylokokken zijn resistent tegen claritromycine.
Als H. pylori niet wordt uitgeroeid na behandeling met claritromycine-bevattende combinatieregimes, kunnen patiënten claritromycine-resistentie ontwikkelen bij H. pylori-isolaten. Daarom moeten bij patiënten bij wie de therapie faalt, indien mogelijk claritromycinegevoeligheidstests worden uitgevoerd. Patiënten met claritromycine-resistente H. pylori mogen niet worden behandeld met een van de volgende behandelingen: omeprazol/claritromycine duale therapie; omeprazol/claritromycine/amoxicilline drievoudige therapie; drievoudige therapie met lansoprazol/claritromycine/amoxicilline; of andere regimes die claritromycine als het enige antibacteriële middel omvatten.
Antimicrobiale activiteit
Van claritromycine is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen, zowel in vitro als bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK ].
Gram-positieve bacteriën
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Gram-negatieve bacteriën
- Haemophilus influenzae
- Haemophilus para-influenzae
- Moraxella catarrhalis
Andere micro-organismen
- Chlamydophila pneumoniae
- Helicobacter pylori
- Mycobacterium avium-complex (MAC) bestaande uit M. avium en M. intracellulare
- Mycoplasma pneumoniae
Ten minste 90 procent van de hieronder vermelde micro-organismen vertoont in vitro minimale remmende concentraties (MIC's) die lager zijn dan of gelijk zijn aan het voor claritromycine gevoelige MIC-breekpunt voor organismen van een soortgelijk type als die weergegeven in tabel 11. De werkzaamheid van claritromycine bij de behandeling van klinische infecties is echter veroorzaakt door deze micro-organismen is niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
- Streptococcus agalactiae
- Streptokokken (Groepen C, F, G)
- Viridans groep streptokokken
Gram-negatieve bacteriën
- Legionella pneumophila
- Pasteurella multocida
Anaërobe bacteriën
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: http://www.fda.gov/STIC.
Dierlijke toxicologie en/of farmacologie
Opaciteit van het hoornvlies trad op bij honden bij doses van 12 keer en bij apen bij doses die 8 keer hoger waren dan de maximale dagelijkse dosis voor de mens (op basis van het lichaamsoppervlak). Lymfoïde depletie trad op bij honden bij doses die 3 keer hoger waren dan bij apen en bij apen bij doses die 2 keer hoger waren dan de maximale dagelijkse dosis voor de mens (op basis van het lichaamsoppervlak).
Klinische studies
Mycobacteriële infecties
Profylaxe van mycobacteriële infecties
Een gerandomiseerde, dubbelblinde klinische studie (studie 3) vergeleek claritromycine 500 mg tweemaal daags met placebo bij patiënten met CDC-gedefinieerde AIDS en CD4-tellingen van minder dan 100 cellen/μL. Deze studie leverde 682 patiënten op van november 1992 tot januari 1994, met een mediane CD4-celtelling bij aanvang van 30 cellen/mcL. De mediane duur van BIAXIN 500 mg was 10,6 maanden versus 8,2 maanden voor placebo. Meer patiënten in de placebo-arm dan de BIAXIN-arm stopten voortijdig met het onderzoek (respectievelijk 75,6% en 67,4%). Als echter voortijdige stopzettingen als gevolg van Mycobacterium avium-complex (MAC) of overlijden worden uitgesloten, stopten ongeveer gelijke percentages patiënten in elke arm (54,8%) op BIAXIN en 52,5% op placebo) het onderzoeksgeneesmiddel vroegtijdig om andere redenen. De studie was bedoeld om de volgende eindpunten te evalueren:
MAC-bacteriëmie
Bij patiënten die waren gerandomiseerd naar BIAXIN, was het risico op MAC-bacteriëmie met 69% verminderd in vergelijking met placebo. Het verschil tussen de groepen was statistisch significant (p
Overleving
Er werd een statistisch significant overlevingsvoordeel van BIAXIN vergeleken met placebo waargenomen (zie figuur 3 en tabel 13). Aangezien de analyse na 18 maanden patiënten omvat die niet langer profylaxe krijgen, kan het overlevingsvoordeel van BIAXIN 250 mg worden onderschat.
Figuur 3: Overleving van alle gerandomiseerde AIDS-patiënten in de loop van de tijd in proef 3 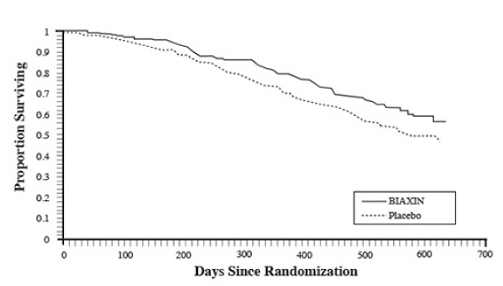
Klinisch significante gedissemineerde MAC-ziekte
In verband met de verminderde incidentie van MAC-bacteriëmie, vertoonden patiënten in de groep die was gerandomiseerd naar BIAXIN een vermindering van de tekenen en symptomen van gedissemineerde MAC-ziekte, waaronder koorts, nachtelijk zweten, gewichtsverlies en bloedarmoede.
Behandeling van mycobacteriële infecties
Dosis-variërende monotherapie-onderzoeken bij volwassen AIDS-patiënten met MAC
Twee gerandomiseerde klinische onderzoeken (Trials 1 en 2) vergeleken verschillende doseringen van BIAXIN bij patiënten met CDC-gedefinieerde AIDS en CD4-tellingen van minder dan 100 cellen/mcL. Deze studies verzamelden patiënten van mei 1991 tot maart 1992. Trial 500 was een gerandomiseerde, dubbelblinde studie; proef 577 was een open-label studie voor compassievol gebruik. In beide onderzoeken werd tweemaal daags 500 mg en 1000 mg BIAXIN gebruikt; proef 1 had ook een groep van 2000 mg tweemaal daags BIAXIN 500 mg. Aan proef 1 namen 154 volwassen patiënten deel en aan proef 2 namen 469 volwassen patiënten deel. De meerderheid van de patiënten had bij aanvang van de studie een CD4-celtelling van minder dan 50 cellen/mcL. De proeven waren ontworpen om de volgende eindpunten te evalueren:
De resultaten voor proef 1 worden hieronder beschreven. De resultaten van proef 2 waren vergelijkbaar met de resultaten van proef 1.
MAC-bacteriëmie
Afnames van MAC-bacteriëmie of negatieve bloedkweken werden gezien bij de meerderheid van de patiënten in alle doseringsgroepen van BIAXIN 500 mg. De gemiddelde afname in MAC kolonievormende eenheden (CFU) vanaf baseline na 4 weken therapie in het 1000 mg (n=32) tweemaal daags en 2000 mg (n=26) tweemaal daags regime was 2,3 log CFU vergeleken met 1,5 log CFU in het BIAXIN 500 mg tweemaal daags (n=35) regime. Een afzonderlijke studie met een regime van vier geneesmiddelen2 (ciprofloxacine, ethambutol, rifampicine en clofazimine) had een gemiddelde verlaging van 1,4 log CFU.
Klinische resultaten geëvalueerd met de verschillende doseringsschema's van claritromycine monotherapie worden weergegeven in Tabel 14. De doses van 1000 mg en 2000 mg tweemaal daags lieten een significant betere controle van bacteriëmie zien tijdens de eerste vier weken van de therapie. Verder dan dat punt werden geen significante verschillen waargenomen. Alle isolaten hadden vóór de behandeling een MIC van minder dan 8 mcg/ml. Terugval ging bijna altijd gepaard met een verhoging van de MIC.
Klinisch significante gedissemineerde MAC-ziekte
Van de patiënten die voorafgaand aan de therapie last hadden van nachtelijk zweten, vertoonde 84% op enig moment tijdens de 12 weken van BIAXIN bij een dosis van 500 mg tot 2000 mg tweemaal daags een oplossing of verbetering. Evenzo meldde 77% van de patiënten op een bepaald moment dat de koorts was verdwenen of verbeterd. Responspercentages voor klinische tekenen van MAC worden gegeven in tabel 15 hieronder.
De mediane duur van de respons, gedefinieerd als verbetering of verdwijning van klinische tekenen en symptomen, was 2 weken tot 6 weken.
Aangezien het onderzoek niet was opgezet om het voordeel van monotherapie na 12 weken te bepalen, kan de duur van de respons worden onderschat voor de 25% tot 33% van de patiënten die na 12 weken nog steeds klinische respons vertoonden.
Overleving
De mediane overlevingstijd vanaf het begin van het onderzoek (onderzoek 1) was 249 dagen bij de dosis van 500 mg tweemaal daags vergeleken met 215 dagen bij de dosis van tweemaal daags 1000 mg. Tijdens de eerste 12 weken van de therapie waren er echter 2 sterfgevallen bij 53 patiënten in de groep met tweemaal daags 500 mg versus 13 sterfgevallen bij 51 patiënten in de groep met tweemaal daags 1000 mg. De reden voor dit schijnbare verschil in sterfte is niet bekend. Overleving in de twee groepen was vergelijkbaar na 12 weken. De mediane overlevingstijden voor deze doseringen waren vergelijkbaar met recente historische controles met MAC bij behandeling met combinatietherapieën
De mediane overlevingstijd vanaf deelname aan onderzoek 2 was 199 dagen voor de dosis van tweemaal daags 500 mg en 179 dagen voor de dosis van tweemaal daags 1000 mg. Tijdens de eerste vier weken van de behandeling, terwijl de patiënten hun oorspronkelijk toegewezen dosis bleven gebruiken, waren er 11 sterfgevallen bij 255 patiënten die tweemaal daags 500 mg gebruikten en 18 sterfgevallen bij 214 patiënten die tweemaal daags 1000 mg gebruikten.
Dosering-variërende monotherapie-onderzoeken bij pediatrische AIDS-patiënten met MAC
Onderzoek 4 was een pediatrisch onderzoek van 3,75 mg/kg, 7,5 mg/kg en 15 mg/kg BIAXIN tweemaal daags bij patiënten met CDC-gedefinieerde AIDS en CD4-tellingen van minder dan 100 cellen/mcL. Aan de studie namen 25 patiënten deel in de leeftijd van 1 tot 20 jaar. De studie evalueerde dezelfde eindpunten als in de volwassen studies 1 en 2. De resultaten met de tweemaal daagse dosis van 7,5 mg/kg in de pediatrische studie waren vergelijkbaar met die voor de 500 mg tweemaal daags regime in de volwassen onderzoeken.
Combinatietherapie bij AIDS-patiënten met gedissemineerde MAC
Onderzoek 5 vergeleek de veiligheid en werkzaamheid van BIAXIN 250 mg in combinatie met ethambutol versus BIAXIN 250 mg in combinatie met ethambutol en clofazimine voor de behandeling van gedissemineerde MAC (dMAC) infectie. Aan deze studie van 24 weken namen 106 patiënten met aids en dMAC deel, waarbij 55 patiënten werden gerandomiseerd om BIAXIN 500 mg en ethambutol te krijgen, en 51 patiënten die werden gerandomiseerd naar claritromycine, ethambutol en clofazime. De baselinekenmerken tussen de behandelarmen waren vergelijkbaar, met uitzondering van het mediane aantal CFU's dat ten minste 1 log hoger was in de BIAXIN 500 mg-, ethambutol- en clofazime-arm.
Vergeleken met eerdere ervaring met claritromycine als monotherapie, verlengde het regime van twee geneesmiddelen van claritromycine en ethambutol de tijd tot microbiologische terugval, grotendeels door het onderdrukken van de opkomst van claritromycine-resistente stammen. De toevoeging van clofazimine aan het regime voegde echter geen extra microbiologisch of klinisch voordeel toe. De verdraagbaarheid van beide multidrug-regimes was vergelijkbaar, waarbij de meest voorkomende bijwerkingen gastro-intestinaal van aard waren. Patiënten die het clofazimine-bevattende regime kregen, hadden verminderde overlevingspercentages; hun baseline mycobacteriële kolonietellingen waren echter hoger. De resultaten van deze studie ondersteunen de toevoeging van ethambutol aan claritromycine voor de behandeling van initiële dMAC-infecties, maar ondersteunen de toevoeging van clofazimine als derde middel niet.
otitis media
Otitis Media-onderzoek van BIAXIN versus oraal cefalosporine
In een gecontroleerd klinisch onderzoek bij pediatrische patiënten met acute middenoorontsteking, uitgevoerd in de Verenigde Staten, waar significante hoeveelheden bètalactamaseproducerende organismen werden gevonden, werd BIAXIN 500 mg vergeleken met een oraal cefalosporine. In deze studie werden strikte evalueerbaarheidscriteria gebruikt om de klinische respons te bepalen. Voor de 223 patiënten die werden geëvalueerd op klinische werkzaamheid, was het klinische succespercentage (dwz genezing plus verbetering) bij het bezoek na de therapie 88% voor BIAXIN 500 mg en 91% voor cefalosporine.
Bij een kleiner aantal patiënten werden microbiologische bepalingen gedaan tijdens het bezoek vóór de behandeling. De vermoedelijke bacteriële uitroeiing/klinische genezingsresultaten (dwz klinisch succes) worden weergegeven in Tabel 16.
Otitis Media-onderzoeken van BIAXIN versus antimicrobiële / bèta-lactamaseremmer
In twee andere gecontroleerde klinische onderzoeken naar acute middenoorontsteking, uitgevoerd in de Verenigde Staten, waar significante percentages bètalactamaseproducerende organismen werden gevonden, werd BIAXIN vergeleken met een oraal antimicrobieel middel dat een specifieke bètalactamaseremmer bevatte. In deze onderzoeken werden strikte evalueerbaarheidscriteria gebruikt om de klinische reacties te bepalen. Bij de 233 patiënten die werden geëvalueerd op klinische werkzaamheid, was het gecombineerde klinische succespercentage (dwz genezing en verbetering) bij het bezoek na de therapie 91% voor zowel BIAXIN 500 mg als de controlegroep.
Voor de patiënten die microbiologische bepalingen hadden tijdens het bezoek aan de behandeling, worden de vermoedelijke bacteriële uitroeiing/klinische genezingsresultaten (dwz klinisch succes) weergegeven in Tabel 17.
H. pylori-uitroeiing om het risico op herhaling van duodenumzweren te verminderen
BIAXIN + Lansoprazol en amoxicilline
Twee gerandomiseerde, dubbelblinde klinische onderzoeken in de VS (onderzoek 6 en onderzoek 7) bij patiënten met H. pylori en ulcus duodeni (gedefinieerd als een actieve zweer of een voorgeschiedenis van een actieve zweer binnen één jaar) evalueerden de werkzaamheid van BIAXIN 500 mg tweemaal dagelijks in combinatie met lansoprazol 30 mg tweemaal daags en amoxicilline 1 g tweemaal daags als 14-daagse tripeltherapie voor de uitroeiing van H. pylori.
Uitroeiing van H. pylori werd gedefinieerd als twee negatieve tests (kweek en histologie) 4 weken tot 6 weken na het einde van de behandeling.
De combinatie van BIAXIN plus lansoprazol en amoxicilline als drievoudige therapie was effectief bij de uitroeiing van H. pylori (zie resultaten in tabel 18). Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van een ulcus duodeni vermindert.
Een gerandomiseerde, dubbelblinde klinische studie (studie 8) uitgevoerd in de VS bij patiënten met H. pylori en ulcus duodeni (gedefinieerd als een actieve zweer of een voorgeschiedenis van een zweer binnen één jaar) vergeleek de werkzaamheid van BIAXIN 250 mg in combinatie met lansoprazol en amoxicilline als drievoudige therapie gedurende 10 dagen en 14 dagen. Dit onderzoek stelde vast dat de 10-daagse tripeltherapie equivalent was aan de 14-daagse tripeltherapie bij het uitroeien van H. pylori (zie resultaten in Tabel 18).
BIAXIN + omeprazol en amoxicillinetherapie
Drie Amerikaanse, gerandomiseerde, dubbelblinde klinische onderzoeken bij patiënten met H. pylori-infectie en ulcus duodeni (n = 558) vergeleken BIAXIN plus omeprazol en amoxicilline met BIAXIN 250 mg plus amoxicilline. Er zijn twee onderzoeken (onderzoeken 9 en 10) uitgevoerd bij patiënten met een actieve zweer in de twaalfvingerige darm, en het derde onderzoek (onderzoek 11) werd uitgevoerd bij patiënten met een ulcus duodeni in de afgelopen 5 jaar, maar zonder dat er een ulcus aanwezig was op het moment van inschrijving . Het doseringsschema in de onderzoeken was BIAXIN 500 mg tweemaal daags plus omeprazol 20 mg tweemaal daags plus amoxicilline 1 gram tweemaal daags gedurende 10 dagen. In de onderzoeken 9 en 10 kregen patiënten die het regime van omeprazol gebruikten, ook nog eens 18 dagen omeprazol 20 mg eenmaal daags. De onderzochte eindpunten waren uitroeiing van H. pylori en genezing van zweren in de twaalfvingerige darm (alleen proeven 9 en 10). De status van H. pylori werd in alle drie de onderzoeken bepaald door CLOtest®, histologie en kweek. Voor een bepaalde patiënt werd H. pylori als uitgeroeid beschouwd als ten minste twee van deze tests negatief waren en geen enkele positief. De combinatie van BIAXIN plus omeprazol en amoxicilline was effectief bij het uitroeien van H. pylori (zie resultaten in tabel 19).
BIAXIN + Omeprazol-therapie
Vier gerandomiseerde, dubbelblinde, multicentrische onderzoeken (onderzoeken 12, 13, 14 en 15) evalueerden BIAXIN 500 mg driemaal daags plus omeprazol 40 mg eenmaal daags gedurende 14 dagen, gevolgd door omeprazol 20 mg eenmaal daags ( onderzoeken 12, 13 en 15) of door omeprazol 40 mg eenmaal daags (onderzoek 14) gedurende nog eens 14 dagen bij patiënten met een actief ulcus duodeni geassocieerd met H. pylori. Proeven 12 en 13 werden uitgevoerd in de VS en Canada en namen respectievelijk 242 en 256 patiënten op. H. pylori-infectie en ulcus duodeni werden bevestigd bij 219 patiënten in onderzoek 12 en bij 228 patiënten in onderzoek 13. In deze onderzoeken werd het combinatieschema vergeleken met omeprazol en BIAXIN-monotherapieën. Proeven 14 en 15 werden uitgevoerd in Europa en namen respectievelijk 154 en 215 patiënten op. H. pylori-infectie en ulcus duodeni werden bevestigd bij 148 patiënten in onderzoek 14 en 208 patiënten in onderzoek 15. In deze onderzoeken werd het combinatieschema vergeleken met omeprazol als monotherapie. De resultaten voor de werkzaamheidsanalyses voor deze onderzoeken worden beschreven in tabellen 20, 21 en 22.
Genezing van duodenumzweren
De combinatie van BIAXIN 250 mg en omeprazol was even effectief als omeprazol alleen voor de genezing van zweren in de twaalfvingerige darm (zie tabel 20).
Uitroeiing van H. pylori geassocieerd met duodenumulcus
De combinatie van BIAXIN 500 mg en omeprazol was effectief bij het uitroeien van H. pylori (zie tabel 21). Uitroeiing van H. pylori werd gedefinieerd als geen positieve test (kweek of histologie) 4 weken na het einde van de behandeling, en er waren twee negatieve tests nodig om als uitgeroeid te worden beschouwd. In de analyse per protocol werden de volgende patiënten uitgesloten: drop-outs, patiënten met ernstige protocolschendingen, patiënten met ontbrekende H. pylori-tests na de behandeling en patiënten bij wie 4 weken na het einde van de behandeling omdat ze aan het einde van de behandeling een niet-genezen zweer hadden.
Herhaling van de twaalfvingerige darm
Herhaling van de zweer na 6 maanden en 12 maanden na het einde van de behandeling werd beoordeeld bij patiënten bij wie de zweren na de behandeling waren genezen (zie de resultaten in tabel 22). Dus bij patiënten met een ulcus duodeni geassocieerd met H. pylori-infectie, verminderde uitroeiing van H. pylori de herhaling van de zweer.
REFERENTIES
2. Kemper CA, et al. Behandeling van Mycobacterium avium Complex-bacteriëmie bij AIDS met een oraal regime met vier geneesmiddelen. Ann Stagiair Med. 1992;116:466-472.
PATIËNT INFORMATIE
Geef de volgende instructies of informatie over BIAXIN 250 mg aan patiënten:
- Adviseer patiënten dat antibacteriële geneesmiddelen, waaronder BIAXIN (claritromycine), alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer BIAXIN 250 mg wordt voorgeschreven voor de behandeling van een bacteriële infectie, moeten patiënten worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met BIAXIN 250 mg of andere antibacteriële geneesmiddelen kunnen worden behandeld.
- Adviseer patiënten dat diarree een veelvoorkomend probleem is dat wordt veroorzaakt door antibacteriële middelen, waaronder BIAXIN (claritromycine), die meestal eindigt wanneer het antibacteriële middel wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibacteriële middelen waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibacteriële middel hebben ingenomen. Als dit gebeurt, instrueer patiënten om zo snel mogelijk contact op te nemen met hun zorgverlener.
- Adviseer patiënten dat BIAXIN (claritromycine) een wisselwerking kan hebben met sommige geneesmiddelen; adviseer patiënten daarom om het gebruik van andere medicijnen aan hun zorgverlener te melden.
- Adviseer patiënten dat BIAXIN (claritromycine) Filmtab en orale suspensie met of zonder voedsel kunnen worden ingenomen en met melk kunnen worden ingenomen; BIAXIN 250 mg XL Filmtab (claritromycine tabletten met verlengde afgifte) moet echter met voedsel worden ingenomen. Bewaar de suspensie niet in de koelkast.
- Er zijn geen gegevens over het effect van BIAXIN (claritromycine) op de rijvaardigheid of het vermogen om machines te bedienen. Adviseer patiënten echter over de mogelijkheid van duizeligheid, duizeligheid, verwardheid en desoriëntatie, die kunnen optreden met de medicatie. Er moet rekening worden gehouden met de mogelijkheid van deze bijwerkingen voordat patiënten autorijden of machines bedienen.
- Adviseer patiënten dat als zwangerschap optreedt tijdens het gebruik van dit medicijn, er een mogelijk gevaar is voor de foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
- Adviseer patiënten met coronaire hartziekte om door te gaan met medicijnen en aanpassingen van de levensstijl voor hun coronaire hartziekte, omdat BIAXIN 500 mg jaren na het einde van de behandeling met BIAXIN in verband kan worden gebracht met een verhoogd risico op sterfte.
