Minocin 50mg, 100mg Minocycline Hydrochloride Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Minocin suspensie voor oraal gebruik en hoe wordt het gebruikt?
Minocin (minocyclinehydrochloride) is een tetracycline-antibioticum dat wordt gebruikt voor de behandeling van veel verschillende bacteriële infecties, zoals urineweginfecties, luchtweginfecties, huidinfecties, ernstige acne, gonorroe, tekenkoorts, chlamydia en andere.
Wat zijn bijwerkingen van Minocin orale suspensie?
Vaak voorkomende bijwerkingen van Minocin zijn onder meer:
- duizeligheid,
- moe gevoel,
- ronddraaiend gevoel,
- gewrichts- of spierpijn,
- verkleuring van uw huid of nagels of tandvlees,
- misselijkheid,
- diarree,
- maagklachten,
- huiduitslag of jeuk,
- gezwollen tong, of
- vaginale jeuk of afscheiding.
Vertel het uw arts als u ernstige bijwerkingen van Minocin 50 mg heeft, waaronder:
- buikkrampen,
- diarree die waterig of bloederig is,
- griep symptomen,
- zweren in uw mond en keel,
- zwakheid,
- donker gekleurde urine,
- ongewone bloeding,
- paarse of rode puntvlekken onder je huid,
- koorts,
- huiduitslag,
- blauwe plekken,
- ernstige tintelingen of gevoelloosheid,
- spier zwakte,
- verlies van eetlust,
- geel worden van de huid of ogen,
- pijn op de borst,
- onregelmatig hartritme,
- hoesten,
- piepende ademhaling,
- kortademigheid,
- verwardheid,
- braken,
- zwelling,
- gewichtstoename,
- minder dan normaal of helemaal niet plassen,
- hoofdpijn of pijn achter uw ogen,
- in je oren rinkelen,
- zichtproblemen,
- gewrichtspijn of zwelling met koorts,
- opgezwollen klieren,
- spierpijn,
- algemeen ziek gevoel,
- ongewone gedachten of gedrag,
- toevallen (convulsies), of
- een ernstige huidreactie.
Om de ontwikkeling van geneesmiddelresistente bacteriën te verminderen en de effectiviteit van MINOCIN® orale suspensie en andere antibacteriële geneesmiddelen te behouden, mag MINOCIN orale suspensie alleen worden gebruikt om infecties te behandelen of te voorkomen waarvan bewezen is of waarvan wordt vermoed dat ze door bacteriën worden veroorzaakt.
OMSCHRIJVING
MINOCIN 100 mg minocyclinehydrochloride, is een semisynthetisch derivaat van tetracycline, 4,7Bis(dimethylamino)-1,4,4a,5,5a,6,11,12a-octahydro-3,10,12,12a-tetrahydroxy-1,11 -dioxo-2naftaceencarboxamide-monohydrochloride.
De structuurformule is:
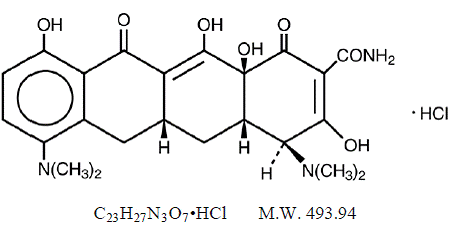 C23H27N3O7•HCl MW 493,94
C23H27N3O7•HCl MW 493,94 MINOCIN 50 mg orale suspensie bevat minocyclinehydrochloride overeenkomend met 50 mg minocycline per 5 ml (10 mg/ml) en de volgende inactieve ingrediënten: alcohol, butylparaben, calciumhydroxide, cellulose, decaglyceryltetraoleaat, edetaatcalciumdinatrium, guargom, polysorbaat 80 , Propylparaben, Propyleenglycol, Natriumsacharine, Natriumsulfiet (zie WAARSCHUWINGEN ) en sorbitol.
INDICATIES
MINOCIN 100 mg orale suspensie is geïndiceerd voor de behandeling van de volgende infecties als gevolg van gevoelige stammen van de aangewezen micro-organismen:
Rocky Mountain spotted fever, tyfus en de tyfusgroep, Q-koorts, rickettsiapokken en tekenkoorts veroorzaakt door rickettsiae.
Luchtweginfecties veroorzaakt door Mycoplasma pneumoniae.
Lymphogranuloma venereum veroorzaakt door Chlamydia trachomatis.
Psittacose (Ornithosis) door Chlamydophila psittaci.
Trachoom veroorzaakt door Chlamydia trachomatis, hoewel het infectieuze agens niet altijd wordt geëlimineerd, zoals beoordeeld door immunofluorescentie.
Inclusie conjunctivitis veroorzaakt door Chlamydia trachomatis.
Niet-gonokokken-urethritis, endocervicale of rectale infecties bij volwassenen veroorzaakt door Ureaplasma urealyticum of Chlamydia trachomatis.
Recidiverende koorts door Borrelia recurrentis.
Chancroid veroorzaakt door Haemophilus ducreyi.
Pest door Yersinia pestis.
Tularemie door Francisella tularensis.
Cholera veroorzaakt door Vibrio cholerae.
Campylobacter foetus-infecties veroorzaakt door Campylobacter foetus.
Brucellose door Brucella-soorten (in combinatie met streptomycine).
Bartonellose door Bartonella bacilliformis.
Granuloma inguinale veroorzaakt door Klebsiella granulomatis.
Minocycline is geïndiceerd voor de behandeling van infecties veroorzaakt door de volgende gram-negatieve micro-organismen wanneer bacteriologisch onderzoek een geschikte gevoeligheid voor het geneesmiddel aangeeft:
Escherichia coli.
Enterobacter aerogenes.
Shigella-soorten.
Acinetobacter-soorten.
Luchtweginfecties veroorzaakt door Haemophilus influenzae.
Luchtweg- en urineweginfecties veroorzaakt door Klebsiella-soorten.
MINOCIN Orale Suspensie is geïndiceerd voor de behandeling van infecties veroorzaakt door de volgende gram-positieve micro-organismen wanneer bacteriologisch onderzoek een geschikte gevoeligheid voor het geneesmiddel aangeeft:
Bovenste luchtweginfecties veroorzaakt door Streptococcus pneumoniae. Huid- en huidstructuurinfecties veroorzaakt door Staphylococcus aureus (opmerking: Minocycline is niet het favoriete medicijn bij de behandeling van elk type stafylokokkeninfectie).
Wanneer penicilline gecontra-indiceerd is, is minocycline een alternatief geneesmiddel bij de behandeling van de volgende infecties:
Ongecompliceerde urethritis bij mannen als gevolg van Neisseria gonorrhoeae en voor de behandeling van andere gonokokkeninfecties.
Infecties bij vrouwen veroorzaakt door Neisseria gonorrhoeae.
Syfilis veroorzaakt door Treponema pallidum ondersoort pallidum.
Yaws veroorzaakt door Treponema pallidum ondersoort pertenue.
Listeriose door Listeria monocytogenes.
Miltvuur door Bacillus anthracis.
Vincent's infectie veroorzaakt door Fusobacterium fusiforme.
Actinomycose veroorzaakt door Actinomyces israelii.
Infecties veroorzaakt door Clostridium-soorten.
Bij acute intestinale amebiasis kan minocycline een nuttige aanvulling zijn op amebiciden.
Bij ernstige acne kan minocycline een nuttige aanvullende therapie zijn.
Orale minocycline is geïndiceerd bij de behandeling van asymptomatische dragers van Neisseria meningitidis om meningokokken uit de nasopharynx te elimineren. Om het nut van minocycline bij de behandeling van asymptomatische meningokokkendragers te behouden, moeten diagnostische laboratoriumprocedures, waaronder serotypering en gevoeligheidstesten, worden uitgevoerd om de dragerschapsstatus en de juiste behandeling vast te stellen. Het wordt aanbevolen om het profylactische gebruik van minocycline te reserveren voor situaties waarin het risico op meningokokkenmeningitis hoog is.
Orale minocycline is niet geïndiceerd voor de behandeling van meningokokkeninfectie.
Hoewel er geen gecontroleerde klinische werkzaamheidsstudies zijn uitgevoerd, tonen beperkte klinische gegevens aan dat oraal minocyclinehydrochloride met succes is gebruikt bij de behandeling van infecties veroorzaakt door Mycobacterium marinum.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van MINOCIN 100 mg orale suspensie en andere antibacteriële geneesmiddelen te behouden, mag MINOCIN orale suspensie alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
DE GEBRUIKELIJKE DOSERING EN TOEDIENINGSFREQUENTIE VAN MINOCYCLINE VERSCHILLEN VAN DIE VAN DE ANDERE TETRACYCLINES. HET OVERSCHRIJDEN VAN DE AANBEVOLEN DOSERING KAN RESULTEREN IN EEN VERHOOGDE INVLOED VAN BIJWERKINGEN.
De therapie moet worden voortgezet gedurende ten minste 24 tot 48 uur nadat de symptomen en koorts zijn verdwenen.
Studies tot nu toe hebben aangetoond dat de absorptie van MINOCIN orale suspensie niet noemenswaardig wordt beïnvloed door voedsel en zuivelproducten.
De farmacokinetiek van minocycline bij patiënten met een nierfunctiestoornis (CLCR WAARSCHUWINGEN ).
Bij de behandeling van streptokokkeninfecties dient gedurende ten minste tien dagen een therapeutische dosis tetracycline te worden toegediend.
Voor pediatrische patiënten ouder dan 8 jaar
De gebruikelijke pediatrische dosering van MINOCIN is aanvankelijk 4 mg/kg, gevolgd door 2 mg/kg om de 12 uur, om de gebruikelijke dosis voor volwassenen niet te overschrijden.
volwassenen
De gebruikelijke dosering van MINOCIN is aanvankelijk 200 mg, gevolgd door 100 mg om de 12 uur.
Voor de behandeling van syfilis moet de gebruikelijke dosering van MINOCIN worden toegediend over een periode van 10 tot 15 dagen. Nauwe follow-up, inclusief laboratoriumtests, wordt aanbevolen.
Gonorroepatiënten die gevoelig zijn voor penicilline kunnen worden behandeld met MINOCIN 50 mg, aanvankelijk toegediend als 200 mg, gevolgd door 100 mg om de 12 uur gedurende minimaal 4 dagen, met kweken na de therapie binnen 2 tot 3 dagen.
Bij de behandeling van meningokokkendragerschap is de aanbevolen dosering 100 mg elke 12 uur gedurende 5 dagen.
Mycobacterium marinum-infecties: Hoewel er geen optimale doses zijn vastgesteld, is 100 mg om de 12 uur gedurende 6 tot 8 weken in een beperkt aantal gevallen met succes gebruikt.
Ongecompliceerde urethrale, endocervicale of rectale infectie bij volwassenen veroorzaakt door Chlamydia trachomatis of Ureaplasma urealyticum: 100 mg oraal, elke 12 uur gedurende ten minste 7 dagen.
Bij de behandeling van ongecompliceerde gonokokkenurethritis bij mannen wordt 100 mg tweemaal daags oraal gedurende 5 dagen aanbevolen.
HOE GELEVERD
MINOCIN (minocyclinehydrochloride) orale suspensie bevat minocyclinehydrochloride overeenkomend met 50 mg minocycline per theelepel (5 ml). Geconserveerd met propylparaben 0,10% en butylparaben 0,06% met alcohol USP 5% v/v. Vla-smaak.
NDC 16781-473-60 - Fles 2 fl. Oz. (60 ml)
Bewaren bij een gecontroleerde kamertemperatuur van 20° tot 25°C (68° tot 77°F).
NIET BEVRIEZEN.
Gefabriceerd voor: Onset Dermatologics, LLC Cumberland, RI 02864. Herzien: nov 2018
BIJWERKINGEN
Vanwege de vrijwel volledige absorptie van oraal minocycline zijn bijwerkingen aan de lagere darmen, met name diarree, zeldzaam geweest. De volgende bijwerkingen zijn waargenomen bij patiënten die tetracyclines kregen.
Lichaam als geheel: Koorts en verkleuring van afscheidingen.
Gastro-intestinaal: Anorexia, misselijkheid, braken, diarree, dyspepsie, stomatitis, glossitis, dysfagie, glazuurhypoplasie, enterocolitis, pseudomembraneuze colitis, pancreatitis, inflammatoire laesies (met moniliale overgroei) in de orale en anogenitale regio's.
Urogenitaal: Vulvovaginitis.
Levertoxiciteit: Hyperbilirubinemie, levercholestase, toename van leverenzymen, fataal leverfalen en geelzucht. Hepatitis, waaronder auto-immuunhepatitis, en leverfalen zijn gemeld (zie: PREVENTIEVE MAATREGELEN ).

Huid: Alopecia, erythema nodosum, hyperpigmentatie van nagels, pruritus, toxische epidermale necrolyse, vasculitis, maculopapulaire uitslag en erythemateuze uitslag. Exfoliatieve dermatitis is gemeld. Vaste uitbarstingen van medicijnen, waaronder balanitis, zijn gemeld. Erythema multiforme en Stevens-Johnson-syndroom zijn gemeld. Lichtgevoeligheid is hierboven besproken (zie WAARSCHUWINGEN ). Pigmentatie van de huid en slijmvliezen is gemeld.
Ademhaling: Hoesten, kortademigheid, bronchospasmen, verergering van astma en longontsteking.
Niertoxiciteit: Interstitiële nefritis. Verhogingen van BUN zijn gemeld en zijn blijkbaar dosisgerelateerd (zie: WAARSCHUWINGEN ). Reversibel acuut nierfalen is gemeld.
Musculoskeletaal: Artralgie, artritis, botverkleuring, spierpijn, gewrichtsstijfheid en gewrichtszwelling.
Overgevoeligheidsreacties: Urticaria, angioneurotisch oedeem, polyartralgie, anafylaxie/anafylactoïde reactie (inclusief shock en dodelijke afloop), anafylactoïde purpura, myocarditis, pericarditis, verergering van systemische lupus erythematodes en longinfiltraten met eosinofilie zijn gemeld. Een voorbijgaand lupusachtig syndroom en serumziekteachtige reacties zijn ook gemeld.
Bloed: Agranulocytose, hemolytische anemie, trombocytopenie, leukopenie, neutropenie, pancytopenie en eosinofilie zijn gemeld.
Centraal zenuwstelsel: Convulsies, duizeligheid, hypesthesie, paresthesie, sedatie en duizeligheid. Pseudotumor cerebri (goedaardige intracraniële hypertensie) bij volwassenen en uitpuilende fontanellen bij zuigelingen (zie PREVENTIEVE MAATREGELEN - Algemeen ). Hoofdpijn is ook gemeld.
Ander: Schildklierkanker is gemeld in de postmarketingsetting in combinatie met minocyclineproducten. Als behandeling met minocycline gedurende langere perioden wordt gegeven, moet worden overwogen om te controleren op tekenen van schildklierkanker. Bij langdurige toediening van tetracyclines is gemeld dat ze een bruinzwarte microscopische verkleuring van de schildklier veroorzaken. Er zijn gevallen van abnormale schildklierfunctie gemeld.
Tandverkleuring bij kinderen jonger dan 8 jaar (zie WAARSCHUWINGEN ) en ook bij volwassenen is gemeld.
Verkleuring van de mondholte (inclusief tong, lip en tandvlees) is gemeld.
Tinnitus en verminderd gehoor zijn gemeld bij patiënten op MINOCIN (minocyclinehydrochloride).
De volgende syndromen zijn gemeld. In sommige gevallen waarbij deze syndromen betrokken waren, is overlijden gemeld. Zoals bij andere ernstige bijwerkingen, moet het geneesmiddel onmiddellijk worden stopgezet als een van deze syndromen wordt herkend:
Overgevoeligheidssyndroom bestaande uit huidreactie (zoals huiduitslag of exfoliatieve dermatitis), eosinofilie en een of meer van de volgende: hepatitis, pneumonitis, nefritis, myocarditis en pericarditis. Koorts en lymfadenopathie kunnen aanwezig zijn.
Lupus-achtig syndroom bestaande uit positief antinucleair antilichaam; artralgie, artritis, gewrichtsstijfheid of gewrichtszwelling; en een of meer van de volgende: koorts, spierpijn, hepatitis, huiduitslag en vasculitis.
Serumziekte-achtig syndroom bestaande uit koorts; urticaria of uitslag; en artralgie, artritis, gewrichtsstijfheid of gewrichtszwelling en lymfadenopathie. Eosinofilie kan aanwezig zijn.
Neem contact op met Valeant Pharmaceuticals North America LLC op 1-800-321-4576 of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch om VERMOEDELIJKE ONGEWENSTE REACTIES te melden.
DRUG-INTERACTIES
Omdat is aangetoond dat tetracyclines de plasma-protrombine-activiteit verlagen, is het mogelijk dat patiënten die een antistollingstherapie ondergaan, een neerwaartse aanpassing van hun antistollingsmiddeldosering nodig hebben.
Aangezien bacteriostatische geneesmiddelen de bacteriedodende werking van penicilline kunnen verstoren, is het raadzaam geen geneesmiddelen van de tetracyclineklasse in combinatie met penicilline te geven.
De absorptie van tetracyclines wordt belemmerd door antacida die aluminium, calcium of magnesium bevatten en ijzerbevattende preparaten.
Er is gemeld dat gelijktijdig gebruik van tetracycline en methoxyfluraan leidt tot fatale niertoxiciteit.
Gelijktijdig gebruik van tetracyclines met orale anticonceptiva kan orale anticonceptiva minder effectief maken.
Toediening van isotretinoïne moet kort voor, tijdens en kort na de behandeling met minocycline worden vermeden. Elk geneesmiddel alleen is in verband gebracht met pseudotumor cerebri (zie: PREVENTIEVE MAATREGELEN ).
Verhoogd risico op ergotisme wanneer moederkorenalkaloïden of hun derivaten worden gegeven met tetracyclines.
WAARSCHUWINGEN
Tandontwikkeling
MINOCIN orale suspensie kan, net als andere antibiotica van de tetracyclineklasse, schade aan de foetus veroorzaken bij toediening aan een zwangere vrouw. Als tetracycline wordt gebruikt tijdens de zwangerschap of als de patiënte zwanger wordt tijdens het gebruik van deze geneesmiddelen, moet de patiënt op de hoogte zijn van het mogelijke gevaar voor de foetus. Het gebruik van geneesmiddelen van de tetracyclineklasse tijdens de ontwikkeling van tanden (laatste helft van de zwangerschap, zuigelingen en kinderjaren tot de leeftijd van 8 jaar) kan permanente verkleuring van de tanden veroorzaken (geel-grijs-bruin).
Deze bijwerking komt vaker voor bij langdurig gebruik van het geneesmiddel, maar is waargenomen na herhaalde kortdurende kuren. Emaille hypoplasie is ook gemeld. Tetracyclinegeneesmiddelen mogen daarom niet worden gebruikt tijdens de ontwikkeling van tanden, tenzij andere geneesmiddelen waarschijnlijk niet effectief zijn of gecontra-indiceerd zijn.
Skelet ontwikkeling
Alle tetracyclines vormen een stabiel calciumcomplex in elk botvormend weefsel. Een afname van de groeisnelheid van de fibula is waargenomen bij premature menselijke zuigelingen die om de zes uur orale tetracycline kregen in doses van 25 mg/kg. Deze reactie bleek omkeerbaar te zijn wanneer het medicijn werd stopgezet.
Gebruik tijdens de zwangerschap
Resultaten van dierstudies geven aan dat tetracyclines de placenta passeren, worden aangetroffen in foetale weefsels en toxische effecten kunnen hebben op de zich ontwikkelende foetus (vaak gerelateerd aan een vertraging van de ontwikkeling van het skelet). Bewijs van embryotoxiciteit is waargenomen bij dieren die vroeg in de dracht werden behandeld. De veiligheid van MINOCIN voor gebruik tijdens de zwangerschap is niet vastgesteld.
Dermatologische reactie
Geneesmiddeluitslag met eosinofilie en systemische symptomen (DRESS), waaronder gevallen met dodelijke afloop, is gemeld bij het gebruik van minocycline. Als dit syndroom wordt herkend, moet het medicijn onmiddellijk worden stopgezet.
Antianabole werking
De anti-anabole werking van de tetracyclines kan een toename van BUN veroorzaken. Hoewel dit geen probleem is bij patiënten met een normale nierfunctie, kunnen hogere serumspiegels van tetracycline bij patiënten met een significant verminderde functie leiden tot azotemie, hyperfosfatemie en acidose. Onder dergelijke omstandigheden wordt controle van creatinine en BUN aanbevolen, en de totale dagelijkse dosering mag niet hoger zijn dan 200 mg in 24 uur (zie DOSERING EN ADMINISTRATIE ). Als er sprake is van een nierfunctiestoornis, kunnen zelfs de gebruikelijke orale of parenterale doses leiden tot systemische accumulatie van het geneesmiddel en mogelijke levertoxiciteit.
lichtgevoeligheid
Fotosensitiviteit die zich manifesteert door een overdreven zonnebrandreactie is waargenomen bij sommige personen die tetracyclines gebruikten. Dit is gemeld met minocycline.
Effecten op het centrale zenuwstelsel
Bijwerkingen van het centrale zenuwstelsel, waaronder een licht gevoel in het hoofd, duizeligheid of vertigo, zijn gemeld bij behandeling met minocycline. Patiënten die deze symptomen ervaren, moeten worden gewaarschuwd voor het besturen van voertuigen of het gebruik van gevaarlijke machines tijdens behandeling met minocycline. Deze symptomen kunnen tijdens de behandeling verdwijnen en verdwijnen gewoonlijk snel wanneer het geneesmiddel wordt stopgezet.
Clostridium Difficile Geassocieerde Diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, inclusief MINOCIN 50 mg, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Overgevoeligheid voor natriumsulfiet
MINOCIN suspensie voor oraal gebruik bevat natriumsulfiet, een sulfiet dat bij bepaalde gevoelige personen allergische reacties kan veroorzaken, waaronder anafylactische symptomen en levensbedreigende of minder ernstige astmatische episodes. De algemene prevalentie van sulfietgevoeligheid in de algemene bevolking is onbekend en waarschijnlijk laag. Sulfietgevoeligheid wordt vaker gezien bij astmatische dan bij niet-astmatische mensen.
Intracraniële hypertensie
Intracraniële hypertensie (IH, pseudotumor cerebri) is in verband gebracht met het gebruik van tetracyclines, waaronder MINOCIN. Klinische manifestaties van IH omvatten hoofdpijn, wazig zien, dubbelzien en verlies van gezichtsvermogen; papiloedeem is te vinden op fundoscopie. Vrouwen in de vruchtbare leeftijd met overgewicht of met een voorgeschiedenis van IH lopen een groter risico op het ontwikkelen van met tetracycline geassocieerde IH. Gelijktijdig gebruik van isotretinoïne en MINOCIN moet worden vermeden, omdat bekend is dat isotretinoïne ook pseudotumor cerebri veroorzaakt.
Hoewel IH doorgaans verdwijnt na stopzetting van de behandeling, bestaat de mogelijkheid van permanent gezichtsverlies. Als zich tijdens de behandeling visuele symptomen ontwikkelen, is een onmiddellijke oftalmologische evaluatie gerechtvaardigd. Aangezien de intracraniale druk wekenlang verhoogd kan blijven na het stoppen met het medicijn, moeten patiënten worden gecontroleerd totdat ze stabiliseren.
PREVENTIEVE MAATREGELEN
Algemeen
Net als bij andere antibiotische preparaten kan het gebruik van dit geneesmiddel leiden tot overgroei van niet-gevoelige organismen, waaronder schimmels. Als superinfectie optreedt, moet het antibioticum worden gestaakt en moet een passende therapie worden ingesteld.
Hepatotoxiciteit is gemeld met minocycline; daarom moet minocycline met voorzichtigheid worden gebruikt bij patiënten met leverdisfunctie en in combinatie met andere hepatotoxische geneesmiddelen.
Incisie en drainage of andere chirurgische procedures moeten worden uitgevoerd in combinatie met antibiotische therapie indien geïndiceerd.
Het voorschrijven van MINOCIN orale suspensie bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Laboratorium testen
Periodieke laboratoriumevaluaties van orgaansystemen, waaronder hematopoëtische, nier- en leversystemen, moeten worden uitgevoerd.
Alle patiënten met gonorroe moeten op het moment van diagnose een serologische test voor syfilis ondergaan. Patiënten die met minocycline worden behandeld, dienen na 3 maanden een serologische vervolgtest op syfilis te ondergaan.
Geneesmiddel-/laboratoriumtestinteracties
Valse verhogingen van catecholaminespiegels in de urine kunnen optreden als gevolg van interferentie met de fluorescentietest.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Toediening via de voeding van minocycline in langdurige tumorigeniciteitsonderzoeken bij ratten resulteerde in aanwijzingen voor schildkliertumorproductie. Minocycline bleek ook schildklierhyperplasie te veroorzaken bij ratten en honden. Daarnaast zijn er aanwijzingen voor oncogene activiteit bij ratten in onderzoeken met een verwant antibioticum, oxytetracycline (dwz bijnier- en hypofysetumoren). Evenzo zijn, hoewel er geen mutageniteitsonderzoeken van minocycline zijn uitgevoerd, positieve resultaten gerapporteerd in in vitro zoogdierceltesten (dwz muislymfoom en longcellen van Chinese hamsters) voor verwante antibiotica (tetracyclinehydrochloride en oxytetracycline). Segment I-onderzoeken (vruchtbaarheid en algemene voortplanting) hebben aangetoond dat minocycline de vruchtbaarheid bij mannelijke ratten schaadt.
Zwangerschap
Risico Samenvatting
Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijkingen, verlies of andere nadelige gevolgen, ongeacht de blootstelling aan geneesmiddelen. Er zijn geen adequate en goed gecontroleerde onderzoeken naar het gebruik van minocycline bij zwangere vrouwen. Minocycline passeert, net als andere antibiotica van de tetracyclineklasse, de placenta en kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Zeldzame spontane meldingen van aangeboren afwijkingen, waaronder reductie van ledematen, zijn gemeld tijdens postmarketingervaring. Er is slechts beperkte informatie beschikbaar over deze rapporten; daarom kan er geen conclusie over causaal verband worden getrokken. Als minocycline tijdens de zwangerschap wordt gebruikt of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënte op de hoogte zijn van het mogelijke gevaar voor de foetus.
Niet-teratogene effecten: (zie WAARSCHUWINGEN ).
Bevalling
Het effect van tetracyclines op de bevalling en de bevalling is niet bekend.
Moeders die borstvoeding geven
Tetracyclines worden uitgescheiden in de moedermelk. Vanwege het potentieel voor ernstige bijwerkingen bij zuigelingen die borstvoeding geven door de tetracyclines, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder (zie WAARSCHUWINGEN ).
Pediatrisch gebruik
Minocycline wordt niet aanbevolen voor gebruik bij kinderen jonger dan 8 jaar, tenzij de verwachte voordelen van de therapie opwegen tegen de risico's (zie WAARSCHUWINGEN ).
Geriatrisch gebruik
Klinische onderzoeken met orale minocycline omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling (zie WAARSCHUWINGEN , DOSERING EN ADMINISTRATIE ).
MINOCIN 50 mg orale suspensie bevat 4,3 mg (0,18 mEq) natrium per 5 ml.
OVERDOSERING
De bijwerkingen die vaker worden gezien bij overdosering zijn duizeligheid, misselijkheid en braken.
Er is geen specifiek antidotum voor minocycline bekend.
In geval van overdosering, stop met medicatie, behandel symptomatisch en stel ondersteunende maatregelen in. Minocycline wordt niet in significante hoeveelheden verwijderd door hemodialyse of peritoneale dialyse.
CONTRA-INDICATIES
Dit medicijn is gecontra-indiceerd bij personen die overgevoelig zijn gebleken voor een van de tetracyclines of voor een van de componenten van de productformulering.
KLINISCHE FARMACOLOGIE
Na een enkele dosis van twee 100 mg minocycline HCl-poedergevulde capsules toegediend aan tien normale volwassen vrijwilligers, varieerden de serumspiegels van 0,74 tot 4,45 mcg/ml in 1 uur (gemiddeld 2,24); na 12 uur varieerden ze van 0,34 tot 2,36 mcg/ml (gemiddeld 1,25). De serumhalfwaardetijd na een enkele dosis van 200 mg bij 12 vrijwel normale vrijwilligers varieerde van 11 tot 17 uur. Bij zeven patiënten met leverdisfunctie varieerde dit van 11 tot 16 uur, en bij 5 patiënten met nierdisfunctie varieerde het van 18 tot 69 uur. Het urinaire en fecale herstel van minocycline bij toediening aan 12 normale vrijwilligers was de helft tot een derde van die van andere tetracyclines.
Microbiologie
Werkingsmechanisme
De tetracyclines zijn voornamelijk bacteriostatisch en men denkt dat ze hun antimicrobiële effect uitoefenen door de remming van de eiwitsynthese. De tetracyclines, waaronder minocycline, hebben een vergelijkbaar antimicrobieel werkingsspectrum tegen een breed scala aan gram-positieve en gram-negatieve organismen. Kruisresistentie van deze organismen tegen tetracycline komt vaak voor.
Antimicrobiale activiteit
Van minocycline is aangetoond dat het actief is tegen de meeste stammen van de volgende micro-organismen, zowel in vitro als bij klinische infecties, zoals beschreven in de INDICATIES sectie:
Gram-positieve bacteriën
Bacillus anthracis Listeria monocytogenes Staphylococcus aureus Streptococcus pneumoniae
Gram-negatieve bacteriën
Bartonella bacilliformis Brucella-soort Klebsiella granulomatis Campylobacter foetus Francisella tularensis Haemophilus ducreyi Vibrio cholerae Yersinia pestis Acinetobacter-soort Enterobacter aerogenes Escherichia coli Haemophilus influenzae Klebsiella-soort Neisseria gonorrhoedise Shigisseria meningiti-soort
Andere micro-organismen
Actinomyces soorten Borrelia recurrentis Chlamydophila psittaci Chlamydia trachomatis Clostridium soorten Entamoeba soorten Fusobacterium nucleatum ondersoort fusiforme Mycobacterium marinum Mycoplasma pneumoniae Propionibacterium acnes Rickettsiae Treponema pallidum ondersoort pallidum Treponematen pallidum subspecies
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Dierfarmacologie en toxicologie
Bij proefdieren (ratten, minivarkens, honden en apen) is waargenomen dat minocycline HCl een donkere verkleuring van de schildklier veroorzaakt. Bij de rat heeft chronische behandeling met minocyclinehydrochloride geresulteerd in struma dat gepaard gaat met een verhoogde opname van radioactief jodium en tekenen van schildkliertumorproductie. Minocyclinehydrochloride bleek ook schildklierhyperplasie te veroorzaken bij ratten en honden.
PATIËNT INFORMATIE
Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
Fotosensitiviteit die zich manifesteert door een overdreven zonnebrandreactie is waargenomen bij sommige personen die tetracyclines gebruikten. Patiënten die vatbaar zijn voor blootstelling aan direct zonlicht of ultraviolet licht, moeten erop worden gewezen dat deze reactie kan optreden met tetracyclinegeneesmiddelen en dat de behandeling moet worden gestaakt bij de eerste tekenen van huiderytheem. Deze reactie is gemeld bij gebruik van minocycline.
Patiënten die symptomen van het centrale zenuwstelsel ervaren, moeten worden gewaarschuwd voor het besturen van voertuigen of het gebruik van gevaarlijke machines tijdens behandeling met minocycline (zie: WAARSCHUWINGEN ).
Gelijktijdig gebruik van tetracycline met orale anticonceptiva kan orale anticonceptiva minder effectief maken (zie: DRUG-INTERACTIES ).
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder MINOCIN 50 mg orale suspensie, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer MINOCIN suspensie voor oraal gebruik wordt voorgeschreven om een bacteriële infectie te behandelen, moeten patiënten worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet kunnen worden behandeld met MINOCIN 50 mg orale suspensie of andere antibacteriële geneesmiddelen .
Ongebruikte voorraden tetracycline-antibiotica moeten vóór de vervaldatum worden weggegooid.
