Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Cipro 750 mg en hoe wordt het gebruikt?
Cipro 500 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van bacteriële infecties te behandelen. Cipro kan alleen of in combinatie met andere medicijnen worden gebruikt.
Cipro behoort tot een klasse geneesmiddelen die fluoroquinolonen worden genoemd.
Het is niet bekend of Cipro 750 mg veilig en effectief is bij kinderen jonger dan 1 jaar.
Wat zijn mogelijke bijwerkingen van Cipro?
Cipro kan ernstige bijwerkingen veroorzaken, waaronder:
- lage bloedsuikerspiegel,
- hoofdpijn,
- honger,
- zweten,
- prikkelbaarheid,
- duizeligheid,
- misselijkheid,
- snelle hartslag,
- zich angstig of wankel voelen,
- gevoelloosheid in uw handen, armen, benen of voeten,
- zwakheid,
- tintelende of brandende pijn,
- nervositeit,
- verwardheid,
- agitatie,
- paranoia,
- hallucinaties,
- geheugen problemen,
- moeite met concentreren,
- zelfmoordgedachten,
- plotselinge pijn,
- zwelling,
- blauwe plekken,
- tederheid,
- stijfheid,
- bewegingsproblemen,
- knappen of knallen in een joint,
- ernstige of constante pijn op de borst, maag of rug,
- diarree die waterig of bloederig is,
- fladderend in je borst,
- kortademigheid,
- duizeligheid,
- uitslag,
- ademhalingsproblemen,
- weinig of geen plassen,
- geel worden van de huid of ogen,
- ernstige hoofdpijn,
- in je oren rinkelen,
- zichtproblemen, en
- pijn achter je ogen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Cipro 1000 mg zijn:
- misselijkheid,
- braken,
- diarree,
- buikpijn,
- vaginale jeuk of afscheiding,
- hoofdpijn, en
- abnormale leverfunctietesten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cipro. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
ERNSTIGE ONGEWENSTE REACTIES WAARONDER TENDINITIS, PEESRUPTUUR, PERIFERE NEUROPATHIE, EFFECTEN VAN HET CENTRALE ZENUWSTELSEL EN EXACERBATIE VAN MYASTHENIA GRAVIS
- Fluoroquinolonen, waaronder Cipro 250 mg, zijn in verband gebracht met invaliderende en mogelijk onomkeerbare ernstige bijwerkingen die samen zijn opgetreden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ), waaronder:
- Tendinitis en peesruptuur (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Perifere neuropathie (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Effecten op het centrale zenuwstelsel (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
Stop onmiddellijk met Cipro 750 mg en vermijd het gebruik van fluorochinolonen, inclusief Cipro, bij patiënten die een van deze ernstige bijwerkingen ervaren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Fluoroquinolonen, waaronder Cipro 750 mg, kunnen spierzwakte verergeren bij patiënten met myasthenia gravis. Vermijd Cipro bij patiënten met een bekende voorgeschiedenis van myasthenia gravis. [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN]
- Omdat fluorochinolonen, waaronder CIPRO 500 mg, in verband zijn gebracht met ernstige bijwerkingen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ), reserveer CIPRO voor gebruik bij patiënten die geen alternatieve behandelingsopties hebben voor ongecompliceerde urineweginfecties (zie INDICATIES )
OMSCHRIJVING
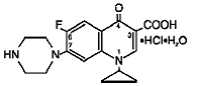
Cipro (cipro 750 mgfloxacine*) tabletten met verlengde afgifte bevatten cipro 500 mgfloxacine, een synthetisch antimicrobieel middel voor orale toediening. Cipro 1000 mg tabletten zijn omhulde, dubbellaagse tabletten die bestaan uit een laag met onmiddellijke afgifte en een laag met gecontroleerde afgifte van het type erosiematrix. De tabletten bevatten een combinatie van twee soorten ciprofloxacine-geneesmiddel, ciprofloxacinehydrochloride en ciprofloxacine-betaïne (base). Cipro 750 mgfloxacinehydrochloride is 1-cyclopropyl-6-fluor-1,4dihydro-4-oxo-7-(1-piperazinyl)-3-chinolinecarbonzuurhydrochloride. Het wordt geleverd als een mengsel van het monohydraat en het sesquihydraat. De empirische formule van het monohydraat is C17H18FN3O3. HCl. H2O en het molecuulgewicht is 385,8. De empirische formule van het sesquihydraat is C17H18FN3O3. HCl. 1,5 H2O en het molecuulgewicht is 394,8. De geneesmiddelsubstantie is een zwak geelachtige tot lichtgele kristallijne substantie. De chemische structuur van het monohydraat is als volgt:
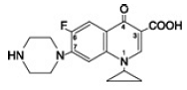
Cipro 1000 mgfloxacine-betaïne is 1-cyclopropyl-6-fluor-1,4-dihydro-4-oxo-7-(1-piperazinyl)-3-chinolinecarbonzuur. Als hydraat is de empirische formule C17H18FN3O3. 3,5 H2O en het molecuulgewicht is 394,3. Het is een lichtgele tot lichtgele kristallijne substantie en de chemische structuur is als volgt:
Cipro is verkrijgbaar in tabletsterkten van 500 mg en 1000 mg (cipro 500 mgfloxacine-equivalent). Cipro-tabletten zijn bijna witte tot licht gelige, filmomhulde, langwerpige tabletten. Elke tablet Cipro 500 mg bevat 500 mg ciprofloxacine als ciprofloxacine HCl (287,5 mg, berekend als ciprofloxacine op gedroogde basis) en cipro 1000 mgfloxacine (212,6 mg, berekend op gedroogde basis). Elke tablet Cipro 1000 mg bevat 1000 mg ciprofloxacine als ciprofloxacine HCl (574,9 mg, berekend als ciprofloxacine op gedroogde basis) en cipro 750 mgfloxacine (425,2 mg, berekend op gedroogde basis). De inactieve ingrediënten zijn crospovidon, hypromellose, magnesiumstearaat, polyethyleenglycol, colloïdaal watervrij siliciumdioxide, barnsteenzuur en titaniumdioxide.
* aangezien cipro 500 mgfloxacine† en cipro 250 mgfloxacinehydrochloride † niet voldoen aan de loss-on-droogtest en residu-on-ontstekingstest van de USP-monografie.
INDICATIES
Huid- en huidstructuurinfecties
CIPRO 1000 mg is geïndiceerd bij volwassen patiënten voor de behandeling van huid- en huidstructuurinfecties veroorzaakt door Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundii, Pseudomonas aericillinoccus aericilline-occepture, methicilline-occeptus, methicilline-locuscepture. methicillinegevoelige Staphylococcus epidermidis of Streptococcus pyogenes.
Bot- en gewrichtsinfecties
CIPRO 750 mg is geïndiceerd bij volwassen patiënten voor de behandeling van bot- en gewrichtsinfecties veroorzaakt door Enterobacter cloacae, Serratia marcescens of Pseudomonas aeruginosa.
Gecompliceerde intra-abdominale infecties
CIPRO 250 mg is geïndiceerd bij volwassen patiënten voor de behandeling van gecompliceerde intra-abdominale infecties (gebruikt in combinatie met metronidazol) veroorzaakt door Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae of Bacteroides fragilis.
Besmettelijke diarree
CIPRO 500 mg is geïndiceerd bij volwassen patiënten voor de behandeling van infectieuze diarree veroorzaakt door Escherichia coli (enterotoxigene isolaten), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri of Shigella sonnei† wanneer antibacteriële therapie is geïndiceerd.
†Hoewel de behandeling van infecties veroorzaakt door dit organisme in dit orgaansysteem een klinisch significant resultaat aantoonde, werd de werkzaamheid onderzocht bij minder dan 10 patiënten.
Buiktyfus (darmkoorts)
CIPRO 1000 mg is geïndiceerd bij volwassen patiënten voor de behandeling van buiktyfus (darmkoorts) veroorzaakt door Salmonella typhi. De werkzaamheid van ciprofloxacine bij de uitroeiing van de chronische dragerschap van tyfus is niet aangetoond.
Ongecompliceerde cervicale en urethrale gonorroe
CIPRO is geïndiceerd bij volwassen patiënten voor de behandeling van ongecompliceerde cervicale en urethrale gonorroe veroorzaakt door Neisseria gonorrhoeae [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Inhalatie miltvuur (post-blootstelling)
CIPRO 250 mg is geïndiceerd bij volwassenen en pediatrische patiënten vanaf de geboorte tot 17 jaar voor inhalatie-anthrax (post-blootstelling) om de incidentie of progressie van ziekte na blootstelling aan vernevelde Bacillus anthracis te verminderen.
Cipro 500 mgfloxacine-serumconcentraties die bij mensen werden bereikt, dienden als een surrogaateindpunt dat redelijkerwijs klinisch voordeel kon voorspellen en vormden de eerste basis voor goedkeuring van deze indicatie. 2001 [zie Klinische studies ].
Pest
CIPRO 1000 mg is geïndiceerd voor de behandeling van pest, inclusief longpest en septikemische pest, veroorzaakt door Yersinia pestis (Y. pestis) en profylaxe voor pest bij volwassenen en pediatrische patiënten vanaf de geboorte tot 17 jaar. Werkzaamheidsstudies van cipro 250 mgfloxacine konden om haalbaarheidsredenen niet worden uitgevoerd bij mensen met pest. Daarom is deze indicatie gebaseerd op een werkzaamheidsonderzoek dat alleen bij dieren is uitgevoerd [zie Klinische studies ].
Chronische bacteriële prostatitis
CIPRO is geïndiceerd bij volwassen patiënten voor de behandeling van chronische bacteriële prostatitis veroorzaakt door Escherichia coli of Proteus mirabilis.
Infecties van de onderste luchtwegen
CIPRO 750 mg is geïndiceerd bij volwassen patiënten voor de behandeling van lagere luchtweginfecties veroorzaakt door Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus parainfluenzae of Streptococcus pneumoniae.
CIPRO is geen geneesmiddel van eerste keuze bij de behandeling van vermoedelijke of bevestigde pneumonie secundair aan Streptococcus pneumoniae.
CIPRO is geïndiceerd voor de behandeling van acute exacerbaties van chronische bronchitis (AECB) veroorzaakt door Moraxella catarrhalis.
Omdat fluorochinolonen, waaronder CIPRO, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] en voor sommige patiënten is AECB zelfbeperkend, reserveer CIPRO 750 mg voor de behandeling van AECB bij patiënten die geen alternatieve behandelingsopties hebben.
Urineweginfecties
Urineweginfecties bij volwassenen
CIPRO 500 mg is geïndiceerd bij volwassen patiënten voor de behandeling van urineweginfecties veroorzaakt door Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter koseri, Citrobacter freundi- , Staphylococcus saprophyticus of Enterococcus faecalis.
Acute ongecompliceerde cystitis
CIPRO 750 mg is geïndiceerd bij volwassen vrouwelijke patiënten voor de behandeling van acute ongecompliceerde cystitis veroorzaakt door Escherichia coli of Staphylococcus saprophyticus.
Omdat fluorochinolonen, waaronder CIPRO, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] en voor sommige patiënten is acute ongecompliceerde cystitis zelfbeperkend, reserveer CIPRO voor de behandeling van acute ongecompliceerde cystitis bij patiënten die geen alternatieve behandelingsopties hebben.
Gecompliceerde urineweginfectie en pyelonefritis bij pediatrische patiënten
CIPRO is geïndiceerd bij pediatrische patiënten in de leeftijd van 1 tot 17 jaar voor de behandeling van gecompliceerde urineweginfecties (cUTI) en pyelonefritis veroorzaakt door Escherichia coli [zie Gebruik bij specifieke populaties ].
Hoewel effectief in klinische onderzoeken, is CIPRO niet het eerste keus geneesmiddel bij pediatrische patiënten vanwege een verhoogde incidentie van bijwerkingen in vergelijking met controles, waaronder reacties gerelateerd aan gewrichten en/of omliggende weefsels. CIPRO 250 mg wordt, net als andere fluoroquinolonen, in verband gebracht met artropathie en histopathologische veranderingen in gewichtdragende gewrichten van jonge dieren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES , Gebruik bij specifieke populaties en Niet-klinische toxicologie ].
Acute sinusitis
CIPRO is geïndiceerd bij volwassen patiënten voor de behandeling van acute sinusitis veroorzaakt door Haemophilus influenzae, Streptococcus pneumoniae of Moraxella catarrhalis.
Omdat fluorochinolonen, waaronder CIPRO, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] en voor sommige patiënten is acute sinusitis zelfbeperkend, reserveer CIPRO voor de behandeling van acute sinusitis bij patiënten die geen alternatieve behandelingsopties hebben.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van CIPRO 1000 mg en andere antibacteriële geneesmiddelen te behouden, mag CIPRO 500 mg alleen worden gebruikt om infecties te behandelen of te voorkomen waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
Als wordt vermoed dat anaërobe organismen bijdragen aan de infectie, moet een geschikte therapie worden toegediend. Voorafgaand aan de behandeling dienen geschikte kweek- en gevoeligheidstesten te worden uitgevoerd om organismen die infectie veroorzaken te isoleren en te identificeren en om hun gevoeligheid voor ciprofloxacine vast te stellen. Therapie met CIPRO kan worden gestart voordat de resultaten van deze tests bekend zijn; zodra de resultaten beschikbaar zijn, moet de juiste therapie worden voortgezet.
Net als bij andere geneesmiddelen kunnen sommige isolaten van Pseudomonas aeruginosa vrij snel resistentie ontwikkelen tijdens behandeling met cipro 1000 mgfloxacine. Kweek- en gevoeligheidstesten die periodiek tijdens de therapie worden uitgevoerd, zullen niet alleen informatie opleveren over het therapeutische effect van het antimicrobiële middel, maar ook over het mogelijke optreden van bacteriële resistentie.
DOSERING EN ADMINISTRATIE
CIPRO 1000 mg tabletten en orale suspensie dienen oraal te worden toegediend zoals beschreven in de desbetreffende doseringsrichtlijnen tabellen.
Dosering bij volwassenen
Bij het bepalen van de dosering en de duur voor een bepaalde patiënt moet rekening worden gehouden met de ernst en de aard van de infectie, de gevoeligheid van het veroorzakende micro-organisme, de integriteit van de afweermechanismen van de patiënt en de status van de nier- en leverfunctie . CIPRO-tabletten of CIPRO voor orale suspensie kunnen naar goeddunken van de arts worden toegediend aan volwassen patiënten wanneer dit klinisch geïndiceerd is. Dien CIPRO voor orale suspensie toe met behulp van de meeverpakte maatlepel [zie DOSERING EN ADMINISTRATIE ].
Conversie van IV naar orale dosering bij volwassenen
Patiënten bij wie de behandeling met CIPRO IV is gestart, kunnen naar goeddunken van de arts worden overgezet op CIPRO 750 mg tabletten of orale suspensie wanneer dit klinisch geïndiceerd is (tabel 2) [zie KLINISCHE FARMACOLOGIE ].
Dosering bij pediatrische patiënten
Dosering en initiële behandelingsroute (dat wil zeggen IV of oraal) voor cUTI of pyelonefritis moeten worden bepaald door de ernst van de infectie. CIPRO moet worden toegediend zoals beschreven in tabel 3. Dien CIPRO voor orale suspensie toe met behulp van de samenverpakte maatlepel [zie DOSERING EN ADMINISTRATIE ].
Doseringsaanpassingen bij patiënten met nierinsufficiëntie
Cipro 250 mgfloxacine wordt voornamelijk via de nieren uitgescheiden; het medicijn wordt echter ook gemetaboliseerd en gedeeltelijk geklaard via het galsysteem van de lever en via de darm. Deze alternatieve routes van geneesmiddeleliminatie lijken de verminderde renale excretie bij patiënten met nierinsufficiëntie te compenseren. Niettemin wordt enige aanpassing van de dosering aanbevolen, met name voor patiënten met ernstige nierfunctiestoornissen. Doseringsrichtlijnen voor gebruik bij patiënten met nierinsufficiëntie worden weergegeven in Tabel 4.
Als alleen de serumcreatinineconcentratie bekend is, kunnen de volgende formules worden gebruikt om de creatinineklaring te schatten:
Het serumcreatinine moet een stabiele nierfunctie vertegenwoordigen.
Bij patiënten met ernstige infecties en ernstige nierinsufficiëntie kan een eenheidsdosis van 750 mg worden toegediend met de hierboven vermelde tussenpozen. Patiënten moeten zorgvuldig worden gecontroleerd.
Pediatrische patiënten met matige tot ernstige nierinsufficiëntie werden uitgesloten van de klinische studie naar cUTI en pyelonefritis. Er is geen informatie beschikbaar over dosisaanpassingen die nodig zijn voor pediatrische patiënten met matige tot ernstige nierinsufficiëntie (d.w.z. een creatinineklaring van
Belangrijke administratie-instructies
Met multivalente kationen
Dien CIPRO ten minste 2 uur vóór of 6 uur na magnesium/aluminium-antacida toe; polymere fosfaatbinders (bijvoorbeeld sevelamer, lanthaancarbonaat) of sucralfaat; Videx® (didanosine) kauwbare / gebufferde tabletten of pediatrisch poeder voor drank; andere sterk gebufferde medicijnen; of andere producten die calcium, ijzer of zink bevatten.
Met zuivelproducten
Gelijktijdige toediening van CIPRO 500 mg met zuivelproducten (zoals melk of yoghurt) of alleen met calcium verrijkte sappen moet worden vermeden, aangezien verminderde absorptie mogelijk is; CIPRO kan echter worden ingenomen bij een maaltijd die deze producten bevat.
Hydratatie van patiënten die CIPRO krijgen
Zorg voor voldoende hydratatie van patiënten die CIPRO 1000 mg krijgen om de vorming van sterk geconcentreerde urine te voorkomen. Kristalurie is gemeld bij chinolonen.
Instrueer de patiënt over de juiste toediening van CIPRO 1000 mg [zie Informatie over patiëntbegeleiding ].
Gemiste doses
Als een dosis wordt gemist, moet deze op elk moment worden ingenomen, maar niet later dan 6 uur vóór de volgende geplande dosis. Als er minder dan 6 uur resteren voor de volgende dosis, mag de gemiste dosis niet worden ingenomen en moet de behandeling worden voortgezet zoals voorgeschreven met de volgende geplande dosis. Er mogen geen dubbele doses worden ingenomen om een gemiste dosis te compenseren.
CIPRO 1000mg-tabletten splitsen
CIPRO 750 mg-tabletten, 250 mg en 500 mg zijn tabletten met een functionele breukstreep die bij de breukstreep in tweeën kunnen worden gesplitst om respectievelijk een sterkte van 125 mg en 250 mg te verkrijgen.
Aanwijzingen voor reconstitutie van de CIPRO 500 mg microcapsules voor orale suspensie
CIPRO 750 mg orale suspensie wordt geleverd in sterktes van 5% (5 g ciprofloxacine in 100 ml) en 10% (10 g cipro 750 mgfloxacine in 100 ml). CIPRO 250 mg suspensie voor oraal gebruik bestaat uit twee componenten (microcapsules en verdunningsmiddel) die moeten worden gecombineerd voordat ze worden verstrekt.
Voorbereiding van de schorsing
Stap 1
De kleine fles bevat de microcapsules, de grote fles bevat het verdunningsmiddel.

Stap 2
Open beide flessen. Kinderveilige dop: Druk naar beneden volgens de instructies op de dop terwijl u naar links draait.

Stap 3
 Giet de microcapsules volledig in de grotere fles verdunningsmiddel. Voeg geen water toe aan de suspensie .
Stap 4
 Verwijder de bovenste laag van het etiket van de fles met verdunningsmiddel (om het etiket CIPRO 1000 mg orale suspensie te onthullen). Sluit de grote fles volledig volgens de aanwijzingen op de dop en schud krachtig gedurende ongeveer 15 seconden. De ophanging is klaar voor gebruik.
Stap 5
Schrijf de vervaldatum van de gereconstitueerde orale suspensie op het etiket van de fles.
Het gereconstitueerde product kan gedurende 14 dagen beneden 30°C (86°F) worden bewaard. Beschermen tegen bevriezing.
Er mogen geen toevoegingen worden gedaan aan de gemengde uiteindelijke ciprofloxacinesuspensie. CIPRO 1000 mg orale suspensie mag niet worden toegediend via voeding of NG (nasogastrische) sondes vanwege de fysieke kenmerken.
Toedieningsinstructies voor CIPRO voor orale suspensie na reconstitutie
- Schud CIPRO 750 mg orale suspensie elke keer krachtig voor gebruik gedurende ongeveer 15 seconden.
- Dien CIPRO orale suspensie toe met behulp van de meeverpakte maatlepel die voor de patiënt is meegeleverd (zie afbeelding 1)
Afbeelding 1: Samenverpakte theelepel met maatverdeling van 5 ml
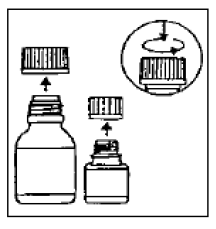
De Co-verpakte maatlepeltje (5 ml) wordt meegeleverd, met markeringen voor ½ (2,5 ml) en 1/1 (5 ml)
- Na gebruik de maatlepel onder stromend water met afwasmiddel reinigen en goed afdrogen.
- Kauw niet op de microcapsules in de CIPRO 250 mg orale suspensie, maar slik ze in hun geheel door.
- Na afloop kan er water worden ingenomen.
- Sluit de fles na elk gebruik goed af volgens de instructies op de dop.
- Nadat de behandeling is voltooid, mag CIPRO 1000 mg orale suspensie niet opnieuw worden gebruikt.
Dosering van CIPRO voor orale suspensie met behulp van de meeverpakte lepel bij volwassenen en pediatrische patiënten
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten
- 250 mg, licht geelachtig, filmomhuld, rond, functioneel ingekerfd, bedrukt met "BAYER" aan de ene kant en "CIP 250" aan de andere.
- 500 mg, licht geelachtig, filmomhuld, capsulevormig, functioneel ingekerfd, bedrukt met "BAYER" aan de ene kant en "CIP 500" aan de andere.
Orale suspensie
- 5% orale suspensie: 250 mg cipro 750 mgfloxacine per 5 ml na reconstitutie
- 10% orale suspensie: 500 mg cipro 250 mgfloxacine per 5 ml na reconstitutie
Opslag en behandeling
CIPRO (cipro 750 mgfloxacinehydrochloride) Tabletten zijn verkrijgbaar als ronde, licht gelige filmomhulde tabletten die 250 mg cipro 500 mgfloxacine bevatten. De tablet van 250 mg is aan de ene kant gecodeerd met het woord "BAYER" en functioneel ingekerfd en gegraveerd met "CIP 250" aan de andere kant. CIPRO is ook verkrijgbaar als capsulevormige, enigszins geelachtige filmomhulde tabletten die 500 mg ciprofloxacine bevatten. De tablet van 500 mg is aan de ene kant gecodeerd met het woord "BAYER" en functioneel ingekerfd en gegraveerd met "CIP 500" aan de andere kant. CIPRO 250 mg en 500 mg zijn verkrijgbaar in flesjes van 100.
Bewaren bij 20° tot 25°C (68° tot 77°F); excursies toegestaan tot 15° tot 30°C (59° tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
CIPRO orale suspensie wordt geleverd in sterktes van 5% en 10%. Het geneesmiddel bestaat uit twee componenten (microcapsules die het werkzame bestanddeel en het verdunningsmiddel bevatten) die door de apotheker moeten worden gemengd [zie DOSERING EN ADMINISTRATIE ].
Bewaar microcapsules en verdunningsmiddel beneden 25°C (77°F); excursies zijn toegestaan van 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen bevriezing.
Het gereconstitueerde product kan gedurende 14 dagen bij 25°C (77°F) worden bewaard; excursies zijn toegestaan van 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen bevriezing.
Een maatlepeltje (5 ml) met markeringen ½ (2,5 ml) en 1/1 (5 ml) wordt voor de patiënt verstrekt.
REFERENTIES
1. 21 CFR 314.510 (Subdeel H-Versnelde goedkeuring van nieuwe geneesmiddelen voor levensbedreigende ziekten).
2. Friedman J, Polifka J. Teratogene effecten van medicijnen: een hulpmiddel voor clinici (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000: 149-195.
3. Loebstein R, Addis A, Ho E, et al. Zwangerschapsuitkomst na zwangerschapsblootstelling aan fluoroquinolonen: een multicenter prospectief gecontroleerd onderzoek. Antimicrob-middelen Chemother. 1998;42(6):1336-1339.
Gefabriceerd voor: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Herzien: november 2021
BIJWERKINGEN
De volgende ernstige en anderszins belangrijke bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Uitschakelen en mogelijk onomkeerbare ernstige bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Tendinitis en peesruptuur [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Perifere neuropathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Effecten op het centrale zenuwstelsel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] Exacerbatie van Myasthenia Gravis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Andere ernstige en soms fatale bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Risico op aorta-aneurysma en dissectie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige bijwerkingen met gelijktijdige theofylline [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridioides difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verlenging van het QT-interval [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Musculoskeletale aandoeningen bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Lichtgevoeligheid/fototoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ontwikkeling van geneesmiddelresistente bacteriën [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Volwassen patiënten
Tijdens klinische onderzoeken met orale en parenterale CIPRO 750 mg kregen 49.038 patiënten kuren met het geneesmiddel.
De meest frequent gemelde bijwerkingen, uit klinische onderzoeken van alle formuleringen, alle doseringen, alle medicamenteuze behandelingsduur en voor alle indicaties van behandeling met ciprofloxacine waren misselijkheid (2,5%), diarree (1,6%), abnormale leverfunctietests (1,3% ), braken (1%) en huiduitslag (1%).
In gerandomiseerde, dubbelblinde, gecontroleerde klinische onderzoeken waarin CIPRO-tabletten [500 mg tweemaal daags (BID)] werden vergeleken met cefuroximaxetil (250 mg-500 mg BID) en met claritromycine (500 mg BID) bij patiënten met luchtweginfecties, toonde CIPRO een CZS-bijwerkingsprofiel vergelijkbaar met de controlegeneesmiddelen.
Pediatrische patiënten
De musculoskeletale en neurologische veiligheid op korte (6 weken) en lange termijn (1 jaar) van oraal/intraveneus ciprofloxacine werd vergeleken met een cefalosporine voor de behandeling van cUTI of pyelonefritis bij pediatrische patiënten van 1 tot 17 jaar (gemiddelde leeftijd van 6 ± 4 jaar). ) in een internationale multicenter-proef. De duur van de behandeling was 10 tot 21 dagen (gemiddelde duur van de behandeling was 11 dagen met een spreiding van 1 tot 88 dagen). In totaal werden 335 met cipro 250 mgfloxacine en 349 met vergelijkende middelen behandelde patiënten geïncludeerd.
Een Independent Pediatric Safety Committee (IPSC) beoordeelde alle gevallen van musculoskeletale bijwerkingen, waaronder abnormale gang of abnormaal gewrichtsonderzoek (basislijn of opkomende behandeling). Binnen 6 weken na de start van de behandeling waren de percentages van musculoskeletale bijwerkingen 9,3% (31/335) in de met cipro 750 mgfloxacine behandelde groep versus 6% (21/349) bij de patiënten behandeld met de comparator. Alle musculoskeletale bijwerkingen die optreden na 6 weken verdwenen (klinische verbetering van tekenen en symptomen), gewoonlijk binnen 30 dagen na het einde van de behandeling. Radiologische evaluaties werden niet routinematig gebruikt om het verdwijnen van de bijwerkingen te bevestigen. Patiënten behandeld met Cipro 500 mgfloxacine hadden meer kans om meer dan één bijwerking en bij meer dan één gelegenheid te melden dan bij controlepatiënten. Het aantal musculoskeletale bijwerkingen was in alle leeftijdssubgroepen consistent hoger in de ciprofloxacinegroep dan in de controlegroep. Aan het einde van 1 jaar was het percentage van deze bijwerkingen dat op enig moment tijdens die periode werd gemeld 13,7% (46/335) in de met cipro 250 mgfloxacine behandelde groep versus 9,5% (33/349) bij de met het vergelijkingsmiddel behandelde patiënten ( Tabel 9).
De incidentiepercentages van neurologische bijwerkingen binnen 6 weken na aanvang van de behandeling waren 3% (9/335) in de CIPRO-groep versus 2% (7/349) in de vergelijkingsgroep en omvatten duizeligheid, nervositeit, slapeloosheid en slaperigheid.
In dit onderzoek was de totale incidentie van bijwerkingen binnen 6 weken na aanvang van de behandeling 41% (138/335) in de cipro 250 mgfloxacinegroep versus 31% (109/349) in de vergelijkingsgroep. De meest voorkomende bijwerkingen waren gastro-intestinaal: 15% (50/335) van de ciprofloxacinepatiënten vergeleken met 9% (31/349) van de vergelijkingspatiënten. Ernstige bijwerkingen werden gezien bij 7,5% (25/335) van de met ciprofloxacine behandelde patiënten vergeleken met 5,7% (20/349) van de controlepatiënten. Stopzetting van het geneesmiddel vanwege een bijwerking werd waargenomen bij 3% (10/335) van de met ciprofloxacine behandelde patiënten versus 1,4% (5/349) van de vergelijkende patiënten. Andere bijwerkingen die voorkwamen bij ten minste 1% van de ciprofloxacinepatiënten waren diarree 4,8%, braken 4,8%, buikpijn 3,3%, dyspepsie 2,7%, misselijkheid 2,7%, koorts 2,1%, astma 1,8% en huiduitslag 1,8%.
Gegevens over de veiligheid op korte termijn voor cipro 1000 mgfloxacine werden ook verzameld in een gerandomiseerde, dubbelblinde klinische studie voor de behandeling van acute longexacerbaties bij patiënten met cystische fibrose (leeftijd 5-17 jaar). Zevenenzestig patiënten kregen CIPRO IV 10 mg/kg/dosis elke 8 uur gedurende één week, gevolgd door CIPRO 250 mg tabletten 20 mg/kg/dosis elke 12 uur om de behandeling van 10–21 dagen te voltooien en 62 patiënten kregen de combinatie van ceftazidim intraveneus 50 mg/kg/dosis om de 8 uur en tobramycine intraveneus 3 mg/kg/dosis om de 8 uur gedurende een totaal van 10-21 dagen. Periodieke musculoskeletale beoordelingen werden uitgevoerd door voor de behandeling geblindeerde onderzoekers. Patiënten werden gemiddeld 23 dagen na voltooiing van de behandeling gevolgd (bereik 0-93 dagen). Bijwerkingen van het bewegingsapparaat werden gemeld bij 22% van de patiënten in de ciprofloxacinegroep en 21% in de vergelijkingsgroep. Een verminderd bewegingsbereik werd gemeld bij 12% van de proefpersonen in de ciprofloxacinegroep en bij 16% in de vergelijkingsgroep. Artralgie werd gemeld bij 10% van de patiënten in de cipro 500 mgfloxacine-groep en bij 11% in de vergelijkingsgroep. Andere bijwerkingen waren vergelijkbaar qua aard en frequentie tussen behandelarmen. De werkzaamheid van CIPRO voor de behandeling van acute longexacerbaties bij pediatrische patiënten met cystische fibrose is niet vastgesteld.
Naast de bijwerkingen die in klinische onderzoeken bij pediatrische patiënten zijn gemeld, is het te verwachten dat bijwerkingen die tijdens klinische onderzoeken of postmarketingervaring bij volwassenen zijn gemeld, ook bij pediatrische patiënten kunnen voorkomen.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld uit wereldwijde marketingervaringen met fluorochinolonen, waaronder CIPRO. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen (tabel 10).
Nadelige laboratoriumveranderingen
Veranderingen in laboratoriumparameters tijdens gebruik van CIPRO 250 mg worden hieronder vermeld:
lever –Verhogingen van ALT (SGPT), AST (SGOT), alkalische fosfatase, LDH, serumbilirubine.
hematologisch –Eosinofilie, leukopenie, verlaagd aantal bloedplaatjes, verhoogd aantal bloedplaatjes, pancytopenie.
nier -Verhogingen van serumcreatinine, BUN, kristalurie, cylindrurie en hematurie zijn gemeld.
Andere veranderingen die zich voordeden waren: verhoging van serumgammaglutamyltransferase, verhoging van serumamylase, verlaging van bloedglucose, verhoogd urinezuur, verlaging van hemoglobine, anemie, bloedingsdiathese, verhoging van bloedmonocyten en leukocytose.
DRUG-INTERACTIES
Ciprofloxacine is een remmer van het door humaan cytochroom P450 1A2 (CYP1A2) gemedieerde metabolisme. Gelijktijdige toediening van CIPRO met andere geneesmiddelen die voornamelijk door CYP1A2 worden gemetaboliseerd, leidt tot verhoogde plasmaconcentraties van deze geneesmiddelen en kan leiden tot klinisch significante bijwerkingen van het gelijktijdig toegediende geneesmiddel.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathie en effecten op het centrale zenuwstelsel
Fluoroquinolonen, waaronder CIPRO, zijn in verband gebracht met invaliderende en mogelijk onomkeerbare ernstige bijwerkingen van verschillende lichaamssystemen die samen bij dezelfde patiënt kunnen optreden. Vaak voorkomende bijwerkingen zijn tendinitis, peesruptuur, artralgie, spierpijn, perifere neuropathie en effecten op het centrale zenuwstelsel (hallucinaties, angst, depressie, slapeloosheid, ernstige hoofdpijn en verwardheid). Deze reacties kunnen optreden binnen enkele uren tot weken na het starten met CIPRO. Patiënten van elke leeftijd of zonder reeds bestaande risicofactoren hebben deze bijwerkingen ervaren [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stop onmiddellijk met CIPRO 250 mg bij de eerste tekenen of symptomen van een ernstige bijwerking. Vermijd bovendien het gebruik van fluorochinolonen, inclusief CIPRO 500 mg, bij patiënten die een van deze ernstige bijwerkingen hebben gehad die verband houden met fluoroquinolonen.
Tendinitis en peesruptuur
Fluoroquinolonen, waaronder CIPRO, zijn bij alle leeftijden in verband gebracht met een verhoogd risico op tendinitis en peesruptuur [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ]. Deze bijwerking heeft meestal betrekking op de achillespees en is ook gemeld bij de rotator cuff (de schouder), de hand, de biceps, de duim en andere pezen. Tendinitis of peesruptuur kan optreden binnen enkele uren of dagen na het starten van CIPRO 500 mg, of tot enkele maanden na voltooiing van de behandeling met fluorochinolon. Tendinitis en peesruptuur kunnen bilateraal voorkomen.
Het risico op het ontwikkelen van fluorochinolon-geassocieerde tendinitis en peesruptuur is verhoogd bij patiënten ouder dan 60 jaar, bij patiënten die corticosteroïden gebruiken en bij patiënten met nier-, hart- of longtransplantaties. Andere factoren die onafhankelijk van elkaar het risico op peesruptuur kunnen verhogen, zijn zware lichamelijke activiteit, nierfalen en eerdere peesaandoeningen zoals reumatoïde artritis. Tendinitis en peesruptuur zijn ook voorgekomen bij patiënten die fluorochinolonen gebruiken en die de bovengenoemde risicofactoren niet hebben. Stop onmiddellijk met CIPRO 250 mg als de patiënt pijn, zwelling, ontsteking of scheuring van een pees ervaart. Vermijd fluoroquinolonen, inclusief CIPRO 250 mg, bij patiënten met een voorgeschiedenis van peesaandoeningen of die tendinitis of peesruptuur hebben gehad [zie ONGEWENSTE REACTIES ].
Perifere neuropathie
Fluoroquinolonen, waaronder CIPRO, zijn in verband gebracht met een verhoogd risico op perifere neuropathie. Gevallen van sensorische of sensorimotorische axonale polyneuropathie die kleine en/of grote axonen aantast, resulterend in paresthesieën, hypesthesieën, dysesthesieën en zwakte zijn gemeld bij patiënten die fluorochinolonen kregen, waaronder CIPRO. Symptomen kunnen kort na het starten van CIPRO optreden en kunnen bij sommige patiënten onomkeerbaar zijn [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Stop onmiddellijk met CIPRO als de patiënt symptomen van perifere neuropathie ervaart, waaronder pijn, branderig gevoel, tintelingen, gevoelloosheid en/of zwakte, of andere veranderingen in gewaarwordingen, waaronder lichte aanraking, pijn, temperatuur, positiegevoel en vibrerend gevoel, en/of motorische kracht in om de ontwikkeling van een onomkeerbare aandoening tot een minimum te beperken. Vermijd fluoroquinolonen, inclusief CIPRO 500 mg, bij patiënten die eerder perifere neuropathie hebben gehad [zie: ONGEWENSTE REACTIES ].
Effecten op het centrale zenuwstelsel
Psychiatrische bijwerkingen
Fluoroquinolonen, waaronder CIPRO, zijn in verband gebracht met een verhoogd risico op psychiatrische bijwerkingen, waaronder: toxische psychose, psychotische reacties die overgaan in zelfmoordgedachten/-gedachten, hallucinaties of paranoia; depressie of zelfbeschadigend gedrag zoals poging tot of voltooide zelfmoord; angst, opwinding of nervositeit; verwarring, delirium, desoriëntatie of aandachtsstoornissen; slapeloosheid of nachtmerries; geheugenstoornis. Deze reacties kunnen optreden na de eerste dosis. Adviseer patiënten die CIPRO krijgen om hun zorgverlener onmiddellijk te informeren als deze reacties optreden, stop met het medicijn en stel passende zorg in.
Bijwerkingen van het centrale zenuwstelsel
Fluoroquinolonen, waaronder CIPRO 750 mg, zijn in verband gebracht met een verhoogd risico op convulsies (convulsies), verhoogde intracraniale druk (pscudotumor cerebri), duizeligheid en tremoren. Het is bekend dat CIPRO, net als andere fluoroquinolonen, epileptische aanvallen veroorzaakt of de aanvalsdrempel verlaagt. Er zijn gevallen van status epilepticus gemeld. Zoals met alle fluorochinolonen, moet CIPRO met voorzichtigheid worden gebruikt bij epileptische patiënten en patiënten met bekende of vermoede aandoeningen van het centrale zenuwstelsel die vatbaar kunnen zijn voor epileptische aanvallen of die de aanvalsdrempel kunnen verlagen (bijvoorbeeld ernstige cerebrale arteriosclerose, voorgeschiedenis van convulsie, verminderde cerebrale bloedstroom, veranderde hersenen structuur of beroerte), of in de aanwezigheid van andere risicofactoren die vatbaar kunnen zijn voor epileptische aanvallen of die de aanvalsdrempel kunnen verlagen (bijvoorbeeld bepaalde medicamenteuze behandeling, nierdisfunctie). Als er epileptische aanvallen optreden, stop dan met CIPRO 500 mg en stel passende zorg in [zie ONGEWENSTE REACTIES en DRUG-INTERACTIES ].
Exacerbatie van Myasthenia Gravis
Fluoroquinolonen, waaronder CIPRO, hebben een neuromusculaire blokkerende activiteit en kunnen spierzwakte verergeren bij patiënten met myasthenia gravis. Ernstige bijwerkingen na het in de handel brengen, waaronder sterfgevallen en de noodzaak van beademing, zijn in verband gebracht met het gebruik van fluorochinolonen bij patiënten met myasthenia gravis. Vermijd CIPRO bij patiënten met een bekende voorgeschiedenis van myasthenia gravis [zie ONGEWENSTE REACTIES ].
Andere ernstige en soms fatale bijwerkingen
Andere ernstige en soms fatale bijwerkingen, sommige wegens overgevoeligheid en sommige wegens onzekere etiologie, zijn gemeld bij patiënten die werden behandeld met chinolonen, waaronder CIPRO. Deze voorvallen kunnen ernstig zijn en treden in het algemeen op na toediening van meerdere doses. Klinische manifestaties kunnen een of meer van de volgende omvatten:
- Koorts, huiduitslag of ernstige dermatologische reacties (bijvoorbeeld toxische epidermale necrolyse, Stevens-Johnson-syndroom);
- Vasculitis; artralgie; spierpijn; allergisch voor antibiotica;
- Allergische pneumonitis;
- Interstitiële nefritis; acute nierinsufficiëntie of nierfalen;
- Hepatitis; geelzucht; acute levernecrose of falen;
- Bloedarmoede, waaronder hemolytische en aplastische; trombocytopenie, waaronder trombotische trombocytopenische purpura; leukopenie; agranulocytose; pancytopenie; en/of andere hematologische afwijkingen.
Stop onmiddellijk met CIPRO 500 mg bij het eerste optreden van huiduitslag, geelzucht of enig ander teken van overgevoeligheid en ondersteunende maatregelen [zie ONGEWENSTE REACTIES ].
Overgevoeligheidsreacties
Ernstige en soms fatale overgevoeligheidsreacties (anafylactische reacties), sommige na de eerste dosis, zijn gemeld bij patiënten die een behandeling met fluorochinolon kregen, waaronder CIPRO. Sommige reacties gingen gepaard met cardiovasculaire collaps, bewustzijnsverlies, tintelingen, faryngeaal of gezichtsoedeem, dyspneu, urticaria en jeuk. Slechts enkele patiënten hadden een voorgeschiedenis van overgevoeligheidsreacties. Ernstige anafylactische reacties vereisen onmiddellijke spoedbehandeling met epinefrine en andere reanimatiemaatregelen, waaronder zuurstof, intraveneuze vloeistoffen, intraveneuze antihistaminica, corticosteroïden, pressoramines en luchtwegbeheer, inclusief intubatie, zoals aangegeven [zie ONGEWENSTE REACTIES ].
Hepatotoxiciteit
Gevallen van ernstige levertoxiciteit, waaronder levernecrose, levensbedreigend leverfalen en fatale voorvallen, zijn gemeld met CIPRO. Acuut leverletsel begint snel (bereik 1 - 39 dagen) en wordt vaak geassocieerd met overgevoeligheid. Het patroon van de verwonding kan hepatocellulair, cholestatisch of gemengd zijn. De meeste patiënten met fatale afloop waren ouder dan 55 jaar. In het geval van tekenen en symptomen van hepatitis (zoals anorexia, geelzucht, donkere urine, pruritus of gevoelige buik), stop dan onmiddellijk met de behandeling.
Er kan een tijdelijke toename zijn van transaminasen, alkalische fosfatase of cholestatische geelzucht, vooral bij patiënten met eerdere leverbeschadiging, die worden behandeld met CIPRO [zie ONGEWENSTE REACTIES ].
Risico op aorta-aneurysma en dissectie
Epidemiologische onderzoeken melden een verhoogd aantal aorta-aneurysma's en dissecties binnen twee maanden na gebruik van fluorochinolonen, vooral bij oudere patiënten. De oorzaak van het verhoogde risico is niet vastgesteld. Bij patiënten met een bekend aorta-aneurysma of patiënten met een groter risico op aorta-aneurysma's, reserveer CIPRO 750 mg alleen voor gebruik als er geen alternatieve antibacteriële behandelingen beschikbaar zijn.
Ernstige bijwerkingen met gelijktijdige theofylline
Ernstige en fatale reacties zijn gemeld bij patiënten die gelijktijdig CIPRO 250 mg en theofylline kregen. Deze reacties omvatten hartstilstand, toevallen, status epilepticus en ademhalingsinsufficiëntie. Gevallen van misselijkheid, braken, tremor, prikkelbaarheid of hartkloppingen zijn ook voorgekomen.
Hoewel vergelijkbare ernstige bijwerkingen zijn gemeld bij patiënten die alleen theofylline kregen, kan de mogelijkheid dat deze reacties worden versterkt door CIPRO niet worden uitgesloten. Als gelijktijdig gebruik niet kan worden vermeden, controleer dan de serumspiegels van theofylline en pas de dosering indien nodig aan [zie: DRUG-INTERACTIES ].
Clostridioides Difficile-geassocieerde diarree
Clostridioides difficile (C. difficile)-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, inclusief CIPRO, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende isolaten van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na antibacterieel gebruik. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het lopende antibacteriële gebruik dat niet is gericht tegen C. difficile. Passend vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële behandeling van C. difficile en chirurgische evaluatie instellen zoals klinisch geïndiceerd [zie ONGEWENSTE REACTIES ].
Verlenging van het QT-interval
Sommige fluoroquinolonen, waaronder CIPRO 750 mg, zijn in verband gebracht met verlenging van het QT-interval op het elektrocardiogram en met gevallen van aritmie. Gevallen van torsade de pointes zijn gemeld tijdens postmarketingsurveillance bij patiënten die fluorochinolonen kregen, waaronder CIPRO.
Vermijd CIPRO 1000 mg bij patiënten met bekende verlenging van het QT-interval, risicofactoren voor QT-verlenging of torsade de pointes (bijvoorbeeld aangeboren lang QT-syndroom, niet-gecorrigeerde verstoring van de elektrolytenbalans, zoals hypokaliëmie of hypomagnesiëmie en hartaandoeningen, zoals hartfalen, myocard infarct of bradycardie), en patiënten die anti-aritmica van klasse IA (kinidine, procaïnamide) of anti-aritmica van klasse III (amiodaron, sotalol), tricyclische antidepressiva, macroliden en antipsychotica krijgen. Oudere patiënten kunnen ook gevoeliger zijn voor geneesmiddelgerelateerde effecten op het QT-interval [zie: ONGEWENSTE REACTIES , Gebruik bij specifieke populaties ].
Aandoeningen van het bewegingsapparaat bij pediatrische patiënten en arthropathische effecten bij dieren
CIPRO 250 mg is alleen geïndiceerd bij pediatrische patiënten (jonger dan 18 jaar) voor cUTI, preventie van inhalatie-anthrax (na blootstelling) en pest [zie AANWIJZINGEN EN GEBRUIK ]. Er is een verhoogde incidentie van bijwerkingen waargenomen in vergelijking met controles, waaronder reacties gerelateerd aan gewrichten en/of omliggende weefsels [zie: ONGEWENSTE REACTIES ].
In preklinische onderzoeken veroorzaakte orale toediening van CIPRO kreupelheid bij onvolgroeide honden. Histopathologisch onderzoek van de gewichtdragende gewrichten van deze honden bracht blijvende laesies van het kraakbeen aan het licht. Verwante geneesmiddelen van de chinolonklasse veroorzaken ook erosies van kraakbeen van gewichtdragende gewrichten en andere tekenen van artropathie bij onvolgroeide dieren van verschillende soorten [zie Gebruik bij specifieke populaties en Niet-klinische toxicologie ].
Lichtgevoeligheid/fototoxiciteit
Matige tot ernstige fotosensibiliteits-/fototoxiciteitsreacties, waarvan de laatste zich kan manifesteren als overdreven zonnebrandreacties (bijvoorbeeld verbranding, erytheem, exsudatie, blaasjes, blaarvorming, oedeem) waarbij delen zijn blootgesteld aan licht (meestal het gezicht, "V"-gebied van de nek, extensoroppervlakken van de onderarmen, dorsa van de handen), kunnen in verband worden gebracht met het gebruik van chinolonen, waaronder CIPRO, na blootstelling aan de zon of UV-licht. Vermijd daarom overmatige blootstelling aan deze lichtbronnen. Stop met CIPRO 250 mg als fototoxiciteit optreedt [zie ONGEWENSTE REACTIES ].
Ontwikkeling van geneesmiddelresistente bacteriën
Het voorschrijven van CIPRO 250 mg tabletten en CIPRO orale suspensie bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Potentiële risico's bij gelijktijdig gebruik van geneesmiddelen die worden gemetaboliseerd door cytochroom P450 1A2-enzymen
CIPRO 750 mg is een remmer van de hepatische CYP1A2-enzymroute. Gelijktijdige toediening van CIPRO en andere geneesmiddelen die voornamelijk worden gemetaboliseerd door CYP1A2 (bijvoorbeeld theofylline, methylxanthinen, cafeïne, tizanidine, ropinirol, clozapine, olanzapine en zolpidem), resulteert in verhoogde plasmaconcentraties van het gelijktijdig toegediende geneesmiddel en kan leiden tot klinisch significante farmacodynamische bijwerkingen van het gelijktijdig toegediende geneesmiddel [zie: DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Interferentie met tijdige diagnose van syfilis
Het is niet aangetoond dat CIPRO 1000 mg effectief is bij de behandeling van syfilis. Antimicrobiële middelen die gedurende korte perioden in hoge doses worden gebruikt om gonorroe te behandelen, kunnen de symptomen van incubatie van syfilis maskeren of vertragen. Voer een serologische test uit voor syfilis bij alle patiënten met gonorroe op het moment van diagnose. Voer een follow-up serologische test uit voor syfilis drie maanden na de CIPRO-behandeling.
kristalurie
Kristallen van ciprofloxacine zijn zelden waargenomen in de urine van proefpersonen, maar vaker in de urine van proefdieren, die gewoonlijk alkalisch is [zie Niet-klinische toxicologie ]. Kristalurie gerelateerd aan CIPRO is slechts zelden gemeld bij mensen omdat menselijke urine gewoonlijk zuur is. Vermijd alkaliteit van de urine bij patiënten die CIPRO krijgen. Hydrateer patiënten goed om de vorming van sterk geconcentreerde urine te voorkomen [zie DOSERING EN ADMINISTRATIE ].
Bloedglucosestoornissen
Fluoroquinolonen, waaronder CIPRO, zijn in verband gebracht met verstoringen van de bloedglucose, waaronder symptomatische hyperglykemie en hypoglykemie, meestal bij diabetespatiënten die gelijktijdig worden behandeld met een oraal bloedglucoseverlagend middel (bijvoorbeeld glyburide) of met insuline. Bij deze patiënten wordt zorgvuldige controle van de bloedglucose aanbevolen. Ernstige gevallen van hypoglykemie met coma of overlijden tot gevolg zijn gemeld. Als een hypoglykemische reactie optreedt bij een patiënt die wordt behandeld met CIPRO, stop dan met CIPRO 750 mg en start onmiddellijk de juiste therapie [zie ONGEWENSTE REACTIES , DRUG-INTERACTIES ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids )
Ernstige bijwerkingen
Adviseer patiënten om te stoppen met het gebruik van CIPRO 250 mg als ze een bijwerking ervaren en om hun zorgverlener te bellen voor advies over het voltooien van de volledige behandelingskuur met een ander antibacterieel geneesmiddel.
Informeer patiënten over de volgende ernstige bijwerkingen die in verband zijn gebracht met het gebruik van CIPRO of ander fluorochinolonen:
- Invaliderende en mogelijk onomkeerbare ernstige bijwerkingen die samen kunnen optreden: Informeer patiënten dat invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathieën en effecten op het centrale zenuwstelsel, in verband zijn gebracht met het gebruik van CIPRO 1000 mg en samen bij dezelfde patiënt kunnen voorkomen. Informeer patiënten om onmiddellijk te stoppen met het gebruik van CIPRO als ze een bijwerking ervaren en om hun zorgverlener te bellen.
- Tendinitis en peesruptuur: Instrueer patiënten om contact op te nemen met hun zorgverlener als ze pijn, zwelling of ontsteking van een pees, of zwakte of onvermogen om een van hun gewrichten te gebruiken, ervaren; rust en onthoud van lichaamsbeweging; en stop de behandeling met CIPRO 750 mg. Symptomen kunnen onomkeerbaar zijn. Het risico op ernstige peesaandoeningen met fluorochinolonen is hoger bij oudere patiënten, gewoonlijk ouder dan 60 jaar, bij patiënten die corticosteroïden gebruiken en bij patiënten met nier-, hart- of longtransplantaties.
- Perifere neuropathieën: Informeer patiënten dat perifere neuropathieën in verband zijn gebracht met het gebruik van ciprofloxacine. De symptomen kunnen kort na het starten van de therapie optreden en kunnen onomkeerbaar zijn. Als zich symptomen van perifere neuropathie ontwikkelen, waaronder pijn, branderig gevoel, tintelingen, gevoelloosheid en/of zwakte, stop dan onmiddellijk met CIPRO en vertel hen contact op te nemen met hun arts.
- Effecten op het centrale zenuwstelsel (bijvoorbeeld convulsies, duizeligheid, licht gevoel in het hoofd, verhoogde intracraniale druk): Informeer patiënten dat convulsies zijn gemeld bij patiënten die fluorochinolonen kregen, waaronder ciprofloxacine. Instrueer patiënten om hun arts op de hoogte te stellen voordat ze dit medicijn gebruiken als ze een voorgeschiedenis van convulsies hebben. Informeer patiënten dat ze moeten weten hoe ze op CIPRO reageren voordat ze een auto of machine bedienen of andere activiteiten ondernemen die mentale alertheid en coördinatie vereisen. Instrueer patiënten om hun arts op de hoogte te stellen als aanhoudende hoofdpijn met of zonder wazig zicht optreedt.
- Exacerbatie van Myasthenia Gravis: Instrueer patiënten om hun arts te informeren over een voorgeschiedenis van myasthenia gravis. Instrueer patiënten om hun arts op de hoogte te stellen als ze symptomen van spierzwakte ervaren, waaronder ademhalingsmoeilijkheden.
- Overgevoeligheidsreacties: Informeer patiënten dat ciprofloxacine overgevoeligheidsreacties kan veroorzaken, zelfs na een enkele dosis, en stop met het gebruik van het geneesmiddel bij het eerste teken van huiduitslag, netelroos of andere huidreacties, een snelle hartslag, moeite met slikken of ademen, zwelling die wijst op angio-oedeem ( bijvoorbeeld zwelling van de lippen, tong, gezicht, beklemd gevoel in de keel, heesheid) of andere symptomen van een allergische reactie.
- Levertoxiciteit: Informeer patiënten dat ernstige hepatotoxiciteit (inclusief acute hepatitis en fatale voorvallen) is gemeld bij patiënten die CIPRO gebruiken. Instrueer patiënten om hun arts te informeren als ze tekenen of symptomen van leverbeschadiging ervaren, waaronder: verlies van eetlust, misselijkheid, braken, koorts, zwakte, vermoeidheid, gevoeligheid van het rechter bovenste kwadrant, jeuk, gele verkleuring van de huid en ogen, lichtgekleurde stoelgang of donkergekleurde urine.
- Aorta-aneurysma en dissectie: Informeer patiënten om medische noodhulp te zoeken als ze plotselinge pijn op de borst, maag of rug ervaren.
- Diarree: Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, instrueer patiënten om zo snel mogelijk contact op te nemen met hun arts.
- Verlenging van het QT-interval: Instrueer patiënten om hun arts te informeren over elke persoonlijke of familiegeschiedenis van QT-verlenging of pro-aritmische aandoeningen zoals hypokaliëmie, bradycardie of recente myocardischemie; als ze een klasse IA (kinidine, procaïnamide) of klasse III (amiodaron, sotalol) anti-aritmica gebruiken. Instrueer patiënten om hun arts op de hoogte te stellen als ze symptomen van verlenging van het QT-interval hebben, waaronder langdurige hartkloppingen of bewustzijnsverlies.
- Aandoeningen van het bewegingsapparaat bij pediatrische patiënten: Instrueer ouders om de arts van hun kind op de hoogte te stellen als het kind in het verleden gewrichtsproblemen heeft gehad voordat dit geneesmiddel wordt gebruikt. Informeer ouders van pediatrische patiënten om de arts van hun kind op de hoogte te stellen van gewrichtsproblemen die optreden tijdens of na behandeling met cipro 1000 mgfloxacine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
- Tizanidine: Instrueer patiënten om cipro 250 mgfloxacine niet te gebruiken als ze al tizanidine gebruiken. CIPRO verhoogt de effecten van tizanidine (Zanaflex®).
- Theofylline: Informeer patiënten dat cipro 250 mgfloxacine CIPRO 1000 mg de effecten van theofylline kan versterken. Er kunnen levensbedreigende effecten op het centrale zenuwstelsel en aritmieën optreden. Adviseer de patiënten om onmiddellijk medische hulp te zoeken als ze epileptische aanvallen, hartkloppingen of ademhalingsmoeilijkheden krijgen.
- Cafeïne: Informeer patiënten dat CIPRO 500 mg de effecten van cafeïne kan versterken. Er is een mogelijkheid van ophoping van cafeïne wanneer producten die cafeïne bevatten worden geconsumeerd tijdens het gebruik van chinolonen.
- Lichtgevoeligheid/fototoxiciteit: Informeer patiënten dat fotosensitiviteit/fototoxiciteit is gemeld bij patiënten die fluorochinolonen kregen. Informeer patiënten om blootstelling aan natuurlijk of kunstmatig zonlicht (zonnebanken of UVA/B-behandeling) te minimaliseren of te vermijden tijdens het gebruik van chinolonen. Als patiënten buitenshuis moeten zijn tijdens het gebruik van chinolonen, instrueer hen dan om loszittende kleding te dragen die de huid tegen blootstelling aan de zon beschermt en bespreek andere zonbeschermingsmaatregelen met hun arts. Als een zonnebrandachtige reactie of huiduitslag optreedt, instrueer patiënten om contact op te nemen met hun arts.
- Bloedglucosestoornissen: Informeer de patiënten dat als ze diabetes hebben en worden behandeld met insuline of een oraal bloedglucoseverlagend middel en er een hypoglykemische reactie optreedt, ze moeten stoppen met CIPRO 250 mg en een arts moeten raadplegen.
- Borstvoeding: Voor andere indicaties dan antrax door inhalatie (na blootstelling), dient u een vrouw te adviseren dat borstvoeding niet wordt aanbevolen tijdens de behandeling met Cipro en gedurende nog eens 2 dagen na de laatste dosis. Als alternatief kan een vrouw pompen en weggooien tijdens de behandeling en gedurende nog eens 2 dagen na de laatste dosis [zie: Gebruik bij specifieke populaties ].
Antibacteriële resistentie
Informeer patiënten dat antibacteriële geneesmiddelen, waaronder CIPRO 250 mg tabletten en CIPRO 1000 mg orale suspensie, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijvoorbeeld verkoudheid). Wanneer CIPRO 500 mg tabletten en CIPRO 500 mg orale suspensie worden voorgeschreven om een bacteriële infectie te behandelen, moeten patiënten worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en niet kunnen worden behandeld met CIPRO 500 mg tabletten en CIPRO 250 mg orale suspensie of andere antibacteriële medicijnen in de toekomst.
Beheer instructies
Instrueer de patiënt
- Om CIPRO orale suspensie elke keer krachtig te schudden voor gebruik gedurende ongeveer 15 seconden.
- Gebruik altijd de meeverpakte maatlepel met maatverdeling met markeringen voor ½ (2,5 ml) en 1/1 (5 ml), om de exacte dosis te verkrijgen.
- Na gebruik moet de maatlepel met schaalverdeling onder stromend water met afwasmiddel worden gereinigd en grondig worden afgedroogd.
- Niet om op de microcapsules te kauwen, maar om ze heel door te slikken.
- Dat water kan achteraf worden ingenomen.
- Sluit de fles na elk gebruik goed af volgens de instructies op de dop.
- Nadat de behandeling is voltooid, mag CIPRO 1000 mg orale suspensie niet opnieuw worden gebruikt.
Informeer patiënten dat CIPRO 250 mg met of zonder voedsel kan worden ingenomen.
Informeer patiënten om royaal te drinken tijdens het gebruik van CIPRO om de vorming van sterk geconcentreerde urine en kristalvorming in de urine te voorkomen.
Informeer patiënten dat antacida die magnesium of aluminium bevatten, evenals sucralfaat, metaalkationen zoals ijzer, en multivitaminepreparaten met zink of didanosine ten minste twee uur vóór of zes uur na toediening van CIPRO 1000 mg moeten worden ingenomen. CIPRO mag niet worden ingenomen met alleen zuivelproducten (zoals melk of yoghurt) of met calcium verrijkte sappen, aangezien de absorptie van ciprofloxacine aanzienlijk kan worden verminderd; CIPRO 500 mg kan echter worden ingenomen bij een maaltijd die deze producten bevat.
Adviseer patiënten dat als een dosis wordt gemist, deze op elk moment moet worden ingenomen, maar niet later dan 6 uur vóór de volgende geplande dosis. Als er minder dan 6 uur resteren voor de volgende dosis, mag de gemiste dosis niet worden ingenomen en moet de behandeling worden voortgezet zoals voorgeschreven met de volgende geplande dosis. Er mogen geen dubbele doses worden ingenomen om een gemiste dosis te compenseren.
Adviseer patiënten dat CIPRO 500 mg-tabletten (250 mg en 500 mg) een breukstreep hebben en bij de breuklijn in tweeën kunnen worden gesplitst om respectievelijk een sterkte van 125 mg of 250 mg te verkrijgen.
Geneesmiddelinteracties Orale antidiabetica
Patiënten informeren dat hypoglykemie is gemeld bij gelijktijdige toediening van cipro 250 mgfloxacine en orale antidiabetica; als een lage bloedsuikerspiegel optreedt met CIPRO 750 mg, instrueer hen om hun arts te raadplegen en dat hun antibacteriële geneesmiddel mogelijk moet worden gewijzigd.
Miltvuur en peststudies
Informeer patiënten die CIPRO kregen voor deze aandoeningen dat werkzaamheidsonderzoeken om haalbaarheidsredenen niet bij mensen konden worden uitgevoerd. Daarom was de goedkeuring voor deze aandoeningen gebaseerd op werkzaamheidsonderzoeken bij dieren.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn acht in vitro mutageniteitstesten uitgevoerd met cipro 500 mgfloxacine en de testresultaten staan hieronder vermeld:
- Salmonella/Microsoomtest (negatief)
- E. coli DNA-reparatietest (negatief)
- Muis lymfoom Cell Forward Mutation Assay (positief)
- Chinese Hamster V79 Cell HGPRT-test (negatief)
- Syrische Hamster Embryo Cel Transformatie Assay (negatief)
- Puntmutatietest Saccharomyces cerevisiae (negatief)
- Saccharomyces cerevisiae Mitotische crossover en genconversietest (negatief)
- Rat hepatocyt DNA-reparatietest (positief)
Dus 2 van de 8 tests waren positief, maar de resultaten van de volgende 3 in vivo testsystemen gaven negatieve resultaten:
- Rat hepatocyt DNA-reparatietest
- Micronucleus-test (muizen)
- Dominante dodelijke test (muizen)
Langdurige carcinogeniteitsonderzoeken bij ratten en muizen resulteerden niet in carcinogene of tumorverwekkende effecten als gevolg van cipro 500 mgfloxacine bij dagelijkse orale doseringen tot 250 mg/kg en 750 mg/kg voor respectievelijk ratten en muizen (ongeveer 1,7 en 2,5 maal de de hoogste aanbevolen therapeutische dosis op basis van respectievelijk het lichaamsoppervlak).
Resultaten van foto-co-carcinogeniteitstesten geven aan dat cipro 1000 mgfloxacine de tijd tot het verschijnen van UV-geïnduceerde huidtumoren niet verkort in vergelijking met vehiculumcontrole. Haarloze (Skh-1) muizen werden gedurende 3,5 uur vijf keer per twee weken gedurende maximaal 78 weken blootgesteld aan UVA-licht, terwijl gelijktijdig ciprofloxacine werd toegediend. De tijd tot ontwikkeling van de eerste huidtumoren was 50 weken bij muizen die gelijktijdig werden behandeld met UVA en cipro 1000 mgfloxacine (muisdosis ongeveer gelijk aan de maximale aanbevolen dosis voor de mens op basis van lichaamsoppervlak), in tegenstelling tot 34 weken wanneer dieren werden behandeld met zowel UVA en voertuig. De tijd tot ontwikkeling van huidtumoren varieerde van 16 weken tot 32 weken bij muizen die gelijktijdig werden behandeld met UVA en andere chinolonen.5
In dit model ontwikkelden muizen die met ciprofloxacine alleen werden behandeld, geen huid- of systemische tumoren. Er zijn geen gegevens van vergelijkbare modellen met gepigmenteerde muizen en/of volledig behaarde muizen. De klinische betekenis van deze bevindingen voor de mens is niet bekend.
Vruchtbaarheidsonderzoeken uitgevoerd bij mannelijke en vrouwelijke ratten met orale doses cipro 250 mgfloxacine tot 100 mg/kg (ongeveer 0,6 maal de hoogste aanbevolen therapeutische orale dosis op basis van lichaamsoppervlak) brachten geen aanwijzingen voor een stoornis aan het licht. Mannelijke ratten kregen oraal ciprofloxacine gedurende 10 weken voorafgaand aan de paring en vrouwtjes kregen gedurende 3 weken voorafgaand aan de paring een dosis tot en met dag 7 van de dracht.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Langdurige ervaring met cipro 1000 mgfloxacine bij zwangere vrouwen gedurende meerdere decennia, op basis van beschikbare gepubliceerde informatie uit casusrapporten, case-control-onderzoeken en observationele onderzoeken met cipro 1000 mgfloxacine toegediend tijdens de zwangerschap, heeft geen geneesmiddel-geassocieerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten (zie Gegevens ). Orale toediening van cipro 500 mgfloxacine tijdens de organogenese in doses tot 100 mg/kg aan drachtige muizen en ratten, en tot 30 mg/kg aan drachtige konijnen veroorzaakte geen foetale misvormingen (zie Gegevens ). Deze doses waren tot 0,3, 0,6 en 0,4 maal de maximaal aanbevolen klinische orale dosis bij respectievelijk muizen, ratten en konijnen, gebaseerd op het lichaamsoppervlak. Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS zijn de geschatte achtergrondrisico's van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Gegevens
Menselijke gegevens
Hoewel beschikbare onderzoeken de afwezigheid van risico niet definitief kunnen vaststellen, hebben gepubliceerde gegevens van prospectieve observationele onderzoeken gedurende meerdere decennia geen verband aangetoond met het gebruik van cipro 250 mgfloxacine tijdens zwangerschap en ernstige geboorteafwijkingen, miskraam of ongunstige maternale of foetale uitkomsten. Beschikbare onderzoeken hebben methodologische beperkingen, waaronder een kleine steekproefomvang en sommige zijn niet specifiek voor ciprofloxacine. Een gecontroleerd prospectief observationeel onderzoek volgde 200 vrouwen die tijdens de zwangerschap werden blootgesteld aan fluoroquinolonen (52,5% blootgesteld aan cipro 250 mgfloxacine en 68% blootstelling in het eerste trimester). In utero blootstelling aan fluoroquinolonen tijdens de embryogenese ging niet gepaard met een verhoogd risico op ernstige misvormingen. De gerapporteerde percentages ernstige aangeboren misvormingen waren 2,2% voor de fluorochinolongroep en 2,6% voor de controlegroep (achtergrondincidentie van ernstige misvormingen is 1-5%). Het aantal spontane abortussen, vroeggeboorte en laag geboortegewicht verschilde niet tussen de groepen en er waren geen klinisch significante musculoskeletale disfuncties tot een jaar oud bij de aan cipro 500 mgfloxacine blootgestelde kinderen.
Een ander prospectief vervolgonderzoek rapporteerde 549 zwangerschappen met blootstelling aan fluorochinolon (93% blootstellingen in het eerste trimester). Er waren 70 blootstellingen aan cipro 500 mgfloxacine, allemaal binnen het eerste trimester. De misvormingspercentages bij levend geboren baby's die werden blootgesteld aan cipro 750 mgfloxacine en aan fluorochinolonen waren in het algemeen beide binnen de achtergrondincidentiebereiken. Er werden geen specifieke patronen van aangeboren afwijkingen gevonden. De studie bracht geen duidelijke bijwerkingen aan het licht als gevolg van blootstelling in utero aan ciprofloxacine.
Er werden geen verschillen gezien in het aantal vroeggeboorten, spontane abortussen of geboortegewicht bij vrouwen die tijdens de zwangerschap aan ciprofloxacine werden blootgesteld. Deze kleine postmarketing epidemiologische onderzoeken, waarvan de meeste ervaring afkomstig is van blootstelling op korte termijn, in het eerste trimester, zijn echter onvoldoende om het risico op minder vaak voorkomende defecten te evalueren of om betrouwbare en definitieve conclusies te trekken over de veiligheid van ciprofloxacine bij zwangere vrouwen en hun zich ontwikkelende foetussen. .
Dierlijke gegevens
Er zijn ontwikkelingstoxicologische onderzoeken uitgevoerd met cipro 500 mgfloxacine bij ratten, muizen en konijnen. Bij ratten en muizen werden orale doses tot 100 mg/kg toegediend tijdens de organogenese (Drachtdagen, GD, 6-17) niet geassocieerd met nadelige ontwikkelingsresultaten, waaronder embryofoetale toxiciteit of misvormingen. Bij ratten en muizen is een dosis van 100 mg/kg respectievelijk ongeveer 0,6 en 0,3 maal de maximale dagelijkse orale dosis voor de mens (1500 mg/dag), gebaseerd op het lichaamsoppervlak. In een reeks van ontwikkelingstoxicologische onderzoeken bij konijnen kregen ze oraal of intraveneus cipro 250 mgfloxacine gedurende een van de volgende perioden van 5 dagen: GD 6 tot 10, GD 10 tot 14 of GD 14 tot 18, bedoeld om de periode van organogenese te dekken. Dit was een poging om de gastro-intestinale intolerantie te verminderen die werd waargenomen bij konijnen die antibacteriële middelen kregen, wat tot uiting kwam in verminderde maternale voedselconsumptie en gewichtsverlies, wat kan leiden tot embryofoetale resorptie of spontane abortus. Een orale dosis cipro 750 mgfloxacine van 100 mg/kg (ongeveer 1,3 maal de hoogste aanbevolen klinische orale dosis op basis van het lichaamsoppervlak) veroorzaakte overmatige maternale toxiciteit, waardoor de evaluatie van de foetussen werd verstoord. Een orale dosis van 30 mg/kg (ongeveer 0,4 maal de hoogste aanbevolen klinische orale dosis) ging gepaard met onderdrukking van de gewichtstoename van de moeder en de foetus, maar foetale misvormingen werden niet waargenomen. Intraveneuze toediening van doses tot 20 mg/kg (ongeveer 0,3 maal de hoogste aanbevolen klinische orale dosis op basis van lichaamsoppervlak) aan drachtige konijnen was niet toxisch voor de moeder en er werden geen embryofoetale toxiciteit of foetale misvormingen waargenomen.
In peri- en postnatale onderzoeken kregen ratten cipro 1000 mgfloxacine doses tot 200 mg/kg/dag (oraal) of tot 30 mg/kg/dag (subcutaan) van GD 16 tot 22 dagen postpartum. De dosis van 200 mg/kg is ongeveer 1,3 maal de maximaal aanbevolen klinische orale dosis op basis van het lichaamsoppervlak. Er werden geen maternale toxiciteit of nadelige effecten op de groei en ontwikkeling van de pups waargenomen, inclusief geen teken van artropathie op de achterpootgewrichten van de pups. Van ciprofloxacine en andere chinolonen is aangetoond dat ze artropathie veroorzaken bij onvolgroeide dieren van de meeste geteste soorten wanneer ze rechtstreeks worden toegediend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Niet-klinische toxicologie ].
Borstvoeding
Risico Samenvatting
Gepubliceerde literatuur meldt dat cipro 1000 mgfloxacine aanwezig is in de moedermelk na intraveneuze en orale toediening. Er is geen informatie over effecten van CIPRO op de melkproductie of de zuigeling die borstvoeding krijgt. Vanwege het potentiële risico op ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen, waaronder artropathie die is aangetoond in onderzoeken bij jonge dieren [zie: Gebruik bij specifieke populaties (klinische overwegingen)], voor de meeste indicaties kan een zogende vrouw overwegen om de moedermelk af te kolven en weg te gooien tijdens de behandeling met CIPRO 500 mg en nog eens twee dagen (vijf halfwaardetijden) na de laatste dosis. U kunt een vrouw ook adviseren dat borstvoeding niet wordt aanbevolen tijdens de behandeling met CIPRO en gedurende nog eens twee dagen (vijf halfwaardetijden) na de laatste dosis.
Echter, voor inademing van miltvuur (na blootstelling), tijdens een incident dat leidt tot blootstelling aan miltvuur, kan de risico-batenbeoordeling van doorgaan met borstvoeding geven terwijl de moeder (en mogelijk het kind) CIPRO gebruikt, acceptabel zijn [zie DOSERING EN ADMINISTRATIE , Pediatrisch gebruik , en Klinische studies ]. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan CIPRO en eventuele nadelige effecten op het kind dat borstvoeding krijgt van CIPRO 1000 mg of van de onderliggende maternale aandoening.
Klinische overwegingen
Cipro 1000 mgfloxacine kan veranderingen in de darmflora veroorzaken bij zuigelingen die borstvoeding geven. Adviseer een vrouw om de zuigeling die borstvoeding krijgt te controleren op dunne of bloederige ontlasting en candidiasis (spruw, luieruitslag).
Pediatrisch gebruik
Hoewel effectief in klinische onderzoeken, is CIPRO 750 mg niet het eerste keus geneesmiddel bij pediatrische patiënten vanwege een verhoogde incidentie van bijwerkingen in vergelijking met controles. Chinolonen, waaronder CIPRO, veroorzaken artropathie (artralgie, artritis) bij jonge dieren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Niet-klinische toxicologie ].
Gecompliceerde urineweginfectie en pyelonefritis
CIPRO 250 mg is geïndiceerd voor de behandeling van cUTI en pyelonefritis als gevolg van Escherichia coli bij pediatrische patiënten van 1 tot 17 jaar. Hoewel het effectief is in klinische onderzoeken, is CIPRO 500 mg niet het eerste keus geneesmiddel bij pediatrische patiënten vanwege een verhoogde incidentie van bijwerkingen in vergelijking met de controlegroep, waaronder voorvallen die verband houden met gewrichten en/of omliggende weefsels [zie ONGEWENSTE REACTIES en Klinische studies ].
Inhalatie miltvuur (post-blootstelling)
CIPRO 750 mg is geïndiceerd bij pediatrische patiënten vanaf de geboorte tot 17 jaar voor inhalatie-anthrax (post-expositie). De risico-batenbeoordeling geeft aan dat toediening van ciprofloxacine aan pediatrische patiënten geschikt is [zie: DOSERING EN ADMINISTRATIE en Klinische studies ].
Pest
CIPRO 500 mg is geïndiceerd bij pediatrische patiënten vanaf de geboorte tot 17 jaar, voor de behandeling van pest, inclusief longpest en septikemische pest veroorzaakt door Yersinia pestis (Y. pestis) en profylaxe voor pest. Werkzaamheidsstudies van CIPRO konden om haalbaarheidsredenen niet worden uitgevoerd bij mensen met longpest. Daarom was de goedkeuring van deze indicatie gebaseerd op een werkzaamheidsonderzoek bij dieren. De risico-batenbeoordeling geeft aan dat toediening van CIPRO aan pediatrische patiënten geschikt is [zie: AANWIJZINGEN EN GEBRUIK , DOSERING EN ADMINISTRATIE en Klinische studies ].
Geriatrisch gebruik
Geriatrische patiënten lopen een verhoogd risico op het ontwikkelen van ernstige peesaandoeningen, waaronder peesruptuur, wanneer ze worden behandeld met een fluorochinolon zoals CIPRO. Dit risico is verder verhoogd bij patiënten die gelijktijdig behandeld worden met corticosteroïden. Tendinitis of peesruptuur kan betrekking hebben op de achillespees, hand, schouder of andere peesplaatsen en kan optreden tijdens of na voltooiing van de therapie; gevallen die tot enkele maanden na de behandeling met fluorochinolonen optraden, zijn gemeld. Voorzichtigheid is geboden bij het voorschrijven van CIPRO 500 mg aan oudere patiënten, met name aan patiënten die corticosteroïden gebruiken. Patiënten moeten worden geïnformeerd over deze mogelijke bijwerking en geadviseerd worden om te stoppen met CIPRO 500 mg en contact op te nemen met hun zorgverlener als er symptomen van tendinitis of peesruptuur optreden [zie GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en ONGEWENSTE REACTIES ].
Epidemiologische onderzoeken rapporteren een verhoogd aantal aorta-aneurysma's en dissecties binnen twee maanden na gebruik van fluorochinolonen, vooral bij oudere patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In een retrospectieve analyse van 23 gecontroleerde klinische onderzoeken met meervoudige doses van CIPRO met meer dan 3500 met ciprofloxacine behandelde patiënten, was 25% van de patiënten ouder dan of gelijk aan 65 jaar en 10% was ouder dan of gelijk aan 75 jaar. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen voor een medicamenteuze behandeling kan niet worden uitgesloten. Van ciprofloxacine is bekend dat het grotendeels door de nieren wordt uitgescheiden, en het risico op bijwerkingen kan groter zijn bij patiënten met een verminderde nierfunctie. Bij patiënten ouder dan 65 jaar met een normale nierfunctie is geen dosisaanpassing nodig. Aangezien sommige oudere personen echter een verminderde nierfunctie ervaren als gevolg van hun hoge leeftijd, moet voorzichtigheid worden betracht bij het kiezen van de dosis voor oudere patiënten, en monitoring van de nierfunctie kan nuttig zijn bij deze patiënten [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Over het algemeen kunnen oudere patiënten gevoeliger zijn voor geneesmiddelgerelateerde effecten op het QT-interval. Daarom moeten voorzorgen worden genomen wanneer CIPRO 500 mg gelijktijdig wordt gebruikt met geneesmiddelen die kunnen leiden tot verlenging van het QT-interval (bijvoorbeeld klasse IA- of klasse III-antiaritmica) of bij patiënten met risicofactoren voor torsade de pointes (bijvoorbeeld bekende QT-verlenging). , ongecorrigeerde hypokaliëmie) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nierfunctiestoornis
Cipro 500 mgfloxacine wordt voornamelijk via de nieren uitgescheiden; het medicijn wordt echter ook gemetaboliseerd en gedeeltelijk geklaard via het galsysteem van de lever en via de darm. Deze alternatieve routes van geneesmiddeleliminatie lijken de verminderde renale excretie bij patiënten met nierinsufficiëntie te compenseren. Niettemin wordt enige aanpassing van de dosering aanbevolen, met name voor patiënten met ernstige nierfunctiestoornissen [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
In voorbereidende onderzoeken bij patiënten met stabiele chronische levercirrose zijn geen significante veranderingen in de farmacokinetiek van ciprofloxacine waargenomen. De farmacokinetiek van cipro 500 mgfloxacine bij patiënten met acute leverinsufficiëntie is niet onderzocht.
OVERDOSERING
In het geval van acute overdosering is in sommige gevallen reversibele niertoxiciteit gemeld. Leeg de maag door braken op te wekken of door maagspoeling. Observeer de patiënt zorgvuldig en geef een ondersteunende behandeling, inclusief controle van de nierfunctie, urine-pH en verzuring, indien nodig, om kristalurie te voorkomen en toediening van magnesium-, aluminium- of calciumbevattende antacida die de absorptie van cipro 750 mgfloxacine kunnen verminderen. Adequate hydratatie moet worden gehandhaafd. Slechts een kleine hoeveelheid cipro 250 mgfloxacine (minder dan 10%) wordt uit het lichaam verwijderd na hemodialyse of peritoneale dialyse.
CONTRA-INDICATIES
overgevoeligheid
CIPRO 1000 mg is gecontra-indiceerd bij personen met een voorgeschiedenis van overgevoeligheid voor cipro 750 mgfloxacine, een lid van de chinolonenklasse van antibacteriële middelen of een van de productcomponenten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Tizanidine
Gelijktijdige toediening met tizanidine is gecontra-indiceerd [zie: DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Ciprofloxacine is een lid van de klasse van antibacteriële middelen van de fluoroquinolonen [zie: Microbiologie ].
Farmacokinetiek
Absorptie
De absolute biologische beschikbaarheid van cipro 500 mgfloxacine bij toediening als orale tablet is ongeveer 70% zonder substantieel verlies door first-pass metabolisme. De maximale serumconcentraties van ciprofloxacine (Cmax) en de oppervlakte onder de curve (AUC) worden weergegeven in de grafiek voor het dosisbereik van 250 mg tot 1000 mg (tabel 12).
Maximale serumconcentraties worden 1 tot 2 uur na orale toediening bereikt. De gemiddelde concentraties 12 uur na toediening van 250, 500 of 750 mg zijn respectievelijk 0,1, 0,2 en 0,4 mcg/ml. De serumeliminatiehalfwaardetijd bij proefpersonen met een normale nierfunctie is ongeveer 4 uur. Serumconcentraties stijgen evenredig met doses tot 1000 mg.
Het is aangetoond dat een orale dosis van 500 mg die om de 12 uur wordt gegeven een AUC produceert die gelijk is aan die geproduceerd door een intraveneuze infusie van 400 mg CIPRO 1000 mg, gegeven gedurende 60 minuten om de 12 uur. Het is aangetoond dat een orale dosis van 750 mg die om de 12 uur wordt gegeven een AUC produceert bij steady-state die gelijk is aan die geproduceerd door een intraveneuze infusie van 400 mg toegediend gedurende 60 minuten om de 8 uur. Een orale dosis van 750 mg resulteert in een Cmax die vergelijkbaar is met die waargenomen bij een intraveneuze dosis van 400 mg (Tabel 13). Een orale dosis van 250 mg die om de 12 uur wordt gegeven, produceert een AUC die gelijk is aan die geproduceerd door een infusie van 200 mg CIPRO 1000 mg om de 12 uur.
Voedsel
Wanneer CIPRO-tablet gelijktijdig met voedsel wordt gegeven, is er een vertraging in de absorptie van het geneesmiddel, wat resulteert in piekconcentraties die dichter bij 2 uur na dosering optreden in plaats van 1 uur, terwijl er geen vertraging wordt waargenomen wanneer CIPRO 750 mg suspensie met voedsel wordt gegeven . De algehele absorptie van CIPRO 1000 mg tablet of CIPRO 500 mg suspensie wordt echter niet wezenlijk beïnvloed. De farmacokinetiek van cipro 750 mgfloxacine gegeven als suspensie wordt evenmin beïnvloed door voedsel. Vermijd gelijktijdige toediening van CIPRO met zuivelproducten (zoals melk of yoghurt) of alleen met calcium verrijkte sappen, aangezien verminderde absorptie mogelijk is; CIPRO 1000 mg kan echter worden ingenomen bij een maaltijd die deze producten bevat
Bij orale toediening is een dosis van 500 mg, gegeven als 10 ml van de 5% CIPRO-suspensie (die 250 mg ciprofloxacine/5 ml bevat), bio-equivalent aan de tablet van 500 mg. Een volume van 10 ml van de 5% CIPRO 1000 mg suspensie (met 250 mg ciprofloxacine/5 ml) is bio-equivalent aan een volume van 5 ml van de 10% CIPRO 750 mg suspensie (met 500 mg cipro 1000 mgfloxacine/5 ml).
Verdeling
De binding van ciprofloxacine aan serumeiwitten is 20% tot 40%, wat waarschijnlijk niet hoog genoeg is om significante eiwitbindingsinteracties met andere geneesmiddelen te veroorzaken.
Na orale toediening wordt cipro 250 mgfloxacine wijd verspreid door het lichaam. Weefselconcentraties overschrijden vaak de serumconcentraties bij zowel mannen als vrouwen, vooral in genitale weefsels, waaronder de prostaat. Ciprofloxacine is in actieve vorm aanwezig in speeksel, neus- en bronchiale secreties, slijmvliezen van de sinussen, sputum, huidblaarvloeistof, lymfe, peritoneale vloeistof, gal en prostaatsecreties. Cipro 500 mgfloxacine is ook aangetroffen in longen, huid, vet, spieren, kraakbeen en botten. Het medicijn diffundeert in de cerebrospinale vloeistof (CSF); de CSF-concentraties zijn echter over het algemeen minder dan 10% van de piekserumconcentraties. Lage niveaus van het geneesmiddel zijn gedetecteerd in de waterige en glasachtige lichaamsvochten van het oog.
Metabolisme
Er zijn vier metabolieten geïdentificeerd in menselijke urine die samen goed zijn voor ongeveer 15% van een orale dosis. De metabolieten hebben antimicrobiële activiteit, maar zijn minder actief dan onveranderd cipro 500 mgfloxacine. Cipro 500 mgfloxacine is een remmer van het door humaan cytochroom P450 1A2 (CYP1A2) gemedieerde metabolisme. Gelijktijdige toediening van ciprofloxacine met andere geneesmiddelen die voornamelijk door CYP1A2 worden gemetaboliseerd, leidt tot verhoogde plasmaconcentraties van deze geneesmiddelen en kan leiden tot klinisch significante bijwerkingen van het gelijktijdig toegediende geneesmiddel (zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ].
uitscheiding
De serumeliminatiehalfwaardetijd bij proefpersonen met een normale nierfunctie is ongeveer 4 uur. Ongeveer 40 tot 50% van een oraal toegediende dosis wordt onveranderd in de urine uitgescheiden. Na een orale dosis van 250 mg zijn de urineconcentraties van cipro 500 mgfloxacine gewoonlijk hoger dan 200 mcg/ml gedurende de eerste twee uur en zijn ze ongeveer 30 mcg/ml 8 tot 12 uur na toediening. De uitscheiding van ciprofloxacine via de urine is binnen 24 uur na toediening vrijwel voltooid. De renale klaring van cipro 250 mgfloxacine, die ongeveer 300 ml/minuut is, overschrijdt de normale glomerulaire filtratiesnelheid van 120 ml/minuut. Actieve tubulaire secretie lijkt dus een belangrijke rol te spelen bij de eliminatie ervan. Gelijktijdige toediening van probenecide met ciprofloxacine resulteert in een verlaging van de renale klaring van ciprofloxacine met ongeveer 50% en een verhoging van de concentratie in de systemische circulatie met 50%.
Hoewel de galconcentraties van cipro 250 mgfloxacine enkele malen hoger zijn dan de serumconcentraties na orale toediening, wordt slechts een kleine hoeveelheid van de toegediende dosis als onveranderd geneesmiddel uit de gal teruggevonden. Nog eens 1% tot 2% van de dosis wordt teruggewonnen uit de gal in de vorm van metabolieten. Ongeveer 20% tot 35% van een orale dosis wordt binnen 5 dagen na toediening uit de ontlasting teruggevonden. Dit kan het gevolg zijn van biliaire klaring of trans-intestinale eliminatie.
Specifieke populaties
Ouderen
Farmacokinetische studies van de orale (enkele dosis) en intraveneuze (enkele en meervoudige dosis) vormen van cipro 250 mgfloxacine geven aan dat de plasmaconcentraties van ciprofloxacine hoger zijn bij oudere proefpersonen (ouder dan 65 jaar) in vergelijking met jonge volwassenen. Hoewel de Cmax met 16% tot 40% is verhoogd, is de stijging van de gemiddelde AUC ongeveer 30% en kan deze ten minste gedeeltelijk worden toegeschreven aan een verminderde nierklaring bij ouderen. De eliminatiehalfwaardetijd is bij ouderen slechts licht (~ 20%) verlengd. Deze verschillen worden niet als klinisch significant beschouwd [zie Gebruik bij specifieke populaties ].
Nierfunctiestoornis
Bij patiënten met een verminderde nierfunctie is de halfwaardetijd van ciprofloxacine enigszins verlengd. Dosisaanpassingen kunnen nodig zijn [zie Gebruik bij specifieke populaties en DOSERING EN ADMINISTRATIE ].
Leverfunctiestoornis
In voorbereidende onderzoeken bij patiënten met stabiele chronische levercirrose zijn geen significante veranderingen in de farmacokinetiek van ciprofloxacine waargenomen. De kinetiek van cipro 750 mgfloxacine bij patiënten met acute leverinsufficiëntie is niet volledig onderzocht.
Kindergeneeskunde
Tabel 14 geeft een overzicht van de farmacokinetische parameters bij pediatrische patiënten in de leeftijd van 1 tot 12 jaar die een intraveneuze behandeling ondergaan.
Deze waarden vallen binnen het bereik dat is gerapporteerd voor volwassenen bij therapeutische doses. Gebaseerd op populatiefarmacokinetische analyse van pediatrische patiënten met verschillende infecties, is de voorspelde gemiddelde halfwaardetijd bij kinderen ongeveer 4 uur – 5 uur, en de biologische beschikbaarheid van de orale suspensie is ongeveer 60%.
Geneesmiddel-geneesmiddelinteracties
Antacida
Gelijktijdige toediening van antacida die magnesiumhydroxide of aluminiumhydroxide bevatten, kan de biologische beschikbaarheid van cipro 500 mgfloxacine met wel 90% verminderen [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
Histamine H2-receptorantagonisten
Histamine-H2-receptorantagonisten lijken geen significant effect te hebben op de biologische beschikbaarheid van cipro 250 mgfloxacine.
Metronidazol
De serumconcentraties van ciprofloxacine en metronidazol veranderden niet wanneer deze twee geneesmiddelen gelijktijdig werden gegeven.
Tizanidine
In een farmacokinetische studie was de systemische blootstelling aan tizanidine (4 mg enkelvoudige dosis) significant verhoogd (Cmax 7-voudig, AUC 10-voudig) wanneer het geneesmiddel gelijktijdig werd gegeven met CIPRO (500 mg tweemaal daags gedurende 3 dagen). Gelijktijdige toediening van tizanidine en CIPRO is gecontra-indiceerd vanwege de versterking van de hypotensieve en sedatieve effecten van tizanidine (zie CONTRA-INDICATIES ].
Ropinirol
In een studie uitgevoerd bij 12 patiënten met de ziekte van Parkinson die eenmaal daags 6 mg ropinirol kregen toegediend met tweemaal daags 500 mg CIPRO 250 mg, waren de gemiddelde Cmax en de gemiddelde AUC van ropinirol verhoogd met respectievelijk 60% en 84%. Controle op aan ropinirol gerelateerde bijwerkingen en geschikte dosisaanpassing van ropinirol wordt aanbevolen tijdens en kort na gelijktijdige toediening met CIPRO [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clozapine
Na gelijktijdige toediening van 250 mg CIPRO 500 mg met 304 mg clozapine gedurende 7 dagen, waren de serumconcentraties van clozapine en N-desmethylclozapine verhoogd met respectievelijk 29% en 31%. Zorgvuldige monitoring van clozapine-gerelateerde bijwerkingen en passende aanpassing van de clozapinedosering tijdens en kort na gelijktijdige toediening met CIPRO worden geadviseerd.
Sildenafil
Na gelijktijdige toediening van een enkelvoudige orale dosis van 50 mg sildenafil met 500 mg CIPRO 1000 mg aan gezonde proefpersonen, waren de gemiddelde Cmax en de gemiddelde AUC van sildenafil beide ongeveer tweevoudig verhoogd. Wees voorzichtig bij het gebruik van sildenafil bij gelijktijdige toediening met CIPRO 500 mg vanwege de verwachte tweevoudige toename van de blootstelling aan sildenafil bij gelijktijdige toediening van CIPRO.
duloxetine
In klinische onderzoeken is aangetoond dat gelijktijdig gebruik van duloxetine met sterke remmers van het CYP450 1A2-isozym zoals fluvoxamine kan resulteren in een 5-voudige toename van de gemiddelde AUC en een 2,5-voudige toename van de gemiddelde Cmax van duloxetine.
lidocaïne
In een onderzoek bij 9 gezonde vrijwilligers resulteerde gelijktijdig gebruik van 1,5 mg/kg IV lidocaïne met CIPRO 500 mg tweemaal daags in een verhoging van lidocaïne Cmax en AUC met respectievelijk 12% en 26%. Hoewel behandeling met lidocaïne bij deze verhoogde blootstelling goed werd verdragen, kan bij gelijktijdige toediening een mogelijke interactie met CIPRO en een toename van bijwerkingen gerelateerd aan lidocaïne optreden.
Metoclopramide
Metoclopramide versnelt de absorptie van oraal cipro 750 mgfloxacine aanzienlijk, wat resulteert in een kortere tijd om maximale plasmaconcentraties te bereiken. Er werd geen significant effect waargenomen op de biologische beschikbaarheid van ciprofloxacine.
Omeprazol
Wanneer CIPRO als een enkelvoudige dosis van 1000 mg gelijktijdig met omeprazol (40 mg eenmaal daags gedurende drie dagen) werd toegediend aan 18 gezonde vrijwilligers, werden de gemiddelde AUC en Cmax van ciprofloxacine verminderd met respectievelijk 20% en 23%. De klinische betekenis van deze interactie is niet vastgesteld.
Microbiologie
Werkingsmechanisme
De bactericide werking van cipro 750 mgfloxacine is het gevolg van remming van de enzymen topo-isomerase II (DNA-gyrase) en topo-isomerase IV (beide type II-topoisomerasen), die nodig zijn voor bacteriële DNA-replicatie, transcriptie, reparatie en recombinatie.
Mechanisme van weerstand
Het werkingsmechanisme van fluorochinolonen, waaronder ciprofloxacine, verschilt van dat van penicillines, cefalosporines, aminoglycosiden, macroliden en tetracyclines; daarom kunnen micro-organismen die resistent zijn tegen deze klassen van geneesmiddelen gevoelig zijn voor ciprofloxacine. Resistentie tegen fluoroquinolonen treedt voornamelijk op door ofwel mutaties in de DNA-gyrasen, verminderde permeabiliteit van de buitenmembraan of geneesmiddelefflux. In vitro resistentie tegen ciprofloxacine ontwikkelt zich langzaam door meerstapsmutaties. Resistentie tegen ciprofloxacine als gevolg van spontane mutaties komt voor met een algemene frequentie van
Dwarsweerstand
Er is geen kruisresistentie bekend tussen cipro 1000 mgfloxacine en andere klassen van antimicrobiële middelen.
Van ciprofloxacine is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK ].
Gram-positieve bacteriën
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (alleen methicilline-gevoelige isolaten) Staphylococcus epidermidis (alleen methicilline-gevoelige isolaten) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatieve bacteriën
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Ten minste 90 procent van de volgende bacteriën vertoont een in vitro minimale remmende concentratie (MIC) die lager is dan of gelijk is aan het gevoelige breekpunt voor cipro 750 mgfloxacine tegen isolaten van een vergelijkbaar geslacht of een vergelijkbare groep organismen. De werkzaamheid van cipro 500 mgfloxacine bij de behandeling van klinische infecties veroorzaakt door deze bacteriën is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Staphylococcus haemolyticus (alleen meticilline-gevoelige isolaten) Staphylococcus hominis (alleen methicilline-gevoelige isolaten)
Gram-negatieve bacteriën
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Klinische studies
Gecompliceerde urineweginfectie en pyelonefritis - werkzaamheid bij pediatrische patiënten
CIPRO, intraveneus en/of oraal toegediend, werd vergeleken met een cefalosporine voor de behandeling van cUTI en pyelonefritis bij pediatrische patiënten van 1 tot 17 jaar (gemiddelde leeftijd van 6 ± 4 jaar). De proef werd uitgevoerd in de VS, Canada, Argentinië, Peru, Costa Rica, Mexico, Zuid-Afrika en Duitsland. De duur van de behandeling was 10 tot 21 dagen (gemiddelde duur van de behandeling was 11 dagen met een spreiding van 1 tot 88 dagen). Het primaire doel van de studie was om de musculoskeletale en neurologische veiligheid te beoordelen.
Patiënten werden beoordeeld op klinisch succes en bacteriologische uitroeiing van het/de basisorganisme(n) zonder nieuwe infectie of superinfectie op 5 tot 9 dagen na de therapie (Test of Cure of TOC). De Per Protocol-populatie had een veroorzakende organisme(n) met in het protocol gespecificeerde kolonietelling(en) bij aanvang, geen schending van het protocol en geen voortijdige stopzetting of verlies voor follow-up (naast andere criteria).
Het klinische succes en de bacteriologische uitroeiingspercentages in de Per Protocol-populatie waren vergelijkbaar tussen CIPRO 250 mg en de vergelijkingsgroep, zoals hieronder weergegeven.
Inhalatiemiltvuur bij volwassenen en pediatrie
De gemiddelde serumconcentraties van ciprofloxacine geassocieerd met een statistisch significante verbetering van de overleving in het resusapenmodel van inhalatieantrax worden bereikt of overschreden bij volwassen en pediatrische patiënten die orale en intraveneuze behandelingen krijgen. De farmacokinetiek van Cipro 500 mgfloxacine is geëvalueerd bij verschillende menselijke populaties. De gemiddelde piekserumconcentratie die bij steady-state wordt bereikt bij volwassenen die 500 mg oraal om de 12 uur krijgen, is 2,97 mcg/ml en 4,56 mcg/ml na 400 mg intraveneus om de 12 uur. De gemiddelde dalserumconcentratie bij steady-state voor beide regimes is 0,2 mcg/ml. In een onderzoek bij 10 pediatrische patiënten tussen 6 en 16 jaar oud is de gemiddelde piekplasmaconcentratie die wordt bereikt 8,3 mcg/ml en de dalconcentraties variëren van 0,09 mcg/ml tot 0,26 mcg/ml, na twee 30 minuten durende intraveneuze infusies van 10 mg/kg toegediend met een tussenpoos van 12 uur. Na de tweede intraveneuze infusie bereikten patiënten die om de 12 uur werden overgeschakeld op 15 mg/kg oraal een gemiddelde piekconcentratie van 3,6 mcg/ml na de initiële orale dosis. Gegevens over de veiligheid op lange termijn, waaronder effecten op kraakbeen, na toediening van CIPRO aan pediatrische patiënten zijn beperkt. Cipro 1000 mgfloxacine-serumconcentraties die bij mensen zijn bereikt, dienen als een surrogaateindpunt dat redelijkerwijs klinisch voordeel kan voorspellen en vormen de basis voor deze indicatie.1
Er werd een placebogecontroleerd dieronderzoek uitgevoerd bij resusapen die waren blootgesteld aan een geïnhaleerde gemiddelde dosis van 11 LD50 (~5,5 x 105 sporen (bereik 5-30 LD50) van B. anthracis. De minimale remmende concentratie (MIC) van cipro 250 mgfloxacine voor de anthrax-stam die in dit onderzoek werd gebruikt, was 0,08 mcg/ml. Bij de onderzochte dieren varieerden de gemiddelde serumconcentraties van cipro 1000 mgfloxacine die werden bereikt bij de verwachte Tmax (1 uur na toediening) na orale toediening tot steady-state van 0,98 mcg/ml tot 1,69 mcg/ml Gemiddelde steady-state dalconcentraties 12 uur na de dosis varieerden van 0,12 mcg/ml tot 0,19 mcg/ml. - de blootstelling was significant lager (1/9), vergeleken met de placebogroep (9/10) [p=0,001] Het ene met CIPRO behandelde dier dat stierf aan miltvuur deed dit na de 30 dagen durende toedieningsperiode van het geneesmiddel.7
Aan meer dan 9300 personen werd aanbevolen om in 2001 minimaal 60 dagen antibacteriële profylaxe te ondergaan tegen mogelijke inhalatieblootstelling aan B. anthracis. Aan de meeste van deze personen werd 250 mg CIPRO aanbevolen voor het gehele of een deel van het profylaxeregime. Sommige personen kregen ook miltvuurvaccin of werden overgeschakeld op alternatieve antibacteriële geneesmiddelen. Niemand die CIPRO 1000 mg of andere therapieën als profylactische behandeling ontving, ontwikkelde vervolgens inhalatie-anthrax. Het aantal personen dat CIPRO ontving als geheel of gedeeltelijk van hun post-expositie profylaxe is niet bekend.
Pest
Er werd een placebogecontroleerd dieronderzoek uitgevoerd bij Afrikaanse groene apen die waren blootgesteld aan een geïnhaleerde gemiddelde dosis van 110 LD50 (bereik 92 tot 127 LD50) van Yersinia pestis (CO92-stam). De minimale remmende concentratie (MIC) van ciprofloxacine voor de Y. pestis-stam die in dit onderzoek werd gebruikt, was 0,015 mcg/ml. De gemiddelde piekserumconcentraties van ciprofloxacine die werden bereikt aan het einde van een enkelvoudige infusie van 60 minuten waren 3,49 ± mcg/ml 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml en 4,03 mcg/ml ± 1,22 mcg/ml op dag 2, Dag 6 en dag 10 van de behandeling bij Afrikaanse groene apen, respectievelijk. Alle dalconcentraties (dag 2, dag 6 en dag 10) waren
Dierlijke toxicologie en/of farmacologie
Van Cipro 250 mgfloxacine en andere chinolonen is aangetoond dat ze artropathie veroorzaken bij onvolgroeide dieren van de meeste geteste soorten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Beschadiging van gewichtdragende gewrichten werd waargenomen bij jonge honden en ratten. Bij jonge beagles veroorzaakte 100 mg/kg ciprofloxacine, dagelijks gegeven gedurende 4 weken, degeneratieve gewrichtsveranderingen van het kniegewricht. Bij 30 mg/kg was het effect op het gewricht minimaal. In een daaropvolgend onderzoek bij jonge beaglehonden veroorzaakten orale doses cipro 750 mgfloxacine van 30 mg/kg en 90 mg/kg cipro 750 mgfloxacine (ongeveer 1,3 maal en 3,5 maal de pediatrische dosis op basis van vergelijkende plasma-AUC's) die gedurende 2 weken dagelijks werden gegeven veranderingen die histopathologisch nog steeds werden waargenomen na een behandelingsvrije periode van 5 maanden. Bij 10 mg/kg (ongeveer 0,6 maal de pediatrische dosis op basis van vergelijkende plasma-AUC's) werden geen effecten op de gewrichten waargenomen. Deze dosis was ook niet geassocieerd met artrotoxiciteit na een aanvullende behandelingsvrije periode van 5 maanden. In een ander onderzoek verminderde het verwijderen van het gewicht uit het gewricht de laesies, maar verhinderde ze niet volledig.
Kristalurie, soms geassocieerd met secundaire nefropathie, komt voor bij laboratoriumdieren die ciprofloxacine kregen toegediend. Dit houdt voornamelijk verband met de verminderde oplosbaarheid van ciprofloxacine onder alkalische omstandigheden, die vooral voorkomt in de urine van proefdieren; bij de mens is kristalurie zeldzaam omdat menselijke urine typisch zuur is. Bij resusapen werd kristalurie zonder nefropathie waargenomen na enkelvoudige orale doses van slechts 5 mg/kg. (ongeveer 0,07 keer de hoogste aanbevolen therapeutische dosis op basis van lichaamsoppervlak). Na 6 maanden intraveneuze toediening van 10 mg/kg/dag werden geen nefropathologische veranderingen waargenomen; er werd echter nefropathie waargenomen na dosering van 20 mg/kg/dag voor dezelfde duur (ongeveer 0,2 maal de hoogste aanbevolen therapeutische dosis op basis van lichaamsoppervlak).
Bij honden veroorzaakt ciprofloxacine bij 3 mg/kg en 10 mg/kg door snelle intraveneuze injectie (15 sec.) uitgesproken hypotensieve effecten. Deze effecten worden geacht verband te houden met de afgifte van histamine, aangezien ze gedeeltelijk worden tegengewerkt door pyrilamine, een antihistaminicum. Bij resusapen veroorzaakt snelle intraveneuze injectie ook hypotensie, maar het effect bij deze soort is inconsistent en minder uitgesproken.
Bij muizen is gemeld dat gelijktijdige toediening van niet-steroïde anti-inflammatoire geneesmiddelen zoals fenylbutazon en indomethacine met chinolonen het CZS-stimulerende effect van chinolonen versterkt.
Oculaire toxiciteit die is waargenomen bij sommige verwante geneesmiddelen is niet waargenomen bij met ciprofloxacine behandelde dieren
REFERENTIES
1. 21 CFR 314.510 (Subdeel H-Versnelde goedkeuring van nieuwe geneesmiddelen voor levensbedreigende ziekten).
5. Rapport gepresenteerd op de vergadering van de Raadgevend Comité voor anti-infectieuze geneesmiddelen en dermatologische geneesmiddelen van de FDA, 31 maart 1993, Silver Spring, MD. Rapport verkrijgbaar bij FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, VS.
6. Kelly DJ, et al. Serumconcentraties van penicilline, doxycycline en ciprofloxacine tijdens langdurige therapie bij resusapen. J Infect Dis 1992; 166: 1184-7.
7. Friedlander AM, et al. Profylaxe na blootstelling tegen experimentele inhalatie-anthrax. J Infect Dis 1993; 167:1239-42.
8. Vergadering van het Adviescomité voor infectieuze geneesmiddelen, 3 april 2012 - De werkzaamheid van ciprofloxacine voor de behandeling van longpest.
PATIËNT INFORMATIE
CIPRO® (Sip-rij) (ciprofloxacine hydrochloride) tabletten, voor oraal gebruik
CIPRO® (Sip-rij) (cipro 1000 mgfloxacine) voor orale suspensie
Lees deze medicatiehandleiding voordat u begint met het innemen van CIPRO 500 mg en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
Wat is de belangrijkste informatie die ik moet weten over CIPRO 500 mg?
CIPRO, een fluoroquinolon antibacterieel geneesmiddel, kan ernstige bijwerkingen veroorzaken. Sommige van deze ernstige bijwerkingen kunnen tegelijkertijd optreden en kunnen de dood tot gevolg hebben.
Als u een van de volgende ernstige bijwerkingen krijgt terwijl u CIPRO gebruikt, moet u onmiddellijk stoppen met het gebruik van CIPRO 750 mg en onmiddellijk medische hulp inroepen.
1. Peesruptuur of zwelling van de pees (tendinitis).
- Peesproblemen kunnen optreden bij mensen van alle leeftijden die CIPRO gebruiken. Pezen zijn taaie weefselkoorden die spieren met botten verbinden. Symptomen van peesproblemen kunnen zijn:
- pijn
- zwelling
- tranen en zwelling van de pezen, inclusief de achterkant van de enkel (achillespees), schouder, hand, duim of andere peesplaatsen.
- Het risico op het krijgen van peesproblemen terwijl u CIPRO gebruikt, is groter als u:
- ouder zijn dan 60 jaar
- steroïden gebruikt (corticosteroïden)
- een nier-, hart- of longtransplantatie heeft ondergaan.
- Peesproblemen kunnen optreden bij mensen die de bovenstaande risicofactoren niet hebben als ze CIPRO gebruiken.
- Andere redenen die uw risico op peesproblemen kunnen vergroten, kunnen zijn:
- lichamelijke activiteit of lichaamsbeweging
- nierfalen
- peesproblemen in het verleden, zoals bij mensen met reumatoïde artritis (RA).
- Stop onmiddellijk met het gebruik van CIPRO en zoek onmiddellijk medische hulp bij het eerste teken van peespijn, zwelling of ontsteking. Het meest voorkomende gebied van pijn en zwelling is de achillespees aan de achterkant van uw enkel. Dit kan ook gebeuren met andere pezen.
- Peesruptuur kan optreden terwijl u CIPRO gebruikt of nadat u klaar bent met het innemen van CIPRO. Peesrupturen kunnen optreden binnen enkele uren of dagen na inname van CIPRO en zijn opgetreden tot enkele maanden nadat mensen klaar zijn met het innemen van hun fluorochinolon.
- Stop onmiddellijk met het innemen van CIPRO 500 mg en zoek onmiddellijk medische hulp als u een van de volgende tekenen of symptomen van een peesruptuur krijgt:
- hoor of voel een klik of knal in een peesgebied
- blauwe plekken direct na een blessure in een peesgebied
- niet in staat om het getroffen gebied te verplaatsen of gewicht te dragen
De peesproblemen kunnen permanent zijn.
2. Veranderingen in gevoel en mogelijke zenuwbeschadiging (perifere neuropathie). Schade aan de zenuwen in armen, handen, benen of voeten kan optreden bij mensen die fluoroquinolonen gebruiken, waaronder CIPRO. Stop onmiddellijk met het innemen van CIPRO 750 mg en neem onmiddellijk contact op met uw zorgverlener als u een van de volgende symptomen van perifere neuropathie in uw armen, handen, benen of voeten krijgt:
- pijn
- doof gevoel
- brandend
- zwakheid
- tintelingen
CIPRO 500 mg moet mogelijk worden gestopt om permanente zenuwbeschadiging te voorkomen.
3. Effecten op het centrale zenuwstelsel (CZS). Geestelijke gezondheidsproblemen en epileptische aanvallen zijn gemeld bij mensen die antibacteriële geneesmiddelen met fluorochinolon gebruiken, waaronder CIPRO. Vertel het uw zorgverlener als u in het verleden epileptische aanvallen heeft gehad voordat u begint met het gebruik van CIPRO. CZS-bijwerkingen kunnen optreden zodra de eerste dosis CIPRO is ingenomen. Stop onmiddellijk met het gebruik van CIPRO en neem onmiddellijk contact op met uw zorgverlener als u een van deze bijwerkingen of andere veranderingen in stemming of gedrag krijgt:
- toevallen
- Moeite met slapen
- stemmen horen, dingen zien of dingen voelen die er niet zijn (hallucinaties)
- nachtmerries
- zich licht in het hoofd of duizelig voelen
- voel je geagiteerd
- meer achterdochtig voelen (paranoia)
- trillingen
- zelfmoordgedachten of -handelingen
- zich angstig of nerveus voelen
- hoofdpijn die niet weggaat, met of zonder
- verwarring wazig zien
- depressie
- geheugenproblemen
- verminderd bewustzijn van de omgeving
- valse of vreemde gedachten of overtuigingen (wanen)
Deze wijzigingen kunnen permanent zijn.
4. Verergering van myasthenia gravis (een probleem dat spierzwakte veroorzaakt). Fluoroquinolonen zoals CIPRO 500 mg kunnen de symptomen van myasthenia gravis verergeren, waaronder spierzwakte en ademhalingsproblemen. Vertel het uw zorgverlener als u in het verleden myasthenia gravis heeft gehad voordat u CIPRO gaat gebruiken. Bel onmiddellijk uw zorgverlener als u verergerende spierzwakte of ademhalingsproblemen heeft.
Wat is CIPRO 750 mg?
CIPRO is een fluorochinolon antibacterieel geneesmiddel dat bij volwassenen van 18 jaar en ouder wordt gebruikt voor de behandeling van bepaalde infecties die worden veroorzaakt door bepaalde ziektekiemen die bacteriën worden genoemd. Deze bacteriële infecties omvatten:
-
- urineweginfectie
- bot- en gewrichtsinfectie
- cervicale en urethrale gonorroe, ongecompliceerd
- chronische prostaatinfectie
- nosocomiale longontsteking
- mensen met een laag aantal witte bloedcellen en koorts
- lagere luchtweginfectie
- intra-abdominale infectie, gecompliceerd
- inhalatie miltvuur
- sinus infectie
- besmettelijke diarree
- pest
- huidinfectie
- tyfus (enterische) koorts
- Studies van CIPRO 1000 mg voor gebruik bij de behandeling van pest en miltvuur werden alleen bij dieren gedaan, omdat pest en miltvuur niet bij mensen konden worden onderzocht.
- CIPRO 250 mg mag niet worden gebruikt bij mensen met acute exacerbatie van chronische bronchitis, acute ongecompliceerde cystitis en sinusitis, als er andere behandelingsopties beschikbaar zijn.
- CIPRO 750 mg mag niet worden gebruikt als eerste keus van antibacteriële geneesmiddelen voor de behandeling van lagere luchtweginfecties veroorzaakt door een bepaald type bacterie, Streptococcus pneumoniae genaamd.
- CIPRO 1000 mg wordt ook gebruikt bij kinderen jonger dan 18 jaar voor de behandeling van gecompliceerde urineweg- en nierinfecties of die miltvuurbacteriën hebben ingeademd, een pest hebben of zijn blootgesteld aan pestbacteriën.
- Kinderen jonger dan 18 jaar hebben een grotere kans op bot-, gewrichts- of peesproblemen (musculoskeletale) zoals pijn of zwelling tijdens het gebruik van CIPRO. CIPRO 500 mg mag niet worden gebruikt als eerste keus van antibacteriële geneesmiddelen bij kinderen jonger dan 18 jaar.
Wie mag CIPRO 1000 mg niet gebruiken?
Gebruik CIPRO 500 mg niet als u:
- ooit een ernstige allergische reactie heeft gehad op een antibacterieel geneesmiddel dat bekend staat als fluoroquinolon, of allergisch bent voor cipro 500 mgfloxacinehydrochloride of voor een van de bestanddelen van CIPRO. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in CIPRO.
- neem ook een geneesmiddel genaamd tizanidine (Zanaflex®). Vraag uw zorgverlener als u het niet zeker weet.
Wat moet ik mijn zorgverlener vertellen voordat ik CIPRO inneem?
Vertel uw zorgverlener over al uw medische aandoeningen voordat u CIPRO gebruikt, ook als u:
- peesproblemen hebben. CIPRO mag niet worden gebruikt bij mensen met een voorgeschiedenis van peesproblemen.
- een ziekte heeft die spierzwakte veroorzaakt (myasthenia gravis). CIPRO mag niet worden gebruikt bij mensen met een bekende voorgeschiedenis van myasthenia gravis.
- leverproblemen hebben.
- problemen met het centrale zenuwstelsel heeft (zoals epilepsie).
- zenuwproblemen hebben. CIPRO 500 mg mag niet worden gebruikt bij mensen die een voorgeschiedenis hebben van een zenuwprobleem dat perifere neuropathie wordt genoemd, of iemand in uw familie heeft een onregelmatige hartslag of een hartaanval, met name een aandoening die 'QT-verlenging' wordt genoemd.
- een laag kaliumgehalte in het bloed (hypokaliëmie) of een laag magnesiumgehalte (hypomagnesiëmie) heeft.
- epileptische aanvallen heeft of heeft gehad.
- nierproblemen hebben. U heeft mogelijk een lagere dosis CIPRO 500 mg nodig als uw nieren niet goed werken.
- diabetes heeft of problemen heeft met een lage bloedsuikerspiegel (hypoglykemie).
- gewrichtsproblemen heeft, waaronder reumatoïde artritis (RA).
- moeite hebben met het slikken van pillen.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of CIPRO 250 mg schadelijk is voor uw ongeboren baby.
- borstvoeding geeft of van plan bent borstvoeding te geven. CIPRO 250 mg gaat over in uw moedermelk.
- U mag geen borstvoeding geven tijdens de behandeling met CIPRO 500 mg en gedurende 2 dagen na inname van uw laatste dosis CIPRO. U mag uw moedermelk afkolven en weggooien tijdens de behandeling met CIPRO en gedurende 2 dagen na het innemen van uw laatste dosis CIPRO.
- Als u CIPRO gebruikt voor inhalatiemiltvuur, moeten u en uw zorgverlener beslissen of u borstvoeding kunt blijven geven terwijl u CIPRO gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
- CIPRO 1000 mg en andere geneesmiddelen kunnen elkaar beïnvloeden en bijwerkingen veroorzaken.
- Vertel het uw zorgverlener vooral als u:
- een steroïde medicijn.
- een antipsychoticum.
- een tricyclisch antidepressivum.
- een waterpil (diureticum).
- theofylline (zoals Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- een geneesmiddel om uw hartslag of ritme onder controle te houden (antiaritmica).
- een oraal middel tegen diabetes.
- fenytoïne (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- cyclosporine (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- een bloedverdunner (zoals warfarine, Coumadin®, Jantoven®).
- methotrexaat (Trexall®).
- ropinirol (Requip®).
- clozapine (Clozaril®, Fazaclo® ODT®).
- een niet-steroïde anti-inflammatoir geneesmiddel (NSAID). Veel voorkomende medicijnen voor pijnverlichting zijn NSAID's. Het gebruik van een NSAID terwijl u CIPRO 500 mg of andere fluorochinolonen gebruikt, kan uw risico op effecten op het centrale zenuwstelsel en epileptische aanvallen verhogen.
- sildenafil (Viagra®, Revatio®).
- duloxetine.
- producten die cafeïne bevatten.
- probenecide (Probalan®, Col-probenecide®).
- Bepaalde geneesmiddelen kunnen ervoor zorgen dat CIPRO-tabletten en CIPRO orale suspensie niet correct werken. Neem CIPRO-tabletten en orale suspensie 2 uur vóór of 6 uur na inname van deze geneesmiddelen, vitamines of supplementen:
- een antacidum, multivitamine of ander geneesmiddel of supplementen met magnesium, calcium, aluminium, ijzer of zink.
- sucralfaat (Carafate®).
- didanosine (Videx®, Videx EC®).
Vraag uw zorgverlener om een lijst van deze geneesmiddelen als u het niet zeker weet.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik CIPRO 500 mg innemen?
- Neem CIPRO precies zoals uw zorgverlener u zegt dat u het moet innemen.
- Uw zorgverlener zal u vertellen hoeveel CIPRO u moet innemen en wanneer u het moet innemen.
- CIPRO kan met of zonder voedsel worden ingenomen.
- CIPRO mag niet alleen worden ingenomen met zuivelproducten (zoals melk of yoghurt) of met calcium verrijkte sappen, maar kan worden ingenomen bij een maaltijd die deze producten bevat.
- Drink veel vocht tijdens het gebruik van CIPRO.
- Sla geen enkele dosis CIPRO over en stop niet met het innemen ervan, zelfs niet als u zich beter begint te voelen, totdat u klaar bent met uw voorgeschreven behandeling, tenzij:
- je hebt peesproblemen. Zien “Wat is de belangrijkste informatie die ik over CIPRO moet weten?”
- u zenuwproblemen heeft. Zien “Wat is de belangrijkste informatie die ik over CIPRO moet weten?”
- u heeft problemen met het centrale zenuwstelsel. Zien “Wat is de belangrijkste informatie die ik moet weten over CIPRO 1000 mg?”
- u een ernstige allergische reactie heeft. Zien "Wat zijn de mogelijke bijwerkingen van CIPRO 750 mg?"
- uw zorgverlener zegt dat u moet stoppen met het gebruik van CIPRO.
Als u al uw CIPRO-doses neemt, zorgt u ervoor dat alle bacteriën worden gedood. Door al uw CIPRO-doses in te nemen, wordt de kans kleiner dat de bacteriën resistent worden tegen CIPRO. Als u resistent wordt tegen CIPRO, is het mogelijk dat CIPRO 1000 mg en andere antibacteriële geneesmiddelen in de toekomst niet meer voor u werken.
-
Als u te veel CIPRO 750 mg heeft ingenomen, neem dan direct contact op met uw zorgverlener of roep medische hulp in.
-
CIPRO wordt geleverd als een tablet met breukgleuf (CIPRO 1000 mg tabletten), orale suspensie (CIPRO 750 mg orale suspensie), tablet met verlengde afgifte (CIPRO XR) en injectie voor intraveneuze infusie (CIPRO IV). Lees en volg onderstaande instructies voor het type CIPRO 500 mg dat uw zorgverlener u heeft voorgeschreven.
CIPRO-tabletten:
- CIPRO-tabletten worden geleverd als tabletten met een breukstreep van 250 mg en 500 mg die in hun geheel kunnen worden ingenomen of doormidden kunnen worden gebroken bij de breukstreep. Uw zorgverlener zal u vertellen hoeveel CIPRO 500 mg tabletten u moet innemen en of u CIPRO 1000 mg tabletten doormidden moet breken om uw voorgeschreven dosis te krijgen.
- Neem CIPRO-tabletten 's morgens en' s avonds elke dag op ongeveer hetzelfde tijdstip in. De tablet niet pletten of erop kauwen. Vertel het uw zorgverlener als u de tablet niet kunt doorslikken.
- Als u een dosis CIPRO 500 mg tabletten overslaat en het is:
- 6 uur of meer tot uw volgende geplande dosis, neem uw gemiste dosis dan meteen in. Neem vervolgens de volgende dosis op uw normale tijdstip.
- minder dan 6 uur Neem de gemiste dosis niet in tot uw volgende geplande dosis. Neem de volgende dosis op uw normale tijd.
- Neem geen 2 doses CIPRO 750 mg tabletten tegelijk in om een vergeten dosis in te halen. Als u niet zeker weet wanneer u CIPRO 500 mg tabletten moet innemen na een vergeten dosis, vraag dan uw arts of apotheker om advies.
CIPRO orale suspensie:
- Neem CIPRO 1000 mg orale suspensie 's morgens en' s avonds elke dag op ongeveer hetzelfde tijdstip in. Schud de fles CIPRO 750 mg orale suspensie elke keer goed voor gebruik gedurende ongeveer 15 seconden om er zeker van te zijn dat de suspensie goed gemengd is. Sluit de fles na gebruik volledig af.
- Als u een dosis CIPRO orale suspensie bent vergeten en het is:
- 6 uur of meer tot uw volgende geplande dosis, neem uw gemiste dosis dan meteen in. Neem vervolgens de volgende dosis op uw normale tijdstip.
- minder dan 6 uur Neem de gemiste dosis niet in tot uw volgende geplande dosis. Neem de volgende dosis op uw normale tijd.
- Neem geen 2 doses CIPRO 750 mg orale suspensie tegelijk in om een vergeten dosis in te halen. Als u niet zeker weet wanneer u CIPRO orale suspensie moet innemen na een vergeten dosis, vraag dan uw arts of apotheker om advies.
Wat moet ik vermijden tijdens het gebruik van CIPRO?
- CIPRO 250 mg kan u duizelig en licht in het hoofd maken. Rijd niet, bedien geen machines of voer geen andere activiteiten uit die mentale alertheid of coördinatie vereisen totdat u weet welke invloed CIPRO 250 mg op u heeft.
- Vermijd zonnelampen, zonnebanken en probeer uw tijd in de zon te beperken. CIPRO 500 mg kan uw huid gevoelig maken voor de zon (lichtgevoeligheid) en het licht van zonnelampen en zonnebanken. U kunt ernstige zonnebrand, blaren of zwelling van uw huid krijgen. Als u een van deze symptomen krijgt terwijl u CIPRO 250 mg gebruikt, neem dan onmiddellijk contact op met uw zorgverlener. U moet een zonnebrandcrème gebruiken en een hoed en kleding dragen die uw huid bedekken als u in de zon moet zijn.
Wat zijn de mogelijke bijwerkingen van CIPRO?
CIPRO kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien “Wat is de belangrijkste informatie die ik over CIPRO moet weten?”
- Ernstige allergische reacties. Ernstige allergische reacties, waaronder overlijden, kunnen optreden bij mensen die fluorochinolonen gebruiken, inclusief CIPRO, zelfs na slechts 1 dosis. Stop met het innemen van CIPRO en zoek onmiddellijk medische hulp als u een van de volgende symptomen van een ernstige allergische reactie krijgt:
- netelroos
- hoge hartslag
- moeite met ademhalen of slikken
- flauwvallen
- zwelling van de lippen, tong, gezicht
- huiduitslag
- beklemd gevoel in de keel, heesheid
Huiduitslag kan optreden bij mensen die CIPRO 1000 mg gebruiken, zelfs na slechts 1 dosis. Stop met het innemen van CIPRO 500 mg bij het eerste teken van huiduitslag en bel uw zorgverlener. Huiduitslag kan een teken zijn van een ernstiger reactie op CIPRO.
- Leverbeschadiging (hepatotoxiciteit). Levertoxiciteit kan optreden bij mensen die CIPRO gebruiken. Bel uw zorgverlener meteen als u onverklaarbare symptomen heeft, zoals:
- misselijkheid of braken
- ongewone vermoeidheid
- buikpijn
- verlies van eetlust
- koorts
- lichtgekleurde stoelgang
- zwakheid
- donker gekleurde urine
- buikpijn of gevoeligheid
- geel worden van de huid en het wit van uw ogen
- jeuk
Stop met het innemen van CIPRO 750 mg en vertel het uw zorgverlener meteen als uw huid of een wit deel van uw ogen geel wordt, of als u donkere urine heeft. Dit kunnen tekenen zijn van een ernstige reactie op CIPRO (een leverprobleem).
- Aorta-aneurysma en dissectie. Vertel het uw zorgverlener als u ooit is verteld dat u een aorta-aneurysma heeft, een zwelling van de grote slagader die bloed van het hart naar het lichaam voert. Roep onmiddellijk medische hulp in als u plotselinge pijn op de borst, maag of rug heeft.
- Darminfectie (Clostridioides difficile - geassocieerde diarree). Clostridioides difficile-geassocieerde diarree (CDAD) kan optreden bij veel antibacteriële geneesmiddelen, waaronder CIPRO. Bel onmiddellijk uw zorgverlener als u waterige diarree, diarree die niet weggaat of bloederige ontlasting krijgt. U kunt last krijgen van maagkrampen en koorts. CDAD kan optreden 2 of meer maanden nadat u klaar bent met uw antibacteriële geneesmiddel.
- Ernstige hartritmeveranderingen (QT-verlenging en torsade de pointes). Vertel het uw zorgverlener meteen als u een verandering in uw hartslag heeft (een snelle of onregelmatige hartslag) of als u flauwvalt. CIPRO kan een zeldzaam hartprobleem veroorzaken dat bekend staat als verlenging van het QT-interval. Deze aandoening kan een abnormale hartslag veroorzaken en kan zeer gevaarlijk zijn. De kans op deze gebeurtenis is groter bij mensen:
- die bejaard zijn.
- met een familiegeschiedenis van verlengd QT-interval.
- met een laag kaliumgehalte in het bloed (hypokaliëmie) of een laag magnesiumgehalte (hypomagnesiëmie).
- die bepaalde geneesmiddelen gebruiken om het hartritme onder controle te houden (antiaritmica).
- Gezamenlijke problemen. Verhoogde kans op problemen met gewrichten en weefsels rond gewrichten bij kinderen onder de 18 jaar kan voorkomen. Vertel de zorgverlener van uw kind als uw kind gewrichtsproblemen heeft tijdens of na de behandeling met CIPRO.
- Gevoeligheid voor zonlicht (lichtgevoeligheid). Zie "Wat moet ik vermijden tijdens het gebruik van CIPRO 250 mg?"
- Veranderingen in de bloedsuikerspiegel. Mensen die CIPRO en andere fluorochinolonen gebruiken met orale antidiabetesgeneesmiddelen of met insuline, kunnen een lage bloedsuikerspiegel (hypoglykemie) en een hoge bloedsuikerspiegel (hyperglykemie) krijgen. Volg de instructies van uw zorgverlener voor hoe vaak u uw bloedsuikerspiegel moet controleren. Als u diabetes heeft en een lage bloedsuiker krijgt terwijl u CIPRO gebruikt, stop dan met het gebruik van CIPRO en bel onmiddellijk uw zorgverlener. Uw antibioticum moet mogelijk worden gewijzigd.
De meest voorkomende bijwerkingen van CIPRO 750 mg zijn:
- misselijkheid
- diarree
- veranderingen in leverfunctietesten
- braken
- uitslag
Vertel uw zorgverlener over elke bijwerking die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van CIPRO. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik CIPRO bewaren?
CIPRO 500 mg-tabletten
- Bewaren bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
CIPRO 750 mg orale suspensie
- Bewaar microcapsules en verdunningsmiddel bij kamertemperatuur tot 77 ° F (25 ° C).
- Niet bevriezen.
- Gooi ongebruikte orale suspensie veilig weg nadat uw CIPRO-behandeling is beëindigd.
Houd CIPRO 250 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van CIPRO.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik CIPRO niet voor een aandoening waarvoor het niet is voorgeschreven. Geef CIPRO niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over CIPRO samen. Als u meer informatie wilt over CIPRO, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over CIPRO 250 mg die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in CIPRO 500mg?
CIPRO 1000mg-tabletten:
- Actief ingrediënt: cipro 250 mgfloxacinehydrochloride
- Inactieve ingredienten: maïszetmeel, crospovidon, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, siliciumdioxide en titaniumdioxide.
CIPRO orale suspensie:
- Actief ingrediënt: ciprofloxacine
- Inactieve ingredienten:
- Microcapsules bevatten: hypromellose, magnesiumstearaat, methacrylzuurcopolymeer en Polysorbaat 20 en povidon.
- Verdunningsmiddel bevat: middellange keten triglyceriden, sucrose, sojalecithine, water en aardbeiensmaak.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
