Keflex 250mg, 500mg Cephalexin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Keflex 250 mg en hoe wordt het gebruikt?
Keflex is een receptgeneesmiddel dat wordt gebruikt om de symptomen van verschillende bacteriële infecties te behandelen door de groei van bacteriën te stoppen. Keflex 500 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Keflex staat bekend als een cefalosporine-antibioticum.
Wat zijn bijwerkingen van Keflex?
Keflex kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- ongebruikelijke vermoeidheid,
- licht gevoel in het hoofd of kortademig voelen,
- gemakkelijk blauwe plekken,
- ongewone bloeding,
- paarse of rode vlekken onder je huid,
- hartinfarct,
- bleke huid,
- koude handen en voeten,
- vergeelde huid, donker gekleurde urine,
- koorts,
- zwakheid ,
- pijn in uw zij of onderrug,
- pijnlijk urineren,
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Keflex 500 mg zijn:
- diarree,
- misselijkheid,
- braken,
- indigestie,
- buikpijn,
- vaginale jeuk of afscheiding,
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Keflex. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
KEFLEX® (cephalexin) Capsules, USP is een semi-synthetisch antibacterieel cefalosporine-medicijn bedoeld voor orale toediening. Het is 7-(D-α-Amino-α-fenylacetamido)-3-methyl-3-cefem-4-carbonzuurmonohydraat. Cephalexin heeft de molecuulformule C16H17N3O4S•H2O en het molecuulgewicht is 365,41.
Cephalexin heeft de volgende structuurformule:
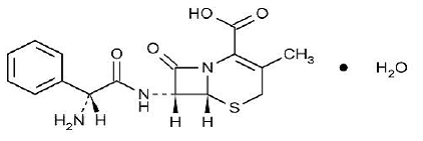
Elke capsule bevat cefalexine-monohydraat overeenkomend met 250 mg, 500 mg of 750 mg cefalexine. De capsules bevatten ook carboxymethylcellulose-natrium, D&C Yellow No. 10, dimethicon, FD&C Blue No. 1, FD&C Yellow No. 6, gelatine, magnesiumstearaat, microkristallijne cellulose en titaniumdioxide.
INDICATIES
Luchtweginfecties
KEFLEX is geïndiceerd voor de behandeling van luchtweginfecties veroorzaakt door gevoelige isolaten van Streptococcus pneumoniae en Streptococcus pyogenes.
otitis media
KEFLEX is geïndiceerd voor de behandeling van middenoorontsteking veroorzaakt door gevoelige isolaten van Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes en Moraxella catarrhalis.
Huid- en huidstructuurinfecties
KEFLEX 250 mg is geïndiceerd voor de behandeling van huid- en huidstructuurinfecties veroorzaakt door gevoelige isolaten van de volgende Gram-positieve bacteriën: Staphylococcus aureus en Streptococcus pyogenes.
Botinfecties
KEFLEX 250 mg is geïndiceerd voor de behandeling van botinfecties veroorzaakt door gevoelige isolaten van Staphylococcus aureus en Proteus mirabilis.
Infecties van het urogenitale kanaal
KEFLEX is geïndiceerd voor de behandeling van urineweginfecties, waaronder acute prostatitis, veroorzaakt door gevoelige isolaten van Escherichia coli, Proteus mirabilis en Klebsiella pneumoniae.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van KEFLEX 250 mg en andere antibacteriële geneesmiddelen te behouden, mag KEFLEX 500 mg alleen worden gebruikt voor de behandeling van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet met deze informatie rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Volwassenen en pediatrische patiënten ten minste 15 jaar oud
De gebruikelijke dosering van orale KEFLEX 250 mg is 250 mg om de 6 uur, maar een dosis van 500 mg om de 12 uur kan worden toegediend. De behandeling wordt gedurende 7 tot 14 dagen toegediend.
Voor ernstigere infecties kunnen grotere orale doses KEFLEX nodig zijn, tot 4 gram per dag in twee tot vier gelijk verdeelde doses.
Pediatrische patiënten (ouder dan 1 jaar)
De aanbevolen totale dagelijkse dosis orale KEFLEX 500 mg voor pediatrische patiënten is 25 tot 50 mg/kg, verdeeld over 7 tot 14 dagen verdeeld over doses. Bij de behandeling van β-hemolytische streptokokkeninfecties wordt een duur van ten minste 10 dagen aanbevolen. Bij ernstige infecties kan een totale dagelijkse dosis van 50 tot 100 mg/kg worden toegediend in gelijk verdeelde doses.
Voor de behandeling van middenoorontsteking is de aanbevolen dagelijkse dosis 75 tot 100 mg/kg, verdeeld over gelijke doses.
Doseringsaanpassingen bij volwassen en pediatrische patiënten van ten minste 15 jaar met nierinsufficiëntie
Dien de volgende doseringsschema's voor KEFLEX toe aan patiënten met een verminderde nierfunctie [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik in specifieke populaties ].
HOE GELEVERD
Doseringsvormen en sterke punten
250mg-capsules: een wit tot lichtgeel poeder gevuld in een ondoorzichtige witte en ondoorzichtige donkergroene capsule die is bedrukt met KEFLEX 250 mg in eetbare zwarte inkt op de witte romp.
500mg-capsules: een wit tot lichtgeel poeder gevuld in een ondoorzichtige lichtgroene en ondoorzichtige donkergroene capsule die bedrukt is met KEFLEX 500 mg in eetbare zwarte inkt op de lichtgroene romp.
750mg-capsules: een wit tot lichtgeel poeder gevuld in een langwerpige ondoorzichtige donkergroene en ondoorzichtige donkergroene capsule die is bedrukt met KEFLEX 750 mg in eetbare witte inkt op de donkergroene romp.
Opslag en behandeling
KEFLEX (cefalexine)-capsules , USP, wordt als volgt geleverd:
250 mg Capsules, flesjes van 100 – NDC 59630-112-10 500 mg Capsules, flesjes van 100 – NDC 59630-113-10 750 mg Capsules, flesjes van 50 – NDC 59630-115-05
KEFLEX moet worden bewaard bij 25°C (77°F); excursies toegestaan tot 15° tot 30°C (59° tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Doseer in een strakke, lichtbestendige container.
Gefabriceerd voor: Shionogi Inc. Florham Park, NJ 07932. Gefabriceerd door: Sandoz GmbH Kundl, Oostenrijk. Herzien: oktober 2015.
BIJWERKINGEN
De volgende ernstige gebeurtenissen worden in meer detail beschreven in het gedeelte Waarschuwingen en voorzorgsmaatregelen:
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Directe Coombs-test seroconversie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Inbeslagnemingspotentieel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Effect op protrombineactiviteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ontwikkeling van geneesmiddelresistente bacteriën [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen
In klinische onderzoeken was diarree de meest voorkomende bijwerking. Misselijkheid en braken, dyspepsie, gastritis en buikpijn zijn ook voorgekomen. Net als bij penicillines en andere cefalosporines zijn voorbijgaande hepatitis en cholestatische geelzucht gemeld.
Andere reacties waren onder meer overgevoeligheidsreacties, genitale en anale pruritus, genitale candidiasis, vaginitis en vaginale afscheiding, duizeligheid, vermoeidheid, hoofdpijn, opwinding, verwardheid, hallucinaties, artralgie, artritis en gewrichtsaandoeningen. Reversibele interstitiële nefritis is gemeld. Eosinofilie, neutropenie, trombocytopenie, hemolytische anemie en lichte verhogingen van aspartaattransaminase (AST) en alaninetransaminase (ALAT) zijn gemeld.
Naast de hierboven genoemde bijwerkingen die zijn waargenomen bij patiënten die werden behandeld met KEFLEX 500 mg, zijn de volgende bijwerkingen en andere gewijzigde laboratoriumtests gemeld voor antibacteriële geneesmiddelen uit de cefalosporineklasse:
Andere bijwerkingen
Koorts, colitis, aplastische anemie, bloeding, nierdisfunctie en toxische nefropathie.
Gewijzigde laboratoriumtests
Verlengde protrombinetijd, verhoogd bloedureumstikstof (BUN), verhoogd creatinine, verhoogd alkalische fosfatase, verhoogd bilirubine, verhoogd lactaatdehydrogenase (LDH), pancytopenie, leukopenie en agranulocytose.
DRUG-INTERACTIES
Metformine
Toediening van KEFLEX 250 mg met metformine resulteert in verhoogde plasmaconcentraties van metformine en verminderde renale klaring van metformine.
Zorgvuldige monitoring van de patiënt en dosisaanpassing van metformine wordt aanbevolen bij patiënten die gelijktijdig KEFLEX en metformine gebruiken (zie KLINISCHE FARMACOLOGIE ].
probenecide
De renale excretie van KEFLEX wordt geremd door probenecide. Gelijktijdige toediening van probenecide met KEFLEX 500 mg wordt niet aanbevolen.
Interactie met laboratorium- of diagnostische tests
Een vals-positieve reactie kan optreden bij het testen op de aanwezigheid van glucose in de urine met behulp van Benedict's oplossing of Fehling's oplossing.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.

PREVENTIEVE MAATREGELEN
Overgevoeligheidsreacties
Allergische reacties in de vorm van huiduitslag, urticaria, angio-oedeem, anafylaxie, erythema multiforme, Stevens-Johnson-syndroom of toxische epidermale necrolyse zijn gemeld bij het gebruik van KEFLEX. Voordat de behandeling met KEFLEX 500 mg wordt ingesteld, dient u te informeren of de patiënt een voorgeschiedenis heeft van overgevoeligheidsreacties op cefalexine, cefalosporines, penicillines of andere geneesmiddelen. Kruisovergevoeligheid tussen bètalactamantibacteriële geneesmiddelen kan voorkomen bij maximaal 10% van de patiënten met een voorgeschiedenis van penicilline-allergie.
Als een allergische reactie op KEFLEX 500 mg optreedt, stop dan met het medicijn en stel een geschikte behandeling in.
Clostridium Difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder KEFLEX 500 mg, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert toxine A en B, die bijdragen aan de ontwikkeling van CDAD. Hypertoxine-producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Directe Coombs-test seroconversie
Positieve directe Coombs-tests zijn gemeld tijdens behandeling met de cefalosporine-antibacteriële geneesmiddelen, waaronder cefalexine. Acute intravasculaire hemolyse geïnduceerd door cefalexinetherapie is gemeld. Als zich anemie ontwikkelt tijdens of na behandeling met cefalexine, voer dan een diagnostisch onderzoek uit voor geneesmiddelgeïnduceerde hemolytische anemie, stop met cefalexine en stel een geschikte therapie in.
Inbeslagnemingspotentieel
Verschillende cefalosporines zijn in verband gebracht met het veroorzaken van epileptische aanvallen, met name bij patiënten met nierinsufficiëntie wanneer de dosering niet werd verlaagd. Als er epileptische aanvallen optreden, stop dan met KEFLEX. Anticonvulsieve therapie kan worden gegeven indien klinisch geïndiceerd.
Verlengde protrombinetijd
Cefalosporines kunnen in verband worden gebracht met een verlengde protrombinetijd. Tot de risicogroepen behoren patiënten met nier- of leverinsufficiëntie of een slechte voedingstoestand, evenals patiënten die een langdurige antibacteriële therapie krijgen en patiënten die anticoagulantia krijgen. Controleer de protrombinetijd bij risicopatiënten en beheer zoals aangegeven.
Ontwikkeling van geneesmiddelresistente bacteriën
Het is onwaarschijnlijk dat het voorschrijven van KEFLEX bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie voordelen voor de patiënt oplevert en het risico op de ontwikkeling van geneesmiddelresistente bacteriën verhoogt.
Langdurig gebruik van KEFLEX kan leiden tot overgroei van niet-gevoelige organismen. Zorgvuldige observatie van de patiënt is essentieel. Als tijdens de behandeling superinfectie optreedt, dienen passende maatregelen te worden genomen.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen levenslange studies bij dieren uitgevoerd om het carcinogene potentieel van cefalexine te evalueren. Er zijn geen tests uitgevoerd om het mutagene potentieel van cefalexine te bepalen. Bij mannelijke en vrouwelijke ratten werden de vruchtbaarheid en het reproductievermogen niet beïnvloed door orale doses cefalexine tot 1,5 keer de hoogste aanbevolen dosis voor de mens op basis van het lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie B
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Er zijn reproductieonderzoeken uitgevoerd bij muizen en ratten waarbij orale doses cefalexinemonohydraat 0,6 en 1,5 maal de maximale dagelijkse dosis voor de mens (66 mg/kg/dag) werden gebruikt op basis van het lichaamsoppervlak, en er zijn geen aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus.
Moeders die borstvoeding geven
Cephalexine wordt uitgescheiden in de moedermelk. Voorzichtigheid is geboden wanneer KEFLEX wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik
De veiligheid en werkzaamheid van KEFLEX 500 mg bij pediatrische patiënten werd vastgesteld in klinische onderzoeken voor de doseringen beschreven in de rubriek dosering en toediening [zie DOSERING EN ADMINISTRATIE ].
Geriatrisch gebruik
Van de 701 proefpersonen in 3 gepubliceerde klinische onderzoeken naar cefalexine waren er 433 (62%) 65 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond.
Dit geneesmiddel wordt grotendeels uitgescheiden door de nieren en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten meer kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het selecteren van de dosis [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nierfunctiestoornis
KEFLEX moet met voorzichtigheid worden toegediend in geval van een verminderde nierfunctie (creatinineklaring DOSERING EN ADMINISTRATIE ].
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard - tiende editie. CLSI-document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2015.
2. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor gevoeligheidstests voor antimicrobiële stoffen; Vijfentwintigste informatief supplement. CLSI-document M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2015.
3. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor gevoeligheidstests voor antimicrobiële schijven; Goedgekeurde standaard - Twaalfde editie. CLSI-document M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS, 2015.
OVERDOSERING
Symptomen van orale overdosering kunnen misselijkheid, braken, epigastrische nood, diarree en hematurie zijn. Stel in geval van overdosering algemene ondersteunende maatregelen in.
Geforceerde diurese, peritoneale dialyse, hemodialyse of houtskoolhemoperfusie zijn niet bewezen als gunstig voor een overdosis cefalexine.
CONTRA-INDICATIES
KEFLEX is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor cefalexine of andere leden van de cefalosporineklasse van antibacteriële geneesmiddelen.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Cephalexin is een antibacterieel middel tegen cefalosporine [zie Microbiologie ].
Farmacokinetiek
Absorptie
Cephalexin is zuurbestendig en mag zonder rekening worden gehouden met maaltijden. Na doses van 250 mg, 500 mg en 1 g werden na 1 uur gemiddelde piekserumspiegels van respectievelijk ongeveer 9, 18 en 32 mcg/ml verkregen. Serumspiegels waren 6 uur na toediening detecteerbaar (op een detectieniveau van 0,2 mcg/ml).
Verdeling
Cephalexine is voor ongeveer 10% tot 15% gebonden aan plasma-eiwitten.
uitscheiding
Cephalexine wordt uitgescheiden in de urine door glomerulaire filtratie en tubulaire secretie. Studies toonden aan dat meer dan 90% van het geneesmiddel binnen 8 uur onveranderd in de urine werd uitgescheiden. Tijdens deze periode waren de piekconcentraties in de urine na de doses van 250 mg, 500 mg en 1 g respectievelijk ongeveer 1000, 2200 en 5000 mcg/ml.
Geneesmiddelinteracties
Bij gezonde proefpersonen die enkelvoudige doses van 500 mg cefalexine en metformine kregen, namen de gemiddelde Cmax en AUC van metformine in plasma toe met respectievelijk gemiddeld 34% en 24% en nam de gemiddelde renale klaring van metformine af met 14%. Er is geen informatie beschikbaar over de interactie van cefalexine en metformine na meerdere doses van beide geneesmiddelen.
Microbiologie
Werkingsmechanisme
Cephalexine is een bacteriedodend middel dat werkt door remming van de bacteriële celwandsynthese.
Weerstand
Meticillineresistente stafylokokken en de meeste isolaten van enterokokken zijn resistent tegen cefalexine. Cephalexin is niet actief tegen de meeste isolaten van Enterobacter spp., Morganella morganii en Proteus vulgaris. Cephalexin heeft geen activiteit tegen Pseudomonas spp. of Acinetobacter calcoaceticus. Penicilline-resistente Streptococcus pneumoniae is gewoonlijk kruisresistent tegen bètalactamantibacteriële geneesmiddelen.
Antimicrobiale activiteit
Van cephalexine is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties [zie: AANWIJZINGEN EN GEBRUIK ].
Gram-positieve bacteriën
Staphylococcus aureus (alleen meticilline-gevoelige isolaten) Streptococcus pneumoniae (penicilline-gevoelige isolaten) Streptococcus pyogenes
Gram-negatieve bacteriën
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Methoden voor gevoeligheidstests
Indien beschikbaar, moet het laboratorium voor klinische microbiologie de resultaten van in vitro gevoeligheidstestresultaten voor antimicrobiële geneesmiddelen die in residentiële ziekenhuizen worden gebruikt, aan de arts verstrekken als periodieke rapporten die het gevoeligheidsprofiel van nosocomiale en buiten het ziekenhuis verworven pathogenen beschrijven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Alleen in gevallen van ongecompliceerde urineweginfectie kan de gevoeligheid van E. coli, K. pneumoniae en P. mirabilis voor cephalexine worden afgeleid door het testen van cefazoline2.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële minimale remmende concentraties (MIC's) te bepalen. Deze MIC's geven schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's moeten worden bepaald met behulp van gestandaardiseerde testmethoden (bouillon of agar)1,2.
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, bieden ook reproduceerbare schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte geeft een schatting van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte moet worden bepaald met behulp van een gestandaardiseerde testmethode2,3.
Een rapport van Vatbaar (S) geeft aan dat het antimicrobiële geneesmiddel waarschijnlijk de groei van het pathogeen remt als het antimicrobiële geneesmiddel de concentratie bereikt die gewoonlijk op de plaats van infectie kan worden bereikt. Een rapport van Intermediair (I) geeft aan dat het resultaat als dubbelzinnig moet worden beschouwd, en als het micro-organisme niet volledig vatbaar is voor alternatieve klinisch haalbare geneesmiddelen, moet de test worden herhaald. Deze categorie impliceert mogelijke klinische toepasbaarheid op lichaamslocaties waar het medicijn fysiologisch geconcentreerd is of in situaties waar een hoge dosering van het medicijn kan worden gebruikt. Deze categorie biedt ook een bufferzone die voorkomt dat kleine ongecontroleerde technische factoren grote interpretatieverschillen veroorzaken. Een rapport van Resistent (R) geeft aan dat het antimicrobiële geneesmiddel de groei van het pathogeen waarschijnlijk niet remt als het antimicrobiële geneesmiddel de concentraties bereikt die gewoonlijk op de infectieplaats kunnen worden bereikt; andere therapie moet worden gekozen.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de persoon die de test uitvoert te controleren en te verzekeren1,2,3.
PATIËNT INFORMATIE
- Adviseer patiënten dat allergische reacties, waaronder ernstige allergische reacties, kunnen optreden en dat ernstige reacties onmiddellijke behandeling vereisen. Vraag de patiënt naar eerdere overgevoeligheidsreacties op KEFLEX, andere bètalactams (inclusief cefalosporines) of andere allergenen
- Adviseer patiënten dat diarree een veel voorkomend probleem is dat wordt veroorzaakt door antibacteriële geneesmiddelen en meestal verdwijnt wanneer het geneesmiddel wordt stopgezet. Soms kan frequente waterige of bloederige diarree optreden en dit kan een teken zijn van een ernstiger darminfectie. Als zich ernstige waterige of bloederige diarree ontwikkelt, adviseer patiënten dan om contact op te nemen met hun zorgverlener.
- Adviseer patiënten dat antibacteriële geneesmiddelen, waaronder KEFLEX, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer KEFLEX 500 mg wordt voorgeschreven om een bacteriële infectie te behandelen, vertel de patiënten dan dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met KEFLEX of andere antibacteriële geneesmiddelen kunnen worden behandeld.
