Levaquin 250mg, 500mg, 750mg Levofloxacin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Levaquin 750 mg en hoe wordt het gebruikt?
Levaquin is een receptgeneesmiddel dat wordt gebruikt om de symptomen van verschillende bacteriële infecties te behandelen. Levaquin kan alleen of in combinatie met andere medicijnen worden gebruikt.
Levaquin 500 mg behoort tot een klasse geneesmiddelen die fluoroquinolonen worden genoemd.
Het is niet bekend of Levaquin veilig en effectief is bij kinderen bij een behandelingsduur van meer dan 14 dagen.
Wat zijn de mogelijke bijwerkingen van Levaquin 500 mg?
Levaquin 750 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- hoofdpijn,
- honger,
- zweten,
- prikkelbaarheid,
- duizeligheid,
- misselijkheid,
- snelle hartslag,
- zich angstig of wankel voelen,
- gevoelloosheid of tintelingen in uw handen, armen, benen of voeten,
- zwakte in uw armen, handen, benen of voeten,
- brandende pijn in uw armen, handen, benen of voeten,
- ernstige stemmings- of gedragsveranderingen,
- nervositeit,
- verwardheid,
- agitatie,
- paranoia,
- hallucinaties,
- geheugen problemen,
- moeite met concentreren,
- zelfmoordgedachten,
- pees breuk,
- plotselinge pijn,
- zwelling,
- blauwe plekken,
- tederheid,
- stijfheid,
- bewegingsproblemen,
- een knappend of ploffend geluid in een van uw gewrichten,
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- fladderend in je borst,
- kortademigheid,
- huiduitslag,
- ademhalingsproblemen,
- toevallen (convulsies),
- ernstige hoofdpijn,
- zichtproblemen,
- pijn achter je ogen,
- pijn in de bovenbuik,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Levaquin 250 mg zijn:
- misselijkheid,
- constipatie,
- diarree,
- hoofdpijn,
- duizeligheid, en
- Moeite met slapen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Levaquin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
ERNSTIGE ONGEWENSTE REACTIES WAARONDER TENDINITIS, PEESRUPTUUR, PERIFERE NEUROPATHIE, EFFECTEN VAN HET CENTRALE ZENUWSTELSEL EN EXACERBATIE VAN MYASTHENIA GRAVIS
- Fluoroquinolonen, waaronder LEVAQUIN®, zijn in verband gebracht met invaliderende en mogelijk onomkeerbare ernstige bijwerkingen die samen zijn opgetreden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ), waaronder:
- Tendinitis en peesruptuur (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Perifere neuropathie (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Effecten op het centrale zenuwstelsel (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
Stop onmiddellijk met LEVAQUIN® en vermijd het gebruik van fluoroquinolonen, inclusief LEVAQUIN®, bij patiënten die een van deze ernstige bijwerkingen ervaren (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN )
- Fluoroquinolonen, waaronder LEVAQUIN®, kunnen spierzwakte verergeren bij patiënten met myasthenia gravis. Vermijd LEVAQUIN® bij patiënten met een bekende voorgeschiedenis van myasthenia gravis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Omdat fluoroquinolonen, waaronder LEVAQUIN®, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], reserveer LEVAQUIN® voor gebruik bij patiënten die geen alternatieve behandelingsopties hebben voor de volgende indicaties:
- Ongecompliceerde urineweginfectie [zie INDICATIES ]
- Acute bacteriële exacerbatie van chronische bronchitis [zie INDICATIES ]
- Acute bacteriële sinusitis [zie INDICATIES ].
OMSCHRIJVING
LEVAQUIN®-tabletten zijn synthetische antibacteriële middelen voor orale toediening. Chemisch gezien is levofloxacine, een chiraal gefluoreerd carboxychinolon, het zuivere (-)-(S)-enantiomeer van de racemische geneesmiddelsubstantie ofloxacine. De chemische naam is (-)-(S)-9-fluor-2,3-dihydro-3-methyl-10-(4-methyl-1-piperazinyl)-7-oxo-7H-pyrido[1,2, 3-de]-1,4-benzoxazine-6-carbonzuurhemihydraat.
Figuur 1: De chemische structuur van levofloxacine
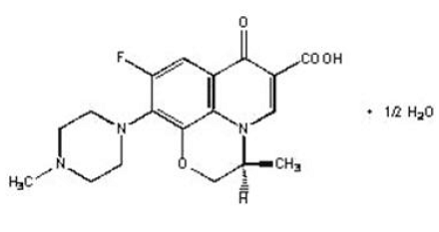
De empirische formule is C18H20FN3O4 · ½ H2O en het molecuulgewicht is 370,38. Levofloxacine is een licht geelachtig wit tot geelwit kristal of kristallijn poeder. Het molecuul bestaat als een zwitterion bij de pH-omstandigheden in de dunne darm.
De gegevens tonen aan dat van pH 0,6 tot 5,8 de oplosbaarheid van levofloxacine in wezen constant is (ongeveer 100 mg/ml). Levofloxacine wordt beschouwd als oplosbaar tot vrij oplosbaar in dit pH-bereik, zoals gedefinieerd door de USP-nomenclatuur. Boven pH 5,8 neemt de oplosbaarheid snel toe tot het maximum bij pH 6,7 (272 mg/ml) en wordt in dit bereik als vrij oplosbaar beschouwd. Boven pH 6,7 neemt de oplosbaarheid af en bereikt een minimumwaarde (ongeveer 50 mg/ml) bij een pH van ongeveer 6,9.
Levofloxacine heeft het potentieel om stabiele coördinatieverbindingen te vormen met veel metaalionen. Dit in vitro chelatievermogen heeft de volgende vormingsvolgorde: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN®-tabletten zijn verkrijgbaar als filmomhulde tabletten en bevatten de volgende inactieve ingrediënten:
- 250 mg (uitgedrukt in watervrije vorm): crospovidon, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, polysorbaat 80, synthetisch rood ijzeroxide en titaniumdioxide.
- 500 mg (uitgedrukt in watervrije vorm): crospovidon, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, polysorbaat 80, synthetische rode en gele ijzeroxiden en titaniumdioxide.
- 750 mg (uitgedrukt in watervrije vorm): crospovidon, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, polysorbaat 80, titaniumdioxide.
INDICATIES
Nosocomiale pneumonie
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van nosocomiale pneumonie als gevolg van methicilline-gevoelige Staphylococcus aureus, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae of Streptococcus pneumoniae. Adjuvante therapie moet worden gebruikt zoals klinisch geïndiceerd. Waar Pseudomonas aeruginosa een gedocumenteerde of vermoedelijke pathogeen is, wordt combinatietherapie met een anti-pseudomonaal β-lactam aanbevolen [zie Klinische studies ].
Gemeenschap verworven pneumonie
Behandelingsregime van 7 tot 14 dagen
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van buiten het ziekenhuis opgelopen pneumonie als gevolg van methicilline-gevoelige Staphylococcus aureus, Streptococcus pneumoniae (inclusief multiresistente Streptococcus pneumoniae [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenalis pneumium, , Chlamydophila pneumoniae, Legionella pneumophila of Mycoplasma pneumoniae [zie DOSERING EN ADMINISTRATIE en Klinische studies ].
MDRSP-isolaten zijn isolaten die resistent zijn tegen twee of meer van de volgende antibacteriële middelen: penicilline (MIC ≥2 mcg/ml), cefalosporines van de 2e generatie, bijv. cefuroxim, macroliden, tetracyclines en trimethoprim/sulfamethoxazol.
Gemeenschap verworven pneumonie
5-daagse behandelingsregime
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van buiten het ziekenhuis opgelopen pneumonie als gevolg van Streptococcus pneumoniae (exclusief multiresistente isolaten [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae of Chlamydophila pneumoniae [zie DOSERING EN ADMINISTRATIE en Klinische studies ].
Gecompliceerde huid- en huidstructuurinfecties
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van gecompliceerde huid- en huidstructuurinfecties als gevolg van methicilline-gevoelige Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes of Proteus mirabilis [zie Klinische studies ].
Ongecompliceerde huid- en huidstructuurinfecties
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van ongecompliceerde huid- en huidstructuurinfecties (licht tot matig), waaronder abcessen, cellulitis, steenpuisten, impetigo, pyodermie, wondinfecties als gevolg van methicilline-gevoelige Staphylococcus aureus of Streptococcus pyogenes.
Chronische bacteriële prostatitis
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van chronische bacteriële prostatitis veroorzaakt door Escherichia coli, Enterococcus faecalis of methicilline-gevoelige Staphylococcus epidermidis [zie Klinische studies ].
Inhalatie miltvuur (post-blootstelling)
LEVAQUIN® is geïndiceerd voor inhalatie-anthrax (na blootstelling) om de incidentie of progressie van ziekte te verminderen na blootstelling aan vernevelde Bacillus anthracis bij volwassenen en pediatrische patiënten van 6 maanden en ouder [zie DOSERING EN ADMINISTRATIE ]. De effectiviteit van LEVAQUIN® is gebaseerd op plasmaconcentraties die bij mensen zijn bereikt, een surrogaateindpunt dat redelijkerwijs klinisch voordeel kan voorspellen.
LEVAQUIN® is niet bij mensen getest voor de preventie van miltvuur door inademing na blootstelling. De veiligheid van LEVAQUIN® bij volwassenen voor behandelingsduur langer dan 28 dagen of bij pediatrische patiënten voor behandelingsduur langer dan 14 dagen is niet onderzocht. Langdurige LEVAQUIN®-therapie mag alleen worden gebruikt als het voordeel opweegt tegen het risico [zie Klinische studies ].
Pest
LEVAQUIN® is geïndiceerd voor de behandeling van pest, inclusief longpest en septikemische pest, veroorzaakt door Yersinia pestis (Y. pestis) en profylaxe voor pest bij volwassenen en pediatrische patiënten van 6 maanden en ouder [zie DOSERING EN ADMINISTRATIE ].
Werkzaamheidsstudies van LEVAQUIN® konden om ethische en haalbaarheidsredenen niet worden uitgevoerd bij mensen met pest. Daarom was de goedkeuring van deze indicatie gebaseerd op een werkzaamheidsonderzoek bij dieren [zie Klinische studies ].
Gecompliceerde urineweginfecties
5-daagse behandelingsregime
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van gecompliceerde urineweginfecties veroorzaakt door Escherichia coli, Klebsiella pneumoniae of Proteus mirabilis [zie Klinische studies ].
Gecompliceerde urineweginfecties
10-daagse behandelingsregime
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van gecompliceerde urineweginfecties (licht tot matig) veroorzaakt door Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis of Pseudomonas aeruginosa [zie Klinische studies ].
Acute pyelonefritis
5 of 10-daagse behandelingsregime
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van acute pyelonefritis veroorzaakt door Escherichia coli, inclusief gevallen met gelijktijdige bacteriëmie [zie Klinische studies ].
Ongecompliceerde urineweginfecties
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van ongecompliceerde urineweginfecties (licht tot matig) veroorzaakt door Escherichia coli, Klebsiella pneumoniae of Staphylococcus saprophyticus.
Omdat fluoroquinolonen, waaronder LEVAQUIN®, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en voor sommige patiënten is een ongecompliceerde urineweginfectie zelfbeperkend, reserveer LEVAQUIN® voor de behandeling van ongecompliceerde urineweginfecties bij patiënten die geen alternatieve behandelingsopties hebben.
Acute bacteriële exacerbatie van chronische bronchitis
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van acute bacteriële exacerbatie van chronische bronchitis (ABECB) als gevolg van methicilline-gevoelige Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae of Moraxella catarrhalis.
Omdat fluoroquinolonen, waaronder LEVAQUIN®, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] en voor sommige patiënten is ABECB zelfbeperkend, reserveer LEVAQUIN® voor de behandeling van ABECB bij patiënten die geen alternatieve behandelingsopties hebben.
Acute bacteriële sinusitis
5-daagse en 10-14-daagse behandelingsregimes
LEVAQUIN® is geïndiceerd bij volwassen patiënten voor de behandeling van acute bacteriële sinusitis (ABS) als gevolg van Streptococcus pneumoniae, Haemophilus influenzae of Moraxella catarrhalis [zie Klinische studies ].
Omdat fluoroquinolonen, waaronder LEVAQUIN®, in verband zijn gebracht met ernstige bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en voor sommige patiënten is ABS zelfbeperkend, reserveer LEVAQUIN® voor de behandeling van ABS bij patiënten die geen alternatieve behandelingsopties hebben.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van LEVAQUIN® en andere antibacteriële geneesmiddelen te behouden, mag LEVAQUIN® alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan het vermoeden bestaat dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
Cultuur- en gevoeligheidstesten
Voorafgaand aan de behandeling dienen geschikte kweek- en gevoeligheidstesten te worden uitgevoerd om de organismen die de infectie veroorzaken te isoleren en te identificeren en om hun gevoeligheid voor levofloxacine vast te stellen [zie Microbiologie ]. Therapie met LEVAQUIN® kan worden gestart voordat de resultaten van deze tests bekend zijn; zodra de resultaten beschikbaar zijn, moet een geschikte therapie worden gekozen.
Zoals met andere geneesmiddelen in deze klasse, kunnen sommige isolaten van Pseudomonas aeruginosa vrij snel resistentie ontwikkelen tijdens de behandeling met LEVAQUIN®. Kweek- en gevoeligheidstesten die periodiek tijdens de therapie worden uitgevoerd, zullen informatie verschaffen over de aanhoudende gevoeligheid van de pathogenen voor het antimicrobiële middel en ook over het mogelijke optreden van bacteriële resistentie.
DOSERING EN ADMINISTRATIE
Dosering van LEVAQUIN®-tabletten bij volwassen patiënten met een creatinineklaring ≥ 50 ml/minuut
De gebruikelijke dosis LEVAQUIN®-tabletten is 250 mg, 500 mg of 750 mg oraal toegediend om de 24 uur, zoals aangegeven door infectie en beschreven in Tabel 1.
Deze aanbevelingen zijn van toepassing op patiënten met een creatinineklaring ≥ 50 ml/minuut. Voor patiënten met een creatinineklaring van minder dan 50 ml/min, zijn aanpassingen aan het doseringsschema vereist [zie: Dosisaanpassing bij volwassenen met nierinsufficiëntie ].
Dosering van LEVAQUIN®-tabletten bij pediatrische patiënten met inhalatie-anthrax of plaag
De dosering van LEVAQUIN®-tabletten voor inhalatie-anthrax (na blootstelling) en pest bij pediatrische patiënten die 30 kg of meer wegen, wordt hieronder beschreven in tabel 2. LEVAQUIN®-tabletten kunnen vanwege de beperkingen niet worden toegediend aan patiënten die minder dan 30 kg wegen van de beschikbare sterkte. Alternatieve formuleringen van levofloxacine kunnen worden overwogen voor pediatrische patiënten die minder dan 30 kg wegen.
Dosisaanpassing bij volwassenen met nierinsufficiëntie
Dien LEVAQUIN® met voorzichtigheid toe bij patiënten met nierinsufficiëntie. Voor en tijdens de behandeling dienen zorgvuldige klinische observatie en geschikte laboratoriumonderzoeken te worden uitgevoerd, aangezien de eliminatie van levofloxacine bij deze patiënten verminderd kan zijn.
Bij patiënten met nierinsufficiëntie (creatinineklaring minder dan 50 ml/min) is aanpassing van het doseringsschema noodzakelijk om accumulatie van levofloxacine als gevolg van verminderde klaring te voorkomen (zie Gebruik bij specifieke populaties ]. Er is geen aanpassing nodig voor patiënten met een creatinineklaring groter dan of gelijk aan 50 ml/minuut.
Tabel 3 laat zien hoe de dosis kan worden aangepast op basis van de creatinineklaring.
Geneesmiddelinteractie met chelatiemiddelen
Antacida, sucralfaat, metaalkationen, multivitaminen
LEVAQUIN®-tabletten moeten ten minste twee uur vóór of twee uur na antacida die magnesium, aluminium en sucralfaat bevatten, metaalkationen zoals ijzer en multivitaminepreparaten worden toegediend met zink- of didanosine-kauw-/gebufferde tabletten of het pediatrische poeder voor drank [zien DRUG-INTERACTIES en PATIËNT INFORMATIE ].
Beheer instructies
LEVAQUIN®-tabletten kunnen zonder voedsel worden toegediend.
Hydratatie voor patiënten die LEVAQUIN®-tabletten ontvangen
Adequate hydratatie van patiënten die LEVAQUIN® krijgen, moet worden gehandhaafd om de vorming van sterk geconcentreerde urine te voorkomen. Kristalurie en cylindrurie zijn gemeld bij chinolonen [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
TABLETTEN, filmomhuld, capsulevormig
- 250 mg terracotta roze tabletten, bedrukt met "250" aan de ene kant en "LEVAQUIN" aan de andere kant
- Perziktabletten van 500 mg, bedrukt met "500" aan de ene kant en "LEVAQUIN" aan de andere kant
- Witte tabletten van 750 mg, bedrukt met "750" aan de ene kant en "LEVAQUIN" aan de andere kant
Opslag en behandeling
LEVAQUIN®-tabletten worden geleverd als capsulevormige, omhulde tabletten van 250, 500 en 750 mg.
LEVAQUIN®-tabletten zijn verpakt in flessen in de volgende configuraties:
- 250 mg tabletten zijn terra cotta roze en hebben de opdruk: "LEVAQUIN®" aan de ene kant en "250" aan de andere kant
- flessen van 50 ( NDC 50458-920-50)
- 500 mg tabletten zijn perzikkleurig en hebben de opdruk: "LEVAQUIN®" aan de ene kant en "500" aan de andere kant
- flessen van 50 ( NDC 50458-925-50)
- Tabletten van 750 mg zijn wit en hebben de opdruk "LEVAQUIN®" aan de ene kant en "750" aan de andere kant
- flessen van 20 ( NDC 50458-930-20)
LEVAQUIN®-tabletten moeten worden bewaard bij 15° tot 30°C (59° tot 86°F) in goed gesloten containers.
Gefabriceerd door: Actief ingrediënt Gemaakt in Japan. Herzien: juli 2018
BIJWERKINGEN
Ernstige en anderszins belangrijke bijwerkingen
De volgende ernstige en anderszins belangrijke bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Uitschakelen en mogelijk onomkeerbare ernstige bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Tendinitis en peesruptuur [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Perifere neuropathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Effecten op het centrale zenuwstelsel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Exacerbatie van Myasthenia Gravis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Andere ernstige en soms fatale reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verlenging van het QT-interval [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Musculoskeletale aandoeningen bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Bloedglucosestoornissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Lichtgevoeligheid/fototoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ontwikkeling van geneesmiddelresistente bacteriën [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Kristalurie en cylindrurie zijn gemeld bij chinolonen, waaronder LEVAQUIN®. Daarom moet voldoende hydratatie worden gehandhaafd bij patiënten die LEVAQUIN® krijgen om de vorming van een sterk geconcentreerde urine te voorkomen [zie DOSERING EN ADMINISTRATIE ].
Klinische proefervaring
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De hieronder beschreven gegevens weerspiegelen de blootstelling aan LEVAQUIN® bij 7537 patiënten in 29 gepoolde klinische fase 3-onderzoeken. De onderzochte populatie had een gemiddelde leeftijd van 50 jaar (ongeveer 74% van de populatie was INDICATIES ]. Patiënten kregen LEVAQUIN®-doses van 750 mg eenmaal daags, 250 mg eenmaal daags of 500 mg een- of tweemaal daags.
De duur van de behandeling was gewoonlijk 3-14 dagen en het gemiddelde aantal dagen therapie was 10 dagen.
De totale incidentie, het type en de distributie van bijwerkingen was vergelijkbaar bij patiënten die LEVAQUIN®-doses van 750 mg eenmaal daags, 250 mg eenmaal daags en 500 mg eenmaal of tweemaal daags kregen.
Stopzetting van LEVAQUIN® vanwege bijwerkingen kwam voor bij 4,3% van de patiënten in totaal, 3,8% van de patiënten die werden behandeld met de doses van 250 mg en 500 mg en 5,4% van de patiënten die werden behandeld met de dosis van 750 mg. De meest voorkomende bijwerkingen die leidden tot stopzetting van de doseringen van 250 en 500 mg waren gastro-intestinaal (1,4%), voornamelijk misselijkheid (0,6%); braken (0,4%); duizeligheid (0,3%); en hoofdpijn (0,2%). De meest voorkomende bijwerkingen die leidden tot stopzetting van de dosis van 750 mg waren gastro-intestinaal (1,2%), voornamelijk misselijkheid (0,6%), braken (0,5%); duizeligheid (0,3%); en hoofdpijn (0,3%).
Bijwerkingen die optreden bij ≥1% van de met LEVAQUIN® behandelde patiënten en minder vaak voorkomende bijwerkingen, die optreden bij 0,1 tot
In klinische onderzoeken met therapie met meervoudige doses zijn oogafwijkingen, waaronder cataracten en meervoudige puntvormige lenticulaire opaciteiten, waargenomen bij patiënten die werden behandeld met chinolonen, waaronder LEVAQUIN®. De relatie van de drugs met deze gebeurtenissen is momenteel niet vastgesteld.
Postmarketingervaring
Tabel 6 geeft een overzicht van bijwerkingen die zijn vastgesteld tijdens het gebruik van LEVAQUIN® na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
DRUG-INTERACTIES
Chelatiemiddelen
Antacida, sucralfaat, metaalkationen, multivitaminen
Hoewel de chelatie door divalente kationen minder uitgesproken is dan bij andere fluorochinolonen, kan gelijktijdige toediening van LEVAQUIN®-tabletten met antacida die magnesium of aluminium bevatten, evenals sucralfaat, metaalkationen zoals ijzer en multivitaminepreparaten met zink de gastro-intestinale absorptie verstoren. van levofloxacine, wat resulteert in systemische niveaus die aanzienlijk lager zijn dan gewenst. Tabletten met antacida die magnesium, aluminium, evenals sucralfaat, metaalkationen zoals ijzer en multivitaminepreparaten met zink of didanosine bevatten, kunnen de gastro-intestinale absorptie van levofloxacine aanzienlijk verstoren, wat resulteert in systemische niveaus die aanzienlijk lager zijn dan gewenst. Deze middelen moeten ten minste twee uur vóór of twee uur na orale toediening van LEVAQUIN® worden ingenomen.
Warfarine
In een klinische studie met gezonde vrijwilligers werd geen significant effect van LEVAQUIN® op de piekplasmaconcentraties, AUC en andere dispositieparameters voor R- en S-warfarine gedetecteerd. Evenzo werd er geen duidelijk effect van warfarine op de absorptie en dispositie van levofloxacine waargenomen. Er zijn echter meldingen geweest tijdens postmarketingervaring bij patiënten dat LEVAQUIN® de effecten van warfarine versterkt. Verhogingen van de protrombinetijd bij gelijktijdig gebruik van warfarine en LEVAQUIN® zijn in verband gebracht met bloedingen. Protrombinetijd, International Normalised Ratio (INR) of andere geschikte antistollingstesten moeten nauwlettend worden gecontroleerd als LEVAQUIN® gelijktijdig met warfarine wordt toegediend. Patiënten moeten ook worden gecontroleerd op tekenen van bloeding [zie: ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Antidiabetica
Verstoringen van de bloedglucose, waaronder hyperglykemie en hypoglykemie, zijn gemeld bij patiënten die gelijktijdig werden behandeld met fluorochinolonen en een antidiabeticum. Daarom wordt zorgvuldige controle van de bloedglucose aanbevolen wanneer deze middelen gelijktijdig worden toegediend [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES , en PATIËNT INFORMATIE ].
Steroïdeloze ontstekingsremmers
De gelijktijdige toediening van een niet-steroïde anti-inflammatoir geneesmiddel met een fluoroquinolon, waaronder LEVAQUIN®, kan het risico op CZS-stimulatie en convulsieve aanvallen verhogen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
theofylline
In een klinische studie met gezonde vrijwilligers werd geen significant effect van LEVAQUIN® op de plasmaconcentraties, AUC en andere dispositieparameters voor theofylline gedetecteerd. Evenzo werd geen duidelijk effect van theofylline op de absorptie en dispositie van levofloxacine waargenomen. Gelijktijdige toediening van andere fluoroquinolonen met theofylline heeft echter geleid tot een verlengde eliminatiehalfwaardetijd, verhoogde serumtheofyllinespiegels en een daaropvolgende toename van het risico op theofyllinegerelateerde bijwerkingen bij de patiëntenpopulatie. Daarom moeten de theofyllinespiegels nauwlettend worden gecontroleerd en moeten de juiste doseringsaanpassingen worden gemaakt wanneer LEVAQUIN® gelijktijdig wordt toegediend. Bijwerkingen, waaronder toevallen, kunnen optreden met of zonder een verhoging van de serumtheofyllinespiegels [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cyclosporine
In een klinische studie met gezonde vrijwilligers werd geen significant effect van LEVAQUIN® op de piekplasmaconcentraties, AUC en andere dispositieparameters voor ciclosporine gedetecteerd. Er zijn echter verhoogde serumspiegels van ciclosporine gemeld bij de patiëntenpopulatie bij gelijktijdige toediening met enkele andere fluorochinolonen. Levofloxacine Cmax en ke waren iets lager, terwijl Tmax en t1/2 iets langer waren in de aanwezigheid van ciclosporine dan die waargenomen in andere onderzoeken zonder gelijktijdige medicatie. De verschillen worden echter niet als klinisch significant beschouwd. Daarom is er geen dosisaanpassing nodig voor LEVAQUIN® of ciclosporine bij gelijktijdige toediening.
Digoxine
In een klinische studie met gezonde vrijwilligers werd geen significant effect van LEVAQUIN® op de piekplasmaconcentraties, AUC en andere dispositieparameters voor digoxine gedetecteerd. De absorptie- en dispositiekinetiek van levofloxacine waren vergelijkbaar in aanwezigheid of afwezigheid van digoxine. Daarom is er geen dosisaanpassing voor LEVAQUIN® of digoxine nodig bij gelijktijdige toediening.
Probenecide en cimetidine
In een klinische studie met gezonde vrijwilligers werd geen significant effect van probenecide of cimetidine op de Cmax van levofloxacine waargenomen. De AUC en t1/2 van levofloxacine waren hoger, terwijl CL/F en CLR lager waren tijdens gelijktijdige behandeling van LEVAQUIN® met probenecide of cimetidine in vergelijking met alleen LEVAQUIN®. Deze veranderingen rechtvaardigen echter geen dosisaanpassing van LEVAQUIN® bij gelijktijdige toediening van probenecide of cimetidine.
Interacties met laboratorium- of diagnostische tests
Sommige fluoroquinolonen, waaronder LEVAQUIN®, kunnen vals-positieve urinescreeningsresultaten voor opiaten produceren met behulp van in de handel verkrijgbare immunoassaykits. Bevestiging van positieve opiaatscreening met meer specifieke methoden kan nodig zijn.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathie en effecten op het centrale zenuwstelsel
Fluoroquinolonen, waaronder LEVAQUIN®, zijn in verband gebracht met invaliderende en mogelijk onomkeerbare ernstige bijwerkingen van verschillende lichaamssystemen die samen bij dezelfde patiënt kunnen optreden. Vaak voorkomende bijwerkingen zijn tendinitis, peesruptuur, artralgie, spierpijn, perifere neuropathie en effecten op het centrale zenuwstelsel (hallucinaties, angst, depressie, slapeloosheid, ernstige hoofdpijn en verwardheid). Deze reacties kunnen optreden binnen enkele uren tot weken na het starten met LEVAQUIN®. Patiënten van elke leeftijd of zonder reeds bestaande risicofactoren hebben deze bijwerkingen ervaren [zie: Tendinitis en peesruptuur, perifere neuropathie, effecten op het centrale zenuwstelsel ].
Stop onmiddellijk met LEVAQUIN® bij de eerste tekenen of symptomen van een ernstige bijwerking. Vermijd bovendien het gebruik van fluorochinolonen, inclusief LEVAQUIN®, bij patiënten die een van deze ernstige bijwerkingen hebben gehad die verband houden met fluoroquinolonen.
Tendinitis en peesruptuur
Fluoroquinolonen, waaronder LEVAQUIN®, zijn in alle leeftijden in verband gebracht met een verhoogd risico op tendinitis en peesruptuur [zie Invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathie en effecten op het centrale zenuwstelsel en ONGEWENSTE REACTIES ]. Deze bijwerking heeft meestal betrekking op de achillespees en is ook gemeld bij de rotator cuff (de schouder), de hand, de biceps, de duim en andere peesplaatsen. Tendinitis of peesruptuur kan optreden binnen enkele uren of dagen na het starten van LEVAQUIN® of tot enkele maanden na voltooiing van de behandeling met fluoroquinolon. Tendinitis en peesruptuur kunnen bilateraal voorkomen.
Het risico op het ontwikkelen van fluorochinolon-geassocieerde tendinitis en peesruptuur is verhoogd bij patiënten ouder dan 60 jaar, bij patiënten die corticosteroïden gebruiken en bij patiënten met nier-, hart- of longtransplantaties. Andere factoren die onafhankelijk van elkaar het risico op peesruptuur kunnen verhogen, zijn zware lichamelijke activiteit, nierfalen en eerdere peesaandoeningen zoals reumatoïde artritis. Tendinitis en peesruptuur zijn gemeld bij patiënten die fluorochinolonen gebruiken en die de bovengenoemde risicofactoren niet hebben. Stop onmiddellijk met LEVAQUIN® als de patiënt pijn, zwelling, ontsteking of scheuring van een pees ervaart. Patiënten moeten worden geadviseerd om te rusten bij het eerste teken van tendinitis of peesruptuur en om contact op te nemen met hun zorgverlener over het overstappen op een niet-chinolonantimicrobieel geneesmiddel. Vermijd LEVAQUIN® bij patiënten met een voorgeschiedenis van peesaandoeningen of peesruptuur [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Perifere neuropathie
Fluoroquinolonen, waaronder LEVAQUIN®, zijn in verband gebracht met een verhoogd risico op perifere neuropathie. Gevallen van sensorische of sensorimotorische axonale polyneuropathie die kleine en/of grote axonen aantast, resulterend in paresthesieën, hypesthesieën, dysesthesieën en zwakte zijn gemeld bij patiënten die fluorochinolonen kregen, waaronder LEVAQUIN®. Symptomen kunnen kort na het starten van LEVAQUIN® optreden en kunnen bij sommige patiënten onomkeerbaar zijn [zie: Invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathie en effecten op het centrale zenuwstelsel en ONGEWENSTE REACTIES ].
Stop onmiddellijk met LEVAQUIN® als de patiënt symptomen van neuropathie ervaart, waaronder pijn, branderig gevoel, tintelingen, gevoelloosheid en/of zwakte of andere veranderingen van het gevoel, waaronder lichte aanraking, pijn, temperatuur, positiegevoel en vibrerend gevoel. Vermijd fluoroquinolonen, inclusief LEVAQUIN®, bij patiënten die eerder perifere neuropathie hebben gehad [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Effecten op het centrale zenuwstelsel
Fluoroquinolonen, waaronder LEVAQUIN®, zijn in verband gebracht met een verhoogd risico op effecten op het centrale zenuwstelsel (CZS), waaronder convulsies, toxische psychosen, verhoogde intracraniale druk (inclusief pseudotumor cerebri). Fluoroquinolonen kunnen ook stimulatie van het centrale zenuwstelsel veroorzaken, wat kan leiden tot tremoren, rusteloosheid, angst, duizeligheid, verwardheid, hallucinaties, paranoia, depressie, nachtmerries en slapeloosheid. Zelfmoordgedachten en zelfmoordpogingen of zelfmoordpogingen kunnen ook voorkomen, vooral bij patiënten met een medische voorgeschiedenis van depressie of een onderliggende risicofactor voor depressie. Deze reacties kunnen optreden na de eerste dosis. Als deze reacties optreden bij patiënten die LEVAQUIN® krijgen, stop dan met LEVAQUIN® en stel passende maatregelen in. Zoals met andere fluoroquinolonen, moet LEVAQUIN® met voorzichtigheid worden gebruikt bij patiënten met een bekende of vermoede aandoening van het centrale zenuwstelsel (CZS) die hen vatbaar kan maken voor epileptische aanvallen of die de aanvalsdrempel kan verlagen (bijv. ernstige cerebrale arteriosclerose, epilepsie) of in aanwezigheid van van andere risicofactoren die hen vatbaar kunnen maken voor aanvallen of die de aanvalsdrempel kunnen verlagen (bijv. bepaalde medicamenteuze behandeling, nierdisfunctie). [zien ONGEWENSTE REACTIES , DRUG-INTERACTIES , en PATIËNT INFORMATIE ].
Exacerbatie van Myasthenia Gravis
Fluoroquinolonen, waaronder LEVAQUIN®, hebben een neuromusculaire blokkerende activiteit en kunnen spierzwakte verergeren bij patiënten met myasthenia gravis. Ernstige bijwerkingen na het in de handel brengen, waaronder sterfgevallen en de noodzaak van beademing, zijn in verband gebracht met het gebruik van fluorochinolonen bij patiënten met myasthenia gravis. Vermijd LEVAQUIN® bij patiënten met een bekende voorgeschiedenis van myasthenia gravis [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Andere ernstige en soms fatale bijwerkingen
Andere ernstige en soms fatale bijwerkingen, sommige vanwege overgevoeligheid en sommige vanwege onzekere etiologie, zijn zelden gemeld bij patiënten die werden behandeld met fluoroquinolonen, waaronder LEVAQUIN®. Deze voorvallen kunnen ernstig zijn en treden in het algemeen op na toediening van meerdere doses. Klinische manifestaties kunnen een of meer van de volgende omvatten:
- koorts, huiduitslag of ernstige dermatologische reacties (bijv. toxische epidermale necrolyse, Stevens-Johnson-syndroom);
- vasculitis; artralgie; spierpijn; allergisch voor antibiotica;
- allergische pneumonitis;
- interstitiële nefritis; acute nierinsufficiëntie of nierfalen;
- hepatitis; geelzucht; acute levernecrose of falen;
- bloedarmoede, waaronder hemolytische en aplastische; trombocytopenie, waaronder trombotische trombocytopenische purpura; leukopenie; agranulocytose; pancytopenie; en/of andere hematologische afwijkingen.
Stop LEVAQUIN® onmiddellijk bij de eerste verschijning van huiduitslag, geelzucht of enig ander teken van overgevoeligheid en stel ondersteunende maatregelen in [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Overgevoeligheidsreacties
Ernstige en soms fatale overgevoeligheids- en/of anafylactische reacties zijn gemeld bij patiënten die werden behandeld met fluorochinolonen, waaronder LEVAQUIN®. Deze reacties treden vaak op na de eerste dosis. Sommige reacties gingen gepaard met cardiovasculaire collaps, hypotensie/shock, toevallen, bewustzijnsverlies, tintelingen, angio-oedeem (inclusief tong, larynx, keel of gezichtsoedeem/zwelling), luchtwegobstructie (inclusief bronchospasme, kortademigheid en acute ademhalingsproblemen). benauwdheid), kortademigheid, urticaria, jeuk en andere ernstige huidreacties. LEVAQUIN® moet onmiddellijk worden stopgezet bij de eerste verschijning van huiduitslag of enig ander teken van overgevoeligheid. Ernstige acute overgevoeligheidsreacties kunnen behandeling met epinefrine en andere reanimatiemaatregelen vereisen, waaronder zuurstof, intraveneuze vloeistoffen, antihistaminica, corticosteroïden, pressoramines en luchtwegbeheer, zoals klinisch geïndiceerd [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Hepatotoxiciteit
Postmarketingmeldingen van ernstige hepatotoxiciteit (inclusief acute hepatitis en fatale voorvallen) zijn ontvangen voor patiënten die met LEVAQUIN® werden behandeld. In klinische onderzoeken met meer dan 7.000 patiënten werd geen bewijs gevonden van ernstige geneesmiddelgerelateerde hepatotoxiciteit. Ernstige hepatotoxiciteit trad in het algemeen op binnen 14 dagen na aanvang van de therapie en de meeste gevallen traden op binnen 6 dagen. De meeste gevallen van ernstige levertoxiciteit waren niet geassocieerd met overgevoeligheid [zie: Andere ernstige en soms fatale bijwerkingen ].
De meeste meldingen van fatale hepatotoxiciteit kwamen voor bij patiënten van 65 jaar of ouder en de meeste werden niet in verband gebracht met overgevoeligheid. LEVAQUIN® moet onmiddellijk worden stopgezet als de patiënt tekenen en symptomen van hepatitis ontwikkelt [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Clostridium Difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder LEVAQUIN®, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Passend vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Verlenging van het QT-interval
Sommige fluoroquinolonen, waaronder LEVAQUIN®, zijn in verband gebracht met verlenging van het QT-interval op het elektrocardiogram en zeldzame gevallen van aritmie. Zeldzame gevallen van torsade de pointes zijn spontaan gemeld tijdens postmarketingsurveillance bij patiënten die fluorochinolonen kregen, waaronder LEVAQUIN®. LEVAQUIN® moet worden vermeden bij patiënten met bekende verlenging van het QT-interval, patiënten met niet-gecorrigeerde hypokaliëmie en patiënten die klasse IA (kinidine, procaïnamide) of klasse III (amiodaron, sotalol) anti-aritmica krijgen. Oudere patiënten kunnen gevoeliger zijn voor geneesmiddelgerelateerde effecten op het QT-interval [zie: ONGEWENSTE REACTIES , Gebruik bij specifieke populaties , en PATIËNT INFORMATIE ].
Aandoeningen van het bewegingsapparaat bij pediatrische patiënten en arthropathische effecten bij dieren
LEVAQUIN® is bij pediatrische patiënten (6 maanden en ouder) alleen geïndiceerd voor de preventie van miltvuur door inademing (post-expositie) en voor de pest [zie INDICATIES ]. Een verhoogde incidentie van musculoskeletale aandoeningen (artralgie, artritis, tendinopathie en gangafwijking) is waargenomen in vergelijking met controles bij pediatrische patiënten die LEVAQUIN® kregen [zie Gebruik bij specifieke populaties ].
Bij onvolgroeide ratten en honden resulteerde de orale en intraveneuze toediening van levofloxacine in verhoogde osteochondrose. Histopathologisch onderzoek van de gewichtdragende gewrichten van onvolgroeide honden die levofloxacine kregen toegediend, onthulde aanhoudende laesies van het kraakbeen. Andere fluoroquinolonen veroorzaken ook soortgelijke erosies in de gewichtdragende gewrichten en andere tekenen van artropathie bij onvolgroeide dieren van verschillende soorten [zie Dierlijke farmacologie ].
Bloedglucosestoornissen
Net als bij andere fluorochinolonen zijn er met LEVAQUIN® stoornissen van de bloedglucose, waaronder symptomatische hyper- en hypoglykemie, gemeld, meestal bij diabetespatiënten die gelijktijdig worden behandeld met een oraal bloedglucoseverlagend middel (bijv. glyburide) of met insuline. Bij deze patiënten wordt zorgvuldige controle van de bloedglucose aanbevolen. Als een hypoglykemische reactie optreedt bij een patiënt die wordt behandeld met LEVAQUIN®, moet LEVAQUIN® worden stopgezet en moet onmiddellijk een geschikte therapie worden gestart [zie ONGEWENSTE REACTIES , DRUG-INTERACTIES en PATIËNT INFORMATIE ].
Lichtgevoeligheid/fototoxiciteit
Matige tot ernstige fotosensibiliteits-/fototoxiciteitsreacties, waarvan de laatste zich kan manifesteren als overdreven zonnebrandreacties (bijv. branderig gevoel, erytheem, exsudatie, blaasjes, blaarvorming, oedeem) waarbij delen zijn blootgesteld die aan licht zijn blootgesteld (meestal het gezicht, "V"-gebied van de nek , extensoroppervlakken van de onderarmen, dorsa van de handen), kunnen in verband worden gebracht met het gebruik van fluoroquinolonen na blootstelling aan de zon of UV-licht. Daarom moet overmatige blootstelling aan deze lichtbronnen worden vermeden. Medicamenteuze therapie moet worden stopgezet als fotosensitiviteit/fototoxiciteit optreedt [zie ONGEWENSTE REACTIES en PATIËNT INFORMATIE ].
Ontwikkeling van geneesmiddelresistente bacteriën
Het voorschrijven van LEVAQUIN® bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën [zie PATIËNT INFORMATIE ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Ernstige bijwerkingen
Adviseer patiënten om te stoppen met het gebruik van LEVAQUIN® als ze een bijwerking ervaren en om hun zorgverlener te bellen voor advies over het voltooien van de volledige behandelingskuur met een ander antibacterieel geneesmiddel.
Informeer patiënten over de volgende ernstige bijwerkingen die in verband zijn gebracht met het gebruik van LEVAQUIN® of ander fluorochinolonen:
- Uitschakelen en mogelijk onomkeerbare ernstige bijwerkingen die samen kunnen optreden: Informeer patiënten dat invaliderende en mogelijk onomkeerbare ernstige bijwerkingen, waaronder tendinitis en peesruptuur, perifere neuropathieën en effecten op het centrale zenuwstelsel, in verband zijn gebracht met het gebruik van LEVAQUIN® en samen bij dezelfde patiënt kunnen voorkomen. Informeer patiënten om onmiddellijk te stoppen met het gebruik van LEVAQUIN® als ze een bijwerking ervaren en om hun zorgverlener te bellen.
- Tendinitis en peesruptuur: Instrueer patiënten om contact op te nemen met hun zorgverlener als ze pijn, zwelling of ontsteking van een pees, of zwakte of onvermogen om een van hun gewrichten te gebruiken, ervaren; rust en onthoud van lichaamsbeweging; en stop de behandeling met LEVAQUIN®. Symptomen kunnen onomkeerbaar zijn. Het risico op ernstige peesaandoeningen met fluorochinolonen is hoger bij oudere patiënten, gewoonlijk ouder dan 60 jaar, bij patiënten die corticosteroïden gebruiken en bij patiënten met nier-, hart- of longtransplantaties.
- Perifere neuropathie: Informeer patiënten dat perifere neuropathieën in verband zijn gebracht met het gebruik van levofloxacine. De symptomen kunnen kort na het starten van de therapie optreden en kunnen onomkeerbaar zijn. Als zich symptomen van perifere neuropathie ontwikkelen, waaronder pijn, branderig gevoel, tintelingen, gevoelloosheid en/of zwakte, stop dan onmiddellijk met LEVAQUIN® en vertel hen dat ze contact moeten opnemen met hun arts.
- Effecten op het centrale zenuwstelsel (bijvoorbeeld convulsies, duizeligheid, licht gevoel in het hoofd, verhoogde intracraniale druk): Informeer patiënten dat convulsies zijn gemeld bij patiënten die fluorochinolonen kregen, waaronder levofloxacine. Instrueer patiënten om hun arts op de hoogte te stellen voordat ze dit medicijn gebruiken als ze een voorgeschiedenis van convulsies hebben. Informeer patiënten dat ze moeten weten hoe ze op LEVAQUIN® reageren voordat ze een auto of machine bedienen of andere activiteiten ondernemen die mentale alertheid en coördinatie vereisen. Instrueer patiënten om hun arts op de hoogte te stellen als aanhoudende hoofdpijn met of zonder wazig zicht optreedt.
- Exacerbatie van Myasthenia Gravis: Instrueer patiënten om hun arts te informeren over een voorgeschiedenis van myasthenia gravis. Instrueer patiënten om hun arts op de hoogte te stellen als ze symptomen van spierzwakte ervaren, waaronder ademhalingsmoeilijkheden.
- Overgevoeligheidsreacties: Informeer patiënten dat levofloxacine overgevoeligheidsreacties kan veroorzaken, zelfs na een enkele dosis, en stop het gebruik van het geneesmiddel bij het eerste teken van huiduitslag, netelroos of andere huidreacties, een snelle hartslag, moeite met slikken of ademen, zwelling die wijst op angio-oedeem ( bijvoorbeeld zwelling van de lippen, tong, gezicht, beklemd gevoel in de keel, heesheid) of andere symptomen van een allergische reactie.
- Levertoxiciteit: Informeer patiënten dat ernstige hepatotoxiciteit (inclusief acute hepatitis en fatale gebeurtenissen) is gemeld bij patiënten die LEVAQUIN® gebruiken. Instrueer patiënten om hun arts te informeren als ze tekenen of symptomen van leverbeschadiging ervaren, waaronder: verlies van eetlust, misselijkheid, braken, koorts, zwakte, vermoeidheid, gevoeligheid van het rechter bovenste kwadrant, jeuk, gele verkleuring van de huid en ogen, lichtgekleurde stoelgang of donkergekleurde urine.
- Diarree: Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, instrueer patiënten om zo snel mogelijk contact op te nemen met hun arts.
- Verlenging van het QT-interval: Instrueer patiënten om hun arts te informeren over elke persoonlijke of familiegeschiedenis van QT-verlenging of pro-aritmische aandoeningen zoals hypokaliëmie, bradycardie of recente myocardischemie; als ze een klasse IA (kinidine, procaïnamide) of klasse III (amiodaron, sotalol) anti-aritmica gebruiken. Instrueer patiënten om hun arts op de hoogte te stellen als ze symptomen van verlenging van het QT-interval hebben, waaronder langdurige hartkloppingen of bewustzijnsverlies.
- Aandoeningen van het bewegingsapparaat bij pediatrische patiënten: Instrueer ouders om de arts van hun kind op de hoogte te stellen als het kind in het verleden gewrichtsproblemen heeft gehad voordat dit medicijn wordt gebruikt. Informeer ouders van pediatrische patiënten om de arts van hun kind op de hoogte te stellen van gewrichtsproblemen die optreden tijdens of na behandeling met levofloxacine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
- Lichtgevoeligheid/fototoxiciteit: Informeer patiënten dat fotosensitiviteit/fototoxiciteit is gemeld bij patiënten die fluorochinolonen kregen. Informeer patiënten om blootstelling aan natuurlijk of kunstmatig zonlicht (zonnebanken of UVA/B-behandeling) te minimaliseren of te vermijden tijdens het gebruik van fluoroquinolonen. Als patiënten buitenshuis moeten zijn tijdens het gebruik van fluorochinolonen, instrueer hen dan om loszittende kleding te dragen die de huid tegen blootstelling aan de zon beschermt en bespreek andere zonbeschermingsmaatregelen met hun arts. Als een zonnebrandachtige reactie of huiduitslag optreedt, instrueer patiënten om contact op te nemen met hun arts.
Antibacteriële resistentie
Antibacteriële geneesmiddelen, waaronder LEVAQUIN®, mogen alleen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer LEVAQUIN® wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënten worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met LEVAQUIN® of andere antibacteriële geneesmiddelen kunnen worden behandeld.
Toediening met voedsel, vloeistoffen en gelijktijdige medicatie
Patiënten moeten worden geïnformeerd dat LEVAQUIN® tabletten met of zonder voedsel kunnen worden ingenomen. De tabletten moeten elke dag op hetzelfde tijdstip worden ingenomen.
Patiënten dienen royaal te drinken tijdens het gebruik van LEVAQUIN® om de vorming van sterk geconcentreerde urine en kristalvorming in de urine te voorkomen.
Antacida die magnesium of aluminium bevatten, evenals sucralfaat, metaalkationen zoals ijzer en multivitaminepreparaten met zink of didanosine moeten ten minste twee uur vóór of twee uur na orale toediening van LEVAQUIN® worden ingenomen.
Geneesmiddelinteracties met insuline, orale hypoglycemische middelen en warfarine
Patiënten moeten worden geïnformeerd dat als ze diabetes hebben en worden behandeld met insuline of een oraal bloedglucoseverlagend middel en er een hypoglykemische reactie optreedt, ze moeten stoppen met LEVAQUIN® en een arts moeten raadplegen.
Patiënten moeten worden geïnformeerd dat gelijktijdige toediening van warfarine en LEVAQUIN® in verband is gebracht met een toename van de International Normalised Ratio (INR) of protrombinetijd en klinische bloedingsepisodes. Patiënten dienen hun arts op de hoogte te stellen als ze warfarine gebruiken, gecontroleerd te worden op tekenen van bloedingen en hun antistollingstests nauwlettend te laten controleren wanneer ze gelijktijdig warfarine gebruiken.
Onderzoek naar pest en miltvuur
Patiënten die LEVAQUIN® voor deze aandoeningen krijgen, moeten worden geïnformeerd dat werkzaamheidsonderzoeken om ethische en haalbaarheidsredenen niet bij mensen kunnen worden uitgevoerd. Daarom was de goedkeuring voor deze aandoeningen gebaseerd op werkzaamheidsonderzoeken bij dieren.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een levenslange bioassay bij ratten vertoonde levofloxacine geen carcinogeen potentieel na dagelijkse toediening via de voeding gedurende 2 jaar; de hoogste dosis (100 mg/kg/dag) was 1,4 keer de hoogste aanbevolen dosis voor de mens (750 mg) op basis van het relatieve lichaamsoppervlak. Levofloxacine verkortte de tijd tot tumorontwikkeling van UV-geïnduceerde huidtumoren bij haarloze albino (Skh-1) muizen bij geen enkel dosisniveau van levofloxacine en was daarom niet fotocarcinogeen onder de omstandigheden van dit onderzoek. Dermale levofloxacineconcentraties bij de haarloze muizen varieerden van 25 tot 42 mcg/g bij de hoogste dosis levofloxacine (300 mg/kg/dag) die werd gebruikt in het fotocarcinogeniteitsonderzoek. Ter vergelijking: de dermale levofloxacineconcentraties bij mensen die 750 mg LEVAQUIN® kregen, waren gemiddeld ongeveer 11,8 mcg/g bij Cmax.
Levofloxacine was niet mutageen in de volgende testen: Ames bacteriële mutatietest (S. typhimurium en E. coli), CHO/HGPRT forward-mutatietest, muis micronucleus test, muis dominante letale test, rat ongeplande DNA-synthese test en de muis zusterchromatide uitwisselingstest. Het was positief in de in vitro chromosomale aberratie (CHL-cellijn) en zusterchromatidenuitwisseling (CHL/IU-cellijn) testen.
Levofloxacine veroorzaakte geen verslechtering van de vruchtbaarheid of het reproductievermogen bij ratten bij orale doses tot 360 mg/kg/dag, wat overeenkomt met 4,2 maal de hoogste aanbevolen dosis voor de mens op basis van het relatieve lichaamsoppervlak en intraveneuze doses tot 100 mg/kg/ dag, overeenkomend met 1,2 keer de hoogste aanbevolen dosis voor de mens op basis van het relatieve lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie C
Levofloxacine was niet teratogeen bij ratten in doses van wel 810 mg/kg/dag, wat overeenkomt met 9,4 keer de hoogste aanbevolen orale dosis voor mensen op basis van het relatieve lichaamsoppervlak. De orale dosis van 810 mg/kg/dag aan ratten veroorzaakte een verminderd foetaal lichaamsgewicht en verhoogde foetale mortaliteit. Er werd geen teratogeniteit waargenomen wanneer konijnen oraal werden gedoseerd tot wel 50 mg/kg/dag, wat overeenkomt met 1,1 maal de hoogste aanbevolen orale dosis voor mensen op basis van het relatieve lichaamsoppervlak.
Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. LEVAQUIN® mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven
Op basis van gegevens over andere fluorochinolonen en zeer beperkte gegevens over LEVAQUIN® kan worden aangenomen dat levofloxacine in de moedermelk wordt uitgescheiden. Vanwege het potentieel voor ernstige bijwerkingen van LEVAQUIN® bij zuigelingen die borstvoeding geven, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
Chinolonen, waaronder levofloxacine, veroorzaken artropathie en osteochondrose bij jonge dieren van verschillende soorten. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Dierlijke farmacologie ].
Inhalatie miltvuur (post-blootstelling)
Levofloxacine is geïndiceerd bij pediatrische patiënten van 6 maanden en ouder voor inhalatieantrax (postexpositie). De risico-batenbeoordeling geeft aan dat toediening van levofloxacine aan pediatrische patiënten geschikt is. De veiligheid van levofloxacine bij pediatrische patiënten die langer dan 14 dagen worden behandeld, is niet onderzocht [zie: INDICATIES , DOSERING EN ADMINISTRATIE en Klinische studies ].
Pest
Levofloxacine is geïndiceerd bij pediatrische patiënten van 6 maanden en ouder voor de behandeling van pest, waaronder longpest en septikemische pest veroorzaakt door Yersinia pestis (Y. pestis) en profylaxe voor pest. Werkzaamheidsstudies van LEVAQUIN® konden om ethische en haalbaarheidsredenen niet worden uitgevoerd bij mensen met longpest. Daarom was de goedkeuring van deze indicatie gebaseerd op een werkzaamheidsonderzoek bij dieren. De risico-batenbeoordeling geeft aan dat toediening van levofloxacine aan pediatrische patiënten geschikt is [zie: INDICATIES , DOSERING EN ADMINISTRATIE en Klinische studies ].
De veiligheid en werkzaamheid van LEVAQUIN® bij pediatrische patiënten jonger dan zes maanden zijn niet vastgesteld.
Farmacokinetiek na intraveneuze toediening
De farmacokinetiek van levofloxacine na een enkelvoudige intraveneuze dosis werd onderzocht bij pediatrische patiënten in de leeftijd van zes maanden tot 16 jaar. Pediatrische patiënten elimineerden levofloxacine sneller dan volwassen patiënten, wat resulteerde in lagere plasmablootstellingen dan volwassenen voor een bepaalde mg/kg-dosis [zie KLINISCHE FARMACOLOGIE en Klinische studies ].
Dosering bij pediatrische patiënten met inhalatie-anthrax of plaag
Voor de aanbevolen dosering van LEVAQUIN®-tabletten bij pediatrische patiënten met inhalatie-anthrax of pest, zie: DOSERING EN ADMINISTRATIE . LEVAQUIN®-tabletten kunnen niet worden toegediend aan pediatrische patiënten die minder dan 30 kg wegen vanwege de beperkingen van de beschikbare sterktes. Alternatieve formuleringen van levofloxacine kunnen worden overwogen voor pediatrische patiënten die minder dan 30 kg wegen.
Bijwerkingen
In klinische onderzoeken werden 1534 pediatrische patiënten (6 maanden tot 16 jaar) behandeld met orale en intraveneuze LEVAQUIN®. Pediatrische patiënten van 6 maanden tot 5 jaar kregen tweemaal daags LEVAQUIN® 10 mg/kg en pediatrische patiënten ouder dan 5 jaar kregen 10 mg/kg eenmaal daags (maximaal 500 mg per dag) gedurende ongeveer 10 dagen. LEVAQUIN®-tabletten kunnen alleen worden toegediend aan pediatrische patiënten met inhalatie-anthrax (post-expositie) of pest die 30 kg of meer wegen vanwege de beperkingen van de beschikbare sterktes [zie DOSERING EN ADMINISTRATIE ].
Een subgroep van pediatrische patiënten in de klinische onderzoeken (1340 LEVAQUIN®-behandeld en 893 niet-fluorchinolon-behandeld) nam deel aan een prospectieve, langetermijnsurveillancestudie om de incidentie van in het protocol gedefinieerde musculoskeletale aandoeningen (artralgie, artritis, tendinopathie, gangafwijkingen) te beoordelen ) gedurende 60 dagen en 1 jaar na de eerste dosis van het onderzoeksgeneesmiddel. Pediatrische patiënten die werden behandeld met LEVAQUIN® hadden een significant hogere incidentie van aandoeningen van het bewegingsapparaat in vergelijking met de kinderen die niet met fluoroquinolon werden behandeld, zoals weergegeven in tabel 7. LEVAQUIN®-tabletten kunnen alleen worden toegediend aan pediatrische patiënten met inhalatie-anthrax (post-expositie) of pest die 30 kg of meer wegen vanwege de beperkingen van de beschikbare sterktes [zie DOSERING EN ADMINISTRATIE ].
Artralgie was de meest voorkomende musculoskeletale aandoening in beide behandelingsgroepen. De meeste musculoskeletale aandoeningen in beide groepen hadden betrekking op meerdere gewichtdragende gewrichten. De stoornissen waren matig bij 8/46 (17%) kinderen en licht bij 35/46 (76%) met LEVAQUIN® behandelde pediatrische patiënten en de meeste werden behandeld met analgetica. De mediane tijd tot herstel was 7 dagen voor met LEVAQUIN® behandelde pediatrische patiënten en 9 voor niet-fluorchinolon behandelde kinderen (ongeveer 80% verdween binnen 2 maanden in beide groepen). Geen enkele pediatrische patiënt had een ernstige of ernstige aandoening en alle aandoeningen van het bewegingsapparaat verdwenen zonder gevolgen.
Braken en diarree waren de meest gemelde bijwerkingen, die in vergelijkbare frequentie voorkwamen bij de met LEVAQUIN® behandelde en niet-fluorchinolon-behandelde pediatrische patiënten.
Naast de bijwerkingen die zijn gemeld bij pediatrische patiënten in klinische onderzoeken, zijn bijwerkingen gemeld bij volwassenen tijdens klinische onderzoeken of postmarketingervaring [zie ONGEWENSTE REACTIES ] kan ook worden verwacht bij pediatrische patiënten.
Geriatrisch gebruik
Geriatrische patiënten lopen een verhoogd risico op het ontwikkelen van ernstige peesaandoeningen, waaronder peesruptuur, wanneer ze worden behandeld met een fluorochinolon zoals LEVAQUIN®. Dit risico is verder verhoogd bij patiënten die gelijktijdig behandeld worden met corticosteroïden. Tendinitis of peesruptuur kan betrekking hebben op de achillespees, hand, schouder of andere peesplaatsen en kan optreden tijdens of na voltooiing van de therapie; gevallen die tot enkele maanden na de behandeling met fluorochinolonen optraden, zijn gemeld. Voorzichtigheid is geboden bij het voorschrijven van LEVAQUIN® aan oudere patiënten, met name aan patiënten die corticosteroïden gebruiken. Patiënten moeten worden geïnformeerd over deze mogelijke bijwerking en geadviseerd worden om te stoppen met LEVAQUIN® en contact op te nemen met hun zorgverlener als er symptomen van tendinitis of peesruptuur optreden [zie DOOS WAARSCHUWING: ; WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ; en ONGEWENSTE REACTIES ].

In klinische fase 3-onderzoeken waren 1.945 met LEVAQUIN® behandelde patiënten (26%) ≥ 65 jaar oud. Hiervan waren 1.081 patiënten (14%) tussen 65 en 74 jaar oud en 864 patiënten (12%) waren 75 jaar of ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Ernstige en soms fatale gevallen van hepatotoxiciteit zijn postmarketing gemeld in verband met LEVAQUIN®. De meeste meldingen van fatale hepatotoxiciteit kwamen voor bij patiënten van 65 jaar of ouder en de meeste werden niet in verband gebracht met overgevoeligheid. LEVAQUIN® moet onmiddellijk worden stopgezet als de patiënt tekenen en symptomen van hepatitis ontwikkelt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Oudere patiënten kunnen gevoeliger zijn voor geneesmiddelgerelateerde effecten op het QT-interval. Daarom moeten voorzorgen worden genomen wanneer LEVAQUIN® gelijktijdig wordt gebruikt met geneesmiddelen die kunnen leiden tot verlenging van het QT-interval (bijv. Klasse IA of Klasse III antiaritmica) of bij patiënten met risicofactoren voor torsade de pointes (bijv. bekende QT-verlenging, ongecorrigeerde hypokaliëmie) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De farmacokinetische eigenschappen van levofloxacine bij jongere volwassenen en oudere volwassenen verschillen niet significant wanneer rekening wordt gehouden met de creatinineklaring. Aangezien echter bekend is dat het geneesmiddel grotendeels door de nieren wordt uitgescheiden, kan het risico op toxische reacties op dit geneesmiddel groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren [zie KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
De klaring van levofloxacine is aanzienlijk verminderd en de plasma-eliminatiehalfwaardetijd is aanzienlijk verlengd bij patiënten met een nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE ].
Leverfunctiestoornis
Er zijn geen farmacokinetische onderzoeken uitgevoerd bij patiënten met een leverfunctiestoornis. Vanwege de beperkte mate van levofloxacinemetabolisme wordt niet verwacht dat de farmacokinetiek van levofloxacine wordt beïnvloed door leverinsufficiëntie.
OVERDOSERING
Bij een acute overdosering dient de maag geleegd te worden. De patiënt moet worden geobserveerd en de juiste hydratatie moet worden gehandhaafd. Levofloxacine wordt niet efficiënt verwijderd door hemodialyse of peritoneale dialyse.
LEVAQUIN® vertoont een laag potentieel voor acute toxiciteit. Muizen, ratten, honden en apen vertoonden de volgende klinische symptomen na toediening van een enkele hoge dosis LEVAQUIN®: ataxie, ptosis, verminderde locomotorische activiteit, kortademigheid, uitputting, tremoren en convulsies. Doses van meer dan 1500 mg/kg oraal en 250 mg/kg IV veroorzaakten significante mortaliteit bij knaagdieren.
CONTRA-INDICATIES
LEVAQUIN® is gecontra-indiceerd bij personen met een bekende overgevoeligheid voor levofloxacine of andere antibacteriële chinolonen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Levofloxacine behoort tot de klasse van antibacteriële middelen van de fluorochinolonen [ zie Microbiologie ].
Farmacokinetiek
De gemiddelde ± SD farmacokinetische parameters van levofloxacine bepaald onder enkelvoudige en steady-state omstandigheden na toediening van de orale tabletten, zijn samengevat in Tabel 8.
De farmacokinetiek van levofloxacine is lineair en voorspelbaar na enkelvoudige en meervoudige orale of IV-doseringsregimes. Steady-state condities worden binnen 48 uur bereikt na een eenmaal daags doseringsschema van 500 mg of 750 mg. De gemiddelde ± SD piek- en dalplasmaconcentraties die werden bereikt na meerdere eenmaal daagse orale doseringsschema's waren ongeveer 5,7 ± 1,4 en 0,5 ± 0,2 mcg/ml na de doses van 500 mg en 8,6 ± 1,9 en 1,1 ± 0,4 mcg/ml na de 750 mg mg-doses, respectievelijk. De gemiddelde ± SD piek- en dalplasmaconcentraties die werden bereikt na meerdere eenmaal daagse IV-regimes waren ongeveer 6,4 ± 0,8 en 0,6 ± 0,2 mcg/ml na de doses van 500 mg en 12,1 ± 4,1 en 1,3 ± 0,71 mcg/ml na de 750 mg doses, respectievelijk.
Absorptie
Levofloxacine wordt na orale toediening snel en in wezen volledig geabsorbeerd. Piekplasmaconcentraties worden gewoonlijk één tot twee uur na orale toediening bereikt. De absolute biologische beschikbaarheid van levofloxacine uit een tablet van 500 mg en een tablet van 750 mg LEVAQUIN® is beide ongeveer 99%, wat een volledige orale absorptie van levofloxacine aantoont. Na een enkelvoudige intraveneuze dosis LEVAQUIN® aan gezonde vrijwilligers was de gemiddelde ± SD piekplasmaconcentratie die werd bereikt 6,2 ± 1,0 mcg/ml na een dosis van 500 mg toegediend gedurende 60 minuten en 11,5 ± 4,0 mcg/ml na een dosis van 750 mg toegediend over 90 minuten. Orale toediening van een dosis van 500 mg LEVAQUIN® met voedsel verlengt de tijd tot piekconcentratie met ongeveer 1 uur en verlaagt de piekconcentratie met ongeveer 14% na tablet en ongeveer 25% na toediening van de drank. Daarom kunnen LEVAQUIN®-tabletten zonder voedsel worden toegediend.
Het plasmaconcentratieprofiel van levofloxacine na intraveneuze toediening is vergelijkbaar en vergelijkbaar in mate van blootstelling (AUC) met dat waargenomen voor LEVAQUIN®-tabletten wanneer gelijke doses (mg/mg) worden toegediend. Daarom kunnen de orale en IV-toedieningsroutes als onderling uitwisselbaar worden beschouwd.
Verdeling
Het gemiddelde distributievolume van levofloxacine varieert over het algemeen van 74 tot 112 l na enkelvoudige en meervoudige doses van 500 mg of 750 mg, wat wijst op wijdverbreide distributie in lichaamsweefsels. Levofloxacine bereikt zijn piekwaarden in huidweefsels en in blaarvocht van gezonde proefpersonen ongeveer 3 uur na toediening. De AUC-verhouding van huidweefselbiopsie tot plasma is ongeveer 2 en de AUC-verhouding van blaarvocht tot plasma is ongeveer 1 na meervoudige eenmaal daagse orale toediening van respectievelijk 750 mg en 500 mg doses LEVAQUIN® aan gezonde proefpersonen. Levofloxacine dringt ook goed door in het longweefsel. De longweefselconcentraties waren over het algemeen 2 tot 5 keer hoger dan de plasmaconcentraties en varieerden van ongeveer 2,4 tot 11,3 mcg/g over een periode van 24 uur na een enkelvoudige orale dosis van 500 mg.
In vitro is levofloxacine over een klinisch relevant bereik (1 tot 10 mcg/ml) van serum/plasma-levofloxacineconcentraties voor ongeveer 24 tot 38% gebonden aan serumeiwitten bij alle onderzochte soorten, zoals bepaald met de evenwichtsdialysemethode. Levofloxacine wordt bij mensen voornamelijk gebonden aan serumalbumine. De binding van levofloxacine aan serumeiwitten is onafhankelijk van de geneesmiddelconcentratie.
Eliminatie
Metabolisme
Levofloxacine is stereochemisch stabiel in plasma en urine en wordt niet metabolisch omgezet in zijn enantiomeer, D-ofloxacine. Levofloxacine ondergaat een beperkt metabolisme bij de mens en wordt voornamelijk als onveranderd geneesmiddel in de urine uitgescheiden. Na orale toediening werd ongeveer 87% van een toegediende dosis binnen 48 uur als onveranderd geneesmiddel in de urine teruggevonden, terwijl minder dan 4% van de dosis binnen 72 uur in de feces werd teruggevonden. Minder dan 5% van een toegediende dosis werd in de urine teruggevonden als desmethyl- en N-oxidemetabolieten, de enige metabolieten die bij mensen zijn geïdentificeerd. Deze metabolieten hebben weinig relevante farmacologische activiteit.
uitscheiding
Levofloxacine wordt grotendeels als onveranderd geneesmiddel in de urine uitgescheiden. De gemiddelde terminale plasma-eliminatiehalfwaardetijd van levofloxacine varieert van ongeveer 6 tot 8 uur na enkelvoudige of meervoudige orale of intraveneuze doses levofloxacine. De gemiddelde schijnbare totale lichaamsklaring en renale klaring variëren van respectievelijk ongeveer 144 tot 226 ml/min en 96 tot 142 ml/min. Nierklaring boven de glomerulaire filtratiesnelheid suggereert dat tubulaire secretie van levofloxacine optreedt naast de glomerulaire filtratie. Gelijktijdige toediening van cimetidine of probenecide resulteert in respectievelijk ongeveer 24% en 35% verlaging van de renale klaring van levofloxacine, wat aangeeft dat secretie van levofloxacine plaatsvindt in de proximale niertubuli. Er werden geen levofloxacinekristallen gevonden in de urinemonsters die vers waren verzameld van proefpersonen die LEVAQUIN® kregen.
Specifieke populaties
Geriatrische patiënten
Er zijn geen significante verschillen in de farmacokinetiek van levofloxacine tussen jonge en oudere proefpersonen wanneer de proefpersonen ' Er wordt rekening gehouden met verschillen in creatinineklaring. Na een orale dosis LEVAQUIN® van 500 mg aan gezonde oudere proefpersonen (66-80 jaar) was de gemiddelde terminale plasma-eliminatiehalfwaardetijd van levofloxacine ongeveer 7,6 uur, vergeleken met ongeveer 6 uur bij jongere volwassenen. Het verschil was toe te schrijven aan de variatie in nierfunctiestatus van de proefpersonen en werd niet klinisch significant geacht. De absorptie van geneesmiddelen lijkt niet te worden beïnvloed door de leeftijd. LEVAQUIN® dosisaanpassing alleen op basis van leeftijd is niet nodig [zie Gebruik bij specifieke populaties ].
Pediatrische patiënten
De farmacokinetiek van levofloxacine na een enkele intraveneuze dosis van 7 mg/kg werd onderzocht bij pediatrische patiënten in de leeftijd van 6 maanden tot 16 jaar. Pediatrische patiënten elimineerden levofloxacine sneller dan volwassen patiënten, wat resulteerde in lagere plasmablootstellingen dan volwassenen bij een bepaalde mg/kg-dosis. Daaropvolgende farmacokinetische analyses voorspelden dat een doseringsschema van 8 mg/kg om de 12 uur (niet meer dan 250 mg per dosis) voor pediatrische patiënten van 6 maanden tot 17 jaar zou leiden tot vergelijkbare steady-state plasmablootstellingen (AUC0-24 en Cmax) als die waargenomen bij volwassen patiënten die eenmaal per 24 uur 500 mg levofloxacine kregen toegediend. LEVAQUIN®-tabletten kunnen alleen worden toegediend aan pediatrische patiënten met inhalatie-anthrax (post-expositie) of pest die 30 kg of meer wegen vanwege de beperkingen van de beschikbare sterktes [zie DOSERING EN ADMINISTRATIE ].
Mannelijke en vrouwelijke onderwerpen
Er zijn geen significante verschillen in de farmacokinetiek van levofloxacine tussen mannelijke en vrouwelijke proefpersonen wanneer proefpersonen' Er wordt rekening gehouden met verschillen in creatinineklaring. Na een orale dosis van 500 mg LEVAQUIN® aan gezonde mannelijke proefpersonen was de gemiddelde terminale plasma-eliminatiehalfwaardetijd van levofloxacine ongeveer 7,5 uur, vergeleken met ongeveer 6,1 uur bij vrouwelijke proefpersonen. Dit verschil was toe te schrijven aan de variatie in nierfunctiestatus van de mannelijke en vrouwelijke proefpersonen en werd niet klinisch significant geacht. De absorptie van geneesmiddelen lijkt niet te worden beïnvloed door het geslacht van de proefpersonen. Dosisaanpassing alleen op basis van geslacht is niet nodig.
Raciale of etnische groepen
Het effect van ras op de farmacokinetiek van levofloxacine werd onderzocht door middel van een covariabele analyse die werd uitgevoerd op gegevens van 72 proefpersonen: 48 blank en 24 niet-blank. De schijnbare totale lichaamsklaring en het schijnbare distributievolume werden niet beïnvloed door het ras van de proefpersonen.
Patiënten met nierinsufficiëntie
De klaring van levofloxacine is aanzienlijk verminderd en de plasma-eliminatiehalfwaardetijd is aanzienlijk verlengd bij volwassen patiënten met een verminderde nierfunctie (creatinineklaring DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Patiënten met leverinsufficiëntie
Er zijn geen farmacokinetische onderzoeken uitgevoerd bij patiënten met een leverfunctiestoornis. Vanwege de beperkte mate van metabolisme van levofloxacine wordt niet verwacht dat de farmacokinetiek van levofloxacine wordt beïnvloed door leverinsufficiëntie [zie Gebruik bij specifieke populaties ].
Patiënten met bacteriële infectie
De farmacokinetiek van levofloxacine bij patiënten met ernstige buiten het ziekenhuis opgelopen bacteriële infecties is vergelijkbaar met die waargenomen bij gezonde proefpersonen.
Geneesmiddelinteractiestudies
Het potentieel voor farmacokinetische geneesmiddelinteracties tussen LEVAQUIN® en antacida, warfarine, theofylline, cyclosporine, digoxine, probenecide en cimetidine is geëvalueerd [zie DRUG-INTERACTIES ].
Microbiologie
Werkingsmechanisme
Levofloxacine is het L-isomeer van het racemaat, ofloxacine, een antimicrobieel middel voor chinolonen. De antibacteriële activiteit van ofloxacine zit voornamelijk in het L-isomeer. Het werkingsmechanisme van levofloxacine en andere antimicrobiële middelen van fluorochinolonen omvat de remming van bacteriële topoisomerase IV en DNA-gyrase (beide type II-topoisomerasen), enzymen die nodig zijn voor DNA-replicatie, transcriptie, herstel en recombinatie.
Weerstand
Fluorochinolonresistentie kan ontstaan door mutaties in gedefinieerde regio's van DNA-gyrase of topoisomerase IV, de zogenaamde quinolone-resistentie-bepalende regio's (QRDR's), of door veranderde efflux.
Fluoroquinolonen, waaronder levofloxacine, verschillen in chemische structuur en werkingsmechanisme van aminoglycosiden, macroliden en β-lactam-antibiotica, waaronder penicillines. Fluoroquinolonen kunnen daarom actief zijn tegen bacteriën die resistent zijn tegen deze antimicrobiële stoffen.
Resistentie tegen levofloxacine als gevolg van spontane mutatie in vitro komt zelden voor (bereik: 10-9 tot 10-10). Er is kruisresistentie waargenomen tussen levofloxacine en sommige andere fluoroquinolonen, sommige micro-organismen die resistent zijn tegen andere fluoroquinolonen kunnen gevoelig zijn voor levofloxacine.
Antimicrobiale activiteit
Levofloxacine heeft in vitro activiteit tegen Gram-negatieve en Gram-positieve bacteriën.
Van levofloxacine is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties, zoals beschreven in zie INDICATIES :
Aërobe bacteriën
Gram-positieve bacteriën
Enterococcus faecalisStaphylococcus aureus (meticilline-gevoelige isolaten)Staphylococcus epidermidis (methicilline-gevoelige isolaten)Staphylococcus saprophyticusStreptococcus pneumoniae (inclusief multi-drug-resistente isolaten [MDRSP]1)Streptococcus pyogenes
Gram-negatieve bacteriën
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Andere micro-organismen
Chlamydophila pneumoniaeMycoplasma pneumoniae
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is onbekend: Levofloxacine vertoont in vitro minimale remmende concentraties (MIC-waarden) van 2 mcg/ml of minder tegen de meeste (≥90%) isolaten van de volgende micro-organismen; de veiligheid en effectiviteit van LEVAQUIN® bij de behandeling van klinische infecties veroorzaakt door deze bacteriën zijn echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
MDRSP-isolaten (Multi-drug-resistente Streptococcus pneumoniae) zijn isolaten die resistent zijn tegen twee of meer van de volgende antibiotica: penicilline (MIC ≥2 mcg/ml), cefalosporines van de 2e generatie, bijv. cefuroxim; macroliden, tetracyclines en trimethoprim/sulfamethoxazol.
Aërobe bacteriën
Gram-positieve bacteriën
Staphylococcus haemolyticusβ-hemolytische Streptococcus (Groep C/F)β-hemolytische Streptococcus (Groep G)Streptococcus agalactiaeStreptococcus milleriViridans group streptococciBacillus anthracis
Gram-negatieve bacteriën
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisgerProvidencia retttoma
Anaërobe bacteriën
Gram-positieve bacteriën
Clostridium perfringens
Gevoeligheidstests
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Dierlijke toxicologie en/of farmacologie
Van levofloxacine en andere chinolonen is aangetoond dat ze artropathie veroorzaken bij onvolgroeide dieren van de meeste geteste soorten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Bij onvolgroeide honden (4-5 maanden oud) resulteerden orale doses van 10 mg/kg/dag gedurende 7 dagen en intraveneuze doses van 4 mg/kg/dag gedurende 14 dagen van levofloxacine in artropathische laesies. Toediening van orale doses van 300 mg/kg/dag gedurende 7 dagen en intraveneuze doses van 60 mg/kg/dag gedurende 4 weken veroorzaakten artropathie bij juveniele ratten. Beagle-honden van drie maanden oud die oraal werden gedoseerd met levofloxacine van 40 mg/kg/dag, vertoonden klinisch ernstige artrotoxiciteit, resulterend in stopzetting van de dosering op dag 8 van een 14-daagse doseringsroutine. Lichte musculoskeletale klinische effecten, bij afwezigheid van grove pathologische of histopathologische effecten, waren het gevolg van het laagste dosisniveau van 2,5 mg/kg/dag (ongeveer 0,2 maal de pediatrische dosis op basis van AUC-vergelijkingen). Synovitis en gewrichtskraakbeenletsels werden waargenomen bij de dosisniveaus van 10 en 40 mg/kg (respectievelijk ongeveer 0,7 maal en 2,4 maal de pediatrische dosis, gebaseerd op AUC-vergelijkingen). De grove pathologie en histopathologie van het gewrichtskraakbeen hielden aan tot het einde van de herstelperiode van 18 weken voor die honden van de dosisniveaus van 10 en 40 mg/kg/dag.
Bij testen in een bioassay met zwelling van de oren van muizen, vertoonde levofloxacine een fototoxiciteit die vergelijkbaar was met die van ofloxacine, maar minder fototoxiciteit dan andere chinolonen.
Hoewel kristalurie is waargenomen in sommige intraveneuze onderzoeken bij ratten, worden er geen urinekristallen gevormd in de blaas, die alleen aanwezig zijn na mictie en niet geassocieerd zijn met nefrotoxiciteit.
Bij muizen wordt het CZS-stimulerende effect van chinolonen versterkt door gelijktijdige toediening van niet-steroïde anti-inflammatoire geneesmiddelen.
Bij honden veroorzaakte levofloxacine, toegediend in een dosis van 6 mg/kg of hoger door snelle intraveneuze injectie, hypotensieve effecten. Deze effecten werden geacht verband te houden met de afgifte van histamine.
In-vitro- en in-vivo-onderzoeken bij dieren geven aan dat levofloxacine geen enzyminductor of remmer is in het therapeutische plasmaconcentratiebereik bij de mens; daarom worden er geen geneesmiddelmetaboliserende enzymgerelateerde interacties met andere geneesmiddelen of middelen verwacht.
Klinische studies
Nosocomiale pneumonie
Volwassen patiënten met klinisch en radiologisch gedocumenteerde nosocomiale pneumonie werden opgenomen in een multicenter, gerandomiseerde, open-label studie waarin intraveneuze LEVAQUIN® (750 mg eenmaal daags) werd vergeleken met orale LEVAQUIN® (750 mg eenmaal daags) gedurende in totaal 7-15 dagen op intraveneuze imipenem/cilastatine (500-1000 mg elke 6-8 uur per dag) gevolgd door orale ciprofloxacine (750 mg elke 12 uur per dag) gedurende in totaal 7-15 dagen. Met LEVAQUIN® behandelde patiënten kregen gemiddeld 7 dagen intraveneuze therapie (bereik: 1-16 dagen); met een vergelijkingsmiddel behandelde patiënten kregen gemiddeld 8 dagen intraveneuze therapie (bereik: 1-19 dagen).
Over het algemeen werd in de klinisch en microbiologisch evalueerbare populatie adjuvante therapie empirisch gestart bij aanvang van de studie bij 56 van de 93 (60,2%) patiënten in de LEVAQUIN®-arm en 53 van de 94 (56,4%) patiënten in de vergelijkingsarm. De gemiddelde duur van aanvullende therapie was 7 dagen in de LEVAQUIN®-arm en 7 dagen in de comparator. Bij klinisch en microbiologisch evalueerbare patiënten met gedocumenteerde Pseudomonas aeruginosa-infectie kregen 15 van de 17 (88,2%) ceftazidim (N = 11) of piperacilline/tazobactam (N = 4) in de LEVAQUIN®-arm en 16 van de 17 (94,1%) kregen een aminoglycoside in de vergelijkingsarm. In totaal werd bij klinisch en microbiologisch evalueerbare patiënten vancomycine toegevoegd aan het behandelingsschema van 37 van de 93 (39,8%) patiënten in de LEVAQUIN®-arm en 28 van de 94 (29,8%) patiënten in de vergelijkingsarm voor vermoede meticilline-resistente S. aureus infectie.
Klinische succespercentages bij klinisch en microbiologisch evalueerbare patiënten bij het bezoek na de therapie (primair eindpunt van de studie beoordeeld op dag 3-15 na voltooiing van de therapie) waren 58,1% voor LEVAQUIN® en 60,6% voor comparator. Het 95%-BI voor het verschil in responspercentages (LEVAQUIN® minus comparator) was [-17,2, 12,0]. De microbiologische uitroeiingspercentages bij het posttherapiebezoek waren 66,7% voor LEVAQUIN® en 60,6% voor de comparator. Het 95%-BI voor het verschil in uitroeiingspercentages (LEVAQUIN® minus comparator) was [-8,3, 20,3]. Klinisch succes en microbiologische uitroeiingspercentages per pathogeen worden beschreven in tabel 9.
Gemeenschap verworven pneumonie
Behandelingsschema van 7-14 dagen
Volwassen klinische en poliklinische patiënten met een diagnose van buiten het ziekenhuis opgelopen bacteriële pneumonie werden geëvalueerd in 2 centrale klinische onderzoeken. In de eerste studie werden 590 patiënten geïncludeerd in een prospectieve, multicenter, niet-geblindeerde, gerandomiseerde studie waarin LEVAQUIN® 500 mg eenmaal daags oraal of intraveneus gedurende 7 tot 14 dagen werd vergeleken met ceftriaxon 1 tot 2 gram intraveneus eenmaal of in gelijk verdeelde doses tweemaal daags gevolgd door cefuroximaxetil 500 mg tweemaal daags oraal gedurende in totaal 7 tot 14 dagen. Patiënten die waren toegewezen aan behandeling met het controleregime mochten erytromycine krijgen (of doxycycline als ze erytromycine niet verdroegen) als een infectie door atypische pathogenen werd vermoed of bewezen. Klinische en microbiologische evaluaties werden uitgevoerd tijdens de behandeling, 5 tot 7 dagen na de therapie en 3 tot 4 weken na de therapie. Klinisch succes (genezing plus verbetering) met LEVAQUIN® 5 tot 7 dagen na therapie, de primaire werkzaamheidsvariabele in deze studie, was superieur (95%) aan de controlegroep (83%). Het 95%-BI voor het verschil in responspercentages (LEVAQUIN® minus comparator) was [-6, 19]. In de tweede studie namen 264 patiënten deel aan een prospectieve, multicenter, niet-vergelijkende studie van 500 mg LEVAQUIN® eenmaal daags oraal of intraveneus toegediend gedurende 7 tot 14 dagen. Klinisch succes voor klinisch evalueerbare patiënten was 93%. Voor beide onderzoeken was het klinische succespercentage bij patiënten met atypische pneumonie als gevolg van Chlamydophila pneumoniae, Mycoplasma pneumoniae en Legionella pneumophila respectievelijk 96%, 96% en 70%. De microbiologische uitroeiingspercentages in beide onderzoeken worden weergegeven in tabel 10.
Door de gemeenschap verworven pneumonie door multiresistente Streptococcus Pneumoniae
LEVAQUIN® was effectief voor de behandeling van buiten het ziekenhuis opgelopen pneumonie veroorzaakt door multiresistente Streptococcus pneumoniae (MDRSP). MDRSP-isolaten zijn isolaten die resistent zijn tegen twee of meer van de volgende antibacteriële middelen: penicilline (MIC ≥2 mcg/ml), cefalosporines van de 2e generatie (bijv. cefuroxim, macroliden, tetracyclines en trimethoprim/sulfamethoxazol). Van 40 microbiologisch evalueerbare patiënten met MDRSP-isolaten, behaalden 38 patiënten (95,0%) klinisch en bacteriologisch succes na de therapie. De klinische en bacteriële succespercentages worden weergegeven in Tabel 11.
Niet alle isolaten waren resistent tegen alle geteste antimicrobiële klassen. De succes- en uitroeiingspercentages zijn samengevat in tabel 12.
Gemeenschap verworven pneumonie
5-daagse behandelingsregime
Om de veiligheid en werkzaamheid van de hogere dosis en kortere kuur van LEVAQUIN® te evalueren, werden 528 poliklinische en gehospitaliseerde volwassenen met klinisch en radiologisch bepaalde milde tot ernstige buiten het ziekenhuis opgelopen pneumonie geëvalueerd in een dubbelblinde, gerandomiseerde, prospectieve, multicenter studie waarin LEVAQUIN werd vergeleken. ® 750 mg, IV of oraal, elke dag gedurende vijf dagen of LEVAQUIN® 500 mg IV of oraal, elke dag gedurende 10 dagen.
Klinische succespercentages (genezing plus verbetering) in de klinisch evalueerbare populatie waren 90,9% in de LEVAQUIN® 750 mg-groep en 91,1% in de LEVAQUIN® 500 mg-groep. Het 95%-BI voor het verschil in responspercentages (LEVAQUIN® 750 minus LEVAQUIN® 500) was [-5,9; 5,4]. In de klinisch evalueerbare populatie (31-38 dagen na opname) werd pneumonie waargenomen bij 7 van de 151 patiënten in de LEVAQUIN® 750 mg-groep en 2 van de 147 patiënten in de LEVAQUIN® 500 mg-groep. Gezien de kleine aantallen die zijn waargenomen, kan de significantie van deze bevinding niet statistisch worden bepaald. De microbiologische werkzaamheid van het 5-daagse regime is gedocumenteerd voor infecties die worden vermeld in Tabel 13.
Acute bacteriële sinusitis
5-daagse en 10-14-daagse behandelingsregimes
LEVAQUIN® is goedgekeurd voor de behandeling van acute bacteriële sinusitis (ABS) bij gebruik van 750 mg oraal × 5 dagen of 500 mg oraal eenmaal daags × 10-14 dagen. Om de veiligheid en werkzaamheid van een hoge dosis korte kuur LEVAQUIN® te evalueren, werden 780 poliklinische volwassenen met klinisch en radiologisch bepaalde acute bacteriële sinusitis geëvalueerd in een dubbelblinde, gerandomiseerde, prospectieve, multicenter studie waarin LEVAQUIN® 750 mg eenmaal daags via de mond werd vergeleken gedurende vijf dagen tot LEVAQUIN® 500 mg via de mond eenmaal daags gedurende 10 dagen.
Klinische succespercentages (gedefinieerd als volledige of gedeeltelijke verdwijning van de tekenen en symptomen van ABS vóór de behandeling in een zodanige mate dat verdere antibioticabehandeling niet nodig werd geacht) in de microbiologisch evalueerbare populatie waren 91,4% (139/152) in de LEVAQUIN® 750 mg-groep en 88,6% (132/149) in de LEVAQUIN® 500 mg-groep bij het test-of-cure (TOC) bezoek (95% BI [-4,2; 10,0] voor LEVAQUIN® 750 mg minus LEVAQUIN® 500 mg) .
De percentages van klinisch succes door pathogeen in de microbiologisch evalueerbare populatie die monsters hadden verkregen door antrale tap bij aanvang van de studie, vertoonden vergelijkbare resultaten voor de vijf- en tiendaagse regimes bij het test-of-cure-bezoek 22 dagen na de behandeling (zie tabel 14) .
Gecompliceerde huid- en huidstructuurinfecties
Driehonderd negenennegentig patiënten werden geïncludeerd in een open-label, gerandomiseerde, vergelijkende studie voor gecompliceerde huid- en huidstructuurinfecties. De patiënten werden gerandomiseerd om ofwel LEVAQUIN® 750 mg eenmaal daags (IV gevolgd door oraal) of een goedgekeurde comparator te krijgen voor een mediaan van 10 ± 4,7 dagen. Zoals te verwachten is bij gecompliceerde huid- en huidstructuurinfecties, werden chirurgische ingrepen uitgevoerd in de LEVAQUIN®- en vergelijkingsgroepen. Chirurgie (incisie en drainage of debridement) werd uitgevoerd bij 45% van de met LEVAQUIN® behandelde patiënten en 44% van de met de comparator behandelde patiënten, kort voor of tijdens de antibioticabehandeling en vormde een integraal onderdeel van de therapie voor deze indicatie.
Van degenen die 2-5 dagen na voltooiing van het onderzoeksgeneesmiddel klinisch konden worden geëvalueerd, waren de algehele succespercentages (verbeterd of genezen) 116/138 (84,1%) voor patiënten behandeld met LEVAQUIN® en 106/132 (80,3%) voor behandelde patiënten met de vergelijker.
Succespercentages varieerden met het type diagnose, variërend van 68% bij patiënten met geïnfecteerde zweren tot 90% bij patiënten met geïnfecteerde wonden en abcessen. Deze percentages waren gelijk aan die bij vergelijkingsgeneesmiddelen.
Chronische bacteriële prostatitis
Volwassen patiënten met een klinische diagnose van prostatitis en microbiologische kweekresultaten van urinemonsters verzameld na prostaatmassage (VB3) of monsters van uitgedrukte prostaatsecretie (EPS) verkregen via de Meares-Stamey-procedure werden opgenomen in een multicenter, gerandomiseerd, dubbelblind onderzoek waarin oraal LEVAQUIN® 500 mg, eenmaal daags gedurende in totaal 28 dagen tot oraal ciprofloxacine 500 mg, tweemaal daags gedurende in totaal 28 dagen. Het primaire werkzaamheidseindpunt was de microbiologische werkzaamheid bij microbiologisch evalueerbare patiënten. In totaal werden 136 en 125 microbiologisch evalueerbare patiënten geïncludeerd in respectievelijk de LEVAQUIN®- en ciprofloxacine-groepen. Het microbiologische uitroeiingspercentage door infectie van de patiënt op 5-18 dagen na voltooiing van de therapie was 75,0% in de LEVAQUIN®-groep en 76,8% in de ciprofloxacinegroep (95% BI [-12,58, 8,98] voor LEVAQUIN® minus ciprofloxacine). De totale uitroeiingspercentages voor pathogenen die van belang zijn, worden weergegeven in tabel 15.
Uitroeiingspercentages voor S. epidermidis, wanneer gevonden met andere co-pathogenen, komen overeen met percentages die worden waargenomen bij zuivere isolaten.
Klinische succespercentages (genezing + verbetering zonder noodzaak voor verdere antibioticatherapie) in de microbiologisch evalueerbare populatie 5-18 dagen na voltooiing van de therapie waren 75,0% voor met LEVAQUIN® behandelde patiënten en 72,8% voor met ciprofloxacine behandelde patiënten (95% BI [- 8,87, 13,27] voor LEVAQUIN® minus ciprofloxacine). Klinische succespercentages op lange termijn (24-45 dagen na voltooiing van de therapie) waren 66,7% voor de met LEVAQUIN® behandelde patiënten en 76,9% voor de met ciprofloxacine behandelde patiënten (95% BI [-23,40, 2,89] voor LEVAQUIN® minus ciprofloxacine).
Gecompliceerde urineweginfecties en acute pyelonefritis
5-daagse behandelingsregime
Om de veiligheid en werkzaamheid van de hogere dosis en kortere kuur van LEVAQUIN® te evalueren, werden 1109 patiënten met cUTI en AP ingeschreven in een gerandomiseerde, dubbelblinde, multicenter klinische studie uitgevoerd in de VS van november 2004 tot april 2006, waarbij LEVAQUIN® 750 werd vergeleken. mg IV of oraal eenmaal daags gedurende 5 dagen (546 patiënten) met ciprofloxacine 400 mg IV of 500 mg oraal tweemaal daags gedurende 10 dagen (563 patiënten). Patiënten met AP gecompliceerd door onderliggende nierziekten of aandoeningen zoals volledige obstructie, chirurgie, transplantatie, gelijktijdige infectie of aangeboren misvorming werden uitgesloten. De werkzaamheid werd gemeten door bacteriologische uitroeiing van het (de) baseline-organisme(n) tijdens het posttherapiebezoek bij patiënten met een pathogeen dat bij baseline werd geïdentificeerd. Het bezoek na de therapie (test-of-cure) vond plaats 10 tot 14 dagen na de laatste actieve dosis LEVAQUIN® en 5 tot 9 dagen na de laatste dosis actief ciprofloxacine.
De totale bacteriologische genezingspercentages voor LEVAQUIN® en controle bij het test-of-cure (TOC) bezoek voor de groep van alle patiënten met een gedocumenteerd pathogeen bij baseline (gemodificeerde intent-to-treat of mITT) en de groep patiënten in de mITT-populatie die het protocol (microbiologisch evalueerbaar) nauw volgden, zijn samengevat in tabel 16.
De microbiologische uitroeiingspercentages in de microbiologisch evalueerbare populatie bij TOC voor individuele pathogenen die zijn hersteld van patiënten die zijn gerandomiseerd naar een LEVAQUIN®-behandeling, worden weergegeven in tabel 17.
Gecompliceerde urineweginfecties en acute pyelonefritis
10-daagse behandelingsregime
Om de veiligheid en werkzaamheid van de dosis van 250 mg, een 10-daags regime van LEVAQUIN® te evalueren, werden 567 patiënten met ongecompliceerde UWI, milde tot matige cUTI en milde tot matige AP opgenomen in een gerandomiseerde, dubbelblinde, multicenter klinische studie uitgevoerd in de VS van juni 1993 tot januari 1995, waarbij LEVAQUIN® 250 mg oraal eenmaal daags gedurende 10 dagen (285 patiënten) werd vergeleken met ciprofloxacine 500 mg oraal tweemaal daags gedurende 10 dagen (282 patiënten). Patiënten met een resistente pathogeen, terugkerende UTI, vrouwen ouder dan 55 jaar en met een verblijfskatheter werden aanvankelijk uitgesloten, voorafgaand aan de wijziging van het protocol die plaatsvond na 30% van de inschrijving. De microbiologische werkzaamheid werd gemeten door bacteriologische uitroeiing van het (de) baseline-organisme(n) 1-12 dagen na de therapie bij patiënten met een pathogeen dat bij baseline werd geïdentificeerd.
De totale bacteriologische genezingspercentages voor LEVAQUIN® en controle bij het test-of-cure (TOC) bezoek voor de groep van alle patiënten met een gedocumenteerd pathogeen bij baseline (gemodificeerde intent-to-treat of mITT) en de groep patiënten in de mITT-populatie die het protocol (microbiologisch evalueerbaar) nauw volgden, zijn samengevat in tabel 18.
Inhalatie miltvuur (post-blootstelling)
De effectiviteit van LEVAQUIN® voor deze indicatie is gebaseerd op plasmaconcentraties die bij mensen zijn bereikt, een surrogaateindpunt dat redelijkerwijs klinisch voordeel kan voorspellen. LEVAQUIN® is niet bij mensen getest voor de preventie van miltvuur door inademing na blootstelling. De gemiddelde plasmaconcentraties van LEVAQUIN® geassocieerd met een statistisch significante verbetering van de overleving ten opzichte van placebo in het resusapenmodel van inhalatie-anthrax worden bereikt of overschreden bij volwassen en pediatrische patiënten die de aanbevolen orale en intraveneuze doseringsschema's krijgen [zie INDICATIES en DOSERING EN ADMINISTRATIE ].
De farmacokinetiek van levofloxacine is geëvalueerd bij volwassen en pediatrische patiënten. De gemiddelde (± SD) steady-state piekplasmaconcentratie bij volwassenen die 500 mg oraal of intraveneus eenmaal daags kregen, is respectievelijk 5,7 ± 1,4 en 6,4 ± 0,8 mcg/ml; en de overeenkomstige totale plasmablootstelling (AUC) is respectievelijk 47,5 ± 6,7 en 54,6 ± 11,1 mcg.h/ml. De voorspelde farmacokinetische parameters bij steady-state bij pediatrische patiënten in de leeftijd van 6 maanden tot 17 jaar die om de 12 uur 8 mg/kg oraal kregen (niet meer dan 250 mg per dosis) werden berekend als vergelijkbaar met die waargenomen bij volwassenen die 500 mg kregen. eenmaal daags oraal [zie KLINISCHE FARMACOLOGIE ].
LEVAQUIN®-tabletten kunnen alleen worden toegediend aan pediatrische patiënten met inhalatie-anthrax (postexposure) of pest die 30 kg of meer wegen vanwege de beperkingen van de beschikbare sterktes [zie DOSERING EN ADMINISTRATIE ].
Bij volwassenen is de veiligheid van LEVAQUIN® voor een behandelingsduur tot 28 dagen goed gekarakteriseerd. Informatie over langdurig gebruik van 500 mg per dag tot 60 dagen is echter beperkt. Langdurige LEVAQUIN®-therapie bij volwassenen mag alleen worden gebruikt als het voordeel opweegt tegen het risico.
Bij pediatrische patiënten is de veiligheid van levofloxacine voor een behandelingsduur van meer dan 14 dagen niet onderzocht. In klinische onderzoeken met een behandelingsduur van maximaal 14 dagen is een verhoogde incidentie van musculoskeletale bijwerkingen (artralgie, artritis, tendinopathie, gangafwijking) waargenomen in vergelijking met controlepersonen. Gegevens over de veiligheid op lange termijn, waaronder effecten op kraakbeen, na toediening van levofloxacine aan pediatrische patiënten zijn beperkt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Er werd een placebogecontroleerd dieronderzoek uitgevoerd bij resusapen die waren blootgesteld aan een geïnhaleerde gemiddelde dosis van 49 LD50 (~2,7 × 106) sporen (bereik 17 – 118 LD50) van B. anthracis (Ames-stam). De minimale remmende concentratie (MIC) van levofloxacine voor de anthrax-stam die in dit onderzoek werd gebruikt, was 0,125 mcg/ml. Bij de onderzochte dieren varieerden de gemiddelde plasmaconcentraties van levofloxacine die werden bereikt bij de verwachte Tmax (1 uur na dosis) na orale toediening tot steady-state van 2,79 tot 4,87 mcg/ml. Steady-state dalconcentraties 24 uur na toediening varieerden van 0,107 tot 0,164 mcg/ml. De gemiddelde (SD) steady-state AUC0-24 was 33,4 ± 3,2 mcg.u/ml (bereik 30,4 tot 36,0 mcg.u/ml). Sterfte als gevolg van miltvuur voor dieren die een regime van 30 dagen oraal LEVAQUIN® kregen, beginnend 24 uur na blootstelling, was significant lager (1/10), vergeleken met de placebogroep (9/10) [P = 0,0011, 2-zijdige Fisher's 39;s Exacte Test]. Het ene met levofloxacine behandelde dier dat stierf aan miltvuur deed dat na de 30 dagen durende toedieningsperiode van het geneesmiddel.
Pest
Werkzaamheidsstudies van LEVAQUIN® konden om ethische en haalbaarheidsredenen niet worden uitgevoerd bij mensen met longpest. Daarom was de goedkeuring van deze indicatie gebaseerd op een werkzaamheidsonderzoek bij dieren.
De gemiddelde plasmaconcentraties van LEVAQUIN® geassocieerd met een statistisch significante verbetering van de overleving ten opzichte van placebo in een Afrikaanse groene aap-model van longpest worden bereikt of overschreden bij volwassen en pediatrische patiënten die de aanbevolen orale en intraveneuze doseringsschema's krijgen [zie INDICATIES en DOSERING EN ADMINISTRATIE ].
De farmacokinetiek van levofloxacine is geëvalueerd bij volwassen en pediatrische patiënten. De gemiddelde (± SD) steady-state piekplasmaconcentratie bij volwassenen die 500 mg oraal of intraveneus eenmaal daags kregen, is respectievelijk 5,7 ± 1,4 en 6,4 ± 0,8 mcg/ml; en de overeenkomstige totale plasmablootstelling (AUC0-24) is respectievelijk 47,5 ± 6,7 en 54,6 ± 11,1 mcg.h/ml. De voorspelde farmacokinetische parameters bij steady-state bij pediatrische patiënten in de leeftijd van 6 maanden tot 17 jaar die om de 12 uur 8 mg/kg oraal kregen (niet meer dan 250 mg per dosis) werden berekend als vergelijkbaar met die waargenomen bij volwassenen die 500 mg kregen. eenmaal daags oraal [zie KLINISCHE FARMACOLOGIE ]. LEVAQUIN®-tabletten kunnen alleen worden toegediend aan pediatrische patiënten met inhalatie-anthrax (postexposure) of pest die 30 kg of meer wegen vanwege de beperkingen van de beschikbare sterktes [zie DOSERING EN ADMINISTRATIE ].
Er werd een placebogecontroleerd dieronderzoek uitgevoerd bij Afrikaanse groene apen die waren blootgesteld aan een geïnhaleerde gemiddelde dosis van 65 LD (bereik 3 tot 145 LD50) van Yersinia pestis (CO92-stam). De minimale remmende concentratie (MIC) van levofloxacine voor de Y. pestis-stam die in dit onderzoek werd gebruikt, was 0,03 mcg/ml. De gemiddelde plasmaconcentraties van levofloxacine die aan het einde van een enkelvoudige infusie van 30 minuten werden bereikt, varieerden van 2,84 tot 3,50 mcg/ml bij Afrikaanse groene apen. Dalconcentraties 24 uur na de dosis varieerden van
PATIËNT INFORMATIE
LEVAQUIN® (Laat ah kwin)(levofloxacine) tabletten
Wat is de belangrijkste informatie die ik moet weten over LEVAQUIN 500 mg?
LEVAQUIN 500 mg, een fluorochinolon-antibioticum, kan ernstige bijwerkingen veroorzaken. Sommige van deze ernstige bijwerkingen kunnen tegelijkertijd optreden en kunnen de dood tot gevolg hebben.
Als u een van de volgende ernstige bijwerkingen krijgt terwijl u LEVAQUIN 500 mg gebruikt, u moet onmiddellijk stoppen met het innemen van LEVAQUIN en onmiddellijk medische hulp inroepen.
- Peesproblemen kunnen optreden bij mensen van alle leeftijden die LEVAQUIN gebruiken. Pezen zijn taaie weefselkoorden die spieren met botten verbinden. Sommige peesproblemen zijn onder meer:
- pijn
- zwelling
- tranen en zwelling van pezen, inclusief de achterkant van de enkel (achillespees), schouder-, hand- of andere peesplaatsen.
- Het risico op het krijgen van peesproblemen terwijl u LEVAQUIN gebruikt, is groter als u:
- ouder zijn dan 60 jaar
- een nier-, hart- of longtransplantatie heeft ondergaan.
- Peesproblemen kunnen optreden bij mensen die de bovenstaande risicofactoren niet hebben als ze LEVAQUIN gebruiken.
- Andere redenen die uw risico op peesproblemen kunnen vergroten, kunnen zijn:
- lichamelijke activiteit of lichaamsbeweging
- nierfalen
- peesproblemen in het verleden, zoals bij mensen met reumatoïde artritis (RA)
- Stop onmiddellijk met het innemen van LEVAQUIN en zoek onmiddellijk medische hulp bij de eerste tekenen van peespijn, zwelling of ontsteking. Vermijd lichaamsbeweging en gebruik het getroffen gebied.
- Het meest voorkomende gebied van pijn en zwelling is de achillespees aan de achterkant van uw enkel. Dit kan ook gebeuren met andere pezen. U heeft mogelijk een ander antibioticum nodig dan een fluorochinolon om uw infectie te behandelen.
- Peesruptuur kan optreden terwijl u LEVAQUIN gebruikt of nadat u klaar bent met het innemen van LEVAQUIN. Peesrupturen kunnen optreden binnen enkele uren of dagen na inname van LEVAQUIN en zijn opgetreden tot enkele maanden nadat mensen klaar zijn met het innemen van hun fluoroquinolon.
- Stop onmiddellijk met het innemen van LEVAQUIN 750 mg en roep onmiddellijk medische hulp in als u een van de volgende tekenen of symptomen van een peesruptuur krijgt:
- hoor of voel een klik of knal in een peesgebied
- blauwe plekken direct na een blessure in een peesgebied
- niet in staat om het getroffen gebied te verplaatsen of gewicht te dragen
- pijn
- brandend
- tintelingen
- doof gevoel
- zwakheid
De zenuwbeschadiging kan permanent zijn.
- toevallen
- stemmen horen, dingen zien of dingen voelen die er niet zijn (hallucinaties)
- rusteloos voelen
- trillingen
- zich angstig of nerveus voelen
- verwardheid
- depressie
- Moeite met slapen
- nachtmerries
- zich licht in het hoofd of duizelig voelen
- meer achterdochtig voelen (paranoia)
- zelfmoordgedachten of -handelingen
- hoofdpijn die niet overgaat, met of zonder wazig zien
Wat is LEVAQUIN?
LEVAQUIN 500 mg is een fluorochinolon-antibioticum dat wordt gebruikt bij volwassenen van 18 jaar en ouder om bepaalde infecties te behandelen die worden veroorzaakt door bepaalde ziektekiemen, bacteriën genaamd. Deze bacteriële infecties omvatten:
- nosocomiale longontsteking
- gemeenschap verworven pneumonie
- huidinfecties, gecompliceerd en ongecompliceerd
- chronische prostaatinfectie
- inademing miltvuur kiemen
- pest
- urineweginfecties, gecompliceerd en ongecompliceerd
- acute nierinfectie (pyelonefritis)
- acute sinus-infectie
- acute verergering of chronische bronchitis
Studies met LEVAQUIN voor gebruik bij de behandeling van pest en miltvuur werden alleen bij dieren gedaan, omdat pest en miltvuur niet bij mensen konden worden onderzocht.
LEVAQUIN mag niet worden gebruikt bij patiënten met ongecompliceerde urineweginfecties, acute bacteriële exacerbatie van chronische bronchitis of acute bacteriële sinusitis als er andere behandelingsopties beschikbaar zijn.
LEVAQUIN 750 mg tabletten wordt ook gebruikt voor de behandeling van kinderen die ten minste 66 pond (of ten minste 30 kilogram) wegen en die miltvuurbacteriën hebben ingeademd, de pest hebben of zijn blootgesteld aan pestbacteriën. Het is niet bekend of LEVAQUIN veilig en effectief is bij kinderen jonger dan 6 maanden.
De veiligheid en werkzaamheid bij kinderen die langer dan 14 dagen met LEVAQUIN® worden behandeld, is niet bekend.
Wie mag LEVAQUIN 750 mg niet gebruiken?
Gebruik LEVAQUIN niet: als u ooit een ernstige allergische reactie heeft gehad op een antibioticum dat bekend staat als fluoroquinolon, of als u allergisch bent voor levofloxacine of voor één van de bestanddelen van LEVAQUIN. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in LEVAQUIN.
Voordat u LEVAQUIN inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- peesproblemen hebben; LEVAQUIN 250 mg mag niet worden gebruikt bij mensen met een voorgeschiedenis van peesproblemen.
- een probleem heeft dat spierzwakte veroorzaakt (myasthenia gravis); LEVAQUIN mag niet worden gebruikt bij mensen met een bekende voorgeschiedenis van myasthenia gravis.
- problemen met het centrale zenuwstelsel heeft, zoals toevallen (epilepsie).
- zenuwproblemen hebben; LEVAQUIN 250 mg mag niet worden gebruikt bij patiënten met een voorgeschiedenis van een zenuwprobleem dat perifere neuropathie wordt genoemd.
- heeft of iemand in uw familie een onregelmatige hartslag heeft, vooral een aandoening die 'QT-verlenging' wordt genoemd.
- een laag kaliumgehalte in het bloed heeft (hypokaliëmie).
- botproblemen hebben.
- gewrichtsproblemen heeft, waaronder reumatoïde artritis (RA).
- nierproblemen hebben. Het kan zijn dat u een lagere dosis LEVAQUIN nodig heeft als uw nieren niet goed werken.
- leverproblemen hebben.
- diabetes heeft of problemen heeft met een lage bloedsuikerspiegel (hypoglykemie).
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of LEVAQUIN 750 mg schadelijk is voor uw ongeboren kind.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of LEVAQUIN in uw moedermelk terechtkomt. U en uw zorgverlener moeten beslissen of u LEVAQUIN 250 mg gaat gebruiken of borstvoeding geeft. Je moet niet allebei doen.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
LEVAQUIN en andere geneesmiddelen kunnen elkaar beïnvloeden en bijwerkingen veroorzaken.
Vertel het uw zorgverlener vooral als u:
- een steroïde medicijn.
- een antipsychoticum.
- een tricyclisch antidepressivum.
- een waterpil (diureticum).
- bepaalde geneesmiddelen kunnen ervoor zorgen dat LEVAQUIN 750 mg niet goed werkt. Neem LEVAQUIN® ofwel 2 uur vóór of 2 uur na inname van deze geneesmiddelen of supplementen:
- een antacidum, multivitamine of andere medicijnen of supplementen die magnesium, aluminium, ijzer of zink bevatten
- sucralfaat (Carafate®)
- didanosine (Videx®, Videx® EC)
- een bloedverdunner (warfarine, Coumadin, Jantoven).
- een oraal geneesmiddel tegen diabetes of insuline.
- een NSAID (niet-steroïde anti-inflammatoir geneesmiddel). Veel voorkomende medicijnen voor pijnverlichting zijn NSAID's. Het gebruik van een NSAID terwijl u LEVAQUIN 250 mg of andere fluorochinolonen gebruikt, kan uw risico op effecten op het centrale zenuwstelsel en epileptische aanvallen verhogen.
- theofylline (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- een geneesmiddel om uw hartslag of ritme onder controle te houden (antiaritmica).
Vraag uw zorgverlener als u niet zeker weet of een van uw geneesmiddelen hierboven vermeld staat. Weet welke medicijnen u gebruikt. Houd een lijst bij van uw geneesmiddelen en toon deze aan uw zorgverlener en apotheker als u een nieuw geneesmiddel krijgt.
Hoe moet ik LEVAQUIN 500 mg innemen?
- Neem LEVAQUIN precies zoals uw zorgverlener u zegt dat u het moet innemen.
- Neem LEVAQUIN 750 mg elke dag op ongeveer hetzelfde tijdstip in.
- Drink veel vocht terwijl u LEVAQUIN gebruikt.
- LEVAQUIN kan met of zonder voedsel worden ingenomen.
- Als u een dosis LEVAQUIN 500 mg bent vergeten, neem deze dan in zodra u eraan denkt. Neem niet meer dan 1 dosis op 1 dag.
- Sla geen enkele dosis LEVAQUIN 750 mg over en stop niet met het innemen ervan, zelfs niet als u zich beter begint te voelen, totdat u klaar bent met uw voorgeschreven behandeling, tenzij:
- je hebt peesproblemen. Zien "Wat is de belangrijkste informatie die ik moet weten over LEVAQUIN 500 mg?".
- je hebt een zenuwprobleem. Zien "Wat zijn de mogelijke bijwerkingen van LEVAQUIN?".
- u een probleem met het centrale zenuwstelsel heeft. Zien "Wat zijn de mogelijke bijwerkingen van LEVAQUIN 750 mg?".
- u een ernstige allergische reactie heeft. Zien "Wat zijn de mogelijke bijwerkingen van LEVAQUIN 250 mg?".
- uw zorgverlener zegt dat u moet stoppen met het innemen van LEVAQUIN.
Als u al uw doses LEVAQUIN 500 mg inneemt, zorgt u ervoor dat alle bacteriën worden gedood. Door al uw doses LEVAQUIN 250 mg in te nemen, verkleint u de kans dat de bacteriën resistent worden tegen LEVAQUIN. Als uw infectie niet beter wordt terwijl u LEVAQUIN 750 mg gebruikt, kan dit betekenen dat de bacterie die uw infectie veroorzaakt, resistent is tegen LEVAQUIN. Als uw infectie niet beter wordt, neem dan contact op met uw zorgverlener. Als uw infectie niet beter wordt, is het mogelijk dat LEVAQUIN en andere soortgelijke antibiotische geneesmiddelen in de toekomst niet meer voor u werken.
- Als u te veel LEVAQUIN heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of roep medische hulp in.
Wat moet ik vermijden tijdens het gebruik van LEVAQUIN 500 mg?
- LEVAQUIN kan u duizelig en licht in het hoofd doen voelen. Niet doen autorijden, machines bedienen of andere activiteiten uitvoeren waarvoor mentale alertheid of coördinatie vereist is, totdat u weet welke invloed LEVAQUIN op u heeft.
- Vermijd zonnelampen, zonnebanken en probeer uw tijd in de zon te beperken. LEVAQUIN 750 mg kan uw huid gevoelig maken voor de zon (lichtgevoeligheid) en het licht van zonnelampen en zonnebanken. U kunt ernstige zonnebrand, blaren of zwelling van uw huid krijgen. Als u een van deze symptomen krijgt terwijl u LEVAQUIN gebruikt, neem dan onmiddellijk contact op met uw zorgverlener. U moet een zonnebrandcrème gebruiken en een hoed en kleding dragen die uw huid bedekken als u in de zon moet zijn.
Wat zijn de mogelijke bijwerkingen van LEVAQUIN 750 mg?
LEVAQUIN 750 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien "Wat is de belangrijkste informatie die ik moet weten over LEVAQUIN 250 mg?"
- Ernstige allergische reacties.
Allergische reacties kunnen optreden bij mensen die fluoroquinolonen gebruiken, waaronder LEVAQUIN 500 mg, zelfs na slechts 1 dosis. Stop met het innemen van LEVAQUIN 500 mg en roep onmiddellijk medische hulp in als u een van de volgende symptomen van een ernstige allergische reactie heeft:
- netelroos
- moeite met ademhalen of slikken
- zwelling van de lippen, tong, gezicht
- beklemd gevoel in de keel, heesheid
- hoge hartslag
- flauwvallen
- huiduitslag
Huiduitslag kan optreden bij mensen die LEVAQUIN 500 mg gebruiken, zelfs na slechts 1 dosis. Stop met het innemen van LEVAQUIN 250 mg bij het eerste teken van huiduitslag en bel onmiddellijk uw zorgverlener. Huiduitslag kan een teken zijn van een ernstiger reactie op LEVAQUIN.
- Leverbeschadiging (hepatotoxiciteit): Levertoxiciteit kan optreden bij mensen die LEVAQUIN® gebruiken. Bel uw zorgverlener meteen als u onverklaarbare symptomen heeft, zoals:
- misselijkheid of braken
- buikpijn
- koorts
- zwakheid
- buikpijn of gevoeligheid
- jeuk
- ongewone vermoeidheid
- verlies van eetlust
- lichtgekleurde stoelgang
- donker gekleurde urine
- geel worden van uw huid of het wit van uw ogen
Stop met het innemen van LEVAQUIN 750 mg en vertel het uw zorgverlener meteen als uw huid of het witte deel van uw ogen geel wordt, of als u donkere urine heeft. Dit kunnen tekenen zijn van een ernstige reactie op LEVAQUIN (een leverprobleem).
- Darminfectie (pseudomembraneuze colitis) Pseudomembraneuze colitis kan optreden bij veel antibiotica, waaronder LEVAQUIN. Bel onmiddellijk uw zorgverlener als u waterige diarree, diarree die niet weggaat of bloederige ontlasting krijgt. U kunt last krijgen van maagkrampen en koorts. Pseudomembraneuze colitis kan optreden 2 of meer maanden nadat u klaar bent met uw antibioticum.
- Ernstige hartritmeveranderingen (QT-verlenging en torsades depointes) Vertel het uw zorgverlener meteen als u een verandering in uw hartslag heeft (een snelle of onregelmatige hartslag) of als u flauwvalt. LEVAQUIN 250 mg kan een zeldzaam hartprobleem veroorzaken dat bekend staat als verlenging van het QT-interval. Deze aandoening kan een abnormale hartslag veroorzaken en kan zeer gevaarlijk zijn. De kans dat dit gebeurt is groter bij mensen:
- die bejaard zijn
- met een familiegeschiedenis van verlengd QT-interval
- met een laag kaliumgehalte in het bloed (hypokaliëmie)
- die bepaalde geneesmiddelen gebruiken om het hartritme onder controle te houden (antiaritmica)
- Gewrichtsproblemen Verhoogde kans op problemen met gewrichten en weefsels rond gewrichten bij kinderen kan voorkomen. Vertel de zorgverlener van uw kind als uw kind gewrichtsproblemen heeft tijdens of na de behandeling met LEVAQUIN.
- Veranderingen in de bloedsuikerspiegel Mensen die LEVAQUIN en andere fluorochinolonen gebruiken met orale antidiabetesgeneesmiddelen of met insuline, kunnen een lage bloedsuikerspiegel (hypoglykemie) en een hoge bloedsuikerspiegel (hyperglykemie) krijgen. Volg de instructies van uw zorgverlener voor hoe vaak u uw bloedsuikerspiegel moet controleren. Als u diabetes heeft en u krijgt een lage bloedsuikerspiegel terwijl u LEVAQUIN gebruikt, stop dan met het gebruik van LEVAQUIN 500 mg en bel onmiddellijk uw zorgverlener. Uw antibioticum moet mogelijk worden gewijzigd.
- Gevoeligheid voor zonlicht (lichtgevoeligheid) Zien "Wat moet ik vermijden tijdens het gebruik van LEVAQUIN?" De meest voorkomende bijwerkingen van LEVAQUIN 250 mg zijn:
- misselijkheid
- hoofdpijn
- diarree
- slapeloosheid
- constipatie
- duizeligheid
Bij kinderen van 6 maanden en ouder die LEVAQUIN gebruiken om miltvuur of pest te behandelen, komt braken ook vaak voor.
LEVAQUIN kan vals-positieve urinescreeningsresultaten voor opiaten veroorzaken wanneer tests worden uitgevoerd met een aantal in de handel verkrijgbare kits. Een positief resultaat moet worden bevestigd met een meer specifieke test. Dit zijn niet alle mogelijke bijwerkingen van LEVAQUIN.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik LEVAQUIN 250 mg bewaren?
- Bewaar LEVAQUIN 500 mg bij kamertemperatuur tussen 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Bewaar LEVAQUIN 500 mg in een goed gesloten container.
Algemene informatie over het veilige en effectieve gebruik van LEVAQUIN.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik LEVAQUIN niet voor een aandoening waarvoor het niet is voorgeschreven. Geef LEVAQUIN 500 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. Deze medicatiehandleiding vat de belangrijkste informatie over LEVAQUIN samen. Als u meer informatie wilt over LEVAQUIN 750 mg, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over LEVAQUIN 500 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in LEVAQUIN 500 mg?
Actief ingrediënt: levofloxacine
Inactieve ingredienten : crospovidon, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, polysorbaat 80, titaniumdioxide.
LEVAQUIN 250 mg tabletten bevatten ook synthetisch rood ijzeroxide.
LEVAQUIN 500 mg tabletten bevatten ook synthetisch rood ijzeroxide en synthetisch geel ijzeroxide.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration
