Omnicef 300mg Cefdinir Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Omnicef en hoe wordt het gebruikt?
Omnicef (cefdinir) is een cefalosporine-antibioticum dat wordt gebruikt voor de behandeling van veel verschillende soorten infecties veroorzaakt door bacteriën. De merknaam Omnicef wordt stopgezet in de VS Omnicef is verkrijgbaar in generieke vorm.
Wat zijn bijwerkingen van Omnicef?
Vaak voorkomende bijwerkingen van Omnicef 300 mg zijn:
- diarree,
- misselijkheid,
- braken,
- buikpijn,
- indigestie,
- hoofdpijn,
- duizeligheid,
- luieruitslag bij een baby die vloeibare cefdinir gebruikt,
- jeuk, of
- huiduitslag,
Opmerking: Deze lijst bevat mogelijk niet alle mogelijke bijwerkingen.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van OMNICEF 300 mg en andere antibacteriële geneesmiddelen te behouden, mag OMNICEF alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze door bacteriën worden veroorzaakt.
OMSCHRIJVING
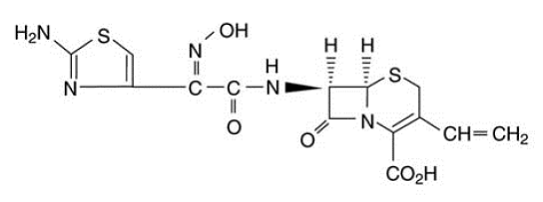
OMNICEF (cefdinir) capsules en OMNICEF (cefdinir) voor orale suspensie bevatten de werkzame stof cefdinir, een semisynthetisch cefalosporine met een uitgebreid spectrum, voor orale toediening. Chemisch gezien is cefdinir [6R-[6α, 7β (Z)]]-7-[[(2-amino-4-thiazolyl)(hydroxyimino)acetyl]amino]3-ethenyl-8-oxo-5-thia-1 -azabicyclo[4.2.0]oct-2-een-2-carbonzuur. Cefdinir is een witte tot licht bruingele vaste stof. Het is enigszins oplosbaar in verdund zoutzuur en matig oplosbaar in 0,1 M pH 7,0 fosfaatbuffer. De empirische formule is C14H13N5O5S2 en het molecuulgewicht is 395,42. Cefdinir heeft de onderstaande structuurformule:
OMNICEF 300 mg capsules bevatten 300 mg cefdinir en de volgende inactieve ingrediënten: carboxymethylcellulose calcium, NF; polyoxyl 40 stearaat, NF; en magnesiumstearaat, NF. De capsulehulzen bevatten FD&C Blue #1; FD&C Rood #40; D&C Rood # 28; titaandioxide, NF; gelatine, NF; siliciumdioxide, NF; en natriumlaurylsulfaat, NF.
OMNICEF 300 mg voor orale suspensie bevat, na reconstitutie, 125 mg cefdinir per 5 ml of 250 mg cefdinir per 5 ml en de volgende inactieve ingrediënten: sucrose, NF; citroenzuur, USP; natriumcitraat, USP; natriumbenzoaat, NF; xanthaangom, NF; guargom, NF; kunstmatige aardbeien- en roomaroma's; siliciumdioxide, NF; en magnesiumstearaat, NF.
INDICATIES
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van OMNICEF 300 mg en andere antibacteriële geneesmiddelen te behouden, mag OMNICEF 300 mg alleen worden gebruikt voor het behandelen of voorkomen van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
OMNICEF (cefdinir) capsules en OMNICEF (cefdinir) voor orale suspensie zijn geïndiceerd voor de behandeling van patiënten met milde tot matige infecties veroorzaakt door gevoelige stammen van de aangewezen micro-organismen in de hieronder vermelde aandoeningen.
Volwassenen en adolescenten
Gemeenschap verworven pneumonie
veroorzaakt door Haemophilus influenzae (inclusief β-lactamase producerende stammen), Haemophilus parainfluenzae (inclusief β-lactamase producerende stammen), Streptococcus pneumoniae (alleen penicilline-gevoelige stammen) en Moraxella catarrhalis (inclusief β-lactamase producerende stammen) (zie Klinische studies ).
Acute exacerbaties van chronische bronchitis
veroorzaakt door Haemophilus influenzae (inclusief β-lactamase producerende stammen), Haemophilus parainfluenzae (inclusief β-lactamase producerende stammen), Streptococcus pneumoniae (alleen penicilline-gevoelige stammen) en Moraxella catarrhalis (inclusief β-lactamase producerende stammen).
Acute maxillaire sinusitis
veroorzaakt door Haemophilus influenzae (inclusief β-lactamaseproducerende stammen), Streptococcus pneumoniae (alleen penicillinegevoelige stammen) en Moraxella catarrhalis (inclusief βlactamaseproducerende stammen).
OPMERKING: Voor informatie over gebruik bij pediatrische patiënten, zie: Pediatrisch gebruik en DOSERING EN ADMINISTRATIE .
Faryngitis/tonsillitis
veroorzaakt door Streptococcus pyogenes (zie Klinische studies ).
OPMERKING: Cefdinir is effectief bij de uitroeiing van S. pyogenes uit de orofarynx. Cefdinir is echter niet onderzocht voor de preventie van reumatische koorts na S. pyogenes faryngitis/tonsillitis. Alleen intramusculaire penicilline is effectief gebleken voor de preventie van reumatische koorts.
Ongecompliceerde huid- en huidstructuurinfecties
veroorzaakt door Staphylococcus aureus (inclusief β-lactamase-producerende stammen) en Streptococcus pyogenes.
Pediatrische patiënten
Acute bacteriële otitis media veroorzaakt door Haemophilus influenzae (inclusief -lactamase producerende stammen), Streptococcus pneumoniae (alleen penicilline-gevoelige stammen) en Moraxella catarrhalis (inclusief β-lactamase producerende stammen).
Faryngitis/tonsillitis
veroorzaakt door Streptococcus pyogenes (zie Klinische studies ).
OPMERKING: Cefdinir is effectief bij de uitroeiing van S. pyogenes uit de orofarynx. Cefdinir is echter niet onderzocht voor de preventie van reumatische koorts na S. pyogenes faryngitis/tonsillitis. Alleen intramusculaire penicilline is effectief gebleken voor de preventie van reumatische koorts.
Ongecompliceerde huid- en huidstructuurinfecties
veroorzaakt door Staphylococcus aureus (inclusief β-lactamase-producerende stammen) en Streptococcus pyogenes.
DOSERING EN ADMINISTRATIE
(zien AANWIJZINGEN EN GEBRUIK voor Aangegeven pathogenen )
Capsules
De aanbevolen dosering en duur van de behandeling voor infecties bij volwassenen en adolescenten worden beschreven in de volgende tabel; de totale dagelijkse dosis voor alle infecties is 600 mg. Een eenmaal daagse dosering gedurende 10 dagen is even effectief als BID-dosering. Eenmaal daagse dosering is niet onderzocht bij longontsteking of huidinfecties; daarom moet OMNICEF-capsules bij deze infecties tweemaal daags worden toegediend. OMNICEF-capsules kunnen worden ingenomen zonder rekening te houden met maaltijden.
Volwassenen en adolescenten (leeftijd 13 jaar en ouder)
PoederVoor orale suspensie
De aanbevolen dosering en duur van de behandeling voor infecties bij pediatrische patiënten worden beschreven in de volgende tabel; de totale dagelijkse dosis voor alle infecties is 14 mg/kg, tot een maximale dosis van 600 mg per dag. Een eenmaal daagse dosering gedurende 10 dagen is even effectief als BID-dosering. Eenmaal daagse dosering is niet onderzocht bij huidinfecties; daarom moet OMNICEF 300 mg voor orale suspensie tweemaal daags worden toegediend bij deze infectie. OMNICEF voor orale suspensie kan worden toegediend zonder rekening te houden met maaltijden.
Pediatrische patiënten (leeftijd 6 maanden tot 12 jaar)
OMNICEF VOOR ORALE SUSPENSIE PEDIATRISCHE DOSERINGSTABEL
Patiënten met nierinsufficiëntie
Voor volwassen patiënten met een creatinineklaring
De creatinineklaring is moeilijk te meten bij poliklinische patiënten. De volgende formule kan echter worden gebruikt om de creatinineklaring (CLcr) bij volwassen patiënten te schatten. Om geldige schattingen te maken, moeten de serumcreatininespiegels de steady-state-spiegels van de nierfunctie weerspiegelen.
waarbij de creatinineklaring in ml/min is, de leeftijd in jaren, het gewicht in kilogram en de serumcreatinine in mg/dL.4
De volgende formule kan worden gebruikt om de creatinineklaring bij pediatrische patiënten te schatten:
CLcr = K × lichaamslengte of -serumcreatinine
waarbij K = 0,55 voor pediatrische patiënten ouder dan 1 jaar5 en 0,45 voor zuigelingen (tot 1 jaar)6.
In de bovenstaande vergelijking is de creatinineklaring in ml/min/1,73 m², de lichaamslengte of lengte in centimeters en het serumcreatinine in mg/dL.
Voor pediatrische patiënten met een creatinineklaring van
Patiënten die hemodialyse ondergaan
Hemodialyse verwijdert cefdinir uit het lichaam. Bij patiënten die chronische hemodialyse ondergaan, is het aanbevolen aanvangsdoseringsschema een dosis van 300 mg of 7 mg/kg om de dag.
Aan het einde van elke hemodialysesessie moet 300 mg (of 7 mg/kg) worden gegeven. Daaropvolgende doses (300 mg of 7 mg/kg) worden dan om de dag toegediend.
Aanwijzingen voor het mengen van Omnicef 300 mg voor orale suspensie
Na mengen kan de suspensie bij kamertemperatuur (25°C/77°F) worden bewaard. De container moet goed gesloten worden gehouden en de suspensie moet voor elke toediening goed worden geschud. De suspensie kan gedurende 10 dagen worden gebruikt, waarna een ongebruikte portie moet worden weggegooid.
HOE GELEVERD
OMNICEF-capsules , die 300 mg cefdinir bevatten, als lavendel- en turkooizen capsules bedrukt met de productnaam, zijn als volgt verkrijgbaar:
60 Capsules/Fles NDC 0074-3769-60 OMNI-PAC™ doos met 3 eenheids-, 5-daagse, 10-capsule blisterkaarten NDC 0074-3769-30
OMNICEF 300 mg voor orale suspensie is een crèmekleurige poederformulering die, indien gereconstitueerd zoals aangegeven, 125 mg cefdinir/5 ml of 250 mg cefdinir/5 ml bevat. De gereconstitueerde suspensies hebben een crèmekleur en aardbeiensmaak. Het poeder is als volgt verkrijgbaar:
125 mg/5 ml
60 ml flessen NDC 0074-3771-60 Flessen van 100 ml NDC 0074-3771-13 250 mg/5 ml flessen van 60 ml NDC 0074-6151-60 Flessen van 100 ml NDC 0074-6151-13
Bewaar de capsules en het niet-gesuspendeerde poeder bij 25°C (77°F); excursies toegestaan tot 15°-30°C (59°-86°F) [zie USP-gecontroleerde kamertemperatuur]. Na reconstitutie kan de orale suspensie gedurende 10 dagen bij gecontroleerde kamertemperatuur worden bewaard.
Gefabriceerd door: CEPH International Corporation Carolina, Puerto Rico 00986. Voor: AbbVie Inc., North Chicago, IL 60064, VS, onder licentie van: Astellas Pharma Inc. Tokyo, Japan. Herzien november 2015
BIJWERKINGEN
Bijwerkingen
Klinische onderzoeken - OMNICEF-capsules (volwassenen en adolescenten)
In klinische onderzoeken werden 5093 volwassen en adolescente patiënten (3841 VS en 1252 niet-VS) behandeld met de aanbevolen dosis cefdinir-capsules (600 mg/dag). De meeste bijwerkingen waren mild en zelfbeperkend. Er werden geen sterfgevallen of blijvende handicaps toegeschreven aan cefdinir. Honderd zevenenveertig van de 5093 (3%) patiënten stopten met de medicatie vanwege bijwerkingen waarvan de onderzoekers dachten dat ze mogelijk, waarschijnlijk of zeker verband hielden met de behandeling met cefdinir. De stopzettingen waren voornamelijk voor gastro-intestinale stoornissen, meestal diarree of misselijkheid. Negentien van de 5093 (0,4%) patiënten werden stopgezet vanwege huiduitslag die verband hield met de toediening van cefdinir.
In de VS dachten onderzoekers dat de volgende bijwerkingen mogelijk, waarschijnlijk of zeker verband hielden met cefdinir-capsules in klinische onderzoeken met meerdere doses (N = 3841 met cefdinir behandelde patiënten):
ONGEWENSTE GEBEURTENISSEN IN VERBAND MET CEFDINIR-CAPSULES US-PROEVEN BIJ VOLWASSEN EN ADOLESCENTE PATINTEN (N = 3841)a
De volgende veranderingen in laboratoriumwaarden van mogelijk klinisch belang, ongeacht de relatie met de behandeling met cefdinir, zijn waargenomen tijdens klinische onderzoeken die in de VS zijn uitgevoerd:
VERANDERINGEN IN LABORATORIUMWAARDE WAARGENOMEN MET CEFDINIR-CAPSULES US-PROEVEN BIJ VOLWASSEN EN ADOLESCENTE PATINTEN (N = 3841)
Klinische onderzoeken - OMNICEF voor orale suspensie (pediatrische patiënten)
In klinische onderzoeken werden 2289 pediatrische patiënten (1783 VS en 506 niet-VS) behandeld met de aanbevolen dosis cefdinir-suspensie (14 mg/kg/dag). De meeste bijwerkingen waren mild en zelfbeperkend. Er werden geen sterfgevallen of blijvende handicaps toegeschreven aan cefdinir. Veertig van 2289 (2%) patiënten stopten met de medicatie vanwege bijwerkingen die door de onderzoekers werden beschouwd als mogelijk, waarschijnlijk of zeker geassocieerd met de behandeling met cefdinir. Stopzettingen waren voornamelijk voor gastro-intestinale stoornissen, meestal diarree. Vijf van de 2289 (0,2%) patiënten werden gestaakt vanwege een huiduitslag die verband hield met de toediening van cefdinir.
In de VS dachten onderzoekers dat de volgende bijwerkingen mogelijk, waarschijnlijk of zeker verband hielden met cefdinir-suspensie in klinische onderzoeken met meerdere doses (N = 1783 met cefdinir behandelde patiënten):
ONGEWENSTE GEBEURTENISSEN IN VERBAND MET CEFDINIR SCHORSING US-PROCESSEN BIJ PEDIATRISCHE PATINTEN (N = 1783)a
OPMERKING: Bij zowel de met cefdinir als de controle behandelde patiënten waren de percentages diarree en huiduitslag hoger bij de jongste pediatrische patiënten. De incidentie van diarree bij met cefdinir behandelde patiënten ≤ 2 jaar was 17% (95/557) vergeleken met 4% (51/1226) bij patiënten > 2 jaar. De incidentie van huiduitslag (voornamelijk luieruitslag bij de jongere patiënten) was 8% (43/557) bij patiënten 2 jaar oud, vergeleken met 1% (8/1226) bij patiënten > 2 jaar.
De volgende veranderingen in laboratoriumwaarden van mogelijk klinisch belang, ongeacht de relatie met de behandeling met cefdinir, zijn waargenomen tijdens klinische onderzoeken die in de VS zijn uitgevoerd:
LABORATORIUMWAARDE WIJZIGINGEN VAN MOGELIJKE KLINISCHE BELANG WAARGENOMEN MET CEFDINIR-SUSPENSIE US-PROEVEN BIJ PEDIATRISCHE PATINTEN (N = 1783)
Postmarketingervaring
De volgende bijwerkingen en gewijzigde laboratoriumtests, ongeacht hun relatie tot cefdinir, zijn gemeld tijdens uitgebreide postmarketingervaring, te beginnen met goedkeuring in Japan in 1991: shock, anafylaxie met zeldzame gevallen van dodelijke afloop, gezichts- en larynxoedeem, gevoel van verstikking, serumziekte-achtige reacties, conjunctivitis, stomatitis, Stevens-Johnson-syndroom, toxische epidermale necrolyse, exfoliatieve dermatitis, erythema multiforme, erythema nodosum, acute hepatitis, cholestase, fulminante hepatitis, leverfalen, geelzucht, verhoogde amylase, acute enterocolitis, bloederige diarree, hemorragische colitis, melena, pseudomembraneuze colitis, pancytopenie, granulocytopenie, leukopenie, trombocytopenie, idiopathische trombocytopenische purpura, hemolytische anemie, acuut respiratoir falen, astmatische aanval, door geneesmiddelen geïnduceerde pneumonie, eosinofiele pneumonie, idiopathische interstitiële pneumonie, koorts, acuut nierfalen, bloedingsneiging, stollingsstoornis orde, gedissemineerde intravasculaire stolling, bloeding in het bovenste deel van het maagdarmkanaal, maagzweer, ileus, bewustzijnsverlies, allergische vasculitis, mogelijke cefdinir-diclofenac-interactie, hartfalen, pijn op de borst, myocardinfarct, hypertensie, onwillekeurige bewegingen en rabdomyolyse.
Bijwerkingen van de cefalosporineklasse
De volgende bijwerkingen en gewijzigde laboratoriumtests zijn gemeld voor antibiotica uit de cefalosporineklasse in het algemeen:
Allergische reacties, anafylaxie, Stevens-Johnson-syndroom, erythema multiforme, toxische epidermale necrolyse, nierdisfunctie, toxische nefropathie, leverdisfunctie waaronder cholestase, aplastische anemie, hemolytische anemie, bloeding, fout-positieve test voor urineglucose, neutropenie, pancytopenie en agranulocytose . Symptomen van pseudomembraneuze colitis kunnen optreden tijdens of na behandeling met antibiotica (zie: WAARSCHUWINGEN ).
Verschillende cefalosporines zijn in verband gebracht met het uitlokken van epileptische aanvallen, met name bij patiënten met nierinsufficiëntie wanneer de dosering niet werd verlaagd (zie DOSERING EN ADMINISTRATIE en OVERDOSERING ). Als er aanvallen optreden die verband houden met medicamenteuze behandeling, moet het medicijn worden stopgezet. Anticonvulsieve therapie kan worden gegeven indien klinisch geïndiceerd.
DRUG-INTERACTIES
Antacida (aluminium- of magnesiumhoudend)
Gelijktijdige toediening van 300 mg cefdinir-capsules met 30 ml Maalox® TC-suspensie vermindert de snelheid (Cmax) en mate (AUC) van absorptie met ongeveer 40%. De tijd om Cmax te bereiken wordt ook met 1 uur verlengd. Er zijn geen significante effecten op de farmacokinetiek van cefdinir als de antacidum 2 uur vóór of 2 uur na cefdinir wordt toegediend. Als antacida nodig zijn tijdens de behandeling met OMNICEF 300 mg, moet OMNICEF 300 mg ten minste 2 uur vóór of na de antacidum worden ingenomen.
probenecide
Net als bij andere β-lactam-antibiotica remt probenecide de renale excretie van cefdinir, wat resulteert in een verdubbeling van de AUC, een stijging van 54% van de piekplasmaspiegels van cefdinir en een verlenging van de schijnbare eliminatie-t van 50%.
IJzersupplementen en voedingsmiddelen verrijkt met ijzer
Gelijktijdige toediening van cefdinir met een therapeutisch ijzersupplement dat 60 mg elementair ijzer (als FeSO4) of vitamines aangevuld met 10 mg elementair ijzer bevat, verminderde de mate van absorptie met respectievelijk 80% en 31%. Als ijzersupplementen nodig zijn tijdens de behandeling met OMNICEF 300 mg, moet OMNICEF ten minste 2 uur vóór of na het supplement worden ingenomen.
Het effect van voedingsmiddelen die sterk verrijkt zijn met elementair ijzer (voornamelijk met ijzer verrijkte ontbijtgranen) op de opname van cefdinir is niet onderzocht.
Gelijktijdig toegediende met ijzer verrijkte zuigelingenvoeding (2,2 mg elementair ijzer/6 oz) heeft geen significant effect op de farmacokinetiek van cefdinir. Daarom kan OMNICEF voor orale suspensie worden toegediend met met ijzer verrijkte zuigelingenvoeding.
Er zijn meldingen geweest van roodachtige ontlasting bij patiënten die cefdinir kregen. In veel gevallen kregen patiënten ook ijzerhoudende producten. De roodachtige kleur is te wijten aan de vorming van een niet-absorbeerbaar complex tussen cefdinir of zijn afbraakproducten en ijzer in het maagdarmkanaal.
Geneesmiddel-/laboratoriumtestinteracties
Een vals-positieve reactie voor ketonen in de urine kan optreden bij tests met nitroprusside, maar niet bij tests met nitroferricyanide. De toediening van cefdinir kan resulteren in een vals-positieve reactie voor glucose in de urine bij gebruik van Clinitest®, Benedict's oplossing of Fehling's oplossing. Het wordt aanbevolen om glucosetesten te gebruiken op basis van enzymatische glucoseoxidasereacties (zoals Clinistix® of Tes-Tape®). Van cefalosporines is bekend dat ze af en toe een positieve directe Coombs-test induceren.
WAARSCHUWINGEN
VOORDAT DE THERAPIE MET OMNICEF (CEFDINIR) WORDT INGESTELD, MOET ZORGVULDIG WORDEN UITGEVOERD OM TE BEPALEN OF DE PATINT EERDERE OVERGEVOELIGE REACTIES HEEFT GEHAD OP CEFDINIR, ANDERE CEPHALOSPORINEN, PENICILLINS OF ANDERE DRUGS. ALS CEFDINIR MOET WORDEN TOEGEDIEND AAN PENICILLINE-GEVOELIGE PATINTEN, MOET VOORZICHTIG WORDEN GEWEEST OMDAT DE KRUISOVERGEVOELIGHEID ONDER β-LACTAM-ANTIBIOTICA DUIDELIJK IS GEDOCUMENTEERD EN KAN VOORKOMEN BIJ TOT 10% VAN DE GESCHIEDENIS PATINTEN MET EEN OVERGEVOELIGHEID VAN -LACTAM. INDIEN EEN ALLERGISCHE REACTIE OP CEFDINIR OPTREDEN, MOET DE DRUG WORDEN STOPGEZET. ERNSTIGE ACUTE OVERGEVOELIGHEIDSREACTIES KUNNEN BEHANDELING MET Epinefrine EN ANDERE NOODMAATREGELEN VEREISEN, WAARONDER ZUURSTOF, INTRAVENEUZE VLOEISTOFFEN, INTRAVENEUZE ANTIHISTAMINEN, CORTICOSTERODEN, PRESSOR-AMINES EN LUCHTWEGENBEHANDELING.
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder OMNICEF, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na antibacterieel gebruik. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het lopende antibacteriële gebruik dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële behandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
PREVENTIEVE MAATREGELEN
Algemeen
Het voorschrijven van OMNICEF 300 mg bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Net als bij andere breedspectrumantibiotica kan een langdurige behandeling leiden tot de mogelijke opkomst en overgroei van resistente organismen. Zorgvuldige observatie van de patiënt is essentieel. Als tijdens de behandeling superinfectie optreedt, dient een geschikte alternatieve therapie te worden toegepast.
Cefdinir moet, net als andere breedspectrumantimicrobiële middelen (antibiotica), met voorzichtigheid worden voorgeschreven aan personen met een voorgeschiedenis van colitis.
Bij patiënten met voorbijgaande of aanhoudende nierinsufficiëntie (creatinineklaring DOSERING EN ADMINISTRATIE ).
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Het carcinogene potentieel van cefdinir is niet geëvalueerd. Er werden geen mutagene effecten waargenomen in de bacteriële reverse-mutatietest (Ames) of puntmutatietest op de hypoxanthine-guaninefosforibosyltransferase-locus (HGPRT) in V79-longcellen van Chinese hamsters. Er werden in vitro geen clastogene effecten waargenomen in de structurele chromosoomafwijkingstest in V79 Chinese hamsterlongcellen of in vivo in de micronucleustest in beenmerg van muizen. Bij ratten werden de vruchtbaarheid en reproductieprestaties niet beïnvloed door cefdinir bij orale doses tot 1000 mg/kg/dag (70 keer de dosis voor mensen gebaseerd op mg/kg/dag, 11 keer gebaseerd op mg/m²/dag).
Zwangerschap
Teratogene effecten
Zwangerschap Categorie B
Cefdinir was niet teratogeen bij ratten bij orale doses tot 1000 mg/kg/dag (70 maal de dosis voor de mens gebaseerd op mg/kg/dag, 11 maal gebaseerd op mg/m²/dag) of bij konijnen bij orale doses tot 10 mg/kg/dag (0,7 maal de dosis voor de mens gebaseerd op mg/kg/dag, 0,23 maal gebaseerd op mg/m²/dag). Maternale toxiciteit (verminderde toename van het lichaamsgewicht) werd waargenomen bij konijnen bij de maximaal getolereerde dosis van 10 mg/kg/dag zonder nadelige effecten op het nageslacht. Verlaagd lichaamsgewicht trad op bij rattenfoetussen bij 100 mg/kg/dag en bij rattennakomelingen bij ≥ 32 mg/kg/dag. Er werden geen effecten waargenomen op de voortplantingsparameters van de moeder of de overleving, ontwikkeling, het gedrag of de voortplantingsfunctie van het nageslacht.
Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Cefdinir is niet onderzocht voor gebruik tijdens de bevalling en de bevalling.
Moeders die borstvoeding geven
Na toediening van enkelvoudige doses van 600 mg werd cefdinir niet aangetroffen in moedermelk.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pasgeborenen en zuigelingen jonger dan 6 maanden zijn niet vastgesteld. Het gebruik van cefdinir voor de behandeling van acute sinusitis maxillaire bij pediatrische patiënten (leeftijd van 6 maanden tot 12 jaar) wordt ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken bij volwassenen en adolescenten, de vergelijkbare pathofysiologie van acute sinusitis bij volwassen en pediatrische patiënten, en vergelijkende farmacokinetische gegevens bij de pediatrische populatie.
Geriatrisch gebruik
De werkzaamheid is vergelijkbaar bij geriatrische patiënten en jongere volwassenen. Hoewel cefdinir in alle leeftijdsgroepen goed werd verdragen, ondervonden geriatrische patiënten in klinische onderzoeken minder bijwerkingen, waaronder diarree, dan jongere volwassenen. Dosisaanpassing bij oudere patiënten is niet nodig, tenzij de nierfunctie duidelijk aangetast is (zie: DOSERING EN ADMINISTRATIE ).
OVERDOSERING
Er is geen informatie beschikbaar over overdosering met cefdinir bij mensen. In acute toxiciteitsstudies bij knaagdieren veroorzaakte een enkele orale dosis van 5600 mg/kg geen nadelige effecten. Toxische tekenen en symptomen na overdosering met andere β-lactam-antibiotica omvatten misselijkheid, braken, epigastrische nood, diarree en convulsies. Hemodialyse verwijdert cefdinir uit het lichaam. Dit kan nuttig zijn in het geval van een ernstige toxische reactie door overdosering, vooral als de nierfunctie is aangetast.
CONTRA-INDICATIES
OMNICEF (cefdinir) is gecontra-indiceerd bij patiënten met een bekende allergie voor de cefalosporineklasse van antibiotica.
KLINISCHE FARMACOLOGIE
Farmacokinetiek en metabolisme van geneesmiddelen
Absorptie
Orale biologische beschikbaarheid
Maximale plasmaconcentraties van cefdinir treden 2 tot 4 uur na toediening op na toediening van de capsule of suspensie. De plasmaconcentraties van cefdinir nemen toe met de dosis, maar de verhogingen zijn minder dan dosisproportioneel van 300 mg (7 mg/kg) tot 600 mg (14 mg/kg). Na toediening van suspensie aan gezonde volwassenen is de biologische beschikbaarheid van cefdinir 120% ten opzichte van capsules. De geschatte biologische beschikbaarheid van cefdinir-capsules is 21% na toediening van een capsuledosis van 300 mg en 16% na toediening van een capsuledosis van 600 mg. De geschatte absolute biologische beschikbaarheid van cefdinir-suspensie is 25%. Cefdinir suspensie voor oraal gebruik met een sterkte van 250 mg/5 ml bleek bio-equivalent te zijn aan de sterkte van 125 mg/5 ml bij gezonde volwassenen in nuchtere toestand.
Effect van voedsel
De Cmax en AUC van cefdinir uit de capsules worden met respectievelijk 16% en 10% verminderd wanneer ze worden gegeven bij een vetrijke maaltijd. Bij volwassenen die de suspensie voor oraal gebruik van 250 mg/5 ml bij een vetrijke maaltijd krijgen, zijn de Cmax en AUC van cefdinir verminderd met respectievelijk 44% en 33%. De omvang van deze verlagingen is waarschijnlijk niet klinisch significant omdat de veiligheids- en werkzaamheidsonderzoeken van orale suspensie bij pediatrische patiënten werden uitgevoerd zonder rekening te houden met voedselinname. Daarom kan cefdinir worden ingenomen zonder rekening te houden met voedsel.
Cefdinir-capsules
De plasmaconcentraties van cefdinir en farmacokinetische parameterwaarden na toediening van enkelvoudige orale doses cefdinir van 300 en 600 mg aan volwassen proefpersonen worden weergegeven in de volgende tabel:
Gemiddelde (± SD) plasma-farmacokinetische parameterwaarden van Cefdinir na toediening van capsules aan volwassen proefpersonen
Cefdinir-schorsing
De plasmaconcentraties van cefdinir en farmacokinetische parameterwaarden na toediening van enkelvoudige orale doses cefdinir van 7 en 14 mg/kg aan pediatrische proefpersonen (leeftijd 6 maanden-12 jaar) worden weergegeven in de volgende tabel:
Gemiddelde (± SD) plasma-farmacokinetische parameterwaarden van Cefdinir na toediening van suspensie aan pediatrische proefpersonen
Meerdere doseringen
Cefdinir accumuleert niet in plasma na een- of tweemaal daagse toediening aan personen met een normale nierfunctie.
Verdeling
Het gemiddelde distributievolume (Vdarea) van cefdinir bij volwassen proefpersonen is 0,35 l/kg (± 0,29); bij pediatrische proefpersonen (leeftijd 6 maanden-12 jaar) is cefdinir Vdarea 0,67 l/kg (± 0,38). Cefdinir is voor 60% tot 70% gebonden aan plasma-eiwitten bij zowel volwassen als pediatrische patiënten; binding is onafhankelijk van concentratie.
Huidblaar
Bij volwassen proefpersonen werden 4 tot 5 uur na toediening van respectievelijk 300 en 600 mg doses mediane (spreiding) maximale cefdinir-concentraties van cefdinir in blaarvloeistof van 0,65 (0,33-1,1) en 1,1 (0,49-1,9) g/ml waargenomen. De gemiddelde (± SD) blister Cmax en AUC (0-∞) waarden waren 48% (± 13) en 91% (± 18) van de overeenkomstige plasmawaarden.
Tonsillenweefsel
Bij volwassen patiënten die een electieve tonsillectomie ondergingen, waren de respectievelijke mediane concentraties van cefdinir in tonsilweefsel 4 uur na toediening van enkelvoudige doses van 300 en 600 mg 0,25 (0,220,46) en 0,36 (0,22-0,80) g/g. De gemiddelde tonsilweefselconcentraties waren 24% (± 8) van de overeenkomstige plasmaconcentraties.
sinus weefsel
Bij volwassen patiënten die electieve kaakchirurgie ondergingen, waren de respectievelijke mediane sinusweefselconcentraties van cefdinir 4 uur na toediening van enkelvoudige doses van 300 en 600 mg
Longweefsel
Bij volwassen patiënten die diagnostische bronchoscopie ondergingen, waren de respectievelijke mediane bronchiale mucosa cefdinirconcentraties 4 uur na toediening van enkelvoudige doses van 300 en 600 mg 0,78 (
Middenoorvloeistof
Bij 14 pediatrische patiënten met acute bacteriële otitis media waren de respectievelijke mediane concentraties van cefdinir in het middenoorvocht 3 uur na toediening van enkelvoudige doses van 7 en 14 mg/kg 0,21 (
CSF
Er zijn geen gegevens beschikbaar over de penetratie van cefdinir in humaan hersenvocht.
Metabolisme en uitscheiding
Cefdinir wordt niet merkbaar gemetaboliseerd. Activiteit is voornamelijk te danken aan het oorspronkelijke medicijn. Cefdinir wordt voornamelijk geëlimineerd via renale excretie met een gemiddelde plasma-eliminatiehalfwaardetijd (t½) van 1,7 (± 0,6) uur. Bij gezonde proefpersonen met een normale nierfunctie is de renale klaring 2,0 (± 1,0) ml/min/kg en de schijnbare orale klaring 11,6 (± 6,0) en 15,5 (± 5,4) ml/min/kg na doses van 300 en 600 -mg, respectievelijk. Het gemiddelde percentage van de dosis dat onveranderd in de urine wordt teruggevonden na doses van 300 en 600 mg is respectievelijk 18,4% (± 6,4) en 11,6% (± 4,6). De klaring van cefdinir is verminderd bij patiënten met nierdisfunctie (zie: Speciale populaties - Patiënten met nierinsufficiëntie ).
Omdat uitscheiding via de nieren de belangrijkste eliminatieroute is, moet de dosering worden aangepast bij patiënten met een duidelijk verminderde nierfunctie of die hemodialyse ondergaan (zie DOSERING EN ADMINISTRATIE ).
Speciale populaties
Patiënten met nierinsufficiëntie
De farmacokinetiek van Cefdinir werd onderzocht bij 21 volwassen proefpersonen met verschillende gradaties van nierfunctie. Verlagingen van de eliminatiesnelheid van cefdinir, de schijnbare orale klaring (CL/F) en de renale klaring waren ongeveer evenredig met de verlaging van de creatinineklaring (CLcr). Dientengevolge waren de plasmaconcentraties van cefdinir hoger en hielden deze langer aan bij proefpersonen met nierinsufficiëntie dan bij personen zonder nierinsufficiëntie. Bij proefpersonen met een CLcr tussen 30 en 60 ml/min, namen de Cmax en t½ ongeveer 2-voudig toe en de AUC ongeveer 3-voudig. Bij proefpersonen met een CLcr DOSERING EN ADMINISTRATIE ).
Hemodialyse
De farmacokinetiek van Cefdinir werd onderzocht bij 8 volwassen proefpersonen die hemodialyse ondergingen. Dialyse (duur van 4 uur) verwijderde 63% van cefdinir uit het lichaam en verminderde de schijnbare eliminatie-t½ van 16 (± 3,5) tot 3,2 (± 1,2) uur. Bij deze patiëntenpopulatie wordt een dosisaanpassing aanbevolen (zie: DOSERING EN ADMINISTRATIE ).
Leverziekte
Omdat cefdinir voornamelijk via de nieren wordt uitgescheiden en niet merkbaar wordt gemetaboliseerd, zijn er geen onderzoeken uitgevoerd bij patiënten met een leverfunctiestoornis. Het is niet te verwachten dat aanpassing van de dosering bij deze populatie nodig is.
Geriatrische patiënten
Het effect van leeftijd op de farmacokinetiek van cefdinir na een enkele dosis van 300 mg werd geëvalueerd bij 32 proefpersonen van 19 tot 91 jaar. Systemische blootstelling aan cefdinir was aanzienlijk verhoogd bij oudere proefpersonen (N = 16), Cmax met 44% en AUC met 86%. Deze toename was het gevolg van een afname van de cefdinirklaring. Het schijnbare distributievolume was ook verminderd, dus er werden geen merkbare veranderingen in de schijnbare eliminatie t waargenomen (ouderen: 2,2 ± 0,6 uur versus jongeren: 1,8 ± 0,4 uur). Aangezien is aangetoond dat de klaring van cefdinir voornamelijk verband houdt met veranderingen in de nierfunctie en niet met leeftijd, hoeven oudere patiënten de dosering niet aan te passen, tenzij ze een duidelijk verminderde nierfunctie hebben (creatinineklaring Patiënten met nierinsufficiëntie, hierboven ).
Geslacht en ras
De resultaten van een meta-analyse van klinische farmacokinetiek (N = 217) wezen niet op een significante invloed van geslacht of ras op de farmacokinetiek van cefdinir.
Microbiologie
Werkingsmechanisme
Net als bij andere cefalosporines is de bacteriedodende activiteit van cefdinir het gevolg van remming van de celwandsynthese. Cefdinir is stabiel in aanwezigheid van enkele, maar niet alle, -lactamase-enzymen. Als gevolg hiervan zijn veel organismen die resistent zijn tegen penicillines en sommige cefalosporines gevoelig voor cefdinir.
Mechanisme van weerstand
Resistentie tegen cefdinir vindt voornamelijk plaats door hydrolyse door sommige β-lactamasen, wijziging van penicillinebindende eiwitten (PBP's) en verminderde permeabiliteit. Cefdinir is inactief tegen de meeste stammen van Enterobacter spp., Pseudomonas spp., Enterococcus spp., penicilline-resistente streptokokken en methicilline-resistente stafylokokken. β-lactamase-negatieve, ampicilline-resistente (BLNAR) H. influenzae-stammen zijn doorgaans niet gevoelig voor cefdinir.
Antimicrobiale activiteit
Cefdinir is werkzaam gebleken tegen de meeste stammen van de volgende micro-organismen, zowel in vitro als bij klinische infecties, zoals beschreven in AANWIJZINGEN EN GEBRUIK .
Gram-positieve bacteriën
Staphylococcus aureus (alleen voor meticilline gevoelige stammen) Streptococcus pneumoniae (alleen voor penicilline gevoelige stammen) Streptococcus pyogenes
Gram-negatieve bacteriën
Haemophilus influenzae Haemophilus para-influenzae Moraxella catarrhalis
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend.
Cefdinir vertoont in vitro minimale remmende concentraties (MIC's) van 1 mcg/ml of minder tegen (≥ 90%) stammen van de volgende micro-organismen; de veiligheid en werkzaamheid van cefdinir bij de behandeling van klinische infecties veroorzaakt door deze micro-organismen zijn echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Staphylococcus epidermidis (alleen voor meticilline gevoelige stammen) Streptococcus agalactiae Streptokokken van de Viridans-groep
Gram-negatieve bacteriën
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Gevoeligheidstestmethoden
Indien beschikbaar, moet het laboratorium voor klinische microbiologie periodieke rapporten verstrekken waarin het regionale/lokale gevoeligheidsprofiel van potentiële nosocomiale en gemeenschapsverworven pathogenen wordt beschreven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële minimale remmende concentraties (MIC's) te bepalen. Deze MIC's geven schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's dienen te worden bepaald met behulp van een gestandaardiseerde testmethode1 (bouillon en/of agar). De MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 1.
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, bieden ook reproduceerbare schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte moet worden bepaald met behulp van een gestandaardiseerde methode.2 De procedure gebruikt papieren schijfjes geïmpregneerd met 5 mcg cefdinir om de gevoeligheid van bacteriën te testen. De interpretatieve criteria voor schijfdiffusie worden gegeven in tabel 1.
De gevoeligheid van stafylokokken voor cefdinir kan worden afgeleid uit het testen van penicilline en cefoxitine of oxacilline. Stafylokokken die gevoelig zijn voor oxacilline (cefoxitine) kunnen als vatbaar worden beschouwd voor cefdinir.3
Een rapport van "Vensvatbaar" geeft aan dat antimicrobiële stoffen waarschijnlijk de groei van de ziekteverwekker remmen als de antimicrobiële verbinding de concentraties bereikt op de plaats van infectie die nodig zijn om de groei van de ziekteverwekker te remmen. Een rapport van "Intermediair" geeft aan dat het resultaat als dubbelzinnig moet worden beschouwd en dat, als het micro-organisme niet volledig vatbaar is voor alternatieve, klinisch haalbare geneesmiddelen, de test moet worden herhaald. Deze categorie impliceert mogelijke klinische toepasbaarheid op lichaamslocaties waar het medicijn fysiologisch geconcentreerd is of in situaties waar een hoge dosering van het medicijn kan worden gebruikt. Deze categorie biedt ook een bufferzone die voorkomt dat kleine ongecontroleerde technische factoren grote interpretatieverschillen veroorzaken. Een rapport van "Resistent" geeft aan dat het antimicrobiële middel de groei van het pathogeen waarschijnlijk niet remt als de antimicrobiële verbinding de concentraties bereikt die gewoonlijk op de infectieplaats kunnen worden bereikt; andere therapie moet worden gekozen.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de persoon die de test uitvoert, te controleren en te verzekeren.1,2,3 Standaard cefdinir-poeder moet het volgende bereik bieden van MIC-waarden zoals vermeld in tabel 2. Voor de diffusietechniek met een schijf van 5 mcg moeten de criteria in tabel 2 worden bereikt.
Klinische studies
Door de gemeenschap verworven bacteriële pneumonie
In een gecontroleerd, dubbelblind onderzoek bij volwassenen en adolescenten, uitgevoerd in de VS, werd cefdinir tweemaal daags vergeleken met cefaclor 500 mg driemaal daags. Met behulp van strikte evalueerbaarheid en microbiologische/klinische responscriteria 6 tot 14 dagen na therapie werden de volgende klinische genezingspercentages, vermoedelijke microbiologische uitroeiingspercentages en statistische resultaten verkregen:
Onderzoek naar door de gemeenschap verworven longontsteking in de VS Cefdinir vs Cefaclor
In een tweede gecontroleerd, onderzoekerblind onderzoek bij volwassenen en adolescenten, voornamelijk uitgevoerd in Europa, werd cefdinir tweemaal daags vergeleken met amoxicilline/clavulanaat 500/125 mg driemaal daags. Met behulp van strikte evalueerbaarheid en klinische responscriteria 6 tot 14 dagen na therapie werden de volgende klinische genezingspercentages, vermoedelijke microbiologische uitroeiingspercentages en statistische resultaten verkregen:
Onderzoek naar door de Europese Gemeenschap verworven pneumonie Cefdinir versus amoxicilline/clavulaan
Streptokokken faryngitis/tonsillitis
In vier gecontroleerde onderzoeken in de Verenigde Staten werd cefdinir vergeleken met 10 dagen penicilline bij volwassen, adolescente en pediatrische patiënten. In twee onderzoeken (een bij volwassenen en adolescenten, de andere bij pediatrische patiënten) werd 10 dagen cefdinir QD of BID vergeleken met penicilline 250 mg of 10 mg/kg QID. Met behulp van strikte evalueerbaarheid en microbiologische/klinische responscriteria 5 tot 10 dagen na therapie werden de volgende klinische genezingspercentages, microbiologische uitroeiingspercentages en statistische resultaten verkregen:
Onderzoek naar faryngitis/tonsillitis Cefdinir (10 dagen) versus penicilline (10 dagen)
In twee onderzoeken (een bij volwassenen en adolescenten, de andere bij pediatrische patiënten) werd 5 dagen cefdinir BID vergeleken met 10 dagen penicilline 250 mg of 10 mg/kg QID. Met behulp van strikte evalueerbaarheid en microbiologische/klinische responscriteria 4 tot 10 dagen na therapie werden de volgende klinische genezingspercentages, microbiologische uitroeiingspercentages en statistische resultaten verkregen:
Onderzoek naar faryngitis/tonsillitis Cefdinir (5 dagen) versus penicilline (10 dagen)
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard – tiende editie. CLSI-document M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
2. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor gevoeligheidstests voor antimicrobiële schijfdiffusie; Goedgekeurde standaard - Twaalfde editie. CLSI-document M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
3. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor antimicrobiële gevoeligheidstesten; Vijfentwintigste informatief supplement, CLSI-document M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
4. Cockcroft DW, Gault MH. Voorspelling van creatinineklaring uit serumcreatinine. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Een eenvoudige schatting van de glomerulaire filtratiesnelheid bij kinderen afgeleid van lichaamslengte en plasmacreatinine. Kindergeneeskunde 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Een eenvoudige schatting van de glomerulaire filtratiesnelheid bij voldragen zuigelingen tijdens het eerste levensjaar. J Kindergeneeskunde 1984;104:849-54.
PATIËNT INFORMATIE
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder OMNICEF 300 mg, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer OMNICEF 300 mg wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige therapiekuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet kunnen worden behandeld met OMNICEF 300 mg of andere antibacteriële geneesmiddelen.
Antacida die magnesium of aluminium bevatten, interfereren met de absorptie van cefdinir. Als dit type antacidum nodig is tijdens de behandeling met OMNICEF 300 mg, moet OMNICEF ten minste 2 uur voor of na het antacidum worden ingenomen.
IJzersupplementen, waaronder multivitaminen die ijzer bevatten, interfereren met de opname van cefdinir. Als ijzersupplementen nodig zijn tijdens de behandeling met OMNICEF 300 mg, moet OMNICEF ten minste 2 uur vóór of na het supplement worden ingenomen.
Met ijzer verrijkte zuigelingenvoeding interfereert niet significant met de absorptie van cefdinir. Daarom kan OMNICEF 300 mg voor orale suspensie worden toegediend met met ijzer verrijkte zuigelingenvoeding.
Diabetespatiënten en zorgverleners dienen zich ervan bewust te zijn dat de orale suspensie 2,86 g sucrose per theelepel bevat.
Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
