Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Augmentin 875 mg en hoe wordt het gebruikt?
Augmentin 250 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van veel verschillende infecties veroorzaakt door bacteriën, zoals infecties van de lagere luchtwegen, chronische obstructieve longziekte, bacteriële sinusitis, bijtwonden bij dieren en mensen en huidinfecties. Augmentin 125 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Augmentin is een penicilline, amino.
Wat zijn de mogelijke bijwerkingen van Augmentin?
Augmentin 750 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- bleke of vergeelde huid,
- donkergekleurde urine,
- koorts,
- verwardheid,
- zwakheid,
- verlies van eetlust,
- pijn in de bovenbuik,
- geel worden van de huid of ogen (geelzucht),
- gemakkelijk blauwe plekken of bloedingen,
- weinig of geen plassen,
- keelpijn,
- zwelling in uw gezicht of tong,
- brandend in je ogen,
- huidpijn gevolgd door een rode of paarse uitslag die zich uitbreidt (op het gezicht of bovenlichaam) met blaren en vervelling
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Augmentin zijn:
- misselijkheid,
- diarree,
- vaginale jeuk of afscheiding,
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Augmentin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
AUGMENTIN 500 mg is een orale antibacteriële combinatie bestaande uit amoxicilline en de bètalactamaseremmer, clavulanaatkalium (het kaliumzout van clavulaanzuur).
Amoxicilline is een analoog van ampicilline, afgeleid van de basische penicillinekern, 6 aminopenicillaanzuur. De molecuulformule van amoxicilline is C16H19N3O5S•3H2O en het molecuulgewicht is 419,46. Chemisch gezien is amoxicilline (2S,5R,6R)-6-[(R)-(-)-2-Amino-2-(p-hydroxyfenyl)acetamido]-3,3-dimethyl-7-oxo-4-thia -1-azabicyclo[3.2.0]heptaan-2-carbonzuurtrihydraat en kan structureel worden weergegeven als:
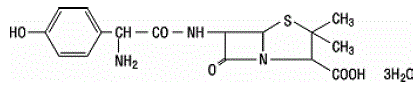
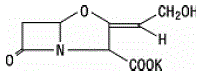
Clavulaanzuur wordt geproduceerd door de fermentatie van Streptomyces clavuligerus. Het is een bètalactam dat structureel verwant is aan de penicillines en heeft het vermogen om sommige bètalactamasen te inactiveren door de actieve plaatsen van deze enzymen te blokkeren. De molecuulformule van het clavulanaatkalium is C8H8KNO5 en het molecuulgewicht is 237,25. Chemisch gezien is clavulanaatkalium kalium (Z)(2R,5R)-3-(2-hydroxyethylideen)-7-oxo-4-oxa-1-azabicyclo[3.2.0]-heptaan-2-carboxylaat en kan het structureel worden weergegeven net zo:
inactieve ingredienten
- Tabletten - Colloïdaal siliciumdioxide, hypromellose, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, natriumzetmeelglycolaat en titaniumdioxide. Elke tablet AUGMENTIN bevat 0,63 mEq kalium.
- Poeder voor orale suspensie - Colloïdaal siliciumdioxide, smaakstoffen, xanthaangom en een of meer van de volgende: hypromellose, mannitol, silicagel, siliciumdioxide, barnsteenzuur, natriumsacharine en aspartaam. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Kauwtabletten - Colloïdaal siliciumdioxide, smaakstoffen, magnesiumstearaat, mannitol en een of meer van de volgende: D&C Yellow No. 10, FD&C Red No. 40, glycine, natriumsacharine en aspartaam. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN]
- Elke kauwtablet van 125 mg en elke 5 ml gereconstitueerde 125/5 ml orale suspensie van AUGMENTIN 750 mg bevat 0,16 mEq kalium
- Elke kauwtablet van 250 mg en elke 5 ml gereconstitueerde 250/5 ml orale suspensie van AUGMENTIN bevat 0,32 mEq kalium
- Elke kauwtablet van 200 mg en elke 5 ml gereconstitueerde 200/5 ml orale suspensie van AUGMENTIN bevat 0,14 mEq kalium
- Elke kauwtablet van 400 mg en elke 5 ml gereconstitueerde 400/5 ml orale suspensie van AUGMENTIN 500 mg bevat 0,29 mEq kalium
INDICATIES
Om de ontwikkeling van geneesmiddelresistente bacteriën te verminderen en de werkzaamheid van AUGMENTIN (amoxicilline/clavulanaatkalium) en andere antibacteriële geneesmiddelen te behouden, mag AUGMENTIN 500 mg alleen worden gebruikt voor de behandeling van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
AUGMENTIN® is een combinatie van penicilline-klasse antibacteriële en bèta-lactamaseremmer die is geïndiceerd voor de behandeling van infecties veroorzaakt door gevoelige isolaten van de aangewezen bacteriën in de onderstaande aandoeningen*:
Infecties van de onderste luchtwegen
Veroorzaakt door bèta-lactamase-producerende isolaten van Haemophilus influenzae en Moraxella catarrhalis.
Acute bacteriële otitis media
Veroorzaakt door bèta-lactamase-producerende isolaten van H. influenzae en M. catarrhalis.
sinusitis
Veroorzaakt door bèta-lactamase-producerende isolaten van H. influenzae en M. catarrhalis.
Huid- en huidstructuurinfecties
Veroorzaakt door bèta-lactamase-producerende isolaten van Staphylococcus aureus, Escherichia coli en Klebsiella-soorten.
Urineweginfecties
Veroorzaakt door bèta-lactamase-producerende isolaten van E. coli, Klebsiella-soorten en Enterobacter-soorten.
Beperkingen van gebruik
Wanneer de resultaten van gevoeligheidstests gevoeligheid voor amoxicilline aantonen, wat erop wijst dat er geen bètalactamase wordt geproduceerd, mag AUGMENTIN niet worden gebruikt.
DOSERING EN ADMINISTRATIE
AUGMENTIN 875 mg kan worden ingenomen zonder rekening te houden met maaltijden; de absorptie van clavulanaatkalium wordt echter versterkt wanneer AUGMENTIN 250 mg aan het begin van een maaltijd wordt toegediend. Om de kans op gastro-intestinale intolerantie te minimaliseren, moet AUGMENTIN 125 mg aan het begin van een maaltijd worden ingenomen.
volwassenen
De gebruikelijke dosering voor volwassenen is één tablet AUGMENTIN van 500 mg om de 12 uur of één tablet van 250 mg AUGMENTIN 125 mg om de 8 uur. Voor ernstigere infecties en infecties van de luchtwegen moet de dosis één 875 mg tablet AUGMENTIN 875 mg elke 12 uur of één 500 mg tablet AUGMENTIN elke 8 uur zijn. Volwassenen die moeite hebben met slikken, kunnen de 125 mg/5 ml of 250 mg/5 ml suspensie krijgen in plaats van de 500 mg tablet. De suspensie van 200 mg/5 ml of de suspensie van 400 mg/5 ml kan worden gebruikt in plaats van de tablet van 875 mg.
Twee AUGMENTIN-tabletten van 250 mg mogen niet worden vervangen door één AUGMENTIN-tablet van 500 mg. Aangezien zowel de 250 mg als de 500 mg tabletten van AUGMENTIN dezelfde hoeveelheid clavulaanzuur (125 mg, als het kaliumzout) bevatten, zijn twee tabletten van 250 mg niet gelijk aan één 500 mg tablet AUGMENTIN.
De AUGMENTIN-tablet van 250 mg en de kauwtablet van 250 mg mogen elkaar niet vervangen, aangezien ze niet onderling uitwisselbaar zijn. De 250 mg tablet AUGMENTIN 250 mg en de 250 mg kauwtablet bevatten niet dezelfde hoeveelheid clavulaanzuur (als het kaliumzout). De AUGMENTIN-tablet van 250 mg bevat 125 mg clavulaanzuur, terwijl de kauwtablet van 250 mg 62,5 mg clavulaanzuur bevat.
Pediatrische patiënten
Op basis van de amoxicillinecomponent moet AUGMENTIN als volgt worden gedoseerd:
Pasgeborenen en zuigelingen van
De aanbevolen dosis AUGMENTIN is 30 mg/kg/dag, verdeeld om de 12 uur, gebaseerd op de amoxicillinecomponent. De ervaring met de formulering van 200 mg/5 ml in deze leeftijdsgroep is beperkt en daarom wordt het gebruik van de orale suspensie van 125 mg/5 ml aanbevolen.
Patiënten van 12 weken (3 maanden) en ouder
Zie doseringsschema's in tabel 1. Het schema om de 12 uur wordt aanbevolen omdat het gepaard gaat met aanzienlijk minder diarree [zie Klinische studies ]. De suspensie om de 12 uur (200 mg/5 ml en 400 mg/5 ml) en kauwtabletten (200 mg en 400 mg) bevatten echter aspartaam en mogen niet door fenylketonurie worden gebruikt. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Patiënten met een gewicht van 40 kg of meer
Pediatrische patiënten die 40 kg of meer wegen, moeten worden gedoseerd volgens de aanbevelingen voor volwassenen.
De AUGMENTIN-tablet van 250 mg mag pas worden gebruikt als het kind ten minste 40 kg weegt, vanwege de verschillende verhoudingen tussen amoxicilline en clavulaanzuur in de AUGMENTIN-tablet van 250 mg (250/125) versus de kauwtablet van 250 mg. AUGMENTIN (250/62.5).
Patiënten met nierinsufficiëntie
Bij patiënten met een verminderde nierfunctie is in het algemeen geen dosisverlaging nodig, tenzij de nierfunctiestoornis ernstig is. Patiënten met een nierfunctiestoornis met een glomerulaire filtratiesnelheid van
Hemodialysepatiënten moeten elke 24 uur 500 mg of 250 mg krijgen, afhankelijk van de ernst van de infectie. Ze moeten zowel tijdens als aan het einde van de dialyse een extra dosis krijgen.
Aanwijzingen voor het mengen van orale suspensie
Bereid op het moment van afgifte als volgt een suspensie: Tik op de fles totdat al het poeder vrij kan stromen. Voeg ongeveer 2/3 van de totale hoeveelheid water voor reconstitutie toe (zie tabel 2 hieronder) en schud krachtig om het poeder te suspenderen. Voeg de rest van het water toe en schud opnieuw krachtig.
Opmerking: Schud de orale suspensie goed voor gebruik. De gereconstitueerde suspensie moet in de koelkast worden bewaard en na 10 dagen worden weggegooid.
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten
- 250 mg/125 mg-tabletten: Elke witte ovale filmomhulde tablet, met de inscriptie AUGMENTIN 750 mg aan de ene kant en 250/125 aan de andere kant, bevat 250 mg amoxicilline en 125 mg clavulaanzuur als kaliumzout.
- 500 mg/125 mg-tabletten: Elke witte ovale filmomhulde tablet, met de inscriptie AUGMENTIN 125 mg aan de ene kant en 500/125 aan de andere kant, bevat 500 mg amoxicilline en 125 mg clavulaanzuur als kaliumzout.
- 875 mg/125 mg-tabletten: Elke witte capsulevormige tablet met een breukgleuf, met aan de ene kant de inscriptie AUGMENTIN 875 en aan de andere kant een breukstreep, bevat 875 mg amoxicilline en 125 mg clavulaanzuur als kaliumzout.
Poeder voor orale suspensie
- 125 mg/31,25 mg per 5 ml: Poeder met bananensmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 125 mg amoxicilline en 31,25 mg clavulaanzuur als kaliumzout).
- 200 mg/28,5 mg per 5 ml: Sinaasappelpoeder voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 200 mg amoxicilline en 28,5 mg clavulaanzuur als kaliumzout).
- 250 mg/62,5 mg per 5 ml: Poeder met sinaasappelsmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 250 mg amoxicilline en 62,5 mg clavulaanzuur als kaliumzout).
- 400 mg/57 mg per 5 ml Poeder met sinaasappelsmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 400 mg amoxicilline en 57,0 mg clavulaanzuur als kaliumzout).
Kauwbare tabletten
- 125 mg/31,25 mg kauwtabletten: Elke gevlekte gele, ronde tablet met citroen-limoensmaak, bedrukt met BMP 189, bevat 125 mg amoxicilline en 31,25 mg clavulaanzuur als kaliumzout.
- 200 mg/28,5 mg kauwtabletten: Elke gevlekte roze, ronde, biconvexe tablet met kersen-banaansmaak, met de inscriptie AUGMENTIN 200, bevat 200 mg amoxicilline en 28,5 mg clavulaanzuur als het kaliumzout.
- 250 mg/62,5 mg kauwtabletten: Elke gevlekte gele, ronde tablet met citroen-limoensmaak, bedrukt met BMP 190, bevat 250 mg amoxicilline en 62,5 mg clavulaanzuur als kaliumzout.
- 400 mg/57 mg kauwtabletten: Elke gevlekte roze, ronde, biconvexe tablet met kersen-banaansmaak, bedrukt met AUGMENTIN 400, bevat 400 mg amoxicilline en 57,0 mg clavulaanzuur als het kaliumzout.
De 250 mg tablet AUGMENTIN 750 mg en de 250 mg kauwtablet mogen NIET door elkaar worden vervangen, aangezien ze niet onderling uitwisselbaar zijn en de 250 mg tablet mag niet worden gebruikt bij kinderen die minder dan 40 kg wegen. De AUGMENTIN-tablet van 250 mg en de kauwtablet van 250 mg bevatten niet dezelfde hoeveelheid clavulaanzuur. De AUGMENTIN-tablet van 250 mg bevat 125 mg clavulaanzuur, terwijl de kauwtablet van 250 mg 62,5 mg clavulaanzuur bevat.
Twee AUGMENTIN-tabletten van 250 mg van 750 mg mogen NIET worden vervangen door één AUGMENTIN-tablet van 500 mg. Aangezien zowel de 250 mg als de 500 mg tabletten AUGMENTIN dezelfde hoeveelheid clavulaanzuur (125 mg, als het kaliumzout) bevatten, zijn twee 250 mg tabletten AUGMENTIN 750 mg niet gelijk aan één 500 mg tablet AUGMENTIN.
Opslag en behandeling
Tabletten
250 mg/125 mg-tabletten: Elke witte ovale filmomhulde tablet, met de inscriptie AUGMENTIN 750 mg aan de ene kant en 250/125 aan de andere kant, bevat 250 mg amoxicilline als het trihydraat en 125 mg clavulaanzuur als het kaliumzout.
NDC 43598-018-30 flessen van 30 NDC 43598-018-78 Eenheidsdosis (10x10) 100 tabletten
500 mg/125 mg-tabletten: Elke witte ovale filmomhulde tablet, met de inscriptie AUGMENTIN aan de ene kant en 500/125 aan de andere kant, bevat 500 mg amoxicilline als het trihydraat en 125 mg clavulaanzuur als het kaliumzout.
NDC 43598-006-14 flessen van 20 NDC 43598-006-78 Eenheidsdosis (10x10) 100 tabletten
875 mg/125 mg-tabletten: Elke witte capsulevormige tablet met breukgleuf, met aan de ene kant de inscriptie AUGMENTIN 875 en aan de andere kant een breukstreep, bevat 875 mg amoxicilline als het trihydraat en 125 mg clavulaanzuur als het kaliumzout.
NDC 43598-021-14 flessen van 20 NDC 43598-021-78 Eenheidsdosis (10x10) 100 tabletten
Poeder voor orale suspensiepennen ion:125 mg/31,25 mg per 5 ml: Poeder met bananensmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 125 mg amoxicilline en 31,25 mg clavulaanzuur als kaliumzout).
NDC 43598-012-51 Fles van 75 ml NDC 43598-012-52 Fles van 100 ml NDC 43598-012-53 150 ml fles
200 mg/28,5 mg per 5 ml: Sinaasappelpoeder voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 200 mg amoxicilline en 28,5 mg clavulaanzuur als kaliumzout).
NDC 43598-013-50 50 ml fles NDC 43598-013-51 Fles van 75 ml NDC 43598-013-52 Fles van 100 ml
250 mg/62,5 mg per 5 ml: Poeder met sinaasappelsmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 250 mg amoxicilline en 62,5 mg clavulaanzuur als kaliumzout).
NDC 43598-004-51 Fles van 75 ml NDC 43598-004-52 Fles van 100 ml NDC 43598-004-53 150 ml fles
400 mg/57 mg per 5 ml Poeder met sinaasappelsmaak voor orale suspensie (elke 5 ml gereconstitueerde suspensie bevat 400 mg amoxicilline en 57,0 mg clavulaanzuur als kaliumzout).
NDC 43598-008-50 50 ml fles NDC 43598-008-51 Fles van 75 ml NDC 43598-008-52 Fles van 100 ml
Kauwtabletten: 125 mg/31,25 mg Kauwtabletten: Elke gevlekte gele, ronde tablet met citroen-limoensmaak, bedrukt met BMP 189, bevat 125 mg amoxicilline en 31,25 mg clavulaanzuur als het kaliumzout.
NDC 43598-014-31 doos met 30 (5x6) tabletten
200 mg/28,5 mg kauwtabletten: Elke gevlekte roze, ronde, biconvexe tablet met kersen-banaansmaak, bedrukt met AUGMENTIN 200, bevat 200 mg amoxicilline en 28,5 mg clavulaanzuur als kaliumzout.
NDC 43598-015-14 doos van 20 tabletten
250 mg/62,5 mg kauwtabletten: Elke gespikkelde gele, ronde tablet met citroen-limoensmaak, bedrukt met BMP 190, bevat 250 mg amoxicilline en 62,5 mg clavulaanzuur als kaliumzout.
NDC 43598-016-31 doos van 30 (5x6) tabletten
400 mg/57 mg kauwtabletten: Elke gevlekte roze, ronde, biconvexe tablet met kersen-banaansmaak, bedrukt met AUGMENTIN 400, bevat 400 mg amoxicilline en 57,0 mg clavulaanzuur als het kaliumzout.
NDC 43598-017-14 doos van 20 tabletten
Doseer in originele verpakking.
Bewaar tabletten en droog poeder bij of beneden 25°C (77°F).
Bewaar de gereconstitueerde suspensie in de koelkast. Gooi ongebruikte suspensie na 10 dagen weg. Buiten bereik van kinderen bewaren.
REFERENTIES
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. De effecten van inname van penicilline en cefalosporine bij kinderen jonger dan zes jaar.Vet Hum Toxicol. 1988; 30: 66 67.
2. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard - 8e. CLSI-document M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienorm voor gevoeligheidstests voor antimicrobiële schijven; Goedgekeurde norm – 11e. CLSI-document M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Prestatienormen voor testen op antimicrobiële gevoeligheid: 22e informatief supplement. CLSI-document M100-S22. CLSI, Wayne, PA, 2012.
Gedistribueerd door: Dr. Reddy's Laboratories Inc. Bridgewater, NJ 08807. Herzien: maart 2013
BIJWERKINGEN
Het volgende wordt in meer detail besproken in andere secties van de etikettering:
- Anafylactische reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverfunctiestoornis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- CDAD [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Klinische proefervaring
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De meest gemelde bijwerkingen waren diarree/dunne ontlasting (9%), misselijkheid (3%), huiduitslag en urticaria (3%), braken (1%) en vaginitis (1%). Minder dan 3% van de patiënten stopte met de behandeling vanwege geneesmiddelgerelateerde bijwerkingen. De totale incidentie van bijwerkingen, en in het bijzonder diarree, nam toe met de hogere aanbevolen dosis. Andere, minder vaak gemelde bijwerkingen (
Bij pediatrische patiënten (in de leeftijd van 2 maanden tot 12 jaar) werd 1 Amerikaans/Canadees klinisch onderzoek uitgevoerd waarin 45/6,4 mg/kg/dag (om de 12 uur verdeeld) AUGMENTIN gedurende 10 dagen werd vergeleken met 40/10 mg/kg/dag (om de 8 uur verdeeld) van AUGMENTIN 125 mg gedurende 10 dagen bij de behandeling van acute middenoorontsteking. In totaal werden 575 patiënten geïncludeerd en in deze studie werden alleen de suspensieformuleringen gebruikt. Over het algemeen waren de waargenomen bijwerkingen vergelijkbaar met die hierboven vermeld; er waren echter verschillen in de frequentie van diarree, huiduitslag/urticaria en uitslag in het luiergebied. [Zien Klinische studies ]
Postmarketingervaring
Naast bijwerkingen die zijn gemeld tijdens klinische onderzoeken, zijn de volgende vastgesteld tijdens postmarketinggebruik van AUGMENTIN. Omdat ze vrijwillig worden gerapporteerd vanuit een populatie van onbekende omvang, kunnen schattingen van de frequentie niet worden gemaakt. Deze voorvallen zijn gekozen voor opname vanwege een combinatie van hun ernst, frequentie van rapportage of mogelijk causaal verband met AUGMENTIN.
gastro-intestinaal
Indigestie, gastritis, stomatitis, glossitis, zwarte "harige" tong, mucocutane candidiasis, enterocolitis en hemorragische/pseudomembraneuze colitis. Symptomen van pseudomembraneuze colitis kunnen optreden tijdens of na behandeling met antibiotica. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Overgevoeligheidsreacties
Pruritus, angio-oedeem, serumziekte-achtige reacties (urticaria of huiduitslag vergezeld van artritis, artralgie, myalgie en vaak koorts), erythema multiforme, Stevens-Johnson-syndroom, acute gegeneraliseerde exanthemateuze pustulosis, overgevoeligheidsvasculitis en gevallen van exfoliatieve dermatitis (inclusief toxische epidermale necrolyse) zijn gemeld. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Lever
Leverfunctiestoornissen, waaronder hepatitis en cholestatische geelzucht, verhogingen van serumtransaminasen (ASAT en/of ALT), serumbilirubine en/of alkalische fosfatase, zijn gemeld met AUGMENTIN. Het is vaker gemeld bij ouderen, bij mannen of bij patiënten die langdurig worden behandeld. De histologische bevindingen over leverbiopsie bestonden voornamelijk uit cholestatische behandeling. De histologische bevindingen over leverbiopsie bestonden voornamelijk uit cholestatische, hepatocellulaire of gemengde cholestatische hepatocellulaire veranderingen. Het begin van tekenen/symptomen van leverdisfunctie kan optreden tijdens of enkele weken nadat de behandeling is stopgezet. De leverfunctiestoornis, die ernstig kan zijn, is meestal omkeerbaar. Er zijn doden gemeld. [zien CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
nier
Interstitiële nefritis, hematurie en kristalurie zijn gemeld. [zien OVERDOSERING ]

Hemische en lymfatische systemen
Anemie, waaronder hemolytische anemie, trombocytopenie, trombocytopenische purpura, eosinofilie, leukopenie en agranulocytose zijn gemeld. Deze reacties zijn gewoonlijk reversibel na stopzetting van de behandeling en er wordt aangenomen dat ze overgevoeligheidsverschijnselen zijn. Trombocytose werd opgemerkt bij minder dan 1% van de patiënten die met AUGMENTIN werden behandeld. Er zijn meldingen geweest van een verlengde protrombinetijd bij patiënten die gelijktijdig met AUGMENTIN 125 mg en anticoagulantia werden behandeld. [zien DRUG-INTERACTIES ]
Centraal zenuwstelsel
Agitatie, angst, gedragsveranderingen, verwardheid, convulsies, duizeligheid, slapeloosheid en reversibele hyperactiviteit zijn gemeld.
Diversen
Tandverkleuring (bruine, gele of grijze verkleuring) is gemeld. De meeste meldingen deden zich voor bij pediatrische patiënten. Verkleuring werd in de meeste gevallen verminderd of geëlimineerd door poetsen of gebitsreiniging.
DRUG-INTERACTIES
probenecide
Probenecide vermindert de renale tubulaire secretie van amoxicilline, maar vertraagt de renale excretie van clavulaanzuur niet. Gelijktijdig gebruik met AUGMENTIN 875 mg kan leiden tot verhoogde en langdurige bloedconcentraties van amoxicilline. Gelijktijdige toediening van probenecide wordt niet aanbevolen.
Orale anticoagulantia
Abnormale verlenging van de protrombinetijd (increased international normalized ratio [INR]) is gemeld bij patiënten die amoxicilline en orale anticoagulantia kregen. Wanneer gelijktijdig met AUGMENTIN anticoagulantia worden voorgeschreven, dient passende controle te worden uitgevoerd. Aanpassingen in de dosis van orale anticoagulantia kunnen nodig zijn om het gewenste niveau van anticoagulatie te handhaven.
Allopurinol
De gelijktijdige toediening van allopurinol en amoxicilline verhoogt de incidentie van huiduitslag bij patiënten die beide geneesmiddelen krijgen in vergelijking met patiënten die alleen amoxicilline krijgen. Het is niet bekend of deze versterking van amoxicilline-uitslag te wijten is aan allopurinol of de hyperurikemie die bij deze patiënten aanwezig is.
Orale anticonceptiva
AUGMENTIN 750 mg kan de darmflora beïnvloeden, wat leidt tot een lagere oestrogeenreabsorptie en verminderde werkzaamheid van gecombineerde orale oestrogeen/progesteron-anticonceptiva.
Effecten op laboratoriumtests
Hoge urineconcentraties van amoxicilline kunnen leiden tot vals-positieve reacties bij het testen op de aanwezigheid van glucose in de urine met behulp van CLINITEST®, Benedict's Solution of Fehling's Solution. Aangezien dit effect ook kan optreden bij AUGMENTIN, wordt aanbevolen glucosetests te gebruiken op basis van enzymatische glucose-oxidasereacties.
Na toediening van amoxicilline aan zwangere vrouwen is een voorbijgaande afname van de plasmaconcentratie van totaal geconjugeerd oestriol, oestriolglucuronide, geconjugeerd oestron en estradiol waargenomen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Overgevoeligheidsreacties
Ernstige en soms fatale overgevoeligheidsreacties (anafylactische reacties) zijn gemeld bij patiënten die bètalactamantibiotica kregen, waaronder AUGMENTIN. Deze reacties komen vaker voor bij personen met een voorgeschiedenis van overgevoeligheid voor penicilline en/of een voorgeschiedenis van gevoeligheid voor meerdere allergenen. Alvorens de behandeling met AUGMENTIN 250 mg te starten, moet zorgvuldig worden nagegaan of eerdere overgevoeligheidsreacties op penicillines, cefalosporines of andere allergenen hebben plaatsgevonden. Als een allergische reactie optreedt, moet AUGMENTIN worden gestaakt en moet een geschikte therapie worden ingesteld.
Leverfunctiestoornis
Leverdisfunctie, waaronder hepatitis en cholestatische geelzucht, is in verband gebracht met het gebruik van AUGMENTIN. Levertoxiciteit is meestal omkeerbaar; er zijn echter sterfgevallen gemeld. De leverfunctie moet met regelmatige tussenpozen worden gecontroleerd bij patiënten met een leverfunctiestoornis.
Clostridium difficile geassocieerde diarree (CDAD)
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder AUGMENTIN 250 mg, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxineproducerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na antibacterieel gebruik. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan 2 maanden na toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het lopende antibacteriële gebruik dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële behandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Huiduitslag bij patiënten met mononucleosis
Een hoog percentage patiënten met mononucleosis die amoxicilline krijgen, ontwikkelt een erythemateuze huiduitslag. AUGMENTIN mag daarom niet worden toegediend aan patiënten met mononucleosis.
Potentieel voor microbiële overgroei
Tijdens de behandeling moet rekening worden gehouden met de mogelijkheid van superinfecties met schimmel- of bacteriële pathogenen. Als superinfectie optreedt, moet amoxicilline/clavulanaatkalium worden gestaakt en moet een passende therapie worden ingesteld.
Fenylketonurie
AUGMENTIN 500 mg kauwtabletten en AUGMENTIN poeder voor drank bevatten aspartaam dat fenylalanine bevat. Elke kauwtablet van 200 mg AUGMENTIN 750 mg bevat 2,1 mg fenylalanine; elke kauwtablet van 400 mg bevat 4,2 mg fenylalanine; elke 5 ml van de 200 mg/5 ml of 400 mg/5 ml suspensie voor oraal gebruik bevat 7 mg fenylalanine. De andere formuleringen van AUGMENTIN 875 mg bevatten geen fenylalanine.
Ontwikkeling van geneesmiddelresistente bacteriën
Het is onwaarschijnlijk dat het voorschrijven van AUGMENTIN 250 mg bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie de patiënt voordeel zal opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen langetermijnstudies bij dieren uitgevoerd om het carcinogene potentieel te evalueren.
AUGMENTIN (formulering met een verhouding van 4:1 van amoxicilline:clavulanaat) was niet-mutageen in de Ames-bacteriemutatietest en de gistgenconversietest. AUGMENTIN was zwak positief in de muislymfoomtest, maar de trend naar verhoogde mutatiefrequenties in deze test trad op bij doses die ook geassocieerd waren met verminderde celoverleving. AUGMENTIN was negatief in de micronucleustest bij muizen en in de dominante letale test bij muizen. Kaliumclavulanaat alleen werd getest in de Ames-bacteriële mutatietest en in de micronucleustest bij muizen, en was negatief in elk van deze testen.
AUGMENTIN (2:1 verhouding formulering van amoxicilline:clavulanaat) bij orale doses tot 1200 mg/kg/dag bleek geen effect te hebben op de vruchtbaarheid en reproductieprestaties bij ratten. Op basis van het lichaamsoppervlak is deze dosis amoxicilline ongeveer 4 keer de maximaal aanbevolen orale dosis voor volwassenen (875 mg om de 12 uur). Voor clavulanaat is de meervoudige dosis ongeveer 9 keer hoger dan de maximaal aanbevolen orale dosis voor volwassenen (125 mg om de 8 uur), ook gebaseerd op het lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten
Zwangerschap Categorie B. Voortplantingsonderzoeken uitgevoerd bij zwangere ratten en muizen die AUGMENTIN kregen (formulering van amoxicilline:clavulanaat in een verhouding van 2:1) in orale doses tot 1200 mg/kg/dag toonden geen bewijs van schade aan de foetus als gevolg van AUGMENTIN. De doses amoxicilline bij ratten en muizen (op basis van lichaamsoppervlak) waren ongeveer 4 en 2 keer de maximaal aanbevolen orale dosis voor volwassenen (875 mg om de 12 uur). Voor clavulanaat waren deze dosisveelvouden ongeveer 9 en 4 keer de maximaal aanbevolen orale dosis voor volwassenen (125 mg om de 8 uur). Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Orale antibiotica van de ampicillineklasse worden slecht geabsorbeerd tijdens de bevalling. Het is niet bekend of het gebruik van amoxicilline/clavulanaatkalium bij de mens tijdens de bevalling of bevalling onmiddellijke of uitgestelde nadelige effecten op de foetus heeft, de duur van de bevalling verlengt of de kans op de noodzaak van een verloskundige ingreep vergroot.
Moeders die borstvoeding geven
Het is aangetoond dat amoxicilline wordt uitgescheiden in de moedermelk. Het gebruik van amoxicilline/clavulaanzuur door moeders die borstvoeding geven, kan leiden tot sensibilisatie bij zuigelingen. Voorzichtigheid is geboden wanneer amoxicilline/clavulaanzuur kalium wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik
De veiligheid en werkzaamheid van AUGMENTIN poeder voor orale suspensie en kauwtabletten zijn vastgesteld bij pediatrische patiënten. Het gebruik van AUGMENTIN 125 mg bij pediatrische patiënten wordt ondersteund door bewijs uit onderzoeken met AUGMENTIN-tabletten bij volwassenen met aanvullende gegevens uit een onderzoek met AUGMENTIN poeder voor orale suspensie bij pediatrische patiënten van 2 maanden tot 12 jaar met acute middenoorontsteking. [zien Klinische studies ]
Vanwege een onvolledig ontwikkelde nierfunctie bij pasgeborenen en jonge zuigelingen kan de eliminatie van amoxicilline vertraagd zijn; De eliminatie van clavulanaat is ongewijzigd in deze leeftijdsgroep. De dosering van AUGMENTIN 500 mg moet worden aangepast bij pediatrische patiënten in de leeftijd DOSERING EN ADMINISTRATIE ]
Geriatrisch gebruik
Van de 3.119 patiënten in een analyse van klinische onderzoeken met AUGMENTIN was 32% ≥65 jaar oud en 14% was ≥75 jaar oud. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op bijwerkingen van dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren.
Dosering bij nierinsufficiëntie
Amoxicilline wordt voornamelijk uitgescheiden door de nieren en aanpassing van de dosering is gewoonlijk vereist bij patiënten met een ernstige nierfunctiestoornis (GFR Patiënten met nierinsufficiëntie voor specifieke aanbevelingen bij patiënten met nierinsufficiëntie.
OVERDOSERING
In geval van overdosering, stop met medicatie, behandel symptomatisch en stel zo nodig ondersteunende maatregelen in. Een prospectieve studie bij 51 pediatrische patiënten in een antigifcentrum suggereerde dat overdoseringen van minder dan 250 mg/kg amoxicilline niet gepaard gaan met significante klinische symptomen1.
Interstitiële nefritis resulterend in oligurisch nierfalen is gemeld bij patiënten na overdosering met amoxicilline/clavulanaatkalium.
Kristalurie, in sommige gevallen leidend tot nierfalen, is ook gemeld na overdosering met amoxicilline/clavulanaat kalium bij volwassen en pediatrische patiënten. In geval van overdosering moeten voldoende vochtinname en diurese worden gehandhaafd om het risico op amoxicilline/clavulanaatkaliumkristallurie te verminderen. Nierinsufficiëntie lijkt reversibel te zijn bij stopzetting van de toediening van het geneesmiddel. Hoge bloedspiegels kunnen sneller optreden bij patiënten met een verminderde nierfunctie vanwege een verminderde renale klaring van amoxicilline/clavulanaatkalium. Amoxicilline/clavulanaatkalium kan door hemodialyse uit de bloedsomloop worden verwijderd. [zien DOSERING EN ADMINISTRATIE ]
CONTRA-INDICATIES
Ernstige overgevoeligheidsreacties
AUGMENTIN is gecontra-indiceerd bij patiënten met een voorgeschiedenis van ernstige overgevoeligheidsreacties (bijv. anafylaxie of Stevens-Johnson-syndroom) op amoxicilline, clavulanaat of op andere bètalactamantibacteriële geneesmiddelen (bijv. penicillines en cefalosporines).
Cholestatische geelzucht/leverfunctiestoornis
AUGMENTIN 250 mg is gecontra-indiceerd bij patiënten met een voorgeschiedenis van cholestatische geelzucht/leverdisfunctie geassocieerd met AUGMENTIN.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
AUGMENTIN is een antibacterieel medicijn. [zien Microbiologie ]
Farmacokinetiek
De gemiddelde farmacokinetische parameters van amoxicilline en clavulanaatkalium bij normale volwassenen na toediening van AUGMENTIN 250 mg tabletten worden weergegeven in tabel 3 en na toediening van AUGMENTIN 250 mg poeder voor orale suspensie en kauwtabletten worden weergegeven in tabel 4.
Orale toediening van 5 ml 250 mg/5 ml suspensie van AUGMENTIN of de equivalente dosis van 10 ml 125 mg/5 ml suspensie van AUGMENTIN levert gemiddelde piekserumconcentraties ongeveer 1 uur na dosering van 6,9 mcg/ml voor amoxicilline en 1,6 mcg /mL voor clavulaanzuur. De oppervlakten onder de serumconcentratiecurves die werden verkregen tijdens de eerste 4 uur na toediening waren 12,6 mcg*h/ml voor amoxicilline en 2,9 mcg*h/ml voor clavulaanzuur bij 5 ml 250 mg/5 ml suspensie van AUGMENTIN of een equivalente dosis van 10 ml 125 mg/5 ml suspensie van AUGMENTIN werd toegediend aan normale volwassenen. Eén kauwtablet van 250 mg AUGMENTIN of twee kauwtabletten van 125 mg AUGMENTIN komen overeen met 5 ml 250 mg/5 ml suspensie van AUGMENTIN en geven vergelijkbare serumconcentraties van amoxicilline en clavulaanzuur.
De serumconcentraties van amoxicilline die worden bereikt met AUGMENTIN 250 mg zijn vergelijkbaar met de concentraties die worden verkregen door de orale toediening van equivalente doses amoxicilline alleen. Er is aangetoond dat de tijd boven de minimale remmende concentratie van 1 mcg/ml voor amoxicilline vergelijkbaar is na overeenkomende doseringsschema's van AUGMENTIN 250 mg om de 12 uur en om de 8 uur bij volwassenen en kinderen.
Absorptie
Dosering in nuchtere of gevoede toestand heeft een minimaal effect op de farmacokinetiek van amoxicilline. Hoewel AUGMENTIN kan worden gegeven zonder rekening te houden met maaltijden, is de absorptie van clavulanaatkalium bij inname met voedsel groter dan in nuchtere toestand. In één onderzoek was de relatieve biologische beschikbaarheid van clavulanaat verminderd wanneer AUGMENTIN 30 en 150 minuten na het begin van een vetrijk ontbijt werd gedoseerd.
Verdeling
Geen van beide componenten in AUGMENTIN is sterk eiwitgebonden; clavulaanzuur is voor ongeveer 25% gebonden aan humaan serum en amoxicilline is voor ongeveer 18% gebonden. Amoxicilline diffundeert gemakkelijk in de meeste lichaamsweefsels en vloeistoffen, met uitzondering van de hersenen en het ruggenmergvocht.
Twee uur na orale toediening van een enkelvoudige dosis van 35 mg/kg suspensie van AUGMENTIN 500 mg aan nuchtere kinderen werden gemiddelde concentraties van 3 mcg/ml amoxicilline en 0,5 mcg/ml clavulaanzuur gedetecteerd in middenooreffusies.
Metabolisme en uitscheiding
De halfwaardetijd van amoxicilline na orale toediening van AUGMENTIN 125 mg is 1,3 uur en die van clavulaanzuur is 1 uur.
Ongeveer 50% tot 70% van het amoxicilline en ongeveer 25% tot 40% van het clavulaanzuur wordt onveranderd uitgescheiden in de urine gedurende de eerste 6 uur na toediening van een enkele tablet van 250 mg of 500 mg AUGMENTIN.
Microbiologie
Amoxicilline is een semisynthetisch antibioticum met in vitro bactericide activiteit tegen Gram-positieve en Gram-negatieve bacteriën. Amoxicilline is echter gevoelig voor afbraak door bètalactamasen en daarom omvat het werkingsspectrum geen organismen die deze enzymen produceren. Clavulaanzuur is een bètalactam, structureel verwant aan de penicillines, dat het vermogen heeft om sommige bètalactamase-enzymen te inactiveren die vaak worden aangetroffen in micro-organismen die resistent zijn tegen penicillines en cefalosporines. Het heeft in het bijzonder een goede activiteit tegen de klinisch belangrijke plasmide-gemedieerde beta-actamasen die vaak verantwoordelijk zijn voor overgedragen geneesmiddelresistentie.
De formulering van amoxicilline en clavulaanzuur in AUGMENTIN beschermt amoxicilline tegen afbraak door sommige bètalactamase-enzymen en breidt het antibioticaspectrum van amoxicilline uit met veel bacteriën die normaal resistent zijn tegen amoxicilline.
Van amoxicilline/clavulaanzuur is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties, zoals beschreven in de rubriek INDICATIES EN GEBRUIK.
Gram-positieve bacteriën
Staphylococcus aureus
Gram-negatieve bacteriën
Enterobactersoort Escherichia coli Haemophilus influenzae Klebsiella-soort Moraxella catarrhalis
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is onbekend . Ten minste 90 procent van de volgende bacteriën vertoont in vitro een minimale remmende concentratie (MIC) die kleiner is dan of gelijk is aan het gevoelige breekpunt voor amoxicilline/clavulaanzuur. De werkzaamheid van amoxicilline/clavulaanzuur bij de behandeling van klinische infecties veroorzaakt door deze bacteriën is niet geweest vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Viridans-groep Streptococcus
Gram-negatieve bacteriën
Eikenellacorrodens Proteus mirabilis
Anaërobe bacteriën
Bacteroides-soorten waaronder Bacteroides fragilis Fusobacterium-soorten Peptostreptococcus-soorten
Gevoeligheidstestmethoden
Indien beschikbaar, moet het laboratorium voor klinische microbiologie de resultaten van in vitro gevoeligheidstestresultaten voor antimicrobiële geneesmiddelen die in residentiële ziekenhuizen worden gebruikt, aan de arts verstrekken als periodieke rapporten die het gevoeligheidsprofiel van nosocomiale en buiten het ziekenhuis verworven pathogenen beschrijven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële minimale remmende concentraties (MIC's) te bepalen. Deze MIC's geven schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's dienen te worden bepaald met behulp van een gestandaardiseerde testmethode2,3 (bouillon en/of agar). De MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 5.
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, kunnen ook reproduceerbare schattingen opleveren van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte geeft een schatting van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte moet worden bepaald met behulp van een gestandaardiseerde testmethode3,4. Bij deze procedure worden papieren schijfjes geïmpregneerd met 30 mcg amoxicilline/clavulaanzuur (20 mcg amoxicilline plus 10 mcg clavulaanzuur) gebruikt om de gevoeligheid van bacteriën voor amoxicilline/clavulaanzuur te testen. De interpretatieve criteria voor schijfdiffusie worden gegeven in Tabel 5.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de personen die de test uitvoeren te controleren en te verzekeren2,3,4. Standaard amoxicilline/clavulaanzuurpoeder moet het volgende bereik van MIC-waarden bieden zoals vermeld in tabel 6 voor de diffusietechniek met behulp van de schijf van 30 mcg amoxicilline/clavulaanzuur (20 mcg amoxicilline plus 10 mcg clavulaanzuur), de criteria in tabel 6 moeten worden bereikt .
Klinische studies
Lagere luchtwegen en gecompliceerde urineweginfecties
Gegevens uit 2 hoofdonderzoeken bij 1.191 patiënten die werden behandeld voor lagere luchtweginfecties of gecompliceerde urineweginfecties vergeleken een regime van 875 mg tabletten AUGMENTIN elke 12 uur met 500 mg tabletten AUGMENTIN 125 mg toegediend om de 8 uur (respectievelijk 584 en 607 patiënten ). Een vergelijkbare werkzaamheid werd aangetoond tussen de doseringsschema's om de 12 uur en om de 8 uur. Er was geen significant verschil in het percentage bijwerkingen in elke groep. De meest gemelde bijwerking was diarree; incidentiecijfers waren vergelijkbaar voor de doseringsschema's van 875 mg om de 12 uur en 500 mg om de 8 uur (respectievelijk 15% en 14%); er was echter een statistisch significant verschil (p
In een van deze centrale onderzoeken werden patiënten met ofwel pyelonefritis (n = 361) of een gecompliceerde urineweginfectie (dwz patiënten met afwijkingen van de urinewegen die vatbaar maken voor terugval van bacteriurie na uitroeiing, n = 268) gerandomiseerd (1: 1) om ofwel 875 mg tabletten AUGMENTIN 125 mg om de 12 uur (n=308) of 500 mg tabletten AUGMENTIN om de 8 uur (n=321) te krijgen.
Het aantal bacteriologisch evalueerbare patiënten was vergelijkbaar tussen de twee doseringsregimes. AUGMENTIN 250 mg produceerde vergelijkbare bacteriologische succespercentages bij patiënten die 2 tot 4 dagen onmiddellijk na het einde van de therapie werden beoordeeld. De bacteriologische werkzaamheidspercentages waren vergelijkbaar bij een van de follow-upbezoeken (5 tot 9 dagen na de therapie) en bij een laat bezoek na de therapie (in de meeste gevallen was dit 2 tot 4 weken na de therapie), zoals te zien is in tabel 7.
Zoals eerder opgemerkt, was er, hoewel er geen significant verschil was in het percentage bijwerkingen in elke groep, een statistisch significant verschil in het percentage ernstige diarree of ontwenningsverschijnselen met diarree tussen de regimes.
Acute bacteriële otitis media en diarree bij pediatrische patiënten
Er werd één Amerikaans/Canadees klinisch onderzoek uitgevoerd waarin 45/6,4 mg/kg/dag (verdeeld om de 12 uur) AUGMENTIN gedurende 10 dagen werd vergeleken met 40/10 mg/kg/dag (verdeeld om de 8 uur) AUGMENTIN gedurende 10 dagen in de behandeling van acute middenoorontsteking. Alleen de suspensieformuleringen werden in deze proef gebruikt. In totaal werden 575 pediatrische patiënten (in de leeftijd van 2 maanden tot 12 jaar) geïncludeerd, met een gelijkmatige verdeling over de 2 behandelingsgroepen en een vergelijkbaar aantal patiënten was evalueerbaar (dwz ³ 84%) per behandelingsgroep. Er waren specifieke criteria voor otitis media vereist om in aanmerking te komen en er werd een sterke correlatie gevonden aan het einde van de therapie en follow-up tussen deze criteria en de beoordeling door de arts van de klinische respons. De klinische werkzaamheidspercentages aan het einde van het therapiebezoek (gedefinieerd als 24 dagen na voltooiing van de therapie) en bij het vervolgbezoek (gedefinieerd als 22 tot 28 dagen na voltooiing van de therapie) waren vergelijkbaar voor de 2 behandelingsgroepen, met de volgende genezingspercentages verkregen voor de evalueerbare patiënten: aan het einde van de therapie 87% (n = 265) en 82% (n = 260) voor respectievelijk 45 mg/kg/dag om de 12 uur en 40 mg/kg/dag om de 8 uur . Bij follow-up 67% (n = 249) en 69% (n = 243) voor respectievelijk 45 mg/kg/dag om de 12 uur en 40 mg/kg/dag om de 8 uur.
Diarree werd gedefinieerd als: (a) 3 of meer waterige of 4 of meer losse/waterige ontlasting in 1 dag; OF (b) 2 waterige ontlasting per dag of 3 losse/waterige ontlasting per dag gedurende 2 opeenvolgende dagen. De incidentie van diarree was significant lager bij patiënten die het elke 12-uurs regime kregen in vergelijking met patiënten die het elke 8-uurs regime kregen (respectievelijk 14% en 34%). Bovendien was het aantal patiënten met ernstige diarree of die gestopt waren met diarree significant lager in de behandelingsgroep om de 12 uur (respectievelijk 3% en 8% voor de 12 uur/10 dagen en elke 8 uur/10 dag). ). In de behandelingsgroep om de 12 uur werden 3 patiënten (1%) teruggetrokken met een allergische reactie, terwijl 1 patiënt in de groep die om de 8 uur werd behandeld om deze reden werd teruggetrokken. Het aantal patiënten met een candida-infectie van het luiergebied was respectievelijk 4% en 6% voor de groepen om de 12 uur en om de 8 uur.
Het is niet bekend of de bevinding van een statistisch significante vermindering van diarree met de orale suspensies die om de 12 uur worden gedoseerd, versus de suspensies die om de 8 uur worden gedoseerd, kan worden geëxtrapoleerd naar de kauwtabletten. De aanwezigheid van mannitol in de kauwtabletten kan bijdragen aan een ander diarreeprofiel. De orale suspensies om de 12 uur (200 mg/5 ml en 400 mg/5 ml) worden gezoet met aspartaam.
PATIËNT INFORMATIE
Patiënten moeten worden geïnformeerd dat AUGMENTIN elke 8 uur of elke 12 uur kan worden ingenomen, afhankelijk van de voorgeschreven dosis. Elke dosis moet bij een maaltijd of tussendoortje worden ingenomen om de kans op gastro-intestinale klachten te verminderen.
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder AUGMENTIN 125 mg, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer AUGMENTIN wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan: (1) de effectiviteit van de onmiddellijke behandeling verminderen, en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet kunnen worden behandeld met AUGMENTIN 250 mg of andere antibacteriële geneesmiddelen .
Adviseer patiënten dat diarree een veelvoorkomend probleem is dat wordt veroorzaakt door antibacteriële middelen en dat het meestal stopt wanneer het antibacteriële middel wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibacteriële middelen waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas 2 maanden of langer nadat ze hun laatste dosis van het antibacteriële middel hebben ingenomen. Als diarree ernstig is of langer dan 2 of 3 dagen aanhoudt, dienen patiënten contact op te nemen met hun arts.
Patiënten moeten worden geadviseerd om de suspensie gekoeld te bewaren. Goed schudden voor gebruik. Als u een kind de suspensie (vloeistof) van AUGMENTIN 125 mg toedient, gebruik dan een doseerlepel of een medicijndruppelaar. Zorg ervoor dat u de lepel of druppelaar na elk gebruik afspoelt. Flessen met suspensie van AUGMENTIN kunnen meer vloeistof bevatten dan nodig is. Volg de instructies van uw arts over de te gebruiken hoeveelheid en de dagen van behandeling die uw kind nodig heeft. Gooi alle ongebruikte medicijnen weg.
Patiënten moeten zich ervan bewust zijn dat AUGMENTIN 125 mg een geneesmiddel uit de penicillineklasse bevat dat bij sommige personen allergische reacties kan veroorzaken.
