Trecator-SC 250mg Ethionamide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Trecator en hoe wordt het gebruikt?
Trecator is een receptgeneesmiddel dat wordt gebruikt om de symptomen van actieve tuberculose te behandelen. Trecator kan alleen of in combinatie met andere medicijnen worden gebruikt.
Trecator behoort tot een klasse geneesmiddelen die antituberculosemiddelen worden genoemd.
Wat zijn de mogelijke bijwerkingen van Trecator?
Trecator kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- gevoelloosheid, tintelingen of brandend gevoel in uw handen of voeten,
- verwardheid,
- ongewone gedachten of gedrag,
- oogpijn,
- wazig zien,
- dubbel zicht,
- duizeligheid,
- hartinfarct,
- pijn in de bovenbuik,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Trecator zijn:
- misselijkheid,
- braken,
- diarree,
- buikpijn,
- verlies van eetlust,
- verhoogde speekselvloed,
- metaalachtige smaak in je mond,
- blaren of zweren in uw mond,
- rood of gezwollen tandvlees,
- moeite met slikken,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- depressieve stemming, en
- rusteloos gevoel
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Trecator. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Trecator® (ethionamide-tabletten, USP) wordt gebruikt bij de behandeling van tuberculose. De chemische naam voor ethionamide is 2-ethylthioisonicotinamide met de volgende structuurformule:
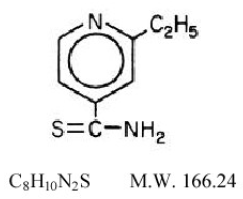
Ethionamide is een gele kristallijne, niet-hygroscopische verbinding met een zwakke tot matige sulfidegeur en een smeltpunt van 162°C. Het is praktisch onoplosbaar in water en ether, maar oplosbaar in methanol en ethanol. Het heeft een partitiecoëfficiënt (octanol/water) Log P-waarde van 0,3699. Trecator-tabletten bevatten 250 mg ethionamide. De aanwezige inactieve ingrediënten zijn croscarmellosenatrium, FD&C Yellow #6, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, polyvinylalcohol, povidon, siliciumdioxide, talk en titaniumdioxide.
INDICATIES
Trecator is voornamelijk geïndiceerd voor de behandeling van actieve tuberculose bij patiënten met M. tuberculosis die resistent is tegen isoniazide of rifampicine, of bij intolerantie van de kant van de patiënt voor andere geneesmiddelen. Het gebruik ervan alleen bij de behandeling van tuberculose resulteert in de snelle ontwikkeling van resistentie. Het is daarom essentieel om een geschikte begeleidende drug of medicijnen te geven, de keuze is gebaseerd op de resultaten van gevoeligheidstesten. Als de gevoeligheidstests aangeven dat het organisme van de patiënt resistent is tegen een van de eerstelijns antituberculosegeneesmiddelen (dwz isoniazide of rifampicine), maar toch vatbaar is voor ethionamide, moet ethionamide vergezeld gaan van ten minste één geneesmiddel waarvoor de M. tuberculosis-isolaat staat bekend als gevoelig.3 Als de tuberculose resistent is tegen zowel isoniazide als rifampicine, maar toch gevoelig is voor ethionamide, moet ethionamide vergezeld gaan van ten minste twee andere geneesmiddelen waarvoor bekend is dat het M. tuberculosis-isolaat vatbaar is.3
Om de ontwikkeling van resistente bacteriën te verminderen en de werkzaamheid van Trecator en andere antibacteriële geneesmiddelen te behouden, mag Trecator alleen worden gebruikt voor de behandeling van infecties waarvan is aangetoond of waarvan het vermoeden bestaat dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
Het niet naleven van de voorgeschreven behandeling door de patiënt kan leiden tot het mislukken van de behandeling en tot de ontwikkeling van resistente tuberculose, die levensbedreigend kan zijn en kan leiden tot andere ernstige gezondheidsrisico's. Het is daarom essentieel dat patiënten zich aan het medicatieregime houden voor de volledige duur van de behandeling. Direct geobserveerde therapie wordt aanbevolen voor alle patiënten die worden behandeld voor tuberculose. Patiënten bij wie geneesmiddelresistente M. tuberculosis-organismen zijn geïsoleerd, moeten worden behandeld in overleg met een deskundige in de behandeling van geneesmiddelresistente tuberculose.
DOSERING EN ADMINISTRATIE
Bij de behandeling van tuberculose is een belangrijke oorzaak van het ontstaan van resistente organismen, en dus van het falen van de behandeling, het niet-naleven van de voorgeschreven behandeling door de patiënt. Mislukken van de behandeling en resistente organismen kunnen levensbedreigend zijn en kunnen leiden tot andere ernstige gezondheidsrisico's. Het is daarom belangrijk dat patiënten zich houden aan het medicatieregime voor de volledige duur van de behandeling. Direct geobserveerde therapie wordt aanbevolen wanneer patiënten worden behandeld voor tuberculose. Overleg met een deskundige in de behandeling van resistente tuberculose wordt geadviseerd bij patiënten bij wie resistente tuberculose wordt vermoed of waarschijnlijk is. Ethionamide moet worden toegediend met ten minste één, soms twee, andere geneesmiddelen waarvan bekend is dat het organisme vatbaar is (zie INDICATIES ).
Trecator wordt oraal toegediend. De gebruikelijke dosis voor volwassenen is 15 tot 20 mg/kg/dag, eenmaal daags toegediend of, als de patiënt een slechte gastro-intestinale tolerantie vertoont, in verdeelde doses, met een maximale dagelijkse dosering van 1 gram.
Trecator-tabletten zijn geherformuleerd van een met suiker omhulde tablet naar een filmomhulde tablet. Patiënten moeten worden gecontroleerd en hun dosering moet worden aangepast wanneer ze overschakelen van de suikeromhulde tablet naar de filmomhulde tablet (zie KLINISCHE FARMACOLOGIE ).
De therapie dient te worden gestart met een dosis van 250 mg per dag, met geleidelijke titratie tot optimale doses die door de patiënt worden verdragen. Een regime van 250 mg per dag gedurende 1 of 2 dagen, gevolgd door 250 mg tweemaal per dag gedurende 1 of 2 dagen met een daaropvolgende verhoging tot 1 g in 3 of 4 verdeelde doses is gerapporteerd.4,5 Tot dusver is er onvoldoende bewijs om de laagste effectieve doseringsniveaus aan te geven. Om het risico op het ontwikkelen van resistentie tegen het geneesmiddel of het begeleidende geneesmiddel tot een minimum te beperken, is daarom het principe gevolgd van het geven van de hoogst getolereerde dosis (op basis van gastro-intestinale intolerantie). Bij de volwassene lijkt dit tussen de 0,5 en 1,0 g per dag te zijn, met een gemiddelde van 0,75 g per dag.
De optimale dosering voor pediatrische patiënten is niet vastgesteld. Echter, pediatrische doseringen van 10 tot 20 mg/kg po per dag in 2 of 3 verdeelde doses gegeven na de maaltijd of 15 mg/kg/24 uur als een enkele dagelijkse dosis zijn aanbevolen.1,2 Net als bij volwassenen kan ethionamide worden toegediend. eenmaal daags aan pediatrische patiënten. Opgemerkt moet worden dat bij patiënten met gelijktijdige tuberculose en HIV-infectie, malabsorptiesyndroom aanwezig kan zijn. Malabsorptie van geneesmiddelen moet worden vermoed bij patiënten die zich aan de therapie houden, maar niet adequaat reageren. In dergelijke gevallen moet worden overwogen om therapeutische geneesmiddelen te monitoren (zie: KLINISCHE FARMACOLOGIE ).
De beste toedieningstijden zijn die welke de individuele patiënt het meest geschikt vindt om gastro-intestinale intolerantie, die gewoonlijk tijdens de maaltijden is, te vermijden of te minimaliseren. Alles moet in het werk worden gesteld om patiënten aan te moedigen door te gaan met de behandeling wanneer gastro-intestinale bijwerkingen optreden, aangezien deze in ernst kunnen verminderen naarmate de behandeling vordert.
Gelijktijdige toediening van pyridoxine wordt aanbevolen.
De duur van de behandeling moet gebaseerd zijn op de individuele klinische respons. Ga in het algemeen door met de therapie totdat de bacteriologische conversie permanent is geworden en maximale klinische verbetering is opgetreden.
HOE GELEVERD
Trecator (ethionamide-tabletten, USP) worden als volgt geleverd in flessen van 100 tabletten:
250 mg, oranje filmomhulde tablet met de markering "W" aan de ene kant en "4117" aan de andere kant, NDC 0008-4117-01.
Bewaren bij een gecontroleerde kamertemperatuur van 20° tot 25°C (68° tot 77°F). Doseer in een strakke container.
REFERENTIES
1. Feigin, RD en Cherry, JD: leerboek van pediatrische infectieziekten, 2e editie. Philadelphia, WB Saunders Co., 1987, blz. 1371-1372.
2. Nelson, WE, Behrman, RE, Vaughan, VC (eds.): Nelson Textbook of Pediatrics, 13e editie. Philadelphia, WB Saunders Co., 1987, p.636.
3. Behandeling van tuberculose en tuberculose-infectie bij volwassenen en kinderen, Am J Respiratory and Critical Care Medicine, 149: 1359-1374, 1994.
4. Peloquin, CA: Farmacologie van de antimycobacteriële geneesmiddelen, Med Clin North Am 77 (6): 1230-1262, 1993.
5. Amerikaanse thoracale samenleving. Am J Respir Crit Care Med 1997; 156: S1-S25.
Gedistribueerd door: Pfizer, Wyeth Pharmaceuticals LLC, een dochteronderneming van Pfizer Inc, Philadelphia, PA 19101. Herzien: januari 2020
BIJWERKINGEN
gastro-intestinaal
De meest voorkomende bijwerkingen van ethionamide zijn gastro-intestinale stoornissen, waaronder misselijkheid, braken, diarree, buikpijn, overmatige speekselvloed, metaalsmaak, stomatitis, anorexia en gewichtsverlies. Nadelige gastro-intestinale effecten lijken dosisgerelateerd te zijn, waarbij ongeveer 50% van de patiënten 1 g als een enkele dosis niet kan verdragen. Gastro-intestinale effecten kunnen worden geminimaliseerd door de dosering te verlagen, door het tijdstip van toediening van het geneesmiddel te veranderen of door gelijktijdige toediening van een anti-emeticum.
Zenuwstelsel
Psychotische stoornissen (inclusief mentale depressie), slaperigheid, duizeligheid, rusteloosheid, hoofdpijn en orthostatische hypotensie zijn gemeld met ethionamide. Zeldzame meldingen van perifere neuritis, optische neuritis, diplopie, wazig zien en een pellagra-achtig syndroom zijn ook gemeld. Gelijktijdige toediening van pyridoxine is aanbevolen om neurotoxische effecten te voorkomen of te verlichten.
lever
Voorbijgaande verhogingen van serumbilirubine, SGOT, SGPT; Hepatitis (met of zonder geelzucht).
Ander
Overgevoeligheidsreacties waaronder huiduitslag, fotosensitiviteit, trombocytopenie en purpura zijn zelden gemeld. Hypoglykemie, hypothyreoïdie, gynaecomastie, impotentie en acne zijn ook voorgekomen. De behandeling van patiënten met diabetes mellitus kan moeilijker worden bij patiënten die ethionamide krijgen.
DRUG-INTERACTIES
Het is gebleken dat Trecator tijdelijk de serumconcentraties van isoniazide verhoogt. Trecator kan de bijwerkingen van andere gelijktijdig toegediende antituberculeuze geneesmiddelen versterken. Er zijn met name convulsies gemeld wanneer ethionamide wordt toegediend met cycloserine en er moet extra voorzichtigheid worden betracht wanneer het behandelingsregime beide geneesmiddelen omvat. Overmatige inname van ethanol moet worden vermeden omdat een psychotische reactie is gemeld.
WAARSCHUWINGEN
Het gebruik van alleen Trecator bij de behandeling van tuberculose resulteert in een snelle ontwikkeling van resistentie. Het is daarom essentieel om een geschikt begeleidend medicijn of medicijnen te geven, waarbij de keuze gebaseerd is op de resultaten van gevoeligheidstesten. De therapie kan echter worden gestart voordat de resultaten van gevoeligheidstests worden ontvangen, zoals de arts dit gepast acht. Ethionamide moet worden toegediend met ten minste één, soms twee, andere geneesmiddelen waarvan bekend is dat het organisme vatbaar is (zie INDICATIES ). Geneesmiddelen die als begeleidende middelen zijn gebruikt, zijn rifampicine, ethambutol, pyrazinamide, cycloserine, kanamycine, streptomycine en isoniazide. De gebruikelijke waarschuwingen, voorzorgsmaatregelen en doseringsschema's voor deze begeleidende geneesmiddelen moeten in acht worden genomen.
De therapietrouw van de patiënt is essentieel voor het succes van de antituberculosetherapie en om het ontstaan van resistente organismen te voorkomen. Daarom moeten patiënten zich aan het medicatieregime houden voor de volledige duur van de behandeling. Het wordt aanbevolen om direct geobserveerde therapie toe te passen wanneer patiënten antituberculeuze medicatie krijgen. Bijkomend advies van deskundigen in de behandeling van resistente tuberculose wordt aanbevolen wanneer patiënten resistente organismen ontwikkelen.
PREVENTIEVE MAATREGELEN
Algemeen
Het is onwaarschijnlijk dat het voorschrijven van Trecator bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie-indicatie de patiënt voordeel zal opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Ethionamide kan de bijwerkingen van de andere gelijktijdig toegediende antituberculeuze geneesmiddelen versterken (zie DRUG-INTERACTIES ). Oftalmologische onderzoeken (inclusief oftalmoscopie) moeten vóór en periodiek tijdens de behandeling met Trecator worden uitgevoerd.
Laboratorium testen
Bepaling van serumtransaminasen (SGOT, SGPT) dient te worden uitgevoerd vóór aanvang van de therapie en dient maandelijks te worden gecontroleerd. Als de serumtransaminasen tijdens de behandeling verhoogd worden, kunnen ethionamide en de begeleidende antituberculosegeneesmiddel(en) tijdelijk worden stopgezet totdat de laboratoriumafwijkingen zijn verdwenen. Ethionamide en de begeleidende antituberculosemedicatie(en) moeten dan achtereenvolgens opnieuw worden geïntroduceerd om te bepalen welk (of welke) geneesmiddelen verantwoordelijk is (zijn) voor de hepatotoxiciteit.
Bloedglucosebepalingen dienen voorafgaand aan en periodiek tijdens de behandeling met Trecator te worden uitgevoerd. Diabetespatiënten dienen bijzonder alert te zijn op episoden van hypoglykemie.
Periodieke controle van schildklierfunctietesten wordt aanbevolen, aangezien hypothyreoïdie, met of zonder struma, is gemeld bij behandeling met ethionamide.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Teratogene effecten
Dierstudies uitgevoerd met Trecator geven aan dat het geneesmiddel teratogeen potentieel heeft bij konijnen en ratten. De doses die in deze onderzoeken werden gebruikt op basis van mg/kg waren aanzienlijk hoger dan de aanbevolen doses bij mensen. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Vanwege deze dierstudies moet het echter worden aanbevolen om Trecator niet te gebruiken bij vrouwen die zwanger zijn of zwanger kunnen worden terwijl ze onder behandeling zijn, tenzij de voorschrijvende arts dit als een essentieel onderdeel van de behandeling beschouwt.
Bevalling
Het effect van Trecator op de bevalling en bevalling bij zwangere vrouwen is niet bekend.
Moeders die borstvoeding geven
Omdat er geen informatie beschikbaar is over de uitscheiding van ethionamide in de moedermelk, mag Trecator alleen aan moeders die borstvoeding geven worden toegediend als de voordelen opwegen tegen de risico's. Pasgeborenen die borstvoeding krijgen van moeders die Trecator gebruiken, moeten worden gecontroleerd op bijwerkingen.
Pediatrisch gebruik
Vanwege het feit dat longtuberculose die resistent is tegen primaire therapie zelden wordt gevonden bij pasgeborenen, zuigelingen en kinderen, is het onderzoek in deze leeftijdsgroepen beperkt. Op dit moment mag het geneesmiddel niet worden gebruikt bij pediatrische patiënten jonger dan 12 jaar, behalve wanneer de organismen absoluut resistent zijn tegen primaire therapie en systemische verspreiding van de ziekte, of andere levensbedreigende complicaties van tuberculose, op handen zijn.
OVERDOSERING
Er is geen specifieke informatie beschikbaar over de behandeling van overdosering met Trecator. Als dit zich voordoet, moeten standaardprocedures worden toegepast om de maaginhoud te evacueren en vitale functies te ondersteunen.
CONTRA-INDICATIES
Ethionamide is gecontra-indiceerd bij patiënten met ernstige leverinsufficiëntie en bij patiënten die overgevoelig zijn voor het geneesmiddel.
KLINISCHE FARMACOLOGIE
Absorptie
Ethionamide wordt in wezen volledig geabsorbeerd na orale toediening en is niet onderhevig aan enig merkbaar first-pass-metabolisme. Ethionamide-tabletten kunnen worden toegediend zonder rekening te houden met het tijdstip van maaltijden.
De farmacokinetische parameters van ethionamide na toediening van een enkelvoudige orale dosis van 250 mg Trecator filmomhulde tabletten in nuchtere toestand aan 40 gezonde volwassen vrijwilligers worden weergegeven in Tabel 1.
Trecator-tabletten zijn geherformuleerd van een met suiker omhulde tablet naar een filmomhulde tablet. De Cmax van de filmomhulde tabletten (2,16 g/ml) was significant hoger dan die van de suikeromhulde tabletten (1,48 μg/ml) (zie DOSERING EN ADMINISTRATIE ).
Verdeling
Ethionamide wordt snel en wijd verspreid in lichaamsweefsels en -vloeistoffen na toediening van een met suiker omhulde tablet, waarbij de concentraties in plasma en verschillende organen ongeveer gelijk zijn. Significante concentraties zijn ook aanwezig in cerebrospinale vloeistof na toediening van een met suiker omhulde tablet. Distributie van ethionamide in dezelfde lichaamsweefsels en -vloeistoffen, inclusief cerebrospinale vloeistof na toediening van de filmomhulde tablet, is niet onderzocht, maar zal naar verwachting niet significant verschillen van die van de suikeromhulde tablet. Het medicijn is voor ongeveer 30% gebonden aan eiwitten. Het gemiddelde (SD) schijnbare orale distributievolume waargenomen bij 40 gezonde vrijwilligers na een orale dosis van 250 mg filmomhulde tabletten was 93,5 (19,2) l.
Metabolisme
Ethionamide wordt uitgebreid gemetaboliseerd tot actieve en inactieve metabolieten. Er wordt aangenomen dat het metabolisme plaatsvindt in de lever en tot dusver zijn 6 metabolieten geïsoleerd: 2-ethylisonicotinamide, carbonyl-dihydropyridine, thiocarbonyl-dihydropyridine, S-oxocarbamoyldihydropyridine, 2-ethylthioiso-nicotinamide en ethionamidesulfoxide. Het is aangetoond dat de sulfoxidemetaboliet antimicrobiële activiteit heeft tegen Mycobacterium tuberculosis.
Eliminatie
De gemiddelde (SD) halfwaardetijd waargenomen bij 40 gezonde vrijwilligers na een orale dosis van 250 mg filmomhulde tabletten was 1,92 (0,27) uur. Minder dan 1% van de orale dosis wordt uitgescheiden als ethionamide in de urine.
Werkingsmechanisme
Ethionamide kan bacteriostatisch of bacteriedodend werken, afhankelijk van de concentratie van het geneesmiddel die wordt bereikt op de plaats van infectie en de gevoeligheid van het infecterende organisme. Het exacte werkingsmechanisme van ethionamide is niet volledig opgehelderd, maar het medicijn lijkt de peptidesynthese in gevoelige organismen te remmen.
Microbiologie
In vitro activiteit
Ethionamide vertoont bacteriostatische activiteit tegen extracellulaire en intracellulaire Mycobacterium tuberculosis-organismen. De ontwikkeling van ethionamide-resistente isolaten van M. tuberculosis kan worden verkregen door herhaalde subkweek in vloeibare of op vaste media die toenemende concentraties ethionamide bevatten. Multiresistente stammen van M. tuberculosis kunnen resistentie hebben verworven tegen zowel isoniazide als ethionamide. De meeste M. tuberculosis-isolaten die resistent zijn tegen de ene, zijn echter meestal vatbaar voor de andere. Er is geen bewijs van kruisresistentie tussen ethionamide en para-aminosalicylzuur (PAS), streptomycine of cycloserine. Beperkte gegevens suggereren echter dat er kruisresistentie kan bestaan tussen ethionamide en thiosemicarbazonen (dwz thiacetazon) en isoniazide.
In vivo activiteit
Ethionamide, oraal toegediend, verminderde aanvankelijk het aantal kweekbare Mycobacterium tuberculosis-organismen uit de longen van met H37Rv geïnfecteerde muizen. Geneesmiddelresistentie ontwikkelde zich bij voortgezette monotherapie met ethionamide, maar trad niet op wanneer muizen ethionamide kregen in combinatie met streptomycine of isoniazide.
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
PATIËNT INFORMATIE
Patiënten dienen te worden geadviseerd hun arts te raadplegen indien wazig zien of verlies van gezichtsvermogen, met of zonder oogpijn, optreedt tijdens de behandeling.
Overmatige inname van ethanol moet worden vermeden omdat een psychotische reactie is gemeld.
Patiënten moeten erop worden gewezen dat antibacteriële geneesmiddelen, waaronder Trecator, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer Trecator wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met Trecator of andere antibacteriële geneesmiddelen kunnen worden behandeld.
