Flagyl 200mg, 400mg Metronidazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Flagyl en hoe wordt het gebruikt?
Flagyl is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van bacteriële infecties van de vagina, maag, lever, huid, gewrichten, hersenen en luchtwegen. Flagyl kan alleen of in combinatie met andere medicijnen worden gebruikt.
Flagyl is een nitroimidazol, CYP3A4-remmer, matig.
Wat zijn de mogelijke bijwerkingen van Flagyl 200 mg?
Flagyl 400 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- diarree,
- pijnlijk of moeilijk plassen,
- Moeite met slapen,
- depressie,
- prikkelbaarheid,
- hoofdpijn,
- duizeligheid
- zwakheid,
- duizeligheid,
- blaren of zweren in uw mond,
- rood of gezwollen tandvlees, en
- moeite met slikken
Vertel het uw arts als u ernstige bijwerkingen van Flagyl ervaart, waaronder:
- doof gevoel,
- tintelingen,
- brandende pijn in uw handen of voeten,
- zichtproblemen,
- pijn achter je ogen,
- flitsen of licht zien,
- spier zwakte,
- coördinatieproblemen,
- moeite met praten of begrijpen wat er tegen je wordt gezegd,
- hartinfarct,
- koorts,
- nekstijfheid, en
- verhoogde gevoeligheid voor licht
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
Dit zijn niet alle mogelijke bijwerkingen van Flagyl. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van FLAGYL® en andere antibacteriële geneesmiddelen te behouden, mag FLAGYL® alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is bewezen of waarvan wordt vermoed dat ze door bacteriën worden veroorzaakt.
WAARSCHUWING
Het is aangetoond dat metronidazol kankerverwekkend is bij muizen en ratten (zie: PREVENTIEVE MAATREGELEN ). Onnodig gebruik van het medicijn moet worden vermeden. Het gebruik ervan moet worden voorbehouden aan de voorwaarden beschreven in de AANWIJZINGEN EN GEBRUIK sectie hieronder.
OMSCHRIJVING
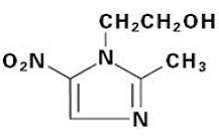
FLAGYL (metronidazol) tabletten, 250 mg of 500 mg is een orale formulering van het synthetische antimicrobiële nitroimidazol, 2-methyl-5-nitro-1H-imidazol-1-ethanol, met de volgende structuurformule:
FLAGYL (metronidazol) tabletten bevatten 250 mg of 500 mg metronidazol. Inactieve ingrediënten zijn onder meer cellulose, FD & C Blue No. 2 Lake, hydroxypropylcellulose, hypromellose, polyethyleenglycol, stearinezuur en titaniumdioxide.
INDICATIES
Symptomatische trichomoniasis. FLAGYL is geïndiceerd voor de behandeling van T. vaginalis-infectie bij vrouwen en mannen wanneer de aanwezigheid van de trichomonade is bevestigd door geschikte laboratoriumprocedures (natte uitstrijkjes en/of kweken).
Asymptomatische trichomoniasis. FLAGYL 400 mg is geïndiceerd voor de behandeling van asymptomatische T. vaginalis-infectie bij vrouwen wanneer het organisme geassocieerd is met endocervicitis, cervicitis of cervicale erosie. Aangezien er aanwijzingen zijn dat de aanwezigheid van de trichomonade de nauwkeurige beoordeling van abnormale cytologische uitstrijkjes kan verstoren, moeten aanvullende uitstrijkjes worden uitgevoerd na uitroeiing van de parasiet.
Behandeling van asymptomatische seksuele partners. T. vaginalis-infectie is een geslachtsziekte. Daarom moeten asymptomatische seksuele partners van behandelde patiënten gelijktijdig worden behandeld als het organisme aanwezig is, om herinfectie van de partner te voorkomen. De beslissing om een asymptomatische mannelijke partner te behandelen die een negatieve cultuur heeft of voor wie geen kweek is geprobeerd, is een individuele beslissing. Bij het nemen van deze beslissing moet worden opgemerkt dat er aanwijzingen zijn dat een vrouw opnieuw besmet kan raken als haar seksuele partner niet wordt behandeld. Aangezien er aanzienlijke moeilijkheden kunnen zijn bij het isoleren van het organisme van de asymptomatische mannelijke drager, kan in dit opzicht niet worden vertrouwd op negatieve uitstrijkjes en kweken. In elk geval moet de seksuele partner worden behandeld met FLAGYL in geval van herinfectie.
amebiasis. FLAGYL is geïndiceerd voor de behandeling van acute intestinale amebiasis (amebische dysenterie) en amebisch leverabces.
Bij amebisch leverabces maakt FLAGYL-therapie de noodzaak van aspiratie of drainage van pus niet overbodig.
Anaërobe bacteriële infecties. FLAGYL 200 mg is geïndiceerd voor de behandeling van ernstige infecties veroorzaakt door gevoelige anaërobe bacteriën. Geïndiceerde chirurgische procedures moeten worden uitgevoerd in combinatie met FLAGYL-therapie. Bij een gemengde aerobe en anaerobe infectie moeten naast FLAGYL antimicrobiële middelen worden gebruikt die geschikt zijn voor de behandeling van de aerobe infectie.
INTRA-ABDOMINALE INFECTIES, waaronder peritonitis, intra-abdominaal abces en leverabces, veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium soorten, Eubacterium-soorten, Peptococcus-soorten en Peptostreptococcus-soorten.
HUID- EN HUIDSTRUCTUURINFECTIES veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep, Clostridium-soorten, Peptococcus-soorten, Peptostreptococcus-soorten en Fusobacterium-soorten.
GYNAECOLOGISCHE INFECTIES, waaronder endometritis, endomyometritis, tubo-ovarieel abces en postoperatieve vaginale manchetinfectie, veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep, Clostridium-soorten, Peptococcus-soorten, Peptostreptococcus-soorten en Fusobacterium-soorten.
BACTERILE SEPTICEMIE veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep en Clostridium-soorten.
BOT- EN GEWRICHTSINFECTIES, (als aanvullende therapie), veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep.
INFECTIES VAN HET CENTRAAL ZENUWSTELSEL (CZS), waaronder meningitis en hersenabces, veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep.
INFECTIES VAN DE LAGERE LUCHTWEGEN, waaronder longontsteking, empyeem en longabces, veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep.
ENDOCARDITIS veroorzaakt door Bacteroides-soorten, waaronder de B. fragilis-groep.
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van FLAGYL 400 mg en andere antibacteriële geneesmiddelen te behouden, mag FLAGYL alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Trichomonas
In de vrouw
Eendaagse behandeling - twee gram FLAGYL, gegeven als een enkele dosis of in twee verdeelde doses van elk één gram, gegeven op dezelfde dag.
Zevendaagse kuur - 250 mg driemaal daags gedurende zeven opeenvolgende dagen. Er zijn aanwijzingen uit gecontroleerde vergelijkende onderzoeken dat de genezingspercentages, zoals bepaald door vaginale uitstrijkjes en tekenen en symptomen, hoger kunnen zijn na een zevendaagse behandeling dan na een eendaagse behandeling.
Het doseringsschema moet individueel worden bepaald. Behandeling met een enkelvoudige dosis kan therapietrouw garanderen, vooral als deze onder toezicht wordt toegediend, bij die patiënten op wie niet kan worden vertrouwd om het zevendaagse regime voort te zetten. Een behandelingskuur van zeven dagen kan herinfectie tot een minimum beperken door de patiënt lang genoeg te beschermen zodat de seksuele contacten een passende behandeling krijgen. Verder kunnen sommige patiënten het ene behandelingsregime beter verdragen dan het andere.
Zwangere patiënten mogen niet worden behandeld tijdens het eerste trimester (zie: CONTRA-INDICATIES ). Bij zwangere patiënten voor wie een alternatieve behandeling niet voldoende was, mag de eendaagse therapie niet worden gebruikt, omdat dit leidt tot hogere serumspiegels die de foetale circulatie kunnen bereiken (zie PREVENTIEVE MAATREGELEN , Zwangerschap ).
Wanneer herhaalde kuren van het geneesmiddel nodig zijn, wordt aanbevolen dat er een interval van vier tot zes weken verstrijkt tussen de kuren en dat de aanwezigheid van de trichomonade opnieuw wordt bevestigd door geschikte laboratoriummaatregelen. Voor en na herbehandeling moeten de totale en differentiële leukocytentellingen worden uitgevoerd.
Bij de man: De behandeling moet worden geïndividualiseerd zoals het is voor de vrouw.
amebiasis
volwassenen
Voor acute intestinale amebiasis (acute amebische dysenterie): 750 mg oraal driemaal daags gedurende 5 tot 10 dagen.
Voor amebisch leverabces: 500 mg of 750 mg oraal driemaal daags gedurende 5 tot 10 dagen.
Pediatrische patiënten: 35 tot 50 mg/kg/24 uur, verdeeld over drie doses, oraal gedurende 10 dagen.
Anaërobe bacteriële infecties
Bij de behandeling van de meest ernstige anaërobe infecties wordt gewoonlijk aanvankelijk intraveneus metronidazol toegediend.
De gebruikelijke orale dosering voor volwassenen is 7,5 mg/kg om de zes uur (ongeveer 500 mg voor een volwassene van 70 kg). Gedurende een periode van 24 uur mag een maximum van 4 g niet worden overschreden.
De gebruikelijke duur van de therapie is 7 tot 10 dagen; infecties van het bot en gewricht, de onderste luchtwegen en het endocardium kunnen echter een langere behandeling vereisen.
Doseringsaanpassingen
Patiënten met ernstige leverinsufficiëntie
Bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh C) moet de dosis FLAGYL met 50% worden verlaagd (zie KLINISCHE FARMACOLOGIE en PREVENTIEVE MAATREGELEN ).
Patiënten die hemodialyse ondergaan
Hemodialyse verwijdert aanzienlijke hoeveelheden metronidazol en zijn metabolieten uit de systemische circulatie. De klaring van metronidazol hangt af van het type dialysemembraan dat wordt gebruikt, de duur van de dialysesessie en andere factoren. Als de toediening van metronidazol niet kan worden gescheiden van de hemodialysesessie, moet worden overwogen om de dosering van metronidazol na de hemodialysesessie aan te vullen, afhankelijk van de klinische situatie van de patiënt (zie KLINISCHE FARMACOLOGIE ).
HOE GELEVERD
FLAGYL 250 mg tabletten zijn rond, blauw, filmomhuld, met aan de ene kant SEARLE en 1831 ingeslagen en aan de andere kant FLAGYL en 250; geleverd als flessen van 50 en 100.
FLAGYL 500 mg tabletten zijn langwerpig, blauw, filmomhuld, met de inscriptie FLAGYL aan de ene kant en 500 aan de andere kant; flessen van 50 en 100.
Opslag en stabiliteit
Bewaren beneden 25°C (77°F) en beschermen tegen licht.
Gedistribueerd door: Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Herzien: december 2021
BIJWERKINGEN
De volgende reacties zijn gemeld tijdens de behandeling met metronidazol:
Centraal zenuwstelsel
De ernstigste bijwerkingen die zijn gemeld bij patiënten die met metronidazol werden behandeld, waren convulsieve aanvallen, encefalopathie, aseptische meningitis, optische en perifere neuropathie, waarbij de laatste voornamelijk wordt gekenmerkt door gevoelloosheid of paresthesie van een extremiteit. Aangezien aanhoudende perifere neuropathie is gemeld bij sommige patiënten die langdurig met metronidazol werden toegediend, moeten patiënten specifiek worden gewaarschuwd voor deze reacties en moeten worden verteld dat ze met het geneesmiddel moeten stoppen en onmiddellijk aan hun arts moeten rapporteren als er neurologische symptomen optreden. Bovendien hebben patiënten melding gemaakt van hoofdpijn, syncope, duizeligheid, vertigo, coördinatiestoornissen, ataxie, verwardheid, dysartrie, prikkelbaarheid, depressie, zwakte en slapeloosheid (zie WAARSCHUWINGEN ).
gastro-intestinaal
De meest voorkomende gemelde bijwerkingen waren gerelateerd aan het maagdarmkanaal, met name misselijkheid, soms gepaard gaande met hoofdpijn, anorexia en soms braken; diarree; epigastrische nood; en buikkrampen en constipatie.
Mond
Een scherpe, onaangename metaalsmaak is niet ongebruikelijk. Harige tong, glossitis en stomatitis zijn opgetreden; deze kunnen in verband worden gebracht met een plotselinge overgroei van Candida die tijdens de behandeling kan optreden.
dermatologisch
Erythemateuze uitslag en jeuk.
hematopoëtisch
Omkeerbare neutropenie (leukopenie); zelden, reversibele trombocytopenie.
Cardiovasculair
QT-verlenging is gemeld, vooral wanneer metronidazol werd toegediend met geneesmiddelen die het QT-interval kunnen verlengen. Afvlakking van de T-golf kan worden gezien in elektrocardiografische traceringen.
overgevoeligheid
Urticaria, erythemateuze uitslag, Stevens-Johnson-syndroom, toxische epidermale necrolyse, blozen, verstopte neus, droge mond (of vagina of vulva) en koorts.
nier
Dysurie, cystitis, polyurie, incontinentie en een gevoel van bekkendruk. Gevallen van donkere urine zijn gemeld door ongeveer één patiënt op 100.000. Hoewel het pigment dat waarschijnlijk verantwoordelijk is voor dit fenomeen niet positief is geïdentificeerd, is het vrijwel zeker een metaboliet van metronidazol en lijkt het geen klinische betekenis te hebben.
lever
Gevallen van ernstige onomkeerbare hepatotoxiciteit/acuut leverfalen, waaronder gevallen met fatale afloop met een zeer snel begin na het starten van systemisch gebruik van metronidazol, zijn gemeld bij patiënten met het Cockayne-syndroom (latentie vanaf het begin van het geneesmiddel tot tekenen van leverfalen van slechts 2 dagen). ) (zien CONTRA-INDICATIES ).
Ander
Proliferatie van Candida in de vagina, dyspareunie, afname van het libido, proctitis en voorbijgaande gewrichtspijnen die soms lijken op "serumziekte". Zeldzame gevallen van pancreatitis, die over het algemeen afnam na stopzetting van het geneesmiddel, zijn gemeld.
Het is bekend dat patiënten met de ziekte van Crohn een verhoogde incidentie hebben van gastro-intestinale en bepaalde extra-intestinale kankers. Er zijn enkele meldingen in de medische literatuur van borst- en darmkanker bij patiënten met de ziekte van Crohn die gedurende langere tijd met metronidazol in hoge doses zijn behandeld. Een oorzaak-gevolg relatie is niet vastgesteld. De ziekte van Crohn is geen goedgekeurde indicatie voor FLAGYL 200 mg tabletten.
DRUG-INTERACTIES
disulfiram
Psychotische reacties zijn gemeld bij alcoholische patiënten die gelijktijdig metronidazol en disulfiram gebruikten. Metronidazol mag niet worden gegeven aan patiënten die de afgelopen twee weken disulfiram hebben gebruikt (zie: CONTRA-INDICATIES ).
Alcoholische dranken
Buikkrampen, misselijkheid, braken, hoofdpijn en blozen kunnen optreden als alcoholische dranken of producten die propyleenglycol bevatten, worden geconsumeerd tijdens of na de behandeling met metronidazol (zie CONTRA-INDICATIES ).
Warfarine en andere orale anticoagulantia
Van metronidazol is gemeld dat het het anticoagulerende effect van warfarine en andere orale cumarine-anticoagulantia versterkt, wat resulteert in een verlenging van de protrombinetijd. Wanneer FLAGYL wordt voorgeschreven aan patiënten die dit type antistollingstherapie ondergaan, moeten de protrombinetijd en INR zorgvuldig worden gecontroleerd.

Lithium
Bij patiënten die gestabiliseerd zijn op relatief hoge doses lithium, is kortdurende behandeling met metronidazol in verband gebracht met verhoging van serumlithium en, in enkele gevallen, tekenen van lithiumtoxiciteit. Serumlithium- en serumcreatininespiegels moeten enkele dagen na het begin van metronidazol worden verkregen om een verhoging te detecteren die vooraf kan gaan aan klinische symptomen van lithiumintoxicatie.
Busulfan
Van metronidazol is gemeld dat het de plasmaconcentraties van busulfan verhoogt, wat kan leiden tot een verhoogd risico op ernstige busulfan-toxiciteit. Metronidazol mag niet gelijktijdig met busulfan worden toegediend, tenzij het voordeel opweegt tegen het risico. Als er geen therapeutische alternatieven voor metronidazol beschikbaar zijn en gelijktijdige toediening met busulfan medisch noodzakelijk is, moet de busulfan-plasmaconcentratie regelmatig worden gecontroleerd en moet de dosis busulfan dienovereenkomstig worden aangepast.
Geneesmiddelen die CYP450-enzymen remmen
De gelijktijdige toediening van geneesmiddelen die de microsomale leverenzymactiviteit verminderen, zoals cimetidine, kan de halfwaardetijd verlengen en de plasmaklaring van metronidazol verlagen.
Geneesmiddelen die CYP450-enzymen induceren
De gelijktijdige toediening van geneesmiddelen die microsomale leverenzymen induceren, zoals fenytoïne of fenobarbital, kan de eliminatie van metronidazol versnellen, wat resulteert in verlaagde plasmaspiegels; verminderde klaring van fenytoïne is ook gemeld.
Geneesmiddelen die het QT-interval verlengen
QT-verlenging is gemeld, vooral wanneer metronidazol werd toegediend met geneesmiddelen die het QT-interval kunnen verlengen.
WAARSCHUWINGEN
Effecten op het centrale en perifere zenuwstelsel
Encefalopathie en perifere neuropathie: Gevallen van encefalopathie en perifere neuropathie (inclusief optische neuropathie) zijn gemeld met metronidazol.
Encefalopathie is gemeld in verband met cerebellaire toxiciteit die wordt gekenmerkt door ataxie, duizeligheid en dysartrie. CZS-laesies die op MRI worden gezien, zijn beschreven in meldingen van encefalopathie. CZS-symptomen zijn over het algemeen omkeerbaar binnen enkele dagen tot weken na stopzetting van metronidazol. CZS-laesies die op MRI worden gezien, zijn ook beschreven als reversibel.
Perifere neuropathie, voornamelijk van het sensorische type, is gemeld en wordt gekenmerkt door gevoelloosheid of paresthesie van een extremiteit.
Convulsieve aanvallen zijn gemeld bij patiënten die werden behandeld met metronidazol.
Aseptische meningitis: Gevallen van aseptische meningitis zijn gemeld met metronidazol. Symptomen kunnen optreden binnen enkele uren na toediening van de dosis en verdwijnen over het algemeen nadat de behandeling met metronidazol is stopgezet.
Het optreden van abnormale neurologische tekenen en symptomen vereist een snelle evaluatie van de baten/risicoverhouding van voortzetting van de therapie (zie: ONGEWENSTE REACTIES ).
PREVENTIEVE MAATREGELEN
Algemeen
Leverfunctiestoornis
Patiënten met een leverfunctiestoornis metaboliseren metronidazol langzaam, met als gevolg accumulatie van metronidazol in het plasma. Voor patiënten met een ernstige leverfunctiestoornis (Child-Pugh C) wordt een verlaagde dosis FLAGYL 400 mg aanbevolen. Voor patiënten met een lichte tot matige leverfunctiestoornis is geen dosisaanpassing nodig, maar deze patiënten moeten worden gecontroleerd op metronidazol-gerelateerde bijwerkingen (zie KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ).
Nierfunctiestoornis
Patiënten met terminale nierziekte kunnen metronidazol en metabolieten langzaam in de urine uitscheiden, wat resulteert in een significante accumulatie van metronidazolmetabolieten. Monitoring op metronidazol-gerelateerde bijwerkingen wordt aanbevolen (zie: KLINISCHE FARMACOLOGIE ).
Schimmel superinfecties
Bekende of voorheen niet-herkende candidiasis kan meer prominente symptomen vertonen tijdens de behandeling met FLAGYL en vereist behandeling met een candidacidaal middel.
Gebruik bij patiënten met bloeddyscrasieën
Metronidazol is een nitroimidazol en moet met voorzichtigheid worden gebruikt bij patiënten met tekenen van bloeddyscrasie of een voorgeschiedenis van bloeddyscrasie. Een milde leukopenie is waargenomen tijdens de toediening ervan; in klinische onderzoeken zijn echter geen aanhoudende hematologische afwijkingen waargenomen die toe te schrijven zijn aan metronidazol. Totale en differentiële leukocytentellingen worden aanbevolen voor en na de therapie.
Geneesmiddelresistente bacteriën en parasieten
Het voorschrijven van FLAGYL bij afwezigheid van een bewezen of sterk vermoede bacteriële of parasitaire infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën en parasieten.
Geneesmiddel-/laboratoriumtestinteracties
Metronidazol kan interfereren met bepaalde soorten bepalingen van serumchemiewaarden, zoals aspartaataminotransferase (AST, SGOT), alanineaminotransferase (ALT, SGPT), lactaatdehydrogenase (LDH), triglyceriden en glucosehexokinase. Waarden van nul kunnen worden waargenomen. Alle assays waarin interferentie is gemeld, omvatten enzymatische koppeling van de assay aan oxidatie-reductie van nicotinamide-adenine-dinucleotide (NAD+NADH). Interferentie is te wijten aan de gelijkenis in absorptiepieken van NADH (340 nm) en metronidazol (322 nm) bij pH 7.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Tumoren die de lever, longen, borst- en lymfatische weefsels aantasten, zijn gedetecteerd in verschillende onderzoeken met metronidazol bij ratten en muizen, maar niet bij hamsters.
Pulmonale tumoren zijn waargenomen in alle zes gerapporteerde onderzoeken bij de muis, waaronder één onderzoek waarin de dieren werden gedoseerd volgens een intermitterend schema (toediening alleen gedurende elke vierde week). Kwaadaardige levertumoren waren toegenomen bij mannelijke muizen die werden behandeld met ongeveer 1500 mg/m² (vergelijkbaar met de maximaal aanbevolen dagelijkse dosis, gebaseerd op vergelijkingen van het lichaamsoppervlak). Maligne lymfomen en pulmonale neoplasmata waren ook toegenomen met levenslange voeding van het medicijn aan muizen. Borst- en levertumoren waren verhoogd bij vrouwelijke ratten die oraal metronidazol kregen toegediend in vergelijking met gelijktijdige controles. Er zijn twee levenslange tumorigeniciteitsstudies bij hamsters uitgevoerd en waarvan gemeld is dat ze negatief waren.
Metronidazol heeft mutagene activiteit aangetoond in in vitro testsystemen, waaronder de Ames-test. Studies bij zoogdieren in vivo hebben geen potentieel voor genetische schade aangetoond.
Metronidazol had geen nadelige effecten op de vruchtbaarheid of de testikelfunctie bij mannelijke ratten bij doses tot 400 mg/kg/dag (vergelijkbaar met de maximaal aanbevolen klinische dosis, gebaseerd op vergelijkingen van het lichaamsoppervlak) gedurende 28 dagen. Ratten die gedurende 6 weken of langer met dezelfde dosis werden behandeld, waren echter onvruchtbaar en vertoonden ernstige degeneratie van het seminifereuze epitheel in de teelballen, evenals duidelijke dalingen in het aantal zaadcellen in de testiculaire en epididymale zaadcellen. De vruchtbaarheid werd bij de meeste ratten hersteld na een herstelperiode van acht weken zonder medicijnen.
Zwangerschap
Teratogene effecten
Er zijn geen adequate en goed gecontroleerde onderzoeken naar FLAGYL bij zwangere vrouwen. Er zijn gepubliceerde gegevens van patiëntcontroleonderzoeken, cohortonderzoeken en 2 meta-analyses van meer dan 5000 zwangere vrouwen die metronidazol tijdens de zwangerschap hebben gebruikt. Veel onderzoeken omvatten blootstellingen in het eerste trimester. Eén onderzoek toonde een verhoogd risico op een hazenlip, met of zonder een gespleten gehemelte, bij zuigelingen die in-utero aan metronidazol werden blootgesteld; deze bevindingen werden echter niet bevestigd. Bovendien namen meer dan tien gerandomiseerde, placebogecontroleerde klinische onderzoeken meer dan 5000 zwangere vrouwen op om het gebruik van antibiotische behandeling (inclusief metronidazol) voor bacteriële vaginose te beoordelen op de incidentie van vroeggeboorte. De meeste onderzoeken toonden geen verhoogd risico op aangeboren afwijkingen of andere nadelige foetale uitkomsten na blootstelling aan metronidazol tijdens de zwangerschap. Drie onderzoeken die zijn uitgevoerd om het risico op kanker bij zuigelingen te beoordelen na blootstelling aan metronidazol tijdens de zwangerschap, lieten geen verhoogd risico zien; het vermogen van deze onderzoeken om een dergelijk signaal te detecteren was echter beperkt.
Metronidazol passeert de placentabarrière en de effecten ervan op de menselijke foetale organogenese zijn niet bekend. Er zijn reproductieonderzoeken uitgevoerd bij ratten, konijnen en muizen in doses die vergelijkbaar zijn met de maximaal aanbevolen dosis voor de mens op basis van vergelijkingen van het lichaamsoppervlak. Er was geen bewijs van schade aan de foetus als gevolg van metronidazol.
Moeders die borstvoeding geven
Metronidazol is aanwezig in moedermelk in concentraties die vergelijkbaar zijn met de serumspiegels van de moeder, en de serumspiegels van baby's kunnen dicht bij of vergelijkbaar zijn met de therapeutische niveaus van baby's. Vanwege het potentieel voor tumorigeniciteit dat is aangetoond voor metronidazol bij muizen en ratten
studies, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder. Als alternatief kan een zogende moeder ervoor kiezen moedermelk af te kolven en weg te gooien voor de duur van de behandeling met metronidazol, en gedurende 24 uur nadat de therapie is beëindigd, en haar baby opgeslagen moedermelk of flesvoeding te geven.
Geriatrisch gebruik
Bij oudere geriatrische patiënten wordt controle op metronidazol-gerelateerde bijwerkingen aanbevolen (zie: KLINISCHE FARMACOLOGIE , PREVENTIEVE MAATREGELEN ). Een verminderde leverfunctie bij geriatrische patiënten kan leiden tot verhoogde concentraties van metronidazol die een aanpassing van de dosering van metronidazol noodzakelijk kunnen maken (zie DOSERING EN ADMINISTRATIE ).
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld, behalve voor de behandeling van amebiasis.
OVERDOSERING
Enkelvoudige orale doses metronidazol, tot 15 g, zijn gemeld bij zelfmoordpogingen en accidentele overdoses. De gemelde symptomen zijn misselijkheid, braken en ataxie.
Oraal metronidazol is onderzocht als een stralingssensibilisator bij de behandeling van kwaadaardige tumoren. Neurotoxische effecten, waaronder toevallen en perifere neuropathie, zijn gemeld na 5 tot 7 dagen doses van 6 tot 10,4 g om de dag.
Behandeling van overdosering
Er is geen specifiek antidotum voor een overdosis metronidazol; daarom moet de behandeling van de patiënt bestaan uit symptomatische en ondersteunende therapie.
CONTRA-INDICATIES
overgevoeligheid
FLAGYL-tabletten zijn gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheid voor metronidazol of andere nitroimidazolderivaten.
Bij patiënten met trichomoniasis is FLAGYL 200 mg tabletten gecontra-indiceerd tijdens het eerste trimester van de zwangerschap (zie PREVENTIEVE MAATREGELEN ).
Psychotische reactie met disulfiram
Het gebruik van oraal metronidazol wordt in verband gebracht met psychotische reacties bij alcoholische patiënten die gelijktijdig disulfiram gebruikten. Dien metronidazol niet toe aan patiënten die de afgelopen twee weken disulfiram hebben gebruikt (zie: PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
Interactie met alcohol
Het gebruik van oraal metronidazol gaat gepaard met een disulfiram-achtige reactie op alcohol, waaronder buikkrampen, misselijkheid, braken, hoofdpijn en blozen. Stop het gebruik van alcohol of producten die propyleenglycol bevatten tijdens en gedurende ten minste drie dagen na de behandeling met metronidazol (zie PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
Cockayne-syndroom
FLAGYL 400 mg tabletten zijn gecontra-indiceerd bij patiënten met het Cockayne-syndroom. Ernstige onomkeerbare levertoxiciteit/acuut leverfalen met fatale afloop zijn gemeld na het starten van metronidazol bij patiënten met het Cockayne-syndroom (zie ONGEWENSTE REACTIES ).
KLINISCHE FARMACOLOGIE
Absorptie
Dispositie van metronidazol in het lichaam is vergelijkbaar voor zowel orale als intraveneuze doseringsvormen. Na orale toediening wordt metronidazol goed geabsorbeerd, met piekplasmaconcentraties tussen één en twee uur na toediening.
Plasmaconcentraties van metronidazol zijn evenredig met de toegediende dosis. Orale toediening van 250 mg, 500 mg of 2.000 mg produceerde piekplasmaconcentraties van respectievelijk 6 mcg/ml, 12 mcg/ml en 40 mcg/ml. Studies onthullen geen significante verschillen in biologische beschikbaarheid tussen mannen en vrouwen; vanwege gewichtsverschillen zijn de resulterende plasmaspiegels bij mannen echter over het algemeen lager.
Verdeling
Metronidazol is het belangrijkste bestanddeel dat in het plasma voorkomt, waarbij ook kleinere hoeveelheden metabolieten aanwezig zijn. Minder dan 20% van het circulerende metronidazol is gebonden aan plasma-eiwitten. Metronidazol verschijnt in cerebrospinale vloeistof, speeksel en moedermelk in concentraties die vergelijkbaar zijn met die in plasma. Bacteriedodende concentraties van metronidazol zijn ook gedetecteerd in pus van leverabcessen.
Metabolisme/uitscheiding
De belangrijkste eliminatieroute van metronidazol en zijn metabolieten is via de urine (60% tot 80% van de dosis), waarbij fecale excretie 6% tot 15% van de dosis uitmaakt. De metabolieten die in de urine verschijnen, zijn voornamelijk het gevolg van oxidatie van de zijketen [1-(ßhydroxyethyl)-2-hydroxymethyl-5-nitroimidazol en 2-methyl-5-nitroimidazol-1-ylazijnzuur] en glucuronideconjugatie, waarbij onveranderd metronidazol wordt verklaard voor ongeveer 20% van het totaal. Zowel de moederverbinding als de hydroxylmetaboliet bezitten in vitro antimicrobiële activiteit.
De renale klaring van metronidazol is ongeveer 10 ml/min/1,73 m². De gemiddelde eliminatiehalfwaardetijd van metronidazol bij gezonde proefpersonen is acht uur.
Nierfunctiestoornis
Een verminderde nierfunctie verandert de farmacokinetiek van een enkelvoudige dosis van metronidazol niet.
Proefpersonen met terminale nierziekte (ESRD; CLCR = 8,1 ± 9,1 ml/min) en die een enkelvoudige intraveneuze infusie van 500 mg metronidazol kregen, hadden geen significante verandering in de farmacokinetiek van metronidazol, maar hadden een 2-voudig hogere Cmax van hydroxy-metronidazol en 5 -maal hogere Cmax van metronidazolacetaat, vergeleken met gezonde proefpersonen met een normale nierfunctie (CLCR=126±16 ml/min). Vanwege de mogelijke accumulatie van metronidazolmetabolieten bij ESRD-patiënten, wordt daarom aanbevolen om te controleren op metronidazol-gerelateerde bijwerkingen (zie PREVENTIEVE MAATREGELEN ).
Effect van dialyse
Na een enkelvoudige intraveneuze infusie of orale dosis metronidazol 500 mg werd de klaring van metronidazol onderzocht bij ESRD-patiënten die hemodialyse of continue ambulante peritoneale dialyse (CAPD) ondergingen. Een hemodialysesessie van 4 tot 8 uur verwijderde 40% tot 65% van de toegediende dosis metronidazol, afhankelijk van het gebruikte type dialysatormembraan en de duur van de dialysesessie. Als de toediening van metronidazol niet kan worden gescheiden van de dialysesessie, dient suppletie van de dosis metronidazol na hemodialyse te worden overwogen (zie DOSERING EN ADMINISTRATIE ). Een peritoneale dialysesessie van 7,5 uur verwijderde ongeveer 10% van de toegediende dosis metronidazol. Er is geen aanpassing van de dosis metronidazol nodig bij ESRD-patiënten die CAPD ondergaan.
Leverfunctiestoornis
Na een enkelvoudige intraveneuze infusie van 500 mg metronidazol was de gemiddelde AUC24 van metronidazol 114% hoger bij patiënten met ernstige (Child-Pugh C) leverinsufficiëntie en met 54% en 53% bij patiënten met lichte (Child-Pugh A) en matige (Child-Pugh B) leverfunctiestoornis, respectievelijk, in vergelijking met gezonde controlepersonen. Er waren geen significante veranderingen in de AUC24 van hydroxyl-metronidazol bij deze patiënten met een leverfunctiestoornis. Een verlaging van de dosering metronidazol met 50% wordt aanbevolen bij patiënten met een ernstige (Child-Pugh C) leverfunctiestoornis (zie DOSERING EN ADMINISTRATIE ). Er is geen dosisaanpassing nodig voor patiënten met een lichte tot matige leverfunctiestoornis. Patiënten met een lichte tot matige leverfunctiestoornis moeten worden gecontroleerd op metronidazol-gerelateerde bijwerkingen (zie: PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ).
Geriatrische patiënten
Na een enkelvoudige orale of intraveneuze dosis metronidazol van 500 mg hadden proefpersonen > 70 jaar zonder duidelijke nier- of leverdisfunctie een 40% tot 80% hogere gemiddelde AUC van hydroxymetronidazol (actieve metaboliet), zonder duidelijke verhoging van de gemiddelde AUC van metronidazol (moederverbinding), vergeleken met jonge gezonde controles PREVENTIEVE MAATREGELEN ).
Pediatrische patiënten
In één onderzoek bleken pasgeboren baby's een verminderd vermogen te hebben om metronidazol te elimineren. De eliminatiehalfwaardetijd, gemeten tijdens de eerste 3 dagen van het leven, was omgekeerd evenredig met de zwangerschapsduur. Bij zuigelingen met een zwangerschapsduur tussen 28 en 40 weken varieerde de overeenkomstige eliminatiehalfwaardetijd van 109 tot 22,5 uur.
Microbiologie
Werkingsmechanisme
Metronidazol, een nitroimidazol, oefent antibacteriële effecten uit in een anaërobe omgeving tegen de meeste obligate anaëroben. Zodra metronidazol het organisme binnenkomt door passieve diffusie en geactiveerd wordt in het cytoplasma van gevoelige anaërobe bacteriën, wordt het verminderd; dit proces omvat intracellulaire elektronentransporteiwitten zoals ferredoxine, overdracht van een elektron naar de nitrogroep van het metronidazol en vorming van een kortlevend nitroso-vrij radicaal. Door deze wijziging van het metronidazolmolecuul wordt een concentratiegradiënt gecreëerd en gehandhaafd die het intracellulaire transport van het geneesmiddel bevordert. De gereduceerde vorm van metronidazol en vrije radicalen kunnen een interactie aangaan met DNA, wat leidt tot remming van de DNA-synthese en DNA-afbraak, wat leidt tot de dood van de bacteriën. Het precieze werkingsmechanisme van metronidazol is onduidelijk.
Weerstand
Er bestaat een potentieel voor ontwikkeling van resistentie tegen metronidazol.
Resistentie kan te wijten zijn aan meerdere mechanismen, waaronder verminderde opname van het geneesmiddel, gewijzigde reductie-efficiëntie, overexpressie van de effluxpompen, inactivering van het geneesmiddel en/of verhoogd herstel van DNA-schade.
Metronidazol heeft geen klinisch relevante activiteit tegen facultatieve anaëroben of obligate aeroben.
Antimicrobiale activiteit
Metronidazol is actief gebleken tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties, zoals beschreven in de rubriek INDICATIES EN GEBRUIK.
Gram-positieve anaëroben
Clostridium-soort Eubacterium-soort Peptococcus-soort Peptostreptococcus-soort
Gram-negatieve aeroben
Bacteroides fragilis-groep (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B.vulgatus) Fusobacterium-soorten
Protozoaire parasieten
Entamoeba histolytica Trichomonas vaginalis
De volgende in-vitrogegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend:
Metronidazol vertoont in vitro minimale remmende concentraties (MIC's) van 8 mcg/ml of minder tegen de meeste (≥ 90%) isolaten van de volgende bacteriën; de veiligheid en werkzaamheid van metronidazol bij de behandeling van klinische infecties veroorzaakt door deze bacteriën zijn echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-negatieve anaëroben
Bacteroides fragilis-groep (B. caccae, B. uniformis) Prevotella-soort (P. bivia, P. buccae, P. disiens)
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
PATIËNT INFORMATIE
Interactie met alcohol
Stop met het gebruik van alcoholische dranken of producten die propyleenglycol bevatten tijdens het gebruik van FLAGYL 400 mg en gedurende ten minste drie dagen daarna, omdat buikkrampen, misselijkheid, braken, hoofdpijn en blozen kunnen optreden (zie CONTRA-INDICATIES en PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
Behandeling van bacteriële en parasitaire infecties
Patiënten moeten erop worden gewezen dat FLAGYL 400 mg alleen mag worden gebruikt voor de behandeling van bacteriële en parasitaire infecties. FLAGYL 400 mg behandelt geen virale infecties (bijv. verkoudheid). Wanneer FLAGYL wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet met FLAGYL 400 mg kunnen worden behandeld.
