Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zyprexa 10 mg en hoe wordt het gebruikt?
Zyprexa is een receptgeneesmiddel dat wordt gebruikt om de symptomen van schizofrenie en bipolaire stoornis (manische depressie) te behandelen. Zyprexa kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Zyprexa behoort tot een klasse geneesmiddelen die antipsychotica, 2e generatie, antimanische middelen wordt genoemd.
- Het is niet bekend of Zyprexa veilig en effectief is bij kinderen jonger dan 13 jaar.
Wat zijn de mogelijke bijwerkingen van Zyprexa 15 mg?
Zyprexa kan ernstige bijwerkingen veroorzaken, waaronder:
- ongecontroleerde spierbewegingen in uw gezicht (kauwen, smakken op de lippen, fronsen, tongbewegingen, knipperen of oogbewegingen),
- moeite met spreken of slikken,
- zwelling in de handen of voeten,
- verwardheid,
- ongewone gedachten of gedrag,
- hallucinaties,
- gedachten over jezelf pijn doen,
- plotselinge zwakte of ziek gevoel,
- koorts,
- rillingen,
- keelpijn,
- gezwollen tandvlees,
- pijnlijke zweertjes in de mond,
- pijn bij het slikken,
- huidzweren,
- verkoudheids- of griepsymptomen,
- hoesten,
- erg dorstig of warm voelen,
- onvermogen om te plassen,
- zwaar zweten,
- hete of droge huid,
- pijn in de bovenbuik,
- jeuk,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- verhoogde dorst,
- meer plassen,
- honger,
- droge mond,
- fruitige ademgeur,
- slaperigheid,
- wazig zien,
- gewichtsverlies,
- zeer stijve spieren,
- hoge koorts,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen, en
- duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zyprexa zijn:
- gewichtstoename (komt vaker voor bij tieners),
- verhoogde eetlust,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- moe of rusteloos voelen,
- problemen met spraak of geheugen,
- trillingen of beven,
- gevoelloosheid of tintelend gevoel,
- persoonlijkheidsveranderingen,
- droge mond,
- verhoogde speekselvloed,
- buikpijn,
- constipatie, en
- pijn in uw armen of benen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zyprexa. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
VERHOOGDE STERFTE BIJ OUDEREN PATINTEN MET DEMENTIEGERELATEERDE PSYCHOSE
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. Analyses van zeventien placebogecontroleerde onderzoeken (modale duur van 10 weken), grotendeels bij patiënten die atypische antipsychotica gebruikten, onthulden een risico op overlijden bij met geneesmiddelen behandelde patiënten van 1,6 tot 1,7 keer het risico op overlijden bij met placebo behandelde patiënten. In de loop van een typische 10 weken durende gecontroleerde studie was het sterftecijfer bij met geneesmiddelen behandelde patiënten ongeveer 4,5%, vergeleken met een percentage van ongeveer 2,6% in de placebogroep. Hoewel de doodsoorzaken uiteenliepen, bleken de meeste sterfgevallen van cardiovasculaire (bijv. hartfalen, plotselinge dood) of infectieuze (bijv. longontsteking) van aard te zijn. Observationele studies suggereren dat behandeling met conventionele antipsychotica, net als bij atypische antipsychotica, de mortaliteit kan verhogen. Het is niet duidelijk in hoeverre de bevindingen van verhoogde mortaliteit in observationele onderzoeken kunnen worden toegeschreven aan het antipsychoticum in tegenstelling tot bepaalde kenmerken van de patiënten. ZYPREXA (olanzapine) is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en PATIËNT INFORMATIE ].
Raadpleeg bij gebruik van ZYPREXA 15 mg en fluoxetine in combinatie ook het gedeelte Waarschuwing in een doos van de bijsluiter voor Symbyax.
OMSCHRIJVING
ZYPREXA (olanzapine) is een atypisch antipsychoticum dat behoort tot de klasse van thienobenzodiazepines. De chemische aanduiding is 2-methyl-4-(4-methyl-1-piperazinyl)-10H-thieno[2,3-b] [1,5]benzodiazepine. De molecuulformule is C17H20N4S, wat overeenkomt met een molecuulgewicht van 312,44. De chemische structuur is:
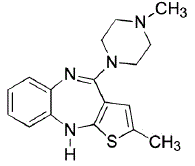
Olanzapine is een gele kristallijne vaste stof die praktisch onoplosbaar is in water.
ZYPREXA 7,5 mg tabletten zijn uitsluitend bedoeld voor orale toediening.
Elke tablet bevat olanzapine overeenkomend met 2,5 mg (8 mol), 5 mg (16 mol), 7,5 mg (24 mol), 10 mg (32 mol), 15 mg (48 mol) of 20 mg (64 mol). Inactieve ingrediënten zijn carnaubawas, crospovidon, hydroxypropylcellulose, hypromellose, lactose, magnesiumstearaat, microkristallijne cellulose en andere inactieve ingrediënten. De kleurcoating bevat Titanium Dioxide (alle sterktes), FD&C Blue No. 2 Aluminium Lake (15 mg) of Synthetic Red Iron Oxide (20 mg). De tabletten van 2,5, 5, 7,5 en 10 mg zijn bedrukt met eetbare inkt die FD&C Blue No. 2 Aluminium Lake bevat.
ZYPREXA 2,5 mg ZYDIS (olanzapine oraal uiteenvallende tabletten) is uitsluitend bedoeld voor orale toediening.
Elke oraal uiteenvallende tablet bevat olanzapine overeenkomend met 5 mg (16 mol), 10 mg (32 mol), 15 mg (48 mol) of 20 mg (64 mol). Het begint binnen enkele seconden in de mond te desintegreren, waardoor de inhoud vervolgens met of zonder vloeistof kan worden ingeslikt. ZYPREXA 15 mg ZYDIS (olanzapine oraal uiteenvallende tabletten) bevat ook de volgende inactieve ingrediënten: gelatine, mannitol, aspartaam, natriummethylparaben en natriumpropylparaben.
ZYPREXA 2, 5 mg IntraMuscular (olanzapine voor injectie) is alleen bedoeld voor intramusculair gebruik.
Elke injectieflacon voorziet in de toediening van 10 mg (32 mol) olanzapine met inactieve ingrediënten 50 mg lactosemonohydraat en 3,5 mg wijnsteenzuur. Zoutzuur en/of natriumhydroxide kunnen tijdens de productie zijn toegevoegd om de pH aan te passen.
INDICATIES
Schizofrenie
Orale ZYPREXA is geïndiceerd voor de behandeling van schizofrenie. De werkzaamheid werd vastgesteld in drie klinische onderzoeken bij volwassen patiënten met schizofrenie: twee onderzoeken van 6 weken en een onderhoudsonderzoek. Bij adolescente patiënten met schizofrenie (leeftijd 13-17) werd de werkzaamheid vastgesteld in één 6 weken durende studie [zie: Klinische studies ].
Bij het kiezen tussen de alternatieve behandelingen die beschikbaar zijn voor adolescenten, dienen clinici rekening te houden met het verhoogde potentieel (bij adolescenten in vergelijking met volwassenen) voor gewichtstoename en dyslipidemie. Artsen moeten rekening houden met de mogelijke langetermijnrisico's bij het voorschrijven aan adolescenten, en in veel gevallen kan dit ertoe leiden dat ze overwegen om eerst andere geneesmiddelen voor te schrijven aan adolescenten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bipolaire I-stoornis (manische of gemengde afleveringen)
Monotherapie
Orale ZYPREXA is geïndiceerd voor de acute behandeling van manische of gemengde episodes geassocieerd met bipolaire I-stoornis en onderhoudsbehandeling van bipolaire I-stoornis. De werkzaamheid werd vastgesteld in drie klinische onderzoeken bij volwassen patiënten met manische of gemengde episodes van bipolaire I-stoornis: twee onderzoeken van 3 tot 4 weken en één onderzoek naar monotherapie als onderhoudsbehandeling. Bij adolescente patiënten met manische of gemengde episodes geassocieerd met bipolaire I-stoornis (leeftijd 13-17), werd de werkzaamheid vastgesteld in één onderzoek van 3 weken [zie Klinische studies ].
Bij het kiezen tussen de alternatieve behandelingen die beschikbaar zijn voor adolescenten, dienen clinici rekening te houden met het verhoogde potentieel (bij adolescenten in vergelijking met volwassenen) voor gewichtstoename en dyslipidemie. Artsen moeten rekening houden met de mogelijke langetermijnrisico's bij het voorschrijven aan adolescenten, en in veel gevallen kan dit ertoe leiden dat ze overwegen om eerst andere geneesmiddelen voor te schrijven aan adolescenten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Aanvullende therapie bij lithium of valproaat
Orale ZYPREXA 5 mg is geïndiceerd voor de behandeling van manische of gemengde episodes geassocieerd met bipolaire I-stoornis als aanvulling op lithium of valproaat. De werkzaamheid werd vastgesteld in twee klinische onderzoeken van 6 weken bij volwassenen. De effectiviteit van aanvullende therapie voor langdurig gebruik is niet systematisch geëvalueerd in gecontroleerde onderzoeken [zie: Klinische studies ].
Speciale overwegingen bij de behandeling van pediatrische schizofrenie en bipolaire I-stoornis
Pediatrische schizofrenie en bipolaire I-stoornis zijn ernstige psychische stoornissen; de diagnose kan echter een uitdaging zijn. Voor pediatrische schizofrenie kunnen symptoomprofielen variabel zijn en voor bipolaire I-stoornis kunnen pediatrische patiënten variabele periodiciteitspatronen van manische of gemengde symptomen hebben. Het wordt aanbevolen om medicamenteuze therapie voor pediatrische schizofrenie en bipolaire I-stoornis alleen te starten nadat een grondige diagnostische evaluatie is uitgevoerd en zorgvuldige afweging is gemaakt van de risico's die gepaard gaan met medicamenteuze behandeling. Medicamenteuze behandeling van zowel pediatrische schizofrenie als bipolaire I-stoornis zou onderdeel moeten zijn van een totaal behandelprogramma dat vaak psychologische, educatieve en sociale interventies omvat.
ZYPREXA 15 mg intramusculair: agitatie geassocieerd met schizofrenie en bipolaire ik-manie
ZYPREXA 15 mg IntraMuscular is geïndiceerd voor de behandeling van acute agitatie geassocieerd met schizofrenie en bipolaire I-manie.
De werkzaamheid werd aangetoond in 3 kortdurende (24 uur IM-behandeling) placebogecontroleerde onderzoeken bij geagiteerde volwassen patiënten met: schizofrenie of bipolaire I-stoornis (manische of gemengde episodes) [zie Klinische studies ].
"Psychomotorische agitatie" wordt in de DSM-IV gedefinieerd als "overmatige motorische activiteit geassocieerd met een gevoel van innerlijke spanning." Patiënten die agitatie ervaren vertonen vaak gedrag dat hun diagnose en zorg verstoort, bijv. dreigend gedrag, escalerend of dringend verontrustend gedrag, of zelfvermoeiend gedrag, wat clinici ertoe brengt om intramusculaire antipsychotica te gebruiken om de agitatie onmiddellijk onder controle te krijgen.
ZYPREXA en fluoxetine in combinatie: depressieve episodes geassocieerd met bipolaire I-stoornis
Op basis van klinische onderzoeken is orale ZYPREXA en fluoxetine in combinatie geïndiceerd voor de behandeling van depressieve episodes die gepaard gaan met bipolaire I-stoornis. Als u ZYPREXA 10 mg en fluoxetine in combinatie gebruikt, raadpleeg dan de rubriek Klinische studies van de bijsluiter van Symbyax.
ZYPREXA monotherapie is niet geïndiceerd voor de behandeling van depressieve episodes geassocieerd met bipolaire I-stoornis.
ZYPREXA en fluoxetine in combinatie: therapieresistente depressie
Orale ZYPREXA en fluoxetine in combinatie is geïndiceerd voor de behandeling van therapieresistente depressie (ernstige depressieve stoornis bij patiënten die niet reageren op 2 afzonderlijke onderzoeken met verschillende antidepressiva met een adequate dosis en duur in de huidige episode), gebaseerd op klinische onderzoeken bij volwassen patiënten . Als u ZYPREXA en fluoxetine in combinatie gebruikt, raadpleeg dan de rubriek Klinische studies van de bijsluiter van Symbyax.
ZYPREXA 5 mg monotherapie is niet geïndiceerd voor de behandeling van therapieresistente depressie.
DOSERING EN ADMINISTRATIE
Schizofrenie
volwassenen
Dosisselectie
Orale olanzapine dient te worden toegediend volgens een eenmaal daags schema, ongeacht de maaltijden, in het algemeen beginnend met 5 tot 10 mg aanvankelijk, met een streefdosis van 10 mg/dag binnen enkele dagen. Verdere dosisaanpassingen, indien geïndiceerd, dienen over het algemeen te gebeuren met tussenpozen van niet minder dan 1 week, aangezien steady-state voor olanzapine niet zou worden bereikt gedurende ongeveer 1 week bij de typische patiënt. Wanneer dosisaanpassingen nodig zijn, worden dosisverhogingen/-verlagingen van 5 mg QD aanbevolen.
De werkzaamheid bij schizofrenie werd in klinische onderzoeken aangetoond in een dosisbereik van 10 tot 15 mg/dag. Doses boven 10 mg/dag bleken echter niet effectiever te zijn dan de dosis van 10 mg/dag. Een verhoging tot een dosis hoger dan de streefdosis van 10 mg/dag (dwz tot een dosis van 15 mg/dag of meer) wordt alleen aanbevolen na klinische beoordeling. Olanzapine is niet geïndiceerd voor gebruik in doses hoger dan 20 mg/dag.
Dosering bij speciale populaties
De aanbevolen startdosering is 5 mg bij patiënten die verzwakt zijn, die aanleg hebben voor hypotensieve reacties, die anders een combinatie van factoren vertonen die kunnen leiden tot een langzamer metabolisme van olanzapine (bijv. niet-rokende vrouwelijke patiënten ≥65 jaar), of die farmacodynamisch gevoeliger kunnen zijn voor olanzapine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ]. Indien geïndiceerd, dient dosisverhoging bij deze patiënten met voorzichtigheid te worden uitgevoerd.
Onderhoudsbehandeling
De werkzaamheid van oraal olanzapine, 10 mg/dag tot 20 mg/dag, bij het handhaven van de respons op de behandeling bij schizofrene patiënten die gedurende ongeveer 8 weken stabiel waren op ZYPREXA en daarna werden gevolgd voor terugval, is aangetoond in een placebogecontroleerd onderzoek [zie Klinische studies ]. De zorgverlener die ervoor kiest om ZYPREXA voor langere perioden te gebruiken, moet periodiek de bruikbaarheid van het geneesmiddel op de lange termijn voor de individuele patiënt opnieuw evalueren.
adolescenten
Dosisselectie
Orale olanzapine dient te worden toegediend volgens een eenmaal daags schema, ongeacht de maaltijden, met een aanbevolen startdosering van 2,5 of 5 mg, met een streefdosering van 10 mg/dag. De werkzaamheid bij adolescenten met schizofrenie werd aangetoond op basis van een flexibel dosisbereik van 2,5 tot 20 mg/dag in klinische onderzoeken, met een gemiddelde modale dosis van 12,5 mg/dag (gemiddelde dosis van 11,1 mg/dag). Wanneer dosisaanpassingen nodig zijn, worden dosisverhogingen/-verlagingen van 2,5 of 5 mg aanbevolen.
De veiligheid en effectiviteit van doses hoger dan 20 mg/dag zijn niet geëvalueerd in klinische onderzoeken [zie: Klinische studies ].
Onderhoudsbehandeling
De werkzaamheid van ZYPREXA voor de onderhoudsbehandeling van schizofrenie bij de adolescente populatie is niet systematisch geëvalueerd; de onderhoudswerkzaamheid kan echter worden geëxtrapoleerd uit gegevens bij volwassenen, samen met vergelijkingen van de farmacokinetische parameters van olanzapine bij volwassen en adolescente patiënten. Daarom wordt over het algemeen aanbevolen om patiënten die reageren voort te zetten na de acute respons, maar met de laagste dosis die nodig is om remissie te behouden. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Bipolaire I-stoornis (manische of gemengde afleveringen)
volwassenen
Dosisselectie voor monotherapie
Oraal olanzapine moet eenmaal daags worden toegediend, ongeacht de maaltijden, in het algemeen beginnend met 10 of 15 mg. Doseringsaanpassingen, indien geïndiceerd, dienen over het algemeen te gebeuren met tussenpozen van niet minder dan 24 uur, in overeenstemming met de procedures in de placebogecontroleerde onderzoeken. Wanneer dosisaanpassingen nodig zijn, worden dosisverhogingen/-verlagingen van 5 mg QD aanbevolen.
In klinische onderzoeken werd kortdurende (3-4 weken) antimanische werkzaamheid aangetoond in een dosisbereik van 5 mg tot 20 mg/dag. De veiligheid van doses hoger dan 20 mg/dag is niet geëvalueerd in klinische onderzoeken [zie: Klinische studies ].
Onderhoud monotherapie
Het voordeel van het handhaven van bipolaire I-patiënten op monotherapie met orale ZYPREXA 10 mg in een dosis van 5 tot 20 mg/dag, na het bereiken van een responderstatus gedurende een gemiddelde duur van 2 weken, werd aangetoond in een gecontroleerd onderzoek [zie Klinische studies ]. De zorgverlener die ervoor kiest om ZYPREXA voor langere perioden te gebruiken, moet periodiek de bruikbaarheid van het geneesmiddel op de lange termijn voor de individuele patiënt opnieuw evalueren.
Dosisselectie voor aanvullende behandeling
Bij toediening als aanvullende behandeling bij lithium of valproaat, dient de orale dosering van olanzapine in het algemeen te beginnen met 10 mg eenmaal daags, ongeacht de maaltijden.
Antimanische werkzaamheid werd aangetoond in een dosisbereik van 5 mg tot 20 mg/dag in klinische onderzoeken [zie: Klinische studies ]. De veiligheid van doses hoger dan 20 mg/dag is niet geëvalueerd in klinische onderzoeken.
adolescenten
Dosisselectie
Orale olanzapine dient te worden toegediend volgens een eenmaal daags schema, ongeacht de maaltijden, met een aanbevolen startdosering van 2,5 of 5 mg, met een streefdosering van 10 mg/dag. De werkzaamheid bij adolescenten met een bipolaire I-stoornis (manische of gemengde episodes) werd aangetoond op basis van een flexibel dosisbereik van 2,5 tot 20 mg/dag in klinische onderzoeken, met een gemiddelde modale dosis van 10,7 mg/dag (gemiddelde dosis van 8,9 mg/dag). ). Wanneer dosisaanpassingen nodig zijn, worden dosisverhogingen/-verlagingen van 2,5 of 5 mg aanbevolen.
De veiligheid en effectiviteit van doses hoger dan 20 mg/dag zijn niet geëvalueerd in klinische onderzoeken [zie: Klinische studies ].
Onderhoudsbehandeling
De werkzaamheid van ZYPREXA 7,5 mg voor de onderhoudsbehandeling van bipolaire I-stoornis bij adolescenten is niet geëvalueerd; de onderhoudswerkzaamheid kan echter worden geëxtrapoleerd uit gegevens bij volwassenen, samen met vergelijkingen van de farmacokinetische parameters van olanzapine bij volwassen en adolescente patiënten. Daarom wordt over het algemeen aanbevolen om patiënten die reageren voort te zetten na de acute respons, maar met de laagste dosis die nodig is om remissie te behouden. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Toediening van ZYPREXA ZYDIS (olanzapine oraal uiteenvallende tabletten)
Na het openen van het sachet de folie van de blister verwijderen. Duw de tablet niet door de folie. Verwijder onmiddellijk na het openen van de blisterverpakking met droge handen de tablet en plaats de volledige ZYPREXA 15 mg ZYDIS in de mond. Desintegratie van de tablet vindt snel plaats in het speeksel, zodat het gemakkelijk kan worden doorgeslikt met of zonder vloeistof.
ZYPREXA intramusculair: agitatie geassocieerd met schizofrenie en bipolaire I-manie
Dosisselectie voor geagiteerde volwassen patiënten met schizofrenie en bipolaire I-manie
De werkzaamheid van intramusculair olanzapine voor injectie bij het beheersen van agitatie bij deze aandoeningen werd aangetoond in een dosisbereik van 2,5 mg tot 10 mg. De aanbevolen dosis bij deze patiënten is 10 mg. Een lagere dosis van 5 of 7,5 mg kan worden overwogen wanneer klinische factoren dit rechtvaardigen [zie: Klinische studies ]. Als de agitatie die aanvullende intramusculaire doses rechtvaardigt aanhoudt na de aanvangsdosis, kunnen volgende doses tot 10 mg worden gegeven. De werkzaamheid van herhaalde doses intramusculair olanzapine voor injectie bij geagiteerde patiënten is echter niet systematisch geëvalueerd in gecontroleerde klinische onderzoeken. Ook is de veiligheid van totale dagelijkse doses van meer dan 30 mg, of injecties van 10 mg die vaker dan 2 uur na de aanvangsdosis en 4 uur na de tweede dosis worden gegeven, niet geëvalueerd in klinische onderzoeken. Maximale dosering van intramusculaire olanzapine (bijv. 3 doses van 10 mg toegediend met een tussenpoos van 2-4 uur) kan gepaard gaan met een aanzienlijk optreden van significante orthostatische hypotensie (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Daarom wordt aanbevolen dat patiënten die daaropvolgende intramusculaire injecties nodig hebben, worden beoordeeld op orthostatische hypotensie voordat eventuele volgende doses intramusculair olanzapine voor injectie worden toegediend. Toediening van een extra dosis aan een patiënt met een klinisch significante houdingsverandering in de systolische bloeddruk wordt niet aanbevolen.
Als lopende therapie met olanzapine klinisch geïndiceerd is, kan oraal olanzapine worden gestart in een spreiding van 5-20 mg/dag zodra dit klinisch aangewezen is [zie Schizofrenie en Bipolaire I-stoornis (manische of gemengde afleveringen) ].
Intramusculaire dosering bij speciale populaties
Een dosis van 5 mg/injectie moet worden overwogen voor geriatrische patiënten of wanneer andere klinische factoren dit rechtvaardigen. Een lagere dosis van 2,5 mg/injectie moet worden overwogen voor patiënten die anders verzwakt zouden kunnen zijn, vatbaar zijn voor hypotensieve reacties of farmacodynamisch gevoeliger zijn voor olanzapine (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
Toediening van ZYPREXA intramusculair
ZYPREXA Intramusculair is uitsluitend bedoeld voor intramusculair gebruik. Niet intraveneus of subcutaan toedienen. Injecteer langzaam, diep in de spiermassa. Parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de container dit toelaten.
Aanwijzingen voor de bereiding van ZYPREXA 2,5 mg intramusculair met steriel water voor injectie
Los de inhoud van de injectieflacon op met 2,1 ml steriel water voor injectie om een oplossing te verkrijgen die ongeveer 5 mg/ml olanzapine bevat. De resulterende oplossing moet helder en geel lijken. ZYPREXA 7,5 mg intramusculair gereconstitueerd met steriel water voor injectie moet onmiddellijk (binnen 1 uur) na reconstitutie worden gebruikt. Gooi elk ongebruikt deel weg.
De volgende tabel geeft injectievolumes voor het toedienen van verschillende doses intramusculair olanzapine voor injectie, gereconstitueerd met steriel water voor injectie.
Informatie over fysieke incompatibiliteit
ZYPREXA 15 mg intramusculair mag alleen worden gereconstitueerd met steriel water voor injectie. ZYPREXA 20 mg IntraMuscular mag niet worden gecombineerd in een injectiespuit met diazepam-injectie omdat er neerslag optreedt wanneer deze producten worden gemengd. Lorazepam-injectie mag niet worden gebruikt om ZYPREXA IntraMuscular te reconstitueren, aangezien deze combinatie resulteert in een vertraagde reconstitutietijd. ZYPREXA IntraMuscular mag niet worden gecombineerd in een injectiespuit met haloperidol-injectie, omdat is aangetoond dat de resulterende lage pH olanzapine in de loop van de tijd afbreekt.
ZYPREXA 20 mg en fluoxetine in combinatie: depressieve episodes geassocieerd met bipolaire I-stoornis
Als u ZYPREXA 7,5 mg en fluoxetine in combinatie gebruikt, raadpleeg dan ook het gedeelte Klinische onderzoeken van de bijsluiter van Symbyax.
volwassenen
Oraal olanzapine moet eenmaal daags in combinatie met fluoxetine 's avonds worden toegediend, ongeacht de maaltijden, in het algemeen beginnend met 5 mg oraal olanzapine en 20 mg fluoxetine. Doseringsaanpassingen, indien geïndiceerd, kunnen worden gemaakt op basis van werkzaamheid en verdraagbaarheid binnen dosisbereiken van oraal olanzapine 5 tot 12,5 mg en fluoxetine 20 tot 50 mg. De antidepressieve werkzaamheid werd aangetoond met ZYPREXA 10 mg en fluoxetine in combinatie bij volwassen patiënten met een dosisbereik van olanzapine 6 tot 12 mg en fluoxetine 25 tot 50 mg. De veiligheid van gelijktijdige toediening van doses hoger dan 18 mg olanzapine met 75 mg fluoxetine is niet geëvalueerd in klinische onderzoeken.
Kinderen en adolescenten (10-17 jaar)
Oraal olanzapine moet eenmaal daags in combinatie met fluoxetine 's avonds worden toegediend, ongeacht de maaltijden, in het algemeen beginnend met 2,5 mg oraal olanzapine en 20 mg fluoxetine. Doseringsaanpassingen, indien geïndiceerd, kunnen worden gemaakt op basis van werkzaamheid en verdraagbaarheid. De veiligheid van gelijktijdige toediening van doses hoger dan 12 mg olanzapine met 50 mg fluoxetine is niet geëvalueerd in pediatrische klinische onderzoeken.
De veiligheid en werkzaamheid van ZYPREXA en fluoxetine in combinatie zijn vastgesteld in klinische onderzoeken ter ondersteuning van de goedkeuring van Symbyax (vaste dosiscombinatie van ZYPREXA en fluoxetine). Symbyax wordt gedoseerd tussen 3 mg/25 mg (olanzapine/fluoxetine) per dag en 12 mg/50 mg (olanzapine/fluoxetine) per dag. De volgende tabel toont de juiste doseringen van de afzonderlijke componenten van ZYPREXA 10 mg en fluoxetine versus Symbyax. Doseringsaanpassingen, indien geïndiceerd, moeten worden gemaakt met de afzonderlijke componenten op basis van werkzaamheid en verdraagbaarheid.
Hoewel er geen bewijs is om de vraag te beantwoorden hoe lang een patiënt die met ZYPREXA en fluoxetine in combinatie wordt behandeld, dit middel moet blijven gebruiken, wordt algemeen aanvaard dat bipolaire I-stoornis, inclusief de depressieve episodes die gepaard gaan met bipolaire I-stoornis, een chronische aandoening is. ziekte die chronische behandeling vereist. De zorgverlener moet periodiek de noodzaak van voortgezette farmacotherapie opnieuw onderzoeken.
ZYPREXA 5 mg monotherapie is niet geïndiceerd voor de behandeling van depressieve episodes geassocieerd met bipolaire I-stoornis.
ZYPREXA 7,5 mg en fluoxetine in combinatie: behandelingsresistente depressie
Als u ZYPREXA en fluoxetine in combinatie gebruikt, raadpleeg dan ook de rubriek Klinische studies van de bijsluiter van Symbyax.
Oraal olanzapine moet eenmaal daags in combinatie met fluoxetine 's avonds worden toegediend, ongeacht de maaltijden, in het algemeen beginnend met 5 mg oraal olanzapine en 20 mg fluoxetine. Doseringsaanpassingen, indien geïndiceerd, kunnen worden gemaakt op basis van werkzaamheid en verdraagbaarheid binnen dosisbereiken van oraal olanzapine 5 tot 20 mg en fluoxetine 20 tot 50 mg. Antidepressieve werkzaamheid werd aangetoond met olanzapine en fluoxetine in combinatie bij volwassen patiënten met een dosisbereik van olanzapine 6 tot 18 mg en fluoxetine 25 tot 50 mg.
De veiligheid en werkzaamheid van olanzapine in combinatie met fluoxetine zijn vastgesteld in klinische onderzoeken ter ondersteuning van de goedkeuring van Symbyax (vaste dosiscombinatie van olanzapine en fluoxetine). Symbyax wordt gedoseerd tussen 3 mg/25 mg (olanzapine/fluoxetine) per dag en 12 mg/50 mg (olanzapine/fluoxetine) per dag. Tabel 1 hierboven toont de juiste individuele componentdoses van ZYPREXA en fluoxetine versus Symbyax. Doseringsaanpassingen, indien geïndiceerd, moeten worden gemaakt met de afzonderlijke componenten op basis van werkzaamheid en verdraagbaarheid.
Hoewel er geen bewijs is om de vraag te beantwoorden hoe lang een patiënt die met ZYPREXA en fluoxetine in combinatie wordt behandeld, dit middel moet blijven gebruiken, wordt algemeen aanvaard dat therapieresistente depressie (ernstige depressieve stoornis bij volwassen patiënten die niet reageren op 2 afzonderlijke onderzoeken met verschillende antidepressiva met een adequate dosis en duur in de huidige episode) is een chronische ziekte die chronische behandeling vereist. De zorgverlener moet periodiek de noodzaak van voortgezette farmacotherapie opnieuw onderzoeken.
De veiligheid van gelijktijdige toediening van doses hoger dan 18 mg olanzapine met 75 mg fluoxetine is niet geëvalueerd in klinische onderzoeken.
ZYPREXA 7,5 mg monotherapie is niet geïndiceerd voor de behandeling van therapieresistente depressie (ernstige depressieve stoornis bij patiënten die niet reageren op 2 antidepressiva met een adequate dosis en duur in de huidige episode).
ZYPREXA 10 mg en fluoxetine in combinatie: dosering bij speciale populaties
De startdosering van oraal olanzapine 2,5-5 mg met fluoxetine 20 mg dient te worden gebruikt bij patiënten met aanleg voor hypotensieve reacties, patiënten met leverinsufficiëntie of patiënten die een combinatie van factoren vertonen die het metabolisme van olanzapine of fluoxetine in combinatie kunnen vertragen. (vrouwelijk geslacht, geriatrische leeftijd, niet-rokersstatus), of die patiënten die farmacodynamisch gevoelig kunnen zijn voor olanzapine. Aanpassing van de dosering kan nodig zijn bij patiënten die een combinatie van factoren vertonen die het metabolisme kunnen vertragen. Indien geïndiceerd, dient dosisverhoging bij deze patiënten met voorzichtigheid te worden uitgevoerd. ZYPREXA en fluoxetine in combinatie zijn niet systematisch onderzocht bij patiënten ouder dan 65 jaar of bij patiënten jonger dan 10 jaar [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
De ZYPREXA 2,5 mg, 5 mg, 7,5 mg en 10 mg tabletten zijn wit, rond en bedrukt in blauwe inkt met LILLY en het tabletnummer. De tabletten van 15 mg zijn elliptisch, blauw en voorzien van de inscriptie LILLY en het tabletnummer. De tabletten van 20 mg zijn elliptisch, roze en voorzien van de inscriptie LILLY en het tabletnummer. Tabletten worden niet gescoord. De tabletten zijn als volgt verkrijgbaar:
ZYPREXA 10 mg ZYDIS (olanzapine oraal uiteenvallende tabletten) zijn geel, rond en hebben de inscriptie van de tabletsterkte. Tabletten worden niet gescoord. De tabletten zijn als volgt verkrijgbaar:
ZYPREXA 15 mg intramusculair is verkrijgbaar in injectieflacons van 10 mg (1s).
De ZYPREXA 2,5 mg, 5 mg, 7,5 mg en 10 mg tabletten zijn wit, rond en bedrukt in blauwe inkt met LILLY en het tabletnummer. De tabletten van 15 mg zijn elliptisch, blauw en voorzien van de inscriptie LILLY en het tabletnummer. De tabletten van 20 mg zijn elliptisch, roze en voorzien van de inscriptie LILLY en het tabletnummer. De tabletten zijn als volgt verkrijgbaar:
ZYPREXA 2,5 mg ZYDIS (olanzapine oraal uiteenvallende tabletten) zijn geel, rond en hebben de inscriptie van de tabletsterkte. De tabletten zijn als volgt verkrijgbaar:
ZYPREXA intramusculair is verkrijgbaar in:
NDC 0002-7597-01 (nr. VL7597) - 10 mg injectieflacon (1s)
Opslag en behandeling
Bewaar ZYPREXA-tabletten, ZYPREXA ZYDIS en ZYPREXA intramusculaire injectieflacons (vóór reconstitutie) bij een gecontroleerde kamertemperatuur, 20° tot 25°C (68° tot 77°F) (zie USP ]. Gereconstitueerd ZYPREXA 20 mg IntraMuscular kan worden bewaard bij een gecontroleerde kamertemperatuur, 20° tot 25°C (68° tot 77°F) [zie USP gedurende maximaal 1 uur indien nodig. Gooi alle ongebruikte porties van gereconstitueerde ZYPREXA IntraMuscular weg. De USP definieert gecontroleerde kamertemperatuur als een temperatuur die thermostatisch wordt gehandhaafd en die de gebruikelijke en gebruikelijke werkomgeving van 20° tot 25°C (68° tot 77°F) omvat; dat resulteert in een gemiddelde kinetische temperatuur die wordt berekend op niet meer dan 25°C; en dat maakt excursies mogelijk tussen 15 ° en 30 ° C (59 ° en 86 ° F) die worden ervaren in apotheken, ziekenhuizen en magazijnen.
Bescherm ZYPREXA tabletten en ZYPREXA ZYDIS tegen licht en vocht. Bescherm ZYPREXA IntraMuscular tegen licht, niet invriezen.
Op de markt gebracht door: Lilly USA, LLC, Indianapolis, IN 46285, VS. Herzien: okt 2019
BIJWERKINGEN
Raadpleeg bij gebruik van ZYPREXA 2,5 mg en fluoxetine in combinatie ook de rubriek Bijwerkingen van de bijsluiter van Symbyax.
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en kunnen de in de praktijk waargenomen percentages niet weerspiegelen of voorspellen.
Klinische onderzoeken bij volwassenen
De onderstaande informatie voor olanzapine is afgeleid van een database van klinische studies voor olanzapine bestaande uit 10.504 volwassen patiënten met ongeveer 4765 patiëntjaren blootstelling aan olanzapine plus 722 patiënten met blootstelling aan intramusculair olanzapine voor injectie. Deze database omvat: (1) 2500 patiënten die deelnamen aan premarketingonderzoeken met meervoudige doses oraal olanzapine bij schizofrenie en de ziekte van Alzheimer, wat neerkomt op ongeveer 1122 patiëntjaren van blootstelling op 14 februari 1995; (2) 182 patiënten die deelnamen aan orale olanzapine premarketing bipolaire I stoornis (manische of gemengde episodes) onderzoeken die ongeveer 66 patiëntjaren van blootstelling vertegenwoordigen; (3) 191 patiënten die deelnamen aan een orale olanzapine-studie bij patiënten met verschillende psychiatrische symptomen in verband met de ziekte van Alzheimer, wat neerkomt op een blootstelling van ongeveer 29 patiëntjaren; (4) 5788 extra patiënten uit 88 orale klinische onderzoeken met olanzapine op 31 december 2001; (5) 1843 extra patiënten uit 41 klinische onderzoeken met olanzapine op 31 oktober 2011; en (6) 722 patiënten die deelnamen aan premarketingonderzoeken met intramusculair olanzapine voor injectie bij geagiteerde patiënten met schizofrenie, bipolaire I-stoornis (manische of gemengde episodes) of dementie. Hieronder is ook informatie opgenomen uit de premarketingdatabase van 6 weken durende klinische studie voor olanzapine in combinatie met lithium of valproaat, bestaande uit 224 patiënten die deelnamen aan onderzoeken naar bipolaire I-stoornis (manische of gemengde episodes) met een blootstelling van ongeveer 22 patiëntjaren.
De omstandigheden en duur van de behandeling met olanzapine varieerden sterk en omvatten (in overlappende categorieën) open-label en dubbelblinde fasen van onderzoeken, klinische en poliklinische patiënten, onderzoeken met vaste doses en dosistitratie, en blootstelling op korte of langere termijn . Bijwerkingen werden beoordeeld door het verzamelen van bijwerkingen, resultaten van lichamelijk onderzoek, vitale functies, gewichten, laboratoriumanalyten, ECG's, thoraxfoto's en resultaten van oogheelkundig onderzoek.
Bepaalde delen van de onderstaande discussie met betrekking tot objectieve of numerieke veiligheidsparameters, namelijk dosisafhankelijke bijwerkingen, veranderingen in vitale functies, gewichtstoename, laboratoriumveranderingen en ECG-veranderingen zijn afgeleid van onderzoeken bij patiënten met schizofrenie en zijn niet gedupliceerd voor bipolaire I-stoornis (manische of gemengde episodes) of agitatie. Deze informatie is echter ook algemeen toepasbaar bij bipolaire I-stoornis (manische of gemengde episodes) en agitatie.
Bijwerkingen tijdens blootstelling werden verkregen door spontane melding en geregistreerd door klinische onderzoekers met gebruikmaking van zelfgekozen terminologie. Het is daarom niet mogelijk om een zinvolle schatting te geven van het aantal personen dat bijwerkingen ervaart zonder eerst vergelijkbare soorten reacties te groeperen in een kleiner aantal gestandaardiseerde reactiecategorieën. In de volgende tabellen en tabellen is MedDRA en COSTART Dictionary-terminologie gebruikt om gemelde bijwerkingen te classificeren.
De vermelde frequenties van bijwerkingen vertegenwoordigen het aantal personen dat ten minste één keer een tijdens de behandeling optredende bijwerking van het vermelde type heeft ervaren. Een reactie werd als opkomend tijdens de behandeling beschouwd als deze voor het eerst optrad of verergerde tijdens de behandeling na evaluatie van de baseline. De gerapporteerde reacties bevatten niet die reactietermen die zo algemeen waren dat ze weinig informatief waren. Reacties die elders in de etikettering worden vermeld, mogen hieronder niet worden herhaald. Het is belangrijk om te benadrukken dat, hoewel de reacties optraden tijdens de behandeling met olanzapine, ze niet noodzakelijkerwijs daardoor werden veroorzaakt. Het volledige etiket moet worden gelezen om een volledig begrip te krijgen van het veiligheidsprofiel van olanzapine.
De voorschrijver dient zich ervan bewust te zijn dat de cijfers in de tabellen en tabellen niet kunnen worden gebruikt om de incidentie van bijwerkingen in de loop van de normale medische praktijk te voorspellen wanneer de patiëntkenmerken en andere factoren verschillen van die welke in de klinische onderzoeken heersten. Evenzo kunnen de genoemde frequenties niet worden vergeleken met cijfers die zijn verkregen uit andere klinische onderzoeken met verschillende behandelingen, toepassingen en onderzoekers. De aangehaalde cijfers bieden de voorschrijvende zorgverlener echter enige basis voor het schatten van de relatieve bijdrage van medicamenteuze en niet-medicamenteuze factoren aan de incidentie van bijwerkingen in de onderzochte populatie.
Incidentie van bijwerkingen in kortdurende, placebogecontroleerde en combinatieonderzoeken
De volgende bevindingen zijn gebaseerd op premarketingonderzoeken met (1) orale olanzapine voor schizofrenie, bipolaire I-stoornis (manische of gemengde episodes), een daaropvolgend onderzoek bij patiënten met verschillende psychiatrische symptomen in verband met de ziekte van Alzheimer, en premarketingcombinatieonderzoeken, en (2 ) intramusculair olanzapine voor injectie bij geagiteerde patiënten met schizofrenie of bipolaire I-manie.
Bijwerkingen die verband houden met stopzetting van de behandeling in kortdurende, placebo-gecontroleerde onderzoeken
Schizofrenie
Over het algemeen was er geen verschil in de incidentie van stopzetting vanwege bijwerkingen (5% voor oraal olanzapine versus 6% voor placebo). Stopzettingen als gevolg van verhogingen van ALT werden echter als geneesmiddelgerelateerd beschouwd (2% voor oraal olanzapine versus 0% voor placebo).
Bipolaire I-stoornis (manische of gemengde episodes) Monotherapie
Over het algemeen was er geen verschil in de incidentie van stopzetting vanwege bijwerkingen (2% voor oraal olanzapine versus 2% voor placebo).
Agitatie
Over het algemeen was er geen verschil in de incidentie van stopzetting vanwege bijwerkingen (0,4% voor intramusculair olanzapine voor injectie versus 0% voor placebo).
Bijwerkingen die verband houden met stopzetting van de behandeling in combinatieonderzoeken op korte termijn
Bipolaire I-stoornis (manische of gemengde episodes), olanzapine als aanvulling op lithium of valproaat
In een onderzoek bij patiënten die al lithium of valproaat als monotherapie verdroegen, was het percentage stopzettingen vanwege bijwerkingen 11% voor de combinatie van oraal olanzapine met lithium of valproaat, vergeleken met 2% voor patiënten die lithium of valproaat als monotherapie bleven gebruiken. Stopzetting van de combinatie van oraal olanzapine en lithium of valproaat die bij meer dan 1 patiënt voorkwam, was: slaperigheid (3%), gewichtstoename (1%) en perifeer oedeem (1%).
Vaak waargenomen bijwerkingen in kortdurende, placebo-gecontroleerde onderzoeken
De vaakst waargenomen bijwerkingen die verband hielden met het gebruik van oraal olanzapine (incidentie van 5% of meer) en die niet met een equivalente incidentie werden waargenomen bij met placebo behandelde patiënten (incidentie van olanzapine ten minste tweemaal die voor placebo) waren:
Olanzapine Intramusculair
Er werd 1 bijwerking (slaperigheid) waargenomen met een incidentie van 5% of meer bij patiënten die met intramusculaire olanzapine voor injectie werden behandeld en niet met een equivalente incidentie onder met placebo behandelde patiënten (incidentie van olanzapine minstens tweemaal die voor placebo) tijdens de placebo-behandeling. -gecontroleerde premarketingstudies. De incidentie van slaperigheid tijdens de IM-behandelingsperiode van 24 uur in klinische onderzoeken bij geagiteerde patiënten met schizofrenie of bipolaire I-manie was 6% voor intramusculaire olanzapine voor injectie en 3% voor placebo.
Bijwerkingen die optreden bij een incidentie van 2% of meer bij orale olanzapine-behandelde patiënten in kortdurende, placebo-gecontroleerde onderzoeken
Tabel 11 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die voorkwamen bij 2% of meer van de patiënten die werden behandeld met oraal olanzapine (doses ≥2,5 mg/dag) en met een hogere incidentie dan placebo die deelnamen aan de acute fase van placebogecontroleerde onderzoeken.
Dosisafhankelijkheid van bijwerkingen
Er is een dosisgroepverschil waargenomen voor vermoeidheid, duizeligheid, gewichtstoename en verhoging van prolactine. In een enkele 8 weken durende, gerandomiseerde, dubbelblinde studie met vaste dosis waarin 10 (N=199), 20 (N=200) en 40 (N=200) mg oraal olanzapine werd vergeleken bij volwassen patiënten met schizofrenie of schizoaffectieve stoornis, incidentie van vermoeidheid (10 mg/dag: 1,5%; 20 mg/dag: 2,1%; 40 mg/dag: 6,6%) werd waargenomen met significante verschillen tussen 10 versus 40 en 20 versus 40 mg/dag. De incidentie van duizeligheid (10 mg/dag: 2,6%; 20 mg/dag: 1,6%; 40 mg/dag: 6,6%) werd waargenomen met significante verschillen tussen 20 en 40 mg. Verschillen in dosisgroepen werden ook opgemerkt voor gewichtstoename en verhoging van prolactine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De volgende tabel behandelt de dosisgerelateerdheid voor andere bijwerkingen op basis van gegevens uit een schizofrenieonderzoek met vaste doseringsbereiken van oraal olanzapine. Het somt het percentage patiënten op met tijdens de behandeling optredende bijwerkingen voor de 3 groepen met een vast dosisbereik en placebo. De gegevens werden geanalyseerd met behulp van de Cochran-Armitage-test, met uitzondering van de placebogroep, en de tabel bevat alleen die bijwerkingen waarvoor er een trend was.
Vaak waargenomen bijwerkingen bij kortdurende onderzoeken met oraal olanzapine als aanvulling op lithium of valproaat
In de aanvullende placebogecontroleerde onderzoeken met bipolaire I-stoornis (manische of gemengde episodes) waren de meest waargenomen bijwerkingen geassocieerd met de combinatie van olanzapine en lithium of valproaat (incidentie van ≥ 5% en ten minste tweemaal placebo):
Bijwerkingen die optreden bij een incidentie van 2% of meer bij oraal met olanzapine behandelde patiënten in kortdurende onderzoeken met olanzapine als aanvulling op lithium of valproaat
Tabel 14 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die voorkwamen bij 2% of meer van de patiënten die werden behandeld met de combinatie van olanzapine (doses ≥ 5 mg/dag) en lithium of valproaat en met een incidentie groter dan alleen lithium of valproaat die hebben deelgenomen aan de acute fase van placebogecontroleerde combinatieonderzoeken.
Voor specifieke informatie over de bijwerkingen die zijn waargenomen met lithium of valproaat, zie de rubriek Bijwerkingen van de bijsluiters van deze andere producten.
Bijwerkingen die optreden bij een incidentie van 1% of meer bij intramusculaire olanzapine voor met injectie behandelde patiënten in kortdurende, placebo-gecontroleerde onderzoeken
Tabel 15 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die voorkwamen bij 1% of meer van de patiënten die werden behandeld met intramusculair olanzapine voor injectie (dosisbereik van 2,5-10 mg/injectie) en met een incidentie hoger dan bij placebo die deelnamen aan de kortdurende, placebogecontroleerde onderzoeken bij geagiteerde patiënten met schizofrenie of bipolaire I-manie.
Extrapiramidale symptomen
De volgende tabel somt het percentage patiënten op met tijdens de behandeling optredende extrapiramidale symptomen zoals beoordeeld door categorische analyses van formele beoordelingsschalen tijdens acute therapie in een gecontroleerd klinisch onderzoek waarin oraal olanzapine in 3 vaste doses werd vergeleken met placebo bij de behandeling van schizofrenie in een 6 weken durende proces.
De volgende tabel somt het percentage patiënten op met tijdens de behandeling optredende extrapiramidale symptomen zoals beoordeeld aan de hand van spontaan gemelde bijwerkingen tijdens acute therapie in hetzelfde gecontroleerde klinische onderzoek waarin olanzapine in 3 vaste doses werd vergeleken met placebo bij de behandeling van schizofrenie in een onderzoek van 6 weken.
De volgende tabel geeft een overzicht van het percentage adolescente patiënten met tijdens de behandeling optredende extrapiramidale symptomen, zoals beoordeeld aan de hand van spontaan gemelde bijwerkingen tijdens acute therapie (dosisbereik: 2,5 tot 20 mg/dag).
De volgende tabel somt het percentage patiënten op met tijdens de behandeling optredende extrapiramidale symptomen zoals beoordeeld door categorische analyses van formele beoordelingsschalen tijdens gecontroleerde klinische onderzoeken waarin vaste doses intramusculair olanzapine voor injectie werden vergeleken met placebo bij agitatie. Patiënten in elke dosisgroep konden tijdens de onderzoeken maximaal 3 injecties krijgen [zie Klinische studies ]. Patiëntbeoordelingen werden uitgevoerd gedurende de 24 uur na de aanvangsdosis van intramusculair olanzapine voor injectie.
De volgende tabel somt het percentage patiënten op met tijdens de behandeling optredende extrapiramidale symptomen zoals beoordeeld aan de hand van spontaan gemelde bijwerkingen in hetzelfde gecontroleerde klinische onderzoek waarin vaste doses intramusculair olanzapine voor injectie werden vergeleken met placebo bij geagiteerde patiënten met schizofrenie.
Dystonie, klasse-effect
Symptomen van dystonie, langdurige abnormale samentrekkingen van spiergroepen, kunnen optreden bij gevoelige personen tijdens de eerste paar dagen van de behandeling. Dystonische symptomen zijn onder meer: spasmen van de nekspieren, soms overgaand in een beklemmend gevoel in de keel, moeite met slikken, ademhalingsmoeilijkheden en/of uitpuilende tong. Hoewel deze symptomen kunnen optreden bij lage doses, zijn de frequentie en ernst groter bij een hoge potentie en bij hogere doses van antipsychotica van de eerste generatie. Over het algemeen kan een verhoogd risico op acute dystonie worden waargenomen bij mannen en jongere leeftijdsgroepen die antipsychotica krijgen; bij gebruik van olanzapine zijn echter zelden (
Andere bijwerkingen
Andere bijwerkingen waargenomen tijdens de klinische studie Evaluatie van oraal olanzapine
Hieronder volgt een lijst van tijdens de behandeling optredende bijwerkingen die zijn gemeld door patiënten die in klinische onderzoeken werden behandeld met oraal olanzapine (in meervoudige doses ≥ 1 mg/dag). Deze lijst is niet bedoeld om reacties op te nemen (1) die al in eerdere tabellen of elders in de etikettering zijn vermeld, (2) waarvoor de oorzaak van het medicijn ver weg was, (3) die zo algemeen waren dat ze niet informatief waren, (4) die niet geacht worden significante klinische implicaties te hebben, of (5) die optraden met een snelheid gelijk aan of lager dan die van placebo. Reacties worden geclassificeerd per lichaamssysteem met behulp van de volgende definities: frequente bijwerkingen zijn bijwerkingen die optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij 1/100 tot 1/1000 patiënten; zeldzame reacties zijn reacties die voorkomen bij minder dan 1/1000 patiënten.
Lichaam als geheel - Onregelmatig: koude rillingen, gezichtsoedeem, fotosensibiliteitsreactie, zelfmoordpoging1; Zelden: koude rillingen en koorts, katereffect, plotselinge dood1.
Cardiovasculair systeem - Zelden: cerebrovasculair accident, vasodilatatie.
Spijsverteringsstelsel - Onregelmatig: opgezette buik, misselijkheid en braken, tongoedeem; Zelden: ileus, darmobstructie, levervetafzetting.
Hemic en lymfatisch systeem - Zelden: trombocytopenie.
Metabole en voedingsstoornissen - Frequent: alkalische fosfatase verhoogd; Onregelmatig: bilirubinemie, hypoproteïnemie.
Musculoskeletaal systeem - Zelden: osteoporose.
Zenuwstelsel - Onregelmatig: ataxie, dysartrie, verminderd libido, verdoving; Zelden: coma.
Ademhalingssysteem - Onregelmatig: epistaxis; Zelden: longoedeem.
Huid en aanhangsels - Zelden: alopecia.
Speciale zintuigen - Onregelmatig: afwijking van de accommodatie, droge ogen; Zelden: mydriasis.
Urogenitaal systeem - Onregelmatig: amenorroe2, pijn in de borst, verminderde menstruatie, impotentie2, verhoogde menstruatie2, menorragie2, metrorragie2, polyurie2, urinaire frequentie, urineretentie, urinaire urgentie, verminderd urineren.
1 Deze termen vertegenwoordigen ernstige bijwerkingen, maar voldoen niet aan de definitie voor bijwerkingen van geneesmiddelen. Ze zijn hier opgenomen vanwege hun ernst. 2 Gecorrigeerd voor geslacht.
Andere bijwerkingen waargenomen tijdens de klinische studie Evaluatie van intramusculair olanzapine voor injectie
Hieronder volgt een lijst van tijdens de behandeling optredende bijwerkingen die zijn gemeld door patiënten die in klinische onderzoeken werden behandeld met intramusculair olanzapine voor injectie (in 1 of meer doses ≥2,5 mg/injectie). Deze lijst is niet bedoeld om reacties op te nemen (1) die al in eerdere tabellen of elders in de etikettering zijn vermeld, (2) waarvoor de oorzaak van het medicijn ver weg was, (3) die zo algemeen waren dat ze niet informatief waren, (4) die niet waarvan wordt aangenomen dat het significante klinische implicaties heeft, of (5) waarvoor het optrad met een snelheid gelijk aan of lager dan die van placebo. Reacties worden geclassificeerd per lichaamssysteem met behulp van de volgende definities: frequente bijwerkingen zijn bijwerkingen die optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij 1/100 tot 1/1000 patiënten.
Lichaam als geheel - Vaak: pijn op de injectieplaats.
Cardiovasculair systeem - Onregelmatig: syncope.
Spijsverteringsstelsel - Zelden: misselijkheid.
Metabole en voedingsstoornissen - Onregelmatig: creatinefosfokinase verhoogd.
Klinische onderzoeken bij adolescente patiënten (leeftijd 13 tot 17 jaar)
Vaak waargenomen bijwerkingen bij orale olanzapine kortdurende, placebo-gecontroleerde onderzoeken
Bijwerkingen bij adolescente patiënten die werden behandeld met orale olanzapine (doses ≥2,5 mg) die werden gemeld met een incidentie van 5% of meer en die minstens tweemaal zo vaak werden gemeld als de met placebo behandelde patiënten, staan vermeld in Tabel 21.
Bijwerkingen die optreden bij een incidentie van 2% of meer bij oraal met olanzapine behandelde patiënten op korte termijn (3-6 weken), placebogecontroleerde onderzoeken
Bijwerkingen bij adolescente patiënten die werden behandeld met orale olanzapine (doses ≥2,5 mg) die werden gemeld met een incidentie van 2% of meer en meer dan placebo, staan vermeld in tabel 22.
Vitale functies en laboratoriumonderzoek
Veranderingen in vitale functies
Oraal olanzapine werd in klinische onderzoeken in verband gebracht met orthostatische hypotensie en tachycardie. Intramusculair olanzapine voor injectie werd in klinische onderzoeken in verband gebracht met bradycardie, hypotensie en tachycardie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Laboratoriumveranderingen
Olanzapine-monotherapie bij volwassenen
Een beoordeling van de premarketingervaring met olanzapine bracht een verband aan het licht met asymptomatische verhogingen van ALT, AST en GGT. Binnen de oorspronkelijke premarketingdatabase van ongeveer 2400 volwassen patiënten met een uitgangswaarde van ALAT ≤90 IE/l, was de incidentie van ALAT-verhogingen tot >200 IE/l 2% (50/2381). Geen van deze patiënten had geelzucht of andere symptomen die toe te schrijven zijn aan leverinsufficiëntie en de meeste hadden voorbijgaande veranderingen die de neiging hadden om te normaliseren terwijl de behandeling met olanzapine werd voortgezet.
In placebogecontroleerde onderzoeken met olanzapine als monotherapie bij volwassenen werden klinisch significante ALAT-verhogingen (verandering van
Uit een analyse van de laboratoriumgegevens in een geïntegreerde database van 41 voltooide klinische onderzoeken bij volwassen patiënten die werden behandeld met oraal olanzapine, werden hoge GGT-spiegels geregistreerd bij ≥1% (88/5245) van de patiënten.
Voorzichtigheid is geboden bij patiënten met tekenen en symptomen van leverinsufficiëntie, bij patiënten met reeds bestaande aandoeningen die gepaard gaan met een beperkte leverfunctiereserve, en bij patiënten die worden behandeld met mogelijk hepatotoxische geneesmiddelen.
Toediening van olanzapine ging ook gepaard met verhogingen van serumprolactine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], met een asymptomatische verhoging van het aantal eosinofielen bij 0,3% van de patiënten en met een verhoging van CPK.
Uit een analyse van de laboratoriumgegevens in een geïntegreerde database van 41 voltooide klinische onderzoeken bij volwassen patiënten die werden behandeld met oraal olanzapine, werd bij ≥3% (171/4641) van de patiënten een verhoogd urinezuur vastgesteld.
Olanzapine-monotherapie bij adolescenten
In placebogecontroleerde klinische onderzoeken bij adolescente patiënten met schizofrenie of bipolaire I-stoornis (manische of gemengde episodes), werden hogere frequenties voor de volgende tijdens de behandeling optredende bevindingen, op elk moment, waargenomen in laboratoriumanalyten in vergelijking met placebo: verhoogde ALAT (≥3X ULN) bij patiënten met ALT bij baseline
In placebogecontroleerde onderzoeken naar monotherapie met olanzapine bij adolescenten werden klinisch significante ALAT-verhogingen (verandering van
ECG-wijzigingen
In gepoolde onderzoeken bij volwassenen en gepoolde onderzoeken bij adolescenten waren er geen significante verschillen tussen olanzapine en placebo in het aantal patiënten dat mogelijk belangrijke veranderingen in ECG-parameters ervoer, waaronder QT-, QTc- (Fridericia-gecorrigeerd) en PR-intervallen. Het gebruik van olanzapine ging gepaard met een gemiddelde verhoging van de hartslag in vergelijking met placebo (volwassenen: +2,4 slagen per minuut versus geen verandering met placebo; adolescenten: +6,3 slagen per minuut versus -5,1 slagen per minuut met placebo). Deze verhoging van de hartslag kan verband houden met het potentieel van olanzapine om orthostatische veranderingen te induceren [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van ZYPREXA na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het moeilijk om hun frequentie betrouwbaar in te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen te evalueren.
Bijwerkingen die sinds de introductie op de markt zijn gemeld en die tijdelijk (maar niet noodzakelijk causaal) verband hielden met de behandeling met ZYPREXA, omvatten de volgende: allergische reactie (bijv. anafylactoïde reactie, angio-oedeem, pruritus of urticaria), cholestatische of gemengde leverbeschadiging, diabetisch coma, diabetische ketoacidose, stopzettingsreactie (diaforese, misselijkheid of braken), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS), hepatitis, geelzucht, neutropenie, pancreatitis, priapisme, huiduitslag, rustelozebenensyndroom, rabdomyolyse, stotteren1 en veneuze trombo-embolische voorvallen (waaronder longembolie en diepe veneuze trombose). Willekeurige cholesterolwaarden van ≥240 mg/dL en willekeurige triglyceridenwaarden van ≥1000 mg/dL zijn gemeld.
1 Stotteren werd alleen bestudeerd in orale en langwerkende injectie (LAI) formuleringen.
DRUG-INTERACTIES
De risico's van het gebruik van olanzapine in combinatie met andere geneesmiddelen zijn niet uitgebreid geëvalueerd in systematische onderzoeken.
Potentieel voor andere geneesmiddelen die olanzapine kunnen beïnvloeden
diazepam
Gelijktijdige toediening van diazepam met olanzapine versterkte de orthostatische hypotensie die werd waargenomen bij olanzapine.
Cimetidine en antacida
Enkelvoudige doses cimetidine (800 mg) of aluminium- en magnesiumbevattende antacida hadden geen invloed op de orale biologische beschikbaarheid van olanzapine.
Inductoren van CYP1A2
Behandeling met carbamazepine (200 mg tweemaal daags) veroorzaakt een toename van ongeveer 50% in de klaring van olanzapine. Deze toename is waarschijnlijk te wijten aan het feit dat carbamazepine een krachtige inductor van CYP1A2-activiteit is. Hogere dagelijkse doses carbamazepine kunnen een nog grotere toename van de olanzapineklaring veroorzaken.
Alcohol
Ethanol (45 mg/70 kg enkele dosis) had geen effect op de farmacokinetiek van olanzapine. Gelijktijdige toediening van alcohol (dwz ethanol) met olanzapine versterkte de orthostatische hypotensie die werd waargenomen bij olanzapine (zie DRUG-INTERACTIES ].
Remmers van CYP1A2
Fluvoxamine
Fluvoxamine, een CYP1A2-remmer, vermindert de klaring van olanzapine. Dit resulteert in een gemiddelde verhoging van de Cmax van olanzapine na fluvoxamine van 54% bij vrouwelijke niet-rokers en 77% bij mannelijke rokers. De gemiddelde toename van de AUC van olanzapine is respectievelijk 52% en 108%. Bij patiënten die gelijktijdig met fluvoxamine worden behandeld, dienen lagere doses olanzapine te worden overwogen.
Remmers van CYP2D6
Fluoxetine
Fluoxetine (60 mg enkelvoudige dosis of 60 mg dagelijkse dosis gedurende 8 dagen) veroorzaakt een kleine (gemiddeld 16%) stijging van de maximale concentratie van olanzapine en een kleine (gemiddeld 16%) daling van de olanzapineklaring. De omvang van de impact van deze factor is klein in vergelijking met de algemene variabiliteit tussen individuen, en daarom wordt dosisaanpassing niet routinematig aanbevolen. Raadpleeg bij gebruik van ZYPREXA en fluoxetine in combinatie ook de rubriek Geneesmiddelinteracties van de bijsluiter voor Symbyax.
Warfarine
Warfarine (20 mg enkele dosis) had geen invloed op de farmacokinetiek van olanzapine.
Inductoren van CYP1A2 of glucuronyltransferase
Omeprazol en rifampicine kunnen de klaring van olanzapine verhogen.
Houtskool
De toediening van actieve kool (1 g) verminderde de Cmax en AUC van oraal olanzapine met ongeveer 60%. Aangezien de piekconcentraties van olanzapine doorgaans niet worden bereikt tot ongeveer 6 uur na toediening, kan houtskool een nuttige behandeling zijn voor een overdosis olanzapine.
Potentieel voor olanzapine om andere geneesmiddelen te beïnvloeden
CZS-werkende medicijnen
Gezien de primaire effecten van olanzapine op het centrale zenuwstelsel, is voorzichtigheid geboden wanneer olanzapine wordt gebruikt in combinatie met andere centraal werkende geneesmiddelen en alcohol.
Antihypertensiva
Olanzapine kan, vanwege zijn potentieel om hypotensie te induceren, de effecten van bepaalde antihypertensiva versterken.
Levodopa en dopamine-agonisten
Olanzapine kan de effecten van levodopa en dopamine-agonisten tegenwerken.
Lorazepam (IM)
Toediening van intramusculair lorazepam (2 mg) 1 uur na intramusculair olanzapine voor injectie (5 mg) had geen significante invloed op de farmacokinetiek van olanzapine, ongeconjugeerd lorazepam of totaal lorazepam. Deze gelijktijdige toediening van intramusculair lorazepam en intramusculair olanzapine voor injectie droeg echter bij aan de slaperigheid die werd waargenomen met elk geneesmiddel alleen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Lithium
Meerdere doses olanzapine (10 mg gedurende 8 dagen) hadden geen invloed op de kinetiek van lithium. Daarom is bij gelijktijdige toediening van olanzapine geen dosisaanpassing van lithium nodig [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Valproaat
Olanzapine (10 mg per dag gedurende 2 weken) had geen invloed op de steady-state plasmaconcentraties van valproaat. Daarom is voor gelijktijdige toediening van olanzapine geen dosisaanpassing van valproaat nodig (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Effect van olanzapine op enzymen die geneesmiddelen metaboliseren
In vitro-onderzoeken met humane levermicrosomen suggereren dat olanzapine weinig potentieel heeft om CYP1A2, CYP2C9, CYP2C19, CYP2D6 en CYP3A te remmen. Het is dus onwaarschijnlijk dat olanzapine klinisch belangrijke geneesmiddelinteracties veroorzaakt die door deze enzymen worden gemedieerd.
imipramine
Enkelvoudige doses olanzapine hadden geen invloed op de farmacokinetiek van imipramine of zijn actieve metaboliet desipramine.
Warfarine
Enkelvoudige doses olanzapine hadden geen invloed op de farmacokinetiek van warfarine.
diazepam
Olanzapine had geen invloed op de farmacokinetiek van diazepam of zijn actieve metaboliet Ndesmethyldiazepam. Diazepam, gelijktijdig toegediend met olanzapine, verhoogde echter de orthostatische hypotensie die werd waargenomen met elk van beide geneesmiddelen afzonderlijk.
Alcohol
Meerdere doses olanzapine hadden geen invloed op de kinetiek van ethanol.
biperiden
Meerdere doses olanzapine hadden geen invloed op de kinetiek van biperideen.
theofylline
Meerdere doses olanzapine hadden geen invloed op de farmacokinetiek van theofylline of zijn metabolieten.
Drugsmisbruik en afhankelijkheid
Afhankelijkheid
In onderzoeken die prospectief waren opgezet om het potentieel van misbruik en afhankelijkheid te beoordelen, bleek olanzapine acute depressieve effecten op het centrale zenuwstelsel te hebben, maar weinig of geen potentieel voor misbruik of fysieke afhankelijkheid bij ratten die orale doses kregen tot 15 maal de dagelijkse orale MRHD (20 mg) en bij resusapen orale doses toegediend tot 8 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak.
Olanzapine is niet systematisch onderzocht bij mensen vanwege het potentieel voor misbruik, tolerantie of lichamelijke afhankelijkheid. Hoewel de klinische onderzoeken geen tendens tot het zoeken naar drugs aan het licht brachten, waren deze waarnemingen niet systematisch, en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in hoeverre een geneesmiddel dat op het centrale zenuwstelsel werkt, misbruikt, afgeleid zal worden. , en/of misbruikt zodra het op de markt is gebracht. Daarom moeten patiënten zorgvuldig worden beoordeeld op een voorgeschiedenis van drugsmisbruik en dergelijke patiënten moeten nauwlettend worden geobserveerd op tekenen van verkeerd gebruik of misbruik van olanzapine (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar geneesmiddelen).
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Raadpleeg bij gebruik van ZYPREXA 7,5 mg en fluoxetine in combinatie ook het gedeelte Waarschuwingen en voorzorgsmaatregelen van de bijsluiter voor Symbyax.
Oudere patiënten met aan dementie gerelateerde psychose
Verhoogde sterfte
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. ZYPREXA 20 mg is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose (zie OMKADERDE WAARSCHUWING, Gebruik bij patiënten met gelijktijdige ziekte en PATINTINFORMATIE).
In placebogecontroleerde klinische onderzoeken bij oudere patiënten met aan dementie gerelateerde psychose was de incidentie van overlijden bij met olanzapine behandelde patiënten significant hoger dan bij met placebo behandelde patiënten (respectievelijk 3,5 % versus 1,5 %).
Cerebrovasculaire bijwerkingen (CVAE), inclusief beroerte
Cerebrovasculaire bijwerkingen (bijv. beroerte, voorbijgaande ischemische aanval), inclusief dodelijke afloop, werden gemeld bij patiënten in onderzoeken met olanzapine bij oudere patiënten met aan dementie gerelateerde psychose. In placebogecontroleerde onderzoeken was er een significant hogere incidentie van cerebrovasculaire bijwerkingen bij patiënten die werden behandeld met olanzapine in vergelijking met patiënten die werden behandeld met placebo. Olanzapine is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: en PATIËNT INFORMATIE ].
Zelfmoord
De mogelijkheid van een zelfmoordpoging is inherent aan schizofrenie en bipolaire I-stoornis, en nauw toezicht op patiënten met een hoog risico moet de medicamenteuze behandeling vergezellen. Voorschriften voor olanzapine moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met een goede behandeling van de patiënt, om het risico op overdosering te verminderen.
Maligne neurolepticasyndroom (NMS)
Een potentieel fataal symptoomcomplex dat soms wordt aangeduid als maligne neurolepticasyndroom (MNS), is gemeld in verband met de toediening van antipsychotica, waaronder olanzapine. Klinische manifestaties van MNS zijn hyperpyrexie, spierstijfheid, veranderde mentale toestand en tekenen van autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen). Bijkomende symptomen kunnen zijn: verhoogde creatininefosfokinase, myoglobinurie (rabdomyolyse) en acuut nierfalen.
De diagnostische evaluatie van patiënten met dit syndroom is gecompliceerd. Om tot een diagnose te komen, is het belangrijk gevallen uit te sluiten waarin de klinische presentatie zowel een ernstige medische aandoening (bijv. longontsteking, systemische infectie, enz.) als onbehandelde of onvoldoende behandelde extrapiramidale tekenen en symptomen (EPS) omvat. Andere belangrijke overwegingen bij de differentiële diagnose zijn centrale anticholinerge toxiciteit, hitteberoerte, medicijnkoorts en primaire pathologie van het centrale zenuwstelsel.
De behandeling van MNS moet het volgende omvatten: 1) onmiddellijke stopzetting van antipsychotica en andere geneesmiddelen die niet essentieel zijn voor gelijktijdige therapie; 2) intensieve symptomatische behandeling en medische monitoring; en 3) behandeling van eventuele bijkomende ernstige medische problemen waarvoor specifieke behandelingen beschikbaar zijn. Er is geen algemene overeenstemming over specifieke farmacologische behandelingsregimes voor NMS.
Als een patiënt behandeling met antipsychotica nodig heeft na herstel van MNS, moet de mogelijke herintroductie van medicamenteuze therapie zorgvuldig worden overwogen. De patiënt moet zorgvuldig worden gecontroleerd, aangezien recidieven van MNS zijn gemeld [zie: PATIËNT INFORMATIE ].
Geneesmiddelreactie met eosinofilie en systemische symptomen (JURK)
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) is gemeld bij blootstelling aan olanzapine. DRESS kan zich presenteren met een huidreactie (zoals uitslag of exfoliatieve dermatitis), eosinofilie, koorts en/of lymfadenopathie met systemische complicaties zoals hepatitis, nefritis, pneumonitis, myocarditis en/of pericarditis. DRESS is soms dodelijk. Stop met olanzapine als DRESS wordt vermoed [zie PATIËNT INFORMATIE ].
Metabolische veranderingen
Atypische antipsychotica zijn in verband gebracht met metabole veranderingen, waaronder hyperglykemie, dyslipidemie en gewichtstoename. Metabole veranderingen kunnen in verband worden gebracht met een verhoogd cardiovasculair/cerebrovasculair risico. Het specifieke metabolische profiel van olanzapine wordt hieronder weergegeven.
Hyperglykemie en diabetes mellitus
Zorgverleners dienen de risico's en voordelen in overweging te nemen bij het voorschrijven van olanzapine aan patiënten met een vastgestelde diagnose van diabetes mellitus, of met een borderline verhoogde bloedglucosespiegel (nuchter 100-126 mg/dL, niet-nuchter 140-200 mg/dL). Patiënten die olanzapine gebruiken, moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten die met de behandeling met olanzapine beginnen, moeten aan het begin van de behandeling en periodiek tijdens de behandeling een nuchtere bloedglucosetest ondergaan. Elke patiënt die met atypische antipsychotica wordt behandeld, moet worden gecontroleerd op symptomen van hyperglykemie, waaronder polydipsie, polyurie, polyfagie en zwakte. Patiënten die symptomen van hyperglykemie ontwikkelen tijdens behandeling met atypische antipsychotica, moeten een nuchtere bloedglucosetest ondergaan. In sommige gevallen is de hyperglykemie verdwenen toen het atypische antipsychoticum werd stopgezet; sommige patiënten hadden echter voortzetting van de antidiabetische behandeling nodig, ondanks stopzetting van het verdachte medicijn [zie: PATIËNT INFORMATIE ].
Hyperglykemie, in sommige gevallen extreem en geassocieerd met ketoacidose of hyperosmolair coma of overlijden, is gemeld bij patiënten die werden behandeld met atypische antipsychotica, waaronder olanzapine. De beoordeling van de relatie tussen atypisch antipsychoticagebruik en glucoseafwijkingen wordt bemoeilijkt door de mogelijkheid van een verhoogd achtergrondrisico op diabetes mellitus bij patiënten met schizofrenie en de toenemende incidentie van diabetes mellitus in de algemene bevolking. Epidemiologische onderzoeken wijzen op een verhoogd risico op tijdens de behandeling optredende hyperglykemiegerelateerde bijwerkingen bij patiënten die worden behandeld met de atypische antipsychotica. Hoewel de relatieve risicoschattingen inconsistent zijn, lijkt het verband tussen atypische antipsychotica en verhogingen van glucosespiegels continu te verlopen en lijkt olanzapine een groter verband te hebben dan sommige andere atypische antipsychotica.
Gemiddelde verhogingen van de bloedglucose zijn waargenomen bij patiënten die werden behandeld (mediane blootstelling van 9,2 maanden) met olanzapine in fase 1 van de Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE). De gemiddelde toename van serumglucose (nuchtere en niet-nuchtere monsters) vanaf baseline tot het gemiddelde van de 2 hoogste serumconcentraties was 15,0 mg/dL.
In een onderzoek met gezonde vrijwilligers hadden proefpersonen die gedurende 3 weken olanzapine (N=22) kregen, een gemiddelde verhoging van 2,3 mg/dl in nuchtere bloedglucose vergeleken met de uitgangswaarde. Met placebo behandelde proefpersonen (N=19) hadden een gemiddelde verhoging van de nuchtere bloedglucose vergeleken met de uitgangswaarde van 0,34 mg/dL.
Olanzapine-monotherapie bij volwassenen
In een analyse van 5 placebogecontroleerde onderzoeken met olanzapine als monotherapie bij volwassenen met een mediane behandelingsduur van ongeveer 3 weken, werd olanzapine geassocieerd met een grotere gemiddelde verandering in nuchtere glucosespiegels in vergelijking met placebo (2,76 mg/dl versus 0,17 mg/dl). Het verschil in gemiddelde veranderingen tussen olanzapine en placebo was groter bij patiënten met tekenen van glucosedysregulatie bij aanvang (patiënten met diabetes mellitus of gerelateerde bijwerkingen, patiënten behandeld met antidiabetica, patiënten met een willekeurige glucosespiegel ≥200 mg/ dL, en/of een nuchtere glucosespiegel ≥126 mg/dL). Met olanzapine behandelde patiënten hadden een grotere gemiddelde HbA1c-stijging vanaf baseline van 0,04% (mediane blootstelling 21 dagen), vergeleken met een gemiddelde HbA1c-daling van 0,06% bij met placebo behandelde proefpersonen (mediane blootstelling 17 dagen).
In een analyse van 8 placebogecontroleerde onderzoeken (mediane behandelingsblootstelling 4-5 weken), had 6,1% van de met olanzapine behandelde proefpersonen (N=855) tijdens de behandeling optredende glycosurie vergeleken met 2,8% van de met placebo behandelde proefpersonen (N=599) . Tabel 2 toont veranderingen op korte en lange termijn in nuchtere glucosespiegels uit onderzoeken met olanzapine als monotherapie bij volwassenen.
De gemiddelde verandering in nuchtere glucose voor patiënten die ten minste 48 weken waren blootgesteld, was 4,2 mg/dL (N=487). In analyses van patiënten die 9-12 maanden behandeling met olanzapine hadden voltooid, bleef de gemiddelde verandering in nuchtere en niet-nuchtere glucosespiegels in de loop van de tijd toenemen.
Olanzapine-monotherapie bij adolescenten
De veiligheid en werkzaamheid van olanzapine zijn niet vastgesteld bij patiënten jonger dan 13 jaar. In een analyse van 3 placebogecontroleerde onderzoeken met olanzapine als monotherapie bij adolescente patiënten, waaronder die met schizofrenie (6 weken) of bipolaire I-stoornis (manische of gemengde episodes) (3 weken), werd olanzapine in verband gebracht met een grotere gemiddelde verandering ten opzichte van baseline in vasten. glucosespiegels vergeleken met placebo (2,68 mg/dL versus -2,59 mg/dL). De gemiddelde verandering in nuchtere glucose voor adolescenten die ten minste 24 weken waren blootgesteld, was 3,1 mg/dl (N=121). Tabel 3 toont veranderingen op korte en lange termijn in nuchtere bloedglucose uit onderzoeken met olanzapine als monotherapie bij adolescenten.
dyslipidemie
Bij gebruik van olanzapine zijn ongewenste veranderingen in lipiden waargenomen. Klinische monitoring, inclusief baseline en periodieke follow-up lipide-evaluaties bij patiënten die olanzapine gebruiken, wordt aanbevolen [zie: PATIËNT INFORMATIE ].
Klinisch significante, en soms zeer hoge (>500 mg/dl), verhogingen van triglyceridenspiegels zijn waargenomen bij gebruik van olanzapine. Er zijn ook bescheiden gemiddelde verhogingen van het totale cholesterol waargenomen bij gebruik van olanzapine.
Olanzapine-monotherapie bij volwassenen
In een analyse van 5 placebogecontroleerde onderzoeken naar olanzapine als monotherapie met een behandelingsduur tot 12 weken, vertoonden de met olanzapine behandelde patiënten een toename van 5,3 mg/dl, 3,0 mg/dl en triglyceriden ten opzichte van de uitgangswaarde. respectievelijk 20,8 mg/dL vergeleken met verlagingen vanaf baseline van gemiddeld nuchter totaal cholesterol, LDL-cholesterol en triglyceriden van 6,1 mg/dL, 4,3 mg/dL en 10,7 mg/dL voor met placebo behandelde patiënten. Voor nuchtere HDL-cholesterol werden geen klinisch betekenisvolle verschillen waargenomen tussen met olanzapine behandelde patiënten en met placebo behandelde patiënten. De gemiddelde verhogingen in nuchtere lipidenwaarden (totaal cholesterol, LDL-cholesterol en triglyceriden) waren groter bij patiënten zonder bewijs van lipidedisregulatie bij baseline, waarbij lipidedisregulatie werd gedefinieerd als patiënten met de diagnose dyslipidemie of gerelateerde bijwerkingen, patiënten behandeld met lipideverlagende middelen, of patiënten met hoge baseline lipideniveaus.
In langetermijnstudies (ten minste 48 weken) hadden patiënten vanaf baseline een toename van het gemiddelde nuchtere totaal cholesterol, LDL-cholesterol en triglyceriden van respectievelijk 5,6 mg/dl, 2,5 mg/dl en 18,7 mg/dl, en een gemiddelde afname van nuchter HDL-cholesterol van 0,16 mg/dL. In een analyse van patiënten die 12 maanden therapie hadden voltooid, nam het gemiddelde niet-nuchtere totale cholesterol na ongeveer 4-6 maanden niet verder toe.
Het percentage patiënten dat veranderingen (ten minste eenmaal) had in totaal cholesterol, LDL-cholesterol of triglyceriden van normaal of borderline naar hoog, of veranderingen in HDL-cholesterol van normaal of borderline naar laag, was groter in langetermijnstudies (ten minste 48 weken) in vergelijking met kortetermijnstudies. Tabel 4 toont categorische veranderingen in nuchtere lipidenwaarden.
In fase 1 van de Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE), over een mediane blootstelling van 9,2 maanden, was de gemiddelde toename van triglyceriden bij patiënten die olanzapine gebruikten 40,5 mg/dL. In fase 1 van CATIE was de gemiddelde toename van het totale cholesterol 9,4 mg/dL.
Olanzapine-monotherapie bij adolescenten
De veiligheid en werkzaamheid van olanzapine zijn niet vastgesteld bij patiënten jonger dan 13 jaar. In een analyse van 3 placebogecontroleerde onderzoeken met olanzapine als monotherapie bij adolescenten, waaronder die met schizofrenie (6 weken) of bipolaire I-stoornis (manische of gemengde episodes) (3 weken), vertoonden met olanzapine behandelde adolescenten een stijging vanaf baseline van het gemiddelde nuchtere totale cholesterol, LDL cholesterol en triglyceriden van respectievelijk 12,9 mg/dL, 6,5 mg/dL en 28,4 mg/dL, vergeleken met stijgingen vanaf baseline van gemiddeld nuchter totaal cholesterol en LDL-cholesterol van 1,3 mg/dL en 1,0 mg/dL, en een afname in triglyceriden van 1,1 mg/dL voor met placebo behandelde adolescenten. Voor nuchtere HDL-cholesterol werden geen klinisch relevante verschillen waargenomen tussen met olanzapine behandelde adolescenten en met placebo behandelde adolescenten.
In langetermijnstudies (ten minste 24 weken) hadden adolescenten een stijging ten opzichte van baseline in gemiddeld nuchter totaal cholesterol, LDL-cholesterol en triglyceriden van respectievelijk 5,5 mg/dL, 5,4 mg/dL en 20,5 mg/dL en een gemiddelde afname van nuchter HDL-cholesterol van 4,5 mg/dL. Tabel 5 toont categorische veranderingen in nuchtere lipidenwaarden bij adolescenten.
Gewichtstoename
Mogelijke gevolgen van gewichtstoename moeten worden overwogen voordat met olanzapine wordt gestart. Patiënten die olanzapine krijgen, dienen regelmatig hun gewicht te controleren [zie: Informatie over patiëntbegeleiding ].
Olanzapine-monotherapie bij volwassenen
In een analyse van 13 placebogecontroleerde onderzoeken met olanzapine als monotherapie, wonnen de met olanzapine behandelde patiënten gemiddeld 2,6 kg (5,7 lb) vergeleken met een gemiddeld 0,3 kg (0,6 lb) gewichtsverlies bij met placebo behandelde patiënten met een mediane blootstelling van 6 weken. ; 22,2% van de met olanzapine behandelde patiënten won ten minste 7% van hun basisgewicht, vergeleken met 3% van de met placebo behandelde patiënten, met een mediane blootstelling aan het voorval van 8 weken; 4,2% van de met olanzapine behandelde patiënten won ten minste 15% van hun uitgangsgewicht, vergeleken met 0,3% van de met placebo behandelde patiënten, met een mediane blootstelling aan het voorval van 12 weken. Klinisch significante gewichtstoename werd waargenomen in alle baseline Body Mass Index (BMI)-categorieën. Stopzetting vanwege gewichtstoename kwam voor bij 0,2% van de met olanzapine behandelde patiënten en bij 0% van de met placebo behandelde patiënten.
In langetermijnstudies (ten minste 48 weken) was de gemiddelde gewichtstoename 5,6 kg (12,3 lb) (mediane blootstelling van 573 dagen, N=2021). De percentages patiënten die bij langdurige blootstelling ten minste 7%, 15% of 25% van hun lichaamsgewicht bij aanvang toenamen, waren respectievelijk 64%, 32% en 12%. Stopzetting wegens gewichtstoename trad op bij 0,4% van de met olanzapine behandelde patiënten na een blootstelling van ten minste 48 weken.
Tabel 6 bevat gegevens over gewichtstoename bij volwassenen met olanzapine, verzameld uit 86 klinische onderzoeken. De gegevens in elke kolom vertegenwoordigen gegevens voor die patiënten die behandelingsperioden van de gespecificeerde duur hebben voltooid.
Er zijn dosisgroepverschillen waargenomen met betrekking tot gewichtstoename. In een enkele 8 weken durende, gerandomiseerde, dubbelblinde studie met vaste dosis waarin 10 (N=199), 20 (N=200) en 40 (N=200) mg oraal olanzapine werd vergeleken bij volwassen patiënten met schizofrenie of schizoaffectieve stoornis, gemiddelde gewichtstoename bij baseline tot eindpunt (10 mg/dag: 1,9 kg; 20 mg/dag: 2,3 kg; 40 mg/dag: 3 kg) werd waargenomen met significante verschillen tussen 10 en 40 mg/dag.
Olanzapine-monotherapie bij adolescenten
De veiligheid en werkzaamheid van olanzapine zijn niet vastgesteld bij patiënten jonger dan 13 jaar. De gemiddelde gewichtstoename bij adolescenten was groter dan bij volwassenen. In 4 placebogecontroleerde onderzoeken vond stopzetting van de behandeling vanwege gewichtstoename plaats bij 1% van de met olanzapine behandelde patiënten, vergeleken met 0% van de met placebo behandelde patiënten.
In langetermijnonderzoeken (ten minste 24 weken) was de gemiddelde gewichtstoename 11,2 kg (24,6 lb); (mediane blootstelling van 201 dagen, N=179). De percentages adolescenten die bij langdurige blootstelling ten minste 7%, 15% of 25% van hun lichaamsgewicht bij aanvang toenamen, waren respectievelijk 89%, 55% en 29%. Bij adolescente patiënten was de gemiddelde gewichtstoename volgens baseline BMI-categorie respectievelijk 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) en 12,7 kg (27,9 lb), voor normaal (N=106), overgewicht (N=26) en obesitas (N=17). Stopzetting vanwege gewichtstoename trad op bij 2,2% van de met olanzapine behandelde patiënten na ten minste 24 weken blootstelling.
Tabel 8 toont gegevens over gewichtstoename bij adolescenten met olanzapine, verzameld uit 6 klinische onderzoeken. De gegevens in elke kolom vertegenwoordigen gegevens voor die patiënten die behandelingsperioden van de gespecificeerde duur hebben voltooid. Er zijn weinig klinische onderzoeksgegevens beschikbaar over gewichtstoename bij adolescenten met olanzapine na een behandeling van meer dan 6 maanden.
Tardieve dyskinesie
Bij patiënten die met antipsychotica worden behandeld, kan zich een syndroom van mogelijk onomkeerbare, onwillekeurige, dyskinetische bewegingen ontwikkelen. Hoewel de prevalentie van het syndroom het hoogst lijkt te zijn bij ouderen, vooral bij oudere vrouwen, is het onmogelijk om te vertrouwen op prevalentieschattingen om bij aanvang van de antipsychotische behandeling te voorspellen welke patiënten het syndroom waarschijnlijk zullen ontwikkelen. Of antipsychotica verschillen in hun potentieel om tardieve dyskinesie te veroorzaken, is niet bekend.
Aangenomen wordt dat het risico op het ontwikkelen van tardieve dyskinesie en de kans dat het onomkeerbaar wordt, toeneemt naarmate de duur van de behandeling en de totale cumulatieve dosis antipsychotica die aan de patiënt worden toegediend toenemen. Het syndroom kan zich echter ontwikkelen, hoewel veel minder vaak, na relatief korte behandelingsperioden met lage doses of kan zelfs optreden na stopzetting van de behandeling.
Tardieve dyskinesie kan geheel of gedeeltelijk verdwijnen als de behandeling met antipsychotica wordt stopgezet. Behandeling met antipsychotica kan echter zelf de tekenen en symptomen van het syndroom onderdrukken (of gedeeltelijk) en kan daardoor mogelijk het onderliggende proces maskeren. Het effect dat symptomatische onderdrukking heeft op het lange termijn beloop van het syndroom is onbekend.
Gezien deze overwegingen dient olanzapine te worden voorgeschreven op een manier die het optreden van tardieve dyskinesie zo klein mogelijk maakt. Chronische behandeling met antipsychotica moet in het algemeen worden voorbehouden aan patiënten (1) die lijden aan een chronische ziekte waarvan bekend is dat deze reageert op antipsychotica, en (2) voor wie alternatieve, even effectieve, maar mogelijk minder schadelijke behandelingen niet beschikbaar of geschikt zijn. Bij patiënten die wel een chronische behandeling nodig hebben, moet worden gestreefd naar de kleinste dosis en de kortste behandelingsduur die een bevredigende klinische respons oplevert. De noodzaak van voortzetting van de behandeling moet periodiek opnieuw worden beoordeeld.
Als er tekenen en symptomen van tardieve dyskinesie optreden bij een patiënt die olanzapine gebruikt, dient te worden overwogen de behandeling te staken. Sommige patiënten kunnen echter ondanks de aanwezigheid van het syndroom behandeling met olanzapine nodig hebben.
Raadpleeg voor specifieke informatie over de waarschuwingen van lithium of valproaat het gedeelte Waarschuwingen van de bijsluiters van deze andere producten.
Orthostatische hypotensie
Olanzapine kan orthostatische hypotensie induceren die gepaard gaat met duizeligheid, tachycardie, bradycardie en, bij sommige patiënten, syncope, vooral tijdens de initiële dosistitratieperiode, waarschijnlijk als gevolg van de α1-adrenerge antagonistische eigenschappen ervan [zie Informatie over patiëntbegeleiding ].
Uit een analyse van de gegevens over de vitale functies in een geïntegreerde database van 41 voltooide klinische onderzoeken bij volwassen patiënten die werden behandeld met oraal olanzapine, werd orthostatische hypotensie geregistreerd bij ≥20% (1277/6030) van de patiënten.
Voor orale therapie met olanzapine kan het risico op orthostatische hypotensie en syncope worden geminimaliseerd door de behandeling te starten met 5 mg QD (zie DOSERING EN ADMINISTRATIE ]. Als hypotensie optreedt, moet een meer geleidelijke titratie naar de streefdosis worden overwogen.
Hypotensie, bradycardie met of zonder hypotensie, tachycardie en syncope werden ook gemeld tijdens de klinische onderzoeken met intramusculair olanzapine voor injectie. In een open-label klinisch farmacologisch onderzoek bij niet-geagiteerde patiënten met schizofrenie, waarbij de veiligheid en verdraagbaarheid van intramusculair olanzapine werden beoordeeld bij een maximaal doseringsschema (drie doses van 10 mg toegediend met een tussenpoos van 4 uur), ervoer ongeveer een derde van deze patiënten een significante orthostatische afname van de systolische bloeddruk (dwz afname ≥30 mmHg) [zie DOSERING EN ADMINISTRATIE ]. Syncope werd gemeld bij 0,6% (15/2500) van de met olanzapine behandelde patiënten in fase 2-3 orale olanzapine-onderzoeken en bij 0,3% (2/722) van de met olanzapine behandelde patiënten met agitatie in de intramusculaire onderzoeken met olanzapine voor injectie. Drie normale vrijwilligers in fase 1-onderzoeken met intramusculair olanzapine ondervonden hypotensie, bradycardie en sinuspauzes van maximaal 6 seconden die spontaan verdwenen (in 2 gevallen traden de reacties op bij intramusculair olanzapine en in 1 geval bij oraal olanzapine). Het risico op deze opeenvolging van hypotensie, bradycardie en sinuspauze kan groter zijn bij niet-psychiatrische patiënten in vergelijking met psychiatrische patiënten die mogelijk beter zijn aangepast aan bepaalde effecten van psychotrope geneesmiddelen. Voor intramusculaire therapie met olanzapine voor injectie moeten patiënten na injectie liggend blijven liggen als ze slaperig of duizelig zijn totdat onderzoek heeft uitgewezen dat ze geen orthostatische hypotensie, bradycardie en/of hypoventilatie ervaren.
Olanzapine moet met bijzondere voorzichtigheid worden gebruikt bij patiënten met bekende cardiovasculaire aandoeningen (voorgeschiedenis van myocardinfarct of ischemie, hartfalen of geleidingsstoornissen), cerebrovasculaire aandoeningen en aandoeningen die patiënten vatbaar maken voor hypotensie (dehydratie, hypovolemie en behandeling met antihypertensiva). ) waar het optreden van syncope, of hypotensie en/of bradycardie de patiënt een verhoogd medisch risico kan opleveren.
Voorzichtigheid is geboden bij patiënten die worden behandeld met andere geneesmiddelen die effecten kunnen veroorzaken die hypotensie, bradycardie, depressie van de luchtwegen of het centrale zenuwstelsel kunnen veroorzaken [zie DRUG-INTERACTIES ]. Gelijktijdige toediening van intramusculair olanzapine en parenterale benzodiazepine wordt niet aanbevolen vanwege de kans op overmatige sedatie en cardiorespiratoire depressie.
Watervallen
ZYPREXA kan slaperigheid, orthostatische hypotensie, motorische en sensorische instabiliteit veroorzaken, wat kan leiden tot vallen en bijgevolg tot fracturen of ander letsel. Voor patiënten met ziekten, aandoeningen of medicijnen die deze effecten kunnen verergeren, volledige valrisicobeoordelingen bij het starten van een antipsychotische behandeling en herhaaldelijk voor patiënten die langdurige antipsychotische therapie ondergaan.
Leukopenie, neutropenie en agranulocytose
Klasse-effect
In klinische onderzoeken en/of postmarketingervaring zijn gevallen van leukopenie/neutropenie gemeld die tijdelijk gerelateerd zijn aan antipsychotica, waaronder ZYPREXA. Agranulocytose is ook gemeld.
Mogelijke risicofactoren voor leukopenie/neutropenie zijn onder meer een reeds bestaand laag aantal witte bloedcellen (WBC) en een voorgeschiedenis van door geneesmiddelen geïnduceerde leukopenie/neutropenie. Bij patiënten met een voorgeschiedenis van een klinisch significante lage WBC of geneesmiddelgeïnduceerde leukopenie/neutropenie moet hun volledige bloedbeeld (CBC) regelmatig worden gecontroleerd tijdens de eerste paar maanden van de behandeling en stopzetting van ZYPREXA moet worden overwogen bij het eerste teken van een klinisch significante afname in WBC bij afwezigheid van andere oorzakelijke factoren.
Patiënten met klinisch significante neutropenie moeten zorgvuldig worden gecontroleerd op koorts of andere symptomen of tekenen van infectie en onmiddellijk worden behandeld als dergelijke symptomen of tekenen optreden. Patiënten met ernstige neutropenie (absoluut aantal neutrofielen
Dysfagie
Slokdarmdysmotiliteit en aspiratie zijn in verband gebracht met het gebruik van antipsychotica. Aspiratiepneumonie is een veelvoorkomende oorzaak van morbiditeit en mortaliteit bij patiënten met gevorderde ziekte van Alzheimer. Olanzapine is niet goedgekeurd voor de behandeling van patiënten met de ziekte van Alzheimer.
epileptische aanvallen
Tijdens premarketingtests traden toevallen op bij 0,9% (22/2500) van de met olanzapine behandelde patiënten. In veel van deze gevallen waren er verstorende factoren die mogelijk hebben bijgedragen aan het optreden van aanvallen. Olanzapine moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van convulsies of met aandoeningen die de drempel voor convulsies mogelijk verlagen, bijv. Alzheimerdementie. Olanzapine is niet goedgekeurd voor de behandeling van patiënten met de ziekte van Alzheimer. Aandoeningen die de aanvalsdrempel verlagen, kunnen vaker voorkomen in een populatie van 65 jaar of ouder.
Potentieel voor cognitieve en motorische stoornissen
Slaperigheid was een vaak gemelde bijwerking in verband met behandeling met olanzapine en trad op met een incidentie van 26% bij olanzapinepatiënten vergeleken met 15% bij placebopatiënten. Deze bijwerking was ook dosisgerelateerd. Slaperigheid leidde tot stopzetting bij 0,4% (9/2500) van de patiënten in de premarketingdatabase.
Aangezien olanzapine het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat de behandeling met olanzapine geen nadelige gevolgen voor hen heeft [zie Informatie over patiëntbegeleiding ].
Regeling lichaamstemperatuur
Een verstoring van het vermogen van het lichaam om de kerntemperatuur van het lichaam te verlagen, wordt toegeschreven aan antipsychotica. Passende zorg wordt geadviseerd bij het voorschrijven van olanzapine aan patiënten die aandoeningen zullen ervaren die kunnen bijdragen aan een verhoging van de lichaamstemperatuur, bijv. zware inspanning, blootstelling aan extreme hitte, gelijktijdige toediening van medicatie met anticholinerge activiteit, of onderhevig zijn aan uitdroging [zie PATIËNT INFORMATIE ].
Gebruik bij patiënten met gelijktijdige ziekte
Klinische ervaring met olanzapine bij patiënten met bepaalde bijkomende systemische ziekten is beperkt [zie: KLINISCHE FARMACOLOGIE ].
Olanzapine vertoont in vitro muscarinereceptoraffiniteit. In klinische premarketingonderzoeken met olanzapine werd olanzapine in verband gebracht met constipatie, droge mond en tachycardie, alle bijwerkingen die mogelijk verband hielden met cholinerge antagonisme. Dergelijke bijwerkingen waren niet vaak de basis voor stopzetting van olanzapine, maar olanzapine moet met voorzichtigheid worden gebruikt bij patiënten met klinisch significante prostaathypertrofie, nauwehoekglaucoom of een voorgeschiedenis van paralytische ileus of aanverwante aandoeningen.
In 5 placebogecontroleerde onderzoeken met olanzapine bij oudere patiënten met aan dementie gerelateerde psychose (n=1184), werden de volgende tijdens de behandeling optredende bijwerkingen gemeld bij met olanzapine behandelde patiënten met een incidentie van ten minste 2% en significant meer dan placebo- behandelde patiënten: vallen, slaperigheid, perifeer oedeem, abnormale gang, urine-incontinentie, lethargie, gewichtstoename, asthenie, koorts, longontsteking, droge mond en visuele hallucinaties. Het percentage stopzettingen vanwege bijwerkingen was groter bij olanzapine dan bij placebo (13% vs. 7%). Oudere patiënten met aan dementie gerelateerde psychose die met olanzapine worden behandeld, lopen een verhoogd risico op overlijden in vergelijking met placebo. Olanzapine is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: , Oudere patiënten met aan dementie gerelateerde psychose , en PATIËNT INFORMATIE ].
Olanzapine is niet geëvalueerd of in noemenswaardige mate gebruikt bij patiënten met een recente voorgeschiedenis van een myocardinfarct of instabiele hartziekte. Patiënten met deze diagnoses werden uitgesloten van premarketing klinische onderzoeken. Vanwege het risico op orthostatische hypotensie met olanzapine is voorzichtigheid geboden bij hartpatiënten [zie: Orthostatische hypotensie ].
Hyperprolactinemie
Zoals met andere geneesmiddelen die dopamine D2-receptoren antagoniseren, verhoogt olanzapine de prolactinespiegels, en de verhoging houdt aan tijdens chronische toediening. Hyperprolactinemie kan hypothalamische GnRH onderdrukken, wat resulteert in verminderde hypofyse-gonadotropinesecretie. Dit kan op zijn beurt de reproductieve functie remmen door de gonadale steroïdogenese bij zowel vrouwelijke als mannelijke patiënten te verminderen. Galactorroe, amenorroe, gynaecomastie en impotentie zijn gemeld bij patiënten die prolactineverhogende verbindingen kregen. Langdurige hyperprolactinemie in combinatie met hypogonadisme kan leiden tot verminderde botdichtheid bij zowel vrouwelijke als mannelijke proefpersonen.
Weefselkweekexperimenten geven aan dat ongeveer een derde van de menselijke borstkankers in vitro afhankelijk is van prolactine, een factor van potentieel belang als het voorschrijven van deze geneesmiddelen wordt overwogen bij een patiënt met eerder gedetecteerde borstkanker. Zoals gebruikelijk is bij verbindingen die de afgifte van prolactine verhogen, werd een toename van borstklierneoplasie waargenomen in de carcinogeniteitsstudies van olanzapine bij muizen en ratten [zie Niet-klinische toxicologie ]. Noch klinische studies noch epidemiologische studies die tot nu toe zijn uitgevoerd, hebben een verband aangetoond tussen chronische toediening van deze klasse geneesmiddelen en tumorigenese bij mensen; het beschikbare bewijs wordt op dit moment te beperkt geacht om sluitend te zijn.
In placebogecontroleerde klinische onderzoeken met olanzapine (tot 12 weken) werden veranderingen van normaal naar hoog in prolactineconcentraties waargenomen bij 30% van de met olanzapine behandelde volwassenen vergeleken met 10,5% van de met placebo behandelde volwassenen. In een gepoolde analyse van klinische onderzoeken met 8136 volwassenen die werden behandeld met olanzapine, omvatten mogelijk geassocieerde klinische manifestaties menstruatiegerelateerde voorvallen1 (2% [49/3240] van de vrouwen), seksuele functiegerelateerde voorvallen2 (2% [150/8136] van de vrouwen en mannen), en borstgerelateerde voorvallen3 (0,7% [23/3240] van de vrouwen, 0,2% [9/4896] van de mannen).
In placebogecontroleerde onderzoeken naar monotherapie met olanzapine bij adolescente patiënten (tot 6 weken) met schizofrenie of bipolaire I-stoornis (manische of gemengde episodes), werden veranderingen van normaal naar hoog in prolactineconcentraties waargenomen bij 47% van de met olanzapine behandelde patiënten vergeleken met 7 % van de met placebo behandelde patiënten. In een gepoolde analyse van klinische onderzoeken met 454 adolescenten die met olanzapine werden behandeld, omvatten mogelijk geassocieerde klinische manifestaties menstruatiegerelateerde voorvallen1 (1% [2/168] van vrouwen), seksuele functiegerelateerde voorvallen2 (0,7% [3/454] van vrouwen en mannen ), en borstgerelateerde gebeurtenissen3 (2% [3/168] van vrouwen, 2% [7/286] van mannen) [zie Gebruik bij specifieke populaties ].
1 Gebaseerd op een zoekopdracht met de volgende termen: amenorroe, hypomenorroe, vertraagde menstruatie en oligomenorroe.
2 Gebaseerd op een zoekopdracht met de volgende termen: anorgasmie, vertraagde ejaculatie, erectiestoornissen, verminderd libido, verlies van libido, abnormaal orgasme en seksuele disfunctie.
Gebaseerd op een zoekopdracht met de volgende termen: afscheiding van de borst, vergroting of zwelling, galactorroe, gynaecomastie en lactatiestoornis.
Verschillen in dosisgroepen met betrekking tot verhoging van prolactine zijn waargenomen. In een enkele 8 weken durende, gerandomiseerde, dubbelblinde studie met vaste dosis waarin 10 (N=199), 20 (N=200) en 40 (N=200) mg oraal olanzapine werd vergeleken bij volwassen patiënten met schizofrenie of schizoaffectieve stoornis, incidentie van prolactineverhoging >24,2 ng/ml (vrouwelijk) of >18,77 ng/ml (mannelijk) op elk moment tijdens het onderzoek (10 mg/dag: 31,2%; 20 mg/dag: 42,7%; 40 mg/dag : 61,1%) duidde op significante verschillen tussen 10 vs. 40 mg/dag en 20 vs. 40 mg/dag.
Gebruik in combinatie met fluoxetine, lithium of valproaat
Bij gebruik van ZYPREXA en fluoxetine in combinatie, dient de voorschrijver ook de rubriek Waarschuwingen en voorzorgsmaatregelen van de bijsluiter van Symbyax te raadplegen. Bij gebruik van ZYPREXA in combinatie met lithium of valproaat, dient de voorschrijver de rubrieken Waarschuwingen en voorzorgsmaatregelen van de bijsluiters voor lithium of valproaat te raadplegen [zie DRUG-INTERACTIES ].
Laboratorium testen
Vasten van bloedglucosemetingen en lipidenprofiel aan het begin van en periodiek tijdens de behandeling wordt aanbevolen [zie Metabolische veranderingen en PATIËNT INFORMATIE ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ) voor de orale formuleringen.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze optreden tijdens het gebruik van ZYPREXA 15 mg als monotherapie of in combinatie met fluoxetine. Als u denkt dat u niet beter wordt of als u zich zorgen maakt over uw toestand terwijl u ZYPREXA 2,5 mg gebruikt, neem dan contact op met uw arts. Als u ZYPREXA en fluoxetine in combinatie gebruikt, raadpleeg dan ook het gedeelte Patiëntenadvies in de bijsluiter van Symbyax.
Oudere patiënten met aan dementie gerelateerde psychose: verhoogde mortaliteit en cerebrovasculaire bijwerkingen (CVAE), waaronder beroerte
Patiënten en zorgverleners moeten erop worden gewezen dat oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, een verhoogd risico op overlijden hebben. Patiënten en zorgverleners moeten erop worden gewezen dat oudere patiënten met aan dementie gerelateerde psychose die met ZYPREXA werden behandeld, een significant hogere incidentie hadden van cerebrovasculaire bijwerkingen (bijv. beroerte, voorbijgaande ischemische aanval) in vergelijking met placebo.
ZYPREXA is niet goedgekeurd voor oudere patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Maligne neurolepticasyndroom (NMS)
Patiënten en zorgverleners moeten erop worden gewezen dat een mogelijk fataal symptoomcomplex, soms aangeduid als NMS, is gemeld in verband met de toediening van antipsychotica, waaronder ZYPREXA. Tekenen en symptomen van MNS omvatten hyperpyrexie, spierstijfheid, veranderde mentale toestand en bewijs van autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelreactie met eosinofilie en systemische symptomen (JURK)
Patiënten moeten worden geadviseerd om hun zorgverlener zo snel mogelijk te informeren over tekenen en symptomen die verband kunnen houden met een geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hyperglykemie en diabetes mellitus
Patiënten dienen te worden geïnformeerd over het mogelijke risico op aan hyperglykemie gerelateerde bijwerkingen. Patiënten moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten met diabetes dienen de instructies van hun arts op te volgen over hoe vaak ze hun bloedsuikerspiegel moeten controleren tijdens het gebruik van ZYPREXA [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
dyslipidemie
Patiënten moeten erop worden gewezen dat dyslipidemie is opgetreden tijdens de behandeling met ZYPREXA. Patiënten moeten hun lipidenprofiel regelmatig laten controleren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gewichtstoename
Patiënten moeten erop worden gewezen dat er gewichtstoename is opgetreden tijdens de behandeling met ZYPREXA. Patiënten moeten hun gewicht regelmatig laten controleren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Orthostatische hypotensie
Patiënten moeten worden geïnformeerd over het risico van orthostatische hypotensie, vooral tijdens de periode van titratie van de initiële dosis en in combinatie met gelijktijdig gebruik van geneesmiddelen die het orthostatische effect van ZYPREXA kunnen versterken, bijv. diazepam of alcohol (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ]. Patiënten moeten worden geadviseerd om voorzichtig van houding te veranderen om orthostatische hypotensie te helpen voorkomen, en om te gaan liggen als ze zich duizelig of flauw voelen, totdat ze zich beter voelen. Patiënten moeten het advies krijgen om hun arts te bellen als ze een van de volgende tekenen en symptomen ervaren die gepaard gaan met orthostatische hypotensie: duizeligheid, snelle of langzame hartslag of flauwvallen.
Potentieel voor cognitieve en motorische stoornissen
Omdat ZYPREXA het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze redelijk zeker zijn dat de behandeling met ZYPREXA geen nadelige gevolgen voor hen heeft [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Regeling lichaamstemperatuur
Patiënten moeten worden geadviseerd over passende zorg om oververhitting en uitdroging te voorkomen. Patiënten moeten worden geadviseerd om onmiddellijk hun arts te bellen als ze ernstig ziek worden en sommige of al deze symptomen van uitdroging hebben: te veel of helemaal niet zweten, droge mond, erg warm voelen, dorst hebben, geen urine kunnen produceren [ zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Patiënten moeten worden geadviseerd hun zorgverleners te informeren als zij Symbyax gebruiken of van plan zijn te gebruiken. Patiënten moeten ook worden geadviseerd hun zorgverleners op de hoogte te stellen als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken, van plan zijn te gebruiken of ermee zijn gestopt, inclusief kruidensupplementen, aangezien er een kans op interacties is [zie DRUG-INTERACTIES ].
Alcohol
Patiënten moeten worden geadviseerd alcohol te vermijden tijdens het gebruik van ZYPREXA [zie: DRUG-INTERACTIES ].
Fenylketonurie
ZYPREXA 10 mg ZYDIS (olanzapine oraal uiteenvallende tabletten) bevat fenylalanine (respectievelijk 0,34, 0,45, 0,67 of 0,90 mg per tablet van 5, 10, 15 of 20 mg) (zie OMSCHRIJVING ].
Gebruik bij specifieke populaties
Zwangerschap
Adviseer vrouwen om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met ZYPREXA. Adviseer patiënten dat ZYPREXA extrapiramidale en/of ontwenningsverschijnselen (agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis) kan veroorzaken bij een pasgeborene. Adviseer patiënten dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan ZYPREXA 7,5 mg zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven en die ZYPREXA 20 mg gebruiken om baby's te controleren op overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen) en om medische hulp in te roepen als ze deze symptomen opmerken. [zien Gebruik bij specifieke populaties ].
Onvruchtbaarheid
Adviseer vrouwen met reproductief vermogen dat ZYPREXA de vruchtbaarheid kan verminderen als gevolg van een verhoging van de serumprolactinespiegels. De effecten op de vruchtbaarheid zijn omkeerbaar [zie Gebruik bij specifieke populaties ].
Pediatrisch gebruik
ZYPREXA 15 mg is geïndiceerd voor de behandeling van schizofrenie en manische of gemengde episodes geassocieerd met bipolaire I-stoornis bij adolescenten van 13 tot 17 jaar. Vergeleken met patiënten uit klinische onderzoeken bij volwassenen, hadden adolescenten waarschijnlijk meer gewicht, een verhoogde sedatie en een grotere toename van de totale cholesterol-, triglyceriden-, LDL-cholesterol-, prolactine- en leveraminotransferasespiegels. Patiënten moeten worden voorgelicht over de mogelijke langetermijnrisico's van ZYPREXA en erop worden gewezen dat deze risico's ertoe kunnen leiden dat ze eerst andere geneesmiddelen overwegen [zie AANWIJZINGEN EN GEBRUIK ]. De veiligheid en werkzaamheid van ZYPREXA 5 mg bij patiënten jonger dan 13 jaar zijn niet vastgesteld. De veiligheid en werkzaamheid van ZYPREXA 15 mg en fluoxetine in combinatie bij patiënten van 10 tot 17 jaar zijn vastgesteld voor de acute behandeling van depressieve episodes geassocieerd met bipolaire I-stoornis. De veiligheid en werkzaamheid van ZYPREXA en fluoxetine in combinatie bij patiënten WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Behoefte aan een uitgebreid behandelingsprogramma bij pediatrische patiënten
ZYPREXA 20 mg is geïndiceerd als een integraal onderdeel van een totaal behandelingsprogramma voor pediatrische patiënten met schizofrenie en bipolaire stoornis, dat andere maatregelen (psychologische, educatieve, sociale) maatregelen voor patiënten met de stoornis kan omvatten. De werkzaamheid en veiligheid van ZYPREXA 7,5 mg zijn niet vastgesteld bij pediatrische patiënten jonger dan 13 jaar. Atypische antipsychotica zijn niet bedoeld voor gebruik bij pediatrische patiënten die symptomen vertonen die secundair zijn aan omgevingsfactoren en/of andere primaire psychiatrische stoornissen. Passende onderwijsplaatsing is essentieel en psychosociale interventie is vaak nuttig. De beslissing om atypische antipsychotica voor te schrijven hangt af van de beoordeling door de zorgverlener van de chroniciteit en ernst van de symptomen van de patiënt [zie AANWIJZINGEN EN GEBRUIK ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Er zijn orale carcinogeniteitsonderzoeken uitgevoerd bij muizen en ratten. Olanzapine werd toegediend aan muizen in twee onderzoeken van 78 weken in doses van 3, 10, 30/20 mg/kg/dag (overeenkomend met 0,8-5 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak) en 0,25, 2 , 8 mg/kg/dag (overeenkomend met 0,06-2 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak). Ratten werden gedurende 2 jaar gedoseerd in doses van 0,25, 1, 2,5, 4 mg/kg/dag (mannetjes) en 0,25, 1, 4, 8 mg/kg/dag (vrouwtjes) (equivalent aan 0,13-2 en 0,13-4 maal de dagelijkse orale MRHD op basis van respectievelijk mg/m² lichaamsoppervlak). De incidentie van leverhemangiomen en hemangiosarcomen was significant verhoogd in 1 muisstudie bij vrouwelijke muizen bij 2 keer de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak. Deze tumoren waren niet verhoogd in een ander muizenonderzoek bij vrouwtjes die tot 2-5 keer de dagelijkse orale MRHD kregen op basis van mg/m² lichaamsoppervlak; in deze studie was er een hoge incidentie van vroege sterfte bij mannen van de 30/20 mg/kg/dag-groep. De incidentie van borstklieradenomen en adenocarcinomen was significant verhoogd bij vrouwelijke muizen die 2 mg/kg/dag kregen en bij vrouwelijke ratten die 4 mg/kg/dag kregen (0,5 en 2 maal de dagelijkse orale MRHD op basis van mg/m²). lichaamsoppervlak, respectievelijk). Van antipsychotica is aangetoond dat ze de prolactinespiegels bij knaagdieren chronisch verhogen. Serumprolactinespiegels werden niet gemeten tijdens de carcinogeniteitsonderzoeken van olanzapine; metingen tijdens subchronische toxiciteitsstudies toonden echter aan dat olanzapine de serumprolactinespiegels tot 4-voudig verhoogde bij ratten bij dezelfde doses die werden gebruikt in het carcinogeniteitsonderzoek. Een toename van borstklierneoplasmata is gevonden bij knaagdieren na chronische toediening van andere antipsychotica en wordt beschouwd als prolactine-gemedieerd. De relevantie voor het menselijk risico van het vinden van prolactine-gemedieerde endocriene tumoren bij knaagdieren is niet bekend [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Mutagenese
Er is geen bewijs gevonden voor het genotoxische potentieel van olanzapine in de Ames-reverse-mutatietest, in vivo micronucleustest bij muizen, de chromosomale aberratietest in ovariumcellen van Chinese hamsters, ongeplande DNA-synthesetest in hepatocyten van ratten, inductie van voorwaartse-mutatietest in lymfoomcellen van muizen , of in vivo zusterchromatidenuitwisselingstest in beenmerg van Chinese hamsters.
Aantasting van de vruchtbaarheid
In een onderzoek naar orale vruchtbaarheid en reproductieve prestaties bij ratten was de paringsprestatie van de man, maar niet de vruchtbaarheid, verminderd bij een dosis van 22,4 mg/kg/dag en was de vrouwelijke vruchtbaarheid verminderd bij een dosis van 3 mg/kg/dag (11 en 1,5 maal de dagelijkse orale MRHD op basis van respectievelijk mg/m² lichaamsoppervlak). Stopzetting van de behandeling met olanzapine deed de effecten op de paringsprestaties van de man teniet. Bij vrouwelijke ratten was de precoïtale periode verhoogd en de paringsindex verlaagd tot 5 mg/kg/dag (2,5 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak). Diestrous was verlengd en oestrus vertraagd bij 1,1 mg/kg/dag (0,6 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak); daarom kan olanzapine een ovulatievertraging veroorzaken.
Gebruik bij specifieke populaties
Als u ZYPREXA en fluoxetine in combinatie gebruikt, raadpleeg dan ook het gedeelte Gebruik bij specifieke populaties van de bijsluiter voor Symbyax.
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap zijn blootgesteld aan atypische antipsychotica, waaronder ZYPREXA. Zorgaanbieders worden aangemoedigd om patiënten te registreren door contact op te nemen met het National Pregnancy Registry for Atypical Antipsychotics op 1-866-961-2388 of door te gaan naar http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risico Samenvatting
Pasgeborenen die tijdens het derde trimester worden blootgesteld aan antipsychotica, waaronder ZYPREXA, lopen risico op extrapiramidale en/of ontwenningsverschijnselen na de bevalling (zie Klinische overwegingen ). Over het geheel genomen beschikbare gegevens van gepubliceerde epidemiologische onderzoeken van zwangere vrouwen die zijn blootgesteld aan olanzapine hebben geen geneesmiddel-geassocieerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten aangetoond (zie Gegevens ). Er zijn risico's voor de moeder verbonden aan onbehandelde schizofrenie of bipolaire I-stoornis en met blootstelling aan antipsychotica, waaronder ZYPREXA 7,5 mg, tijdens de zwangerschap (zie Klinische overwegingen ).
Olanzapine was niet teratogeen bij orale toediening aan drachtige ratten en konijnen in doses die 9 en 30 maal de dagelijkse maximale aanbevolen dosis voor de mens (MRHD) zijn, gebaseerd op mg/m² lichaamsoppervlak; sommige foetale toxiciteiten werden waargenomen bij deze doses (zie: Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijkingen, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en embryo-/foetale risico
Er is een risico voor de moeder door onbehandelde schizofrenie of bipolaire I-stoornis, waaronder een verhoogd risico op terugval, ziekenhuisopname en zelfmoord. Schizofrenie en bipolaire I-stoornis zijn geassocieerd met verhoogde ongunstige perinatale uitkomsten, waaronder vroeggeboorte. Het is niet bekend of dit een direct gevolg is van de ziekte of andere comorbide factoren.
Foetale/neonatale bijwerkingen
Extrapiramidale en/of ontwenningsverschijnselen, waaronder agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis zijn gemeld bij pasgeborenen die tijdens het derde trimester van de zwangerschap werden blootgesteld aan antipsychotica, waaronder ZYPREXA 2,5 mg. Deze symptomen varieerden in ernst. Controleer pasgeborenen op extrapiramidale en/of ontwenningsverschijnselen en behandel de symptomen op de juiste manier. Sommige pasgeborenen herstelden binnen enkele uren of dagen zonder specifieke behandeling; anderen vereisten langdurige ziekenhuisopname.
Gegevens
Menselijke gegevens
Placentapassage is gemeld in gepubliceerde onderzoeksrapporten; de placenta-passageverhouding was echter zeer variabel, variërend van 7% tot 167% bij de geboorte na blootstelling tijdens de zwangerschap. De klinische relevantie van deze bevinding is niet bekend.
Gepubliceerde gegevens uit observationele studies, geboorteregisters en casusrapporten die het gebruik van atypische antipsychotica tijdens de zwangerschap hebben geëvalueerd, laten geen verhoogd risico op ernstige geboorteafwijkingen zien. Een retrospectief cohortonderzoek uit een Medicaid-database van 9258 vrouwen die tijdens de zwangerschap aan antipsychotica waren blootgesteld, duidde niet op een algeheel verhoogd risico op ernstige geboorteafwijkingen.
Dierlijke gegevens
In orale reproductiestudies bij ratten bij doses tot 18 mg/kg/dag en bij konijnen bij doses tot 30 mg/kg/dag (respectievelijk 9 en 30 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak), er werd geen bewijs van teratogeniteit waargenomen. In een oraal teratologisch onderzoek bij ratten werden vroege resorpties en een verhoogd aantal niet-levensvatbare foetussen waargenomen bij een dosis van 18 mg/kg/dag (9 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak) en werd de dracht verlengd met 10 mg/kg/dag (5 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak). In een oraal teratologisch onderzoek bij konijnen trad foetale toxiciteit, die zich manifesteerde als verhoogde resorpties en verlaagd foetaal gewicht, op bij een maternale toxische dosis van 30 mg/kg/dag (30 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak).
Borstvoeding
Risico Samenvatting
Olanzapine is aanwezig in de moedermelk. Er zijn meldingen van overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen) bij zuigelingen die via de moedermelk aan olanzapine zijn blootgesteld (zie Klinische overwegingen ). Er is geen informatie over de effecten van olanzapine op de melkproductie.
De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan ZYPREXA en eventuele nadelige effecten op het kind dat borstvoeding krijgt van ZYPREXA of van de onderliggende aandoening van de moeder.
Klinische overwegingen
Baby's die zijn blootgesteld aan ZYPREXA 7,5 mg moeten worden gecontroleerd op overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen).
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
vrouwen
Op basis van de farmacologische werking van olanzapine (D2-receptorantagonisme), kan behandeling met ZYPREXA resulteren in een verhoging van de serumprolactinespiegels, wat kan leiden tot een omkeerbare vermindering van de vruchtbaarheid bij vrouwen met reproductief vermogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pediatrisch gebruik
De veiligheid en werkzaamheid van oraal toegediende ZYPREXA bij de behandeling van schizofrenie en manische of gemengde episodes geassocieerd met bipolaire I-stoornis zijn vastgesteld in kortdurende onderzoeken bij adolescenten (in de leeftijd van 13 tot 17 jaar). Het gebruik van ZYPREXA bij adolescenten wordt ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken met ZYPREXA 5 mg, waarbij 268 adolescenten 20 mg ZYPREXA kregen in een spreiding van 2,5 tot 20 mg/dag [zie Klinische studies ]. De aanbevolen startdosis voor adolescenten is lager dan die voor volwassenen [zie DOSERING EN ADMINISTRATIE ]. Vergeleken met patiënten uit klinische onderzoeken bij volwassenen, hadden adolescenten waarschijnlijk meer gewicht, een verhoogde sedatie en een grotere toename van de totale cholesterol-, triglyceriden-, LDL-cholesterol-, prolactine- en leveraminotransferasespiegels [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ]. Bij het kiezen tussen de alternatieve behandelingen die beschikbaar zijn voor adolescenten, dienen clinici rekening te houden met het verhoogde potentieel (bij adolescenten in vergelijking met volwassenen) voor gewichtstoename en dyslipidemie. Artsen moeten rekening houden met de mogelijke langetermijnrisico's bij het voorschrijven aan adolescenten, en in veel gevallen kan dit ertoe leiden dat ze overwegen om eerst andere geneesmiddelen voor te schrijven aan adolescenten [zie AANWIJZINGEN EN GEBRUIK ].
De veiligheid en werkzaamheid van olanzapine bij kinderen PATIËNT INFORMATIE ].
De veiligheid en werkzaamheid van ZYPREXA 7,5 mg en fluoxetine in combinatie bij kinderen en adolescenten (10 tot 17 jaar) zijn vastgesteld voor de acute behandeling van depressieve episodes geassocieerd met bipolaire I-stoornis.
De veiligheid en werkzaamheid van ZYPREXA en fluoxetine in combinatie bij kinderen jonger dan 10 jaar zijn niet vastgesteld.
Geriatrisch gebruik
Van de 2500 patiënten in premarketing klinische onderzoeken met oraal olanzapine was 11% (263) 65 jaar of ouder. Bij patiënten met schizofrenie waren er geen aanwijzingen voor een andere verdraagbaarheid van olanzapine bij ouderen dan bij jongere patiënten. Studies bij oudere patiënten met aan dementie gerelateerde psychose hebben gesuggereerd dat er bij deze populatie een ander verdraagbaarheidsprofiel kan zijn dan bij jongere patiënten met schizofrenie. Oudere patiënten met aan dementie gerelateerde psychose die met olanzapine worden behandeld, hebben een verhoogd risico op overlijden in vergelijking met placebo. In placebogecontroleerde onderzoeken met olanzapine bij oudere patiënten met aan dementie gerelateerde psychose, was er een hogere incidentie van cerebrovasculaire bijwerkingen (bijv. beroerte, voorbijgaande ischemische aanval) bij patiënten die werden behandeld met olanzapine in vergelijking met patiënten die werden behandeld met placebo. Olanzapine is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose. Ook zou de aanwezigheid van factoren die de farmacokinetische klaring kunnen verminderen of de farmacodynamische respons op olanzapine kunnen verhogen, ertoe leiden dat een lagere startdosis voor elke geriatrische patiënt wordt overwogen [zie GEVAARLIJKE WAARSCHUWING: , DOSERING EN ADMINISTRATIE , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Klinische studies van ZYPREXA en fluoxetine in combinatie omvatten niet voldoende aantallen patiënten ≥65 jaar om te bepalen of zij anders reageren dan jongere patiënten.
OVERDOSERING
Menselijke ervaring
In premarketingonderzoeken waarbij meer dan 3100 patiënten en/of normale proefpersonen betrokken waren, werd bij 67 patiënten een accidentele of opzettelijke acute overdosering van olanzapine vastgesteld. Bij de patiënt die de grootste geïdentificeerde hoeveelheid, 300 mg, nam, waren de enige symptomen die werden gemeld slaperigheid en onduidelijke spraak. Bij het beperkte aantal patiënten dat in ziekenhuizen werd geëvalueerd, inclusief de patiënt die 300 mg slikte, waren er geen waarnemingen die wijzen op een nadelige verandering in laboratoriumanalyten of ECG. De vitale functies waren gewoonlijk binnen de normale grenzen na overdoses.
In postmarketingmeldingen van overdosering met alleen olanzapine zijn in de meeste gevallen symptomen gemeld. Bij symptomatische patiënten omvatten symptomen met een incidentie van ≥ 10% agitatie/agressiviteit, dysartrie, tachycardie, verschillende extrapiramidale symptomen en een verminderd bewustzijn, variërend van sedatie tot coma. Onder de minder vaak gemelde symptomen waren de volgende potentieel medisch ernstige reacties: aspiratie, hartstilstand, hartritmestoornissen (zoals supraventriculaire tachycardie en 1 patiënt die een sinuspauze had met spontane hervatting van het normale ritme), delirium, mogelijk maligne neurolepticasyndroom, ademhalingsdepressie/stilstand , convulsies, hypertensie en hypotensie. Eli Lilly and Company heeft meldingen ontvangen van dodelijke afloop in verband met overdosering van alleen olanzapine. In 1 geval van overlijden werd gemeld dat de hoeveelheid acuut ingenomen olanzapine mogelijk zo laag was als 450 mg oraal olanzapine; in een ander geval werd echter gemeld dat een patiënt een acute inname van olanzapine van ongeveer 2 g oraal olanzapine overleefde.
Beheer van een overdosis
Neem voor actuele informatie over de behandeling van een overdosis ZYPREXA (olanzapine) contact op met een gecertificeerd antigifcentrum (1-800-222-1222 of www.poison.org). De mogelijkheid van betrokkenheid van meerdere geneesmiddelen moet worden overwogen. In geval van acute overdosering, zorg voor een luchtweg en zorg voor voldoende zuurstofvoorziening en ventilatie, inclusief intubatie. Maagspoeling (na intubatie, als de patiënt bewusteloos is) en toediening van actieve kool samen met een laxeermiddel moeten worden overwogen. De toediening van actieve kool (1 g) verminderde de Cmax en AUC van oraal olanzapine met ongeveer 60%. Aangezien de piekconcentraties van olanzapine doorgaans niet worden bereikt tot ongeveer 6 uur na toediening, kan houtskool een nuttige behandeling zijn voor een overdosis olanzapine.
De mogelijkheid van obtundatie, toevallen of dystonische reactie van het hoofd en de nek na een overdosis kan een risico op aspiratie met geïnduceerd braken veroorzaken. Cardiovasculaire monitoring moet onmiddellijk beginnen en moet continue elektrocardiografische monitoring omvatten om mogelijke aritmieën te detecteren.
Er is geen specifiek antidotum voor olanzapine. Daarom moeten passende ondersteunende maatregelen worden genomen. Hypotensie en circulatoire collaps moeten worden behandeld met geschikte maatregelen, zoals intraveneuze vloeistoffen en/of sympathicomimetica. (Gebruik geen epinefrine, dopamine of andere sympathicomimetica met bèta-agonistische activiteit, aangezien bètastimulatie hypotensie kan verergeren bij een door olanzapine geïnduceerde alfablokkade.) Strikt medisch toezicht en monitoring moeten worden voortgezet totdat de patiënt is hersteld.
Raadpleeg voor specifieke informatie over overdosering met lithium of valproaat de rubriek Overdosering van de bijsluiters van deze producten. Voor specifieke informatie over overdosering met olanzapine en fluoxetine in combinatie, zie de rubriek Overdosering van de Symbyax-bijsluiter.
CONTRA-INDICATIES
- Geen met ZYPREXA monotherapie.
- Raadpleeg bij gebruik van ZYPREXA en fluoxetine in combinatie ook de rubriek Contra-indicaties van de bijsluiter van Symbyax.
- Raadpleeg voor specifieke informatie over de contra-indicaties van lithium of valproaat de rubriek Contra-indicaties van de bijsluiters van deze andere producten.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van olanzapine bij de vermelde indicaties is onduidelijk. De werkzaamheid van olanzapine bij schizofrenie kan echter worden gemedieerd door een combinatie van dopamine en serotonine type 2 (5HT2)-antagonisme.
farmacodynamiek
Olanzapine bindt met hoge affiniteit aan de volgende receptoren: serotonine 5HT2A/2C, 5HT6 (respectievelijk Ki=4, 11 en 5 nM), dopamine D1-4 (Ki=11-31 nM), histamine H1 (Ki=7 nM ), en adrenerge 1-receptoren (Ki=19 nM). Olanzapine is een antagonist met matige affiniteitsbinding voor serotonine 5HT3 (Ki=57 nM) en muscarine M1-5 (respectievelijk Ki=73, 96, 132, 32 en 48 nM). Olanzapine bindt met lage affiniteit aan GABAA-, BZD- en β-adrenerge receptoren (Ki>10 M).
Farmacokinetiek
Orale toediening, monotherapie
Olanzapine wordt goed geabsorbeerd en bereikt piekconcentraties in ongeveer 6 uur na een orale dosis. Het wordt grotendeels geëlimineerd door first-pass metabolisme, waarbij ongeveer 40% van de dosis wordt gemetaboliseerd voordat het de systemische circulatie bereikt. Voedsel heeft geen invloed op de snelheid of mate van absorptie van olanzapine. Farmacokinetische onderzoeken hebben aangetoond dat doseringsvormen van ZYPREXA 5 mg en ZYPREXA ZYDIS (olanzapine oraal uiteenvallende tabletten) van olanzapine bio-equivalent zijn.
Olanzapine vertoont lineaire kinetiek over het klinische doseringsbereik. De halfwaardetijd varieert van 21 tot 54 uur (5e tot 95e percentiel; gemiddelde van 30 uur) en de schijnbare plasmaklaring varieert van 12 tot 47 l/uur (5e tot 95e percentiel; gemiddelde van 25 l/uur).
Toediening van olanzapine eenmaal daags leidt tot steady-state concentraties in ongeveer 1 week die ongeveer tweemaal de concentraties zijn na enkelvoudige doses. Plasmaconcentraties, halfwaardetijd en klaring van olanzapine kunnen van persoon tot persoon verschillen op basis van rookstatus, geslacht en leeftijd.
Olanzapine wordt uitgebreid door het lichaam gedistribueerd, met een distributievolume van ongeveer 1000 l. Het is voor 93% gebonden aan plasma-eiwitten in het concentratiebereik van 7 tot 1100 ng/ml, waarbij het voornamelijk bindt aan albumine en α1-zuurglycoproteïne.
Metabolisme en eliminatie
Na een enkelvoudige orale dosis 14C-gelabeld olanzapine werd 7% van de dosis olanzapine als onveranderd geneesmiddel in de urine teruggevonden, wat aangeeft dat olanzapine in hoge mate wordt gemetaboliseerd. Ongeveer 57% en 30% van de dosis werd respectievelijk teruggevonden in de urine en feces. In het plasma was olanzapine slechts verantwoordelijk voor 12% van de AUC van de totale radioactiviteit, wat wijst op een significante blootstelling aan metabolieten. Na meervoudige dosering waren de belangrijkste circulerende metabolieten de 10-N-glucuronide, aanwezig in steady state bij 44% van de concentratie van olanzapine, en 4´-N-desmethylolanzapine, aanwezig in steady state bij 31% van de concentratie van olanzapine . Beide metabolieten missen farmacologische activiteit bij de waargenomen concentraties.
Directe glucuronidering en door cytochroom P450 (CYP) gemedieerde oxidatie zijn de primaire metabole routes voor olanzapine. In vitro-onderzoeken suggereren dat CYP's 1A2 en 2D6 en het flavinebevattende mono-oxygenasesysteem betrokken zijn bij de oxidatie van olanzapine. Door CYP2D6 gemedieerde oxidatie lijkt in vivo een minder belangrijke metabole route te zijn, omdat de klaring van olanzapine niet wordt verminderd bij personen met een tekort aan dit enzym.
Intramusculaire toediening
ZYPREXA IntraMuscular resulteert in snelle absorptie met piekplasmaconcentraties die optreden binnen 15 tot 45 minuten. Op basis van een farmacokinetisch onderzoek bij gezonde vrijwilligers produceert een dosis van 5 mg intramusculair olanzapine voor injectie gemiddeld een maximale plasmaconcentratie die ongeveer 5 keer hoger is dan de maximale plasmaconcentratie die wordt geproduceerd door een dosis van 5 mg oraal olanzapine. De oppervlakte onder de curve die wordt bereikt na een intramusculaire dosis is vergelijkbaar met de oppervlakte die wordt bereikt na orale toediening van dezelfde dosis. De halfwaardetijd die wordt waargenomen na intramusculaire toediening is vergelijkbaar met de halfwaardetijd die wordt waargenomen na orale toediening. De farmacokinetiek is lineair over het klinische doseringsbereik. Metabolische profielen na intramusculaire toediening zijn kwalitatief gelijk aan metabole profielen na orale toediening.
Specifieke populaties
Nierfunctiestoornis
Omdat olanzapine vóór excretie sterk wordt gemetaboliseerd en slechts 7% van het geneesmiddel onveranderd wordt uitgescheiden, is het onwaarschijnlijk dat nierdisfunctie alleen een grote invloed heeft op de farmacokinetiek van olanzapine. De farmacokinetische kenmerken van olanzapine waren vergelijkbaar bij patiënten met ernstige nierinsufficiëntie en normale proefpersonen, wat aangeeft dat dosisaanpassing op basis van de mate van nierinsufficiëntie niet nodig is. Bovendien wordt olanzapine niet verwijderd door dialyse. Het effect van nierinsufficiëntie op de eliminatie van metabolieten is niet onderzocht.
Leverfunctiestoornis
Hoewel kan worden verwacht dat de aanwezigheid van een leverfunctiestoornis de klaring van olanzapine vermindert, toonde een onderzoek naar het effect van een gestoorde leverfunctie bij proefpersonen (n=6) met klinisch significante cirrose (Childs-Pugh-classificatie A en B) weinig effect op de farmacokinetiek aan. van olanzapine.
geriatrische
In een onderzoek onder 24 gezonde proefpersonen was de gemiddelde eliminatiehalfwaardetijd van olanzapine ongeveer 1,5 keer langer bij ouderen (≥65 jaar) dan bij niet-oudere proefpersonen ( DOSERING EN ADMINISTRATIE ].
Geslacht
De klaring van olanzapine is ongeveer 30% lager bij vrouwen dan bij mannen. Er waren echter geen duidelijke verschillen tussen mannen en vrouwen in effectiviteit of bijwerkingen. Doseringsaanpassingen op basis van geslacht zouden niet nodig moeten zijn.
Rookstatus
De klaring van olanzapine is ongeveer 40% hoger bij rokers dan bij niet-rokers, hoewel dosisaanpassingen niet routinematig worden aanbevolen.
Ras
In-vivo-onderzoeken hebben aangetoond dat de blootstellingen vergelijkbaar zijn bij Japanners, Chinezen en Kaukasiërs, vooral na normalisatie voor verschillen in lichaamsgewicht. Doseringsaanpassingen voor ras worden daarom niet aanbevolen.
Gecombineerde effecten
De gecombineerde effecten van leeftijd, roken en geslacht kunnen leiden tot aanzienlijke farmacokinetische verschillen in populaties. De klaring bij jonge rokende mannen kan bijvoorbeeld 3 keer hoger zijn dan die bij oudere niet-rokende vrouwen. Aanpassing van de dosering kan nodig zijn bij patiënten die een combinatie van factoren vertonen die kunnen leiden tot een langzamer metabolisme van olanzapine [zie DOSERING EN ADMINISTRATIE ].
Adolescenten (leeftijd 13 tot 17 jaar)
In klinische onderzoeken waren de meeste adolescenten niet-rokers en deze populatie had een lager gemiddeld lichaamsgewicht, wat resulteerde in een hogere gemiddelde blootstelling aan olanzapine in vergelijking met volwassenen.
Dierlijke toxicologie en/of farmacologie
In dierstudies met olanzapine waren de belangrijkste hematologische bevindingen reversibele perifere cytopenieën bij individuele honden die werden gedoseerd met 10 mg/kg (17 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak), dosisgerelateerde verlagingen van lymfocyten en neutrofielen bij muizen en lymfopenie bij ratten. Enkele honden die werden behandeld met 10 mg/kg ontwikkelden reversibele neutropenie en/of reversibele hemolytische anemie tussen 1 en 10 maanden behandeling. Dosisgerelateerde verlagingen van lymfocyten en neutrofielen werden waargenomen bij muizen die doses van 10 mg/kg kregen (gelijk aan 2 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak) in onderzoeken met een duur van 3 maanden. Niet-specifieke lymfopenie, consistent met verminderde lichaamsgewichtstoename, trad op bij ratten die 22,5 mg/kg kregen (11 maal de dagelijkse orale MRHD op basis van mg/m² lichaamsoppervlak) gedurende 3 maanden of 16 mg/kg (8 maal de dagelijkse orale MRHD op basis van op mg/m² lichaamsoppervlak) gedurende 6 of 12 maanden. Bij geen van de onderzochte soorten werd bewijs van beenmergcytotoxiciteit gevonden. Beenmerg was normocellulair of hypercellulair, wat aangeeft dat de afname van circulerende bloedcellen waarschijnlijk te wijten was aan perifere (niet-merg) factoren.
Klinische studies
Als u ZYPREXA 7,5 mg en fluoxetine in combinatie gebruikt, raadpleeg dan ook het gedeelte Klinische onderzoeken van de bijsluiter van Symbyax.
Schizofrenie
volwassenen
De werkzaamheid van oraal olanzapine bij de behandeling van schizofrenie werd vastgesteld in 2 kortdurende (6 weken) gecontroleerde onderzoeken met volwassen opgenomen patiënten die voldeden aan de DSM III-R-criteria voor schizofrenie. Een enkele haloperidol-arm werd opgenomen als vergelijkende behandeling in 1 van de 2 onderzoeken, maar in dit onderzoek werden deze 2 geneesmiddelen niet vergeleken voor het volledige bereik van klinisch relevante doses voor beide.
In deze onderzoeken werden verschillende instrumenten gebruikt voor het beoordelen van psychiatrische tekenen en symptomen, waaronder de Brief Psychiatric Rating Scale (BPRS), een multi-iteminventarisatie van algemene psychopathologie die traditioneel wordt gebruikt om de effecten van medicamenteuze behandeling bij schizofrenie te evalueren. Het BPRS-psychosecluster (conceptuele desorganisatie, hallucinerend gedrag, achterdocht en ongebruikelijke gedachteninhoud) wordt als een bijzonder nuttige subgroep beschouwd voor het beoordelen van actief psychotische schizofrene patiënten. Een tweede traditionele beoordeling, de Clinical Global Impression (CGI), weerspiegelt de indruk van een ervaren waarnemer, volledig bekend met de manifestaties van schizofrenie, over de algehele klinische toestand van de patiënt. Daarnaast werden 2 meer recent ontwikkelde schalen gebruikt; deze omvatten de 30-item Positieve en Negatieve Symptomen Schaal (PANSS), waarin de 18 items van de BPRS zijn ingebed, en de Schaal voor het Beoordelen van Negatieve Symptomen (SANS). De onderzoekssamenvattingen hieronder richten zich op de volgende uitkomsten: PANSS-totaal en/of BPRS-totaal; BPRS-psychosecluster; PANSS negatieve subschaal of SANS; en CGI-ernst. De resultaten van de proeven volgen:
(1) In een 6 weken durende, placebogecontroleerde studie (n=149) met 2 vaste olanzapinedoses van 1 en 10 mg/dag (eenmaal daags schema), olanzapine, van 10 mg/dag (maar niet met 1 mg/dag). dag), was superieur aan placebo op de PANSS-totaalscore (ook op het geëxtraheerde BPRS-totaal), op het BPRS-psychosecluster, op de PANSS-negatieve subschaal en op CGI-ernst.
(2) In een 6 weken durende, placebogecontroleerde studie (n=253) met 3 vaste dosisbereiken van olanzapine (5 ± 2,5 mg/dag, 10 ± 2,5 mg/dag en 15 ± 2,5 mg/dag) op een eenmaal daags waren de 2 hoogste olanzapine-dosisgroepen (werkelijke gemiddelde doses van respectievelijk 12 en 16 mg/dag) superieur aan placebo op de totale BPRS-score, de BPRS-psychosecluster en de CGI-ernstscore; de hoogste olanzapine-dosisgroep was superieur aan placebo op de SANS. Er was geen duidelijk voordeel voor de groep met een hoge dosis ten opzichte van de groep met een gemiddelde dosis.
(3) In een onderzoek op langere termijn werden volwassen poliklinische patiënten (n=326) die voornamelijk voldeden aan de DSM-IV-criteria voor schizofrenie en die gedurende ten minste 8 weken stabiel bleven op olanzapine tijdens open-label behandeling, gerandomiseerd naar voortzetting van hun huidige olanzapine. doses (variërend van 10 tot 20 mg/dag) of op placebo. De follow-upperiode om patiënten te observeren voor terugval, gedefinieerd in termen van toename van BPRS-positieve symptomen of ziekenhuisopname, was gepland voor 12 maanden, maar er werd voldaan aan de criteria om de studie vroegtijdig te stoppen vanwege een overmaat aan placebo-recidieven vergeleken met olanzapine-recidives , en olanzapine was superieur aan placebo op tijd tot terugval, de primaire uitkomst van deze studie. Zo was olanzapine werkzamer dan placebo bij het handhaven van de werkzaamheid bij patiënten die gedurende ongeveer 8 weken gestabiliseerd waren en gedurende een observatieperiode van maximaal 8 maanden werden gevolgd.
Onderzoek van populatiesubsets (ras en geslacht) bracht geen differentiële responsiviteit aan het licht op basis van deze subgroepen.
adolescenten
De werkzaamheid van oraal olanzapine bij de acute behandeling van schizofrenie bij adolescenten (in de leeftijd van 13 tot 17 jaar) werd vastgesteld in een 6 weken durende dubbelblinde, placebogecontroleerde, gerandomiseerde studie bij opgenomen en poliklinische patiënten met schizofrenie (n=107) die een diagnostische criteria volgens DSM-IV-TR en bevestigd door het Kiddie Schedule for Affective Disorders and Schizophrenia for School Aged Children-Present and Lifetime Version (K-SADS-PL).
Het primaire beoordelingsinstrument dat werd gebruikt voor het beoordelen van psychiatrische tekenen en symptomen in dit onderzoek was de totale score van de verankerde versie van de Brief Psychiatric Rating Scale for Children (BPRS-C).
In dit onderzoek met flexibele doses was olanzapine 2,5 tot 20 mg/dag (gemiddelde modale dosis 12,5 mg/dag, gemiddelde dosis 11,1 mg/dag) effectiever dan placebo bij de behandeling van adolescenten met de diagnose schizofrenie, zoals ondersteund door de statistisch significant grotere gemiddelde afname van de totale BPRS-C-score voor patiënten in de olanzapine-behandelingsgroep dan in de placebogroep.
Hoewel er geen bewijsmateriaal beschikbaar is om de vraag te beantwoorden hoe lang de adolescente patiënt die met ZYPREXA wordt behandeld, moet worden gehandhaafd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van olanzapine bij volwassen en adolescente patiënten. Over het algemeen wordt aanbevolen om patiënten die reageren voort te zetten na de acute respons, maar met de laagste dosis die nodig is om remissie te behouden. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Bipolaire I-stoornis (manische of gemengde afleveringen)
volwassenen
Monotherapie
De werkzaamheid van oraal olanzapine bij de behandeling van manische of gemengde episodes werd vastgesteld in 2 kortdurende (een 3 weken durende en een 4 weken durende) placebogecontroleerde onderzoeken bij volwassen patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis met manische of gemengde episodes. Deze onderzoeken omvatten patiënten met of zonder psychotische kenmerken en met of zonder een snelle cyclus.
Het primaire beoordelingsinstrument dat werd gebruikt voor het beoordelen van manische symptomen in deze onderzoeken was de Young Mania Rating Scale (Y-MRS), een door clinici beoordeelde schaal met 11 items die traditioneel wordt gebruikt om de mate van manische symptomatologie te beoordelen (prikkelbaarheid, storend/agressief gedrag, slaap , verhoogde stemming, spraak, verhoogde activiteit, seksuele interesse, taal-/denkstoornis, gedachte-inhoud, uiterlijk en inzicht) in een bereik van 0 (geen manische kenmerken) tot 60 Â (maximale score). De primaire uitkomstmaat in deze onderzoeken was verandering ten opzichte van baseline in de Y-MRS-totaalscore. De resultaten van de proeven volgen:
(1) In één 3 weken durende placebogecontroleerde studie (n=67) waarbij een doseringsbereik van olanzapine (5-20 mg/dag, eenmaal daags, beginnend met 10 mg/dag) was betrokken, was olanzapine superieur aan placebo in de verlaging van de Y-MRS-totaalscore. In een identiek opgezet onderzoek dat gelijktijdig met het eerste onderzoek werd uitgevoerd, vertoonde olanzapine een vergelijkbaar behandelingsverschil, maar mogelijk vanwege de steekproefomvang en de variabiliteit van de plaats, werd niet aangetoond dat het bij deze uitkomst superieur was aan placebo.
(2) In een 4 weken durende placebogecontroleerde studie (n=115), waarbij een doseringsbereik van olanzapine (5-20 mg/dag, eenmaal daags, beginnend met 15 mg/dag) was betrokken, was olanzapine superieur aan placebo in de verlaging van de Y-MRS-totaalscore.
(3) In een ander onderzoek waren 361 patiënten die voldeden aan de DSM-IV-criteria voor een manische of gemengde episode van bipolaire I-stoornis en die tijdens een initiële open-label behandelingsfase gemiddeld ongeveer 2 weken reageerden op olanzapine 5 tot 20 mg/ dag werden gerandomiseerd naar voortzetting van olanzapine in dezelfde dosis (n=225) of naar placebo (n=136), voor observatie van terugval. Ongeveer 50% van de patiënten was gestopt met de olanzapinegroep op dag 59 en 50% van de placebogroep was gestopt op dag 23 van de dubbelblinde behandeling. De respons tijdens de open-labelfase werd gedefinieerd door een verlaging van de Y-MRS-totaalscore tot ≤12 en HAM-D 21 tot ≤8. Terugval tijdens de dubbelblinde fase werd gedefinieerd als een verhoging van de Y-MRS- of HAM-D 21-totaalscore tot ≥ 15, of ziekenhuisopname vanwege manie of depressie. In de gerandomiseerde fase hadden patiënten die olanzapine kregen een significant langere tijd tot terugval.
Aanvulling op lithium of valproaat
De werkzaamheid van oraal olanzapine met gelijktijdig gebruik van lithium of valproaat bij de behandeling van manische of gemengde episodes werd vastgesteld in 2 gecontroleerde onderzoeken bij patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis met manische of gemengde episodes. Deze onderzoeken omvatten patiënten met of zonder psychotische kenmerken en met of zonder een snelle cyclus. De resultaten van de proeven volgen:
(1) In één placebogecontroleerd combinatieonderzoek van 6 weken werden 175 poliklinische patiënten die lithium- of valproaattherapie kregen met onvoldoende gecontroleerde manische of gemengde symptomen (Y-MRS ≥16) gerandomiseerd om ofwel olanzapine ofwel placebo te krijgen, in combinatie met hun oorspronkelijke therapie. . Olanzapine (in een doseringsbereik van 5-20 mg/dag, eenmaal daags, beginnend met 10 mg/dag) gecombineerd met lithium of valproaat (in een therapeutisch bereik van 0,6 mEq/L tot 1,2 mEq/L of 50 μg/ml tot 125 g/ml) was superieur aan alleen lithium of valproaat in de verlaging van de totale Y-MRS-score.
(2) In een tweede 6 weken durende placebogecontroleerde combinatiestudie werden 169 poliklinische patiënten op lithium- of valproaattherapie met onvoldoende gecontroleerde manische of gemengde symptomen (Y-MRS ≥ 16) gerandomiseerd om ofwel olanzapine ofwel placebo te krijgen, in combinatie met hun oorspronkelijke therapie. Olanzapine (in een doseringsbereik van 5-20 mg/dag, eenmaal daags, beginnend met 10 mg/dag) gecombineerd met lithium of valproaat (in een therapeutisch bereik van 0,6 mEq/L tot 1,2 mEq/L of 50 μg/ml tot 125 g/ml) was superieur aan alleen lithium of valproaat in de verlaging van de totale Y-MRS-score.
adolescenten
Acute monotherapie
De werkzaamheid van oraal olanzapine bij de behandeling van acute manische of gemengde episoden bij adolescenten (in de leeftijd van 13 tot 17 jaar) werd vastgesteld in een 3 weken durende, dubbelblinde, placebogecontroleerde, gerandomiseerde studie bij adolescente intramurale en poliklinische patiënten die voldeden aan de diagnostische criteria voor manische of gemengde episodes geassocieerd met bipolaire I-stoornis (met of zonder psychotische kenmerken) volgens de DSM-IV-TR (n=161). De diagnose werd bevestigd door de K-SADS-PL.
Het primaire beoordelingsinstrument dat werd gebruikt voor het beoordelen van manische symptomen in dit onderzoek was de totale score van de Adolescent Structured Young-Mania Rating Scale (Y-MRS).
In dit onderzoek met flexibele doses was olanzapine 2,5 tot 20 mg/dag (gemiddelde modale dosis 10,7 mg/dag, gemiddelde dosis 8,9 mg/dag) effectiever dan placebo bij de behandeling van adolescenten met manische of gemengde episodes geassocieerd met bipolaire I. stoornis, zoals ondersteund door de statistisch significant grotere gemiddelde verlaging van de Y-MRS-totaalscore voor patiënten in de olanzapine-behandelingsgroep dan in de placebogroep.
Hoewel er geen bewijsmateriaal beschikbaar is om de vraag te beantwoorden hoe lang de adolescente patiënt die met ZYPREXA wordt behandeld, moet worden gehandhaafd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van olanzapine bij volwassen en adolescente patiënten. Over het algemeen wordt aanbevolen om patiënten die reageren voort te zetten na de acute respons, maar met de laagste dosis die nodig is om remissie te behouden. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Agitatie geassocieerd met schizofrenie en bipolaire I-manie
De werkzaamheid van intramusculair olanzapine voor injectie voor de behandeling van agitatie werd vastgesteld in 3 kortdurende (24 uur IM-behandeling) placebogecontroleerde onderzoeken bij geagiteerde volwassen opgenomen patiënten uit 2 diagnostische groepen: schizofrenie en bipolaire I-stoornis (manische of gemengde episodes) . Elk van de onderzoeken omvatte een enkele actieve vergelijkende behandelingsarm van ofwel haloperidol-injectie (schizofrenie-onderzoeken) of lorazepam-injectie (bipolaire I-manie-onderzoek). Patiënten die deelnamen aan de onderzoeken moesten: (1) door de klinische onderzoekers worden beoordeeld als klinisch geagiteerd en klinisch geschikte kandidaten voor behandeling met intramusculaire medicatie, en (2) een agitatieniveau vertonen dat een drempelscore van ≥14 bereikte of overschreed op de 5 items bestaande uit de Positieve en Negatieve Syndroomschaal (PANSS) Opgewonden Component (dwz slechte impulsbeheersing, spanning, vijandigheid, weigering en opwinding) met ten minste 1 individueel item score ≥4 met behulp van een 1-7 scoresysteem (1= afwezig, 4=matig, 7=extreem). In de onderzoeken was de gemiddelde PANSS Excited Component-score bij aanvang 18,4, met scores variërend van 13 tot 32 (van een maximale score van 35), wat duidt op overwegend matige niveaus van agitatie, waarbij sommige patiënten milde of ernstige agitatie ervaren. De primaire werkzaamheidsmaatstaf die werd gebruikt voor het beoordelen van tekenen en symptomen van agitatie in deze onderzoeken was de verandering ten opzichte van de uitgangswaarde in de PANSS-opgewonden component 2 uur na injectie. Patiënten konden tijdens de IM-behandelingsperioden van 24 uur maximaal 3 injecties krijgen; patiënten konden de tweede injectie echter pas krijgen na de eerste periode van 2 uur waarin de primaire werkzaamheidsmeting werd beoordeeld. De resultaten van de proeven volgen:
(1) In een placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voldeden aan de DSM-IV-criteria voor schizofrenie (n=270), werden 4 vaste intramusculaire olanzapine voor injectiedoses van 2,5 mg, 5 mg, 7,5 mg en 10 mg geëvalueerd. Alle doses waren statistisch superieur aan placebo op de PANSS Excited Component 2 uur na injectie. Het effect was echter groter en consistenter voor de 3 hoogste doses. Er waren geen significante paarsgewijze verschillen voor de doses van 7,5 en 10 mg ten opzichte van de dosis van 5 mg.
(2) In een tweede placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voldeden aan de DSM-IV-criteria voor schizofrenie (n=311), werd 1 vaste intramusculaire olanzapine voor injectiedosis van 10 mg geëvalueerd. Olanzapine voor injectie was statistisch superieur aan placebo op de PANSS Excited Component 2 uur na injectie.
(3) In een placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voldoen aan de DSM-IV-criteria voor bipolaire I-stoornis (en momenteel een acute manische of gemengde episode met of zonder psychotische kenmerken vertonen) (n=201), 1 vaste intramusculaire dosis olanzapine voor injectie van 10 mg werd geëvalueerd. Olanzapine voor injectie was statistisch superieur aan placebo op de PANSS Excited Component 2 uur na injectie.
Onderzoek van populatiesubsets (leeftijd, ras en geslacht) bracht geen differentiële responsiviteit aan het licht op basis van deze subgroepen.
PATIËNT INFORMATIE
ZYPREXA® (zy-PREX-a) (olanzapine) Tablet
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olanzapine) Tablet, oraal desintegrerend
Lees de medicatiehandleiding die bij ZYPREXA wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze medicatiehandleiding vervangt niet het praten met uw arts over uw medische toestand of behandeling. Praat met uw arts of apotheker als u iets niet begrijpt of als u meer wilt weten over ZYPREXA.
Wat is de belangrijkste informatie die ik over ZYPREXA moet weten?
ZYPREXA 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
Deze ernstige bijwerkingen worden hieronder beschreven.
1. Verhoogd risico op overlijden bij ouderen die verward zijn, geheugenverlies hebben en het contact met de realiteit hebben verloren (dementiegerelateerde psychose). ZYPREXA is niet goedgekeurd voor de behandeling van psychose bij ouderen met dementie.
2. Hoge bloedsuikerspiegel (hyperglykemie). Een hoge bloedsuikerspiegel kan optreden als u al diabetes heeft of als u nog nooit diabetes heeft gehad. Een hoge bloedsuikerspiegel kan leiden tot:
- een ophoping van zuur in uw bloed als gevolg van ketonen (ketoacidose)
- coma
- dood
Uw arts moet tests doen om uw bloedsuikerspiegel te controleren voordat u begint met het innemen van ZYPREXA 7,5 mg en tijdens de behandeling. Bij mensen die geen diabetes hebben, verdwijnt soms een hoge bloedsuikerspiegel wanneer ZYPREXA 7,5 mg wordt stopgezet. Mensen met diabetes en sommige mensen die geen diabetes hadden voordat ze ZYPREXA gebruikten, moeten medicijnen tegen een hoge bloedsuikerspiegel gebruiken, zelfs nadat ze zijn gestopt met het gebruik van ZYPREXA.
Als u diabetes heeft, volg dan de instructies van uw arts over hoe vaak u uw bloedsuikerspiegel moet controleren terwijl u ZYPREXA gebruikt.
Bel je dokter als u een van deze symptomen van een hoge bloedsuikerspiegel (hyperglykemie) heeft tijdens het gebruik van ZYPREXA:
- erg dorstig voelen
- meer moet plassen dan normaal
- voel me erg hongerig
- zich zwak of moe voelen
- misselijk worden in je maag
- zich verward voelen of je adem fruitig ruikt
3. Hoge vetgehaltes in uw bloed (cholesterol en triglyceriden). Hoge vetgehaltes kunnen optreden bij mensen die behandeld worden met ZYPREXA 10 mg, vooral bij tieners (13 tot 17 jaar oud), of bij gebruik in combinatie met fluoxetine bij kinderen (10 tot 17 jaar oud). Het kan zijn dat u geen symptomen heeft, dus uw arts moet bloedonderzoek doen om uw cholesterol- en triglyceridenspiegels te controleren voordat u begint met het gebruik van ZYPREXA en tijdens de behandeling.
4. Gewichtstoename. Gewichtstoename komt zeer vaak voor bij mensen die ZYPREXA gebruiken. Tieners (13 tot 17 jaar oud) hebben meer kans om aan te komen en meer aan te komen dan volwassenen. Kinderen (10 tot 17 jaar oud) hebben ook meer kans op gewichtstoename en meer gewicht dan volwassenen wanneer ZYPREXA 7,5 mg wordt gebruikt in combinatie met fluoxetine. Sommige mensen kunnen veel aankomen tijdens het gebruik van ZYPREXA, dus u en uw arts moeten uw gewicht regelmatig controleren. Praat met uw arts over manieren om gewichtstoename onder controle te houden, zoals het eten van een gezond, uitgebalanceerd dieet en lichaamsbeweging.
Wat is ZYPREXA?
ZYPREXA is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van:
- schizofrenie bij mensen van 13 jaar of ouder.
- bipolaire stoornis, waaronder:
- manische of gemengde episodes die optreden bij een bipolaire I-stoornis bij mensen van 13 jaar of ouder.
- manische of gemengde episodes die optreden bij bipolaire I-stoornis, bij gebruik in combinatie met het geneesmiddel lithium of valproaat, bij volwassenen.
- langdurige behandeling van bipolaire I-stoornis bij volwassenen.
- episoden van depressie die optreden bij bipolaire I-stoornis, bij gebruik in combinatie met het geneesmiddel fluoxetine (Prozac®) bij mensen van 10 jaar of ouder.
- depressies die niet beter worden na 2 andere geneesmiddelen, ook wel therapieresistente depressie genoemd, bij gebruik in combinatie met het geneesmiddel fluoxetine (Prozac), bij volwassenen.
ZYPREXA 7,5 mg is niet goedgekeurd voor gebruik bij kinderen jonger dan 13 jaar. ZYPREXA 10 mg in combinatie met fluoxetine is niet goedgekeurd voor gebruik bij kinderen jonger dan 10 jaar.
De symptomen van schizofrenie zijn onder meer stemmen horen, dingen zien die er niet zijn, overtuigingen hebben die niet waar zijn en achterdochtig of teruggetrokken zijn.
De symptomen van bipolaire I-stoornis zijn onder meer afwisselende perioden van depressie en een hoge of prikkelbare stemming, verhoogde activiteit en rusteloosheid, snelle gedachten, snel praten, impulsief gedrag en een verminderde behoefte aan slaap.
De symptomen van therapieresistente depressie omvatten verminderde stemming, verminderde interesse, toegenomen schuldgevoelens, verminderde energie, verminderde concentratie, veranderingen in eetlust en zelfmoordgedachten of zelfmoordgedrag.
Sommige van uw symptomen kunnen met de behandeling verbeteren. Als u denkt dat u niet beter wordt, neem dan contact op met uw arts.
Wat moet ik mijn arts vertellen voordat ik ZYPREXA inneem?
ZYPREXA is misschien niet geschikt voor u. Vertel uw arts voordat u met ZYPREXA begint als u:
- hart problemen
- toevallen
- diabetes of hoge bloedsuikerspiegels (hyperglykemie)
- hoog cholesterol- of triglyceridengehalte in uw bloed
- leverproblemen
- lage of hoge bloeddruk
- beroertes of "mini-beroertes", ook wel transiënte ischemische aanvallen (TIA's) genoemd
- de ziekte van Alzheimer
- nauwe-kamerhoekglaucoom
- vergrote prostaat bij mannen
- darmobstructie
- fenylketonurie, omdat ZYPREXA 5 mg ZYDIS fenylalanine bevat
- borstkanker
- gedachten aan zelfmoord of jezelf pijn doen
- een andere medische aandoening
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of ZYPREXA 2,5 mg schadelijk is voor uw ongeboren baby.
- Als u zwanger wordt terwijl u ZYPREXA 20 mg krijgt, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Atypische Antipsychotica. U kunt zich registreren door te bellen naar 1-866-961-2388 of naar http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/ te gaan.
- borstvoeding geeft of van plan bent borstvoeding te geven. ZYPREXA gaat over in uw moedermelk. Praat met uw arts over de beste manier om uw baby te voeden als u ZYPREXA gebruikt.
Vertel het uw arts als u veel sport of vaak op warme plaatsen bent.
De symptomen van bipolaire I-stoornis, therapieresistente depressie of schizofrenie kunnen zijn: gedachten aan zelfmoord of jezelf of anderen pijn te doen. Als u deze gedachten op enig moment heeft, vertel dit dan aan uw arts of ga meteen naar de eerste hulp.
Vertel uw arts over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. ZYPREXA 20 mg en sommige geneesmiddelen kunnen met elkaar interageren en werken mogelijk niet zo goed, of veroorzaken mogelijk ernstige bijwerkingen. Uw arts kan u vertellen of het veilig is om ZYPREXA samen met uw andere geneesmiddelen in te nemen. Start of stop geen geneesmiddel terwijl u ZYPREXA gebruikt zonder eerst met uw arts te overleggen.
Hoe moet ik ZYPREXA 7,5 mg innemen?
- Neem ZYPREXA precies zoals voorgeschreven. Het kan nodig zijn dat uw arts de dosis ZYPREXA 15 mg verandert (aanpast) totdat deze geschikt voor u is.
- Als u een dosis ZYPREXA 20 mg bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan gewoon de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem geen twee doses ZYPREXA 10 mg tegelijk in.
- Om ernstige bijwerkingen te voorkomen, mag u niet plotseling stoppen met het gebruik van ZYPREXA. Als u moet stoppen met het gebruik van ZYPREXA, kan uw arts u vertellen hoe u veilig kunt stoppen met het gebruik ervan.
- Als u te veel ZYPREXA heeft ingenomen, bel dan onmiddellijk uw arts of het antigifcentrum op 1-800-222-1222 of vraag een spoedbehandeling.
- ZYPREXA 10 mg kan met of zonder voedsel worden ingenomen.
- ZYPREXA wordt gewoonlijk één keer per dag ingenomen.
- Neem ZYPREXA 20 mg ZYDIS als volgt in:
- Zorg ervoor dat uw handen droog zijn.
- Open het sachet en verwijder de folie van de blisterverpakking. Duw de tablet niet door de folie.
- Zodra u de blisterverpakking opent, verwijdert u de tablet en stopt u deze in uw mond.
- De tablet valt snel uiteen in uw speeksel, zodat u deze gemakkelijk kunt doorslikken met of zonder drinkvloeistof.
- Neem contact op met uw arts als u denkt dat u niet beter wordt of als u zich zorgen maakt over uw toestand terwijl u ZYPREXA gebruikt.
Wat moet ik vermijden tijdens het gebruik van ZYPREXA?
- ZYPREXA kan slaperigheid veroorzaken en kan uw vermogen om beslissingen te nemen, helder te denken of snel te reageren beïnvloeden. U mag niet autorijden, zware machines bedienen of andere gevaarlijke activiteiten ondernemen totdat u weet welke invloed ZYPREXA 7,5 mg op u heeft.
- Vermijd het drinken van alcohol tijdens het gebruik van ZYPREXA. Als u alcohol drinkt terwijl u ZYPREXA gebruikt, kunt u slaperiger worden dan wanneer u alleen ZYPREXA 15 mg inneemt.
Wat zijn de mogelijke bijwerkingen van ZYPREXA 5 mg?
Er kunnen ernstige bijwerkingen optreden als u ZYPREXA 5 mg gebruikt, waaronder:
- Zie "Wat is de belangrijkste informatie die ik moet weten over ZYPREXA?", waarin het verhoogde risico op overlijden wordt beschreven bij ouderen met aan dementie gerelateerde psychose en de risico's van een hoge bloedsuikerspiegel, hoge cholesterol- en triglyceridenspiegels en gewichtstoename.
- Verhoogde incidentie van beroerte of "mini-beroertes", transient ischemic attacks (TIA's) genoemd, bij ouderen met aan dementie gerelateerde psychose (ouderen die het contact met de realiteit hebben verloren door verwarring en geheugenverlies). ZYPREXA is niet goedgekeurd voor deze patiënten.
- Maligne neurolepticasyndroom (MNS): MNS is een zeldzame maar zeer ernstige aandoening die kan optreden bij mensen die antipsychotica gebruiken, waaronder ZYPREXA. NMS kan de dood veroorzaken en moet in een ziekenhuis worden behandeld. Bel onmiddellijk uw arts als u ernstig ziek wordt en een van deze symptomen heeft:
- hoge koorts
- overmatig zweten
- stijve spieren
- verwardheid
- veranderingen in uw ademhaling, hartslag en bloeddruk.
- Geneesmiddelreactie met eosinofilie en systemische symptomen (JURK): DRESS kan optreden bij ZYPREXA. Kenmerken van DRESS kunnen zijn: huiduitslag, koorts, gezwollen klieren en andere interne organen zoals lever, nieren, longen en hart. JURK is soms dodelijk; vertel het daarom onmiddellijk aan uw arts als u een van deze symptomen ervaart.
- Tardieve dyskinesie: Deze aandoening veroorzaakt lichaamsbewegingen die blijven plaatsvinden en die u niet kunt beheersen. Deze bewegingen hebben meestal invloed op het gezicht en de tong. Tardieve dyskinesie verdwijnt mogelijk niet, zelfs niet als u stopt met het gebruik van ZYPREXA. Het kan ook beginnen nadat u bent gestopt met het innemen van ZYPREXA. Vertel het uw arts als u lichaamsbewegingen krijgt die u niet kunt beheersen.
- Verlaagde bloeddruk wanneer u van houding verandert, met symptomen van duizeligheid, snelle of langzame hartslag of flauwvallen.
- Moeite met slikken, waardoor voedsel of vloeistof in uw longen kan komen.
- Toevallen: Vertel het uw arts als u een aanval krijgt tijdens de behandeling met ZYPREXA.
- Problemen met de controle van de lichaamstemperatuur: U kunt het erg warm krijgen, bijvoorbeeld als u veel sport of als u in een zeer warme ruimte verblijft. Het is belangrijk dat u water drinkt om uitdroging te voorkomen. Bel onmiddellijk uw arts als u ernstig ziek wordt en een van deze symptomen van uitdroging heeft:
- te veel of helemaal niet zweten
- droge mond
- erg warm voelen
- dorst hebben
- geen urine kunnen produceren.
Vaak voorkomende bijwerkingen van ZYPREXA zijn: gebrek aan energie, droge mond, verhoogde eetlust, slaperigheid, tremor (schudden), harde of onregelmatige ontlasting, duizeligheid, gedragsveranderingen of rusteloosheid.
Andere vaak voorkomende bijwerkingen bij tieners (13-17 jaar oud) zijn onder meer: hoofdpijn, pijn in de maagstreek (buik), pijn in uw armen of benen, of vermoeidheid. Tieners ervoeren een grotere toename van prolactine, leverenzymen en slaperigheid in vergelijking met volwassenen.
Vertel uw arts over elke bijwerking die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van ZYPREXA. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik ZYPREXA bewaren?
- Bewaar ZYPREXA bij kamertemperatuur, tussen 20 °C en 25 °C (68 °F tot 77 °F).
- Houd ZYPREXA uit de buurt van licht.
- Houd ZYPREXA 15 mg droog en uit de buurt van vocht.
Houd ZYPREXA 5 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over ZYPREXA
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik ZYPREXA niet voor een aandoening waarvoor het niet is voorgeschreven. Geef ZYPREXA 5 mg niet aan andere mensen, ook niet als ze dezelfde aandoening hebben. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over ZYPREXA samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over ZYPREXA 20 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg. Voor meer informatie over ZYPREXA bel 1-800-Lilly-Rx (1-800-545-5979).
Wat zijn de ingrediënten in ZYPREXA?
Actief ingrediënt: olanzapine
Inactieve ingredienten:
carnaubawas, crospovidon, hydroxypropylcellulose, hypromellose, lactose, magnesiumstearaat, microkristallijne cellulose en andere inactieve ingrediënten. De kleurcoating bevat: Titanium Dioxide, FD&C Blue No. 2 Aluminium Lake, of Synthetic Red Iron Oxide.
ZYDIS- gelatine, mannitol, aspartaam, natriummethylparabeen en natriumpropylparabeen.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
