Effexor 37.5mg, 75mg Venlafaxine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
PATIËNT INFORMATIE
Effexor (venlafaxine) (ven-la-fax-een) Tabletten, USP
Lees de medicatiehandleiding die wordt geleverd met venlafaxine-tabletten, USP voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze medicatiehandleiding vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling. Praat met uw zorgverlener als u iets niet begrijpt of waar u meer over wilt weten.
Wat is de belangrijkste informatie die ik moet weten over Venlafaxine-tabletten, USP?
Venlafaxine-tabletten, USP en andere antidepressiva kunnen ernstige bijwerkingen veroorzaken, waaronder:
1. Suïcidale gedachten of acties:
- Venlafaxine-tabletten, USP en andere antidepressiva kunnen bij sommige kinderen, tieners of jonge volwassenen zelfmoordgedachten of -acties doen toenemen in de eerste paar maanden van de behandeling of wanneer de dosis wordt gewijzigd.
- Depressie of andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van suïcidale gedachten of acties.
- Let op deze veranderingen en bel onmiddellijk uw zorgverlener als u merkt:
- Nieuwe of plotselinge veranderingen in stemming, gedrag, acties, gedachten of gevoelens, vooral als ze ernstig zijn.
- Besteed bijzondere aandacht aan dergelijke veranderingen wanneer venlafaxinetabletten, USP wordt gestart of wanneer de dosis wordt gewijzigd.
Bewaar alle vervolgbezoeken bij uw zorgverlener en bel tussen bezoeken als u zich zorgen maakt over symptomen.
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 als zich een noodgeval voordoet, vooral als ze nieuw zijn, erger zijn of u zich zorgen maken:
- pogingen om zelfmoord te plegen
- handelen op gevaarlijke impulsen
- agressief of gewelddadig handelen
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere depressie
- nieuwe of ergere angst- of paniekaanvallen
- zich geagiteerd, rusteloos, boos of prikkelbaar voelen
- Moeite met slapen
- een toename in activiteit of meer praten dan normaal voor u is
- andere ongewone veranderingen in gedrag of stemming
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 in een noodgeval. Venlafaxine-tabletten, USP kunnen in verband worden gebracht met deze ernstige bijwerkingen:
2. Serotoninesyndroom
Deze aandoening kan levensbedreigend zijn en kan bestaan uit:
- agitatie, hallucinaties, coma of andere veranderingen in mentale toestand
- coördinatieproblemen of spiertrekkingen (overactieve reflexen)
- snelle hartslag, hoge of lage bloeddruk
- zweten of koorts
- misselijkheid, braken of diarree
- spierstijfheid
3. Veranderingen in bloeddruk. Venlafaxine-tabletten, USP kunnen:
- uw bloeddruk verhogen. Controleer hoge bloeddruk voordat u met de behandeling begint en controleer de bloeddruk regelmatig
4. Vergrote pupillen (mydriasis).
5. Angst en slapeloosheid.
6. Veranderingen in eetlust of gewicht.
- kinderen en adolescenten moeten tijdens de behandeling hun lengte en gewicht laten controleren
7. Manische/hypomanische episodes:
- sterk verhoogde energie
- ernstige slaapproblemen
- snelle gedachten
- roekeloos gedrag
- ongewoon grootse ideeën
- overmatig geluk of prikkelbaarheid
- meer of sneller praten dan normaal
8. Laag zoutgehalte (natrium) in het bloed.
Ouderen lopen hier mogelijk een groter risico op. Symptomen kunnen zijn:
- hoofdpijn
- zwakte of onvast gevoel
- verwarring, concentratie- of denkproblemen of geheugenproblemen
9. Toevallen of convulsies.
10. Abnormale bloeding: venlafaxine-tabletten, USP en andere antidepressiva kunnen het risico op bloedingen of blauwe plekken verhogen, vooral als u de bloedverdunner warfarine (Coumadin®, Jantoven®), een niet-steroïde anti-inflammatoir geneesmiddel (NSAID's, zoals ibuprofen of naproxen), of aspirine.
11. Verhoogd cholesterol.
12. Longziekte en longontsteking: venlafaxine tabletten, USP kan zeldzame longproblemen veroorzaken. Symptomen zijn onder meer:
- verergering van kortademigheid
- hoesten
- pijn op de borst
13. Ernstige allergische reacties:
- moeite met ademhalen
- zwelling van het gezicht, de tong, de ogen of de mond
- uitslag, jeukende striemen (netelroos) of blaren, alleen of met koorts of gewrichtspijn
14. Visuele problemen:
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
Stop niet met Venlafaxine Tabletten, USP zonder eerst met uw zorgverlener te overleggen. Te snel stoppen met venlafaxinetabletten, USP of te snel overstappen van een ander antidepressivum kan ernstige symptomen veroorzaken, waaronder:
- angst, prikkelbaarheid
- zich moe, rusteloos voelen of problemen met slapen
- hoofdpijn, zweten, duizeligheid
- elektrische schokachtige sensaties, beven, verwardheid, nachtmerries
- braken, misselijkheid, diarree
Wat is Venlafaxine-tabletten, USP?
Venlafaxine-tabletten, USP is een receptgeneesmiddel dat wordt gebruikt om depressie te behandelen. Het is belangrijk om met uw zorgverlener te praten over de risico's van het behandelen van depressie en ook de risico's van het niet behandelen ervan. U dient alle behandelkeuzes met uw zorgverlener te bespreken.
Neem contact op met uw zorgverlener als u denkt dat uw toestand niet beter wordt met venlafaxine-tabletten, USP-behandeling.
Wie mag Venlafaxine-tabletten, USP niet gebruiken?
- Neem geen venlafaxine-tabletten, USP als u:
- zijn allergisch voor venlafaxine-tabletten, USP of voor een van de ingrediënten in venlafaxine-tabletten, USP. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in venlafaxinetabletten, USP.
- ongecontroleerd nauwekamerhoekglaucoom hebben
- neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, inclusief het antibioticum linezolid.
- Neem geen MAO-remmer in binnen 7 dagen na het stoppen met venlafaxine-tabletten, USP, tenzij uw arts u heeft gevraagd dit te doen.
- Begin niet met venlafaxine-tabletten, USP als u de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw arts u heeft gevraagd dit te doen.
Mensen die Venlafaxine-tabletten, USP op tijd in de buurt van een MAO-remmer nemen, kunnen ernstige of zelfs levensbedreigende bijwerkingen krijgen. Roep meteen medische hulp in als u een van deze symptomen heeft:
- hoge koorts
- ongecontroleerde spierspasmen
- stijve spieren
- snelle veranderingen in hartslag of bloeddruk
- verwardheid
- bewustzijnsverlies (uitvallen)
Wat moet ik mijn zorgverlener vertellen voordat ik Venlafaxine-tabletten, USP, inneem? Vraag ernaar als je het niet zeker weet.
Voordat u met venlafaxine-tabletten, USP begint, moet u uw zorgverlener informeren als u:
- Gebruikt u bepaalde medicijnen, zoals:
- Geneesmiddelen die worden gebruikt om migrainehoofdpijn te behandelen, zoals:
- triptanen
- Geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, zoals:
- tricyclische antidepressiva
- lithium
- SSRI's
- SNRI's
- antipsychotica
- Geneesmiddelen die worden gebruikt om pijn te behandelen, zoals:
- tramadol
- Geneesmiddelen die worden gebruikt om uw bloed te verdunnen, zoals:
- warfarine
- Geneesmiddelen die worden gebruikt om brandend maagzuur te behandelen, zoals:
- cimetidine
- Zelfzorggeneesmiddelen of supplementen zoals:
- Aspirine of andere NSAID's
- Tryptofaan
- St. Janskruid
- hartproblemen hebben
- diabetes hebben
- leverproblemen hebben
- nierproblemen hebben
- schildklierproblemen hebben
- glaucoom hebben
- epileptische aanvallen of convulsies heeft of heeft gehad
- een bipolaire stoornis of manie hebben;
- een laag natriumgehalte in uw bloed heeft
- hoge bloeddruk hebben
- een hoog cholesterolgehalte hebben
- bloedingsproblemen heeft of heeft gehad
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of venlafaxine-tabletten, USP, schadelijk zijn voor uw ongeboren baby. Praat met uw zorgverlener over de voordelen en risico's van de behandeling van depressie tijdens de zwangerschap
- borstvoeding geeft of van plan bent borstvoeding te geven. Sommige venlafaxine-tabletten, USP kunnen in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens het gebruik van venlafaxine-tabletten, USP.
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Venlafaxine-tabletten, USP en sommige geneesmiddelen kunnen met elkaar interageren, werken mogelijk niet zo goed of kunnen ernstige bijwerkingen veroorzaken.
Uw zorgverlener of apotheker kan u vertellen of het veilig is om venlafaxine tabletten, USP, samen met uw andere geneesmiddelen in te nemen. Start of stop geen medicijnen tijdens het gebruik van venlafaxine-tabletten, USP zonder eerst met uw zorgverlener te overleggen.
Als u venlafaxine-tabletten, USP, gebruikt, mag u geen andere geneesmiddelen gebruiken die (venlafaxine) bevatten, waaronder: venlafaxine HCl.
Hoe moet ik Venlafaxine-tabletten, USP gebruiken?
- Neem venlafaxine-tabletten, USP precies zoals voorgeschreven. Uw zorgverlener moet mogelijk de dosis venlafaxine-tabletten, USP, wijzigen totdat dit de juiste dosis voor u is.
- Venlafaxine-tabletten, USP moeten met voedsel worden ingenomen.
- Als u een dosis venlafaxine-tabletten, USP, bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem niet tegelijkertijd twee doses venlafaxine-tabletten, USP.
- Als u te veel venlafaxine-tabletten, USP, heeft ingenomen, bel dan onmiddellijk uw zorgverlener of antigifcentrum of vraag een spoedbehandeling.
- Bij het overschakelen van een ander antidepressivum naar venlafaxine-tabletten, kan het zijn dat uw arts eerst de dosis van het initiële antidepressivum wil verlagen om bijwerkingen te voorkomen
Wat moet ik vermijden tijdens het gebruik van Venlafaxine-tabletten, USP?
Venlafaxine-tabletten, USP kunnen slaperigheid veroorzaken of uw vermogen om beslissingen te nemen, helder te denken of snel te reageren beïnvloeden.
mag niet autorijden, zware machines bedienen of andere gevaarlijke activiteiten doen totdat u weet welke invloed venlafaxine-tabletten, USP op u heeft. Drink geen alcohol tijdens het gebruik van venlafaxine-tabletten, USP.
Wat zijn de mogelijke bijwerkingen van Venlafaxine-tabletten, USP?
Venlafaxine-tabletten, USP kunnen ernstige bijwerkingen veroorzaken, waaronder:
- Zie "Wat is de belangrijkste informatie die ik moet weten over Venlafaxine-tabletten, USP?"
- Verhoogd cholesterol - laat uw cholesterol regelmatig controleren
- Pasgeborenen van wie de moeder venlafaxine-tabletten neemt, USP in het derde trimester, kunnen direct na de geboorte problemen hebben, waaronder:
- problemen met eten en ademen
- toevallen
- trillen, zenuwachtigheid of constant huilen
- Smallehoekglaucoom/vergrote pupillen.
Controleer regelmatig de oogdruk als u:
- een voorgeschiedenis heeft van verhoogde oogdruk
- lopen risico op bepaalde vormen van glaucoom
Vaak voorkomende mogelijke bijwerkingen bij mensen die venlafaxine-tabletten gebruiken, USP zijn:
ongebruikelijke dromen
- seksuele problemen
- verlies van eetlust, constipatie, diarree, misselijkheid of braken, of droge mond
- zich moe, vermoeid of overdreven slaperig voelen
- verandering in slaapgewoonten, slaapproblemen
- geeuwen
- trillen of trillen
- duizeligheid, wazig zien
- zweten
- zich angstig, nerveus of zenuwachtig voelen
- hoofdpijn
- verhoging van de hartslag
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van venlafaxine-tabletten, USP.
Vraag uw zorgverlener of apotheker om meer informatie.
BEL UW ARTS VOOR MEDISCH ADVIES OVER BIJWERKINGEN. U MAG BIJWERKINGEN MELDEN AAN DE FDA OP 1-800-FDA-1088.
Hoe moet ik Venlafaxine-tabletten, USP bewaren?
- Bewaren bij 20° tot 25°C (68° tot 77°F) excursies toegestaan 15° tot 30°C (59° tot 86°F) [Zie USP-gecontroleerde kamertemperatuur ].
- Bewaar velafaxine tabletten, USP op een droge plaats.
Houd Venlafaxine Tabletten, USP en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over venlafaxine tabletten, USP Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een Medicatiegids. Gebruik geen venlafaxine-tabletten, USP voor een aandoening waarvoor het niet is voorgeschreven. Geef venlafaxine-tabletten, USP niet aan andere mensen, ook niet als ze dezelfde aandoening hebben. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over venlafaxinetabletten, USP, samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over venlafaxine-tabletten, USP die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Neem contact op met Sun Pharmaceutical Industries, Inc. op 1-800-818-4555 om VERMOEDELIJKE BIJWERKINGEN te melden.
Wat zijn de ingrediënten in Venlafaxine-tabletten, USP?
Actief bestanddeel: (venlafaxine)
Inactieve ingredienten:
- Tabletten: microkristallijne cellulose, lactosemonohydraat, gepregelatiniseerd zetmeel, natriumzetmeelglycolaat, rood ijzeroxide, geel ijzeroxide, colloïdaal siliciumdioxide en magnesiumstearaat
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration voor alle antidepressiva.
INDICATIES
Ernstige depressieve stoornis
Effexor XR (venlafaxinehydrochloride) capsules met verlengde afgifte zijn geïndiceerd voor de behandeling van depressieve stoornis (MDD). De werkzaamheid werd vastgesteld in drie kortlopende (4, 8 en 12 weken) en twee langdurige onderhoudsonderzoeken.
Gegeneraliseerde angststoornis
Effexor XR is geïndiceerd voor de behandeling van gegeneraliseerde angststoornis (GAD). De werkzaamheid werd vastgesteld in twee placebogecontroleerde onderzoeken van 8 weken en twee 26 weken durende placebogecontroleerde onderzoeken.
Sociale angststoornis
Effexor XR is geïndiceerd voor de behandeling van sociale angststoornis (SAD), ook bekend als sociale fobie. De werkzaamheid werd vastgesteld in vier placebogecontroleerde onderzoeken van 12 weken en één van 26 weken.
Paniekstoornis
Effexor XR is geïndiceerd voor de behandeling van paniekstoornis (PD), met of zonder agorafobie. De werkzaamheid werd vastgesteld in twee placebogecontroleerde onderzoeken van 12 weken.
DOSERING EN ADMINISTRATIE
Effexor 37,5 mg XR moet in een enkele dosis met voedsel worden toegediend, 's morgens of' s avonds, elke dag op ongeveer hetzelfde tijdstip [zie KLINISCHE FARMACOLOGIE ]. Elke capsule moet in zijn geheel worden doorgeslikt met vloeistof en mag niet worden verdeeld, fijngemaakt, gekauwd of in water worden gedaan, of het kan worden toegediend door de capsule voorzichtig te openen en de volledige inhoud op een lepel appelmoes te sprenkelen. Dit mengsel van geneesmiddel en voedsel moet onmiddellijk worden ingeslikt zonder te kauwen en gevolgd door een glas water om ervoor te zorgen dat de korrels (sferoïden) volledig worden doorgeslikt.
Ernstige depressieve stoornis
Voor de meeste patiënten is de aanbevolen startdosering voor Effexor 37,5 mg XR 75 mg per dag, toegediend in een enkele dosis. Voor sommige patiënten kan het wenselijk zijn om te beginnen met 37,5 mg per dag gedurende 4 tot 7 dagen om nieuwe patiënten de kans te geven zich aan de medicatie aan te passen alvorens te verhogen naar 75 mg per dag. Patiënten die niet reageren op de initiële dosis van 75 mg per dag kunnen baat hebben bij dosisverhogingen tot een maximum van 225 mg per dag. Dosisverhogingen dienen, indien nodig, in stappen van maximaal 75 mg per dag plaats te vinden, en met tussenpozen van niet minder dan 4 dagen, aangezien de steady-state plasmaspiegels van venlafaxine en zijn belangrijkste metabolieten bij de meeste patiënten op dag 4 worden bereikt. [zien KLINISCHE FARMACOLOGIE ]. In de klinische onderzoeken die de werkzaamheid vaststelden, was opwaartse titratie toegestaan met tussenpozen van 2 weken of meer.
Opgemerkt moet worden dat, hoewel de maximale aanbevolen dosis voor poliklinische patiënten met matige depressie ook 225 mg per dag is voor Effexor (onmiddellijke afgifte), ernstiger depressieve patiënten in één onderzoek van het ontwikkelingsprogramma voor dat product reageerden op een gemiddelde dosis van 350 mg per dag (bereik van 150 tot 375 mg per dag). Of hogere doses Effexor 37,5 mg XR nodig zijn voor ernstiger depressieve patiënten is niet bekend; de ervaring met Effexor 75 mg XR doses hoger dan 225 mg per dag is echter zeer beperkt.
Gegeneraliseerde angststoornis
Voor de meeste patiënten is de aanbevolen startdosering voor Effexor XR 75 mg per dag, toegediend in een enkele dosis. Voor sommige patiënten kan het wenselijk zijn om te beginnen met 37,5 mg per dag gedurende 4 tot 7 dagen om nieuwe patiënten de kans te geven zich aan de medicatie aan te passen alvorens te verhogen naar 75 mg per dag. Patiënten die niet reageren op de initiële dosis van 75 mg per dag kunnen baat hebben bij dosisverhogingen tot een maximum van 225 mg per dag. Dosisverhogingen dienen, indien nodig, in stappen van maximaal 75 mg per dag plaats te vinden, en met tussenpozen van niet minder dan 4 dagen, aangezien de steady-state plasmaspiegels van venlafaxine en zijn belangrijkste metabolieten bij de meeste patiënten op dag 4 worden bereikt. [zien KLINISCHE FARMACOLOGIE ].
Sociale angststoornis (sociale fobie)
De aanbevolen dosis is 75 mg per dag, toegediend in een enkele dosis. Er was geen bewijs dat hogere doses enig extra voordeel opleveren.
Paniekstoornis
De aanbevolen startdosering is 37,5 mg Effexor 75 mg XR per dag gedurende 7 dagen. Patiënten die niet reageren op 75 mg per dag kunnen baat hebben bij dosisverhogingen tot een maximum van ongeveer 225 mg per dag. Dosisverhogingen dienen, indien nodig, in stappen van maximaal 75 mg per dag plaats te vinden, met tussenpozen van niet minder dan 7 dagen.
Overschakelen van patiënten van Effexor 37,5 mg-tabletten
Depressieve patiënten die momenteel worden behandeld met een therapeutische dosis met Effexor (onmiddellijke afgifte) kunnen worden overgezet op Effexor 37,5 mg XR in de dichtstbijzijnde equivalente dosis (mg per dag), bijv. 37,5 mg venlafaxine tweemaal daags naar 75 mg Effexor 75 mg XR een keer per dag. Individuele dosisaanpassingen kunnen echter noodzakelijk zijn.
Specifieke populaties
Patiënten met leverinsufficiëntie
De totale dagelijkse dosis moet met 50% worden verlaagd bij patiënten met een lichte (Child-Pugh=5-6) tot matige (Child-Pugh=7-9) leverfunctiestoornis. Bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh=10-15) of levercirrose kan het nodig zijn de dosis met 50% of meer te verlagen (zie Gebruik bij specifieke populaties ].
Patiënten met nierinsufficiëntie
De totale dagelijkse dosis moet met 25% tot 50% worden verlaagd bij patiënten met een lichte (CLcr= 60-89 ml/min) of matige (CLcr= 30-59 ml/min) nierfunctiestoornis. Bij patiënten die hemodialyse ondergaan of met een ernstige nierfunctiestoornis (CLcr Gebruik bij specifieke populaties ].
Onderhoudsbehandeling
Er is geen bewijs uit gecontroleerde onderzoeken om aan te geven hoe lang patiënten met MDD, GAD, SAD of PD moeten worden behandeld met Effexor 75 mg XR.
Men is het er algemeen over eens dat acute episodes van MDD enkele maanden of langer aanhoudende farmacologische therapie vereisen die verder gaan dan de respons op de acute episode. Effexor XR/Effexor heeft in klinische onderzoeken tot 52 weken een voortzetting van de respons aangetoond, bij dezelfde dosis waarop patiënten reageerden tijdens de initiële behandeling [zie Klinische studies ]. Het is niet bekend of de dosis Effexor XR die nodig is voor onderhoudsbehandeling identiek is aan de dosis die nodig is om een eerste respons te bereiken. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling en de juiste dosis voor een dergelijke behandeling te bepalen.
Bij patiënten met GAS en SAD is in 6 maanden durende klinische onderzoeken aangetoond dat Effexor 37,5 mg XR effectief is. De noodzaak om de medicatie voort te zetten bij patiënten met GAS en SAD die verbeteren met behandeling met Effexor XR, moet periodiek opnieuw worden beoordeeld.
In een klinische studie voor PD ondervonden patiënten die Effexor 75 mg XR voortzetten met dezelfde dosis waarop ze reageerden tijdens de eerste 12 weken van de behandeling een statistisch significant langere tijd tot terugval dan patiënten die waren gerandomiseerd naar placebo [zie Klinische studies ]. De noodzaak om de medicatie voort te zetten bij patiënten met PD die verbeteren met behandeling met Effexor XR, moet periodiek opnieuw worden beoordeeld.
Stoppen met Effexor XR
Een geleidelijke verlaging van de dosis, in plaats van abrupte stopzetting, wordt aanbevolen wanneer de behandeling met Effexor 37,5 mg XR wordt stopgezet. In klinische onderzoeken met Effexor 37,5 mg XR werd afbouwen bereikt door de dagelijkse dosis te verlagen met 75 mg met tussenpozen van een week. Individualisering van tapering kan nodig zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Bij sommige patiënten kan het nodig zijn om over een periode van enkele maanden te stoppen.
Overschakelen van patiënten naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het stoppen met een MAO-remmer (bedoeld voor de behandeling van psychiatrische stoornissen) en het starten van de behandeling met Effexor XR. Bovendien moet er ten minste 7 dagen worden gewacht na het stoppen met Effexor XR voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ].
Gebruik van Effexor XR met andere MAO-remmers zoals linezolid of intraveneus methyleenblauw
Start Effexor 75 mg XR niet bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen [zie CONTRA-INDICATIES ].
In sommige gevallen kan een patiënt die al wordt behandeld met Effexor 37,5 mg XR een dringende behandeling met linezolid of intraveneus methyleenblauw nodig hebben. Als er geen aanvaardbare alternatieven voor linezolid of intraveneuze methyleenblauw beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze methyleenblauw-behandeling opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet Effexor XR onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw kan worden toegediend. Controleer de patiënt op symptomen van het serotoninesyndroom gedurende 7 dagen of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet. De therapie met Effexor 75 mg XR kan 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden hervat [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg gelijktijdig met Effexor XR is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
Effexor 37,5 mg XR® (venlafaxinehydrochloride) capsules met verlengde afgifte zijn verkrijgbaar in de volgende sterktes:
- 37,5 mg capsules (grijze dop/perzikkleurige romp met “W” en “Effexor 75 mg XR” op de dop en “37,5” op de romp)
- 75 mg capsules (perzikkleurige dop en romp met “W” en “Effexor 37,5 mg XR” op de dop en “75” op de romp)
- 150 mg capsules (donkeroranje dop en romp met “W” en “Effexor 75 mg XR” op de dop en “150” op de romp)
Opslag en behandeling
Effexor XR® (venlafaxinehydrochloride) capsules met verlengde afgifte zijn als volgt verkrijgbaar:
NDC 0008-0837-20, fles van 15 capsules in eenheidsverpakking. NDC 0008-0837-21, fles van 30 capsules in eenheidsverpakking. NDC 0008-0837-22, fles van 90 capsules in eenheidsverpakking. NDC 0008-0837-03, doos met 10 Redipak® blisterstrips van elk 10 capsules.
NDC 0008-0833-20, fles van 15 capsules in eenheidsverpakking. NDC 0008-0833-21, fles van 30 capsules in eenheidsverpakking. NDC 0008-0833-22, fles van 90 capsules in eenheidsverpakking. NDC 0008-0833-03, doos met 10 Redipak® blisterstrips van elk 10 capsules.
NDC 0008-0836-20, fles van 15 capsules in eenheidsverpakking. NDC 0008-0836-21, fles van 30 capsules in eenheidsverpakking. NDC 0008-0836-22, fles van 90 capsules in eenheidsverpakking. NDC 0008-0836-03, doos met 10 Redipak® blisterstrips van elk 10 capsules.
- 37,5 mg , grijze dop/perzikkleurige body met “W” en “Effexor XR” op de dop en “37.5” op de body.
- 75 mg , perzikkleurige dop en body met "W" en "Effexor 37,5 mg XR" op de dop en "75" op de body.
- 150 mg donkeroranje dop en body met “W” en “Effexor XR” op de dop en “150” op de body.
Bewaren bij een gecontroleerde kamertemperatuur, 20° tot 25°C (68° tot 77°F).
De eenheidsverpakking is bedoeld om als eenheid te worden verstrekt.
Gedistribueerd door: Wyeth Pharmaceuticals LLC, een dochteronderneming van Pfizer Inc, Philadelphia, PA 19101. Herzien: november 2021
BIJWERKINGEN
De volgende bijwerkingen worden in andere secties van het etiket in meer detail besproken:
- overgevoeligheid [zie CONTRA-INDICATIES ]
- Suïcidale gedachten en gedrag bij kinderen, adolescenten en volwassenen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhogingen van de bloeddruk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Abnormale bloeding [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hoeksluiting Glaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Activering van manie/hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stopzettingssyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- inbeslagneming [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Gewichts- en lengteveranderingen bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Eetlustveranderingen bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Interstitiële longziekte en eosinofiele pneumonie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Seksuele disfunctie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring in klinische studies
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
Meest voorkomende bijwerkingen
De vaakst waargenomen bijwerkingen in de klinische onderzoeksdatabase bij met Effexor XR behandelde patiënten bij MDD, GAD, SAD en PD (incidentie ≥ 5% en ten minste tweemaal zo vaak als placebo) waren: misselijkheid (30,0%), slaperigheid (15,3 %), droge mond (14,8%), zweten (11,4%), abnormale ejaculatie (9,9%), anorexia (9,8%), constipatie (9,3%), impotentie (5,3%) en verminderd libido (5,1%).
Bijwerkingen gerapporteerd als redenen voor stopzetting van de behandeling
Gecombineerd over kortdurende, placebogecontroleerde premarketingonderzoeken voor alle indicaties, stopte 12% van de 3.558 patiënten die Effexor XR (37,5-225 mg) kregen de behandeling vanwege een bijwerking, vergeleken met 4% van de 2.197 met placebo behandelde patiënten in die onderzoeken.De meest voorkomende bijwerkingen die leidden tot stopzetting bij ≥ 1% van de met Effexor XR behandelde patiënten in de kortetermijnonderzoeken (tot 12 weken) voor alle indicaties worden weergegeven in Tabel 7.
Veelvoorkomende bijwerkingen in placebogecontroleerde onderzoeken
Het aantal patiënten dat meerdere doses Effexor XR kreeg tijdens de premarketingbeoordeling voor elke goedgekeurde indicatie wordt weergegeven in Tabel 8. De omstandigheden en duur van blootstelling aan venlafaxine in alle ontwikkelingsprogramma's varieerden sterk, en omvatten (in overlappende categorieën) open en dubbel- blinde onderzoeken, ongecontroleerde en gecontroleerde onderzoeken, klinische (alleen Effexor) en poliklinische onderzoeken, onderzoeken met vaste doses en titratieonderzoeken.
De incidenties van vaak voorkomende bijwerkingen (die optraden bij ≥ 2% van de met Effexor XR behandelde patiënten [357 MDD-patiënten, 1.381 GAD-patiënten, 819 SAD-patiënten en 1.001 PD-patiënten] en vaker dan placebo) bij met Effexor XR behandelde patiënten in het kort Langdurige, placebogecontroleerde klinische onderzoeken met vaste en flexibele doseringen (doses 37,5 tot 225 mg per dag) worden weergegeven in Tabel 9.
Het bijwerkingenprofiel verschilde niet wezenlijk tussen de verschillende patiëntenpopulaties.
Andere bijwerkingen waargenomen in klinische onderzoeken
Lichaam als geheel: Fotosensitiviteitsreactie, koude rillingen
Cardiovasculair systeem: Posturale hypotensie, syncope, hypotensie, tachycardie
Spijsverteringsstelsel: Gastro-intestinale bloeding [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ],
bruxisme Hemic/lymfatisch systeem: Ecchymose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Metabool/voeding: Hypercholesterolemie, gewichtstoename [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], gewichtsverlies [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Zenuwstelsel: aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], manische reactie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], agitatie, verwardheid, acathisie, hallucinaties, hypertonie, myoclonus, depersonalisatie, apathie
Huid en aanhangsels: Urticaria, pruritus, uitslag, alopecia
Speciale zintuigen: Mydriasis, afwijking van accommodatie, tinnitus, smaakvervorming
Urogenitaal systeem: Urineretentie, verminderd urineren, urine-incontinentie, verhoogde urinaire frequentie, menstruatiestoornissen geassocieerd met verhoogde bloeding of toegenomen onregelmatige bloeding (bijv. menorragie, metrorragie)
Veranderingen in vitale functies
In placebogecontroleerde premarketingonderzoeken waren er verhogingen van de gemiddelde bloeddruk (zie tabel 10). Bij de meeste indicaties was een dosisgerelateerde toename van de gemiddelde systolische en diastolische bloeddruk in rugligging duidelijk bij patiënten die werden behandeld met Effexor 37,5 mg XR's. In alle klinische onderzoeken bij MDD, GAD, SAD en PD, ervoer 1,4% van de patiënten in de Effexor XR-groepen een toename van SDBP van ≥15 mm Hg samen met een bloeddruk ≥ 105 mm Hg, vergeleken met 0,9% van de patiënten in de placebo groepen. Evenzo ervoer 1% van de patiënten in de Effexor 37,5 mg XR-groepen een toename van SSBP van ≥ 20 mm Hg met een bloeddruk ≥ 180 mm Hg, vergeleken met 0,3% van de patiënten in de placebogroepen.
Behandeling met Effexor 37,5 mg XR ging gepaard met aanhoudende hypertensie (gedefinieerd als tijdens de behandeling optredende diastolische bloeddruk in rug [SDBP] ≥ 90 mm Hg en ≥ 10 mm Hg boven de uitgangswaarde gedurende drie opeenvolgende on-therapiebezoeken (zie tabel 11). van de patiënten ontving in klinische onderzoeken gemiddelde doses Effexor XR van meer dan 300 mg per dag om de incidentie van aanhoudende bloeddrukstijgingen bij deze hogere doses volledig te evalueren.
Effexor 37,5 mg XR ging gepaard met gemiddelde verhogingen van de polsslag in vergelijking met placebo in placebogecontroleerde premarketingonderzoeken (zie tabel 12) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Laboratoriumveranderingen
Serum Cholesterol
Effexor XR werd geassocieerd met gemiddelde uiteindelijke verhogingen van serumcholesterolconcentraties vergeleken met gemiddelde uiteindelijke verlagingen voor placebo in premarketing MDD-, GAD-, SAD- en PD-klinische onderzoeken (Tabel 13).
Behandeling met Effexor 75 mg XR (venlafaxinehydrochloride) capsules met verlengde afgifte gedurende maximaal 12 weken in premarketing placebogecontroleerde onderzoeken voor depressieve stoornis ging gepaard met een gemiddelde uiteindelijke verhoging van de serumcholesterolconcentratie van ongeveer 1,5 mg/dl vergeleken met een gemiddelde uiteindelijke afname van 7,4 mg/dL voor placebo. Behandeling met Effexor XR tot 8 weken en tot 6 maanden in placebogecontroleerde GAD-onderzoeken voorafgaand aan het op de markt brengen ging gepaard met gemiddelde uiteindelijke verhogingen van de serumcholesterolconcentratie van respectievelijk ongeveer 1,0 mg/dl en 2,3 mg/dl tijdens de behandeling, terwijl placebo-patiënten gemiddelde uiteindelijke verlagingen van respectievelijk 4,9 mg/dL en 7,7 mg/dL. Behandeling met Effexor XR tot 12 weken en tot 6 maanden in premarketing placebogecontroleerde onderzoeken naar sociale angststoornis ging gepaard met gemiddelde uiteindelijke verhogingen van de serumcholesterolconcentratie van respectievelijk ongeveer 7,9 mg/dl en 5,6 mg/dl tijdens de therapie, vergeleken met met gemiddelde uiteindelijke verlagingen van respectievelijk 2,9 en 4,2 mg/dL voor placebo. Behandeling met Effexor XR tot 12 weken in premarketing placebogecontroleerde paniekstoornisstudies ging gepaard met een gemiddelde uiteindelijke stijging van de serumcholesterolconcentratie tijdens de behandeling van ongeveer 5,8 mg/dl vergeleken met een gemiddelde uiteindelijke daling van 3,7 mg/dl voor placebo.
Patiënten die gedurende ten minste 3 maanden met Effexor (onmiddellijke afgifte) werden behandeld in placebogecontroleerde verlengingsonderzoeken van 12 maanden, hadden een gemiddelde uiteindelijke stijging van het totale cholesterolgehalte tijdens de behandeling van 9,1 mg/dL vergeleken met een daling van 7,1 mg/dL bij placebo- behandelde patiënten. Deze toename was afhankelijk van de duur gedurende de onderzoeksperiode en was meestal groter bij hogere doses. Klinisch relevante verhogingen van serumcholesterol, gedefinieerd als 1) een uiteindelijke verhoging van serumcholesterol tijdens therapie ≥50 mg/dL vanaf baseline en tot een waarde van ≥261 mg/dL, of 2) een gemiddelde verhoging van serumcholesterol tijdens therapie ≥ 50 mg/dL vanaf baseline en tot een waarde ≥261 mg/dL, werden geregistreerd bij 5,3% van de met venlafaxine behandelde patiënten en 0,0% van de met placebo behandelde patiënten.
Serum triglyceriden
Effexor 75 mg XR ging gepaard met gemiddelde uiteindelijke verhogingen van de nuchtere serumtriglyceriden in vergelijking met placebo in premarketing klinische onderzoeken naar SAD en PD tot 12 weken (gepoolde gegevens) en 6 maanden (Tabel 14).
Pediatrische patiënten
Over het algemeen was het bijwerkingenprofiel van venlafaxine (in placebogecontroleerde klinische onderzoeken) bij kinderen en adolescenten (in de leeftijd van 6 tot 17 jaar) vergelijkbaar met dat bij volwassenen. Net als bij volwassenen werden verminderde eetlust, gewichtsverlies, verhoogde bloeddruk en verhoogd serumcholesterol waargenomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
In pediatrische klinische onderzoeken werd de bijwerking, zelfmoordgedachten, waargenomen.
In het bijzonder werden de volgende bijwerkingen waargenomen bij pediatrische patiënten: buikpijn, agitatie, dyspepsie, ecchymose, epistaxis en myalgie.
Bijwerkingen geïdentificeerd tijdens gebruik na goedkeuring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van Effexor XR na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan geneesmiddelen:
Lichaam als geheel: Anafylaxie, angio-oedeem
Cardiovasculair systeem: QT-verlenging, ventriculaire fibrillatie, ventriculaire tachycardie (inclusief torsade de pointes), takotsubo-cardiomyopathie
Spijsverteringsstelsel: Pancreatitis
Hemic/lymfatisch systeem: Slijmvliesbloeding [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], bloeddyscrasieën (waaronder agranulocytose, aplastische anemie, neutropenie en pancytopenie), verlengde bloedingstijd, trombocytopenie
Metabool/voeding: Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], Syndroom van ongepaste secretie van antidiuretisch hormoon (SIADH) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], abnormale leverfunctietesten, hepatitis, verhoogde prolactine
Musculoskeletaal: Rabdomyolyse
Zenuwstelsel: Maligne neurolepticasyndroom (MNS) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], serotonerge syndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], delirium, extrapiramidale reacties (inclusief dystonie en dyskinesie), verminderde coördinatie en evenwicht, tardieve dyskinesie
Ademhalingssysteem: Dyspnoe, interstitiële longziekte, pulmonale eosinofilie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Huid en aanhangsels: Stevens-Johnson-syndroom, toxische epidermale necrolyse, erythema multiforme
Speciale zintuigen: Hoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
DRUG-INTERACTIES
Centraal zenuwstelsel (CZS)-actieve geneesmiddelen
Het risico van het gebruik van venlafaxine in combinatie met andere CZS-actieve geneesmiddelen is niet systematisch geëvalueerd. Daarom is voorzichtigheid geboden wanneer Effexor XR wordt gebruikt in combinatie met andere CZS-actieve geneesmiddelen.
Monoamineoxidaseremmers
Bijwerkingen, waarvan sommige ernstig waren, zijn gemeld bij patiënten bij wie onlangs een MAO-remmer is stopgezet en begonnen met antidepressiva met farmacologische eigenschappen die vergelijkbaar zijn met Effexor XR (SNRI's of SSRI's), of bij wie onlangs de SNRI- of SSRI-therapie werd stopgezet voordat tot het starten van een MAO-remmer [zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Serotonerge geneesmiddelen
Op basis van het werkingsmechanisme van Effexor XR en het potentieel voor serotoninesyndroom, is voorzichtigheid geboden wanneer Effexor XR gelijktijdig wordt toegediend met andere geneesmiddelen die de serotonerge neurotransmittersystemen kunnen beïnvloeden, zoals triptanen, SSRI's, andere SNRI's, linezolid (een antibioticum dat een omkeerbare niet-selectieve MAOI), lithium, tramadol of sint-janskruid. Als gelijktijdige behandeling met Effexor XR en deze geneesmiddelen klinisch gerechtvaardigd is, wordt zorgvuldige observatie van de patiënt geadviseerd, vooral tijdens de start van de behandeling en bij dosisverhogingen. Gelijktijdig gebruik van Effexor 75 mg XR met tryptofaansupplementen wordt niet aanbevolen [zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelen die de hemostase verstoren (bijv. NSAID's, aspirine en warfarine)
De afgifte van serotonine door bloedplaatjes speelt een belangrijke rol bij hemostase. Het gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren, wordt in verband gebracht met het optreden van bloedingen in het bovenste deel van het maagdarmkanaal en gelijktijdig gebruik van een NSAID of aspirine kan dit risico op bloedingen vergroten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Veranderde antistollingseffecten, waaronder toegenomen bloedingen, zijn gemeld bij gelijktijdige toediening van SSRI's en SNRI's met warfarine. Patiënten die met warfarine worden behandeld, moeten zorgvuldig worden gecontroleerd wanneer Effexor 37,5 mg XR wordt gestart of stopgezet.
Afslankmiddelen
De veiligheid en werkzaamheid van behandeling met venlafaxine in combinatie met middelen voor gewichtsverlies, waaronder fentermine, zijn niet vastgesteld. Gelijktijdige toediening van Effexor XR en middelen voor gewichtsverlies wordt niet aanbevolen. Effexor XR is niet geïndiceerd voor gewichtsverlies alleen of in combinatie met andere producten.
Effecten van andere geneesmiddelen op Effexor XR
Figuur 1: Effect van geneesmiddelen die een wisselwerking hebben op de farmacokinetiek van venlafaxine en de actieve metaboliet O-desmethylvenlafaxine (ODV).
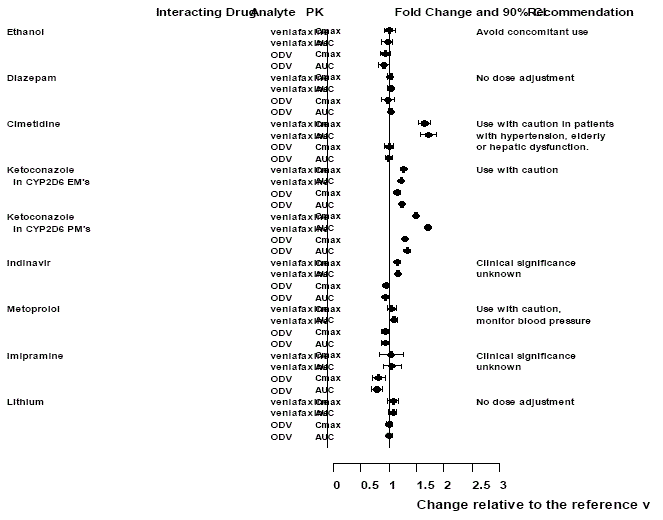
Effecten van Effexor XR op andere geneesmiddelen
Figuur 2: Effect van venlafaxine op de farmacokinetische interactie van geneesmiddelen en hun actieve metabolieten.
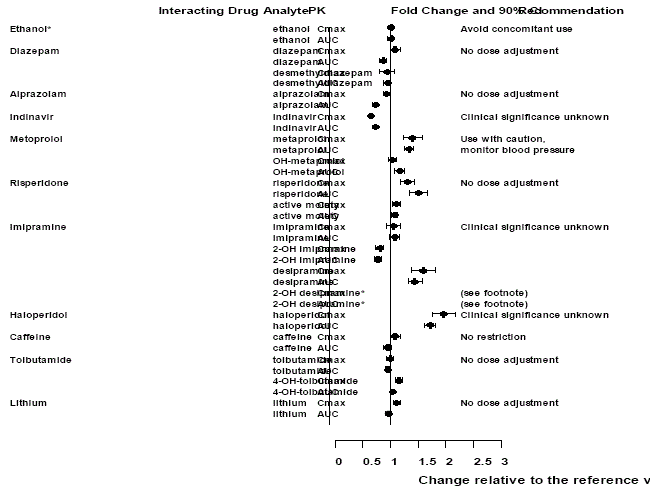
Opmerking
Toediening van venlafaxine in een stabiel regime versterkte de psychomotorische en psychometrische effecten van ethanol niet bij deze zelfde proefpersonen wanneer ze geen venlafaxine kregen.
Geneesmiddel-laboratoriumtestinteracties
Vals-positieve urine-immunoassay-screeningtests voor fencyclidine (PCP) en amfetamine zijn gemeld bij patiënten die venlafaxine gebruiken. Dit komt door een gebrek aan specificiteit van de screeningstesten. Vals-positieve testresultaten kunnen enkele dagen na stopzetting van de behandeling met venlafaxine worden verwacht. Bevestigende tests, zoals gaschromatografie/massaspectrometrie, zullen venlafaxine onderscheiden van PCP en amfetamine.
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
Effexor 75 mg XR is geen gereguleerde stof.
Misbruik
Hoewel venlafaxine in klinische onderzoeken niet systematisch is onderzocht vanwege het potentieel voor misbruik, waren er in de klinische onderzoeken geen aanwijzingen voor het zoeken naar geneesmiddelen. Het is echter niet mogelijk om op basis van premarketingervaring te voorspellen in hoeverre een op het CZS actief geneesmiddel zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen artsen patiënten zorgvuldig te evalueren op voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen, hen te observeren op tekenen van verkeerd gebruik of misbruik van venlafaxine (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar geneesmiddelen).
Afhankelijkheid
In vitro-onderzoeken hebben aangetoond dat venlafaxine vrijwel geen affiniteit heeft voor opiaat-, benzodiazepine-, fencyclidine (PCP) of N-methyl-D-asparaginezuur (NMDA)-receptoren.
Venlafaxine bleek geen significante CZS-stimulerende activiteit te hebben bij knaagdieren. In onderzoeken naar drugsdiscriminatie bij primaten vertoonde venlafaxine geen significante aansprakelijkheid voor misbruik van stimulerende of depressieve middelen.
Er zijn stopzettingseffecten gemeld bij patiënten die venlafaxine kregen [zie: DOSERING EN ADMINISTRATIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jonge volwassenen
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken naar antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18-24 jaar) met MDD en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve-compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken van 9 antidepressiva bij meer dan 4.400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel versus placebo) waren echter relatief stabiel binnen leeftijdsgroepen en indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1.000 behandelde patiënten) worden gegeven in Tabel 1.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het geneesmiddel op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dwz langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsstudies bij volwassenen met een depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die werden behandeld met antidepressiva voor MDD, evenals bij voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Als de beslissing is genomen om de behandeling te staken, moet de medicatie zo snel mogelijk worden afgebouwd, maar met de erkenning dat abrupte stopzetting gepaard kan gaan met bepaalde symptomen [zie Stopzettingssyndroom en DOSERING EN ADMINISTRATIE ].
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor MDD of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen, zoals evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor Effexor XR moeten worden geschreven voor de kleinste hoeveelheid capsules in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat Effexor XR niet is goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld bij serotonine-noradrenalineheropnameremmers (SNRI's) en SSRI's, waaronder alleen Effexor XR, maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen en sint-janskruid) en met geneesmiddelen die het metabolisme van met name serotonine aantasten, MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid of intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium, coma) autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, hyperthermie, diaforese, blozen en duizeligheid), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus , hyperreflexie, coördinatiestoornissen); toevallen en gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van Effexor XR met MAO-remmers (bedoeld voor de behandeling van psychiatrische stoornissen) is gecontra-indiceerd. Effexor XR mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die Effexor 37,5 mg XR gebruikt. Effexor XR moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart [zie: CONTRA-INDICATIES , DOSERING EN ADMINISTRATIE , en DRUG-INTERACTIES ].
Als gelijktijdig gebruik van Effexor 37,5 mg XR met andere serotonerge geneesmiddelen (bijv. triptanen, tricyclische antidepressiva, mirtazapine, fentanyl, lithium, tramadol, buspiron, amfetaminen, tryptofaan of sint-janskruid) klinisch gerechtvaardigd is, zorgvuldige observatie van de patiënt wordt geadviseerd, vooral tijdens de start van de behandeling en dosisverhogingen [zie: DRUG-INTERACTIES ]. Patiënten moeten bewust worden gemaakt van het potentiële risico van het serotoninesyndroom. De behandeling met Effexor XR en alle gelijktijdig gebruikte serotonerge middelen dient onmiddellijk te worden gestaakt als de bovenstaande voorvallen optreden, en ondersteunende symptomatische behandeling moet worden gestart.
Verhogingen van de bloeddruk
In gecontroleerde onderzoeken waren er dosisgerelateerde verhogingen van de systolische en diastolische bloeddruk, evenals gevallen van aanhoudende hypertensie [zie ONGEWENSTE REACTIES ].
Controleer de bloeddruk voordat u begint met de behandeling met Effexor 37,5 mg XR en regelmatig tijdens de behandeling. Beheers reeds bestaande hypertensie voordat de behandeling met Effexor 75 mg XR wordt gestart. Wees voorzichtig bij de behandeling van patiënten met reeds bestaande hypertensie of cardiovasculaire of cerebrovasculaire aandoeningen die kunnen worden aangetast door een verhoging van de bloeddruk. Aanhoudende bloeddrukverhoging kan leiden tot nadelige gevolgen. Gevallen van verhoogde bloeddruk die onmiddellijke behandeling vereisen, zijn gemeld met Effexor XR. Overweeg dosisverlaging of stopzetting van de behandeling bij patiënten die een aanhoudende stijging van de bloeddruk ervaren.
In alle klinische onderzoeken met Effexor 37,5 mg ervoer 1,4% van de patiënten in de met Effexor XR behandelde groepen een toename van ≥15 mm Hg in liggende diastolische bloeddruk (SDBP) ≥ 105 mm Hg, vergeleken met 0,9% van de patiënten in de placebogroepen. Evenzo ervoer 1% van de patiënten in de met Effexor 75 mg XR behandelde groepen een toename van ≥ 20 mm Hg in liggende systolische bloeddruk (SSBP) met een bloeddruk ≥ 180 mm Hg, vergeleken met 0,3% van de patiënten in de placebogroepen [zie tabel 10] in ONGEWENSTE REACTIES ]. Behandeling met Effexor 75 mg XR ging gepaard met aanhoudende hypertensie (gedefinieerd als tijdens de behandeling optredende SDBP ≥ 90 mm Hg en ≥ 10 mm Hg boven de uitgangswaarde gedurende drie opeenvolgende bezoeken tijdens de therapie [zie tabel 11 in ONGEWENSTE REACTIES ]. Een onvoldoende aantal patiënten kreeg in klinische onderzoeken gemiddelde doses Effexor 37,5 mg XR van meer dan 300 mg per dag om de incidentie van aanhoudende bloeddrukstijgingen bij deze hogere doses volledig te evalueren.
Abnormale bloeding
SSRI's en SNRI's, waaronder Effexor 37,5 mg XR, kunnen het risico op bloedingen verhogen, variërend van ecchymosen, hematomen, epistaxis, petechiën en gastro-intestinale bloedingen tot levensbedreigende bloedingen. Gelijktijdig gebruik van aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), warfarine en andere anticoagulantia of andere geneesmiddelen waarvan bekend is dat ze de bloedplaatjesfunctie beïnvloeden, kan dit risico vergroten. Case-reports en epidemiologische studies (case-control en cohort-design) hebben een verband aangetoond tussen het gebruik van geneesmiddelen die de heropname van serotonine verstoren en het optreden van gastro-intestinale bloedingen. Pas op voor patiënten met het risico op bloedingen bij gelijktijdig gebruik van Effexor 75 mg XR en NSAID's, aspirine of andere geneesmiddelen die de stolling beïnvloeden.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder Effexor XR, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
Activering van manie/hypomanie
Manie of hypomanie werd gemeld bij met Effexor 37,5 mg XR behandelde patiënten in de premarketingonderzoeken bij MDD, SAD en PD (zie tabel 2). Manie/hypomanie is ook gemeld bij een klein deel van de patiënten met stemmingsstoornissen die werden behandeld met andere op de markt gebrachte geneesmiddelen voor de behandeling van MDD. Effexor 37,5 mg XR moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van manie of hypomanie.
Stopzettingssyndroom
Symptomen van stopzetting zijn systematisch geëvalueerd bij patiënten die venlafaxine gebruiken, inclusief prospectieve analyses van klinische onderzoeken naar GAS en retrospectieve onderzoeken naar onderzoeken naar MDD en SAD. Het abrupt staken of verlagen van de dosering van venlafaxine in verschillende doseringen bleek geassocieerd te zijn met het optreden van nieuwe symptomen, waarvan de frequentie toenam bij een hogere dosering en bij een langere behandelingsduur. Gerapporteerde symptomen zijn onder meer agitatie, anorexia, angst, verwardheid, verminderde coördinatie en evenwicht, diarree, duizeligheid, droge mond, dysfore stemming, fasciculatie, vermoeidheid, griepachtige symptomen, hoofdpijn, hypomanie, slapeloosheid, misselijkheid, nervositeit, nachtmerries, sensorische stoornissen ( inclusief schokachtige elektrische sensaties), slaperigheid, zweten, tremor, duizeligheid en braken.
Er zijn postmarketingmeldingen geweest van ernstige ontwenningsverschijnselen die langdurig en ernstig kunnen zijn. Voltooide zelfmoord, zelfmoordgedachten, agressie en gewelddadig gedrag zijn waargenomen bij patiënten tijdens verlaging van de Effexor 75 mg XR-dosering, ook tijdens stopzetting. Andere postmarketingrapporten beschrijven visuele veranderingen (zoals wazig zien of moeite met focussen) en verhoogde bloeddruk na het stoppen of verlagen van de dosis Effexor XR.
Tijdens het op de markt brengen van Effexor XR, andere SNRI's en SSRI's zijn er spontane meldingen geweest van andere bijwerkingen die optraden na stopzetting van deze geneesmiddelen, met name bij abrupte, waaronder de volgende: prikkelbaarheid, lethargie, emotionele labiliteit, tinnitus en toevallen.
Patiënten moeten op deze symptomen worden gecontroleerd wanneer de behandeling met Effexor XR wordt stopgezet. Een geleidelijke verlaging van de dosis, in plaats van abrupt stoppen, wordt aanbevolen. Als ondraaglijke symptomen optreden na een verlaging van de dosis of na stopzetting van de behandeling, kan worden overwogen om de eerder voorgeschreven dosis te hervatten. Vervolgens kan de zorgverlener doorgaan met het verlagen van de dosis, maar in een meer geleidelijk tempo. Bij sommige patiënten kan het nodig zijn om over een periode van enkele maanden te stoppen [zie: DOSERING EN ADMINISTRATIE ].
epileptische aanvallen
Er zijn epileptische aanvallen opgetreden bij behandeling met venlafaxine. Effexor 75 mg XR moet, net als veel andere antidepressiva, met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van convulsies en moet worden gestaakt bij elke patiënt die convulsies ontwikkelt. [Moet het risico verminderen: risicofactoren, gelijktijdige medicijnen die de aanvalsdrempel verlagen.]
Hyponatriëmie
Hyponatriëmie kan optreden als gevolg van behandeling met SSRI's en SNRI's, waaronder Effexor 37,5 mg XR. In veel gevallen lijkt de hyponatriëmie het gevolg te zijn van de secretie van het syndroom van ongepast antidiuretisch hormoon (SIADH). Gevallen met serumnatrium lager dan 110 mmol/L zijn gemeld. Oudere patiënten lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met SSRI's en SNRI's [zie: Gebruik bij specifieke populaties ]. Ook kunnen patiënten die diuretica gebruiken of patiënten met een volumedepletie een groter risico lopen. Overweeg stopzetting van Effexor 37,5 mg XR bij patiënten met symptomatische hyponatriëmie en stel een geschikte medische interventie in.
Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Tekenen en symptomen die gepaard gaan met ernstigere en/of acute gevallen omvatten hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden.
Gewichts- en lengteveranderingen bij pediatrische patiënten
Gewichtsveranderingen
De gemiddelde verandering in lichaamsgewicht en incidentie van gewichtsverlies (percentage patiënten dat 3,5% of meer verloor) in de placebogecontroleerde pediatrische onderzoeken bij MDD, GAD en SAD worden weergegeven in tabellen 3 en 4.
Gewichtsverlies was niet beperkt tot patiënten met tijdens de behandeling optredende anorexia [zie: Eetlustveranderingen bij pediatrische patiënten ].
De risico's die gepaard gaan met langdurig gebruik van Effexor 75 mg XR werden beoordeeld in een open-label MDD-onderzoek bij kinderen en adolescenten die Effexor XR gedurende maximaal zes maanden kregen. De kinderen en adolescenten in de studie hadden een gewichtstoename die minder was dan verwacht, gebaseerd op gegevens van leeftijds- en geslachtsgenoten. Het verschil tussen de waargenomen gewichtstoename en de verwachte gewichtstoename was groter voor kinderen (
Hoogteveranderingen
Tabel 5 toont de gemiddelde lengtetoename bij pediatrische patiënten in de kortdurende, placebogecontroleerde MDD-, GAD- en SAD-onderzoeken. De verschillen in lengtetoename in GAS- en MDD-onderzoeken waren het meest opvallend bij patiënten jonger dan twaalf jaar.
In het zes maanden durende open-label MDD-onderzoek hadden kinderen en adolescenten een lengtetoename die minder was dan verwacht, op basis van gegevens van leeftijds- en geslachtsgenoten. Het verschil tussen waargenomen en verwachte groei was groter voor kinderen (
Eetlustveranderingen bij pediatrische patiënten
Verminderde eetlust (gerapporteerd als anorexia die optreedt tijdens de behandeling) werd vaker waargenomen bij met Effexor XR behandelde patiënten versus met placebo behandelde patiënten in de premarketingbeoordeling van Effexor XR voor MDD, GAD en SAD (zie tabel 6).
Interstitiële longziekte en eosinofiele pneumonie
Interstitiële longziekte en eosinofiele pneumonie geassocieerd met behandeling met venlafaxine zijn zelden gemeld. De mogelijkheid van deze bijwerkingen moet in overweging worden genomen bij met venlafaxine behandelde patiënten die zich presenteren met progressieve dyspneu, hoesten of ongemak op de borst. Dergelijke patiënten dienen een onmiddellijke medische evaluatie te ondergaan en stopzetting van de behandeling met venlafaxine moet worden overwogen.
Seksuele disfunctie
Het gebruik van SNRI's, waaronder Effexor XR, kan symptomen van seksuele disfunctie veroorzaken [zie: ONGEWENSTE REACTIES ]. Bij mannelijke patiënten kan het gebruik van SNRI leiden tot vertraging of falen van de ejaculatie, verminderd libido en erectiestoornissen. Bij vrouwelijke patiënten kan het gebruik van SNRI resulteren in een verminderd libido en een vertraagd of afwezig orgasme.
Het is belangrijk voor voorschrijvers om te informeren naar de seksuele functie voordat met Effexor 37,5 mg XR wordt gestart en om specifiek te informeren naar veranderingen in de seksuele functie tijdens de behandeling, omdat seksuele functie mogelijk niet spontaan wordt gemeld. Bij het evalueren van veranderingen in seksuele functie is het verkrijgen van een gedetailleerde geschiedenis (inclusief timing van het begin van de symptomen) belangrijk omdat seksuele symptomen andere oorzaken kunnen hebben, waaronder de onderliggende psychiatrische stoornis. Bespreek mogelijke managementstrategieën om patiënten te ondersteunen bij het nemen van weloverwogen beslissingen over de behandeling.
Informatie over patiëntbegeleiding
Zie FDA-goedgekeurd PATIËNT INFORMATIE ( Medicatiegids ).
Voorschrijvers of andere beroepsbeoefenaren in de gezondheidszorg moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van behandeling met Effexor 37,5 mg XR en hen adviseren bij het juiste gebruik ervan. Voor Effexor 75 mg XR is een medicatiehandleiding voor patiënten beschikbaar over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -handelingen". De voorschrijver of beroepsbeoefenaar in de gezondheidszorg moet patiënten, hun families en hun verzorgers instrueren om de medicatiehandleiding te lezen en moet hen helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de medicatiehandleiding te bespreken en om antwoord te krijgen op eventuele vragen. De volledige tekst van de medicatiehandleiding is herdrukt aan het einde van dit document. Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze optreden tijdens het gebruik van Effexor XR.
Suïcidale gedachten en gedrag
Adviseer patiënten, hun families en verzorgers te zoeken naar het ontstaan van suïcidaliteit, verergering van depressie en andere psychiatrische symptomen (angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie, psychomotorische rusteloosheid, hypomanie, manie, andere ongebruikelijke gedragsveranderingen), vooral in het begin van de behandeling en wanneer de dosis naar boven of beneden wordt aangepast. Dergelijke symptomen moeten aan de voorschrijver of zorgverlener van de patiënt worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen van de patiënt. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak van zeer nauwlettend toezicht [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Adviseer patiënten die Effexor XR gebruiken om niet gelijktijdig andere producten te gebruiken die venlafaxine of desvenlafaxine bevatten. Beroepsbeoefenaren in de gezondheidszorg moeten patiënten instrueren om Effexor XR niet in te nemen met een MAO-remmer of binnen 14 dagen na het stoppen met een MAO-remmer en 7 dagen na het stoppen van Effexor XR te wachten voordat met een MAO-remmer wordt begonnen [zie CONTRA-INDICATIES ].
serotonine syndroom
Patiënten moeten worden gewaarschuwd voor het risico op het serotoninesyndroom bij gelijktijdig gebruik van Effexor 75 mg XR en triptanen, tramadol, amfetaminen, tryptofaansupplementen, met antipsychotica of andere dopamineantagonisten of andere serotonerge middelen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Verhoogde bloeddruk
Adviseer patiënten dat ze regelmatig de bloeddruk moeten controleren wanneer ze Effexor XR gebruiken [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Abnormale bloeding
Patiënten moeten worden gewaarschuwd voor het gelijktijdig gebruik van Effexor 75 mg XR en NSAID's, aspirine, warfarine of andere geneesmiddelen die de stolling beïnvloeden, aangezien gecombineerd gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren en deze middelen in verband zijn gebracht met een verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hoeksluiting glaucoom
Patiënten moeten erop worden gewezen dat het gebruik van Effexor XR lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen misschien worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Activering van manie/hypomanie
Adviseer patiënten, hun families en zorgverleners om te observeren op tekenen van activering van manie/hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cardiovasculaire/cerebrovasculaire ziekte
Voorzichtigheid is geboden bij het toedienen van Effexor XR aan patiënten met cardiovasculaire, cerebrovasculaire of lipidenmetabolismestoornissen [zie ONGEWENSTE REACTIES ].
Verhoging van serumcholesterol en triglyceriden
Adviseer patiënten dat verhogingen van totaal cholesterol, LDL en triglyceriden kunnen optreden en dat meting van serumlipiden kan worden overwogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzettingssyndroom
Adviseer patiënten niet te stoppen met het gebruik van Effexor 75 mg XR zonder eerst met hun zorgverlener te overleggen. Patiënten dienen zich ervan bewust te zijn dat stopzettingseffecten kunnen optreden bij het stoppen met Effexor XR [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Seksuele disfunctie
Adviseer patiënten dat het gebruik van Effexor XR symptomen van seksuele disfunctie kan veroorzaken bij zowel mannelijke als vrouwelijke patiënten. Informeer patiënten dat ze eventuele veranderingen in de seksuele functie en mogelijke managementstrategieën met hun zorgverlener moeten bespreken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Interferentie met cognitieve en motorische prestaties
Waarschuw patiënten voor het bedienen van gevaarlijke machines, inclusief auto's, totdat ze redelijk zeker zijn dat Effexor 37,5 mg XR-therapie hun vermogen om dergelijke activiteiten uit te voeren niet nadelig beïnvloedt.
Alcohol
Adviseer patiënten om alcohol te vermijden tijdens het gebruik van Effexor 37,5 mg XR [zie DRUG-INTERACTIES ].
Allergische reacties
Adviseer patiënten om hun arts op de hoogte te stellen als ze allergische verschijnselen ontwikkelen zoals huiduitslag, netelroos, zwelling of ademhalingsmoeilijkheden.
Zwangerschap
Adviseer patiënten om hun arts op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de therapie [zie: Gebruik bij specifieke populaties ].
Verpleegkunde
Adviseer patiënten om hun arts op de hoogte te stellen als ze een baby borstvoeding geven [zie: Gebruik bij specifieke populaties ].
Overblijvende sferoïden
Effexor XR bevat sferoïden, die het medicijn langzaam in het spijsverteringskanaal afgeven. Het onoplosbare deel van deze sferoïden wordt geëlimineerd en patiënten kunnen merken dat sferoïden in de ontlasting of via colostomie terechtkomen. Patiënten moeten worden geïnformeerd dat de actieve medicatie al is opgenomen tegen de tijd dat de patiënt de sferoïden ziet.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Tumoren werden niet verhoogd door behandeling met venlafaxine bij muizen of ratten. Venlafaxine werd oraal toegediend aan muizen gedurende 18 maanden in doses tot 120 mg/kg per dag, wat 1,7 maal de maximaal aanbevolen dosis voor de mens was op basis van mg/m2. Venlafaxine werd ook aan ratten toegediend via orale sondevoeding gedurende 24 maanden in doses tot 120 mg/kg per dag. Bij ratten die de dosis van 120 mg/kg kregen, waren de plasmaconcentraties van venlafaxine bij necropsie 1 keer (mannelijke ratten) en 6 keer (vrouwelijke ratten) de plasmaconcentraties van patiënten die de maximaal aanbevolen dosis voor de mens kregen. De plasmaspiegels van de O-desmethylmetaboliet (ODV) waren lager bij ratten dan bij patiënten die de maximaal aanbevolen dosis kregen. O-desmethylvenlafaxine (ODV), de belangrijkste humane metaboliet van venlafaxine, gedurende 2 jaar oraal toegediend aan muizen en ratten, verhoogde de incidentie van tumoren in geen van beide onderzoeken. Muizen kregen ODV in doseringen tot 500/300 mg/kg/dag (dosis verlaagd na 45 weken dosering). De blootstelling bij de dosis van 300 mg/kg/dag is 9 keer die van een dosis voor mensen van 225 mg/dag. Ratten kregen ODV in doseringen tot 300 mg/kg/dag (mannetjes) of 500 mg/kg/dag (vrouwtjes). De blootstelling bij de hoogste dosis is ongeveer 8 (mannen) of 11 (vrouwen) maal die van een dosis voor mensen van 225 mg/dag.
Mutagenese
Venlafaxine en de belangrijkste humane metaboliet, ODV, waren niet mutageen in de Ames-reverse-mutatietest in Salmonella-bacteriën of de Chinese hamsterovarium/HGPRT-zoogdiercel-forward-genmutatietest. Venlafaxine was ook niet mutageen of clastogeen in de in vitro BALB/c-3T3-muizenceltransformatietest, de zusterchromatidenuitwisselingstest in gekweekte eierstokcellen van Chinese hamsters, of in de in vivo chromosomale aberratietest in beenmerg van ratten. ODV was niet clastogeen in de in vitro chromosomale aberratie-assay van de Chinese hamster-ovariumcel of in de in-vivo-test op chromosomale aberratie bij ratten.
Aantasting van de vruchtbaarheid
Voortplantings- en vruchtbaarheidsonderzoeken van venlafaxine bij ratten lieten geen nadelige effecten zien van venlafaxine op de mannelijke of vrouwelijke vruchtbaarheid bij orale doses tot 2 maal de maximaal aanbevolen dosis voor de mens van 225 mg/dag op basis van mg/m2. Er werd echter verminderde vruchtbaarheid waargenomen in een onderzoek waarin mannelijke en vrouwelijke ratten werden behandeld met O-desmethylvenlafaxine (ODV), de belangrijkste menselijke metaboliet van venlafaxine, voor en tijdens de paring en de dracht. Dit gebeurde bij een ODV-blootstelling (AUC) die ongeveer 2 tot 3 keer hoger was dan die van een humane dosis venlafaxine van 225 mg/dag.
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Venlafaxine veroorzaakte geen misvormingen bij nakomelingen van ratten of konijnen die doses kregen tot 2,5 maal (rat) of 4 maal (konijn) de maximaal aanbevolen dagelijkse dosis voor de mens op basis van mg/m2. Bij ratten was er echter een afname van het gewicht van de jongen, een toename van doodgeboren jongen en een toename van de sterfte van jongen tijdens de eerste 5 dagen van de lactatie, toen de dosering begon tijdens de dracht en werd voortgezet tot het spenen. De oorzaak van deze sterfgevallen is niet bekend. Deze effecten traden op bij 2,5 maal (mg/m2) de maximale dagelijkse dosis voor de mens. De dosis zonder effect voor de mortaliteit van rattenjongen was 0,25 maal de dosis bij de mens op basis van mg/m2. In reproductieve ontwikkelingsstudies bij ratten en konijnen met O-desmethylvenlafaxine (ODV), de belangrijkste menselijke metaboliet van venlafaxine, werd geen bewijs van teratogeniteit waargenomen bij blootstellingsmarges van 13 bij ratten en 0,3 bij konijnen. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Effexor XR mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Niet-teratogene effecten
Pasgeborenen die laat in het derde trimester aan Effexor 37,5 mg XR, andere SNRI's of SSRI's zijn blootgesteld, hebben complicaties ontwikkeld die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen. Dergelijke complicaties kunnen direct na de bevalling optreden. Gerapporteerde klinische bevindingen omvatten ademnood, cyanose, apneu, toevallen, temperatuurinstabiliteit, voedingsproblemen, braken, hypoglykemie, hypotonie, hypertonie, hyperreflexie, tremor, zenuwachtigheid, prikkelbaarheid en constant huilen. Deze kenmerken komen overeen met ofwel een direct toxisch effect van SSRI's en SNRI's, of mogelijk een syndroom van stopzetting van het geneesmiddel. Opgemerkt moet worden dat in sommige gevallen het klinische beeld consistent is met het serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ]. Bij de behandeling van een zwangere vrouw met Effexor XR tijdens het derde trimester moet de arts de mogelijke risico's en voordelen van de behandeling zorgvuldig overwegen.
Bevalling
Het effect van venlafaxine op de bevalling en bevalling bij mensen is niet bekend.
Moeders die borstvoeding geven
Van venlafaxine en ODV is gemeld dat ze worden uitgescheiden in de moedermelk. Vanwege het potentieel voor ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen van Effexor XR, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
Er zijn twee placebogecontroleerde onderzoeken bij 766 pediatrische patiënten met MDD en twee placebogecontroleerde onderzoeken bij 793 pediatrische patiënten met GAS uitgevoerd met Effexor XR, en de gegevens waren niet voldoende om een claim voor gebruik bij pediatrische patiënten te staven.
Iedereen die het gebruik van Effexor XR bij een kind of adolescent overweegt, moet de mogelijke risico's afwegen tegen de klinische noodzaak [zie: DOOS WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Hoewel er geen onderzoeken zijn opgezet om primair de invloed van Effexor 37,5 mg XR op de groei, ontwikkeling en rijping van kinderen en adolescenten te beoordelen, suggereren de uitgevoerde onderzoeken dat Effexor XR een negatief effect kan hebben op gewicht en lengte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Mocht de beslissing worden genomen om een pediatrische patiënt met Effexor XR te behandelen, dan wordt regelmatige controle van gewicht en lengte aanbevolen tijdens de behandeling, vooral als de behandeling op lange termijn moet worden voortgezet [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. De veiligheid van een behandeling met Effexor 75 mg XR voor pediatrische patiënten is niet systematisch beoordeeld voor chronische behandelingen die langer dan zes maanden duren. In de onderzoeken bij pediatrische patiënten (leeftijd 6-17) was het optreden van bloeddruk- en cholesterolverhogingen die als klinisch relevant worden beschouwd bij pediatrische patiënten vergelijkbaar met die waargenomen bij volwassen patiënten. Bijgevolg zijn de voorzorgsmaatregelen voor volwassenen van toepassing op pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geriatrisch gebruik
Het percentage patiënten in klinische onderzoeken voor Effexor 37,5 mg XR voor MDD, GAD, SAD en PD die 65 jaar of ouder waren, wordt weergegeven in Tabel 15.
Er werden geen algemene verschillen in werkzaamheid of veiligheid waargenomen tussen geriatrische patiënten en jongere patiënten, en andere gerapporteerde klinische ervaringen hebben over het algemeen geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Een grotere gevoeligheid van sommige ouderen kan echter niet worden uitgesloten. SSRI's en SNRI's, waaronder Effexor XR, zijn in verband gebracht met gevallen van klinisch significante hyponatriëmie bij oudere patiënten, die mogelijk een groter risico lopen op deze bijwerking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De farmacokinetiek van venlafaxine en ODV is niet wezenlijk veranderd bij ouderen [zie: KLINISCHE FARMACOLOGIE ] (zie afbeelding 3). Er wordt geen dosisaanpassing aanbevolen voor ouderen alleen op basis van leeftijd, hoewel andere klinische omstandigheden, waarvan sommige vaker voorkomen bij ouderen, zoals nier- of leverinsufficiëntie, een dosisverlaging kunnen rechtvaardigen [zie DOSERING EN ADMINISTRATIE ].
Leeftijd en geslacht
Een farmacokinetische populatieanalyse van 404 met Effexor behandelde patiënten uit twee onderzoeken met zowel tweemaal daags als driemaal daags regimes toonde aan dat de dosisgenormaliseerde dalplasmaspiegels van venlafaxine of ODV niet veranderden door leeftijds- of geslachtsverschillen. Aanpassing van de dosering op basis van de leeftijd of het geslacht van een patiënt is over het algemeen niet nodig [zie: DOSERING EN ADMINISTRATIE ] (zie Tabel 15).
Gebruik in subgroepen van patiënten
Figuur 3: Farmacokinetiek van venlafaxine en zijn metaboliet O-desmethylvenlafaxine (ODV) in speciale populaties.
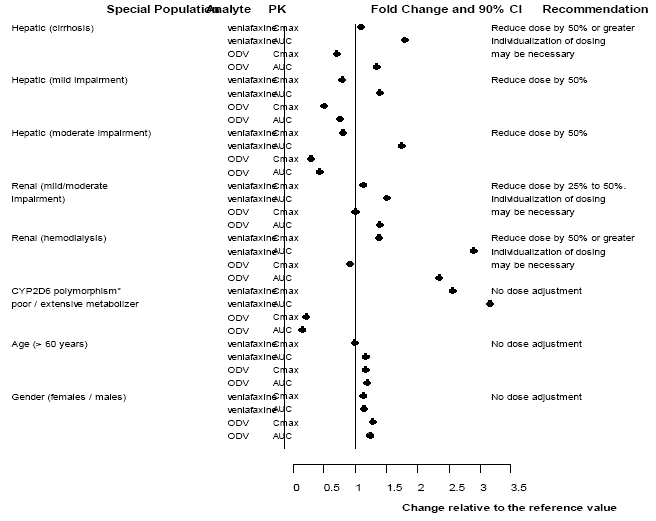
OVERDOSERING
Menselijke ervaring
Tijdens de premarketingevaluaties van Effexor 75 mg XR (voor MDD, GAD, SAD en PD) en Effexor (voor MDD) waren er twintig meldingen van acute overdosering met Effexor (respectievelijk 6 en 14 meldingen bij patiënten met Effexor XR en Effexor 75 mg) , alleen of in combinatie met andere drugs en/of alcohol.
Slaperigheid was het meest gemelde symptoom. Tot de andere gemelde symptomen behoorden paresthesie van alle vier de ledematen, matige duizeligheid, misselijkheid, gevoelloze handen en voeten, en warme en koude perioden 5 dagen na de overdosis. In de meeste gevallen werden geen tekenen of symptomen geassocieerd met overdosering. De meeste meldingen hadden betrekking op inname waarbij de totale ingenomen dosis venlafaxine niet meer dan enkele malen hoger was dan de gebruikelijke therapeutische dosis. Bij één patiënt die 2,75 g venlafaxine had ingenomen, werd waargenomen dat hij twee gegeneraliseerde convulsies had en een verlenging van QTc tot 500 msec, vergeleken met 405 msec bij baseline. Milde sinustachycardie werd gemeld bij twee van de andere patiënten.
Maatregelen die werden genomen om de overdosis te behandelen waren onder meer geen behandeling, ziekenhuisopname en symptomatische behandeling, en ziekenhuisopname plus behandeling met actieve kool. Alle patiënten herstelden.
In postmarketingervaring is overdosering met venlafaxine voornamelijk opgetreden in combinatie met alcohol en/of andere geneesmiddelen. De meest gemelde voorvallen bij overdosering zijn onder meer tachycardie, veranderingen in het bewustzijnsniveau (variërend van slaperigheid tot coma), mydriasis, toevallen en braken.
Veranderingen op het elektrocardiogram (bijv. verlenging van het QT-interval, bundeltakblok, QRS-verlenging), ventriculaire tachycardie, bradycardie, hypotensie, rabdomyolyse, duizeligheid, levernecrose, serotoninesyndroom en overlijden zijn gemeld.
Gepubliceerde retrospectieve onderzoeken melden dat overdosering met venlafaxine gepaard kan gaan met een verhoogd risico op fatale afloop in vergelijking met het risico dat wordt waargenomen bij SSRI-antidepressiva, maar lager dan bij tricyclische antidepressiva. Epidemiologische studies hebben aangetoond dat met venlafaxine behandelde patiënten een hogere bestaande last van suïciderisicofactoren hebben dan met SSRI behandelde patiënten. De mate waarin de bevinding van een verhoogd risico op fatale afloop kan worden toegeschreven aan de toxiciteit van venlafaxine bij overdosering, in tegenstelling tot sommige kenmerken van met venlafaxine behandelde patiënten, is niet duidelijk. Voorschriften voor Effexor 75 mg XR moeten worden geschreven voor de kleinste hoeveelheid capsules in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Beheer van overdosering
Raadpleeg een gecertificeerd antigifcentrum voor up-to-date begeleiding en advies (1-800-222-1222 of www.poison.org). Bied in geval van een overdosis ondersteunende zorg, inclusief nauw medisch toezicht en monitoring. De behandeling moet bestaan uit die algemene maatregelen die worden gebruikt bij de behandeling van overdosering met een geneesmiddel. Overweeg de mogelijkheid van een overdosis van meerdere geneesmiddelen. Zorg voor een adequate luchtweg, zuurstofvoorziening en ventilatie. Controleer het hartritme en de vitale functies. Zorg voor ondersteunende en symptomatische maatregelen.
CONTRA-INDICATIES
overgevoeligheid
Overgevoeligheid voor venlafaxinehydrochloride, desvenlafaxinesuccinaat of voor een van de hulpstoffen in de formulering
Gelijktijdig gebruik met monoamineoxidaseremmers (MAO-remmers)
Het gelijktijdig gebruik van MAO-remmers (bedoeld voor de behandeling van psychiatrische stoornissen) met Effexor 75 mg XR of binnen 7 dagen na stopzetting van de behandeling met Effexor XR is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van Effexor 37,5 mg XR binnen 14 dagen na stopzetting van de behandeling met een MAO-remmer (bedoeld voor de behandeling van psychiatrische stoornissen) is ook gecontra-indiceerd [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ].
Het starten van Effexor XR bij een patiënt die wordt behandeld met een MAO-remmer zoals linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het exacte mechanisme van de antidepressieve werking van venlafaxine bij mensen is niet bekend, maar men denkt dat het verband houdt met de versterking van serotonine en noradrenaline in het centrale zenuwstelsel, door remming van hun heropname. Niet-klinische studies hebben aangetoond dat venlafaxine en zijn actieve metaboliet, ODV, krachtige en selectieve remmers zijn van neuronale serotonine- en noradrenalineheropname en zwakke remmers van dopamineheropname.
farmacodynamiek
Venlafaxine en ODV hebben in vitro geen significante affiniteit voor muscarine-cholinerge, H1-histaminerge of α1-adrenerge receptoren. Er wordt verondersteld dat farmacologische activiteit op deze receptoren verband houdt met de verschillende anticholinerge, sedatieve en cardiovasculaire effecten die worden waargenomen bij andere psychotrope geneesmiddelen. Venlafaxine en ODV hebben geen monoamineoxidase (MAO)-remmende activiteit.
Cardiale elektrofysiologie
Het effect van venlafaxine op het QT-interval werd geëvalueerd in een gerandomiseerde, dubbelblinde, placebo- en positief-gecontroleerde drie-periode cross-over grondige QT-studie bij 54 gezonde volwassen proefpersonen. Er werd geen significant QT-verlengend effect van venlafaxine 450 mg waargenomen.
Farmacokinetiek
Steady-state concentraties van venlafaxine en ODV in plasma worden bereikt binnen 3 dagen na orale therapie met meervoudige doses. Venlafaxine en ODV vertoonden lineaire kinetiek over het dosisbereik van 75 tot 450 mg per dag. De gemiddelde ±SD steady-state plasmaklaring van venlafaxine en ODV is respectievelijk 1,3±0,6 en 0,4±0,2 l/u/kg; de schijnbare eliminatiehalfwaardetijd is respectievelijk 5±2 en 11±2 uur; en het schijnbare (steady-state) distributievolume is respectievelijk 7,5 ± 3,7 en 5,7 ± 1,8 l/kg. Venlafaxine en ODV worden bij therapeutische concentraties minimaal gebonden aan plasma-eiwitten (respectievelijk 27% en 30%).
Absorptie en distributie
Venlafaxine wordt goed geabsorbeerd en uitgebreid gemetaboliseerd in de lever. ODV is de belangrijkste actieve metaboliet. Op basis van massabalansonderzoeken wordt ten minste 92% van een enkelvoudige orale dosis venlafaxine geabsorbeerd. De absolute biologische beschikbaarheid van venlafaxine is ongeveer 45%.
Toediening van Effexor 37,5 mg XR (150 mg eenmaal daags) resulteerde in het algemeen in lagere Cmax- en latere Tmax-waarden dan voor Effexor (onmiddellijke afgifte) tweemaal daags toegediend (Tabel 16). Wanneer gelijke dagelijkse doses venlafaxine werden toegediend als tablet met onmiddellijke afgifte of als capsule met verlengde afgifte, was de blootstelling aan zowel venlafaxine als ODV vergelijkbaar voor de twee behandelingen en was de fluctuatie in plasmaconcentraties iets lager met de Effexor 37,5 mg XR-capsule. Daarom biedt Effexor XR een langzamere absorptiesnelheid, maar dezelfde mate van absorptie in vergelijking met de tablet met onmiddellijke afgifte.
Voedsel had geen invloed op de biologische beschikbaarheid van venlafaxine of zijn actieve metaboliet, ODV. Het tijdstip van toediening (AM versus PM) had geen invloed op de farmacokinetiek van venlafaxine en ODV van de 75 mg Effexor 75 mg XR-capsule.
Venlafaxine is niet sterk gebonden aan plasma-eiwitten; daarom zou toediening van Effexor 37,5 mg XR aan een patiënt die een ander geneesmiddel neemt dat sterk aan eiwit gebonden is, geen verhoogde vrije concentraties van het andere geneesmiddel veroorzaken.
Metabolisme en eliminatie
Na absorptie ondergaat venlafaxine een uitgebreid presystemisch metabolisme in de lever, voornamelijk tot ODV, maar ook tot N-desmethylvenlafaxine, N,O-didesmethylvenlafaxine en andere minder belangrijke metabolieten. In vitro-onderzoeken geven aan dat de vorming van ODV wordt gekatalyseerd door CYP2D6; dit is bevestigd in een klinisch onderzoek dat aantoont dat patiënten met lage CYP2D6-spiegels (slechte metaboliseerders) verhoogde venlafaxine- en verlaagde ODV-spiegels hadden in vergelijking met mensen met normale CYP2D6-spiegels (extensieve metaboliseerders) [zie Gebruik bij specifieke populaties ].
Ongeveer 87% van een dosis venlafaxine wordt binnen 48 uur in de urine teruggevonden als onveranderd venlafaxine (5%), ongeconjugeerd ODV (29%), geconjugeerd ODV (26%) of andere minder belangrijke inactieve metabolieten (27%). De renale eliminatie van venlafaxine en zijn metabolieten is dus de primaire uitscheidingsroute.
Klinische studies
Ernstige depressieve stoornis
De werkzaamheid van Effexor 75 mg XR (venlafaxinehydrochloride) capsules met verlengde afgifte als behandeling voor depressieve stoornis (MDD) werd vastgesteld in twee placebogecontroleerde, kortdurende (8 weken voor onderzoek 1; 12 weken voor onderzoek 2), flexibele - dosisonderzoeken, met doses vanaf 75 mg per dag en variërend tot 225 mg per dag bij volwassen poliklinische patiënten die voldoen aan de DSM-III-R- of DSM-IV-criteria voor MDD. Bij matig depressieve poliklinische patiënten was de aanvangsdosis venlafaxine 75 mg per dag. In beide onderzoeken toonde Effexor XR superioriteit ten opzichte van placebo op de primaire werkzaamheidsmaatstaf gedefinieerd als verandering van baseline in de HAM-D-21 totale score tot het eindpuntbezoek, Effexor XR toonde ook superioriteit ten opzichte van placebo op het belangrijkste secundaire werkzaamheidseindpunt, het klinische eindpunt. Global Impressions (CGI) Ernst van ziekte schaal. Onderzoek van geslachtssubsets van de bestudeerde populatie bracht geen differentiële responsiviteit op basis van geslacht aan het licht.
Een 4 weken durende studie van opgenomen patiënten die voldeden aan de DSM-III-R-criteria voor MDD met melancholie die Effexor 37,5 mg gebruikten in een bereik van 150 tot 375 mg per dag (verdeeld in een driemaal daags schema) toonde superioriteit van Effexor aan ten opzichte van placebo op basis van de HAM-D-21 totaalscore. De gemiddelde dosis bij voltooide patiënten was 350 mg per dag (onderzoek 3).
In een langere-termijnstudie werden volwassen poliklinische patiënten met MDD die reageerden tijdens een 8 weken durende open-label studie met Effexor 37,5 mg XR (75, 150 of 225 mg, eenmaal daags elke ochtend) gerandomiseerd naar voortzetting van hun zelfde Effexor XR-dosis of placebo, gedurende maximaal 26 weken observatie voor terugval. De respons tijdens de open-labelfase werd gedefinieerd als een CGI Severity of Illness-itemscore van ≤ 3 en een HAM-D-21-totaalscore van ≤ 10 bij de evaluatie op dag 56. Terugval tijdens de dubbelblinde fase werd als volgt gedefinieerd: (1) een terugkeer van een depressieve stoornis zoals gedefinieerd door de DSM-IV-criteria en een CGI-itemscore Severity of Illness van ≥4 (matig ziek), (2) 2 opeenvolgende CGI Itemscores voor Ernst van Ziekte van ≥ 4, of (3) een uiteindelijke CGI-itemscore voor Ernst van Ziekte van ≥ 4 voor elke patiënt die zich om welke reden dan ook uit het onderzoek heeft teruggetrokken. Patiënten die een voortgezette behandeling met Effexor 37,5 mg XR kregen, ondervonden statistisch significant lagere terugvalpercentages gedurende de daaropvolgende 26 weken in vergelijking met degenen die placebo kregen (onderzoek 4).
In een tweede onderzoek op langere termijn werden volwassen poliklinische patiënten met MDD, terugkerend type, die reageerden (HAM-D21 totale score ≤ 12 op de evaluatie op dag 56) en verder verbeterden [gedefinieerd als aan de volgende criteria werd voldaan gedurende dagen 56 tot en met 180 : (1) geen HAM-D-21 totaalscore ≥ 20; (2) niet meer dan 2 HAM39 D-21 totaalscores > 10, en (3) geen enkele CGI Severity of Illness itemscore ≥ 4 (matig ziek)] tijdens een eerste behandeling van 26 weken met Effexor [100 tot 200 mg per dag, volgens een tweemaal daags schema] werden gerandomiseerd naar voortzetting van hun dezelfde Effexor-dosis of naar placebo. De follow-upperiode om patiënten te observeren voor terugval, gedefinieerd als een CGI Severity of Illness itemscore ≥ 4, was tot 52 weken. Patiënten die een voortgezette behandeling met Effexor kregen, ondervonden statistisch significant lagere terugvalpercentages gedurende de daaropvolgende 52 weken in vergelijking met degenen die placebo kregen (onderzoek 5).
Gegeneraliseerde angststoornis
De werkzaamheid van Effexor XR als behandeling van gegeneraliseerde angststoornis (GAD) werd vastgesteld in twee 8 weken durende, placebogecontroleerde, vaste-dosisonderzoeken (75 tot 225 mg per dag), één 6 maanden durende, placebogecontroleerde, flexibele - dosisonderzoek (75 tot 225 mg per dag) en één 6 maanden durende, placebogecontroleerde studie met vaste dosis (37,5, 75 en 150 mg per dag) bij volwassen poliklinische patiënten die voldoen aan de DSM-IV-criteria voor GAS.
In een onderzoek van 8 weken toonde Effexor XR superioriteit ten opzichte van placebo voor de doses van 75, 150 en 225 mg per dag, zoals gemeten door de Hamilton Rating Scale for Anxiety (HAM-A) totale score, zowel de HAM-A angst als spanning items, en de Clinical Global Impressions (CGI) schaal. De doses van 75 en 150 mg per dag waren echter niet zo consistent effectief als de hoogste dosis (onderzoek 1). Een tweede 8 weken durende studie waarin doses van 75 en 150 mg per dag en placebo werden geëvalueerd, toonde aan dat beide doses op sommige van deze zelfde resultaten effectiever waren dan placebo; de dosis van 75 mg per dag was echter consistenter effectief dan de dosis van 150 mg per dag (onderzoek 2). Een dosis-responsrelatie voor de werkzaamheid bij GAS werd niet duidelijk vastgesteld in het bestudeerde dosisbereik van 75 tot 225 mg per dag.
Twee onderzoeken van 6 maanden, waarbij één Effexor 75 mg XR-doses van 37,5, 75 en 150 mg per dag evalueerde (onderzoek 3) en de andere Effexor XR-doses van 75 tot 225 mg per dag (onderzoek 4), toonden aan dat dagelijkse doses van 75 mg of meer was effectiever dan placebo op het HAM-A totaal, zowel de HAM-A angst- en spanningsitems als de CGI-schaal gedurende 6 maanden behandeling. Hoewel er ook bewijs was voor superioriteit ten opzichte van placebo voor de dosis van 37,5 mg per dag, was deze dosis niet zo consistent effectief als de hogere doses.
Onderzoek van geslachtssubsets van de bestudeerde populatie bracht geen differentiële responsiviteit op basis van geslacht aan het licht.
Sociale angststoornis (ook bekend als sociale fobie)
De werkzaamheid van Effexor 37,5 mg XR voor de behandeling van sociale angststoornis (SAD) werd vastgesteld in vier dubbelblinde, parallelle groepen, 12 weken durende, multicenter, placebogecontroleerde, flexibele-dosisonderzoeken (onderzoeken 1-4) en één dubbelblinde, parallelle groep, 6 maanden durende, placebogecontroleerde studie met vaste/flexibele doses, met doses in het bereik van 75 tot 225 mg per dag bij volwassen poliklinische patiënten die voldeden aan de DSM-IV-criteria voor SAD (onderzoek 5 ).
In deze vijf onderzoeken was Effexor 75 mg XR statistisch significant effectiever dan placebo bij verandering van baseline tot eindpunt op de totale score van de Liebowitz Social Anxiety Scale (LSAS). Er was geen bewijs voor een grotere werkzaamheid van de groep van 150 tot 225 mg per dag in vergelijking met de groep van 75 mg per dag in het 6 maanden durende onderzoek.
Onderzoek van subsets van de onderzochte populatie bracht geen differentiële responsiviteit op basis van geslacht aan het licht. Er was onvoldoende informatie om het effect van leeftijd of ras op de uitkomst in deze onderzoeken te bepalen.
Paniekstoornis
De werkzaamheid van Effexor XR als behandeling voor paniekstoornis (PD) werd vastgesteld in twee dubbelblinde, 12 weken durende, multicenter, placebogecontroleerde onderzoeken bij volwassen poliklinische patiënten die voldeden aan de DSM-IV-criteria voor PD, met of zonder agorafobie. Patiënten kregen vaste doses van 75 of 150 mg per dag in één onderzoek (onderzoek 1) en 75 of 225 mg per dag in het andere onderzoek (onderzoek 2).
De werkzaamheid werd beoordeeld op basis van uitkomsten in drie variabelen: (1) percentage patiënten dat vrij was van paniekaanvallen met volledige symptomen op de Panic and Anticipatory Anxiety Scale (PAAS); (2) gemiddelde verandering van baseline tot eindpunt op de totale score van de Panic Disorder Severity Scale (PDSS); en (3) percentage patiënten beoordeeld als responders (veel verbeterd of zeer sterk verbeterd) op de Clinical Global Impressions (CGI) verbeteringsschaal. In deze twee onderzoeken was Effexor XR statistisch significant effectiever dan placebo (voor elke vaste dosis) op alle drie de eindpunten, maar een dosis-responsrelatie werd niet duidelijk vastgesteld.
Onderzoek van subsets van de onderzochte populatie bracht geen differentiële responsiviteit op basis van geslacht aan het licht. Er was onvoldoende informatie om het effect van leeftijd of ras op de uitkomst in deze onderzoeken te bepalen.
In een onderzoek op langere termijn (onderzoek 3) werden volwassen poliklinische patiënten die voldeden aan de DSM-IV-criteria voor PD en die tijdens een open fase van 12 weken hadden gereageerd met Effexor 75 mg XR (75 tot 225 mg per dag) willekeurig toegewezen om dezelfde Effexor 75 mg voort te zetten. XR-dosis (75, 150 of 225 mg) of schakel over naar placebo voor observatie voor terugval onder dubbelblinde omstandigheden. Respons tijdens de open fase werd gedefinieerd als ≤ 1 paniekaanval met volledige symptomen per week gedurende de laatste 2 weken van de open fase en een CGI-verbeteringsscore van 1 (zeer veel verbeterd) of 2 (veel verbeterd). Terugval tijdens de dubbelblinde fase werd gedefinieerd als het hebben van 2 of meer volledige symptoom paniekaanvallen per week gedurende 2 opeenvolgende weken of het stoppen vanwege verlies van effectiviteit, zoals bepaald door de onderzoekers tijdens het onderzoek. Gerandomiseerde patiënten waren in responsstatus gedurende gemiddeld 34 dagen voordat ze werden gerandomiseerd. In de gerandomiseerde fase die volgde op de open-label periode van 12 weken, hadden patiënten die Effexor 75 mg XR kregen een statistisch significant langere tijd tot terugval.
Pediatrische patiënten
Twee placebogecontroleerde onderzoeken bij 766 pediatrische patiënten met MDD en twee placebogecontroleerde onderzoeken bij 793 pediatrische patiënten met GAS zijn uitgevoerd met Effexor XR, en de gegevens waren niet voldoende om een claim voor gebruik bij pediatrische patiënten te staven.
Wat is Effexor en hoe wordt het gebruikt?
Effexor is een receptgeneesmiddel dat wordt gebruikt om de symptomen van depressie, gegeneraliseerde angst, sociale angst en paniekstoornis te behandelen. Effexor kan alleen of in combinatie met andere medicijnen worden gebruikt.
Effexor behoort tot een klasse geneesmiddelen die antidepressiva, selectieve serotonine en noradrenalineheropnameremmer (SNRI's) worden genoemd.
Wat zijn de mogelijke bijwerkingen van Effexor 37,5 mg?
Effexor kan ernstige bijwerkingen veroorzaken, waaronder:
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- gemakkelijk blauwe plekken of bloedingen krijgen (neusbloedingen, bloedend tandvlees),
- bloed in uw urine of ontlasting,
- bloed ophoesten,
- hoesten,
- beklemming op de borst,
- moeite met ademhalen,
- convulsies (toevallen),
- hoofdpijn,
- verwardheid,
- onduidelijke spraak,
- ernstige zwakte,
- braken,
- verlies van coördinatie,
- onvast voelen,
- zeer stijve (starre) spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen, en
- duizeligheid
- Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
- De meest voorkomende bijwerkingen van Effexor zijn:
- duizeligheid,
- slaperigheid,
- ongerustheid,
- nerveus voelen,
- slaapproblemen (slapeloosheid),
- visie verandert,
- misselijkheid,
- braken,
- diarree,
- veranderingen in gewicht of eetlust,
- droge mond,
- geeuwen,
- toegenomen zweten,
- verminderde zin in seks,
- impotentie,
- abnormale ejaculatie, en
- moeite met een orgasme
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Effexor. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van venlafaxine-tabletten, USP of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Venlafaxine-tabletten, USP is niet goedgekeurd voor gebruik bij pediatrische patiënten. (Zien WAARSCHUWINGEN : Klinische verslechtering en zelfmoordrisico , PATIËNT INFORMATIE , en PREVENTIEVE MAATREGELEN : Pediatrisch gebruik ).
OMSCHRIJVING
Venlafaxine-tabletten, USP is een structureel nieuw antidepressivum voor orale toediening. Het wordt aangeduid als (R/S)-1-[2-(dimethylamino)-1-(4-methoxyfenyl)ethyl]cyclohexanolhydrochloride of (±)-1-[α- [(dimethyl-amino)methyl]-p- methoxybenzyl]cyclohexanolhydrochloride en heeft de empirische formule van C17H27NO2 HCl. Het molecuulgewicht is 313,87. De structuurformule is hieronder weergegeven.
Venlafaxinehydrochloride is een witte tot gebroken witte kristallijne vaste stof met een oplosbaarheid van 572 mg/ml in water (aangepast tot een ionsterkte van 0,2 M met natriumchloride). De verdelingscoëfficiënt octanol:water (0,2 M natriumchloride) is 0,43.
Gecomprimeerde tabletten bevatten venlafaxinehydrochloride, USP equivalent aan 25 mg, 37,5 mg, 50 mg, 75 mg of 100 mg venlafaxinebase en de volgende inactieve ingrediënten: microkristallijne cellulose, lactosemonohydraat, gepregelatineerd zetmeel, natriumzetmeelglycolaat, rood ijzeroxide, geel ijzeroxide, colloïdaal siliciumdioxide en magnesiumstearaat.
