Abilify 10mg, 15mg, 20mg Aripiprazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.

Wat is Abilify 20 mg en hoe wordt het gebruikt?
Abilify is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van schizofrenie, bipolaire I-stoornis (manische depressie) en depressieve stoornis. Abilify 10 mg kan alleen of in combinatie met andere medicijnen worden gebruikt. Abilify is een antipsychoticum, antimanisch middel.
- Het is niet bekend of Abilify veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Abilify 15 mg?
Abilify 15 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige opwinding of angst,
- rusteloos voelen,
- spiertrekkingen of oncontroleerbare bewegingen van uw ogen, lippen, tong, gezicht, armen of benen,
- maskerachtig uiterlijk van het gezicht,
- moeite met slikken,
- spraakproblemen,
- toevallen (convulsies),
- gedachten aan zelfmoord of zelfbeschadiging,
- stijve of stijve spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen (trillen),
- licht in het hoofd voelen,
- rillingen,
- keelpijn,
- zweertjes in de mond,
- huidzweren,
- hoesten,
- moeite met ademhalen,
- verhoogde dorst,
- meer plassen,
- droge mond, en
- fruitige ademgeur
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Abilify 20 mg zijn:
- ongecontroleerde spierbewegingen,
- ongerustheid,
- rusteloos voelen,
- gewichtstoename,
- misselijkheid,
- braken,
- constipatie,
- verhoogde eetlust,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- zich moe voelen,
- slaapproblemen (slapeloosheid),
- verstopte neus, en
- keelpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Abilify. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
VERHOOGDE STERFTE BIJ OUDEREN PATINTEN MET DEMENTIEGERELATEERDE PSYCHOSE en SUICIDALE GEDACHTEN EN GEDRAG MET ANTIDEPRESSANTE DRUGS
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. ABILIFY 20 mg is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Antidepressiva verhoogden het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen in kortdurende onderzoeken. Deze onderzoeken lieten geen toename zien van het risico op zelfmoordgedachten en -gedrag bij gebruik van antidepressiva bij patiënten ouder dan 24 jaar; er was een vermindering van het risico bij gebruik van antidepressiva bij patiënten van 65 jaar en ouder (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Bij patiënten van alle leeftijden die beginnen met antidepressiva, moet u nauwlettend controleren op verergering en op het optreden van zelfmoordgedachten en -gedrag. Adviseer families en zorgverleners over de noodzaak van nauwkeurige observatie en communicatie met de voorschrijver (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
Aripiprazol is een psychotroop geneesmiddel dat verkrijgbaar is als ABILIFY® (aripiprazol) tabletten, ABILIFY DISCMELT® (aripiprazol) oraal uiteenvallende tabletten, ABILIFY® (aripiprazol) orale oplossing en ABILIFY® (aripiprazol) injectie, een oplossing voor intramusculaire injectie. Aripiprazol is 7-[4-[4-(2,3-dichloorfenyl)-1-piperazinyl]butoxy]-3,4-dihydrocarbostyril. De empirische formule is C23H27Cl2N3O2 en het molecuulgewicht is 448,38. De chemische structuur is:
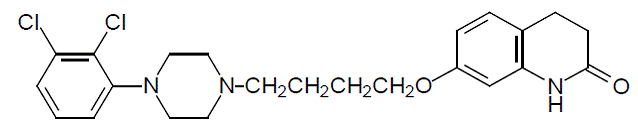
ABILIFY-tabletten zijn verkrijgbaar in sterkten van 2 mg, 5 mg, 10 mg, 15 mg, 20 mg en 30 mg. Inactieve ingrediënten zijn onder meer maïszetmeel, hydroxypropylcellulose, lactosemonohydraat, magnesiumstearaat en microkristallijne cellulose. Kleurstoffen omvatten ijzeroxide (geel of rood) en FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT oraal uiteenvallende tabletten zijn verkrijgbaar in sterkten van 10 mg en 15 mg. Inactieve ingrediënten zijn acesulfaam-kalium, aspartaam, calciumsilicaat, croscarmellose-natrium, crospovidon, crème de vanille (natuurlijke en kunstmatige smaakstoffen), magnesiumstearaat, microkristallijne cellulose, siliciumdioxide, wijnsteenzuur en xylitol. Kleurstoffen omvatten ijzeroxide (geel of rood) en FD&C Blue No. 2 Aluminium Lake.
ABILIFY drank is een heldere, kleurloze tot lichtgele oplossing die verkrijgbaar is in een concentratie van 1 mg/ml. De inactieve ingrediënten voor deze oplossing zijn dinatriumedetaat, fructose, glycerine, dl-melkzuur, methylparaben, propyleenglycol, propylparaben, natriumhydroxide, sucrose en gezuiverd water. De drank is op smaak gebracht met natuurlijke sinaasappelroom en andere natuurlijke aroma's.
ABILIFY Injection is beschikbaar in injectieflacons met een enkelvoudige dosis als een gebruiksklare, heldere, kleurloze, steriele, waterige oplossing van 9,75 mg/1,3 ml (7,5 mg/ml), uitsluitend voor intramusculair gebruik. Inactieve ingrediënten voor deze oplossing zijn 199,5 mg sulfobutylether-β-cyclodextrine (SBECD), 10,4 mg wijnsteenzuur, qs tot pH 4,3 natriumhydroxide en qs tot 1,33 ml water voor injectie.
INDICATIES
ABILIFY orale tabletten, oraal uiteenvallende tabletten en orale oplossing zijn geïndiceerd voor de behandeling van:
- schizofrenie [zie Klinische studies ]
- Acute behandeling van manische en gemengde episodes geassocieerd met bipolaire I-stoornis [zie Klinische studies ]
- Aanvullende behandeling van depressieve stoornis [zie Klinische studies ]
- Prikkelbaarheid geassocieerd met autistische stoornis [zie Klinische studies ]
- Behandeling van de stoornis van Gilles de la Tourette [zie Klinische studies ]
ABILIFY Injection is geïndiceerd voor de behandeling van:
- Agitatie geassocieerd met schizofrenie of bipolaire manie [zie Klinische studies ]
DOSERING EN ADMINISTRATIE
Schizofrenie
volwassenen
De aanbevolen start- en streefdosering voor ABILIFY is 10 of 15 mg/dag, eenmaal daags toegediend, ongeacht de maaltijden. ABILIFY is systematisch geëvalueerd en is effectief gebleken in een doseringsbereik van 10 tot 30 mg/dag, indien toegediend als tabletformulering; Doses hoger dan 10 of 15 mg/dag waren echter niet effectiever dan 10 of 15 mg/dag. Doseringsverhogingen dienen over het algemeen niet eerder dan 2 weken te worden gedaan, de tijd die nodig is om steady-state te bereiken [zie Klinische studies ].
Onderhoudsbehandeling: Handhaving van de werkzaamheid bij schizofrenie werd aangetoond in een onderzoek bij patiënten met schizofrenie die symptomatisch stabiel waren op andere antipsychotica gedurende perioden van 3 maanden of langer. Deze patiënten werden stopgezet met die medicijnen en gerandomiseerd naar ABILIFY 15 mg/dag of placebo, en geobserveerd voor terugval [zie Klinische studies ]. Patiënten dienen periodiek opnieuw te worden beoordeeld om te bepalen of onderhoudsbehandeling noodzakelijk blijft.
adolescenten
De aanbevolen streefdosering van ABILIFY is 10 mg/dag. Aripiprazol werd onderzocht bij adolescente patiënten van 13 tot 17 jaar met schizofrenie in dagelijkse doses van 10 mg en 30 mg. De dagelijkse aanvangsdosis van de tabletformulering bij deze patiënten was 2 mg, die na 2 dagen werd getitreerd tot 5 mg en na 2 extra dagen tot de streefdosis van 10 mg. Daaropvolgende dosisverhogingen dienen te worden toegediend in stappen van 5 mg. De dosis van 30 mg/dag bleek niet effectiever te zijn dan de dosis van 10 mg/dag. ABILIFY kan worden toegediend zonder rekening te houden met maaltijden [zie Klinische studies ]. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Overstappen van andere antipsychotica
Er zijn geen systematisch verzamelde gegevens over het specifiek overstappen van patiënten met schizofrenie van andere antipsychotica op ABILIFY 20 mg of over gelijktijdige toediening met andere antipsychotica. Hoewel het voor sommige patiënten met schizofrenie aanvaardbaar kan zijn om de vorige behandeling met antipsychotica onmiddellijk te staken, kan een meer geleidelijke stopzetting voor anderen het meest geschikt zijn. In alle gevallen moet de periode van overlappende toediening van antipsychotica worden geminimaliseerd.
Bipolaire I-stoornis
Acute behandeling van manische en gemengde episodes
volwassenen
De aanbevolen startdosering bij volwassenen is 15 mg eenmaal daags als monotherapie en 10 mg tot 15 mg eenmaal daags als aanvullende therapie met lithium of valproaat. ABILIFY 10 mg kan worden gegeven zonder rekening te houden met maaltijden. De aanbevolen streefdosering van ABILIFY is 15 mg/dag, als monotherapie of als aanvullende therapie met lithium of valproaat. De dosis kan worden verhoogd tot 30 mg/dag op basis van de klinische respons. De veiligheid van doses hoger dan 30 mg/dag is niet geëvalueerd in klinische onderzoeken.
Kindergeneeskunde
De aanbevolen startdosering bij pediatrische patiënten (10 tot 17 jaar) als monotherapie is 2 mg/dag, met titratie tot 5 mg/dag na 2 dagen en een streefdosis van 10 mg/dag na 2 extra dagen. De aanbevolen dosering als aanvullende therapie bij lithium of valproaat is hetzelfde. Daaropvolgende dosisverhogingen, indien nodig, moeten worden toegediend in stappen van 5 mg/dag. ABILIFY kan worden gegeven zonder rekening te houden met maaltijden [zie Klinische studies ].
Aanvullende behandeling van depressieve stoornis
volwassenen
De aanbevolen startdosering voor ABILIFY als aanvullende behandeling voor patiënten die al een antidepressivum gebruiken, is 2 tot 5 mg/dag. Het aanbevolen doseringsbereik is 2 tot 15 mg/dag. Doseringsaanpassingen tot 5 mg/dag dienen geleidelijk plaats te vinden, met tussenpozen van niet minder dan 1 week [zie Klinische studies ]. Patiënten dienen periodiek opnieuw te worden beoordeeld om te bepalen of onderhoudsbehandeling noodzakelijk blijft.
Prikkelbaarheid geassocieerd met autistische stoornis
Pediatrische patiënten (6 tot 17 jaar)
Het aanbevolen doseringsbereik voor de behandeling van pediatrische patiënten met prikkelbaarheid geassocieerd met een autistische stoornis is 5 tot 15 mg/dag.
De dosering dient te worden gestart met 2 mg/dag. De dosis dient te worden verhoogd tot 5 mg/dag, met daaropvolgende verhogingen tot 10 of 15 mg/dag indien nodig. Dosisaanpassingen tot 5 mg/dag dienen geleidelijk plaats te vinden, met tussenpozen van niet minder dan 1 week [zie Klinische studies ]. Patiënten dienen periodiek opnieuw te worden beoordeeld om te bepalen of onderhoudsbehandeling noodzakelijk blijft.
De stoornis van Gilles de la Tourette
Pediatrische patiënten (6 tot 18 jaar)
Het aanbevolen doseringsbereik voor de stoornis van Gilles de la Tourette is 5 tot 20 mg/dag.
Voor patiënten die minder dan 50 kg wegen, moet de dosering worden gestart met 2 mg/dag met een streefdosis van 5 mg/dag na 2 dagen. De dosis kan worden verhoogd tot 10 mg/dag bij patiënten die de tics niet optimaal onder controle krijgen. Doseringsaanpassingen dienen geleidelijk te gebeuren met tussenpozen van niet minder dan 1 week.
Voor patiënten die 50 kg of meer wegen, moet de dosering worden gestart met 2 mg/dag gedurende 2 dagen en vervolgens worden verhoogd tot 5 mg/dag gedurende 5 dagen, met een streefdosis van 10 mg/dag op dag 8. De dosis kan verhoogd tot 20 mg/dag voor patiënten die de tics niet optimaal onder controle krijgen. Doseringsaanpassingen dienen geleidelijk plaats te vinden in stappen van 5 mg/dag met tussenpozen van niet minder dan 1 week. [Zien Klinische studies ].
Patiënten dienen periodiek opnieuw te worden beoordeeld om te bepalen of onderhoudsbehandeling noodzakelijk blijft.
Agitatie geassocieerd met schizofrenie of bipolaire manie (intramusculaire injectie)
volwassenen
De aanbevolen dosis bij deze patiënten is 9,75 mg. Het aanbevolen doseringsbereik is 5,25 tot 15 mg. Er werd geen bijkomend voordeel aangetoond voor 15 mg in vergelijking met 9,75 mg. Een lagere dosis van 5,25 mg kan worden overwogen wanneer klinische factoren dit rechtvaardigen. Als de agitatie die een tweede dosis rechtvaardigt aanhoudt na de aanvangsdosis, kunnen cumulatieve doses tot een totaal van 30 mg/dag worden gegeven. De werkzaamheid van herhaalde doses ABILIFY 10 mg injectie bij geagiteerde patiënten is echter niet systematisch geëvalueerd in gecontroleerde klinische onderzoeken. De veiligheid van totale dagelijkse doses van meer dan 30 mg of injecties die vaker dan om de 2 uur worden gegeven, is niet adequaat beoordeeld in klinische onderzoeken [zie Klinische studies ].
Als lopende ABILIFY-therapie klinisch geïndiceerd is, dient orale ABILIFY in een spreiding van 10 tot 30 mg/dag de ABILIFY-injectie zo snel mogelijk te vervangen [zie DOSERING EN ADMINISTRATIE ].
Toediening van ABILIFY-injectie
Om ABILIFY 10 mg injectie toe te dienen, zuigt u het benodigde volume oplossing op in de spuit zoals weergegeven in Tabel 1. Gooi alle ongebruikte porties weg.
ABILIFY Injection is uitsluitend bedoeld voor intramusculair gebruik. Niet intraveneus of subcutaan toedienen. Injecteer langzaam, diep in de spiermassa.
Parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de container dit toelaten.
Doseringsaanpassingen voor cytochroom P450-overwegingen
Dosisaanpassingen worden aanbevolen bij patiënten van wie bekend is dat ze trage CYP2D6-metaboliseerders zijn en bij patiënten die gelijktijdig CYP3A4-remmers of CYP2D6-remmers of sterke CYP3A4-inductoren gebruiken (zie tabel 2). Wanneer het gelijktijdig toegediende geneesmiddel wordt stopgezet uit de combinatietherapie, moet de dosis ABILIFY 10 mg worden aangepast tot het oorspronkelijke niveau. Wanneer de gelijktijdig toegediende CYP3A4-inductor wordt stopgezet, moet de ABILIFY-dosering in 1 tot 2 weken worden verlaagd tot het oorspronkelijke niveau. Bij patiënten die mogelijk een combinatie van sterke, matige en zwakke remmers van CYP3A4 en CYP2D6 krijgen (bijv. een sterke CYP3A4-remmer en een matige CYP2D6-remmer of een matige CYP3A4-remmer met een matige CYP2D6-remmer), kan de dosering worden verlaagd tot één - een kwart (25%) van de gebruikelijke dosis aanvankelijk en daarna aangepast om een gunstige klinische respons te bereiken.
Wanneer adjuvans ABILIFY wordt toegediend aan patiënten met depressieve stoornis, dient ABILIFY 10 mg te worden toegediend zonder dosisaanpassing zoals gespecificeerd in Dosering en toediening (2.3).
Dosering van orale oplossing
De drank kan worden vervangen door tabletten op basis van mg per mg tot het dosisniveau van 25 mg. Patiënten die tabletten van 30 mg krijgen, moeten 25 mg van de oplossing krijgen [zie: KLINISCHE FARMACOLOGIE ].
Dosering van oraal uiteenvallende tabletten
De dosering voor ABILIFY 10 mg oraal uiteenvallende tabletten is dezelfde als voor de orale tabletten [zie bovenstaande secties ].
HOE GELEVERD
Doseringsvormen en sterke punten
ABILIFY® (aripiprazol)-tabletten zijn verkrijgbaar zoals beschreven in tabel 3.
ABILIFY DISCMELT® (aripiprazol) oraal desintegrerende tabletten zijn verkrijgbaar zoals beschreven in tabel 4.
ABILIFY® (aripiprazol) drank (1 mg/ml) is een heldere, kleurloze tot lichtgele oplossing, geleverd in kindveilige flessen samen met een gekalibreerde orale doseerbeker.
ABILIFY® (aripiprazol) injectie voor intramusculair gebruik is een heldere, kleurloze oplossing die beschikbaar is als een gebruiksklare 9,75 mg/1,3 ml (7,5 mg/ml) oplossing in heldere, type 1 glazen injectieflacons.
Opslag en behandeling
ABILIFY® (aripiprazol) tabletten hebben markeringen aan één kant en zijn verkrijgbaar in de sterktes en verpakkingen vermeld in Tabel 32.
ABILIFY 15 mg DISCMELT® (aripiprazol) oraal desintegrerende tabletten zijn ronde tabletten met markeringen aan weerszijden. ABILIFY 15 mg DISCMELT is verkrijgbaar in de sterktes en verpakkingen vermeld in Tabel 33.
ABILIFY® (aripiprazol) drank (1 mg/ml) wordt geleverd in kindveilige flessen samen met een gekalibreerde orale doseerbeker. ABILIFY 20 mg drank is als volgt verkrijgbaar:
150 ml fles NDC 59148-013-15
ABILIFY® (aripiprazol) Injectie voor intramusculair gebruik is als volgt beschikbaar als een gebruiksklare oplossing van 9,75 mg/1,3 ml (7,5 mg/ml) in heldere, type 1 glazen injectieflacons:
9,75 mg/1,3 ml injectieflacon met enkelvoudige dosis NDC 59148-016-65
Opslag
Tabletten
Bewaren bij 25°C (77°F); excursies toegestaan tussen 15°C en 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Orale oplossing
Bewaren bij 25°C (77°F); excursies toegestaan tussen 15°C en 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Geopende flessen ABILIFY drank kunnen tot 6 maanden na opening worden gebruikt, maar niet na de vervaldatum op de fles. De fles en de inhoud ervan moeten worden weggegooid na de vervaldatum.
Injectie
Bewaren bij 25°C (77°F); excursies toegestaan tussen 15°C en 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Tegen licht beschermen door in de originele verpakking te bewaren. Bewaar in de doos tot het moment van gebruik.
Gedistribueerd en op de markt gebracht door Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc. Rev aug. 2019
BIJWERKINGEN
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De volgende bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose [zie GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cerebrovasculaire bijwerkingen, waaronder beroerte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Suïcidale gedachten en gedrag bij kinderen, adolescenten en jongvolwassenen [zie GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Maligne neurolepticasyndroom (MNS) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Tardieve dyskinesie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Metabolische veranderingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Pathologisch gokken en ander dwangmatig gedrag [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Orthostatische hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- valt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leukopenie, neutropenie en agranulocytose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Toevallen/convulsies [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Potentieel voor cognitieve en motorische stoornissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Regeling lichaamstemperatuur [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- zelfmoord [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Dysfagie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
De meest voorkomende bijwerkingen bij volwassen patiënten in klinische onderzoeken (≥10%) waren misselijkheid, braken, constipatie, hoofdpijn, duizeligheid, acathisie, angst, slapeloosheid en rusteloosheid.
De meest voorkomende bijwerkingen in de pediatrische klinische onderzoeken (≥10%) waren slaperigheid, hoofdpijn, braken, extrapiramidale stoornis, vermoeidheid, toegenomen eetlust, slapeloosheid, misselijkheid, nasofaryngitis en gewichtstoename.
ABILIFY is beoordeeld op veiligheid bij 13.543 volwassen patiënten die deelnamen aan klinische onderzoeken met meervoudige doses bij schizofrenie, bipolaire stoornis, depressieve stoornis, dementie van het Alzheimer-type, de ziekte van Parkinson en alcoholisme, en die ongeveer 7619 patiëntjaren van blootstelling aan orale ABILIFY 10 mg en 749 patiënten met blootstelling aan ABILIFY-injectie. In totaal werden 3390 patiënten behandeld met orale ABILIFY gedurende ten minste 180 dagen en 1933 patiënten die werden behandeld met orale ABILIFY hadden een blootstelling van ten minste 1 jaar.
ABILIFY 15 mg is beoordeeld op veiligheid bij 1.686 patiënten (6 tot 18 jaar) die deelnamen aan klinische onderzoeken met meervoudige doses bij schizofrenie, bipolaire manie, autistische stoornis of de stoornis van Gilles de la Tourette en die ongeveer 1.342 patiëntjaren blootgesteld waren aan orale ABILIFY . In totaal werden 959 pediatrische patiënten behandeld met orale ABILIFY gedurende ten minste 180 dagen en 556 pediatrische patiënten die werden behandeld met orale ABILIFY 10 mg hadden een blootstelling van ten minste 1 jaar.
De voorwaarden en duur van de behandeling met ABILIFY (monotherapie en aanvullende therapie met antidepressiva of stemmingsstabilisatoren) omvatten (in overlappende categorieën) dubbelblinde, vergelijkende en niet-vergelijkende open-label onderzoeken, klinische en poliklinische onderzoeken, onderzoeken met vaste en flexibele doses, en blootstelling op korte en langere termijn.
Ervaring met klinische proeven
Volwassen patiënten met schizofrenie
De volgende bevindingen zijn gebaseerd op een pool van vijf placebogecontroleerde onderzoeken (vier van 4 weken en één van 6 weken) waarin orale ABILIFY 15 mg werd toegediend in doses variërend van 2 tot 30 mg/dag.
Vaak waargenomen bijwerkingen
De enige vaak waargenomen bijwerking die in verband wordt gebracht met het gebruik van ABILIFY 20 mg bij patiënten met schizofrenie (incidentie van 5% of meer en ABILIFY-incidentie ten minste tweemaal die voor placebo) was acathisie (ABILIFY 8%; placebo 4%).
Volwassen patiënten met bipolaire manie
Monotherapie
De volgende bevindingen zijn gebaseerd op een pool van 3 weken durende, placebogecontroleerde, bipolaire manie-onderzoeken waarin orale ABILIFY 15 mg werd toegediend in doses van 15 of 30 mg/dag.
Vaak waargenomen bijwerkingen
Vaak waargenomen bijwerkingen geassocieerd met het gebruik van ABILIFY bij patiënten met bipolaire manie (incidentie van 5% of meer en ABILIFY 15 mg incidentie minstens twee keer zo hoog als bij placebo) worden weergegeven in Tabel 16.
Minder vaak voorkomende bijwerkingen bij volwassenen
Tabel 17 somt de gepoolde incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute therapie (tot 6 weken bij schizofrenie en tot 3 weken bij bipolaire manie), inclusief alleen die reacties die optraden bij 2% of meer van de patiënten behandeld met ABILIFY (doses ≥ 2 mg/dag) en bij wie de incidentie bij patiënten behandeld met ABILIFY 20 mg hoger was dan de incidentie bij patiënten behandeld met placebo in de gecombineerde dataset.
Een onderzoek van populatiesubgroepen bracht geen duidelijk bewijs aan het licht van een differentiële incidentie van bijwerkingen op basis van leeftijd, geslacht of ras.
Volwassen patiënten met aanvullende therapie met bipolaire manie
De volgende bevindingen zijn gebaseerd op een placebogecontroleerd onderzoek bij volwassen patiënten met een bipolaire stoornis waarbij ABILIFY 15 mg werd toegediend in doses van 15 of 30 mg/dag als aanvullende therapie met lithium of valproaat.
Bijwerkingen die verband houden met stopzetting van de behandeling
In een onderzoek bij patiënten die al lithium of valproaat als monotherapie verdroegen, was het percentage stopzettingen vanwege bijwerkingen 12% voor patiënten die werden behandeld met adjuvante ABILIFY, vergeleken met 6% voor patiënten die werden behandeld met adjuvante placebo. De meest voorkomende bijwerkingen geassocieerd met stopzetting bij de adjuvante met ABILIFY behandelde patiënten in vergelijking met de met placebo behandelde patiënten waren acathisie (respectievelijk 5% en 1%) en tremor (respectievelijk 2% en 1%).
Vaak waargenomen bijwerkingen
De vaak waargenomen bijwerkingen geassocieerd met adjuvante ABILIFY en lithium of valproaat bij patiënten met bipolaire manie (incidentie van 5% of meer en incidentie ten minste tweemaal zo hoog als bij aanvullende placebo) waren: acathisie, slapeloosheid en extrapiramidale stoornis.
Minder vaak voorkomende bijwerkingen bij volwassen patiënten met aanvullende therapie bij bipolaire manie
Tabel 18 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute behandeling (tot 6 weken), inclusief alleen die reacties die optraden bij 2% of meer van de patiënten die werden behandeld met adjuvante ABILIFY (doses van 15 of 30 mg/dag) en lithium of valproaat en waarbij de incidentie bij patiënten die met deze combinatie werden behandeld hoger was dan de incidentie bij patiënten die werden behandeld met placebo plus lithium of valproaat.
Pediatrische patiënten (13 tot 17 jaar) met schizofrenie
De volgende bevindingen zijn gebaseerd op een placebogecontroleerd onderzoek van 6 weken waarin orale ABILIFY werd toegediend in doses variërend van 2 tot 30 mg/dag.
Bijwerkingen die verband houden met stopzetting van de behandeling
De incidentie van stopzetting vanwege bijwerkingen tussen met ABILIFY behandelde en met placebo behandelde pediatrische patiënten (13 tot 17 jaar) was respectievelijk 5% en 2%.
Vaak waargenomen bijwerkingen
Vaak waargenomen bijwerkingen die verband houden met het gebruik van ABILIFY 10 mg bij adolescente patiënten met schizofrenie (incidentie van 5% of meer en ABILIFY-incidentie ten minste tweemaal die voor placebo) waren extrapiramidale stoornis, slaperigheid en tremor.
Pediatrische patiënten (10 tot 17 jaar) met bipolaire manie
De volgende bevindingen zijn gebaseerd op een 4 weken durende, placebogecontroleerde studie waarin orale ABILIFY werd toegediend in doses van 10 of 30 mg/dag.
Bijwerkingen die verband houden met stopzetting van de behandeling
De incidentie van stopzetting vanwege bijwerkingen tussen met ABILIFY behandelde en met placebo behandelde pediatrische patiënten (10 tot 17 jaar) was respectievelijk 7% en 2%.
Vaak waargenomen bijwerkingen
Vaak waargenomen bijwerkingen die verband houden met het gebruik van ABILIFY 20 mg bij pediatrische patiënten met bipolaire manie (incidentie van 5% of meer en ABILIFY-incidentie ten minste tweemaal die voor placebo) worden weergegeven in Tabel 19.
Pediatrische patiënten (6 tot 17 jaar) met een autistische stoornis
De volgende bevindingen zijn gebaseerd op twee 8 weken durende, placebogecontroleerde onderzoeken waarin oraal ABILIFY 20 mg werd toegediend in doses van 2 tot 15 mg/dag.
Bijwerkingen die verband houden met stopzetting van de behandeling
De incidentie van stopzetting vanwege bijwerkingen tussen met ABILIFY behandelde en met placebo behandelde pediatrische patiënten (6 tot 17 jaar) was respectievelijk 10% en 8%.
Vaak waargenomen bijwerkingen
Vaak waargenomen bijwerkingen die verband houden met het gebruik van ABILIFY bij pediatrische patiënten met een autistische stoornis (incidentie van 5% of meer en ABILIFY 10 mg incidentie minstens twee keer zo hoog als bij placebo) worden weergegeven in Tabel 20.
Pediatrische patiënten (6 tot 18 jaar) met de stoornis van Gilles de la Tourette
De volgende bevindingen zijn gebaseerd op een placebogecontroleerd onderzoek van 8 weken en een van 10 weken waarin oraal ABILIFY 15 mg werd toegediend in doses van 2 tot 20 mg/dag.
Bijwerkingen die verband houden met stopzetting van de behandeling
De incidentie van stopzetting vanwege bijwerkingen tussen met ABILIFY behandelde en met placebo behandelde pediatrische patiënten (6 tot 18 jaar) was respectievelijk 7% en 1%.
Vaak waargenomen bijwerkingen
Vaak waargenomen bijwerkingen geassocieerd met het gebruik van ABILIFY bij pediatrische patiënten met de stoornis van Gilles de la Tourette (incidentie van 5% of meer en ABILIFY 10 mg incidentie minstens twee keer zo hoog als bij placebo) worden weergegeven in Tabel 21.
Minder vaak voorkomende bijwerkingen bij pediatrische patiënten (6 tot 18 jaar) met schizofrenie, bipolaire manie, autistische stoornis of de stoornis van Gilles de la Tourette
Tabel 22 somt de gepoolde incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute therapie (tot 6 weken bij schizofrenie, tot 4 weken bij bipolaire manie, tot 8 weken bij autistische stoornis en tot 10 weken bij de stoornis van Gilles de la Tourette), waaronder alleen die reacties die optraden bij 2% of meer van de pediatrische patiënten die werden behandeld met ABILIFY (doses ≥ 2 mg/dag) en waarbij de incidentie bij patiënten die werden behandeld met ABILIFY 10 mg hoger was dan de incidentie bij patiënten behandeld met placebo.
Volwassen patiënten die ABILIFY krijgen als aanvullende behandeling van depressieve stoornis
De volgende bevindingen zijn gebaseerd op een pool van twee placebogecontroleerde onderzoeken bij patiënten met depressieve stoornis waarbij ABILIFY 20 mg werd toegediend in doses van 2 mg tot 20 mg als aanvullende behandeling bij voortgezette antidepressiva.
Bijwerkingen die verband houden met stopzetting van de behandeling
De incidentie van stopzetting vanwege bijwerkingen was 6% voor adjuvante met ABILIFY behandelde patiënten en 2% voor adjuvante placebo-behandelde patiënten.
Vaak waargenomen bijwerkingen
De vaak waargenomen bijwerkingen geassocieerd met het gebruik van adjuvante ABILIFY 15 mg bij patiënten met depressieve stoornis (incidentie van 5% of meer en ABILIFY 15 mg incidentie minstens tweemaal zo groot als bij placebo) waren: acathisie, rusteloosheid, slapeloosheid, constipatie, vermoeidheid en wazig zicht.
Minder vaak voorkomende bijwerkingen bij volwassen patiënten met depressieve stoornis
Tabel 23 somt de gepoolde incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute therapie (tot 6 weken), inclusief alleen die bijwerkingen die optraden bij 2% of meer van de patiënten die werden behandeld met adjuvante ABILIFY (doses ≥ 2 mg/dag) en waarvoor de incidentie bij patiënten die werden behandeld met adjuvante ABILIFY 10 mg hoger was dan de incidentie bij patiënten die werden behandeld met adjuvante placebo in de gecombineerde dataset.
Patiënten met agitatie geassocieerd met schizofrenie of bipolaire manie (intramusculaire injectie)
De volgende bevindingen zijn gebaseerd op een pool van drie placebogecontroleerde onderzoeken bij patiënten met agitatie geassocieerd met schizofrenie of bipolaire manie waarbij ABILIFY 20 mg injectie werd toegediend in doses van 5,25 mg tot 15 mg.
Vaak waargenomen bijwerkingen
Er was één vaak waargenomen bijwerking (misselijkheid) geassocieerd met het gebruik van ABILIFY 10 mg injectie bij patiënten met agitatie geassocieerd met schizofrenie en bipolaire manie (incidentie van 5% of meer en ABILIFY 20 mg incidentie minstens twee keer zo hoog als bij placebo).
Minder vaak voorkomende bijwerkingen bij patiënten met agitatie geassocieerd met schizofrenie of bipolaire manie
Tabel 24 somt de gepoolde incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute therapie (24 uur), inclusief alleen die bijwerkingen die optraden bij 2% of meer van de patiënten die werden behandeld met ABILIFY-injectie (doses ≥5,25 mg /dag) en waarvoor de incidentie bij patiënten behandeld met ABILIFY 15 mg injectie hoger was dan de incidentie bij patiënten behandeld met placebo in de gecombineerde dataset.
Dosisgerelateerde bijwerkingen
Schizofrenie
Dosis-responsrelaties voor de incidentie van tijdens de behandeling optredende bijwerkingen werden geëvalueerd in vier onderzoeken bij volwassen patiënten met schizofrenie, waarbij verschillende vaste doses (2, 5, 10, 15, 20 en 30 mg/dag) orale ABILIFY werden vergeleken met placebo. Deze analyse, gestratificeerd per studie, gaf aan dat slaperigheid [inclusief sedatie] de enige bijwerking was met een mogelijke dosis-responsrelatie, en dan het meest prominent alleen met 30 mg; (incidenties waren placebo, 7,1%; 10 mg, 8,5%; 15 mg, 8,7%; 20 mg, 7,5%; 30 mg, 12,6%).
In de studie van pediatrische patiënten (13 tot 17 jaar) met schizofrenie, leken drie veel voorkomende bijwerkingen een mogelijke dosis-responsrelatie te hebben: extrapiramidale stoornis (incidenties waren placebo, 5,0%; 10 mg, 13,0%; 30 mg, 21,6 %); slaperigheid (incidenties waren placebo, 6,0%; 10 mg, 11,0%; 30 mg, 21,6%); en tremor (incidenties waren placebo, 2,0%; 10 mg, 2,0%; 30 mg, 11,8%).
Bipolaire manie
In de studie van pediatrische patiënten (10 tot 17 jaar) met bipolaire manie hadden vier veelvoorkomende bijwerkingen een mogelijke dosis-responsrelatie na 4 weken; extrapiramidale stoornis (incidenties waren placebo, 3,1%; 10 mg, 12,2%; 30 mg, 27,3%); slaperigheid (incidenties waren placebo, 3,1%; 10 mg, 19,4%; 30 mg, 26,3%); acathisie (incidenties waren placebo, 2,1%; 10 mg, 8,2%; 30 mg, 11,1%); en speekselhypersecretie (incidenties waren placebo, 0%; 10 mg, 3,1%; 30 mg, 8,1%).
Autistische stoornis
In een onderzoek bij pediatrische patiënten (6 tot 17 jaar) met een autistische stoornis had één veelvoorkomende bijwerking een mogelijke dosis-responsrelatie: vermoeidheid (incidenties waren placebo, 0%; 5 mg, 3,8%; 10 mg, 22,0%; 15 mg, 18,5%).
De stoornis van Gilles de la Tourette
In een onderzoek bij pediatrische patiënten (7 tot 17 jaar) met de stoornis van Gilles de la Tourette hadden geen enkele vaak voorkomende bijwerking een dosis-responsrelatie.
Extrapiramidale symptomen
Schizofrenie
In kortdurende, placebogecontroleerde onderzoeken naar schizofrenie bij volwassenen was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor met ABILIFY behandelde patiënten 13% versus 12% voor placebo; en de incidentie van acathisie-gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 8% vs. 4% voor placebo. In het kortdurende, placebogecontroleerde onderzoek naar schizofrenie bij pediatrische patiënten (13 tot 17 jaar) was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor met ABILIFY behandelde patiënten 25% vs. 7% voor placebo; en de incidentie van acathisie-gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 9% vs. 6% voor placebo.
Objectief verzamelde gegevens van die onderzoeken werden verzameld op de Simpson Angus Rating Scale (voor EPS), de Barnes Akathisia Scale (voor acathisie) en de Assessments of Involuntary Movement Scales (voor dyskinesieën). In de onderzoeken naar schizofrenie bij volwassenen lieten de objectief verzamelde gegevens geen verschil zien tussen ABILIFY 10 mg en placebo, met uitzondering van de Barnes Akathisia-schaal (ABILIFY 20 mg, 0,08; placebo, -0,05). In het onderzoek naar schizofrenie bij kinderen (13 tot 17 jaar) lieten de objectief verzamelde gegevens geen verschil zien tussen ABILIFY 20 mg en placebo, met uitzondering van de Simpson Angus Rating Scale (ABILIFY 20 mg, 0,24; placebo, -0,29).
Evenzo werden in een langetermijn (26 weken), placebogecontroleerd onderzoek naar schizofrenie bij volwassenen, objectief gegevens verzameld over de Simpson Angus Rating Scale (voor EPS), de Barnes Akathisia Scale (voor acathisie) en de Assessments of Involuntary Bewegingsschalen (voor dyskinesieën) lieten geen verschil zien tussen ABILIFY en placebo.
Bipolaire manie
In de kortdurende, placebogecontroleerde onderzoeken naar bipolaire manie bij volwassenen was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor monotherapie met ABILIFY behandelde patiënten 16% vs. 8% voor placebo en de incidentie van acathisie-gerelateerde voorvallen voor monotherapie met ABILIFY behandelde patiënten was 13% vs. 4% voor placebo. In het 6 weken durende, placebogecontroleerde onderzoek naar bipolaire manie voor adjuvante therapie met lithium of valproaat, was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie voor adjuvante ABILIFY-behandelde patiënten, 15% vs. 8% voor adjuvante placebo en de incidentie van acathisie-gerelateerde voorvallen voor adjuvante met ABILIFY behandelde patiënten was 19% vs. 5% voor adjuvante placebo. In het kortdurende, placebogecontroleerde onderzoek naar bipolaire manie bij pediatrische (10 tot 17 jaar) patiënten was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor met ABILIFY behandelde patiënten 26% vs. 5% voor placebo en de incidentie van acathisie-gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 10% vs. 2% voor placebo.
In de volwassen bipolaire manie-onderzoeken met ABILIFY als monotherapie, lieten de Simpson Angus Rating Scale en de Barnes Akathisia Scale een significant verschil zien tussen ABILIFY 15 mg en placebo (ABILIFY, 0,50; placebo, -0,01 en ABILIFY 10 mg, 0,21; placebo, -0,05). Veranderingen in de beoordelingen van onvrijwillige bewegingsschalen waren vergelijkbaar voor de ABILIFY 15 mg- en placebogroepen. In de bipolaire manie-onderzoeken met ABILIFY 20 mg als aanvullende therapie met lithium of valproaat, lieten de Simpson Angus Rating Scale en de Barnes Akathisia Scale een significant verschil zien tussen aanvullende ABILIFY en aanvullende placebo (ABILIFY 20 mg, 0,73; placebo, 0,07 en ABILIFY 10 mg, 0,30; placebo, 0,11). Veranderingen in de beoordelingen van onvrijwillige bewegingsschalen waren vergelijkbaar voor adjuvante ABILIFY 20 mg en adjuvante placebo. In de pediatrische (10 tot 17 jaar), kortdurende bipolaire manie-studie, toonde de Simpson Angus Rating Scale een significant verschil tussen ABILIFY 10 mg en placebo (ABILIFY 15 mg, 0,90; placebo, -0,05). Veranderingen in de Barnes Akathisia Scale en de Assessments of Involuntary Movement Scales waren vergelijkbaar voor de ABILIFY 20 mg- en placebogroepen.
Ernstige depressieve stoornis
In de kortdurende, placebogecontroleerde onderzoeken bij depressieve stoornis was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor adjuvante ABILIFY-behandelde patiënten 8% versus 5% voor adjuvante placebo-behandelde patiënten; en de incidentie van acathisie-gerelateerde voorvallen voor adjuvante met ABILIFY behandelde patiënten was 25% vs. 4% voor adjuvante placebo-behandelde patiënten.
In de onderzoeken naar depressieve stoornissen lieten de Simpson Angus Rating Scale en de Barnes Akathisia Scale een significant verschil zien tussen adjuvante ABILIFY en adjuvante placebo (ABILIFY 10 mg, 0,31; placebo, 0,03 en ABILIFY, 0,22; placebo, 0,02). Veranderingen in de beoordelingen van onvrijwillige bewegingsschalen waren vergelijkbaar voor de adjuvante ABILIFY- en adjuvante placebogroepen.
Autistische stoornis
In de kortdurende, placebogecontroleerde onderzoeken naar autistische stoornis bij pediatrische patiënten (6 tot 17 jaar) was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor met ABILIFY behandelde patiënten 18% vs. 2% voor placebo en de incidentie van acathisie-gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 3% vs. 9% voor placebo.
In de pediatrische (6 tot 17 jaar) kortdurende autistische stoornisstudies liet de Simpson Angus Rating Scale een significant verschil zien tussen ABILIFY en placebo (ABILIFY 20 mg, 0,1; placebo, -0,4). Veranderingen in de Barnes Akathisia Scale en de Assessments of Involuntary Movement Scales waren vergelijkbaar voor de ABILIFY 10 mg- en placebogroepen.
De stoornis van Gilles de la Tourette
In de kortdurende, placebogecontroleerde onderzoeken naar de stoornis van Gilles de la Tourette bij pediatrische patiënten (6 tot 18 jaar) was de incidentie van gerapporteerde EPS-gerelateerde voorvallen, met uitzondering van voorvallen gerelateerd aan acathisie, voor met ABILIFY behandelde patiënten 7% vs. 6% voor placebo en de incidentie van acathisie-gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 4% vs. 6% voor placebo.
In de pediatrische (6 tot 18 jaar) kortdurende onderzoeken naar de stoornis van Gilles de la Tourette waren veranderingen in de Simpson Angus Rating Scale, Barnes Akathisia Scale en Assessments of Involuntary Movement Scale niet klinisch significant verschillend voor ABILIFY 15 mg en placebo.
Agitatie geassocieerd met schizofrenie of bipolaire manie
In de placebogecontroleerde onderzoeken bij patiënten met agitatie geassocieerd met schizofrenie of bipolaire manie, was de incidentie van gerapporteerde EPS-gerelateerde voorvallen met uitzondering van voorvallen gerelateerd aan acathisie voor met ABILIFY behandelde patiënten 2% vs. 2% voor placebo en de incidentie van acathisie- gerelateerde voorvallen voor met ABILIFY behandelde patiënten was 2% vs. 0% voor placebo. Objectief verzamelde gegevens over de Simpson Angus Rating Scale (voor EPS) en de Barnes Akathisia Scale (voor acathisie) voor alle behandelingsgroepen lieten geen verschil zien tussen ABILIFY 10 mg en placebo.
Dystonie
Symptomen van dystonie, langdurige abnormale samentrekkingen van spiergroepen, kunnen optreden bij gevoelige personen tijdens de eerste paar dagen van de behandeling. Dystonische symptomen zijn onder meer: spasmen van de nekspieren, soms overgaand in een beklemmend gevoel in de keel, moeite met slikken, ademhalingsmoeilijkheden en/of uitpuilende tong. Hoewel deze symptomen bij lage doses kunnen optreden, komen ze vaker en ernstiger voor bij een hoge potentie en bij hogere doses antipsychotica van de eerste generatie. Een verhoogd risico op acute dystonie wordt waargenomen bij mannen en jongere leeftijdsgroepen.
Aanvullende bevindingen waargenomen in klinische onderzoeken
Bijwerkingen bij langdurige, dubbelblinde, placebo-gecontroleerde onderzoeken
De bijwerkingen die werden gemeld in een 26 weken durende, dubbelblinde studie waarin oraal ABILIFY 10 mg en placebo werden vergeleken bij patiënten met schizofrenie waren over het algemeen consistent met de bijwerkingen die werden gemeld in de kortdurende, placebogecontroleerde onderzoeken, behalve een hogere incidentie van tremor [8] % (12/153) voor ABILIFY 20 mg vs. 2% (3/153) voor placebo]. In deze studie waren de meeste gevallen van tremor van lichte intensiteit (8/12 licht en 4/12 matig), traden ze vroeg in de behandeling op (9/12 49 dagen) en waren ze van beperkte duur (7/12 ≤). 10 dagen). Tremor leidde zelden tot stopzetting (
Andere bijwerkingen waargenomen tijdens de premarketingevaluatie van ABILIFY
De volgende lijst bevat geen reacties: 1) die al in eerdere tabellen of elders in de etikettering zijn vermeld, 2) waarvoor een medicijnveroorzaker ver weg was, 3) die zo algemeen waren dat ze niet informatief waren, 4) die niet als significant werden beschouwd klinische implicaties, of 5) die optraden met een snelheid gelijk aan of lager dan die van placebo.
Reacties worden gecategoriseerd per lichaamssysteem volgens de volgende definities: frequente bijwerkingen zijn bijwerkingen die optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij 1/100 tot 1/1000 patiënten; zeldzame reacties komen voor bij minder dan 1/1000 patiënten:
Volwassenen - orale toediening
Bloed- en lymfestelselaandoeningen: zelden - trombocytopenie
Hartaandoeningen: zelden - bradycardie, hartkloppingen, zelden - atriale flutter, hartstilstand, atrioventriculair blok, atriale fibrillatie, angina pectoris, myocardischemie, myocardinfarct, cardiopulmonaal falen
Oogaandoeningen: zeldzaam - fotofobie; zeldzaam - diplopie
Maagdarmstelselaandoeningen: zeldzaam - gastro-oesofageale refluxziekte
Algemene aandoeningen en toedieningsplaatsvoorwaarden: frequent - asthenie; zeldzaam - perifeer oedeem, pijn op de borst; zeldzaam - gezichtsoedeem
Lever- en galaandoeningen: zelden - hepatitis, geelzucht
Immuunsysteemaandoeningen : zelden - overgevoeligheid
Letsel, vergiftiging en procedurele complicaties: zeldzaam - vallen; zeldzaam - hitteberoerte
onderzoeken: vaak - gewichtsafname, zelden - leverenzymen verhoogd, bloedglucose verhoogd, bloedlactaatdehydrogenase verhoogd, gamma-glutamyltransferase verhoogd; zelden - verhoogd bloedprolactine, verhoogd bloedureum, verhoogd bloedcreatinine, verhoogd bloedbilirubine, verlengd QT-interval op elektrocardiogram, verhoogd geglycosyleerd hemoglobine
Metabolisme en voedingsstoornissen: frequent - anorexia; zelden - hypokaliëmie, hyponatriëmie, hypoglykemie
Musculoskeletale en bindweefselaandoeningen: zeldzaam - spierzwakte, spierstrakheid; zelden - rabdomyolyse, verminderde mobiliteit
Zenuwstelselaandoeningen: zeldzaam - parkinsonisme, geheugenstoornis, tandradstijfheid, hypokinesie, bradykinesie; zelden - akinesie, myoclonus, abnormale coördinatie, spraakstoornis, Grand Mal-convulsie;
Psychische stoornissen: zeldzaam - agressie, verlies van libido, delirium; zelden - verhoogd libido, anorgasmie, tic, moordgedachten, katatonie, slaapwandelen
Nier- en urinewegaandoeningen: zelden - urineretentie, nocturie
Voortplantingsstelsel en borstaandoeningen: zeldzaam - erectiestoornissen; zelden - gynaecomastie, onregelmatige menstruatie, amenorroe, pijn in de borsten, priapisme
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: zeldzaam - verstopte neus, dyspnoe
Huid- en onderhuidaandoeningen: zeldzaam - huiduitslag, hyperhidrose, pruritus, fotosensibiliteitsreactie, alopecia; zeldzaam - urticaria
Bloedvataandoeningen: zeldzaam - hypotensie, hypertensie
Pediatrische patiënten - orale toediening
De meeste bijwerkingen die werden waargenomen in de gepoolde database van 1.686 pediatrische patiënten in de leeftijd van 6 tot 18 jaar, werden ook waargenomen bij de volwassen populatie. Bijkomende bijwerkingen die zijn waargenomen bij pediatrische patiënten worden hieronder vermeld.
Oogaandoeningen zeldzaam - oculogyrische crisis
Maagdarmstelselaandoeningen: zeldzaam - droge tong, tongkrampen
onderzoeken: vaak - bloedinsuline verhoogd
Zenuwstelselaandoeningen: zelden - slaap praten
Nier- en urinewegaandoeningen frequent - enuresis
Huid- en onderhuidaandoeningen: zeldzaam - hirsutisme
Volwassenen - Intramusculaire injectie
De meeste bijwerkingen die werden waargenomen in de gepoolde database van 749 volwassen patiënten die werden behandeld met ABILIFY-injectie, werden ook waargenomen bij de volwassen populatie die werd behandeld met oraal ABILIFY. Aanvullende bijwerkingen die zijn waargenomen bij de ABILIFY-injectiepopulatie worden hieronder vermeld.
Algemene aandoeningen en toedieningsplaatsvoorwaarden: ≥1/100 patiënten - reactie op de injectieplaats; ≥1/1000 patiënten en
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van ABILIFY na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen: optreden van allergische reacties (anafylactische reactie, angio-oedeem, laryngospasme, pruritus/urticaria of orofaryngeale spasme), pathologisch gokken , hikken en bloedglucoseschommelingen.
DRUG-INTERACTIES
Geneesmiddelen met klinisch belangrijke interacties met ABILIFY
Geneesmiddelen zonder klinisch belangrijke interacties met ABILIFY
Op basis van farmacokinetische onderzoeken is geen dosisaanpassing van ABILIFY nodig bij gelijktijdige toediening met famotidine, valproaat, lithium en lorazepam.
Bovendien is er geen dosisaanpassing nodig voor substraten van CYP2D6 (bijv. dextromethorfan, fluoxetine, paroxetine of venlafaxine), CYP2C9 (bijv. warfarine), CYP2C19 (bijv. omeprazol, warfarine, escitalopram) of CYP3A4 (bijv. dextromethorfan). indien gelijktijdig toegediend met ABILIFY. Bovendien is er geen dosisaanpassing nodig voor valproaat, lithium, lamotrigine, lorazepam of sertraline bij gelijktijdige toediening met ABILIFY (zie KLINISCHE FARMACOLOGIE ].
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
ABILIFY is geen gereguleerde stof.
Misbruik
ABILIFY is niet systematisch onderzocht bij mensen vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. Patiënten moeten daarom zorgvuldig worden beoordeeld op een voorgeschiedenis van drugsmisbruik en dergelijke patiënten moeten nauwlettend worden geobserveerd op tekenen van misbruik of misbruik van ABILIFY 20 mg (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar drugs).
Afhankelijkheid
In onderzoeken naar lichamelijke afhankelijkheid bij apen werden ontwenningsverschijnselen waargenomen na abrupte stopzetting van de dosering. Hoewel de klinische onderzoeken geen enkele neiging tot het zoeken naar drugs aan het licht brachten, waren deze waarnemingen niet systematisch en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in welke mate een geneesmiddel dat op het centrale zenuwstelsel werkt, zal worden misbruikt, omgeleid, en/of misbruikt zodra ze op de markt zijn gebracht.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Verhoogde sterfte
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. ABILIFY (aripiprazol) is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose (zie OMKADERDE WAARSCHUWING ).
Veiligheidservaring bij oudere patiënten met psychose geassocieerd met de ziekte van Alzheimer
In drie, 10 weken durende, placebogecontroleerde onderzoeken met ABILIFY 10 mg bij oudere patiënten met psychose geassocieerd met de ziekte van Alzheimer (n=938; gemiddelde leeftijd: 82,4 jaar; bereik: 56-99 jaar), werden de bijwerkingen gerapporteerd met een incidentie van ≥ 3% en een incidentie van ABILIFY 15 mg die minstens tweemaal zo hoog was als die voor placebo waren lethargie  [placebo 2%, ABILIFY 5%], slaperigheid (inclusief sedatie) [placebo 3%, ABILIFY 8%] en incontinentie (voornamelijk , urine-incontinentie) [placebo 1%, ABILIFY 5%], overmatige speekselvloed [placebo 0%, ABILIFY 4%] en duizeligheid [placebo 1%, ABILIFY 4%].
De veiligheid en werkzaamheid van ABILIFY 15 mg bij de behandeling van patiënten met psychose geassocieerd met dementie zijn niet vastgesteld. Als de voorschrijver ervoor kiest om dergelijke patiënten met ABILIFY 15 mg te behandelen, beoordeel dan het optreden van slikproblemen of overmatige slaperigheid, wat vatbaar zou kunnen zijn voor accidenteel letsel of aspiratie [zie GEVAARLIJKE WAARSCHUWING: ].
Cerebrovasculaire bijwerkingen, waaronder beroerte
In placebogecontroleerde klinische onderzoeken (twee onderzoeken met flexibele doses en één met een vaste dosis) van aan dementie gerelateerde psychose, was er een verhoogde incidentie van cerebrovasculaire bijwerkingen (bijv. beroerte, voorbijgaande ischemische aanval), inclusief dodelijke afloop, bij met ABILIFY behandelde patiënten ( gemiddelde leeftijd: 84 jaar; bereik: 78-88 jaar). In het onderzoek met vaste dosis was er een statistisch significante dosis-responsrelatie voor cerebrovasculaire bijwerkingen bij patiënten die werden behandeld met ABILIFY. ABILIFY is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: ].
Zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jonge volwassenen
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende, placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18-24 jaar) met MDD en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve-compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in Tabel 5.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die werden behandeld met antidepressiva voor MDD en voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen die de patiënt vertoonde.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor ABILIFY moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie.
Opgemerkt moet worden dat ABILIFY 20 mg niet is goedgekeurd voor gebruik bij de behandeling van depressie bij pediatrische patiënten.
Maligne neurolepticasyndroom (NMS)
Een potentieel fataal symptoomcomplex dat soms wordt aangeduid als maligne neurolepticasyndroom (MNS), kan optreden bij toediening van antipsychotica, waaronder ABILIFY. zeldzame gevallen van MNS deden zich voor tijdens behandeling met ABILIFY 15 mg in de wereldwijde klinische database. Klinische manifestaties van MNS zijn hyperpyrexie, spierstijfheid, veranderde mentale toestand en tekenen van autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen). Bijkomende symptomen kunnen zijn: verhoogde creatinefosfokinase, myoglobinurie (rabdomyolyse) en acuut nierfalen.
De diagnostische evaluatie van patiënten met dit syndroom is gecompliceerd. Om tot een diagnose te komen, is het belangrijk om gevallen uit te sluiten waarin de klinische presentatie zowel een ernstige medische aandoening (bijv. longontsteking, systemische infectie) als onbehandelde of onvoldoende behandelde extrapiramidale tekenen en symptomen (EPS) omvat. Andere belangrijke overwegingen bij de differentiële diagnose zijn centrale anticholinerge toxiciteit, hitteberoerte, medicijnkoorts en primaire pathologie van het centrale zenuwstelsel.
De behandeling van MNS moet het volgende omvatten: 1) onmiddellijke stopzetting van antipsychotica en andere geneesmiddelen die niet essentieel zijn voor gelijktijdige therapie; 2) intensieve symptomatische behandeling en medische monitoring; en 3) behandeling van eventuele bijkomende ernstige medische problemen waarvoor specifieke behandelingen beschikbaar zijn. Er is geen algemene overeenstemming over specifieke farmacologische behandelingsregimes voor ongecompliceerde MNS.
Als een patiënt behandeling met antipsychotica nodig heeft na herstel van MNS, moet de mogelijke herintroductie van medicamenteuze therapie zorgvuldig worden overwogen. De patiënt moet zorgvuldig worden gecontroleerd, aangezien recidieven van MNS zijn gemeld.
Tardieve dyskinesie
Bij patiënten die met antipsychotica worden behandeld, kan zich een syndroom van mogelijk onomkeerbare, onwillekeurige, dyskinetische bewegingen ontwikkelen. Hoewel de prevalentie van het syndroom het hoogst lijkt te zijn bij ouderen, vooral bij oudere vrouwen, is het onmogelijk om te vertrouwen op prevalentieschattingen om bij aanvang van de antipsychotische behandeling te voorspellen welke patiënten het syndroom waarschijnlijk zullen ontwikkelen. Of antipsychotica verschillen in hun potentieel om tardieve dyskinesie te veroorzaken, is niet bekend.
Aangenomen wordt dat het risico op het ontwikkelen van tardieve dyskinesie en de kans dat het onomkeerbaar wordt, toeneemt naarmate de duur van de behandeling en de totale cumulatieve dosis antipsychotica die aan de patiënt worden toegediend toenemen. Het syndroom kan zich echter ontwikkelen, hoewel veel minder vaak, na relatief korte behandelingsperioden met lage doses.
Tardieve dyskinesie kan geheel of gedeeltelijk verdwijnen als de behandeling met antipsychotica wordt stopgezet. Behandeling met antipsychotica zelf kan echter de tekenen en symptomen van het syndroom onderdrukken (of gedeeltelijk) en kan daardoor mogelijk het onderliggende proces maskeren. Het effect dat symptomatische onderdrukking heeft op het lange termijn beloop van het syndroom is onbekend.
Gezien deze overwegingen moet ABILIFY worden voorgeschreven op een manier die het optreden van tardieve dyskinesie zo klein mogelijk maakt. Chronische behandeling met antipsychotica dient in het algemeen te worden voorbehouden aan patiënten die lijden aan een chronische ziekte waarvan (1) bekend is dat deze reageert op antipsychotica en (2) voor wie alternatieve, even effectieve, maar mogelijk minder schadelijke behandelingen niet beschikbaar of geschikt zijn. Bij patiënten die wel een chronische behandeling nodig hebben, moet worden gestreefd naar de kleinste dosis en de kortste behandelingsduur die een bevredigende klinische respons oplevert. De noodzaak van voortzetting van de behandeling moet periodiek opnieuw worden beoordeeld.
Als er tekenen en symptomen van tardieve dyskinesie optreden bij een patiënt die ABILIFY gebruikt, moet worden overwogen om de behandeling met het geneesmiddel te staken. Sommige patiënten kunnen echter ondanks de aanwezigheid van het syndroom toch een behandeling met ABILIFY 15 mg nodig hebben.
Metabolische veranderingen
Atypische antipsychotica zijn in verband gebracht met metabole veranderingen, waaronder hyperglykemie/diabetes mellitus, dyslipidemie en gewichtstoename. Hoewel is aangetoond dat alle geneesmiddelen in de klasse enkele metabole veranderingen veroorzaken, heeft elk medicijn zijn eigen specifieke risicoprofiel.
Hyperglykemie/diabetes mellitus
Hyperglykemie, in sommige gevallen extreem en geassocieerd met ketoacidose of hyperosmolair coma of overlijden, is gemeld bij patiënten die werden behandeld met atypische antipsychotica. Er zijn meldingen geweest van hyperglykemie bij patiënten die werden behandeld met ABILIFY [zie: ONGEWENSTE REACTIES ]. De beoordeling van de relatie tussen atypisch antipsychoticagebruik en glucoseafwijkingen wordt bemoeilijkt door de mogelijkheid van een verhoogd achtergrondrisico op diabetes mellitus bij patiënten met schizofrenie en de toenemende incidentie van diabetes mellitus in de algemene bevolking. Gezien deze confounders is de relatie tussen atypisch antipsychoticagebruik en hyperglykemiegerelateerde bijwerkingen niet volledig begrepen. Epidemiologische onderzoeken wijzen echter op een verhoogd risico op hyperglykemiegerelateerde bijwerkingen bij patiënten die worden behandeld met de atypische antipsychotica. Omdat ABILIFY niet op de markt was op het moment dat deze onderzoeken werden uitgevoerd, is het niet bekend of ABILIFY in verband wordt gebracht met dit verhoogde risico. Precieze risicoschattingen voor aan hyperglykemie gerelateerde bijwerkingen bij patiënten die worden behandeld met atypische antipsychotica zijn niet beschikbaar.
Patiënten met een vastgestelde diagnose diabetes mellitus die worden gestart met atypische antipsychotica, moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten met risicofactoren voor diabetes mellitus (bijv. obesitas, familiegeschiedenis van diabetes) die beginnen met een behandeling met atypische antipsychotica, moeten aan het begin van de behandeling en periodiek tijdens de behandeling een nuchtere bloedglucosetest ondergaan. Elke patiënt die met atypische antipsychotica wordt behandeld, moet worden gecontroleerd op symptomen van hyperglykemie, waaronder polydipsie, polyurie, polyfagie en zwakte. Patiënten die symptomen van hyperglykemie ontwikkelen tijdens behandeling met atypische antipsychotica, moeten een nuchtere bloedglucosetest ondergaan. In sommige gevallen is de hyperglykemie verdwenen toen het atypische antipsychoticum werd stopgezet; bij sommige patiënten was het echter nodig om de antidiabetische behandeling voort te zetten ondanks het stopzetten van het verdachte geneesmiddel.
volwassenen
In een analyse van 13 placebogecontroleerde monotherapieonderzoeken bij volwassenen, voornamelijk met schizofrenie of bipolaire stoornis, was de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten (+4,4 mg/dL; mediane blootstelling 25 dagen; N=1057) niet significant. anders dan bij met placebo behandelde patiënten (+2,5 mg/dl; mediane blootstelling 22 dagen; N=799). Tabel 6 toont het aandeel van met ABILIFY behandelde patiënten met normale en borderline nuchtere glucose bij baseline (mediane blootstelling 25 dagen) die tijdens de behandeling optredende hoge nuchtere glucosemetingen hadden in vergelijking met met placebo behandelde patiënten (mediane blootstelling 22 dagen).
Na 24 weken was de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten niet significant anders dan bij met placebo behandelde patiënten [respectievelijk +2,2 mg/dL (n=42) en +9,6 mg/dL (n=28)] .
De gemiddelde verandering in nuchtere glucose bij met adjuvante ABILIFY behandelde patiënten met depressieve stoornis (+0,7 mg/dl; mediane blootstelling 42 dagen; N=241) was niet significant verschillend van die bij met placebo behandelde patiënten (+0,8 mg/dl; mediaan). blootstelling 42 dagen; N=246). Tabel 7 toont het percentage volwassen patiënten met veranderingen in nuchtere glucosespiegels uit twee placebogecontroleerde, aanvullende onderzoeken (mediane blootstelling 42 dagen) bij patiënten met depressieve stoornis.
Pediatrische patiënten en adolescenten
In een analyse van twee placebogecontroleerde onderzoeken bij adolescenten met schizofrenie (13 tot 17 jaar) en pediatrische patiënten met een bipolaire stoornis (10 tot 17 jaar), bleek de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten (+4,8 mg/dL; met een mediane blootstelling van 43 dagen; N=259) was niet significant anders dan bij met placebo behandelde patiënten (+1,7 mg/dL; met een mediane blootstelling van 42 dagen; N=123).
In een analyse van twee placebogecontroleerde onderzoeken bij pediatrische en adolescente patiënten met prikkelbaarheid geassocieerd met autistische stoornis (6 tot 17 jaar) met een mediane blootstelling van 56 dagen, was de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten (-0,2 mg /dL; N=83) was niet significant anders dan bij met placebo behandelde patiënten (-0,6 mg/dL; N=33).
In een analyse van twee placebogecontroleerde onderzoeken bij pediatrische en adolescente patiënten met de stoornis van Gilles de la Tourette (6 tot 18 jaar) met een mediane blootstelling van 57 dagen, was de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten (0,79 mg/dL; N=90) was niet significant anders dan bij met placebo behandelde patiënten (–1,66 mg/dL; N=58).
Tabel 8 toont het percentage patiënten met veranderingen in nuchtere glucosespiegels van de gepoolde adolescente schizofrenie en pediatrische bipolaire patiënten (mediane blootstelling van 42-43 dagen), van twee placebogecontroleerde onderzoeken bij pediatrische patiënten (6 tot 17 jaar) met prikkelbaarheid geassocieerd met een autistische stoornis (mediane blootstelling van 56 dagen), en uit de twee placebogecontroleerde onderzoeken bij pediatrische patiënten (6 tot 18 jaar) met de stoornis van Gilles de la Tourette (mediane blootstelling 57 dagen).
Na 12 weken in de gepoolde onderzoeken naar schizofrenie bij adolescenten en pediatrische bipolaire stoornis, was de gemiddelde verandering in nuchtere glucose bij met ABILIFY behandelde patiënten niet significant anders dan bij met placebo behandelde patiënten [+2,4 mg/dL (n=81) en +0,1 mg /dL (n=15), respectievelijk].
dyslipidemie
Bij patiënten die met atypische antipsychotica werden behandeld, zijn ongewenste veranderingen in de lipiden waargenomen.
Er waren geen significante verschillen tussen met ABILIFY en placebo behandelde patiënten in de verhouding met veranderingen van normale naar klinisch significante niveaus voor nuchtere/niet-nuchtere totale cholesterol, nuchtere triglyceriden, nuchtere LDL's en nuchtere/niet-nuchtere HDL's. Analyses van patiënten met een blootstelling van ten minste 12 of 24 weken werden beperkt door een klein aantal patiënten.
volwassenen
Tabel 9 toont het aandeel volwassen patiënten, voornamelijk uit gepoolde placebogecontroleerde onderzoeken naar schizofrenie en bipolaire stoornis als monotherapie, met veranderingen in totaal cholesterol (gepoold uit 17 onderzoeken; mediane blootstelling 21 tot 25 dagen), nuchtere triglyceriden (gepoold uit acht onderzoeken; mediaan blootstelling 42 dagen), nuchtere LDL-cholesterol (gepoold uit acht onderzoeken; mediane blootstelling 39 tot 45 dagen, behalve voor met placebo behandelde patiënten met baseline normale nuchtere LDL-metingen, die een mediane behandelingsblootstelling van 24 dagen hadden) en HDL-cholesterol (gepoold van negen onderzoeken; mediane blootstelling 40 tot 42 dagen).
In monotherapiestudies bij volwassenen was het percentage patiënten na 12 weken en 24 weken met veranderingen van normaal naar hoog in totaal cholesterol (nuchter/niet nuchter), nuchtere triglyceriden en nuchter LDL-cholesterol vergelijkbaar tussen ABILIFY- en placebobehandelde patiënten: op 12 weken, totaal cholesterol (vasten/niet vasten), 1/71 (1,4%) vs. 3/74 (4,1%); Nuchtere triglyceriden, 8/62 (12,9%) versus 5/37 (13,5%); Nuchter LDL-cholesterol, respectievelijk 0/34 (0%) vs. 1/25 (4,0%); en na 24 weken totaal cholesterol (nuchter/niet vastend), 1/42 (2,4%) vs. 3/37 (8,1%); Nuchtere triglyceriden, 5/34 (14,7%) versus 5/20 (25%); Nuchter LDL-cholesterol, respectievelijk 0/22 (0%) vs. 1/18 (5,6%).
Tabel 10 toont het percentage patiënten met veranderingen in totaal cholesterol (nuchter/niet nuchter), nuchtere triglyceriden, nuchter LDL-cholesterol en HDL-cholesterol uit twee placebogecontroleerde aanvullende onderzoeken bij volwassen patiënten met depressieve stoornis (mediane blootstelling 42 dagen).
Pediatrische patiënten en adolescenten
Tabel 11 toont het aandeel adolescenten met schizofrenie (13 tot 17 jaar) en pediatrische patiënten met een bipolaire stoornis (10 tot 17 jaar) met veranderingen in totaal cholesterol en HDL-cholesterol (gepoold uit twee placebogecontroleerde onderzoeken; mediane blootstelling 42 tot 43 dagen ) en nuchtere triglyceriden (gepoold uit twee placebogecontroleerde onderzoeken; mediane blootstelling 42 tot 44 dagen).

In monotherapieonderzoeken bij adolescenten met schizofrenie en pediatrische patiënten met een bipolaire stoornis was het percentage patiënten na 12 weken en 24 weken met veranderingen van normaal naar hoog in totaal cholesterol (nuchter/niet nuchter), nuchtere triglyceriden en nuchter LDL-cholesterol vergelijkbaar tussen ABILIFY - en met placebo behandelde patiënten: na 12 weken totaal cholesterol (nuchter/niet nuchter), 0/57 Â (0%) vs. 0/15 (0%); Nuchtere triglyceriden, respectievelijk 2/72 (2,8%) versus 1/14 (7,1%); en na 24 weken totaal cholesterol (nuchter/niet nuchter), 0/36 (0%) vs. 0/12 (0%); Nuchtere triglyceriden, respectievelijk 1/47 (2,1%) versus 1/10 (10,0%).
Tabel 12 toont het percentage patiënten met veranderingen in totaal cholesterol (nuchter/niet nuchter) en nuchtere triglyceriden (mediane blootstelling 56 dagen) en HDL-cholesterol (mediane blootstelling 55 tot 56 dagen) uit twee placebogecontroleerde onderzoeken bij pediatrische patiënten (6 tot 17 jaar) met prikkelbaarheid geassocieerd met een autistische stoornis.
Tabel 13 toont het percentage patiënten met veranderingen in totaal cholesterol (nuchter/niet nuchter) en nuchtere triglyceriden (mediane blootstelling 57 dagen) en HDL-cholesterol (mediane blootstelling 57 dagen) uit twee placebogecontroleerde onderzoeken bij pediatrische patiënten (6 tot 18 jaar) met de stoornis van Gilles de la Tourette.
Gewichtstoename
Gewichtstoename is waargenomen bij gebruik van atypische antipsychotica. Klinische controle van het gewicht wordt aanbevolen.
volwassenen
In een analyse van 13 placebogecontroleerde monotherapieonderzoeken, voornamelijk van gepoolde schizofrenie en bipolaire stoornis, met een mediane blootstelling van 21 tot 25 dagen, was de gemiddelde verandering in lichaamsgewicht bij met ABILIFY behandelde patiënten +0,3 kg (N=1673) vergeleken met tot -0,1 kg (N=1100) bij placebogecontroleerde patiënten. Na 24 weken was de gemiddelde verandering vanaf baseline in lichaamsgewicht bij met ABILIFY behandelde patiënten -1,5 kg (n=73) vergeleken met -0,2 kg (n=46) bij met placebo behandelde patiënten.
In de onderzoeken waarbij ABILIFY aan antidepressiva werd toegevoegd, kregen de patiënten eerst 8 weken behandeling met antidepressiva, gevolgd door 6 weken aanvullende ABILIFY 10 mg of placebo naast hun lopende behandeling met antidepressiva. De gemiddelde verandering in lichaamsgewicht bij patiënten die adjuvante ABILIFY kregen was +1,7 kg (N=347) vergeleken met +0,4 kg (N=330) bij patiënten die adjuvante placebo kregen.
Tabel 14 toont het percentage volwassen patiënten met een gewichtstoename van ≥7% van het lichaamsgewicht per indicatie.
Pediatrische patiënten en adolescenten
In een analyse van twee placebogecontroleerde onderzoeken bij adolescenten met schizofrenie (13 tot 17 jaar) en pediatrische patiënten met een bipolaire stoornis (10 tot 17 jaar) met een mediane blootstelling van 42 tot 43 dagen, was de gemiddelde verandering in lichaamsgewicht bij met ABILIFY behandelde patiënten was +1,6 kg (N=381) vergeleken met +0,3 kg (N=187) bij met placebo behandelde patiënten. Na 24 weken was de gemiddelde verandering ten opzichte van de uitgangswaarde in lichaamsgewicht in
De met ABILIFY behandelde patiënten waren +5,8 kg (n=62) vergeleken met +1,4 kg (n=13) bij de met placebo behandelde patiënten.
In twee kortlopende, placebogecontroleerde onderzoeken bij patiënten (6 tot 17 jaar) met prikkelbaarheid geassocieerd met een autistische stoornis met een mediane blootstelling van 56 dagen, was de gemiddelde verandering in lichaamsgewicht bij met ABILIFY behandelde patiënten +1,6 kg (n=209 ) vergeleken met +0,4 kg (n=98) bij met placebo behandelde patiënten.
In twee kortlopende, placebogecontroleerde onderzoeken bij patiënten (6 tot 18 jaar) met de stoornis van Gilles de la Tourette met een mediane blootstelling van 57 dagen, was de gemiddelde verandering in lichaamsgewicht bij met ABILIFY behandelde patiënten +1,5 kg (n=105 ) vergeleken met +0,4 kg (n=66) bij met placebo behandelde patiënten.
Tabel 15 toont het percentage pediatrische en adolescente patiënten met een gewichtstoename van ≥7% van het lichaamsgewicht per indicatie.
In een open-label onderzoek waarbij patiënten uit de twee placebogecontroleerde onderzoeken met adolescenten met schizofrenie (13 tot 17 jaar) en pediatrische patiënten met een bipolaire stoornis (10 tot 17 jaar) deelnamen, voltooide 73,2% van de patiënten (238/325) 26 weken therapie met ABILIFY. Na 26 weken was 32,8% van de patiënten ≥7% van hun lichaamsgewicht aangekomen, niet gecorrigeerd voor normale groei. Om te corrigeren voor normale groei werden z-scores afgeleid (gemeten in standaarddeviaties [SD]), die normaliseren voor de natuurlijke groei van pediatrische patiënten en adolescenten door vergelijking met op leeftijd en geslacht gematchte populatienormen. Een verandering in de z-score
In een open-label onderzoek waarin patiënten werden opgenomen uit twee kortlopende, placebogecontroleerde onderzoeken, patiënten (6 tot 17 jaar) met prikkelbaarheid geassocieerd met een autistische stoornis, evenals de novo patiënten, voltooide 60,3% (199/330) een jaar therapie met ABILIFY. De gemiddelde verandering in gewichtsz-score was 0,26 SD voor patiënten die >9 maanden behandeling kregen.
Bij de behandeling van pediatrische patiënten voor welke indicatie dan ook, moet de gewichtstoename worden gecontroleerd en beoordeeld ten opzichte van de verwachte normale groei.
Pathologisch gokken en ander dwangmatig gedrag
Post-marketing casusrapporten suggereren dat patiënten intense drang kunnen ervaren, met name om te gokken, en het onvermogen om deze drang onder controle te houden tijdens het gebruik van aripiprazol. Andere dwangmatige driften, die minder vaak worden gemeld, zijn onder meer: seksuele driften, winkelen, eten of eetbuien en ander impulsief of dwangmatig gedrag. Omdat patiënten dit gedrag mogelijk niet als abnormaal herkennen, is het belangrijk dat voorschrijvers patiënten of hun verzorgers specifiek vragen naar de ontwikkeling van nieuwe of intense gokdrang, dwangmatige seksuele driften, dwangmatig winkelen, eetbuien of dwangmatig eten, of andere driften tijdens de behandeling met aripiprazol. Opgemerkt moet worden dat impulsbeheersingssymptomen geassocieerd kunnen zijn met de onderliggende stoornis. In sommige gevallen, hoewel niet alle, werd gemeld dat de drang was gestopt toen de dosis werd verlaagd of de medicatie werd stopgezet. Dwangmatig gedrag kan de patiënt en anderen schade berokkenen als het niet wordt herkend. Overweeg dosisverlaging of stopzetting van de medicatie als een patiënt dergelijke drang ontwikkelt.
Orthostatische hypotensie
ABILIFY 20 mg kan orthostatische hypotensie veroorzaken, mogelijk vanwege het 1-adrenerge receptorantagonisme. De incidentie van orthostatische hypotensie-geassocieerde voorvallen uit kortdurende, placebogecontroleerde onderzoeken bij volwassen patiënten die oraal ABILIFY kregen (n=2467) omvatte (ABILIFY 20 mg incidentie, placebo-incidentie) orthostatische hypotensie (1%, 0,3%), posturale duizeligheid ( 0,5%, 0,3% en syncope (0,5%, 0,4%); van pediatrische patiënten van 6 tot 18 jaar (n=732) die oraal ABILIFY kregen, omvatte orthostatische hypotensie (0,5%, 0%), posturale duizeligheid (0,4%, 0%) en syncope (0,2%, 0%); en van patiënten op ABILIFY-injectie (n = 501) omvatten orthostatische hypotensie (0,6%, 0%), houdingsduizeligheid (0,2%, 0,5%) en syncope (0,4%, 0%) (zie ONGEWENSTE REACTIES ].
De incidentie van een significante orthostatische verandering in bloeddruk (gedefinieerd als een verlaging van de systolische bloeddruk ≥20 mmHg gepaard gaand met een verhoging van de hartslag ≥25 bpm bij het vergelijken van staande met liggende waarden) voor ABILIFY was niet significant verschillend van placebo (incidentie ABILIFY , placebo-incidentie): bij volwassen orale met ABILIFY behandelde patiënten (4%, 2%), bij pediatrische orale
ABILIFY-behandelde patiënten van 6 tot 18 jaar (0,4%, 1%) of bij ABILIFY 15 mg injectie-behandelde patiënten (3%, 2%).
ABILIFY 20 mg moet met voorzichtigheid worden gebruikt bij patiënten met bekende cardiovasculaire aandoeningen (voorgeschiedenis van myocardinfarct of ischemische hartziekte, hartfalen of geleidingsstoornissen), cerebrovasculaire aandoeningen of aandoeningen die patiënten vatbaar maken voor hypotensie (dehydratie, hypovolemie en behandeling met antihypertensiva). medicijnen) [zie DRUG-INTERACTIES ].
Als parenterale benzodiazepinetherapie nodig wordt geacht naast ABILIFY-injectiebehandeling, moeten patiënten worden gecontroleerd op overmatige sedatie en op orthostatische hypotensie [zie DRUG-INTERACTIES ].
Watervallen
Antipsychotica, waaronder ABILIFY 10 mg, kunnen slaperigheid, orthostatische hypotensie, motorische en sensorische instabiliteit veroorzaken, wat kan leiden tot vallen en bijgevolg tot fracturen of ander letsel. Voor patiënten met ziekten, aandoeningen of medicijnen die deze effecten kunnen verergeren, volledige beoordeling van het valrisico bij het starten van een antipsychotische behandeling en herhaaldelijk voor patiënten die langdurige antipsychotische therapie ondergaan.
Leukopenie, neutropenie en agranulocytose
In klinische onderzoeken en/of postmarketingervaring zijn gevallen van leukopenie en neutropenie gemeld die tijdelijk gerelateerd zijn aan antipsychotica, waaronder ABILIFY. Agranulocytose is ook gemeld.
Mogelijke risicofactoren voor leukopenie/neutropenie zijn onder meer een reeds bestaand laag aantal witte bloedcellen (WBC)/absoluut aantal neutrofielen (ANC) en een voorgeschiedenis van door geneesmiddelen geïnduceerde leukopenie/neutropenie. Bij patiënten met een voorgeschiedenis van een klinisch significant laag WBC/ANC of geneesmiddelgeïnduceerde leukopenie/neutropenie, dient u tijdens de eerste paar maanden van de behandeling regelmatig een volledig bloedbeeld (CBC) uit te voeren. Overweeg bij dergelijke patiënten het stopzetten van ABILIFY bij het eerste teken van een klinisch significante afname van WBC in afwezigheid van andere oorzakelijke factoren.
Patiënten met klinisch significante neutropenie controleren op koorts of andere symptomen of tekenen van infectie en onmiddellijk behandelen als dergelijke symptomen of tekenen optreden. Stop ABILIFY 20 mg bij patiënten met ernstige neutropenie (absoluut aantal neutrofielen
Toevallen/convulsies
In kortdurende, placebogecontroleerde onderzoeken kwamen patiënten met een voorgeschiedenis van uitgesloten epileptische aanvallen/convulsies voor bij 0,1% (3/2467) van de niet-gediagnosticeerde volwassen patiënten die werden behandeld met orale ABILIFY 20 mg, bij 0,1% (1/732) van de pediatrische patiënten (6 tot 18 jaar), en bij 0,2% (1/501) van de volwassen met ABILIFY 15 mg injectie behandelde patiënten.
Zoals met andere antipsychotica, moet ABILIFY 15 mg met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van convulsies of met aandoeningen die de drempel voor convulsies verlagen. Aandoeningen die de aanvalsdrempel verlagen, kunnen vaker voorkomen in een populatie van 65 jaar of ouder.
Potentieel voor cognitieve en motorische stoornissen
ABILIFY kan, net als andere antipsychotica, het beoordelingsvermogen, het denken of de motoriek aantasten. In kortdurende, placebogecontroleerde onderzoeken werd bijvoorbeeld slaperigheid (inclusief sedatie) als volgt gemeld (incidentie ABILIFY, incidentie placebo): bij volwassen patiënten (n=2467) die werden behandeld met oraal ABILIFY (11%, 6%), bij pediatrische patiënten van 6 tot 17 jaar (n=611) (24%, 6%) en bij volwassen patiënten (n=501) op ABILIFY-injectie (9%, 6%). Slaperigheid (inclusief sedatie) leidde tot stopzetting bij 0,3% (8/2467) van de volwassen patiënten en bij 3% (20/732) van de pediatrische patiënten (6 tot 18 jaar) met orale ABILIFY 10 mg in kortdurende, placebogecontroleerde onderzoeken, maar leidde niet tot stopzetting van volwassen patiënten met ABILIFY Injection.
Ondanks de relatief bescheiden verhoogde incidentie van deze voorvallen in vergelijking met placebo, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat behandeling met ABILIFY 15 mg geen nadelige gevolgen voor hen heeft.
Regeling lichaamstemperatuur
Een verstoring van het vermogen van het lichaam om de kerntemperatuur van het lichaam te verlagen, wordt toegeschreven aan antipsychotica. Passende zorg wordt geadviseerd bij het voorschrijven van ABILIFY 10 mg aan patiënten die aandoeningen zullen ervaren die kunnen bijdragen aan een verhoging van de lichaamstemperatuur (bijv. zware inspanning, blootstelling aan extreme hitte, gelijktijdig gebruik van medicatie met anticholinerge activiteit, of onderhevig zijn aan uitdroging) [zien ONGEWENSTE REACTIES ].
Zelfmoord
De mogelijkheid van een zelfmoordpoging is inherent aan psychotische ziekten, bipolaire stoornis en depressieve stoornis, en nauw toezicht op patiënten met een hoog risico moet de medicamenteuze behandeling vergezellen. Voorschriften voor ABILIFY moeten worden geschreven voor de kleinste hoeveelheid in overeenstemming met goed patiëntenbeheer om het risico op overdosering te verminderen [zie ONGEWENSTE REACTIES ].
Dysfagie
Slokdarmdysmotiliteit en aspiratie zijn in verband gebracht met het gebruik van antipsychotica, waaronder ABILIFY. Aspiratiepneumonie is een veelvoorkomende oorzaak van morbiditeit en mortaliteit bij oudere patiënten, in het bijzonder bij patiënten met gevorderde Alzheimerdementie. ABILIFY en andere antipsychotica moeten met voorzichtigheid worden gebruikt bij patiënten met een risico op aspiratiepneumonie [zie Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose en ONGEWENSTE REACTIES ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Bespreek de volgende problemen met patiënten die ABILIFY hebben voorgeschreven:
Klinische verslechtering van depressie en zelfmoordrisico
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten worden gemeld aan de voorschrijver van de patiënt of zorgverlener, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen van de patiënt. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op suïcidaal denken en gedrag en duiden op een noodzaak van zeer nauwgezette monitoring en mogelijk veranderingen in de medicatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Voorschrijvers of andere gezondheidswerkers moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van de behandeling met ABILIFY en hen adviseren bij het juiste gebruik ervan. Voor ABILIFY is een medicatiehandleiding voor patiënten beschikbaar met informatie over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -handelingen". De voorschrijver of gezondheidswerker moet patiënten, hun families en hun zorgverleners instrueren om de medicatiehandleiding te lezen en moet hen helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de medicatiehandleiding te bespreken en om antwoord te krijgen op eventuele vragen. Opgemerkt moet worden dat ABILIFY niet is goedgekeurd als monotherapie voor de behandeling van depressie en niet is geëvalueerd bij pediatrische depressieve stoornissen.
Pathologisch gokken en ander dwangmatig gedrag
Informeer patiënten en hun verzorgers over de mogelijkheid dat ze dwangmatige drang om te winkelen, intense drang om te gokken, dwangmatige seksuele drang, eetaanvallen en/of andere compulsieve drang kunnen ervaren en het onvermogen om deze drang te beheersen tijdens het gebruik van aripiprazol. In sommige gevallen, maar niet in alle gevallen, werd gemeld dat de aandrang was gestopt toen de dosis werd verlaagd of gestopt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gebruik van oraal desintegrerende tablet
Open de blister niet voordat u klaar bent om het toe te dienen. Voor het verwijderen van een enkele tablet opent u de verpakking en trekt u de folie van de blisterverpakking los om de tablet bloot te leggen. Duw de tablet niet door de folie omdat dit de tablet kan beschadigen. Verwijder onmiddellijk na het openen van de blister met droge handen de tablet en plaats de gehele ABILIFY DISCMELT oraal uiteenvallende tablet op de tong. Tablet desintegratie vindt snel plaats in speeksel. Het wordt aanbevolen om ABILIFY DISCMELT zonder vloeistof in te nemen. Indien nodig kan het echter met vloeistof worden ingenomen. Probeer de tablet niet te splitsen.
Interferentie met cognitieve en motorische prestaties
Omdat ABILIFY het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat de ABILIFY-therapie geen nadelige gevolgen voor hen heeft [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Patiënten moeten worden geadviseerd om hun arts te informeren als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, aangezien er een kans op interacties is [zie DRUG-INTERACTIES ].
Blootstelling aan hitte en uitdroging
Patiënten moeten worden geadviseerd over passende zorg om oververhitting en uitdroging te voorkomen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Suikergehalte
Patiënten moeten erop worden gewezen dat elke ml ABILIFY 10 mg drank 400 mg sucrose en 200 mg fructose bevat.
Zwangerschap
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met ABILIFY. Adviseer patiënten dat ABILIFY 20 mg extrapiramidale en/of ontwenningsverschijnselen (agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis) kan veroorzaken bij een pasgeborene. Adviseer patiënten dat er een zwangerschapsregistratie is die de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan ABILIFY 15 mg zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Fenylketonurie
Fenylalanine is een bestanddeel van aspartaam. Elke ABILIFY DISCMELT oraal uiteenvallende tablet bevat de volgende hoeveelheden: 10 mg, 1,12 mg fenylalanine en 15 mg, 1,68 mg fenylalanine.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Levenslange carcinogeniteitsstudies werden uitgevoerd bij ICR-muizen, F344-ratten en Sprague-Dawley (SD)-ratten. Aripiprazol werd gedurende 2 jaar via de voeding toegediend in doses van 1, 3, 10 en 30 mg/kg/dag aan ICR-muizen en 1, 3 en 10 mg/kg/dag aan F344-ratten (0,2, 0,5, 2 en 5 keer en 0,3, 1 en 3 keer de MRHD van respectievelijk 30 mg/dag op basis van mg/m² lichaamsoppervlak). Bovendien werden SD-ratten gedurende 2 jaar oraal gedoseerd met 10, 20, 40 en 60 mg / kg / dag, wat 3, 6, 13 en 19 keer de MRHD is op basis van mg / m² lichaamsoppervlak. Aripiprazol veroorzaakte geen tumoren bij mannelijke muizen of mannelijke ratten. Bij vrouwelijke muizen was de incidentie van hypofyse-adenomen en borstklieradenocarcinomen en adenoacanthomas verhoogd bij voedingsdoses van 3 tot 30 mg/kg/dag (0,5 tot 5 maal de MRHD). Bij vrouwelijke ratten was de incidentie van borstklierfibroadenomen verhoogd bij een dieetdosis van 10 mg/kg/dag (3 maal de MRHD); en de incidentie van adrenocorticale carcinomen en gecombineerde adrenocorticale adenomen/carcinomen waren verhoogd bij een orale dosis van 60 mg/kg/dag (19 maal de MRHD).
Een toename van borst-, hypofyse- en endocriene pancreasneoplasmen is gevonden bij knaagdieren na chronische toediening van andere antipsychotica en wordt geacht te worden gemedieerd door langdurig dopamine-D2-receptorantagonisme en hyperprolactinemie. Serumprolactine werd niet gemeten in de carcinogeniteitsstudies van aripiprazol. Er werden echter verhogingen van de serumprolactinespiegels waargenomen bij vrouwelijke muizen in een 13 weken durend voedingsonderzoek bij de doses geassocieerd met borstklier- en hypofysetumoren. Serumprolactine was niet verhoogd bij vrouwelijke ratten in voedingsonderzoeken van 4 weken en 13 weken bij de dosis geassocieerd met borstkliertumoren. De relevantie voor het risico bij de mens van de bevindingen van prolactine-gemedieerde endocriene tumoren bij knaagdieren is onduidelijk.
Mutagenese
Het mutagene potentieel van aripiprazol werd getest in de in vitro bacteriële reverse-mutatietest, de in vitro bacteriële DNA-reparatietest, de in vitro voorwaartse genmutatietest in muislymfoomcellen, de in vitro chromosomale aberratietest in Chinese hamsterlong (CHL) cellen, de in vivo micronucleustest bij muizen en de ongeplande DNA-synthesetest bij ratten. Aripiprazol en een metaboliet (2,3-DCPP) waren clastogeen in de in vitro chromosomale aberratietest in CHL-cellen met en zonder metabolische activering. De metaboliet, 2,3DCPP, verhoogde numerieke aberraties in de in vitro-test in CHL-cellen in afwezigheid van metabole activering. Een positieve respons werd verkregen in de in vivo micronucleus-assay bij muizen; de respons was echter te wijten aan een mechanisme dat niet relevant werd geacht voor mensen.
Aantasting van de vruchtbaarheid
Vrouwelijke ratten werden oraal behandeld met aripiprazol vanaf 2 weken vóór de paring tot en met dag 7 van de dracht in doses van 2, 6 en 20 mg/kg/dag, wat 0,6, 2 en 6 keer de MRHD van 30 mg/dag is op basis van mg/m² lichaamsoppervlak. Bij alle doses werden onregelmatigheden in de oestruscyclus en verhoogde corpora lutea waargenomen, maar er werd geen verminderde vruchtbaarheid waargenomen. Verhoogd pre-implantatieverlies werd gezien bij 2 en 6 keer de MRHD en een verminderd foetaal gewicht werd gezien bij 6 keer de MRHD.
Mannelijke ratten werden oraal behandeld met aripiprazol vanaf 9 weken voorafgaand aan de paring tot en met de paring in doses van 20, 40 en 60 mg/kg/dag, wat 6, 13 en 19 keer de MRHD van 30 mg/dag is, gebaseerd op mg/dag. m² lichaamsoppervlak. Verstoringen in de spermatogenese werden gezien bij 19 keer de MRHD en prostaatatrofie werd gezien bij 13 en 19 keer de MRHD zonder aantasting van de vruchtbaarheid.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap zijn blootgesteld aan atypische antipsychotica, waaronder ABILIFY. Zorgaanbieders worden aangemoedigd om patiënten te registreren door contact op te nemen met het National Pregnancy Registry for Atypical Antipsychotics op 1-866-961-2388 of door te gaan naar http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Risico Samenvatting
Pasgeborenen die tijdens het derde trimester van de zwangerschap zijn blootgesteld aan antipsychotica, waaronder ABILIFY 20 mg, lopen risico op extrapiramidale en/of ontwenningsverschijnselen na de bevalling (zie Klinische overwegingen ). Over het geheel genomen beschikbare gegevens van gepubliceerde epidemiologische onderzoeken van zwangere vrouwen die zijn blootgesteld aan aripiprazol hebben geen geneesmiddel-geassocieerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten aangetoond (zie Gegevens ). Er zijn risico's voor de moeder verbonden aan onbehandelde schizofrenie, bipolaire I-stoornis of depressieve stoornis, en met blootstelling aan antipsychotica, waaronder ABILIFY, tijdens de zwangerschap (zie Klinische overwegingen ).
In reproductiestudies bij dieren, orale en intraveneuze toediening van aripiprazol tijdens de organogenese bij ratten en/of konijnen in doses van respectievelijk 10 en 19 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 30 mg/dag op basis van mg/m² lichaamsoppervlak, geproduceerd foetale dood, verminderd foetaal gewicht, niet-ingedaalde testikels, vertraagde ossificatie van het skelet, skeletafwijkingen en hernia diafragmatica. Orale en intraveneuze toediening van aripiprazol tijdens de pre- en postnatale periode bij ratten in doses van 10 maal de MRHD op basis van mg/m² lichaamsoppervlak, veroorzaakte een verlengde dracht, doodgeboorten, een verminderd gewicht van de jongen en een verminderde overleving van de jongen (zie Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Er is een risico voor de moeder door onbehandelde schizofrenie of bipolaire I-stoornis, waaronder een verhoogd risico op terugval, ziekenhuisopname en zelfmoord. Schizofrenie en bipolaire I-stoornis zijn geassocieerd met verhoogde ongunstige perinatale uitkomsten, waaronder vroeggeboorte. Het is niet bekend of dit een direct gevolg is van de ziekte of andere comorbide factoren.
Een prospectief, longitudinaal onderzoek volgde 201 zwangere vrouwen met een voorgeschiedenis van depressieve stoornis die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten. De vrouwen die tijdens de zwangerschap stopten met antidepressiva, hadden meer kans op een terugval van een ernstige depressie dan vrouwen die doorgingen met antidepressiva. Overweeg het risico op onbehandelde depressie bij het stopzetten of wijzigen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Foetale/neonatale bijwerkingen
Extrapiramidale en/of ontwenningsverschijnselen, waaronder agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis zijn gemeld bij pasgeborenen die tijdens het derde trimester van de zwangerschap werden blootgesteld aan antipsychotica (waaronder ABILIFY). Deze symptomen varieerden in ernst. Controleer pasgeborenen op extrapiramidale en/of ontwenningsverschijnselen en behandel de symptomen op de juiste manier. Sommige pasgeborenen herstelden binnen enkele uren of dagen zonder specifieke behandeling; anderen vereisten langdurige ziekenhuisopname.
Gegevens
Menselijke gegevens
Gepubliceerde gegevens uit observationele studies, geboorteregisters en casusrapporten over het gebruik van atypische antipsychotica tijdens de zwangerschap melden geen duidelijk verband met antipsychotica en ernstige geboorteafwijkingen. Een retrospectief onderzoek uit een Medicaid-database van 9258 vrouwen die tijdens de zwangerschap aan antipsychotica werden blootgesteld, wees niet op een algeheel verhoogd risico op ernstige geboorteafwijkingen.
Dierlijke gegevens
In dierstudies vertoonde aripiprazol ontwikkelingstoxiciteit, inclusief mogelijke teratogene effecten bij ratten en konijnen.
Bij drachtige ratten die oraal werden behandeld met aripiprazol tijdens de organogenese in doses van 3, 10 en 30 mg/kg/dag, wat ongeveer 1, 3 en 10 keer de MRHD van 30 mg/dag is, gebaseerd op mg/m² lichaamsoppervlak, kan een lichte verlenging van de zwangerschap en vertraging in de ontwikkeling van de foetus, zoals blijkt uit een verminderd foetaal gewicht en niet-ingedaalde testikels, werden waargenomen bij 10 keer de MRHD. Vertraagde botvorming van het skelet werd waargenomen bij 3 en 10 keer de MRHD. Geleverde nakomelingen hadden een verhoogde incidentie van hepatodiafragmatische knobbeltjes en diafragmatische hernia werd waargenomen bij 10 keer de MRHD (de andere dosisgroepen werden niet onderzocht op deze bevindingen). Postnataal werd een vertraagde vaginale opening gezien bij 3 en 10 keer de MRHD. Verminderde reproductieve prestaties (verminderd vruchtbaarheidscijfer, corpora lutea, implantaten, levende foetussen en verhoogd verlies na implantatie, waarschijnlijk gemedieerd door effecten op vrouwelijke nakomelingen) werden waargenomen bij 10 keer de MRHD; er waren echter geen aanwijzingen dat deze ontwikkelingseffecten secundair waren aan maternale toxiciteit.
Bij zwangere ratten die tijdens de organogenese intraveneus werden geïnjecteerd met aripiprazol in doses van 3, 9 en 27 mg/kg/dag, wat 1, 3 en 9 keer de MRHD van 30 mg/dag is, gebaseerd op mg/m² lichaamsoppervlak, nam foetaal gewicht en vertraagde botvorming van het skelet werden waargenomen bij 9 keer de MRHD; deze dosis veroorzaakte ook maternale toxiciteit.
Bij drachtige konijnen die oraal werden behandeld met aripiprazol tijdens de organogenese in doses van 10, 30 en 100 mg/kg/dag, wat 6, 19 en 65 keer de MRHD is van 30 mg/dag op basis van mg/m² lichaamsoppervlak, verminderde maternale voedselconsumptie en verhoogde abortussen evenals verhoogde foetale mortaliteit werden waargenomen bij 65 keer de MHRD. Verminderd foetaal gewicht en verhoogde incidentie van gefuseerde sternebrae werden waargenomen bij 19 en 65 keer de MRHD.
Bij drachtige konijnen die tijdens de organogenese intraveneus werden geïnjecteerd met aripiprazol in doses van 3, 10 en 30 mg/kg/dag, wat 2, 6 en 19 keer de MRHD van 30 mg/dag is op basis van mg/m² lichaamsoppervlak, nam foetaal gewicht, verhoogde foetale afwijkingen (voornamelijk skelet) en verminderde foetale skeletossificatie werden waargenomen bij 19 keer de MRHD; deze dosis veroorzaakte ook maternale toxiciteit. De foetale dosis zonder effect was 10 mg/kg/dag, wat 6 keer de MRHD is.
Bij ratten die oraal werden behandeld met aripiprazol peri- en postnataal vanaf dag 17 van de dracht tot dag 21 na de bevalling in doses van 3, 10 en 30 mg/kg/dag die 1, 3 en 10 maal de MRHD van 30 mg/dag zijn op basis van mg/m² lichaamsoppervlak werden lichte maternale toxiciteit en licht verlengde zwangerschap waargenomen bij 10 keer de MHRD. Bij deze dosis werden ook een toename van het aantal doodgeboorten en een afname van het gewicht van de jongen (die aanhield tot in de volwassenheid) en overleving gezien.
Bij ratten die intraveneus werden geïnjecteerd met aripiprazol vanaf dag 6 van de dracht tot dag 20 van de lactatie in doses van 3, 8 en 20 mg/kg/dag, wat 1, 3 en 6 keer de MRHD van 30 mg/dag is op basis van mg/m² lichaamsoppervlak, verhoogde doodgeboorten werden waargenomen bij 3 en 6 keer de MRHD; en afnames in het vroege postnatale gewicht en de overleving van de pup werden waargenomen bij 6 keer de MRHD; deze doses veroorzaakten ook enige maternale toxiciteit. Er waren geen effecten op de postnatale gedrags- en reproductieve ontwikkeling.
Borstvoeding
Risico Samenvatting
Beperkte gegevens uit gepubliceerde literatuur melden de aanwezigheid van aripiprazol in moedermelk, bij relatieve zuigelingendoses variërend van 0,7% tot 8,3% van de voor het gewicht van de moeder aangepaste dosering. Er zijn meldingen van een geringe gewichtstoename bij zuigelingen die borstvoeding krijgen en die zijn blootgesteld aan aripiprazol en meldingen van onvoldoende melkproductie bij vrouwen die borstvoeding geven en aripiprazol gebruiken.
De ontwikkeling en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan ABILIFY en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van ABILIFY of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten met depressieve stoornis of agitatie geassocieerd met schizofrenie of bipolaire manie zijn niet vastgesteld.
De farmacokinetiek van aripiprazol en dehydro-aripiprazol bij pediatrische patiënten van 10 tot 17 jaar was vergelijkbaar met die bij volwassenen na correctie voor de verschillen in lichaamsgewicht [zie KLINISCHE FARMACOLOGIE ].
Schizofrenie
De veiligheid en werkzaamheid bij pediatrische patiënten met schizofrenie werden vastgesteld in een 6 weken durende, placebogecontroleerde klinische studie bij 202 pediatrische patiënten in de leeftijd van 13 tot 17 jaar [zie DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ]. Hoewel de onderhoudswerkzaamheid bij pediatrische patiënten niet systematisch is geëvalueerd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van aripiprazol bij volwassen en pediatrische patiënten.
Bipolaire I-stoornis
De veiligheid en werkzaamheid bij pediatrische patiënten met bipolaire manie werden vastgesteld in een 4 weken durende, placebogecontroleerde klinische studie bij 197 pediatrische patiënten in de leeftijd van 10 tot 17 jaar [zie DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ]. Hoewel de onderhoudswerkzaamheid bij pediatrische patiënten niet systematisch is geëvalueerd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van aripiprazol bij volwassen en pediatrische patiënten.
De werkzaamheid van adjuvante ABILIFY 10 mg met gelijktijdig lithium of valproaat bij de behandeling van manische of gemengde episodes bij pediatrische patiënten is niet systematisch geëvalueerd. Een dergelijke werkzaamheid en het ontbreken van farmacokinetische interactie tussen aripiprazol en lithium of valproaat kunnen echter worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van aripiprazol bij volwassen en pediatrische patiënten.
Prikkelbaarheid geassocieerd met autistische stoornis
De veiligheid en werkzaamheid bij pediatrische patiënten die prikkelbaarheid vertoonden geassocieerd met een autistische stoornis werden vastgesteld in twee 8 weken durende, placebogecontroleerde klinische onderzoeken bij 212 pediatrische patiënten in de leeftijd van 6 tot 17 jaar [zie AANWIJZINGEN EN GEBRUIK , DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ]. Er werd een onderhoudsonderzoek uitgevoerd bij pediatrische patiënten (6 tot 17 jaar) met prikkelbaarheid geassocieerd met een autistische stoornis. De eerste fase van dit onderzoek was een open-label, flexibel gedoseerde (aripiprazol 2 tot 15 mg/dag) fase waarin patiënten gestabiliseerd waren (gedefinieerd als > 25% verbetering op de ABC-I-subschaal en een CGI-I-score van “veel verbeterd” of “zeer veel verbeterd”) op ABILIFY gedurende 12 opeenvolgende weken. In totaal waren 85 patiënten gestabiliseerd en gingen ze de tweede, 16 weken durende, dubbelblinde fase in waarin ze gerandomiseerd werden om ofwel de ABILIFY-behandeling voort te zetten of over te schakelen op placebo. In deze studie werd de werkzaamheid van ABILIFY voor de onderhoudsbehandeling van prikkelbaarheid geassocieerd met een autistische stoornis niet vastgesteld.
De stoornis van Gilles de la Tourette
De veiligheid en werkzaamheid van aripiprazol bij pediatrische patiënten met de stoornis van Gilles de la Tourette werden vastgesteld in een onderzoek van 8 weken (7 tot 17 jaar) en een onderzoek van 10 weken (6 tot 18 jaar) bij 194 pediatrische patiënten [zie DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ]. De werkzaamheid bij onderhoud bij pediatrische patiënten is niet systematisch geëvalueerd.
Onderzoek bij jonge dieren
Aripiprazol bij juveniele ratten veroorzaakte mortaliteit, klinische symptomen van het centrale zenuwstelsel, verminderd geheugen en leervermogen, en vertraagde seksuele rijping bij orale doses van 10, 20, 40 mg/kg/dag vanaf het spenen (21 dagen oud) tot volwassenheid (80 dagen oud) . Bij 40 mg/kg/dag werden bij beide geslachten mortaliteit, verminderde activiteit, gespreide achterpoten, gebogen houding, ataxie, tremoren en andere CZS-symptomen waargenomen. Bovendien werd een vertraagde seksuele rijping waargenomen bij mannen. Bij alle doses en op een dosisafhankelijke manier, verminderd geheugen en leervermogen, verhoogde motorische activiteit en histopathologische veranderingen in de hypofyse (atrofie), bijnieren (bijnierschorshypertrofie), borstklieren (hyperplasie en verhoogde secretie) en vrouwelijke voortplantingsorganen ( vaginale mucificatie, endometriumatrofie, afname van ovariële corpora lutea) werden waargenomen. De veranderingen in vrouwelijke voortplantingsorganen werden als secundair beschouwd aan de stijging van de prolactineserumspiegels. Er kon geen No Observed Adverse Effect Level (NOAEL) worden bepaald en bij de laagste geteste dosis van 10 mg/kg/dag is er geen veiligheidsmarge ten opzichte van de systemische blootstelling (AUC0-24) voor aripiprazol of zijn belangrijkste actieve metaboliet bij adolescenten bij de maximaal aanbevolen pediatrische dosis van 15 mg/dag. Alle geneesmiddelgerelateerde effecten waren omkeerbaar na een herstelperiode van 2 maanden, en de meeste geneesmiddeleffecten bij jonge ratten werden ook waargenomen bij volwassen ratten uit eerder uitgevoerde onderzoeken.
Aripiprazol bij juveniele honden (2 maanden oud) veroorzaakte klinische verschijnselen van het centrale zenuwstelsel van tremoren, hypoactiviteit, ataxie, op de grond liggen en beperkt gebruik van de achterpoten bij orale toediening gedurende 6 maanden bij 3, 10, 30 mg/kg/dag. Het gemiddelde lichaamsgewicht en de gewichtstoename waren tot 18% afgenomen bij vrouwen in alle geneesmiddelgroepen ten opzichte van de controlewaarden. Er kon geen NOAEL worden vastgesteld en bij de laagste geteste dosis van 3 mg/kg/dag is er geen veiligheidsmarge ten opzichte van de systemische blootstelling (AUC0-24) voor aripiprazol of zijn belangrijkste actieve metaboliet bij adolescenten bij de maximaal aanbevolen pediatrische dosis van 15 mg/dag. Alle geneesmiddelgerelateerde effecten waren omkeerbaar na een herstelperiode van 2 maanden.
Geriatrisch gebruik
Er wordt geen dosisaanpassing aanbevolen voor oudere patiënten [zie GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en KLINISCHE FARMACOLOGIE ].
Van de 13.543 patiënten die in klinische onderzoeken met oraal ABILIFY 15 mg werden behandeld, waren 1073 (8%) ≥65 jaar oud en 799 (6%) ≥75 jaar oud. Placebo-gecontroleerde onderzoeken naar orale ABILIFY 10 mg bij schizofrenie, bipolaire manie of depressieve stoornis omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen.
Van de 749 patiënten die in klinische onderzoeken met ABILIFY-injectie werden behandeld, waren 99 (13%) ≥65 jaar oud en 78 (10%) waren ≥75 jaar oud. Placebo-gecontroleerde onderzoeken naar ABILIFY-injectie bij patiënten met agitatie geassocieerd met schizofrenie of bipolaire manie omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen.
ABILIFY 15 mg is niet goedgekeurd voor de behandeling van patiënten met psychose geassocieerd met de ziekte van Alzheimer [zie GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CYP2D6 slechte metaboliseerders
Aanpassing van de dosering wordt aanbevolen bij bekende trage CYP2D6-metaboliseerders vanwege hoge aripiprazolconcentraties. Ongeveer 8% van de blanken en 3 tot 8% van de zwarte/Afrikaanse Amerikanen kan CYP2D6-substraten niet metaboliseren en wordt geclassificeerd als trage metaboliseerders (PM) [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Lever- en nierfunctiestoornissen
Er is geen dosisaanpassing voor ABILIFY nodig op basis van de leverfunctie van een patiënt (lichte tot ernstige leverfunctiestoornis, Child-Pugh-score tussen 5 en 15), of nierfunctie (lichte tot ernstige nierfunctiestoornis, glomerulaire filtratiesnelheid tussen 15 en 90 ml/minuut) [zie KLINISCHE FARMACOLOGIE ].
Andere specifieke populaties
Er is geen dosisaanpassing voor ABILIFY nodig op basis van het geslacht, ras of rookstatus van de patiënt [zie KLINISCHE FARMACOLOGIE ].
OVERDOSERING
MedDRA-terminologie is gebruikt om de bijwerkingen te classificeren.
Menselijke ervaring
In klinische onderzoeken en tijdens postmarketingervaring zijn wereldwijd bijwerkingen van opzettelijke of onopzettelijke overdosering met oraal ABILIFY gemeld. Deze omvatten overdoses met oraal ABILIFY 20 mg alleen en in combinatie met andere stoffen. Er werd geen dodelijke afloop gemeld met ABILIFY alleen. De grootste bekende dosis met een bekend resultaat betrof acute inname van 1260 mg orale ABILIFY (42 maal de maximaal aanbevolen dagelijkse dosis) door een volledig herstelde patiënt. Opzettelijke of onopzettelijke overdosering werd ook gemeld bij kinderen (12 jaar en jonger) waarbij sprake was van orale inname van ABILIFY 10 mg tot 195 mg zonder dodelijke afloop.
Vaak voorkomende bijwerkingen (gemeld in ten minste 5% van alle gevallen van overdosering) gemeld bij orale overdosering met ABILIFY (alleen of in combinatie met andere stoffen) zijn braken, slaperigheid en tremor. Andere klinisch belangrijke tekenen en symptomen die zijn waargenomen bij een of meer patiënten met een overdosis ABILIFY (alleen of met andere stoffen) zijn acidose, agressie, verhoogd aspartaataminotransferase, atriumfibrilleren, bradycardie, coma, verwardheid, convulsie, verhoogd creatinefosfokinase in het bloed, verlaagd niveau van bewustzijn, hypertensie, hypokaliëmie, hypotensie, lethargie, bewustzijnsverlies, QRS-complex verlengd, QT verlengd, pneumonie-aspiratie, ademstilstand, status epilepticus en tachycardie.
Beheer van overdosering
Er is geen specifieke informatie beschikbaar over de behandeling van overdosering met ABILIFY. In geval van overdosering moet een elektrocardiogram worden gemaakt en als er sprake is van verlenging van het QT-interval, moet hartbewaking worden ingesteld. Anders moet de behandeling van een overdosis zich concentreren op ondersteunende therapie, het in stand houden van een adequate luchtweg, oxygenatie en ventilatie en het beheersen van symptomen. Nauwgezet medisch toezicht en monitoring moeten worden voortgezet totdat de patiënt is hersteld.
Houtskool
In het geval van een overdosis ABILIFY 10 mg, kan een vroege toediening van houtskool nuttig zijn om de absorptie van aripiprazol gedeeltelijk te voorkomen. Toediening van 50 g actieve kool, één uur na een enkelvoudige orale dosis van 15 mg ABILIFY, verlaagde de gemiddelde AUC en Cmax van aripiprazol met 50%.
Hemodialyse
Hoewel er geen informatie is over het effect van hemodialyse bij de behandeling van een overdosis met ABILIFY, is het onwaarschijnlijk dat hemodialyse nuttig is bij de behandeling van overdosering, aangezien aripiprazol sterk gebonden is aan plasma-eiwitten.
CONTRA-INDICATIES
ABILIFY 15 mg is gecontra-indiceerd bij patiënten met een voorgeschiedenis van een overgevoeligheidsreactie op aripiprazol. De reacties varieerden van pruritus/urticaria tot anafylaxie [zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van aripiprazol bij schizofrenie of bipolaire manie is onduidelijk. De werkzaamheid van aripiprazol bij de vermelde indicaties kan echter worden gemedieerd door een combinatie van gedeeltelijke agonistische activiteit op D2- en 5-HT1A-receptoren en antagonistische activiteit op 5-HT2A-receptoren.
farmacodynamiek
Aripiprazol vertoont een hoge affiniteit voor dopamine D2 en D3, serotonine 5-HT1A- en 5-HT2A-receptoren (Ki-waarden van respectievelijk 0,34 nM, 0,8 nM, 1,7 nM en 3,4 nM), matige affiniteit voor dopamine D4, serotonine 5-HT2C en 5-HT7-, alfa1-adrenerge en histamine H1-receptoren (Ki-waarden van respectievelijk 44 nM, 15 nM, 39 nM, 57 nM en 61 nM) en matige affiniteit voor de serotonineheropnameplaats (Ki=98 nM). Aripiprazol heeft geen merkbare affiniteit voor cholinerge muscarinereceptoren (IC50>1000 nM).
Farmacokinetiek
ABILIFY-activiteit is vermoedelijk voornamelijk te wijten aan het oorspronkelijke geneesmiddel, aripiprazol, en in mindere mate aan zijn belangrijkste metaboliet, dehydro-aripiprazol, waarvan is aangetoond dat het affiniteiten heeft voor D2-receptoren die vergelijkbaar zijn met het oorspronkelijke geneesmiddel en dat 40% van het oorspronkelijke geneesmiddel vertegenwoordigt. blootstelling aan geneesmiddelen in plasma. De gemiddelde eliminatiehalfwaardetijden zijn respectievelijk ongeveer 75 uur en 94 uur voor aripiprazol en dehydro-aripiprazol. Steady-state concentraties worden binnen 14 dagen na toediening bereikt voor beide actieve delen. Accumulatie van aripiprazol is voorspelbaar op basis van de farmacokinetiek van een enkelvoudige dosis. Bij steady-state is de farmacokinetiek van aripiprazol dosisproportioneel. Eliminatie van aripiprazol vindt voornamelijk plaats via levermetabolisme waarbij twee P450-isozymen, CYP2D6 en CYP3A4, betrokken zijn. Voor trage metaboliseerders van CYP2D6 is de gemiddelde eliminatiehalfwaardetijd van aripiprazol ongeveer 146 uur.
Farmacokinetische studies hebben aangetoond dat ABILIFY 10 mg DISCMELT oraal uiteenvallende tabletten bio-equivalent zijn aan ABILIFY 15 mg tabletten.
Mondelinge toediening
Absorptie
Tablet: Aripiprazol wordt goed geabsorbeerd na toediening van de tablet, met piekplasmaconcentraties die optreden binnen 3 uur tot 5 uur; de absolute orale biologische beschikbaarheid van de tabletformulering is 87%. ABILIFY 10 mg kan met of zonder voedsel worden toegediend. Toediening van een ABILIFY-tablet van 15 mg met een standaard vetrijke maaltijd had geen significante invloed op de Cmax of AUC van aripiprazol of zijn actieve metaboliet, dehydro-aripiprazol, maar vertraagde de Tmax met 3 uur voor aripiprazol en 12 uur voor dehydro-aripiprazol.
Orale oplossing: Aripiprazol wordt goed geabsorbeerd bij orale toediening als oplossing. Bij equivalente doses waren de plasmaconcentraties van aripiprazol uit de oplossing hoger dan die uit de tabletformulering. In een onderzoek naar de relatieve biologische beschikbaarheid waarin de farmacokinetiek van 30 mg aripiprazol als drank werd vergeleken met 30 mg aripiprazol-tabletten bij gezonde proefpersonen, waren de verhoudingen tussen oplossing en tablet van geometrisch gemiddelde Cmax- en AUC-waarden respectievelijk 122% en 114% [zie DOSERING EN ADMINISTRATIE ]. De farmacokinetiek van een enkelvoudige dosis van aripiprazol was lineair en dosisproportioneel tussen de doses van 5 mg tot 30 mg.
Verdeling
Distributie Het steady-state distributievolume van aripiprazol na intraveneuze toediening is hoog (404 l of 4,9 l/kg), wat wijst op uitgebreide extravasculaire distributie. Bij therapeutische concentraties worden aripiprazol en zijn belangrijkste metaboliet voor meer dan 99% gebonden aan serumeiwitten, voornamelijk aan albumine. Bij gezonde menselijke vrijwilligers die gedurende 14 dagen 0,5 tot 30 mg/dag aripiprazol kregen toegediend, was er een dosisafhankelijke D2-receptorbezetting, wat wijst op penetratie in de hersenen van aripiprazol bij mensen.
Metabolisme en eliminatie
Aripiprazol wordt voornamelijk gemetaboliseerd door drie biotransformatieroutes: dehydrogenering, hydroxylering en N-dealkylering. Op basis van in vitro-onderzoeken zijn CYP3A4- en CYP2D6-enzymen verantwoordelijk voor de dehydrogenering en hydroxylering van aripiprazol, en wordt N-dealkylering gekatalyseerd door CYP3A4. Aripiprazol is de belangrijkste geneesmiddelgroep in de systemische circulatie. Bij steady-state vertegenwoordigt dehydro-aripiprazol, de actieve metaboliet, ongeveer 40% van de AUC van aripiprazol in plasma.
Na een enkelvoudige orale dosis [14C]-gelabeld aripiprazol werd respectievelijk ongeveer 25% en 55% van de toegediende radioactiviteit teruggevonden in de urine en feces. Minder dan 1% van onveranderd aripiprazol werd uitgescheiden in de urine en ongeveer 18% van de orale dosis werd onveranderd teruggevonden in de feces.
Geneesmiddelinteractiestudies
Effecten van andere geneesmiddelen op de blootstelling aan aripiprazol en dehydro-aripiprazol zijn respectievelijk samengevat in figuur 1 en figuur 2. Op basis van simulatie wordt een 4,5-voudige toename van de gemiddelde Cmax- en AUC-waarden bij steady-state verwacht wanneer uitgebreide metaboliseerders van CYP2D6 worden toegediend met zowel sterke CYP2D6- als CYP3A4-remmers. Een drievoudige toename van de gemiddelde Cmax- en AUC-waarden bij steady-state wordt verwacht bij trage metaboliseerders van CYP2D6 die worden toegediend met sterke CYP3A4-remmers.
Figuur 1: De effecten van andere geneesmiddelen op de farmacokinetiek van aripiprazol 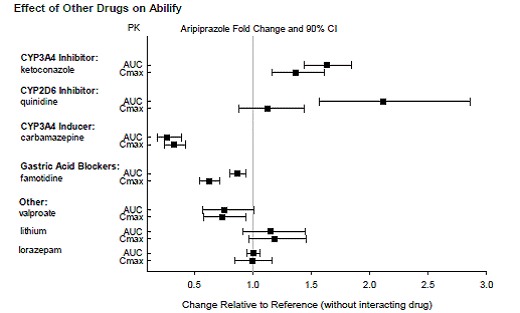
Figuur 2: De effecten van andere geneesmiddelen op de farmacokinetiek van dehydro-aripiprazol 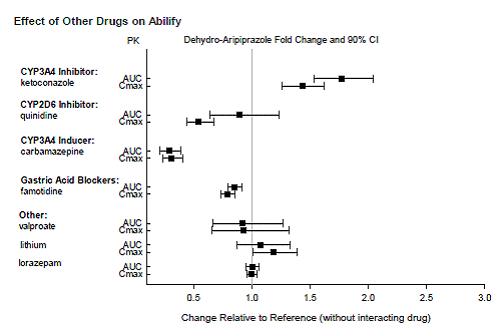
De effecten van ABILIFY 15 mg op de blootstelling aan andere geneesmiddelen zijn samengevat in figuur 3. Een farmacokinetische populatieanalyse bij patiënten met depressieve stoornis toonde geen substantiële verandering in plasmaconcentraties van fluoxetine (20 of 40 mg/dag), paroxetine CR (37,5 of 50 mg/dag), of sertraline (100 of 150 mg/dag) gedoseerd tot steady-state. De steady-state plasmaconcentraties van fluoxetine en norfluoxetine stegen met respectievelijk ongeveer 18% en 36%, en de concentraties van paroxetine daalden met ongeveer 27%. De steady-state plasmaconcentraties van sertraline en desmethylsertraline werden niet wezenlijk veranderd wanneer deze antidepressiva gelijktijdig met aripiprazol werden toegediend.
Figuur 3: De effecten van ABILIFY 15 mg op de farmacokinetiek van andere geneesmiddelen 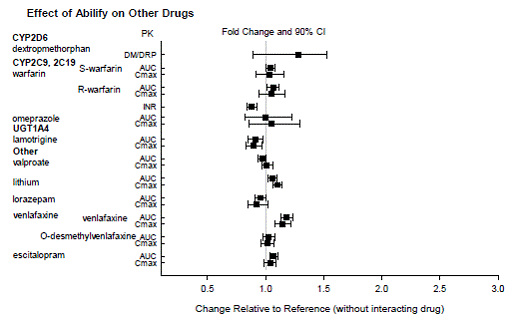
Studies bij specifieke populaties
Blootstellingen aan aripiprazol en dehydro-aripiprazol bij specifieke populaties zijn respectievelijk samengevat in figuur 4 en figuur 5. Bovendien was bij pediatrische patiënten (10 tot 17 jaar) die ABILIFY (20 mg tot 30 mg) toegediend kregen, de voor lichaamsgewicht gecorrigeerde aripiprazolklaring vergelijkbaar met die van volwassenen.
Figuur 4: Effecten van intrinsieke factoren op de farmacokinetiek van aripiprazol 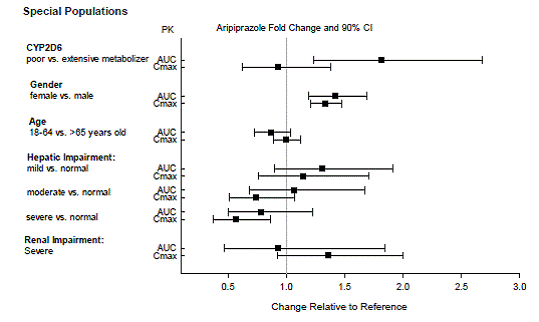
Figuur 5: Effecten van intrinsieke factoren op de farmacokinetiek van dehydro-aripiprazol 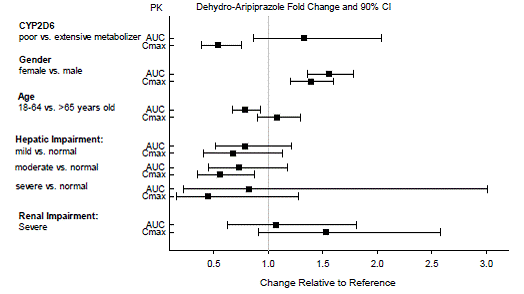
Intramusculaire toediening
In twee farmacokinetische onderzoeken naar intramusculaire toediening van aripiprazol-injectie aan gezonde proefpersonen, was de mediane tijd tot de piekplasmaconcentraties 1 uur en 3 uur. Een intramusculaire injectie van 5 mg aripiprazol had een absolute biologische beschikbaarheid van 100%. De geometrisch gemiddelde maximale concentratie die werd bereikt na een intramusculaire dosis was gemiddeld 19% hoger dan de Cmax van de orale tablet. Hoewel de systemische blootstelling gedurende 24 uur over het algemeen vergelijkbaar was tussen intramusculaire injectie met aripiprazol en na orale tablettoediening, was de AUC van aripiprazol in de eerste 2 uur na een intramusculaire injectie 90% groter dan de AUC na dezelfde dosis als een tablet. Bij stabiele patiënten met schizofrenie of schizoaffectieve stoornis was de farmacokinetiek van aripiprazol na intramusculaire toediening lineair over een dosisbereik van 1 mg tot 45 mg. Hoewel het metabolisme van aripiprazol-injectie niet systematisch werd geëvalueerd, wordt niet verwacht dat de intramusculaire toedieningsroute de metabole routes verandert.
Dierlijke toxicologie en/of farmacologie
Aripiprazol veroorzaakte retinadegeneratie bij albinoratten in een 26 weken durende chronische toxiciteitsstudie bij een dosis van 60 mg/kg/dag en in een 2 jaar durende carcinogeniteitsstudie bij doses van 40 en 60 mg/kg/dag die 13 en 19 keer zijn de MRHD van 30 mg/dag op basis van mg/m² lichaamsoppervlak. Evaluatie van het netvlies van albino-muizen en van apen bracht geen bewijs van netvliesdegeneratie aan het licht. Er zijn geen aanvullende onderzoeken uitgevoerd om het mechanisme verder te evalueren. De relevantie van deze bevinding voor het risico bij de mens is niet bekend.
Klinische studies
De werkzaamheid van de orale formuleringen van ABILIFY (aripiprazol) werd vastgesteld in de volgende adequate en goed gecontroleerde onderzoeken:
- Vier kortetermijnonderzoeken en één onderhoudsonderzoek bij volwassen patiënten en één kortetermijnonderzoek bij adolescenten (13-17 jaar) met schizofrenie [zie Klinische studies ]
- Vier kortetermijnstudies met monotherapie en één aanvullende studie van 6 weken bij volwassen patiënten en één kortetermijnstudie met monotherapie bij pediatrische patiënten (1017 jaar) met manische of gemengde episodes [zie Klinische studies ]
- Eén onderhoudsstudie met monotherapie en in één onderhoudsadjuvante studie bij volwassen patiënten met een bipolaire I-stoornis [zie Klinische studies ]
- Twee kortetermijnonderzoeken bij volwassen patiënten met MDD die tijdens de huidige episode onvoldoende reageerden op behandeling met antidepressiva [zie Klinische studies ]
- Twee kortetermijnonderzoeken bij pediatrische patiënten (leeftijd 6-17 jaar) voor de behandeling van prikkelbaarheid geassocieerd met autistische stoornis [zie Klinische studies ]
- Twee kortetermijnonderzoeken bij pediatrische patiënten (leeftijd 6-18 jaar) met de stoornis van Gilles de la Tourette [zie Klinische studies ]
De werkzaamheid van de injecteerbare formulering van ABILIFY (aripiprazol) werd vastgesteld in de volgende adequate en goed gecontroleerde onderzoeken:
- Drie onderzoeken van 24 uur bij geagiteerde volwassen patiënten met schizofrenie of manische/gemengde episodes van bipolaire I-stoornis [zie Klinische studies ]
Schizofrenie
volwassenen
De werkzaamheid van ABILIFY 15 mg bij de behandeling van schizofrenie werd geëvalueerd in vijf kortdurende (4 weken en 6 weken), placebogecontroleerde onderzoeken met acuut recidiverende opgenomen patiënten die voornamelijk voldeden aan de DSM-III/IV-criteria voor schizofrenie. Vier van de vijf onderzoeken waren in staat om ABILIFY te onderscheiden van placebo, maar één onderzoek, de kleinste, deed dat niet. Drie van deze onderzoeken omvatten ook een actieve controlegroep bestaande uit ofwel risperidon (één onderzoek) of haloperidol (twee onderzoeken), maar ze waren niet ontworpen om een vergelijking van ABILIFY 20 mg en de actieve comparatoren mogelijk te maken.
In de vier positieve onderzoeken naar ABILIFY 10 mg werden vier primaire metingen gebruikt voor het beoordelen van psychiatrische tekenen en symptomen. De werkzaamheid werd beoordeeld aan de hand van de totale score op de Positieve en Negatieve Syndroomschaal (PANSS). De PANSS is een schaal van 30 items die positieve symptomen van schizofrenie (7 items), negatieve symptomen van schizofrenie (7 items) en algemene psychopathologie (16 items) meet, elk gescoord op een schaal van 1 (afwezig) tot 7 (extreem) ; totale PANSS-scores variëren van 30 tot 210. De beoordeling van de Clinical Global Impression (CGI) weerspiegelt de indruk van een ervaren waarnemer, volledig bekend met de manifestaties van schizofrenie, over de algehele klinische toestand van de patiënt.
In een onderzoek van 4 weken (n=414) waarin twee vaste doses ABILIFY (15 of 30 mg/dag) werden vergeleken met placebo, waren beide doses ABILIFY 10 mg superieur aan placebo in de totale PANSS-score (onderzoek 1 in tabel 26), PANSS-positieve subschaal en CGI-ernstscore. Bovendien was de dosis van 15 mg superieur aan placebo op de PANSS-negatieve subschaal.
In een 4 weken durende studie (n=404) waarin twee vaste doses ABILIFY (20 of 30 mg/dag) werden vergeleken met placebo, waren beide doses ABILIFY superieur aan placebo in de totale PANSS-score (onderzoek 2 in tabel 26), PANSS positieve subschaal, PANSS negatieve subschaal en CGI-ernstscore.
In een onderzoek van 6 weken (n=420) waarin drie vaste doses ABILIFY (10, 15 of 20 mg/dag) werden vergeleken met placebo, waren alle drie de doses ABILIFY superieur aan placebo in de totale PANSS-score (onderzoek 3 in tabel 26), PANSS-positieve subschaal en de PANSS-negatieve subschaal.
In een onderzoek van 6 weken (n=367) waarin drie vaste doses ABILIFY (2, 5 of 10 mg/dag) werden vergeleken met placebo, was de dosis ABILIFY van 10 mg superieur aan placebo in de totale PANSS-score (onderzoek 4 in Tabel 26), de primaire uitkomstmaat van het onderzoek. De doses van 2 en 5 mg vertoonden geen superioriteit ten opzichte van placebo op de primaire uitkomstmaat.
Zo werd de werkzaamheid van dagelijkse doses van 10, 15, 20 en 30 mg vastgesteld in twee onderzoeken voor elke dosis. Van deze doses was er geen bewijs dat de groepen met de hogere dosis enig voordeel boden ten opzichte van de groep met de laagste dosis van deze onderzoeken.
Een onderzoek van populatiesubgroepen bracht geen duidelijk bewijs van differentiële responsiviteit op basis van leeftijd, geslacht of ras aan het licht.
Aan een langere-termijnstudie namen 310 klinische of poliklinische patiënten deel die voldeden aan de DSM-IV-criteria voor schizofrenie die, door de geschiedenis, symptomatisch stabiel waren op andere antipsychotica gedurende een periode van 3 maanden of langer. Deze patiënten werden stopgezet met hun antipsychotica en gerandomiseerd naar ABILIFY 15 mg/dag of placebo gedurende maximaal 26 weken observatie voor terugval. Terugval tijdens de dubbelblinde fase werd gedefinieerd als CGI-verbeteringsscore van ≥ 5 (minimaal slechter), scores ≥ 5 (matig ernstig) op de items vijandigheid of weigering van de PANSS, of ≥ 20% toename van de PANSS-totaalscore. Patiënten die ABILIFY 15 mg/dag kregen, ondervonden een significant langere tijd tot terugval in de daaropvolgende 26 weken in vergelijking met degenen die placebo kregen (onderzoek 5 in figuur 6).
Pediatrische patiënten
De werkzaamheid van ABILIFY (aripiprazol) bij de behandeling van schizofrenie bij pediatrische patiënten (13 tot 17 jaar) werd geëvalueerd in een 6 weken durende, placebogecontroleerde studie met poliklinische patiënten die voldeden aan de DSM-IV-criteria voor schizofrenie en een PANSS-score hadden. ≥70 bij baseline. In dit onderzoek (n=302) waarin twee vaste doses ABILIFY (10 of 30 mg/dag) werden vergeleken met placebo, werd ABILIFY 15 mg getitreerd vanaf 2 mg/dag tot de streefdosis in 5 dagen in de 10 mg/dag-behandelingsarm en in 11 dagen in de behandelingsarm van 30 mg/dag. Beide doses ABILIFY waren superieur aan placebo wat betreft de totale PANSS-score (onderzoek 6 in tabel 26), de primaire uitkomstmaat van het onderzoek. De dosering van 30 mg/dag bleek niet effectiever te zijn dan de dosis van 10 mg/dag. Hoewel de onderhoudswerkzaamheid bij pediatrische patiënten niet systematisch is geëvalueerd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van aripiprazol bij volwassen en pediatrische patiënten.
Figuur 6: Kaplan-Meier-schatting van het cumulatieve aandeel van patiënten met terugval (Schizofrenieonderzoek 5) 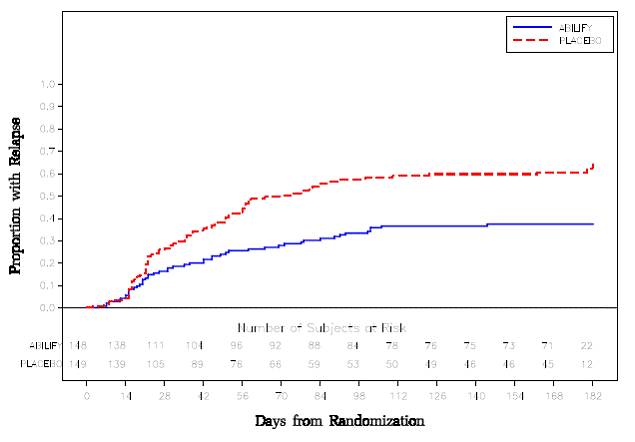
Bipolaire stoornis
Acute behandeling van manische en gemengde episodes
volwassenen
Monotherapie
De werkzaamheid van ABILIFY 10 mg als monotherapie bij de acute behandeling van manische episodes werd vastgesteld in vier placebogecontroleerde onderzoeken van 3 weken bij gehospitaliseerde patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis met manische of gemengde episodes. Deze onderzoeken omvatten patiënten met of zonder psychotische kenmerken en twee van de onderzoeken omvatten ook patiënten met of zonder een snelle cyclus.
Het primaire instrument dat werd gebruikt voor het beoordelen van manische symptomen was de Young Mania Rating Scale (Y-MRS), een door clinici beoordeelde schaal met 11 items die traditioneel wordt gebruikt om de mate van manische symptomatologie te beoordelen in een bereik van 0 (geen manische kenmerken) tot 60 ( maximale score). Een belangrijk secundair instrument was de Clinical Global Impression-Bipolar (CGI-BP) Scale.
In de vier positieve, 3 weken durende, placebogecontroleerde onderzoeken (n=268; n=248; n=480; n=485) die ABILIFY evalueerden in een bereik van 15 mg tot 30 mg, eenmaal daags (met een startdosis van 30 mg/dag in twee onderzoeken en 15 mg/dag in twee onderzoeken), was ABILIFY 20 mg superieur aan placebo wat betreft de verlaging van de totale Y-MRS-score (onderzoeken 1-4 in tabel 27) en de CGI-BP-score voor ernst van de ziekte (manie). In de twee onderzoeken met een aanvangsdosis van 15 mg/dag waren 48% en 44% van de patiënten op het eindpunt op 15 mg/dag. In de twee onderzoeken met een aanvangsdosis van 30 mg/dag waren 86% en 85% van de patiënten op het eindpunt op 30 mg/dag.
Aanvullende therapie
De werkzaamheid van adjuvante ABILIFY met gelijktijdig lithium of valproaat bij de behandeling van manische of gemengde episodes werd vastgesteld in een 6 weken durende, placebogecontroleerde studie (n=384) met een 2 weken durende inleidende monotherapiefase met stemmingsstabilisator bij volwassen patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis. Deze studie omvatte patiënten met manische of gemengde episodes en met of zonder psychotische kenmerken.
De patiënten werden gestart met open-label lithium (0,6 tot 1,0 mEq/l) of valproaat (50 tot 125 g/ml) bij therapeutische serumspiegels en bleven gedurende 2 weken op stabiele doses. Aan het einde van 2 weken werden patiënten die onvoldoende respons vertoonden (YMRS-totaalscore ≥16 en ≤25% verbetering op de Y-MRS-totaalscore) op lithium of valproaat gerandomiseerd om ABILIFY (15 mg/dag of een verhoging tot 30 mg/dag) te krijgen. mg/dag al vanaf dag 7) of placebo als aanvullende therapie met open-label lithium of valproaat. In de 6 weken durende, placebogecontroleerde fase was adjuvante ABILIFY beginnend met 15 mg/dag met gelijktijdig lithium of valproaat (in een therapeutisch bereik van respectievelijk 0,6 tot 1,0 mEq/L of 50 tot 125 μg/ml) superieur aan lithium of valproaat met adjuvante placebo voor de verlaging van de YMRS-totaalscore (onderzoek 5 in tabel 27) en de CGI-BP-score voor ernst van de ziekte (manie). Eenenzeventig procent van de patiënten die gelijktijdig valproaat kregen toegediend en 62% van de patiënten die gelijktijdig lithium kregen, kregen 15 mg/dag op het eindpunt van 6 weken.
Pediatrische patiënten
De werkzaamheid van ABILIFY 15 mg bij de behandeling van bipolaire I-stoornis bij pediatrische patiënten (10 tot 17 jaar) werd geëvalueerd in een 4 weken durende, placebogecontroleerde studie (n=296) met poliklinische patiënten die voldeden aan de DSM-IV-criteria voor bipolaire Ik heb manische of gemengde episodes met of zonder psychotische kenmerken en had een Y-MRS-score ≥20 bij aanvang. In deze dubbelblinde, placebogecontroleerde studie werden twee vaste doses ABILIFY (10 of 30 mg/dag) vergeleken met placebo. De dosis ABILIFY 20 mg werd gestart met 2 mg/dag, die na 2 dagen werd getitreerd tot 5 mg/dag, en tot de streefdosis in 5 dagen in de 10 mg/dag-behandelingsarm en in 13 dagen in de 30 mg/dag-behandelingsarm. dagbehandeling arm. Beide doses ABILIFY 10 mg waren superieur aan placebo wat betreft verandering van baseline tot week 4 op de Y-MRS-totaalscore (onderzoek 6 in tabel 27).
Onderhoudsbehandeling van bipolaire I-stoornis
Monotherapie Onderhoudstherapie
Er werd een onderhoudsonderzoek uitgevoerd bij volwassen patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis met een recente manische of gemengde episode die waren gestabiliseerd op open-label ABILIFY 20 mg en die een klinische respons hadden behouden gedurende ten minste 6 weken. De eerste fase van deze studie was een open-label stabilisatieperiode waarin klinische en poliklinische patiënten klinisch werden gestabiliseerd en vervolgens gedurende ten minste 6 opeenvolgende weken. Honderdeenenzestig poliklinische patiënten werden vervolgens dubbelblind gerandomiseerd naar ofwel dezelfde dosis ABILIFY die ze gebruikten aan het einde van de stabilisatie- en onderhoudsperiode ofwel placebo en werden vervolgens gecontroleerd op manische of depressieve terugval. Tijdens de randomisatiefase was ABILIFY op tijd superieur aan placebo ten opzichte van het aantal gecombineerde affectieve recidieven (manisch plus depressief), de primaire uitkomstmaat voor dit onderzoek (onderzoek 7 in figuur 7). Tijdens de dubbelblinde behandelfase werden in totaal 55 stemmingswisselingen waargenomen. Negentien kwamen uit de ABILIFY-groep en 36 uit de placebogroep. Het aantal waargenomen manische episodes in de ABILIFY 15 mg-groep (6) was minder dan dat in de placebogroep (19), terwijl het aantal depressieve episodes in de ABILIFY-groep (9) vergelijkbaar was met dat in de placebogroep (11) .
Een onderzoek van bevolkingssubgroepen bracht geen duidelijk bewijs van differentiële responsiviteit op basis van leeftijd en geslacht aan het licht; er waren echter onvoldoende aantallen patiënten in elk van de etnische groepen om de verschillen tussen groepen adequaat te beoordelen.
Figuur 7: Kaplan-Meier-schatting van het cumulatieve aandeel van patiënten met terugval (bipolair onderzoek 7) 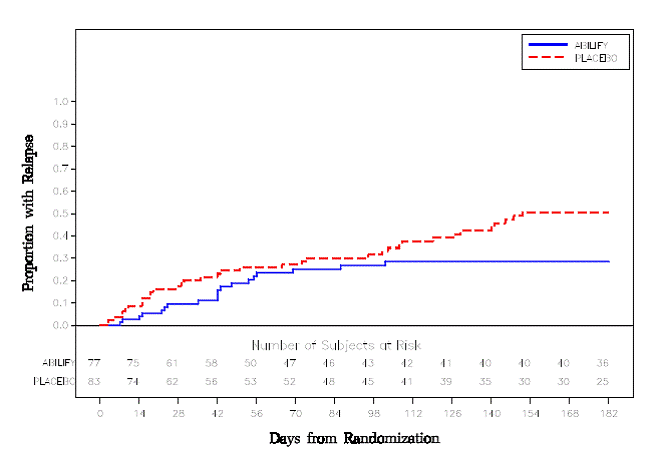
Aanvullende onderhoudstherapie
Een aanvullend onderhoudsonderzoek werd uitgevoerd bij volwassen patiënten die voldeden aan de DSMIV-criteria voor bipolaire I-stoornis met een recente manische of gemengde episode. De patiënten werden gestart met open-label lithium (0,6 tot 1,0 mEq/l) of valproaat (50 tot 125 g/ml) bij therapeutische serumspiegels en bleven gedurende 2 weken op stabiele doses. Na 2 weken kregen patiënten die onvoldoende respons vertoonden (Y-MRS-totaalscore ≥16 en ≤35% verbetering ten opzichte van de Y-MRS-totaalscore) op lithium of valproaat ABILIFY met een startdosis van 15 mg/dag met de optie te verhogen tot 30 mg of te verlagen tot 10 mg al op dag 4, als aanvullende therapie met open-label lithium of valproaat. Voorafgaand aan randomisatie moesten patiënten die de combinatie van enkelblinde ABILIFY en lithium of valproaat kregen, gedurende 12 opeenvolgende weken stabiel blijven (Y-MRS en MADRS-totaalscores ≤12). Driehonderd zevenendertig patiënten werden vervolgens dubbelblind gerandomiseerd naar ofwel dezelfde dosis ABILIFY 20 mg die ze gebruikten aan het einde van de stabilisatieperiode ofwel placebo plus lithium of valproaat en werden vervolgens gecontroleerd op manische, gemengde of depressieve terugval gedurende maximaal 52 weken. ABILIFY 15 mg was superieur aan placebo op het primaire eindpunt, de tijd vanaf randomisatie tot terugval tot een stemmingsgebeurtenis (onderzoek 8 in figuur 8). Een stemmingsstoornis werd gedefinieerd als ziekenhuisopname voor een manische, gemengde of depressieve episode, stopzetting van de studie wegens gebrek aan werkzaamheid vergezeld van een Y-MRS-score >16 en/of een MADRS >16, of een SAE van verergering van de ziekte vergezeld van Y- MRS-score >16 en/of een MADRS >16. Tijdens de dubbelblinde behandelingsfase werden in totaal 68 stemmingswisselingen waargenomen. Vijfentwintig kwamen uit de ABILIFY 20 mg-groep en 43 kwamen uit de placebogroep. Het aantal waargenomen manische episodes in de ABILIFY 15 mg-groep (7) was minder dan dat in de placebogroep (19), terwijl het aantal depressieve episodes in de ABILIFY-groep (14) vergelijkbaar was met dat in de placebogroep (18) . De Kaplan-Meier-curven van de tijd vanaf randomisatie tot terugval tot een stemmingsgebeurtenis tijdens de 52 weken durende, dubbelblinde behandelingsfase voor ABILIFY 10 mg- en placebogroepen worden weergegeven in figuur 8.
Afbeelding 8: Kaplan-Meier-schatting van het cumulatieve aandeel van patiënten met een terugval in een stemmingsstoornis (bipolair onderzoek 8) 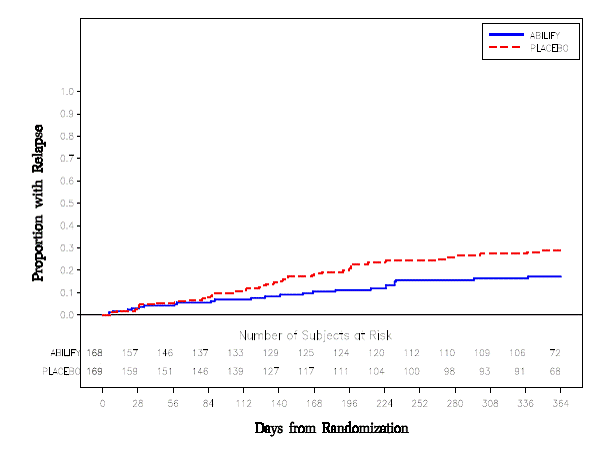
Een onderzoek van bevolkingssubgroepen bracht geen duidelijk bewijs van differentiële responsiviteit op basis van leeftijd en geslacht aan het licht; er waren echter onvoldoende aantallen patiënten in elk van de etnische groepen om de verschillen tussen groepen adequaat te beoordelen.
Aanvullende behandeling van depressieve stoornis
volwassenen
De werkzaamheid van ABILIFY 15 mg bij de aanvullende behandeling van depressieve stoornis (MDD) werd aangetoond in twee kortdurende (6 weken), placebogecontroleerde onderzoeken bij volwassen patiënten die voldeden aan de DSM-IV-criteria voor MDD en die onvoldoende hadden gereageerd op eerdere behandeling met antidepressiva (1 tot 3 kuren) in de huidige episode en die ook een ontoereikende respons vertoonden op 8 weken prospectieve antidepressivatherapie (paroxetine met gereguleerde afgifte, venlafaxine met verlengde afgifte, fluoxetine, escitalopram of sertraline). Een ontoereikende respons voor prospectieve behandeling werd gedefinieerd als een verbetering van minder dan 50% op de 17-itemversie van de Hamilton Depression Rating Scale (HAMD17), een minimale HAMD17-score van 14 en een Clinical Global Impressions Improvement-score van niet beter dan minimale verbetering. Een ontoereikende respons op eerdere behandeling werd gedefinieerd als een verbetering van minder dan 50% zoals waargenomen door de patiënt na minimaal 6 weken behandeling met antidepressiva bij of boven de minimale effectieve dosis.
Het primaire instrument dat werd gebruikt voor het beoordelen van depressieve symptomen was de Montgomery-Asberg Depression Rating Scale (MADRS), een door clinici beoordeelde schaal met 10 items die wordt gebruikt om de mate van depressieve symptomatologie te beoordelen. Het belangrijkste secundaire instrument was de Sheehan Disability Scale (SDS), een zelfbeoordelingsinstrument met drie items dat wordt gebruikt om de impact van depressie op drie domeinen van functioneren te beoordelen, waarbij elk item een score van 0 (helemaal niet) tot 10 (extreem) heeft.
In de twee onderzoeken (n=381, n=362) was ABILIFY 15 mg superieur aan placebo bij het verlagen van de gemiddelde totale MADRS-scores (onderzoeken 1, 2 in tabel 28). In één onderzoek was ABILIFY ook superieur aan placebo bij het verlagen van de gemiddelde SDS-score.
In beide onderzoeken kregen patiënten ABILIFY 15 mg als aanvulling op antidepressiva in een dosis van 5 mg/dag. Op basis van verdraagbaarheid en werkzaamheid kunnen de doses worden aangepast met stappen van 5 mg, met een tussenpoos van één week. Toegestane doses waren: 2, 5, 10, 15 mg/dag, en voor patiënten die geen krachtige CYP2D6-remmers gebruikten, fluoxetine en paroxetine, 20 mg/dag. De gemiddelde uiteindelijke dosis op het eindpunt voor de twee onderzoeken was 10,7 en 11,4 mg/dag.
Een onderzoek van populatiesubgroepen bracht geen bewijs van differentiële respons aan het licht op basis van leeftijd, keuze van antidepressivum of ras. Wat het geslacht betreft, werd een kleinere gemiddelde afname op de MADRS-totaalscore gezien bij mannen dan bij vrouwen.
Prikkelbaarheid geassocieerd met autistische stoornis
Pediatrische patiënten
De werkzaamheid van ABILIFY (aripiprazol) bij de behandeling van prikkelbaarheid geassocieerd met een autistische stoornis werd vastgesteld in twee 8 weken durende, placebogecontroleerde onderzoeken bij pediatrische patiënten (6 tot 17 jaar) die voldeden aan de DSM-IV-criteria voor autistische stoornis en vertoond gedrag zoals driftbuien, agressie, zelfbeschadigend gedrag of een combinatie van deze problemen. Meer dan 75% van deze proefpersonen was jonger dan 13 jaar.
De werkzaamheid werd geëvalueerd met behulp van twee beoordelingsschalen: de Aberrant Behavior Checklist (ABC) en de Clinical Global Impression-Improvement (CGI-I) schaal. De primaire uitkomstmaat in beide onderzoeken was de verandering van baseline tot eindpunt in de subschaal Prikkelbaarheid van de ABC (ABC-I). De ABC-I-subschaal mat symptomen van prikkelbaarheid bij een autistische stoornis.
De resultaten van deze proeven zijn als volgt:
In een van de 8 weken durende, placebogecontroleerde onderzoeken kregen kinderen en adolescenten met een autistische stoornis (n=98), in de leeftijd van 6 tot 17 jaar, dagelijkse doses placebo of ABILIFY 2 tot 15 mg/dag. ABILIFY, beginnend bij 2 mg/dag met verhogingen toegestaan tot 15 mg/dag op basis van klinische respons, verbeterde significant de scores op de ABC-I-subschaal en op de CGI-I-schaal in vergelijking met placebo. De gemiddelde dagelijkse dosis ABILIFY 10 mg aan het einde van de behandeling van 8 weken was 8,6 mg/dag (onderzoek 1 in tabel 29).
In de andere 8 weken durende, placebogecontroleerde studie bij kinderen en adolescenten met een autistische stoornis (n=218) in de leeftijd van 6 tot 17 jaar werden drie vaste doses ABILIFY (5 mg/dag, 10 mg/dag of 15 mg/dag) dag) werden vergeleken met placebo. De dosering van ABILIFY begon met 2 mg/dag en werd na één week verhoogd tot 5 mg/dag. Na een tweede week werd het verhoogd tot 10 mg/dag voor patiënten in de 10 en 15 mg-dosisarmen en na een derde week werd het verhoogd tot 15 mg/dag in de 15 mg/dag-behandelingsarm (onderzoek 2 in Tabel 29). Alle drie de doses ABILIFY verbeterden de scores op de ABC-I-subschaal significant in vergelijking met placebo.
De stoornis van Gilles de la Tourette
Pediatrische patiënten
De werkzaamheid van ABILIFY (aripiprazol) bij de behandeling van de stoornis van Gilles de la Tourette werd vastgesteld in een placebogecontroleerd onderzoek van 8 weken (7 tot 17 jaar) en een placebogecontroleerd onderzoek van 10 weken (6 tot 18 jaar). pediatrische patiënten (6 tot 18 jaar) die voldeden aan de DSM-IV-criteria voor de stoornis van Gilles de la Tourette en een totale ticscore (TTS) ≥ 20-22 hadden op de Yale Global Tic Severity Scale (YGTSS). De YGTSS is een volledig gevalideerde schaal die is ontworpen om de huidige ernst van tic te meten. De werkzaamheid werd geëvalueerd met behulp van twee beoordelingsschalen: 1) de Total Tic-score (TTS) van de YGTSS en 2) de Clinical Global Impressions Scale for Tourette's Syndrome (CGI-TS), een door de arts bepaalde samenvattende maatstaf die rekening houdt met alle beschikbare patiëntinformatie. Meer dan 65% van deze patiënten was jonger dan 13 jaar.
De primaire uitkomstmaat in beide onderzoeken was de verandering van baseline naar eindpunt in de TTS van de YGTSS. Beoordelingen voor de TTS worden gemaakt langs 5 verschillende dimensies op een schaal van 0 tot 5 voor motorische en vocale tics elk. Optelling van deze 10 scores levert een TTS op (dwz 0-50).
De resultaten van deze proeven zijn als volgt:
In het 8 weken durende, placebogecontroleerde onderzoek met vaste dosis werden kinderen en adolescenten met de stoornis van Gilles de la Tourette (n=133), in de leeftijd van 7 tot 17 jaar, 1:1:1 gerandomiseerd naar een lage dosis ABILIFY, hoge dosis ABILIFY 15 mg of placebo. De streefdoses voor de lage en hoge dosis ABILIFY 10 mg-groepen waren gebaseerd op gewicht. Patiënten
Figuur 9: Least Square Means of Change vanaf baseline in YGTSS TTS per week (onderzoek naar de stoornis van Tourette 1) 
In het 10 weken durende, placebogecontroleerde, flexibele-dosisonderzoek bij kinderen en adolescenten met de stoornis van Gilles de la Tourette (n=61), in de leeftijd van 6 tot 18 jaar, kregen patiënten dagelijkse doses placebo of ABILIFY, beginnend met 2 mg/ dag met verhogingen toegestaan tot 20 mg/dag op basis van klinische respons. ABILIFY toonde statistisch significant verbeterde scores op de YGTSS TTS-schaal in vergelijking met placebo (onderzoek 2 in tabel 30). De gemiddelde dagelijkse dosis ABILIFY aan het einde van de 10 weken durende behandeling was 6,54 mg/dag.
Agitatie geassocieerd met schizofrenie of bipolaire manie
De werkzaamheid van intramusculaire ABILIFY voor injectie voor de behandeling van agitatie werd vastgesteld in drie kortdurende (24-uurs), placebogecontroleerde onderzoeken bij geagiteerde opgenomen patiënten uit twee diagnostische groepen: schizofrenie en bipolaire I-stoornis (manische of gemengde episodes, met of zonder psychotische kenmerken). Elk van de onderzoeken omvatte een enkele actieve vergelijkende behandelingsarm van ofwel haloperidol-injectie (schizofrenie-onderzoeken) of lorazepam-injectie (bipolaire manie-onderzoek). Patiënten konden tijdens de behandelingsperioden van 24 uur maximaal drie injecties krijgen; patiënten konden de tweede injectie echter pas krijgen na de eerste periode van 2 uur waarin de primaire werkzaamheidsmaat werd beoordeeld. Patiënten die deelnamen aan de onderzoeken moesten: (1) door de klinische onderzoekers worden beoordeeld als klinisch geagiteerd en klinisch geschikte kandidaten voor behandeling met intramusculaire medicatie, en (2) een agitatieniveau vertonen dat een drempelscore van ≥15 bereikte of overschreed op de vijf items bestaande uit de Positieve en Negatieve Syndroomschaal (PANSS) Opgewonden Component (dwz slechte impulscontrole, spanning, vijandigheid, weigering en opwinding) met ten minste twee individuele itemscores ≥4 met behulp van een 1-7 scoresysteem (1 = afwezig, 4 = matig, 7 = extreem). In de onderzoeken was de gemiddelde PANSS Excited Component-score bij aanvang 19, met scores variërend van 15 tot 34 (van een maximumscore van 35), wat duidt op overwegend matige niveaus van agitatie, waarbij sommige patiënten milde of ernstige agitatie ervaren. De primaire werkzaamheidsmaatstaf die werd gebruikt voor het beoordelen van tekenen en symptomen van agitatie in deze onderzoeken was de verandering ten opzichte van de uitgangswaarde in de PANSS-opgewonden component 2 uur na injectie. Een belangrijke secundaire maatstaf was de Clinical Global Impression of Improvement (CGI-I) Scale. De resultaten van de proeven volgen:
In een placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voornamelijk voldeden aan de DSM-IV-criteria voor schizofrenie (n=350), werden vier vaste ABILIFY 20 mg injectiedoses van 1 mg, 5,25 mg, 9,75 mg en 15 mg geëvalueerd. 2 uur na injectie waren de doses van 5,25 mg, 9,75 mg en 15 mg statistisch superieur aan placebo in de PANSS-opgewonden component (onderzoek 1 in tabel 31) en op de CGII-schaal.
In een tweede placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voornamelijk voldeden aan de DSM-IV-criteria voor schizofrenie (n=445), werd één vaste ABILIFY 15 mg injectiedosis van 9,75 mg geëvalueerd. 2 uur na injectie was ABILIFY voor injectie statistisch superieur aan placebo in de PANSS-geëxciteerde component (onderzoek 2 in tabel 31) en op de CGI-I-schaal.
In een placebogecontroleerd onderzoek bij geagiteerde opgenomen patiënten die voldeden aan de DSMIV-criteria voor bipolaire I-stoornis (manisch of gemengd) (n=291), werden twee vaste ABILIFY 10 mg-injectiedoses van 9,75 mg en 15 mg geëvalueerd. 2 uur na injectie waren beide doses statistisch superieur aan placebo in de PANSS-geëxciteerde component (onderzoek 3 in tabel 31).
Onderzoek van populatiesubsets (leeftijd, ras en geslacht) bracht geen differentiële responsiviteit aan het licht op basis van deze subgroepen.
PATIËNT INFORMATIE
ABILIFY® (aripiprazol) Tabletten
ABILIFY DISCMELT® (aripiprazol) Oraal desintegrerende tabletten
ABILIFY® (aripiprazol) orale oplossing
ABILIFY® (aripiprazol) Injectie alleen voor intramusculair gebruik
Wat is de belangrijkste informatie die ik moet weten over ABILIFY 20 mg?
(Voor andere bijwerkingen, zie ook “Wat zijn de mogelijke bijwerkingen van ABILIFY?”)
Er kunnen ernstige bijwerkingen optreden als u ABILIFY gebruikt, waaronder:
- Verhoogd risico op overlijden bij oudere patiënten met aan dementie gerelateerde psychose: Geneesmiddelen zoals ABILIFY 10 mg kunnen het risico op overlijden verhogen bij ouderen die het contact met de realiteit (psychose) hebben verloren als gevolg van verwardheid en geheugenverlies (dementie). ABILIFY is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose.
- Risico op zelfmoordgedachten of -acties: Antidepressiva, depressie en andere ernstige psychische aandoeningen, en zelfmoordgedachten of zelfmoordacties:
1. Antidepressiva kunnen bij sommige kinderen, tieners en jonge volwassenen zelfmoordgedachten of zelfmoordacties doen toenemen in de eerste paar maanden van de behandeling.
2. Depressie en andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van zelfmoordgedachten en -acties. Sommige mensen lopen een bijzonder hoog risico op zelfmoordgedachten of -acties. Deze omvatten mensen met (of een familiegeschiedenis van) een bipolaire stoornis (ook wel manisch-depressieve stoornis genoemd) of zelfmoordgedachten of zelfmoordacties.
3. Hoe kan ik zelfmoordgedachten en -acties bij mezelf of een familielid voorkomen en proberen te voorkomen?
- Besteed veel aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel de zorgverlener meteen om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken aan de zorgverlener zoals gepland. Bel indien nodig de zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk een zorgverlener als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich erg geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met een zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken en ook de risico's van het niet behandelen ervan. Patiënten en hun families of andere zorgverleners moeten alle behandelkeuzes met de zorgverlener bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met de zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan de zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
- Niet alle antidepressiva die voor kinderen worden voorgeschreven, zijn door de FDA goedgekeurd voor gebruik bij kinderen. Praat met de zorgverlener van uw kind voor meer informatie.
Wat is ABILIFY?
- ABILIFY 20 mg orale tabletten, oraal uiteenvallende tabletten en orale oplossing zijn geneesmiddelen op recept die worden gebruikt voor de behandeling van:
- Schizofrenie
- manische of gemengde episodes die optreden bij een bipolaire I-stoornis
- depressieve stoornis (MDD) wanneer ABILIFY 20 mg wordt gebruikt met antidepressiva
- prikkelbaarheid geassocieerd met autistische stoornis
- De stoornis van Gilles de la Tourette
- ABILIFY Injection is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van:
- agitatie geassocieerd met schizofrenie of bipolaire manie
Het is niet bekend of ABILIFY 10 mg veilig of effectief is bij kinderen:
- jonger dan 13 jaar met schizofrenie
- jonger dan 10 jaar met een bipolaire I-stoornis
- jonger dan 6 jaar met prikkelbaarheid geassocieerd met autistische stoornis
- jonger dan 6 jaar met de stoornis van Gilles de la Tourette
Neem ABILIFY 20 mg niet in als u: allergisch bent voor aripiprazol of voor één van de bestanddelen van ABILIFY. Zie het einde van deze Medicatiegids voor een volledige lijst van ingrediënten in ABILIFY.
Voordat u ABILIFY 15 mg inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- diabetes of hoge bloedsuikerspiegel in u of uw familie; uw zorgverlener moet uw bloedsuikerspiegel controleren voordat u start met ABILIFY 10 mg en ook tijdens de behandeling.
- toevallen (convulsies).
- lage of hoge bloeddruk.
- hartproblemen of beroerte.
- zwangerschap of plannen om zwanger te worden. Het is niet bekend of ABILIFY schadelijk is voor uw ongeboren baby.
- Als u zwanger wordt terwijl u ABILIFY 10 mg krijgt, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Atypische Antipsychotica. U kunt zich registreren door te bellen naar 1-866-961-2388 of naar http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/ te gaan
- borstvoeding geeft of van plan bent borstvoeding te geven. ABILIFY gaat over in uw moedermelk. Praat met uw zorgverlener over de beste manier om uw baby te voeden als u ABILIFY krijgt.
- laag aantal witte bloedcellen.
- fenylketonurie. ABILIFY DISCMELT Oraal uiteenvallende tabletten bevatten fenylalanine.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
ABILIFY en andere geneesmiddelen kunnen elkaar beïnvloeden en mogelijk ernstige bijwerkingen veroorzaken. ABILIFY kan de werking van andere geneesmiddelen beïnvloeden en andere geneesmiddelen kunnen de werking van ABILIFY beïnvloeden.
Uw zorgverlener kan u vertellen of het veilig is om ABILIFY samen met uw andere geneesmiddelen in te nemen. Start of stop geen geneesmiddelen terwijl u ABILIFY gebruikt zonder eerst met uw zorgverlener te overleggen. Weet welke medicijnen u gebruikt. Houd een lijst bij van uw geneesmiddelen om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik ABILIFY 20 mg innemen?
- Neem ABILIFY 10 mg precies in zoals uw zorgverlener u zegt dat u het moet innemen. Verander de dosis niet en stop zelf niet met het innemen van ABILIFY.
- ABILIFY 20 mg kan met of zonder voedsel worden ingenomen.
- ABILIFY-tabletten moeten heel worden doorgeslikt.
- Als u een dosis ABILIFY 20 mg bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan gewoon de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem geen twee doses ABILIFY 10 mg tegelijk in.
- Als ABILIFY DISCMELT aan u is voorgeschreven, neem deze dan als volgt in:
- Open de blisterverpakking pas als u klaar bent om de DISCMELT-tablet in te nemen.
- Om één DISCMELT-tablet te verwijderen, opent u de verpakking en trekt u de folie van de blisterverpakking los om de tablet bloot te leggen.
- Duw de tablet niet door de folie omdat dit de tablet kan beschadigen.
- Verwijder onmiddellijk na het openen van de blister met droge handen de tablet en plaats de gehele ABILIFY DISCMELT oraal uiteenvallende tablet op de tong.
- Desintegratie van de tablet vindt snel plaats in speeksel. Het wordt aanbevolen ABILIFY 10 mg DISCMELT zonder vloeistof in te nemen. Indien nodig kan het echter met vloeistof worden ingenomen.
- Probeer de DISCMELT-tablet niet te splitsen.
- Als u te veel ABILIFY heeft ingenomen, bel dan onmiddellijk uw zorgverlener of antigifcentrum op 1-800-222-1222, of ga naar de dichtstbijzijnde eerstehulpafdeling van het ziekenhuis.
Wat moet ik vermijden tijdens het gebruik van ABILIFY 10 mg?
- Rijd niet, bedien geen zware machines of voer geen andere gevaarlijke activiteiten uit totdat u weet welke invloed ABILIFY 10 mg op u heeft. ABILIFY 20 mg kan u slaperig maken.
- Voorkom oververhitting of uitdroging.
- Oefen niet te veel.
- Blijf bij warm weer indien mogelijk binnen op een koele plaats.
- Blijf uit de zon. Draag niet te veel of zware kleding.
- Drink veel water.
Wat zijn de mogelijke bijwerkingen van ABILIFY?
ABILIFY 10 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zie “Wat is de belangrijkste informatie die ik moet weten over ABILIFY 10mg?”
- Beroerte bij ouderen (cerebrovasculaire problemen) die tot de dood kunnen leiden
- Maligne neurolepticasyndroom (MNS). Vertel het uw zorgverlener meteen als u enkele of alle van de volgende symptomen heeft: hoge koorts, stijve spieren, verwardheid, zweten, veranderingen in hartslag, hartslag en bloeddruk. Dit kunnen symptomen zijn van een zeldzame en ernstige aandoening die tot de dood kan leiden. Bel onmiddellijk uw zorgverlener als u een van deze symptomen heeft.
- Ongecontroleerde lichaamsbewegingen (tardieve dyskinesie). ABILIFY kan bewegingen veroorzaken die u niet onder controle heeft in uw gezicht, tong of andere lichaamsdelen. Tardieve dyskinesie verdwijnt mogelijk niet, zelfs als u stopt met het ontvangen van ABILIFY. Tardieve dyskinesie kan ook beginnen nadat u stopt met het ontvangen van ABILIFY.
- Problemen met uw stofwisseling zoals:
- Hoge bloedsuikerspiegel (hyperglykemie) en diabetes. Bij sommige mensen die ABILIFY gebruiken, kan een verhoging van de bloedsuikerspiegel optreden. Een extreem hoge bloedsuikerspiegel kan leiden tot coma of de dood. Als u diabetes of risicofactoren voor diabetes heeft (zoals overgewicht of een familiegeschiedenis van diabetes), moet uw zorgverlener uw bloedsuikerspiegel controleren voordat u met ABILIFY begint en tijdens uw behandeling.
Bel uw zorgverlener als u een van deze symptomen van een hoge bloedsuikerspiegel heeft terwijl u ABILIFY krijgt:
- erg dorstig voelen
- meer moet plassen dan normaal
- voel me erg hongerig
- zich zwak of moe voelen
- misselijk worden in je maag
- verward voelen, of je adem ruikt fruitig
- Verhoogd vetgehalte (cholesterol en triglyceriden) in uw bloed.
- Gewichtstoename. U en uw zorgverlener moeten uw gewicht regelmatig controleren.
- Ongewone drang. Sommige mensen die ABILIFY 15 mg gebruiken, hebben ongewone neigingen gehad, zoals gokken, vreetbuien of eten waar u geen controle over heeft (compulsief), dwangmatig winkelen en seksuele driften. Als u of uw gezinsleden merken dat u ongebruikelijke neigingen of gedragingen heeft, neem dan contact op met uw zorgverlener.
- Orthostatische hypotensie (verlaagde bloeddruk). Duizeligheid of flauwvallen kan optreden als u te snel opstaat vanuit een zittende of liggende positie.
- Valt. ABILIFY kan u slaperig of duizelig maken, kan een verlaging van uw bloeddruk veroorzaken wanneer u van houding verandert en kan uw denkvermogen en motoriek vertragen, wat kan leiden tot vallen die breuken of ander letsel kan veroorzaken.
- Laag aantal witte bloedcellen
- Toevallen (convulsies)
- Problemen met de controle van uw lichaamstemperatuur, vooral wanneer u veel sport of zich in een zeer warme ruimte bevindt. Het is belangrijk dat u water drinkt om uitdroging te voorkomen. Zie “Wat moet ik vermijden tijdens het gebruik van ABILIFY 15 mg?”
- Moeite met slikken waardoor voedsel of vloeistof in uw longen kan komen.
De meest voorkomende bijwerkingen van ABILIFY 10 mg bij volwassenen zijn:
- Misselijkheid
- duizeligheid
- braken
- ongerustheid
- constipatie
- slapeloosheid
- hoofdpijn
- rusteloosheid
- wazig zien
- ziekte van de bovenste luchtwegen
- innerlijk gevoel van rusteloosheid / behoefte om te bewegen (akathisie)
De meest voorkomende bijwerkingen van ABILIFY bij kinderen zijn:
- slaperig voelen
- slapeloosheid
- hoofdpijn
- misselijkheid
- braken
- verstopte neus
- vermoeidheid
- gewichtstoename
- verhoogde of verminderde eetlust
- ongecontroleerde bewegingen zoals rusteloosheid, tremor
- verhoogd speeksel of kwijlen
- Spierstijfheid
Dit zijn niet alle mogelijke bijwerkingen van ABILIFY.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik ABILIFY bewaren?
- Bewaar ABILIFY 15 mg bij kamertemperatuur, tussen 20 °C en 25 °C (68 °F tot 77 °F).
- Geopende flessen ABILIFY 10 mg drank kunnen tot 6 maanden na opening worden gebruikt, maar niet na de vervaldatum op de fles.
Houd ABILIFY en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van ABILIFY
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik ABILIFY 20 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef ABILIFY 20 mg niet aan andere mensen, ook niet als ze dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw zorgverlener of apotheker om informatie vragen over ABILIFY 10 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in ABILIFY?
Actief ingrediënt: aripiprazol
Inactieve ingredienten:
maïszetmeel, hydroxypropylcellulose, lactosemonohydraat, magnesiumstearaat en microkristallijne cellulose. Kleurstoffen omvatten ijzeroxide (geel of rood) en FD&C Blue No. 2 Aluminium Lake
ABILIFY 10 mg DISCMELT oraal uiteenvallende tabletten: acesulfaam-kalium, aspartaam (dat fenylalanine bevat), calciumsilicaat, croscarmellosenatrium, crospovidon, crème de vanille (natuurlijke en kunstmatige smaakstoffen), magnesiumstearaat, microkristallijne cellulose, siliciumdioxide, wijnsteenzuur en xylitol. Kleurstoffen omvatten ijzeroxide (geel of rood) en FD&C Blue No. 2 Aluminium Lake
ABILIFY orale oplossing: dinatriumedetaat, fructose (200 mg per ml), glycerine, dl-melkzuur, methylparaben, propyleenglycol, propylparaben, natriumhydroxide, sucrose (400 mg per ml) en gezuiverd water. De drank is op smaak gebracht met natuurlijke sinaasappelroom en andere natuurlijke aroma's
Ga voor meer informatie over ABILIFY naar www.abilify.com of bel 1-800-438-6055.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration
