Wellbutrin 150mg, 300mg Bupropion Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Wellbutrin 150 mg en hoe wordt het gebruikt?
Wellbutrin 150 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van ernstige depressie en seizoensgebonden affectieve stoornis te behandelen. Wellbutrin 150 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Wellbutrin 150 mg behoort tot een klasse geneesmiddelen die antidepressiva, dopamine-heropnameremmers, antidepressiva en andere hulpmiddelen voor stoppen met roken worden genoemd.
Wat zijn de mogelijke bijwerkingen van Wellbutrin 150 mg?
Wellbutrin kan ernstige bijwerkingen veroorzaken, waaronder:
- toevallen (convulsies),
- verwardheid,
- ongewone veranderingen in stemming of gedrag,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- snelle of onregelmatige hartslag,
- race gedachten,
- verhoogde energie,
- roekeloos gedrag,
- extreem gelukkig of prikkelbaar voelen,
- praten meer dan normaal, en
- ernstige slaapproblemen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Wellbutrin zijn onder meer:
- droge mond,
- verstopte neus,
- zichtproblemen,
- gehoorproblemen,
- misselijkheid,
- braken,
- constipatie,
- slaapproblemen (slapeloosheid),
- trillingen,
- zweten,
- zich angstig of nerveus voelen,
- snelle hartslagen,
- verwardheid,
- agitatie,
- vijandigheid,
- uitslag,
- hoofdpijn,
- duizeligheid, en
- gewrichtspijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Wellbutrin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088
WAARSCHUWING
SUICIDALE GEDACHTEN EN GEDRAG
SUICIDALITEIT EN ANTIDEPRESSANTE DRUGS
Antidepressiva verhoogden het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken. Deze onderzoeken lieten geen toename zien van het risico op zelfmoordgedachten en -gedrag bij gebruik van antidepressiva bij personen ouder dan 24 jaar; er was een vermindering van het risico bij gebruik van antidepressiva bij personen van 65 jaar en ouder (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Bij patiënten van alle leeftijden die beginnen met antidepressiva, moet u nauwlettend controleren op verergering en op het optreden van zelfmoordgedachten en -gedrag. Adviseer families en zorgverleners over de noodzaak van nauwkeurige observatie en communicatie met de voorschrijver (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
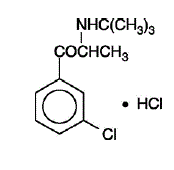
WELLBUTRIN (bupropionhydrochloride), een antidepressivum van de aminoketonklasse, is chemisch niet gerelateerd aan tricyclische, tetracyclische, selectieve serotonineheropnameremmer of andere bekende antidepressiva. De structuur lijkt sterk op die van diethylpropion; het is verwant aan fenylethylaminen. Het wordt aangeduid als (±)-1-(3-chloorfenyl)-2-[(1,1-dimethylethyl)amino]-1-propanonhydrochloride. Het molecuulgewicht is 276,2. De molecuulformule is C13H18ClNO•HCl. Bupropionhydrochloridepoeder is wit, kristallijn en zeer oplosbaar in water. Het heeft een bittere smaak en veroorzaakt het gevoel van lokale anesthesie op het mondslijmvlies. De structuurformule is:
WELLBUTRIN wordt geleverd voor orale toediening als filmomhulde tabletten van 75 mg (geel-goud) en 100 mg (rood). Elke tablet bevat de aangegeven hoeveelheid bupropionhydrochloride en de inactieve ingrediënten: 75 mg tablet – D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, microkristallijne cellulose, polyethyleenglycol, talk en titaniumdioxide; Tablet van 100 mg – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, microkristallijne cellulose, polyethyleenglycol, talk en titaniumdioxide.
INDICATIES
WELLBUTRIN (bupropionhydrochloride) is geïndiceerd voor de behandeling van depressieve stoornis (MDD), zoals gedefinieerd in de diagnostische en statistische handleiding (DSM).
De werkzaamheid van WELLBUTRIN 300 mg bij de behandeling van een depressieve episode werd vastgesteld in twee gecontroleerde klinische onderzoeken van 4 weken en een gecontroleerde poliklinische proef van 6 weken bij volwassen proefpersonen met MDD [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Algemene gebruiksaanwijzing
Om het risico op een aanval te minimaliseren, moet u de dosis geleidelijk verhogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Dosisverhogingen mogen niet hoger zijn dan 100 mg/dag in een periode van 3 dagen. WELLBUTRIN-tabletten moeten heel worden doorgeslikt en mogen niet worden fijngemaakt, verdeeld of gekauwd. WELLBUTRIN 300 mg kan met of zonder voedsel worden ingenomen.
De aanbevolen startdosering is 200 mg/dag, gegeven als tweemaal daags 100 mg. Na 3 dagen dosering kan de dosis worden verhoogd tot 300 mg/dag, driemaal daags 100 mg, met ten minste 6 uur tussen opeenvolgende doses. Dosering boven 300 mg/dag kan worden bereikt met de 75 of 100 mg tabletten.
Een maximum van 450 mg/dag, gegeven in verdeelde doses van niet meer dan 150 mg elk, kan worden overwogen voor patiënten die na enkele weken behandeling met 300 mg/dag geen klinische verbetering vertonen. Dien de tablet van 100 mg 4 maal per dag toe om de limiet van 150 mg in een enkele dosis niet te overschrijden.
Men is het er algemeen over eens dat acute depressieve episodes meerdere maanden of langer behandeling met antidepressiva vereisen die verder gaan dan de respons in de acute episode. Het is niet bekend of de dosis WELLBUTRIN die nodig is voor de onderhoudsbehandeling identiek is aan de dosis die een eerste respons gaf. Evalueer regelmatig de noodzaak van een onderhoudsbehandeling en de juiste dosis voor een dergelijke behandeling.
Dosisaanpassing bij patiënten met leverinsufficiëntie
Bij patiënten met een matige tot ernstige leverfunctiestoornis (Child-Pugh-score: 7 tot 15) is de maximale dosis WELLBUTRIN 150 mg 75 mg/dag. Bij patiënten met een lichte leverfunctiestoornis (Child-Pugh-score: 5 tot 6), overweeg dan om de dosis en/of frequentie van de dosering te verlagen (zie Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
Dosisaanpassing bij patiënten met nierinsufficiëntie
Overweeg om de dosis en/of frequentie van WELLBUTRIN 150 mg te verlagen bij patiënten met een nierfunctiestoornis (glomerulaire filtratiesnelheid minder dan 90 ml/min) [zie Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
Een patiënt overschakelen van of naar een monoamineoxidaseremmer (MAOI) antidepressivum
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van depressie en het starten van de behandeling met WELLBUTRIN. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met WELLBUTRIN voordat wordt gestart met een MAO-remmer (zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
Gebruik van WELLBUTRIN met omkeerbare MAO-remmers zoals linezolid of methyleenblauw
Start WELLBUTRIN 300 mg niet bij een patiënt die wordt behandeld met een reversibele MAO-remmer zoals linezolid of intraveneus methyleenblauw. Geneesmiddelinteracties kunnen het risico op hypertensieve reacties verhogen. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten niet-farmacologische interventies, waaronder ziekenhuisopname, worden overwogen [zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
In sommige gevallen kan een patiënt die al wordt behandeld met WELLBUTRIN een dringende behandeling met linezolid of intraveneus methyleenblauw nodig hebben. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van hypertensieve reacties bij een bepaalde patiënt, moet WELLBUTRIN 300 mg onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw blauw kan worden toegediend. De patiënt moet gedurende 2 weken of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden gecontroleerd, afhankelijk van wat zich het eerst voordoet. De therapie met WELLBUTRIN 300 mg kan 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden hervat.
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met WELLBUTRIN 300 mg is onduidelijk. De clinicus moet zich niettemin bewust zijn van de mogelijkheid van een geneesmiddelinteractie bij dergelijk gebruik [zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
HOE GELEVERD
Doseringsvormen en sterke punten
- 75 mg - geelgouden, ronde, biconvexe tabletten met de opdruk "WELLBUTRIN 75".
- 100 mg - rode, ronde, biconvexe tabletten met de opdruk "WELLBUTRIN 100".
Opslag en behandeling
WELLBUTRIN 150 mg tabletten, 75 mg bupropionhydrochloride, zijn geelgouden, ronde, biconvexe tabletten bedrukt met “WELLBUTRIN 75” in flessen van 100 ( NDC 0173-0177-55).
WELLBUTRIN-tabletten, 100 mg bupropionhydrochloride, zijn rode, ronde, biconvexe tabletten bedrukt met “WELLBUTRIN 100” in flessen van 100 ( NDC 0173-0178-55).
Bewaren bij kamertemperatuur, 20° tot 25°C (68° tot 77°F); excursies toegestaan tussen 15°C en 30°C (59°F en 86°F) [Zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen licht en vocht.
Gefabriceerd voor: GlaxoSmithKline, Research Triangle Park,. Herzien: november 2019
BIJWERKINGEN
De volgende bijwerkingen worden in andere secties van de etikettering in meer detail besproken:
- Suïcidale gedachten en gedrag bij adolescenten en jonge volwassenen [zie GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Neuropsychiatrische symptomen en zelfmoordrisico bij stoppen met roken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- inbeslagneming [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypertensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Activering van manie of hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Psychose en andere neuropsychiatrische reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Bijwerkingen die leiden tot stopzetting van de behandeling
Bijwerkingen waren voldoende hinderlijk om stopzetting van de behandeling met WELLBUTRIN te veroorzaken bij ongeveer 10% van de 2.400 proefpersonen en gezonde vrijwilligers die deelnamen aan klinische onderzoeken tijdens de initiële ontwikkeling van het product. De meest voorkomende gebeurtenissen die het staken van de behandeling veroorzaken, zijn onder meer neuropsychiatrische stoornissen (3,0%), voornamelijk agitatie en afwijkingen in de mentale toestand; gastro-intestinale stoornissen (2,1%), voornamelijk misselijkheid en braken; neurologische stoornissen (1,7%), voornamelijk toevallen, hoofdpijn en slaapstoornissen; en dermatologische problemen (1,4%), voornamelijk huiduitslag. Het is echter belangrijk op te merken dat veel van deze voorvallen optraden bij doses die de aanbevolen dagelijkse dosis overschrijden.
Vaak waargenomen bijwerkingen
Bijwerkingen die vaak voorkomen bij personen die met WELLBUTRIN worden behandeld, zijn agitatie, droge mond, slapeloosheid, hoofdpijn/migraine, misselijkheid/braken, constipatie, tremor, duizeligheid, overmatig zweten, wazig zien, tachycardie, verwardheid, huiduitslag, vijandigheid, hartritmestoornissen en auditieve verstoring.
Tabel 2 vat de bijwerkingen samen die optraden in placebogecontroleerde onderzoeken met een incidentie van ten minste 1% van de proefpersonen die WELLBUTRIN 150 mg kregen en vaker bij deze proefpersonen dan in de placebogroep.
Andere bijwerkingen waargenomen tijdens de klinische ontwikkeling van WELLBUTRIN
De omstandigheden en duur van blootstelling aan WELLBUTRIN varieerden sterk, en een aanzienlijk deel van de ervaring werd opgedaan in open en ongecontroleerde klinische settings. Tijdens deze ervaring werden talrijke bijwerkingen gemeld; zonder passende controles is het echter onmogelijk om met zekerheid te bepalen welke gebeurtenissen wel of niet door WELLBUTRIN werden veroorzaakt. De volgende opsomming is georganiseerd per orgaansysteem en beschrijft gebeurtenissen in termen van hun relatieve frequentie van rapportage in de database.
De volgende definities van frequentie worden gebruikt: Frequente bijwerkingen worden gedefinieerd als bijwerkingen die optreden bij ten minste 1/100 proefpersonen. Onregelmatige bijwerkingen zijn bijwerkingen die optreden bij 1/100 tot 1/1.000 proefpersonen, terwijl zeldzame bijwerkingen optreden bij minder dan 1/1.000 proefpersonen.
Cardiovasculair Vaak was oedeem; zeldzaam waren pijn op de borst, afwijkingen op het elektrocardiogram (ECG) (vroegtijdige slagen en niet-specifieke ST-T-veranderingen) en kortademigheid/kortademigheid; zelden waren blozen en myocardinfarct.
dermatologisch: Zelden was alopecia.
Endocrien: Onregelmatig was gynaecomastie; zeldzaam was glycosurie.
Gastro-intestinaal: Zelden waren dysfagie, dorststoornis en leverbeschadiging/geelzucht; zeldzaam was darmperforatie.
Urogenitaal: Frequent was nocturie; zeldzaam waren vaginale irritatie, zwelling van de testikels, urineweginfectie, pijnlijke erectie en vertraagde ejaculatie; zeldzaam waren enuresis en urine-incontinentie.
Neurologisch: Frequent waren ataxie/oncoördinatie, toevallen, myoclonus, dyskinesie en dystonie; zeldzaam waren mydriasis, duizeligheid en dysartrie; zelden waren afwijkingen van het elektro-encefalogram (EEG) en verminderde aandacht.
Neuropsychiatrisch: Frequent waren manie/hypomanie, verhoogd libido, hallucinaties, verminderde seksuele functie en depressie; zeldzaam waren geheugenstoornissen, depersonalisatie, psychose, dysforie, stemmingsinstabiliteit, paranoia en formele denkstoornis; zeldzaam was zelfmoordgedachten.
Mondelinge klachten: Vaak was stomatitis; zeldzaam waren kiespijn, bruxisme, tandvleesirritatie en oraal oedeem.
Ademhaling: Zelden waren bronchitis en kortademigheid/kortademigheid; zeldzaam was een longembolie.
Speciale zintuigen: Onregelmatig was visuele stoornis; zeldzaam was diplopie.
niet-specifiek: Frequent waren griepachtige symptomen; zeldzaam was niet-specifieke pijn; zeldzaam was een overdosis.
Veranderde eetlust en gewicht
Een gewichtsverlies van meer dan 5 lbs. kwam voor bij 28% van de proefpersonen die WELLBUTRIN kregen. Deze incidentie is ongeveer het dubbele van die bij vergelijkbare proefpersonen die met tricyclische middelen of placebo worden behandeld. Bovendien, terwijl 35% van de proefpersonen die tricyclische antidepressiva kregen in gewicht toenamen, deed slechts 9,4% van de met WELLBUTRIN behandelde proefpersonen dat. Als gewichtsverlies een belangrijk symptoom is van de depressieve ziekte van een patiënt, moet daarom het anorectische en/of gewichtsverlagende potentieel van WELLBUTRIN worden overwogen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van WELLBUTRIN na goedkeuring en worden niet elders op het etiket beschreven. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam (algemeen)
Artralgie, myalgie en koorts met huiduitslag en andere symptomen die wijzen op vertraagde overgevoeligheid. Deze symptomen kunnen lijken op serumziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cardiovasculair
Hypertensie (in sommige gevallen ernstig), orthostatische hypotensie, derdegraads hartblok.
endocrien
Hyponatriëmie, syndroom van ongepaste secretie van antidiuretisch hormoon, hyperglykemie, hypoglykemie.
gastro-intestinaal
Oesofagitis, hepatitis.
Hemic en lymfatisch
Ecchymose, leukocytose, leukopenie, trombocytopenie. Veranderde PT en/of INR, zelden geassocieerd met hemorragische of trombotische complicaties, werden waargenomen wanneer bupropion gelijktijdig met warfarine werd toegediend.
Musculoskeletaal
Spierstijfheid/koorts/rabdomyolyse, spierzwakte.
Zenuwstelsel
Agressie, coma, voltooide zelfmoord, delirium, droomafwijkingen, paranoïde gedachten, paresthesie, parkinsonisme, rusteloosheid, zelfmoordpoging, ontmaskering van tardieve dyskinesie.
Huid en aanhangsels
Stevens-Johnson-syndroom, angio-oedeem, exfoliatieve dermatitis, urticaria.
Speciale zintuigen
Tinnitus, verhoogde intraoculaire druk.
DRUG-INTERACTIES
Potentieel voor andere geneesmiddelen om WELLBUTRIN te beïnvloeden
Bupropion wordt voornamelijk gemetaboliseerd tot hydroxybupropion door CYP2B6. Daarom bestaat de mogelijkheid van geneesmiddelinteracties tussen WELLBUTRIN en geneesmiddelen die remmers of inductoren zijn van CYP2B6.
Remmers van CYP2B6
Ticlopidine en Clopidogrel
Gelijktijdige behandeling met deze geneesmiddelen kan de blootstelling aan bupropion verhogen, maar de blootstelling aan hydroxybupropion verlagen. Op basis van de klinische respons kan dosisaanpassing van WELLBUTRIN nodig zijn bij gelijktijdige toediening met CYP2B6-remmers (bijv. ticlopidine of clopidogrel) (zie KLINISCHE FARMACOLOGIE ].
Inductoren van CYP2B6
Ritonavir, Lopinavir en Efavirenz
Gelijktijdige behandeling met deze geneesmiddelen kan de blootstelling aan bupropion en hydroxybupropion verminderen. Dosisverhoging van WELLBUTRIN kan nodig zijn bij gelijktijdige toediening met ritonavir, lopinavir of efavirenz (zie KLINISCHE FARMACOLOGIE ] maar mag de maximaal aanbevolen dosis niet overschrijden.
Carbamazepine, Fenobarbital, Fenytoïne
Hoewel ze niet systematisch zijn onderzocht, kunnen deze geneesmiddelen het metabolisme van bupropion induceren en de blootstelling aan bupropion verminderen [zie: KLINISCHE FARMACOLOGIE ]. Als bupropion gelijktijdig met een CYP-inductor wordt gebruikt, kan het nodig zijn de dosis bupropion te verhogen, maar de maximaal aanbevolen dosis mag niet worden overschreden.
Potentieel voor WELLBUTRIN 300 mg om andere geneesmiddelen te beïnvloeden
Geneesmiddelen gemetaboliseerd door CYP2D6
Bupropion en zijn metabolieten (erythrohydrobupropion, threohydrobupropion, hydroxybupropion) zijn CYP2D6-remmers. Daarom kan gelijktijdige toediening van WELLBUTRIN met geneesmiddelen die worden gemetaboliseerd door CYP2D6 de blootstelling aan geneesmiddelen die substraten zijn van CYP2D6 verhogen. Dergelijke geneesmiddelen omvatten bepaalde antidepressiva (bijv. venlafaxine, nortriptyline, imipramine, desipramine, paroxetine, fluoxetine en sertraline), antipsychotica (bijv. haloperidol, risperidon, thioridazine), bètablokkers (bijv. metoprolol) en type 1C-antiaritmica (bijv. , propafenon en flecaïnide). Bij gelijktijdig gebruik met WELLBUTRIN kan het nodig zijn de dosis van deze CYP2D6-substraten te verlagen, vooral voor geneesmiddelen met een smalle therapeutische breedte.
Geneesmiddelen die metabolische activering door CYP2D6 nodig hebben om effectief te zijn (bijv. tamoxifen), zouden theoretisch een verminderde werkzaamheid kunnen hebben bij gelijktijdige toediening met remmers van CYP2D6 zoals bupropion. Patiënten die gelijktijdig met WELLBUTRIN en dergelijke geneesmiddelen worden behandeld, kunnen verhoogde doses van het geneesmiddel nodig hebben [zie: KLINISCHE FARMACOLOGIE ].
Digoxine
Gelijktijdige toediening van WELLBUTRIN met digoxine kan de plasma-digoxinespiegels verlagen. Controleer de plasma-digoxinespiegels bij patiënten die gelijktijdig met WELLBUTRIN en digoxine worden behandeld (zie KLINISCHE FARMACOLOGIE ].
Geneesmiddelen die de aanvalsdrempel verlagen
Wees uiterst voorzichtig bij gelijktijdige toediening van WELLBUTRIN met andere geneesmiddelen die de aanvalsdrempel verlagen (bijv. andere bupropionproducten, antipsychotica, antidepressiva, theofylline of systemische corticosteroïden). Gebruik lage aanvangsdoses en verhoog de dosis geleidelijk [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Dopaminerge geneesmiddelen (Levodopa en Amantadine)
Bupropion, levodopa en amantadine hebben dopamine-agonistische effecten. CZS-toxiciteit is gemeld bij gelijktijdige toediening van bupropion met levodopa of amantadine. Bijwerkingen waren rusteloosheid, agitatie, tremor, ataxie, loopstoornis, duizeligheid en duizeligheid. Aangenomen wordt dat de toxiciteit het gevolg is van cumulatieve dopamine-agonistische effecten. Wees voorzichtig bij het gelijktijdig toedienen van WELLBUTRIN 150 mg met deze geneesmiddelen.
Gebruik met alcohol
Tijdens postmarketingervaring zijn er zeldzame meldingen geweest van neuropsychiatrische bijwerkingen of verminderde alcoholtolerantie bij patiënten die alcohol dronken tijdens de behandeling met WELLBUTRIN. Het gebruik van alcohol tijdens de behandeling met WELLBUTRIN moet tot een minimum worden beperkt of vermeden.
MAO-remmers
Bupropion remt de heropname van dopamine en noradrenaline. Gelijktijdig gebruik van MAO-remmers en bupropion is gecontra-indiceerd omdat er een verhoogd risico is op hypertensieve reacties als bupropion gelijktijdig met MAO-remmers wordt gebruikt. Studies bij dieren tonen aan dat de acute toxiciteit van bupropion wordt versterkt door de MAO-remmer fenelzine. Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van depressie en het starten van de behandeling met WELLBUTRIN. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met WELLBUTRIN 150 mg voordat wordt gestart met een MAO-remmer (zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES ].
Geneesmiddel-laboratoriumtestinteracties
Vals-positieve urine-immunoassay-screeningtests voor amfetaminen zijn gemeld bij patiënten die bupropion gebruiken. Dit komt door een gebrek aan specificiteit van sommige screeningstesten. Zelfs na stopzetting van de behandeling met bupropion kunnen fout-positieve testresultaten optreden. Bevestigende tests, zoals gaschromatografie/massaspectrometrie, zullen bupropion van amfetaminen onderscheiden.
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
Bupropion is geen gereguleerde stof.
Misbruik
mensen
Gecontroleerde klinische onderzoeken uitgevoerd bij normale vrijwilligers, bij proefpersonen met een voorgeschiedenis van meervoudig drugsmisbruik en bij depressieve proefpersonen vertoonden enige toename in motorische activiteit en agitatie/opwinding, vaak typerend voor centrale stimulerende activiteit.
In een populatie van personen die ervaring hadden met drugsmisbruik, veroorzaakte een enkele orale dosis van 400 mg bupropion een milde amfetamine-achtige activiteit in vergelijking met placebo op de morfine-benzedrine-subschaal van de Addiction Research Center Inventories (ARCI) en een score hoger dan placebo maar minder dan 15 mg van de Schedule II-stimulant dextroamphetamine op de Like-schaal van de ARCI. Deze schalen meten algemene gevoelens van euforie en voorkeur voor drugs die vaak worden geassocieerd met misbruikpotentieel.
Het is echter niet bekend dat bevindingen in klinische onderzoeken het misbruikpotentieel van geneesmiddelen betrouwbaar voorspellen. Desalniettemin suggereert bewijs uit onderzoeken met enkelvoudige doses dat de aanbevolen dagelijkse dosering van bupropion bij orale toediening in verdeelde doses waarschijnlijk niet significant versterkend zal zijn voor misbruikers van amfetamine of CZS-stimulerende middelen. Hogere doses (die niet konden worden getest vanwege het risico op epileptische aanvallen) zouden echter bescheiden aantrekkelijk kunnen zijn voor degenen die CZS-stimulerende middelen misbruiken.
WELLBUTRIN is uitsluitend bedoeld voor oraal gebruik. Het inademen van verpulverde tabletten of het injecteren van opgelost bupropion is gemeld. Toevallen en/of gevallen van overlijden zijn gemeld wanneer bupropion intranasaal of via parenterale injectie is toegediend.
Dieren
Studies bij knaagdieren en primaten hebben aangetoond dat bupropion enkele farmacologische werkingen vertoont die gebruikelijk zijn bij psychostimulantia. Bij knaagdieren is aangetoond dat het de locomotorische activiteit verhoogt, een milde stereotiepe gedragsreactie opwekt en de reactiesnelheid verhoogt in verschillende schema-gecontroleerde gedragsparadigma's. In primaatmodellen die de positief versterkende effecten van psychoactieve drugs beoordeelden, werd bupropion zelf intraveneus toegediend. Bij ratten produceerde bupropion amfetamine-achtige en cocaïne-achtige discriminerende stimuluseffecten in paradigma's van drugsdiscriminatie die worden gebruikt om de subjectieve effecten van psychoactieve drugs te karakteriseren.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jonge volwassenen
Patiënten met MDD, zowel bij volwassenen als bij kinderen, kunnen een verergering van hun depressie ervaren en/of het ontstaan van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden tot significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege stadia van de behandeling.
Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (selectieve serotonineheropnameremmers [SSRI's] en andere) tonen aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen (18 jaar) verhogen. tot 24) met MDD en andere psychiatrische stoornissen. Klinische onderzoeken op korte termijn lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4.400 proefpersonen. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 proefpersonen. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen drugs, maar een tendens naar een toename bij de jongere proefpersonen voor bijna alle onderzochte drugs. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1.000 behandelde proefpersonen) worden gegeven in Tabel 1.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt [zie OMKADERDE WAARSCHUWING].
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen die de patiënt vertoonde.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor MDD of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen, zoals evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor WELLBUTRIN 150 mg moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Neuropsychiatrische bijwerkingen en zelfmoordrisico bij stoppen met roken behandeling
WELLBUTRIN is niet goedgekeurd voor behandeling bij het stoppen met roken; het bevat echter dezelfde werkzame stof als het stoppen met roken medicijn ZYBAN. Ernstige neuropsychiatrische bijwerkingen zijn gemeld bij patiënten die bupropion gebruikten om te stoppen met roken. Deze postmarketingrapporten omvatten stemmingswisselingen (waaronder depressie en manie), psychose, hallucinaties, paranoia, wanen, moordgedachten, agressie, vijandigheid, agitatie, angst en paniek, evenals zelfmoordgedachten, zelfmoordpogingen en voltooide zelfmoord [ zien ONGEWENSTE REACTIES ]. Sommige patiënten die zijn gestopt met roken, hebben mogelijk symptomen van nicotineontwenning ervaren, waaronder een depressieve stemming. Depressie, zelden met inbegrip van zelfmoordgedachten, is gemeld bij rokers die een poging tot stoppen met roken ondergingen zonder medicatie. Sommige van deze bijwerkingen traden echter op bij patiënten die bupropion gebruikten en die bleven roken.
Neuropsychiatrische bijwerkingen traden op bij patiënten zonder en met een reeds bestaande psychiatrische aandoening; sommige patiënten ervoeren een verergering van hun psychiatrische aandoeningen. Observeer patiënten op het optreden van neuropsychiatrische bijwerkingen. Adviseer patiënten en zorgverleners dat de patiënt moet stoppen met het gebruik van WELLBUTRIN 300 mg en onmiddellijk contact moet opnemen met een zorgverlener als agitatie, depressieve stemming of veranderingen in gedrag of denken worden waargenomen die niet typisch zijn voor de patiënt, of als de patiënt zelfmoordgedachten of zelfmoordgedrag ontwikkelt . In veel postmarketinggevallen werd melding gemaakt van het verdwijnen van de symptomen na stopzetting van bupropion. In sommige gevallen hielden de symptomen echter aan; daarom moeten voortdurende monitoring en ondersteunende zorg worden geboden totdat de symptomen zijn verdwenen.
Hartinfarct
WELLBUTRIN 300 mg kan epileptische aanvallen veroorzaken. Het risico op een aanval is dosisafhankelijk. De dosis mag niet hoger zijn dan 450 mg/dag. Verhoog de dosis geleidelijk. Stop met WELLBUTRIN 150 mg en herstart de behandeling niet als de patiënt een aanval krijgt.
Het risico op aanvallen is ook gerelateerd aan patiëntfactoren, klinische situaties en gelijktijdige medicatie die de aanvalsdrempel verlaagt. Overweeg deze risico's voordat u begint met de behandeling met WELLBUTRIN. WELLBUTRIN 300 mg is gecontra-indiceerd bij patiënten met een epileptische aandoening, huidige of eerdere diagnose van anorexia nervosa of boulimia, of die abrupt stoppen met alcohol, benzodiazepinen, barbituraten en anti-epileptica [zie CONTRA-INDICATIES , DRUG-INTERACTIES ]. De volgende aandoeningen kunnen ook het risico op een aanval vergroten: ernstig hoofdletsel; arterioveneuze misvorming; CNS-tumor of CNS-infectie; ernstige beroerte; gelijktijdig gebruik van andere medicijnen die de aanvalsdrempel verlagen (bijv. andere bupropionproducten, antipsychotica, tricyclische antidepressiva, theofylline en systemische corticosteroïden); stofwisselingsstoornissen (bijv. hypoglykemie, hyponatriëmie, ernstige leverinsufficiëntie en hypoxie); gebruik van illegale drugs (bijv. cocaïne); of misbruik of misbruik van geneesmiddelen op recept, zoals CZS-stimulerende middelen. Bijkomende predisponerende aandoeningen zijn onder meer diabetes mellitus die wordt behandeld met orale hypoglycemische geneesmiddelen of insuline; gebruik van anorectische medicijnen; en overmatig gebruik van alcohol, benzodiazepinen, sedativa/hypnotica of opiaten.
Incidentie van epileptische aanvallen bij gebruik van bupropion
Bupropion wordt geassocieerd met epileptische aanvallen bij ongeveer 0,4% (4/1.000) van de patiënten die worden behandeld met doses tot 450 mg/dag. De geschatte incidentie van aanvallen voor WELLBUTRIN neemt bijna 10-voudig toe tussen 450 en 600 mg/dag.
Het risico op epileptische aanvallen kan worden verminderd als de dosis WELLBUTRIN 300 mg niet hoger is dan 450 mg/dag, gegeven als driemaal daags 150 mg, en de titratiesnelheid geleidelijk is.
Hypertensie
Behandeling met WELLBUTRIN kan leiden tot verhoogde bloeddruk en hypertensie. Beoordeel de bloeddruk voordat de behandeling met WELLBUTRIN 150 mg wordt gestart en controleer deze regelmatig tijdens de behandeling. Het risico op hypertensie neemt toe als WELLBUTRIN 150 mg gelijktijdig wordt gebruikt met MAO-remmers of andere geneesmiddelen die de dopaminerge of noradrenerge activiteit verhogen (zie CONTRA-INDICATIES ].
Gegevens uit een vergelijkende studie van de formulering met aanhoudende afgifte van bupropion HCl, nicotine transdermaal systeem (NTS), de combinatie van bupropion met aanhoudende afgifte plus NTS en placebo als hulpmiddel bij het stoppen met roken suggereren een hogere incidentie van tijdens de behandeling optredende hypertensie bij patiënten behandeld met de combinatie van bupropion met aanhoudende afgifte en NTS. In dit onderzoek had 6,1% van de proefpersonen die werden behandeld met de combinatie van bupropion met aanhoudende afgifte en NTS tijdens de behandeling optredende hypertensie, vergeleken met 2,5%, 1,6% en 3,1% van de proefpersonen die werden behandeld met respectievelijk bupropion met aanhoudende afgifte, NTS en placebo. . De meerderheid van deze proefpersonen had aanwijzingen voor reeds bestaande hypertensie. Bij drie proefpersonen (1,2%) die werden behandeld met de combinatie van bupropion met aanhoudende afgifte en NTS en bij 1 proefpersoon (0,4%) die met NTS werd behandeld, werd de studiemedicatie stopgezet vanwege hypertensie in vergelijking met geen van de proefpersonen die werden behandeld met bupropion met aanhoudende afgifte of placebo. Controle van de bloeddruk wordt aanbevolen bij patiënten die de combinatie van bupropion en nicotinevervangers krijgen.
In een klinische studie met bupropion met onmiddellijke afgifte bij patiënten met MDD met stabiel congestief hartfalen (N = 36), werd bupropion geassocieerd met een verergering van reeds bestaande hypertensie bij 2 proefpersonen, wat leidde tot stopzetting van de behandeling met bupropion. Er zijn geen gecontroleerde onderzoeken die de veiligheid van bupropion beoordelen bij patiënten met een recente voorgeschiedenis van een myocardinfarct of instabiele hartziekte.
Activering van manie/hypomanie
Behandeling met antidepressiva kan een manische, gemengde of hypomanische manische episode uitlokken. Het risico lijkt verhoogd te zijn bij patiënten met een bipolaire stoornis of die risicofactoren hebben voor een bipolaire stoornis. Voordat WELLBUTRIN wordt gestart, moeten patiënten worden gescreend op een voorgeschiedenis van een bipolaire stoornis en de aanwezigheid van risicofactoren voor een bipolaire stoornis (bijv. een familiegeschiedenis van een bipolaire stoornis, zelfmoord of depressie). WELLBUTRIN 150 mg is niet goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
Psychose en andere neuropsychiatrische reacties
Depressieve patiënten die met WELLBUTRIN werden behandeld, hadden verschillende neuropsychiatrische tekenen en symptomen, waaronder wanen, hallucinaties, psychose, concentratiestoornissen, paranoia en verwardheid. Sommige van deze patiënten hadden de diagnose bipolaire stoornis. In sommige gevallen namen deze symptomen af na dosisverlaging en/of stopzetting van de behandeling. Instrueer patiënten om contact op te nemen met een beroepsbeoefenaar in de gezondheidszorg als dergelijke reacties optreden.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder WELLBUTRIN 300 mg, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
Overgevoeligheidsreacties
Anafylactoïde/anafylactische reacties zijn opgetreden tijdens klinische onderzoeken met bupropion. Reacties werden gekenmerkt door pruritus, urticaria, angio-oedeem en dyspneu die medische behandeling vereisen. Daarnaast zijn er zeldzame, spontane postmarketingmeldingen geweest van erythema multiforme, Stevens-Johnson-syndroom en anafylactische shock geassocieerd met bupropion. Instrueer patiënten om te stoppen met WELLBUTRIN 150 mg en een zorgverlener te raadplegen als ze tijdens de behandeling een allergische of anafylactoïde/anafylactische reactie ontwikkelen (bijv. huiduitslag, jeuk, netelroos, pijn op de borst, oedeem en kortademigheid).
Er zijn meldingen van artralgie, myalgie, koorts met uitslag en andere serumziekteachtige symptomen die wijzen op vertraagde overgevoeligheid.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Suïcidale gedachten en gedrag
Instrueer patiënten, hun families en/of hun verzorgers alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Adviseer families en zorgverleners van patiënten om het optreden van dergelijke symptomen dagelijks te observeren, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten worden gemeld aan de voorschrijver van de patiënt of beroepsbeoefenaar in de gezondheidszorg, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen die de patiënt vertoont. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak tot zeer nauwgezette monitoring en mogelijk wijzigingen in de medicatie.
Neuropsychiatrische bijwerkingen en zelfmoordrisico bij stoppen met roken behandeling
Hoewel WELLBUTRIN 150 mg niet is geïndiceerd voor een behandeling om te stoppen met roken, bevat het dezelfde werkzame stof als ZYBAN die voor dit gebruik is goedgekeurd. Informeer patiënten dat sommige patiënten veranderingen in stemming hebben ervaren (waaronder depressie en manie), psychose, hallucinaties, paranoia, waanideeën, moordgedachten, agressie, vijandigheid, agitatie, angst en paniek, evenals zelfmoordgedachten en zelfmoord bij een poging om te stoppen roken terwijl u bupropion gebruikt. Instrueer patiënten om te stoppen met bupropion en neem contact op met een beroepsbeoefenaar in de gezondheidszorg als ze dergelijke symptomen ervaren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
Ernstige allergische reacties
Informeer patiënten over de symptomen van overgevoeligheid en stop met WELLBUTRIN 300 mg als ze een ernstige allergische reactie hebben.
Hartinfarct
Instrueer patiënten om te stoppen met WELLBUTRIN en niet opnieuw te starten als ze een aanval krijgen tijdens de behandeling. Adviseer patiënten dat overmatig gebruik of abrupt staken van alcohol, benzodiazepinen, anti-epileptica of sedativa/hypnotica het risico op een aanval kan verhogen. Adviseer patiënten om het gebruik van alcohol te minimaliseren of te vermijden.
Hoeksluiting glaucoom
Patiënten moeten erop worden gewezen dat het gebruik van WELLBUTRIN 150 mg lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen misschien worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bupropion-bevattende producten
Vertel patiënten dat WELLBUTRIN 150 mg hetzelfde werkzame bestanddeel (bupropionhydrochloride) bevat als ZYBAN, dat wordt gebruikt als hulpmiddel bij de behandeling om te stoppen met roken, en dat WELLBUTRIN 150 mg niet mag worden gebruikt in combinatie met ZYBAN of andere geneesmiddelen die bupropion bevatten (zoals als WELLBUTRIN 150 mg SR, de formulering met verlengde afgifte en WELLBUTRIN XL of FORFIVO XL, de formuleringen met verlengde afgifte, en APLENZIN, de formulering met verlengde afgifte van bupropionhydrobromide). Daarnaast zijn er een aantal generieke bupropion HCl-producten voor de formuleringen met onmiddellijke, langdurige en verlengde afgifte.
Potentieel voor cognitieve en motorische stoornissen
Adviseer patiënten dat elk CZS-actief medicijn zoals WELLBUTRIN hun vermogen om taken uit te voeren die beoordelingsvermogen of motorische en cognitieve vaardigheden vereisen, kan verminderen. Adviseer patiënten dat totdat ze redelijk zeker zijn dat WELLBUTRIN 300 mg hun prestaties niet nadelig beïnvloedt, ze moeten afzien van het besturen van een auto of het bedienen van complexe, gevaarlijke machines. WELLBUTRIN 150 mg kan leiden tot een verminderde alcoholtolerantie.
Gelijktijdige medicatie
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, omdat WELLBUTRIN 150 mg en andere geneesmiddelen elkaars stofwisseling kunnen beïnvloeden.

Zwangerschap
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met WELLBUTRIN. Adviseer patiënten dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan WELLBUTRIN 150 mg zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Opslaginformatie
Instrueer patiënten om WELLBUTRIN op kamertemperatuur te bewaren, tussen 20 °C en 25 °C (68 °F en 77 °F) en de tabletten droog en uit het licht te bewaren.
Administratie Informatie
Instrueer patiënten om WELLBUTRIN in gelijk verdeelde doses 3 of 4 keer per dag in te nemen, met een tussenpoos van ten minste 6 uur om het risico op aanvallen te minimaliseren. Instrueer patiënten als ze een dosis hebben overgeslagen, geen extra tablet in te nemen om de vergeten dosis in te halen en de volgende tablet op het normale tijdstip in te nemen vanwege het dosisgerelateerde risico op epileptische aanvallen. Instrueer patiënten dat WELLBUTRIN-tabletten heel moeten worden doorgeslikt en niet mogen worden fijngemaakt, verdeeld of gekauwd. WELLBUTRIN kan met of zonder voedsel worden ingenomen.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150 mg XL en ZYBAN zijn handelsmerken die eigendom zijn van of in licentie zijn gegeven aan de GSK-bedrijvengroep. De andere vermelde merken zijn handelsmerken die eigendom zijn van of in licentie zijn gegeven aan hun respectievelijke eigenaren en zijn geen eigendom van of in licentie gegeven aan de GSK-bedrijvengroep. De makers van deze merken zijn niet gelieerd aan en onderschrijven de GSK-bedrijvengroep of haar producten niet.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Levenslange carcinogeniteitsstudies werden uitgevoerd bij ratten en muizen met bupropiondoses tot respectievelijk 300 en 150 mg/kg/dag. Deze doses zijn respectievelijk ongeveer 6 en 2 keer de MRHD, op basis van mg/m2. In het onderzoek bij ratten was er een toename van nodulaire proliferatieve laesies van de lever bij doses van 100 tot 300 mg/kg/dag (ongeveer 2 tot 6 maal de MRHD op basis van mg/m2); lagere doses werden niet getest. De vraag of dergelijke laesies al dan niet voorlopers kunnen zijn van neoplasmata van de lever is momenteel onopgelost. Vergelijkbare leverlaesies werden niet gezien in het muizenonderzoek en in geen van beide onderzoeken werd een toename van kwaadaardige tumoren van de lever en andere organen gezien.
Bupropion produceerde een positieve respons (2 tot 3 keer de mutatiesnelheid van de controle) in 2 van de 5 stammen in de bacteriële mutageniteitstest van Ames. Bupropion veroorzaakte een toename van chromosomale afwijkingen in 1 van de 3 in vivo cytogenetische studies van beenmerg bij ratten.
Er waren geen effecten op de mannelijke en vrouwelijke vruchtbaarheid wanneer ratten orale doses bupropion tot 300 mg/kg/dag (ongeveer 6 keer de MRHD op basis van mg/m2) kregen toegediend aan vrouwtjes voorafgaand aan de paring en ofwel tot dag 13 van de dracht of door lactatie, en aan mannetjes gedurende 60 dagen voorafgaand aan en tijdens de paring. Doses van 200 mg/kg/dag (ongeveer 4 keer de MRHD op basis van mg/m2) of meer veroorzaakten echter voorbijgaande ataxie of gedragsveranderingen bij volwassen vrouwelijke ratten. Er waren ook geen nadelige effecten op de vruchtbaarheid, reproductie of groei en ontwikkeling van mannelijke of vrouwelijke nakomelingen.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een onafhankelijk register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan antidepressiva zijn blootgesteld. Zorgaanbieders worden aangemoedigd om patiënten te registreren door het National Pregnancy Registry for Antidepressants te bellen op 1-844-4056185 of online te bezoeken op https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants.
Risico Samenvatting
Gegevens uit epidemiologische onderzoeken van zwangere vrouwen die in het eerste trimester aan bupropion zijn blootgesteld, hebben geen algemeen verhoogd risico op aangeboren afwijkingen aangetoond (zie Gegevens ). Er zijn risico's voor de moeder verbonden aan onbehandelde depressie tijdens de zwangerschap (zie: Klinische overwegingen ). Wanneer bupropion werd toegediend aan zwangere ratten tijdens de organogenese, waren er geen aanwijzingen voor foetale misvormingen bij doses tot ongeveer 10 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 450 mg/dag. Bij toediening aan drachtige konijnen tijdens de organogenese werden niet-dosisgerelateerde verhogingen van de incidentie van foetale misvormingen en skeletvariaties waargenomen bij doses die ongeveer gelijk waren aan de MRHD en hoger. Een verminderd foetaal gewicht werd gezien bij doses die tweemaal de MRHD en hoger waren (zie: Dierlijke gegevens ).
Het geschatte achtergrondrisico op ernstige geboorteafwijkingen en miskraam is niet bekend voor de aangegeven populatie. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico op ernstige geboorteafwijkingen en op een miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Een prospectief, longitudinaal onderzoek volgde 201 zwangere vrouwen met een voorgeschiedenis van depressieve stoornis die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten tijdens de zwangerschap. De vrouwen die tijdens de zwangerschap stopten met antidepressiva, hadden meer kans op een terugval van een ernstige depressie dan vrouwen die doorgingen met antidepressiva. Overweeg de risico's voor de moeder van onbehandelde depressie en mogelijke effecten op de foetus bij het stoppen of veranderen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Gegevens
Menselijke gegevens
Gegevens van de internationale bupropion Pregnancy Registry (675 blootstellingen in het eerste trimester) en een retrospectieve cohortstudie met gebruikmaking van de United Healthcare-database (1.213 blootstellingen in het eerste trimester) lieten geen verhoogd risico op algemene misvormingen zien. Het register is niet ontworpen of gebruikt om specifieke defecten te evalueren, maar suggereerde een mogelijke toename van hartafwijkingen.
Er is geen verhoogd risico op cardiovasculaire misvormingen waargenomen na blootstelling aan bupropion tijdens het eerste trimester. Het prospectief waargenomen aantal cardiovasculaire misvormingen bij zwangerschappen met blootstelling aan bupropion in het eerste trimester uit het internationale zwangerschapsregister was 1,3% (9 cardiovasculaire misvormingen/675 maternale blootstellingen aan bupropion in het eerste trimester), wat vergelijkbaar is met het achtergrondpercentage van cardiovasculaire misvormingen (ongeveer 1%). Gegevens uit de United Healthcare-database, met een beperkt aantal blootgestelde gevallen met cardiovasculaire misvormingen, en een case-control-onderzoek (6.853 zuigelingen met cardiovasculaire misvormingen en 5.763 met niet-cardiovasculaire misvormingen) van zelfgerapporteerd bupropiongebruik van de National Birth Defects Preventiestudie (NBDPS) toonde geen verhoogd risico op cardiovasculaire misvormingen in het algemeen na blootstelling aan bupropion tijdens het eerste trimester.
Onderzoeksbevindingen over blootstelling aan bupropion tijdens het eerste trimester en het risico op obstructie van de linkerventrikel-outflow-tractus (LVOTO) zijn inconsistent en laten geen conclusies toe met betrekking tot een mogelijke associatie. De United Healthcare-database had onvoldoende power om deze associatie te evalueren; de NBDPS vond een verhoogd risico op LVOTO (n = 10; aangepaste OR = 2,6; 95% BI: 1,2, 5,7), en de case-control studie van Slone Epidemiology vond geen verhoogd risico op LVOTO.
Onderzoeksbevindingen over blootstelling aan bupropion tijdens het eerste trimester en het risico op ventrikelseptumdefect (VSD) zijn inconsistent en laten geen conclusies toe met betrekking tot een mogelijk verband. De Slone Epidemiology Study vond een verhoogd risico op VSD na blootstelling aan maternale bupropion in het eerste trimester (n = 17; aangepaste OR = 2,5; 95% BI: 1,3; 5,0) maar vond geen verhoogd risico op andere onderzochte cardiovasculaire malformaties (inclusief LVOTO als bovenstaande). Het NBDPS- en United Healthcare-databaseonderzoek vond geen verband tussen blootstelling aan maternale bupropion in het eerste trimester en VSD.
Voor de bevindingen van LVOTO en VSD waren de onderzoeken beperkt door het kleine aantal blootgestelde gevallen, inconsistente bevindingen tussen onderzoeken en het potentieel voor toevallige bevindingen uit meerdere vergelijkingen in case-control-onderzoeken.
Dierlijke gegevens
In onderzoeken uitgevoerd bij drachtige ratten en konijnen werd bupropion oraal toegediend tijdens de periode van organogenese in doses tot respectievelijk 450 en 150 mg/kg/dag (respectievelijk ongeveer 10 en 6 maal de MRHD, op basis van mg/m2 ). Er waren geen aanwijzingen voor foetale misvormingen bij ratten. Bij toediening aan drachtige konijnen tijdens de organogenese werden niet-dosisgerelateerde verhogingen van de incidentie van foetale misvormingen en skeletvariaties waargenomen bij de laagste geteste dosis (25 mg/kg/dag, ongeveer gelijk aan de MRHD op basis van mg/m2) en groter. Verminderde foetale gewichten werden waargenomen bij doses van 50 mg/kg/dag (ongeveer 2 maal de MRHD op basis van mg/m2) en hoger. Er was geen maternale toxiciteit zichtbaar bij doses van 50 mg/kg/dag of minder.
In een pre- en postnatale ontwikkelingsstudie had bupropion oraal toegediend aan drachtige ratten in doses tot 150 mg/kg/dag (ongeveer 3 maal de MRHD op basis van mg/m2) vanaf embryonale implantatie tot lactatie geen effect op de groei van de jongen of ontwikkeling.
Borstvoeding
Risico Samenvatting
Gegevens uit gepubliceerde literatuur melden de aanwezigheid van bupropion en zijn metabolieten in moedermelk (zie: Gegevens ). Er zijn geen gegevens over de effecten van bupropion of zijn metabolieten op de melkproductie. Beperkte gegevens uit postmarketingrapporten hebben geen duidelijk verband aangetoond tussen bijwerkingen bij zuigelingen die borstvoeding krijgen. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan WELLBUTRIN en eventuele nadelige effecten op het kind dat borstvoeding krijgt van WELLBUTRIN of van de onderliggende maternale aandoening.
Gegevens
In een lactatieonderzoek bij 10 vrouwen werden oraal gedoseerde bupropion en zijn actieve metabolieten gemeten in afgekolfde melk. De gemiddelde dagelijkse blootstelling van zuigelingen (uitgaande van een dagelijkse consumptie van 150 ml/kg) aan bupropion en zijn actieve metabolieten was 2% van de voor het gewicht van de moeder aangepaste dosis. Postmarketingrapporten hebben epileptische aanvallen beschreven bij zuigelingen die borstvoeding krijgen. De relatie tussen blootstelling aan bupropion en deze aanvallen is onduidelijk.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld [zie: GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geriatrisch gebruik
Van de ongeveer 6.000 proefpersonen die deelnamen aan klinische onderzoeken met bupropion-tabletten met verlengde afgifte (onderzoeken naar depressie en stoppen met roken), waren er 275 65 jaar en 47 jaar ≥75 jaar. Daarnaast namen enkele honderden proefpersonen van ≥65 jaar deel aan klinische onderzoeken met de formulering met onmiddellijke afgifte van bupropion (depressieonderzoeken). Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen. Gerapporteerde klinische ervaring heeft geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Bupropion wordt uitgebreid in de lever gemetaboliseerd tot actieve metabolieten, die verder worden gemetaboliseerd en uitgescheiden door de nieren. Het risico op bijwerkingen kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, kan het nodig zijn om deze factor in overweging te nemen bij de dosiskeuze; het kan nuttig zijn om de nierfunctie te controleren [zie DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Overweeg een lagere dosis en/of doseringsfrequentie van WELLBUTRIN bij patiënten met nierinsufficiëntie (glomerulaire filtratiesnelheid: minder dan 90 ml/min). Bupropion en zijn metabolieten worden via de nieren geklaard en kunnen zich bij dergelijke patiënten in grotere mate dan normaal ophopen. Controleer nauwlettend op bijwerkingen die kunnen wijzen op hoge blootstelling aan bupropion of metabolieten [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Bij patiënten met een matige tot ernstige leverfunctiestoornis (Child-Pugh-score: 7 tot 15) is de maximale dosis WELLBUTRIN 150 mg 75 mg per dag. Bij patiënten met een lichte leverfunctiestoornis (Child-Pugh-score: 5 tot 6), overweeg dan om de dosis en/of frequentie van de dosering te verlagen (zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Ervaring met menselijke overdosis
Overdoseringen tot 30 gram of meer bupropion zijn gemeld. Insulten werden gemeld in ongeveer een derde van alle gevallen. Andere ernstige reacties die werden gemeld bij overdoses van alleen bupropion waren hallucinaties, bewustzijnsverlies, sinustachycardie en ECG-veranderingen zoals geleidingsstoornissen (inclusief QRS-verlenging) of aritmieën. Koorts, spierstijfheid, rabdomyolyse, hypotensie, stupor, coma en respiratoire insufficiëntie zijn voornamelijk gemeld wanneer bupropion deel uitmaakte van meerdere overdoses van geneesmiddelen.
Hoewel de meeste patiënten herstelden zonder gevolgen, zijn sterfgevallen gemeld die verband houden met overdoses van alleen bupropion bij patiënten die grote doses van het geneesmiddel innamen. Bij deze patiënten werden meerdere ongecontroleerde aanvallen, bradycardie, hartfalen en hartstilstand voor overlijden gemeld.
Beheer van overdosering
Raadpleeg een gecertificeerd antigifcentrum voor up-to-date begeleiding en advies. Telefoonnummers van gecertificeerde antigifcentra staan vermeld in de Physician's Desk Reference (PDR). Bel 1-800-222-1222 of raadpleeg www.poison.org.
Er zijn geen antidota bekend voor bupropion. Bied in geval van een overdosis ondersteunende zorg, inclusief nauw medisch toezicht en monitoring. Overweeg de mogelijkheid van een overdosis van meerdere geneesmiddelen. Zorg voor een adequate luchtweg, zuurstofvoorziening en ventilatie. Controleer het hartritme en de vitale functies. Inductie van braken wordt niet aanbevolen.
CONTRA-INDICATIES
- WELLBUTRIN 150 mg is gecontra-indiceerd bij patiënten met een epileptische aandoening.
- WELLBUTRIN is gecontra-indiceerd bij patiënten met een huidige of eerdere diagnose van boulimia of anorexia nervosa, aangezien een hogere incidentie van aanvallen werd waargenomen bij dergelijke patiënten die met WELLBUTRIN werden behandeld (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- WELLBUTRIN 300 mg is gecontra-indiceerd bij patiënten die abrupt stoppen met alcohol, benzodiazepinen, barbituraten en anti-epileptica [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- Het gelijktijdig gebruik van MAO-remmers (bedoeld voor de behandeling van psychiatrische stoornissen) met WELLBUTRIN 300 mg of binnen 14 dagen na stopzetting van de behandeling met WELLBUTRIN 150 mg is gecontra-indiceerd. Er is een verhoogd risico op hypertensieve reacties wanneer WELLBUTRIN gelijktijdig met MAO-remmers wordt gebruikt. Het gebruik van WELLBUTRIN binnen 14 dagen na stopzetting van de behandeling met een MAO-remmer is ook gecontra-indiceerd. Het starten van WELLBUTRIN 150 mg bij een patiënt die wordt behandeld met reversibele MAO-remmers zoals linezolid of intraveneus methyleenblauw is gecontra-indiceerd [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- WELLBUTRIN is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor bupropion of andere bestanddelen van WELLBUTRIN. Anafylactoïde/anafylactische reacties en Stevens-Johnson-syndroom zijn gemeld [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het exacte mechanisme van de antidepressieve werking van bupropion is niet bekend, maar er wordt aangenomen dat het verband houdt met noradrenerge en/of dopaminerge mechanismen. Bupropion is een relatief zwakke remmer van de neuronale heropname van noradrenaline en dopamine en remt de heropname van serotonine niet. Bupropion remt monoamineoxidase niet.
Farmacokinetiek
Bupropion is een racemisch mengsel. De farmacologische activiteit en farmacokinetiek van de individuele enantiomeren zijn niet onderzocht. De gemiddelde eliminatiehalfwaardetijd (±SD) van bupropion na chronische toediening is 21 (±9) uur, en steady-state plasmaconcentraties van bupropion worden binnen 8 dagen bereikt.
Absorptie
De absolute biologische beschikbaarheid van WELLBUTRIN bij mensen is niet vastgesteld omdat er geen intraveneuze formulering voor menselijk gebruik beschikbaar is. Het lijkt echter waarschijnlijk dat slechts een klein deel van een oraal toegediende dosis de systemische circulatie intact bereikt. In studies bij ratten en honden varieerde de biologische beschikbaarheid van bupropion van 5% tot 20%.
Bij mensen worden na orale toediening van WELLBUTRIN 300 mg de piekplasmaconcentraties van bupropion gewoonlijk binnen 2 uur bereikt. De plasmaconcentraties van bupropion zijn dosisproportioneel na enkelvoudige doses van 100 tot 250 mg; het is echter niet bekend of de evenredigheid tussen dosis en plasmaspiegel behouden blijft bij chronisch gebruik.
Verdeling
In vitro testen tonen aan dat bupropion voor 84% gebonden is aan humane plasma-eiwitten bij concentraties tot 200 mcg/ml. De mate van eiwitbinding van de hydroxybupropionmetaboliet is vergelijkbaar met die van bupropion, terwijl de mate van eiwitbinding van de threohydrobupropionmetaboliet ongeveer de helft is van die van bupropion.
Metabolisme
Bupropion wordt uitgebreid gemetaboliseerd bij de mens. Drie metabolieten zijn actief: hydroxybupropion, dat wordt gevormd via hydroxylering van de tert-butylgroep van bupropion, en de aminoalcoholisomeren threohydrobupropion en erythrohydrobupropion, die worden gevormd via reductie van de carbonylgroep. In vitro bevindingen suggereren dat CYP2B6 het belangrijkste iso-enzym is dat betrokken is bij de vorming van hydroxybupropion, terwijl cytochroom P450-enzymen niet betrokken zijn bij de vorming van threohydrobupropion. Oxidatie van de zijketen van bupropion resulteert in de vorming van een glycineconjugaat van metachloorbenzoëzuur, dat vervolgens wordt uitgescheiden als de belangrijkste urinaire metaboliet. De potentie en toxiciteit van de metabolieten ten opzichte van bupropion zijn niet volledig gekarakteriseerd. In een antidepressivum-screeningtest bij muizen is echter aangetoond dat hydroxybupropion half zo krachtig is als bupropion, terwijl threohydrobupropion en erythrohydrobupropion vijfmaal minder krachtig zijn dan bupropion. Dit kan van klinisch belang zijn omdat de plasmaconcentraties van de metabolieten even hoog of hoger zijn dan die van bupropion.
Na een enkelvoudige dosis bij mensen treden de piekplasmaconcentraties van hydroxybupropion ongeveer 3 uur na toediening van WELLBUTRIN op en zijn ongeveer 10 keer de piekconcentratie van het oorspronkelijke geneesmiddel bij steady-state. De eliminatiehalfwaardetijd van hydroxybupropion is ongeveer 20 (±5) uur en de AUC bij steady state is ongeveer 17 keer die van bupropion. De tijden tot piekconcentraties voor de metabolieten van erythrohydrobupropion en threohydrobupropion zijn vergelijkbaar met die van de metaboliet van hydroxybupropion. Hun eliminatiehalfwaardetijden zijn echter langer, respectievelijk 33 (±10) en 37 (±13) uur, en de AUC's bij steady-state zijn respectievelijk 1,5 en 7 keer die van bupropion.
Bupropion en zijn metabolieten vertonen een lineaire kinetiek na chronische toediening van 300 tot 450 mg/dag.
Eliminatie
Na orale toediening van 200 mg 14C-bupropion bij de mens werd respectievelijk 87% en 10% van de radioactieve dosis teruggevonden in de urine en feces. Slechts 0,5% van de orale dosis werd als onveranderd bupropion uitgescheiden.
Specifieke populaties
Van factoren of omstandigheden die de metabolische capaciteit (bijv. leverziekte, congestief hartfalen [CHF], leeftijd, gelijktijdige medicatie, enz.) of eliminatie veranderen, kan worden verwacht dat ze de mate en mate van accumulatie van de actieve metabolieten van bupropion beïnvloeden. De eliminatie van de belangrijkste metabolieten van bupropion kan worden beïnvloed door een verminderde nier- of leverfunctie, omdat het matig polaire verbindingen zijn en het waarschijnlijk is dat ze verder worden gemetaboliseerd of geconjugeerd in de lever voordat ze via de urine worden uitgescheiden.
Patiënten met nierinsufficiëntie
Er is beperkte informatie over de farmacokinetiek van bupropion bij patiënten met nierinsufficiëntie. Een vergelijking tussen normale proefpersonen en proefpersonen met nierfalen in het eindstadium toonde aan dat de Cmax- en AUC-waarden van het oorspronkelijke geneesmiddel vergelijkbaar waren in de 2 groepen, terwijl de metabolieten van hydroxybupropion en threohydrobupropion respectievelijk een 2,3- en 2,8-voudige toename vertoonden. in AUC voor proefpersonen met nierfalen in het eindstadium. Een tweede onderzoek, waarin normale proefpersonen werden vergeleken met proefpersonen met matige tot ernstige nierinsufficiëntie (GFR 30,9 ± 10,8 ml/min) toonde aan dat na een enkelvoudige dosis van 150 mg bupropion met aanhoudende afgifte de blootstelling aan bupropion ongeveer 2 maal hoger was bij proefpersonen met een verminderde nierfunctie, terwijl de niveaus van de hydroxybupropion en threo/erythrohydrobupropion (gecombineerde) metabolieten vergelijkbaar waren in de 2 groepen. Bupropion wordt uitgebreid in de lever gemetaboliseerd tot actieve metabolieten, die verder worden gemetaboliseerd en vervolgens door de nieren worden uitgescheiden. De eliminatie van de belangrijkste metabolieten van bupropion kan worden verminderd door een verminderde nierfunctie. WELLBUTRIN moet met voorzichtigheid worden gebruikt bij patiënten met nierinsufficiëntie en een verminderde frequentie en/of dosis moet worden overwogen [zie Gebruik bij specifieke populaties ].
Patiënten met leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van bupropion werd gekarakteriseerd in 2 onderzoeken met enkelvoudige doses, één bij proefpersonen met alcoholische leverziekte en één bij proefpersonen met lichte tot ernstige cirrose. De eerste studie toonde aan dat de halfwaardetijd van hydroxybupropion significant langer was bij 8 personen met alcoholische leverziekte dan bij 8 gezonde vrijwilligers (respectievelijk 32 ± 14 uur versus 21 ± 5 uur). Hoewel niet statistisch significant, waren de AUC's voor bupropion en hydroxybupropion meer variabel en neigden ze groter te zijn (met 53% tot 57%) bij vrijwilligers met alcoholische leverziekte. De verschillen in halfwaardetijd voor bupropion en de andere metabolieten in de 2 groepen waren minimaal.
De tweede studie toonde geen statistisch significante verschillen aan in de farmacokinetiek van bupropion en zijn actieve metabolieten bij 9 proefpersonen met milde tot matige levercirrose in vergelijking met 8 gezonde vrijwilligers. Er werd echter meer variabiliteit waargenomen in sommige farmacokinetische parameters voor bupropion (AUC, Cmax en Tmax) en zijn actieve metabolieten (t½) bij proefpersonen met lichte tot matige levercirrose. Bij proefpersonen met ernstige levercirrose werden significante veranderingen in de farmacokinetiek van bupropion en zijn metabolieten gezien (tabel 3).
Patiënten met linkerventrikeldisfunctie
Tijdens een chronisch doseringsonderzoek met bupropion bij 14 depressieve proefpersonen met linkerventrikeldisfunctie (geschiedenis van CHF of een vergroot hart op röntgenfoto's), was er geen duidelijk effect op de farmacokinetiek van bupropion of zijn metabolieten, vergeleken met gezonde vrijwilligers.
Leeftijd
De effecten van leeftijd op de farmacokinetiek van bupropion en zijn metabolieten zijn niet volledig gekarakteriseerd, maar een verkenning van steady-state bupropionconcentraties uit verschillende depressie-effectiviteitsonderzoeken met proefpersonen die werden gedoseerd in een bereik van 300 tot 750 mg/dag, op een 3- tijdschema, liet geen verband zien tussen leeftijd (18 tot 83 jaar) en plasmaconcentratie van bupropion. Een farmacokinetisch onderzoek met een enkelvoudige dosis toonde aan dat de dispositie van bupropion en zijn metabolieten bij oudere proefpersonen vergelijkbaar was met die van jongere proefpersonen. Deze gegevens suggereren dat er geen prominent effect van leeftijd op de bupropionconcentratie is; een ander farmacokinetisch onderzoek met enkelvoudige en meervoudige doses suggereerde echter dat ouderen een verhoogd risico lopen op accumulatie van bupropion en zijn metabolieten [zie Gebruik bij specifieke populaties ].
Mannelijke en vrouwelijke patiënten
Gepoolde analyse van de farmacokinetische gegevens van bupropion van 90 gezonde mannelijke en 90 gezonde vrouwelijke vrijwilligers bracht geen seksegerelateerde verschillen in de piekplasmaconcentraties van bupropion aan het licht. De gemiddelde systemische blootstelling (AUC) was ongeveer 13% hoger bij mannelijke vrijwilligers dan bij vrouwelijke vrijwilligers. De klinische betekenis van deze bevinding is niet bekend.
Rokers
De effecten van het roken van sigaretten op de farmacokinetiek van bupropion werden bestudeerd bij 34 gezonde mannelijke en vrouwelijke vrijwilligers; 17 waren chronische sigarettenrokers en 17 waren niet-rokers. Na orale toediening van een enkelvoudige dosis van 150 mg bupropion waren er geen statistisch significante verschillen in Cmax, halfwaardetijd, Tmax, AUC of klaring van bupropion of zijn actieve metabolieten tussen rokers en niet-rokers.
Geneesmiddelinteractiestudies
Potentieel voor andere geneesmiddelen om WELLBUTRIN te beïnvloeden
In vitro-onderzoeken geven aan dat bupropion voornamelijk wordt gemetaboliseerd tot hydroxybupropion door CYP2B6. Daarom bestaat de mogelijkheid van geneesmiddelinteracties tussen WELLBUTRIN en geneesmiddelen die remmers of inductoren zijn van CYP2B6. Bovendien suggereren in vitro-onderzoeken dat paroxetine, sertraline, norfluoxetine, fluvoxamine en nelfinavir de hydroxylering van bupropion remmen.
Remmers van CYP2B6
Ticlopidine, Clopidogrel: In een onderzoek bij gezonde mannelijke vrijwilligers verhoogde clopidogrel 75 mg eenmaal daags of ticlopidine 250 mg tweemaal daags de blootstelling (Cmax en AUC) aan bupropion met 40% en 60% voor clopidogrel en met 38% en 85% voor ticlopidine , respectievelijk. De blootstellingen (Cmax en AUC) aan hydroxybupropion werden respectievelijk met 50% en 52% verlaagd door clopidogrel en respectievelijk 78% en 84% door ticlopidine. Aangenomen wordt dat dit effect het gevolg is van de remming van de door CYP2B6 gekatalyseerde hydroxylering van bupropion.
Prasugrel: Prasugrel is een zwakke remmer van CYP2B6. Bij gezonde proefpersonen verhoogde prasugrel de Cmax- en AUC-waarden van bupropion met respectievelijk 14% en 18%, en verlaagde het de Cmax- en AUC-waarden van hydroxybupropion, een actieve metaboliet van bupropion, met respectievelijk 32% en 24%.
Cimetidine: De threohydrobupropion-metaboliet van bupropion lijkt niet te worden geproduceerd door cytochroom P450-enzymen. De effecten van gelijktijdige toediening van cimetidine op de farmacokinetiek van bupropion en zijn actieve metabolieten werden bestudeerd bij 24 gezonde jonge mannelijke vrijwilligers. Na orale toediening van bupropion 300 mg met en zonder cimetidine 800 mg, werd de farmacokinetiek van bupropion en hydroxybupropion niet beïnvloed. Er waren echter 16% en 32% stijgingen in de AUC en Cmax, respectievelijk van de gecombineerde delen van threohydrobupropion en erythrohydrobupropion.
Citalopram: Citalopram had geen invloed op de farmacokinetiek van bupropion en zijn drie metabolieten.
Inductoren van CYP2B6
Ritonavir en lopinavir: in een onderzoek met gezonde vrijwilligers verminderde ritonavir 100 mg tweemaal daags de AUC en Cmax van bupropion met respectievelijk 22% en 21%. De blootstelling aan de hydroxybupropionmetaboliet was verminderd met 23%, het threohydrobupropion nam af met 38% en het erythrohydrobupropion nam af met 48%.
In een tweede onderzoek met gezonde vrijwilligers verminderde ritonavir in een dosis van 600 mg tweemaal daags de AUC en de Cmax van bupropion met respectievelijk 66% en 62%. De blootstelling aan de hydroxybupropionmetaboliet was met 78% verlaagd, het threohydrobupropion met 50% en het erythrohydrobupropion met 68%.
In een ander onderzoek met gezonde vrijwilligers verlaagde lopinavir 400 mg/ritonavir 100 mg tweemaal daags de AUC en Cmax van bupropion met 57%. De AUC en Cmax van hydroxybupropion waren respectievelijk met 50% en 31% verlaagd.
Efavirenz: In een onderzoek bij gezonde vrijwilligers verminderde efavirenz 600 mg eenmaal daags gedurende 2 weken de AUC en Cmax van bupropion met respectievelijk ongeveer 55% en 34%. De AUC van hydroxybupropion was onveranderd, terwijl de Cmax van hydroxybupropion met 50% was verhoogd.
Carbamazepine, fenobarbital, fenytoïne: hoewel niet systematisch onderzocht, kunnen deze geneesmiddelen het metabolisme van bupropion induceren.
Potentieel voor WELLBUTRIN om andere geneesmiddelen te beïnvloeden
Diergegevens wezen erop dat bupropion een inductor kan zijn van geneesmiddelmetaboliserende enzymen bij mensen. In één onderzoek, na chronische toediening van bupropion 100 mg driemaal daags aan 8 gezonde mannelijke vrijwilligers gedurende 14 dagen, was er geen bewijs van inductie van zijn eigen metabolisme. Desalniettemin kunnen klinisch belangrijke veranderingen optreden in de bloedspiegels van gelijktijdig toegediende geneesmiddelen.
Geneesmiddelen gemetaboliseerd door CYP2D6
In vitro zijn bupropion en zijn metabolieten (erythrohydrobupropion, threohydrobupropion, hydroxybupropion) CYP2D6-remmers. In een klinische studie met 15 mannelijke proefpersonen (leeftijd 19 tot 35 jaar) die snelle metaboliseerders van CYP2D6 waren, verhoogde bupropion 300 mg/dag gevolgd door een enkelvoudige dosis van 50 mg desipramine de Cmax, AUC en t½ van desipramine met een gemiddelde van respectievelijk ongeveer 2-, 5- en 2-voudig. Het effect was aanwezig gedurende ten minste 7 dagen na de laatste dosis bupropion. Gelijktijdig gebruik van bupropion met andere geneesmiddelen die door CYP2D6 worden gemetaboliseerd, is niet formeel onderzocht.
Citalopram: Hoewel citalopram niet primair wordt gemetaboliseerd door CYP2D6, verhoogde bupropion in één onderzoek de Cmax en AUC van citalopram met respectievelijk 30% en 40%.
Lamotrigine: Meerdere orale doses bupropion hadden geen statistisch significant effect op de farmacokinetiek van een enkele dosis lamotrigine bij 12 gezonde vrijwilligers.
Digoxine: Uit literatuurgegevens bleek dat de blootstelling aan digoxine werd verlaagd wanneer een enkelvoudige orale dosis van 0,5 mg digoxine werd toegediend 24 uur na een enkelvoudige orale dosis van 150 mg bupropion met verlengde afgifte bij gezonde vrijwilligers.
Klinische studies
De werkzaamheid van WELLBUTRIN 150 mg bij de behandeling van depressieve stoornis werd vastgesteld in twee placebogecontroleerde onderzoeken van 4 weken bij volwassen opgenomen patiënten met MDD (onderzoeken 1 en 2 in tabel 4) en in een placebogecontroleerd onderzoek van 6 weken bij volwassen poliklinische patiënten met MDD (proef 3 in tabel 4). In het eerste onderzoek was het doseringsbereik van WELLBUTRIN 300 mg 300 mg tot 600 mg/dag, verdeeld over 3 doses; 78% van de proefpersonen werd behandeld met doses van 300 mg tot 450 mg/dag. De studie toonde de werkzaamheid van WELLBUTRIN 300 mg aan zoals gemeten door de Hamilton Depression Rating Scale (HDRS) totale score, het HDRS depressieve stemmingsitem (item 1) en de Clinical Global Impressions-severity score (CGI-S). De tweede studie omvatte 2 doses WELLBUTRIN (300 en 450 mg/dag) en placebo. Dit onderzoek toonde de effectiviteit van WELLBUTRIN 150 mg aan voor alleen de dosis van 450 mg/dag. De werkzaamheidsresultaten waren statistisch significant voor de HDRS-totaalscore en de CGI-S-score, maar niet voor HDRS-item 1. In de derde studie werden poliklinische patiënten behandeld met 300 mg WELLBUTRIN per dag. Deze studie toonde de werkzaamheid van WELLBUTRIN 150 mg aan, gemeten aan de hand van de HDRS-totaalscore, de HDRS-item 1, de Montgomery-Asberg Depression Rating Scale (MADRS), de CGI-S-score en de CGI-Improvement Scale (CGI-I)-score . De effectiviteit van WELLBUTRIN 300 mg bij langdurig gebruik, dat wil zeggen gedurende meer dan 6 weken, is niet systematisch geëvalueerd in gecontroleerde onderzoeken.
PATIËNT INFORMATIE
WELLBUTRIN (GOED byu-trine) (bupropionhydrochloride) Tabletten
BELANGRIJK: Zorg ervoor dat u de drie secties van deze medicatiehandleiding leest. Het eerste deel gaat over het risico op zelfmoordgedachten en -acties met antidepressiva; het tweede deel gaat over het risico op veranderingen in denken en gedrag, depressie en zelfmoordgedachten of -acties met medicijnen die worden gebruikt om te stoppen met roken; en het derde deel is getiteld "Welke andere belangrijke informatie moet ik weten over WELLBUTRIN 150 mg?"
Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties
Dit gedeelte van de medicatiehandleiding gaat alleen over het risico op zelfmoordgedachten en -acties met antidepressiva.
Wat is de belangrijkste informatie die ik moet weten over antidepressiva, depressie en andere ernstige psychische aandoeningen, en zelfmoordgedachten of -acties?
1. Antidepressiva kunnen bij sommige kinderen, tieners of jonge volwassenen het risico op zelfmoordgedachten of -acties binnen de eerste paar maanden van de behandeling verhogen.
2. Depressie of andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van suïcidale gedachten en handelingen. Sommige mensen lopen een bijzonder hoog risico op zelfmoordgedachten of -acties. Deze omvatten mensen met (of een familiegeschiedenis van) een bipolaire stoornis (ook wel manisch-depressieve stoornis genoemd) of zelfmoordgedachten of zelfmoordacties.
3. Hoe kan ik zelfmoordgedachten en -acties bij mezelf of een familielid voorkomen en proberen te voorkomen?
- Besteed veel aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel onmiddellijk uw zorgverlener om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken met uw zorgverlener zoals gepland. Bel indien nodig de zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk uw zorgverlener als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich erg geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met een zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken en ook de risico's van het niet behandelen ervan. Patiënten en hun families of andere zorgverleners moeten alle behandelkeuzes met de zorgverlener bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met de zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan de zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
Het is niet bekend of WELLBUTRIN veilig en effectief is bij kinderen onder de 18 jaar.
Stoppen met roken, stoppen met roken medicijnen, veranderingen in denken en gedrag, depressie en zelfmoordgedachten of -acties
Dit gedeelte van de Medicatiegids gaat alleen over het risico op veranderingen in denken en gedrag, depressie en zelfmoordgedachten of -acties met drugs die worden gebruikt om te stoppen met roken. Hoewel WELLBUTRIN geen behandeling is om te stoppen met roken, bevat het dezelfde werkzame stof (bupropionhydrochloride) als ZYBAN, dat wordt gebruikt om patiënten te helpen stoppen met roken.
Praat met uw zorgverlener of de zorgverlener van uw gezinslid over:
- alle risico's en voordelen van stoppen met roken medicijnen.
- alle behandelkeuzes voor het stoppen met roken.
Wanneer u probeert te stoppen met roken, met of zonder bupropion, kunt u symptomen krijgen die het gevolg kunnen zijn van nicotineontwenning, waaronder:
- drang om te roken
- frustratie
- rusteloosheid
- depressieve bui
- woede
- verlaagde hartslag
- Moeite met slapen
- angstig voelen
- verhoogde eetlust
- prikkelbaarheid
- moeite met concentreren
- gewichtstoename
Sommige mensen hebben zelfs zelfmoordgedachten gehad wanneer ze probeerden te stoppen met roken zonder medicatie.
Soms kan stoppen met roken leiden tot verergering van psychische problemen die u al heeft, zoals depressie.
Sommige mensen hebben ernstige bijwerkingen gehad tijdens het gebruik van bupropion om hen te helpen stoppen met roken, waaronder: Nieuwe of ergere psychische problemen, zoals veranderingen in gedrag of denken, agressie, vijandigheid, agitatie, depressie of zelfmoordgedachten of -acties. Sommige mensen hadden deze symptomen toen ze begonnen met het gebruik van bupropion, en anderen ontwikkelden ze na enkele weken behandeling of na het stoppen met bupropion. Deze symptomen kwamen vaker voor bij mensen met een voorgeschiedenis van psychische problemen voordat ze bupropion gebruikten dan bij mensen zonder een voorgeschiedenis van psychische problemen.
Stop met het innemen van WELLBUTRIN en bel onmiddellijk uw zorgverlener als u, uw familie of verzorger een van deze symptomen opmerkt. Werk samen met uw zorgverlener om te beslissen of u WELLBUTRIN moet blijven gebruiken. Bij veel mensen verdwenen deze symptomen na het stoppen met WELLBUTRIN 300 mg, maar bij sommige mensen hielden de symptomen aan na het stoppen met WELLBUTRIN. Het is belangrijk dat u contact opneemt met uw zorgverlener totdat uw symptomen verdwijnen. Vertel uw zorgverlener voordat u WELLBUTRIN 150 mg inneemt als u ooit een depressie of andere psychische problemen heeft gehad. U moet uw zorgverlener ook vertellen over eventuele symptomen die u had tijdens andere keren dat u probeerde te stoppen met roken, met of zonder bupropion.
Welke andere belangrijke informatie moet ik weten over WELLBUTRIN?
- Toevallen: Er is een kans op een aanval (convulsie, toevallen) met WELLBUTRIN 150 mg, vooral bij mensen:
- met bepaalde medische problemen.
- die bepaalde medicijnen gebruiken. De kans op epileptische aanvallen neemt toe met hogere doses WELLBUTRIN. Voor meer informatie, zie de rubrieken “Wie mag WELLBUTRIN niet gebruiken?” en "Wat moet ik mijn zorgverlener vertellen voordat ik WELLBUTRIN 300 mg inneem?" Vertel uw zorgverlener over al uw medische aandoeningen en alle medicijnen die u gebruikt. Gebruik geen andere geneesmiddelen terwijl u WELLBUTRIN 150 mg gebruikt, tenzij uw zorgverlener heeft gezegd dat u ze mag gebruiken. Als u een aanval krijgt terwijl u WELLBUTRIN gebruikt, stop dan met het innemen van de tabletten en bel onmiddellijk uw zorgverlener. Gebruik WELLBUTRIN 150 mg niet opnieuw als u een aanval krijgt.
- Hoge bloeddruk (hypertensie). Sommige mensen krijgen hoge bloeddruk die ernstig kan zijn als ze WELLBUTRIN gebruiken. De kans op hoge bloeddruk kan groter zijn als u ook nicotinevervangende therapie (zoals een nicotinepleister) gebruikt om u te helpen stoppen met roken (zie het gedeelte van deze medicatiehandleiding genaamd "Hoe moet ik WELLBUTRIN 150 mg innemen?").
- Manische afleveringen. Sommige mensen kunnen perioden van manie hebben tijdens het gebruik van WELLBUTRIN 300 mg, waaronder:
- Sterk verhoogde energie
- Ernstige slaapproblemen
- Race gedachten
- Roekeloos gedrag
- Ongewoon grootse ideeën
- Overmatig geluk of prikkelbaarheid
- Meer of sneller praten dan normaal Als u een van de bovenstaande symptomen van manie heeft, neem dan contact op met uw zorgverlener.
- Ongewone gedachten of gedrag. Sommige patiënten hebben ongewone gedachten of gedrag tijdens het gebruik van WELLBUTRIN, waaronder waanideeën (denk dat u iemand anders bent), hallucinaties (dingen zien of horen die er niet zijn), paranoia (het gevoel hebben dat mensen tegen u zijn) of zich verward voelen. Als dit bij u gebeurt, neem dan contact op met uw zorgverlener.
- Visuele problemen.
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
- Ernstige allergische reacties. Sommige mensen kunnen ernstige allergische reacties krijgen op WELLBUTRIN. Stop met het innemen van WELLBUTRIN 300 mg en bel onmiddellijk uw zorgverlener als u huiduitslag, jeuk, netelroos, koorts, gezwollen lymfeklieren, pijnlijke zweren in de mond of rond de ogen, zwelling van de lippen of tong, pijn op de borst of moeite met ademhalen krijgt. Dit kunnen tekenen zijn van een ernstige allergische reactie.
Wat is WELLBUTRIN?
WELLBUTRIN is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van volwassenen met een bepaald type depressie, de zogenaamde depressieve stoornis.
Wie mag WELLBUTRIN 150 mg niet gebruiken?
Gebruik WELLBUTRIN niet als u:
- een epileptische aandoening of epilepsie heeft of heeft gehad.
- een eetstoornis zoals anorexia nervosa of boulimia heeft of heeft gehad.
- andere geneesmiddelen gebruikt die bupropion bevatten, waaronder ZYBAN (gebruikt om mensen te helpen stoppen met roken), WELLBUTRIN 300 mg SR, WELLBUTRIN 150 mg XL, APLENZIN of FORFIVO XL. Bupropion is hetzelfde actieve ingrediënt dat in WELLBUTRIN zit.
- veel alcohol drinkt en abrupt stopt met drinken, of medicijnen gebruikt die sedativa worden genoemd (deze maken u slaperig), benzodiazepinen of anti-epileptica, en u stopt met het gebruik ervan ineens.
- neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, inclusief het antibioticum linezolid.
- neem geen MAO-remmer binnen 2 weken na het stoppen met WELLBUTRIN, tenzij uw zorgverlener u heeft gevraagd dit te doen.
- start WELLBUTRIN 150 mg niet als u in de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw zorgverlener u heeft gevraagd dit te doen.
- zijn allergisch voor het actieve ingrediënt in WELLBUTRIN 300 mg, bupropion of voor een van de inactieve ingrediënten. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in WELLBUTRIN.
Wat moet ik mijn zorgverlener vertellen voordat ik WELLBUTRIN inneem?
Vertel het uw zorgverlener als u ooit een depressie, zelfmoordgedachten of -acties of andere psychische problemen heeft gehad. Zie "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties."
- Vertel uw zorgverlener over uw andere medische aandoeningen, ook als u:
- leverproblemen heeft, met name cirrose van de lever.
- nierproblemen hebben.
- een eetstoornis heeft of heeft gehad, zoals anorexia nervosa of boulimia.
- hoofdletsel hebben gehad.
- een epileptische aanval heeft gehad (convulsies, toevallen).
- een tumor in uw zenuwstelsel (hersenen of ruggengraat) heeft.
- een hartaanval, hartproblemen of hoge bloeddruk heeft gehad.
- diabetespatiënt bent die insuline of andere geneesmiddelen gebruikt om uw bloedsuikerspiegel onder controle te houden.
- alcohol drinken.
- misbruik van voorgeschreven medicijnen of straatdrugs.
- zwanger bent of van plan bent zwanger te worden. Praat met uw zorgverlener over het risico voor uw ongeboren baby als u WELLBUTRIN 300 mg gebruikt tijdens de zwangerschap.
- Vertel het uw zorgverlener als u zwanger wordt of denkt zwanger te zijn tijdens de behandeling met WELLBUTRIN.
- Als u zwanger wordt tijdens de behandeling met WELLBUTRIN, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Antidepressiva. U kunt zich aanmelden door te bellen naar 1-844-405-6185.
- borstvoeding geeft of van plan bent borstvoeding te geven tijdens de behandeling met WELLBUTRIN. WELLBUTRIN gaat over in uw melk. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens de behandeling met WELLBUTRIN.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept, vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Veel geneesmiddelen vergroten uw kans op epileptische aanvallen of andere ernstige bijwerkingen als u ze gebruikt terwijl u WELLBUTRIN gebruikt.
Hoe moet ik WELLBUTRIN 300 mg innemen?
- Neem WELLBUTRIN 300 mg precies zoals voorgeschreven door uw zorgverlener. Verander uw dosis niet en stop niet met het innemen van WELLBUTRIN zonder eerst met uw zorgverlener te overleggen.
- Slik WELLBUTRIN tabletten heel door. WELLBUTRIN 300 mg tabletten niet kauwen, snijden of pletten.
- Neem WELLBUTRIN 300 mg elke dag op hetzelfde tijdstip in.
- Neem uw doses WELLBUTRIN 300 mg met een tussenpoos van ten minste 6 uur.
- U kunt WELLBUTRIN met of zonder voedsel innemen.
- Als u een dosis bent vergeten, neem dan geen extra dosis om de vergeten dosis in te halen. Wacht en neem uw volgende dosis op het normale tijdstip. Dit is erg belangrijk. Te veel WELLBUTRIN kan uw kans op een aanval vergroten.
- Als u te veel WELLBUTRIN of een overdosis heeft ingenomen, bel dan onmiddellijk uw plaatselijke spoedeisende hulp of antigifcentrum.
- Gebruik geen andere geneesmiddelen terwijl u WELLBUTRIN 300 mg gebruikt, tenzij uw arts u heeft verteld dat het in orde is.
- Als u WELLBUTRIN 150 mg gebruikt voor de behandeling van depressieve stoornis, kan het enkele weken duren voordat u voelt dat WELLBUTRIN 150 mg werkt. Als u zich eenmaal beter voelt, is het belangrijk om WELLBUTRIN precies te blijven gebruiken zoals voorgeschreven door uw zorgverlener. Bel uw zorgverlener als u denkt dat WELLBUTRIN niet voor u werkt.
Wat moet ik vermijden tijdens het gebruik van WELLBUTRIN 300 mg?
- Beperk of vermijd het gebruik van alcohol tijdens de behandeling met WELLBUTRIN. Als u gewoonlijk veel alcohol drinkt, overleg dan met uw zorgverlener voordat u plotseling stopt. Als u plotseling stopt met het drinken van alcohol, kunt u het risico op epileptische aanvallen vergroten.
- Bestuur geen auto en gebruik geen zware machines totdat u weet welke invloed WELLBUTRIN 150 mg op u heeft. WELLBUTRIN kan van invloed zijn op uw vermogen om deze dingen veilig te doen.
Wat zijn mogelijke bijwerkingen van WELLBUTRIN 300 mg?
WELLBUTRIN kan ernstige bijwerkingen veroorzaken. Zie de rubrieken aan het begin van deze medicatiehandleiding voor informatie over ernstige bijwerkingen van WELLBUTRIN.
De meest voorkomende bijwerkingen van WELLBUTRIN zijn:
- nervositeit
- zwaar zweten
- droge mond
- beverigheid (tremor)
- constipatie
- Moeite met slapen
- hoofdpijn
- wazig zien
- misselijkheid of braken
- snelle hartslag
- duizeligheid
Als u misselijk bent, neem uw geneesmiddel dan in met voedsel. Als u moeite heeft met slapen, neem uw geneesmiddel dan niet te kort voor het slapengaan in.
Vertel uw zorgverlener meteen over eventuele bijwerkingen die u storen.
Dit zijn niet alle mogelijke bijwerkingen van WELLBUTRIN. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw zorgverlener voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
U kunt bijwerkingen ook melden aan GlaxoSmithKline op 1-888-825-5249.
Hoe moet ik WELLBUTRIN 300 mg bewaren?
- Bewaar WELLBUTRIN bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
- Bewaar WELLBUTRIN-tabletten droog en uit het licht.
Houd WELLBUTRIN en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van WELLBUTRIN.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik WELLBUTRIN 300 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef WELLBUTRIN niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Als u een urinetest voor drugsonderzoek doet, kan WELLBUTRIN het testresultaat positief maken voor amfetaminen. Als u de persoon die u de screeningstest voor geneesmiddelen geeft vertelt dat u WELLBUTRIN 300 mg gebruikt, kan hij of zij een specifiekere screeningstest voor geneesmiddelen doen die dit probleem niet zou moeten hebben.
Deze medicatiehandleiding vat belangrijke informatie over WELLBUTRIN samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over WELLBUTRIN die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Bel voor meer informatie over WELLBUTRIN 1-888-825-5249.
Wat zijn de ingrediënten in WELLBUTRIN 300 mg?
Actief bestanddeel: bupropionhydrochloride.
Inactieve ingrediënten: tablet van 75 mg - D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, microkristallijne cellulose, polyethyleenglycol, talk en titaniumdioxide; Tablet van 100 mg - FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, microkristallijne cellulose, polyethyleenglycol, talk en titaniumdioxide.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
