Geodon 40mg, 80mg, 20mg Ziprasidone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Geodon en hoe wordt het gebruikt?
Geodon is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van schizofrenie, acute agitatie met schizofrenie en bipolaire I-stoornis. Geodon kan alleen of met andere medicijnen worden gebruikt.
Geodon 20 mg behoort tot een klasse medicijnen die antipsychotica worden genoemd.
Het is niet bekend of Geodon veilig en effectief is bij kinderen.
Wat zijn mogelijke bijwerkingen van Geodon?
Geodon 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- snelle of bonzende hartslagen,
- fladderend in je borst,
- kortademigheid,
- plotselinge duizeligheid,
- ongecontroleerde spierbewegingen in uw gezicht (kauwen, smakken op de lippen, fronsen, tongbewegingen, knipperen of oogbewegingen),
- eventuele huiduitslag,
- koorts,
- zweertjes in de mond,
- huidzweren,
- keelpijn,
- hoesten,
- moeite met ademhalen,
- verhoogde dorst,
- meer plassen
- droge mond,
- fruitige ademgeur,
- zeer stijve spieren,
- hoge koorts,
- zweten,
- agitatie, en
- verwardheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Geodon 40 mg zijn:
- duizeligheid,
- slaperigheid,
- zwakheid,
- misselijkheid,
- braken,
- moeite met slikken,
- rusteloos voelen,
- trillingen,
- zichtproblemen,
- loopneus, en
- nieuwe of verergerende hoest
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prometrium. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
VERHOOGDE STERFTE BIJ OUDEREN PATINTEN MET DEMENTIEGERELATEERDE PSYCHOSE
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. GEODON is niet goedgekeurd voor de behandeling van aan dementie gerelateerde psychose (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
GEODON 40 mg is verkrijgbaar als capsules (ziprasidonhydrochloride) voor orale toediening en als injectie (ziprasidonmesylaat) alleen voor intramusculair gebruik. Ziprasidon is een psychotroop middel dat chemisch niet verwant is aan fenothiazine- of butyrofenon-antipsychotica. Het heeft een molecuulgewicht van 412,94 (vrije base), met de volgende chemische naam: 5-[2-[4-(1,2-benzisothiazool-3-yl)-1-piperazinyl]ethyl]-6-chloor-1 ,3-dihydro-2H-indol-2-on. De empirische formule van C21H21ClN4OS (vrije base van ziprasidon) vertegenwoordigt de volgende structuurformule:
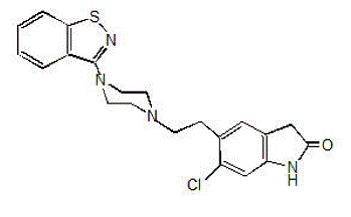
GEODON-capsules bevatten een monohydrochloride, monohydraatzout van ziprasidon. Chemisch gezien is ziprasidonhydrochloride-monohydraat 5-[2-[4-(1,2-benzisothiazool-3-yl)-1-piperazinyl]ethyl]-6-chloor-1,3-dihydro-2H-indol-2-on , monohydrochloride, monohydraat. De empirische formule is C21H21ClN4OS• HCl• H2O en het molecuulgewicht is 467,42. Ziprasidonhydrochloride-monohydraat is een wit tot lichtroze poeder.
GEODON 20 mg capsules worden geleverd voor orale toediening in capsules van 20 mg (blauw/wit), 40 mg (blauw/blauw), 60 mg (wit/wit) en 80 mg (blauw/wit). GEODON 40 mg capsules bevatten ziprasidonhydrochloride-monohydraat, lactose, gepregelatiniseerd zetmeel en magnesiumstearaat.
GEODON voor injectie bevat een gevriesdroogde vorm van ziprasidonmesylaattrihydraat. Chemisch gezien is ziprasidonmesylaattrihydraat 5-[2-[4-(1,2-benzisothiazool-3-yl)-1-piperazinyl]ethyl]-6-chloor-1,3-dihydro-2H-indol-2-on , methaansulfonaat, trihydraat. De empirische formule is C21H21ClN4OS • CH3SO3H • 3H2O en het molecuulgewicht is 563,09.
GEODON 40 mg voor injectie is verkrijgbaar in een injectieflacon met een enkelvoudige dosis als ziprasidonmesylaat (20 mg ziprasidon/ml indien gereconstitueerd volgens de instructies op het etiket) [zie DOSERING EN ADMINISTRATIE ]. Elke ml ziprasidonmesylaat voor injectie (na reconstitutie) bevat 20 mg ziprasidon en 4,7 mg methaansulfonzuur opgelost in 294 mg sulfobutylether-β-cyclodextrine-natrium (SBECD).
INDICATIES
GEODON is geïndiceerd voor de behandeling van schizofrenie, als monotherapie voor de acute behandeling van bipolaire manische of gemengde episodes, en als aanvulling op lithium of valproaat voor de onderhoudsbehandeling van bipolaire stoornis. GEODON intramusculair is geïndiceerd voor acute agitatie bij schizofrene patiënten. Bij het kiezen van de alternatieve behandelingen die beschikbaar zijn voor de aandoening die behandeling nodig heeft, moet de voorschrijver rekening houden met de bevinding van het grotere vermogen van ziprasidon om het QT/QTc-interval te verlengen in vergelijking met verschillende andere antipsychotica [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verlenging van het QTc-interval wordt bij sommige andere geneesmiddelen in verband gebracht met het vermogen om torsade de pointes-achtige aritmie, een mogelijk fatale polymorfe ventriculaire tachycardie en plotselinge dood te veroorzaken. In veel gevallen zou dit leiden tot de conclusie dat eerst andere medicijnen moeten worden geprobeerd. Of ziprasidon torsade de pointes zal veroorzaken of de snelheid van plotselinge dood zal verhogen, is nog niet bekend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Schizofrenie
- GEODON is geïndiceerd voor de behandeling van schizofrenie bij volwassenen [zie: Klinische studies ].
Bipolaire I-stoornis (acute gemengde of manische episodes en onderhoudsbehandeling als aanvulling op lithium of valproaat)
- GEODON is geïndiceerd als monotherapie voor de acute behandeling van volwassenen met manische of gemengde episodes geassocieerd met bipolaire I-stoornis [zie Klinische studies ].
- GEODON 40 mg is geïndiceerd als aanvulling op lithium of valproaat voor de onderhoudsbehandeling van bipolaire I-stoornis bij volwassenen [zie Klinische studies ].
Acute behandeling van agitatie bij schizofrenie
- GEODON 40 mg intramusculair is geïndiceerd voor de behandeling van acute agitatie bij schizofrene volwassen patiënten voor wie behandeling met ziprasidon geschikt is en die intramusculaire antipsychotica nodig hebben voor snelle controle van agitatie [zie Klinische studies ].
Aangezien er geen ervaring is met de veiligheid van intramusculaire toediening van ziprasidon aan schizofrene patiënten die al oraal ziprasidon gebruiken, wordt gelijktijdige toediening niet aanbevolen.
DOSERING EN ADMINISTRATIE
Schizofrenie
Dosisselectie
GEODON 40 mg capsules dienen te worden toegediend in een initiële dagelijkse dosis van 20 mg tweemaal daags met voedsel. Bij sommige patiënten kan de dagelijkse dosering vervolgens worden aangepast op basis van de individuele klinische status tot tweemaal daags 80 mg. Doseringsaanpassingen, indien geïndiceerd, dienen over het algemeen met tussenpozen van niet minder dan 2 dagen te gebeuren, aangezien steady-state binnen 1 tot 3 dagen wordt bereikt. Om ervoor te zorgen dat de laagste effectieve dosis wordt gebruikt, moeten patiënten gewoonlijk gedurende enkele weken op verbetering worden geobserveerd voordat de dosis wordt verhoogd.
De werkzaamheid bij schizofrenie werd aangetoond in een doseringsbereik van tweemaal daags 20 mg tot 100 mg in kortdurende, placebogecontroleerde klinische onderzoeken. Er waren trends in de richting van een dosisrespons binnen het bereik van 20 mg tot 80 mg tweemaal daags, maar de resultaten waren niet consistent. Een verhoging tot een dosis van meer dan 80 mg tweemaal daags wordt over het algemeen niet aanbevolen. De veiligheid van doses hoger dan 100 mg tweemaal daags is niet systematisch geëvalueerd in klinische onderzoeken [zie: Klinische studies ].
Onderhoudsbehandeling
Hoewel er geen bewijsmateriaal beschikbaar is om de vraag te beantwoorden hoe lang een patiënt die met ziprasidon wordt behandeld, dit middel moet blijven gebruiken, toonde een onderhoudsonderzoek bij patiënten die symptomatisch stabiel waren en vervolgens gerandomiseerd om door te gaan met ziprasidon of over te schakelen op placebo een vertraging in de tijd aan. terugval bij patiënten die GEODON krijgen [zie Klinische studies ]. Er werd geen bijkomend voordeel aangetoond voor doses hoger dan 20 mg tweemaal daags. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Bipolaire I-stoornis (acute gemengde of manische episodes en onderhoudsbehandeling als aanvulling op lithium of valproaat)
Acute behandeling van manische of gemengde episodes
Doseringskeuze - Oraal ziprasidon dient te worden toegediend in een initiële dagelijkse dosis van tweemaal daags 40 mg met voedsel. De dosis kan dan worden verhoogd tot 60 mg of 80 mg tweemaal daags op de tweede dag van de behandeling en vervolgens worden aangepast op basis van tolerantie en werkzaamheid binnen het bereik van 40 mg tot 80 mg tweemaal daags. In de klinische onderzoeken met flexibele doses was de gemiddelde dagelijkse dosis ongeveer 120 mg [zie: Klinische studies ].
Onderhoudsbehandeling (als aanvulling op lithium of valproaat)
Zet de behandeling voort met dezelfde dosis waarop de patiënt aanvankelijk gestabiliseerd was, binnen het bereik van 40 mg tot 80 mg tweemaal daags met voedsel. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van onderhoudsbehandeling te bepalen [zie: Klinische studies ].
Acute behandeling van agitatie bij schizofrenie
Intramusculaire dosering
De aanbevolen dosis is 10 mg tot 20 mg, toegediend naar behoefte tot een maximale dosis van 40 mg per dag. Doses van 10 mg kunnen om de twee uur worden toegediend; doses van 20 mg mogen om de vier uur worden toegediend tot een maximum van 40 mg/dag. Intramusculaire toediening van ziprasidon gedurende meer dan drie opeenvolgende dagen is niet onderzocht.
Als langdurige therapie geïndiceerd is, dienen orale capsules met ziprasidonhydrochloride de intramusculaire toediening zo snel mogelijk te vervangen.
Aangezien er geen ervaring is met de veiligheid van intramusculaire toediening van ziprasidon aan schizofrene patiënten die al oraal ziprasidon gebruiken, wordt gelijktijdige toediening niet aanbevolen.
Ziprasidon intramusculair is alleen bedoeld voor intramusculair gebruik en mag niet intraveneus worden toegediend.
Intramusculaire voorbereiding voor toediening
GEODON voor injectie (ziprasidonmesylaat) mag alleen worden toegediend via intramusculaire injectie en mag niet intraveneus worden toegediend. Injectieflacons met een enkelvoudige dosis moeten vóór toediening worden gereconstitueerd.
Voeg 1,2 ml steriel water voor injectie toe aan de injectieflacon en schud krachtig totdat al het geneesmiddel is opgelost. Elke ml gereconstitueerde oplossing bevat 20 mg ziprasidon. Om een dosis van 10 mg toe te dienen, trekt u 0,5 ml van de gereconstitueerde oplossing op. Om een dosis van 20 mg toe te dienen, trekt u 1,0 ml van de gereconstitueerde oplossing op. Elk ongebruikt deel moet worden weggegooid. Aangezien er geen conserveermiddel of bacteriostatisch middel in dit product aanwezig is, moet een aseptische techniek worden gebruikt bij de bereiding van de uiteindelijke oplossing. Dit geneesmiddel mag niet gemengd worden met andere geneesmiddelen of andere oplosmiddelen dan steriel water voor injectie. Parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de container dit toelaten.
HOE GELEVERD
Doseringsvormen en sterke punten
GEODON-capsules worden onderscheiden door capsulekleur/grootte en zijn bedrukt in zwarte inkt met "Pfizer en ZDX [doseringssterkte]" of "Pfizer" en een uniek nummer. GEODON 40 mg capsules worden geleverd voor orale toediening in capsules van 20 mg (blauw/wit), 40 mg (blauw/blauw), 60 mg (wit/wit) en 80 mg (blauw/wit). Ze worden geleverd in de volgende sterktes en pakketconfiguraties:
GEODON voor injectie is verkrijgbaar in een injectieflacon met een enkelvoudige dosis als ziprasidonmesylaat (20 mg ziprasidon/ml indien gereconstitueerd volgens de instructies op het etiket) [zie DOSERING EN ADMINISTRATIE ]. Elke ml ziprasidonmesylaat voor injectie (indien gereconstitueerd) levert een kleurloze tot lichtroze oplossing op die 20 mg ziprasidon en 4,7 mg methaansulfonzuur bevat opgelost door 294 mg sulfobutylether-β-cyclodextrine-natrium (SBECD).
Opslag en behandeling
GEODON-capsules worden onderscheiden door capsulekleur/grootte en zijn bedrukt in zwarte inkt met "Pfizer en ZDX [doseringssterkte]" of met "Pfizer" en een uniek nummer. GEODON 20 mg capsules worden geleverd voor orale toediening in capsules van 20 mg (blauw/wit), 40 mg (blauw/blauw), 60 mg (wit/wit) en 80 mg (blauw/wit). Ze worden geleverd in de volgende sterktes en pakketconfiguraties:
Of
GEODON-capsules moeten worden bewaard bij 25°C (77°F); excursies toegestaan tot 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
GEODON 80 mg voor injectie is verkrijgbaar in een injectieflacon met een enkelvoudige dosis als ziprasidonmesylaat (20 mg ziprasidon/ml indien gereconstitueerd volgens de instructies op het etiket) [zie DOSERING EN ADMINISTRATIE ]. Elke ml ziprasidonmesylaat voor injectie (indien gereconstitueerd) levert een kleurloze tot lichtroze oplossing op die 20 mg ziprasidon en 4,7 mg methaansulfonzuur bevat opgelost door 294 mg sulfobutylether-β-cyclodextrine-natrium (SBECD).
GEODON 40 mg voor injectie moet worden bewaard bij 25 ° C (77 ° F); excursies toegestaan tot 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur in droge vorm. Bescherm tegen licht. Na reconstitutie kan GEODON 40 mg voor injectie worden bewaard, beschermd tegen licht, tot 24 uur bij 15°C tot 30°C (59°F tot 86°F) of tot 7 dagen gekoeld, 2°C tot 8 dagen. °C (36°F tot 46°F).
Gedistribueerd door: Roerig Division of Pfizer Inc, NY, NY 10017. Herzien: okt 2020
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Klinische onderzoeken met oraal ziprasidon omvatten ongeveer 5700 patiënten en/of normale proefpersonen die werden blootgesteld aan een of meer doses ziprasidon. Van deze 5700 waren er meer dan 4800 patiënten die deelnamen aan onderzoeken naar de effectiviteit van meerdere doses, en hun ervaring kwam overeen met ongeveer 1831 patiëntjaren. Deze patiënten omvatten: (1) 4331 patiënten die deelnamen aan onderzoeken met meerdere doses, voornamelijk bij schizofrenie, wat neerkomt op ongeveer 1698 patiëntjaren van blootstelling op 5 februari 2000; en (2) 472 patiënten die deelnamen aan bipolaire manie-onderzoeken die ongeveer 133 patiëntjaren van blootstelling vertegenwoordigen. Nog eens 127 patiënten met een bipolaire stoornis namen deel aan een onderzoek naar langdurige onderhoudsbehandeling, wat overeenkomt met ongeveer 74,7 patiëntjaren van blootstelling aan ziprasidon. De voorwaarden en duur van de behandeling met ziprasidon omvatten open-label en dubbelblinde onderzoeken, klinische en poliklinische onderzoeken en blootstelling op korte en langere termijn.
Klinische onderzoeken naar intramusculair ziprasidon omvatten 570 patiënten en/of normale proefpersonen die een of meer injecties met ziprasidon kregen. Meer dan 325 van deze proefpersonen namen deel aan onderzoeken waarbij meerdere doses werden toegediend.
Bijwerkingen tijdens blootstelling werden verkregen door het verzamelen van vrijwillig gemelde bijwerkingen, evenals resultaten van lichamelijk onderzoek, vitale functies, gewichten, laboratoriumanalyses, ECG's en resultaten van oogheelkundig onderzoek.
De vermelde frequenties van bijwerkingen vertegenwoordigen het aantal personen dat ten minste één keer een tijdens de behandeling optredende bijwerking van het vermelde type heeft ervaren. Een reactie werd als opkomend tijdens de behandeling beschouwd als deze voor het eerst optrad of verergerde tijdens de behandeling na evaluatie van de baseline.
Bijwerkingen waargenomen in kortdurende, placebogecontroleerde onderzoeken met oraal ziprasidon
De volgende bevindingen zijn gebaseerd op de kortdurende placebogecontroleerde premarketingonderzoeken voor schizofrenie (een pool van twee onderzoeken van 6 weken en twee onderzoeken met een vaste dosis van 4 weken) en bipolaire manie (een pool van twee onderzoeken met flexibele doses van 3 weken). studies) waarin ziprasidon werd toegediend in doses variërend van 10 tot 200 mg/dag.
Vaak waargenomen bijwerkingen in kortetermijn-placebo-gecontroleerde onderzoeken
De volgende bijwerkingen waren de bijwerkingen die het vaakst werden waargenomen bij het gebruik van ziprasidon (incidentie van 5% of meer) en die niet met een equivalente incidentie werden waargenomen bij met placebo behandelde patiënten (incidentie van ziprasidon minstens twee keer zo hoog als bij placebo):
Schizofrenie-onderzoeken (zie tabel 11)
- Slaperigheid
- Luchtweginfectie
Bipolaire onderzoeken (zie tabel 12)
- Slaperigheid
- Extrapiramidale symptomen, waaronder de volgende termen voor bijwerkingen: extrapiramidaal syndroom, hypertonie, dystonie, dyskinesie, hypokinesie, tremor, verlamming en spiertrekkingen. Geen van deze bijwerkingen trad individueel op met een incidentie van meer dan 10% in onderzoeken naar bipolaire manie.
- Duizeligheid, waaronder de bijwerkingstermen duizeligheid en licht gevoel in het hoofd.
- Akathisia
- Abnormaal zicht
- Asthenie
- Braken
Schizofrenie
Bijwerkingen die verband houden met stopzetting van de behandeling bij kortdurende, placebo-gecontroleerde onderzoeken met oraal ziprasidon
Ongeveer 4,1% (29/702) van de met ziprasidon behandelde patiënten in kortdurende, placebogecontroleerde onderzoeken stopte met de behandeling vanwege een bijwerking, vergeleken met ongeveer 2,2% (6/273) op placebo. De meest voorkomende reactie geassocieerd met drop-out was huiduitslag, waaronder 7 drop-outs voor uitslag bij ziprasidonpatiënten (1%) vergeleken met geen placebopatiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bijwerkingen die optreden bij een incidentie van 2% of meer bij met ziprasidon behandelde patiënten in kortdurende, orale, placebo-gecontroleerde onderzoeken
Tabel 11 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die optraden tijdens acute therapie (tot 6 weken) bij voornamelijk patiënten met schizofrenie, inclusief alleen die reacties die optraden bij 2% of meer van de patiënten behandeld met ziprasidon en waarvoor de incidentie bij patiënten behandeld met ziprasidon hoger was dan de incidentie bij met placebo behandelde patiënten.
Dosisafhankelijkheid van bijwerkingen in kortdurende, vaste dosis, placebo-gecontroleerde onderzoeken
Een analyse voor dosisrespons in de schizofrenie 4-onderzoekenpool onthulde een duidelijke relatie tussen bijwerking en dosis voor de volgende reacties: asthenie, orthostatische hypotensie, anorexie, droge mond, verhoogde speekselvloed, artralgie, angst, duizeligheid, dystonie, hypertonie, slaperigheid , tremor, rhinitis, huiduitslag en abnormaal zicht.
Extrapiramidale symptomen (EPS)
De incidentie van gerapporteerde EPS (waaronder de bijwerkingentermen extrapiramidaal syndroom, hypertonie, dystonie, dyskinesie, hypokinesie, tremor, verlamming en spiertrekkingen) voor met ziprasidon behandelde patiënten in de kortdurende, placebogecontroleerde schizofrenieonderzoeken was 14% vs. 8% voor placebo. Objectief verzamelde gegevens van die onderzoeken op de Simpson-Angus Rating Scale (voor EPS) en de Barnes Akathisia Scale (voor acathisie) lieten over het algemeen geen verschil zien tussen ziprasidon en placebo.
Dystonie
Klasse-effect: Symptomen van dystonie, langdurige abnormale samentrekkingen van spiergroepen, kunnen optreden bij gevoelige personen tijdens de eerste paar dagen van de behandeling. Dystonische symptomen zijn onder meer: spasmen van de nekspieren, soms overgaand in een beklemmend gevoel in de keel, moeite met slikken, ademhalingsmoeilijkheden en/of uitpuilende tong. Hoewel deze symptomen bij lage doses kunnen optreden, komen ze vaker en ernstiger voor bij een hoge potentie en bij hogere doses antipsychotica van de eerste generatie. Een verhoogd risico op acute dystonie wordt waargenomen bij mannen en jongere leeftijdsgroepen.
Veranderingen in vitale functies
Ziprasidon wordt geassocieerd met orthostatische hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
ECG-wijzigingen
Ziprasidon wordt geassocieerd met een verlenging van het QTc-interval [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. In de schizofrenieonderzoeken werd ziprasidon geassocieerd met een gemiddelde verhoging van de hartslag van 1,4 slagen per minuut vergeleken met een daling van 0,2 slagen per minuut bij placebopatiënten.
Andere bijwerkingen waargenomen tijdens de premarketingevaluatie van oraal ziprasidon
Hieronder volgt een lijst van COSTART-termen die tijdens de behandeling optredende bijwerkingen weergeven zoals gedefinieerd in de inleiding tot de rubriek ONGEWENSTE REACTIES die zijn gemeld door patiënten die werden behandeld met ziprasidon in schizofrenieonderzoeken bij meervoudige doses >4 mg/dag in de database van 3834 patiënten. Alle gemelde reacties zijn opgenomen, behalve de reacties die al in Tabel 11 of elders in de etikettering zijn vermeld, die reactietermen die zo algemeen waren dat ze niet informatief waren, reacties die slechts één keer werden gemeld en die geen substantiële kans hadden om acuut levensbedreigend te zijn, reacties die maken deel uit van de ziekte die wordt behandeld of komen anderszins vaak voor als achtergrondreacties, en reacties waarvan het onwaarschijnlijk wordt geacht dat ze verband houden met het geneesmiddel. Het is belangrijk te benadrukken dat, hoewel de gemelde reacties tijdens de behandeling met ziprasidon optraden, ze er niet noodzakelijk door werden veroorzaakt.
Bijwerkingen worden verder onderverdeeld per lichaamssysteem en gerangschikt in volgorde van afnemende frequentie volgens de volgende definities:
Frequent - bijwerkingen die optreden bij ten minste 1/100 patiënten (≥1,0% van de patiënten) (alleen de bijwerkingen die nog niet zijn vermeld in de tabel met resultaten van placebogecontroleerde onderzoeken, worden in deze lijst weergegeven);
Onregelmatig - bijwerkingen die optreden bij 1/100 tot 1/1000 patiënten (bij 0,1-1,0% van de patiënten)
Zelden - bijwerkingen die optreden bij minder dan 1/1000 patiënten (
Lichaam als geheel
Frequente buikpijn, griepsyndroom, koorts, per ongeluk vallen, gezichtsoedeem, koude rillingen, fotosensitiviteitsreactie, flankpijn, hypothermie, motorvoertuigongeval
Cardiovasculair systeem
Frequente tachycardie, hypertensie, orthostatische hypotensie
Onregelmatige bradycardie, angina pectoris, atriale fibrillatie
Zeldzaam eerstegraads AV-blok, bundeltakblok, flebitis, longembolie, cardiomegalie, herseninfarct, cerebrovasculair accident, diepe tromboflebitis, myocarditis, tromboflebitis
Spijsverteringsstelsel
Frequente anorexia, braken
Onregelmatige rectale bloeding, dysfagie, tongoedeem
Zeldzame tandvleesbloeding, geelzucht, fecale impactie, verhoogde gamma-glutamyltranspeptidase, hematemesis, cholestatische geelzucht, hepatitis, hepatomegalie, leukoplakie van de mond, leververvetting, melena
endocrien
Zelden hypothyreoïdie, hyperthyreoïdie, thyreoïditis
Hemic en lymfatisch systeem
Onregelmatige anemie, ecchymose, leukocytose, leukopenie, eosinofilie, lymfadenopathie
Zelden trombocytopenie, hypochrome anemie, lymfocytose, monocytose, basofilie, lymfoedeem, polycytemie, trombocytemie
Metabole en voedingsstoornissen
Onregelmatige dorst, transaminase verhoogd, perifeer oedeem, hyperglykemie, creatinefosfokinase verhoogd, alkalische fosfatase verhoogd, hypercholesteremie, dehydratie, lactaatdehydrogenase verhoogd, albuminurie, hypokaliëmie
Zelden BUN verhoogd, creatinine verhoogd, hyperlipemie, hypocholesteremie, hyperkaliëmie, hypochloremie, hypoglykemie, hyponatriëmie, hypoproteïnemie, verlaagde glucosetolerantie, jicht, hyperchloremie, hyperurikemie, hypocalciëmie, hypoglykemiecreactie, hypomagnesiëmie, ketose, respiratoire alkalose
Musculoskeletaal systeem
Frequente spierpijn
Onregelmatige tenosynovitis
Zeldzame myopathie
Zenuwstelsel
Frequente agitatie, extrapiramidaal syndroom, tremor, dystonie, hypertonie, dyskinesie, vijandigheid, spiertrekkingen, paresthesie, verwardheid, duizeligheid, hypokinesie, hyperkinesie, abnormale gang, oculogyrische crisis, hypesthesie, ataxie, geheugenverlies, tandradstijfheid, delirium, hypotonie, akinesie, dysartrie ontwenningssyndroom, buccoglossaal syndroom, choreoathetose, diplopie, coördinatiestoornissen, neuropathie
Onregelmatige verlamming
Zelden myoclonus, nystagmus, torticollis, circumorale paresthesie, opisthotonos, verhoogde reflexen, trismus
Ademhalingssysteem
Frequente dyspneu
Onregelmatige longontsteking, epistaxis
Zelden bloedspuwing, laryngisme
Huid en aanhangsels
Onregelmatige maculopapulaire uitslag, urticaria, alopecia, eczeem, exfoliatieve dermatitis, contactdermatitis, vesiculobulleuze uitslag
Speciale zintuigen
Frequente schimmeldermatitis
Onregelmatige conjunctivitis, droge ogen, tinnitus, blefaritis, cataract, fotofobie
Zeldzame oogbloeding, gezichtsvelddefect, keratitis, keratoconjunctivitis
Urogenitaal systeem
Onregelmatige impotentie, abnormale ejaculatie, amenorroe, hematurie, menorragie, borstvoeding bij vrouwen, polyurie, urineretentie metrorragie, seksuele disfunctie bij mannen, anorgasmie, glycosurie
Zelden gynaecomastie, vaginale bloeding, nocturie, oligurie, vrouwelijke seksuele disfunctie, baarmoederbloeding
Bipolaire stoornis
Acute behandeling van manische of gemengde episodes
Bijwerkingen die verband houden met stopzetting van de behandeling op korte termijn, placebogecontroleerde onderzoeken
Ongeveer 6,5% (18/279) van de met ziprasidon behandelde patiënten in kortdurende, placebogecontroleerde onderzoeken stopte met de behandeling vanwege een bijwerking, vergeleken met ongeveer 3,7% (5/136) met placebo. De meest voorkomende reacties geassocieerd met uitval bij de met ziprasidon behandelde patiënten waren acathisie, angst, depressie, duizeligheid, dystonie, huiduitslag en braken, met 2 uitval voor elk van deze reacties bij ziprasidonpatiënten (1%) vergeleken met één placebopatiënt elk voor dystonie en huiduitslag (1%) en geen placebopatiënten voor de overige bijwerkingen.
Bijwerkingen die optreden bij een incidentie van 2% of meer bij met ziprasidon behandelde patiënten in kortdurende, orale, placebo-gecontroleerde onderzoeken
Tabel 12 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die optraden tijdens acute therapie (tot 3 weken) bij patiënten met bipolaire manie, inclusief alleen die reacties die optraden bij 2% of meer van de patiënten die werden behandeld met ziprasidon en waarvoor de incidentie bij patiënten behandeld met ziprasidon hoger was dan de incidentie bij met placebo behandelde patiënten.
Onderzoeken naar interacties op basis van geslacht brachten geen klinisch relevante verschillen aan het licht in het optreden van bijwerkingen op basis van deze demografische factor.
Intramusculaire Ziprasidon
Bijwerkingen die optreden bij een incidentie van 1% of meer bij met ziprasidon behandelde patiënten in kortdurende onderzoeken met intramusculair ziprasidon
Tabel 13 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die optraden tijdens acute therapie met intramusculair ziprasidon bij 1% of meer van de patiënten.
In deze onderzoeken werden de meest waargenomen bijwerkingen geassocieerd met het gebruik van intramusculaire ziprasidon (incidentie van 5% of meer) en waargenomen met een snelheid van ten minste tweemaal die van de laagste intramusculaire ziprasidon-groep (in de hogere dosisgroepen) waren hoofdpijn (13%), misselijkheid (12%) en slaperigheid (20%).
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van GEODON na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bijwerkingen die hierboven niet zijn vermeld en die zijn ontvangen sinds de introductie op de markt, omvatten zeldzame gevallen van de volgende: Hartaandoeningen: Tachycardie, torsade de pointes (in aanwezigheid van meerdere verstorende factoren), [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]; Spijsverteringsstoornissen: gezwollen tong; Voortplantingsstelsel- en borstaandoeningen: Galactorroe, priapisme; Zenuwstelselaandoeningen: gezichtsverzakking, maligne neurolepticasyndroom, serotoninesyndroom (alleen of in combinatie met serotonerge geneesmiddelen), tardieve dyskinesie; Psychische stoornissen: slapeloosheid, manie/hypomanie; Huid- en onderhuidaandoeningen: allergische reactie (zoals allergische dermatitis, angio-oedeem, orofaciaal oedeem, urticaria), huiduitslag, geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS); Urogenitale systeemaandoeningen: Enuresis, urine-incontinentie; Bloedvataandoeningen: orthostatische hypotensie, syncope.
DRUG-INTERACTIES
Geneesmiddel-geneesmiddelinteracties kunnen farmacodynamisch (gecombineerde farmacologische effecten) of farmacokinetisch (verandering van plasmaspiegels) zijn. De risico's van het gebruik van ziprasidon in combinatie met andere geneesmiddelen zijn beoordeeld zoals hieronder beschreven. Alle interactiestudies zijn uitgevoerd met oraal ziprasidon. Op basis van het farmacodynamische en farmacokinetische profiel van ziprasidon kunnen mogelijke interacties worden verwacht:
Metabole route
Ongeveer tweederde van ziprasidon wordt gemetaboliseerd via een combinatie van chemische reductie door glutathion en enzymatische reductie door aldehydeoxidase. Er zijn geen klinisch relevante remmers of inductoren van aldehydeoxidase bekend. Minder dan een derde van de metabole klaring van ziprasidon wordt gemedieerd door door cytochroom P450 gekatalyseerde oxidatie.
In vitro onderzoek
Een in vitro enzymremmingsonderzoek waarbij gebruik werd gemaakt van humane levermicrosomen toonde aan dat ziprasidon weinig remmend effect had op CYP1A2, CYP2C9, CYP2C19, CYP2D6 en CYP3A4, en dus waarschijnlijk niet interfereert met het metabolisme van geneesmiddelen die voornamelijk door deze enzymen worden gemetaboliseerd. Er is weinig kans op geneesmiddelinteracties met ziprasidon als gevolg van verdringing [zie KLINISCHE FARMACOLOGIE ].
Farmacodynamische interacties
Ziprasidon mag niet worden gebruikt met geneesmiddelen die het QT-interval verlengen [zie CONTRA-INDICATIES ].
Gezien de primaire effecten van ziprasidon op het centrale zenuwstelsel, is voorzichtigheid geboden bij gebruik in combinatie met andere centraal werkende geneesmiddelen.
Vanwege het potentieel om hypotensie te induceren, kan ziprasidon de effecten van bepaalde antihypertensiva versterken.
Ziprasidon kan de effecten van levodopa en dopamine-agonisten tegenwerken.
Farmacokinetische interacties
Carbamazepine
Carbamazepine is een inductor van CYP3A4; toediening van 200 mg tweemaal daags gedurende 21 dagen resulteerde in een afname van ongeveer 35% van de AUC van ziprasidon. Dit effect kan groter zijn wanneer hogere doses carbamazepine worden toegediend.
Ketoconazol
Ketoconazol, een krachtige remmer van CYP3A4, verhoogde in een dosis van 400 mg eenmaal daags gedurende 5 dagen de AUC en Cmax van ziprasidon met ongeveer 35-40%. Van andere remmers van CYP3A4 wordt verwacht dat ze vergelijkbare effecten hebben.
cimetidine
Cimetidine in een dosis van 800 mg QD gedurende 2 dagen had geen invloed op de farmacokinetiek van ziprasidon.
maagzuurremmer
De gelijktijdige toediening van 30 ml Maalox® met ziprasidon had geen invloed op de farmacokinetiek van ziprasidon.
Lithium
Ziprasidon in een dosis van 40 mg tweemaal daags, gelijktijdig toegediend met lithium in een dosis van 450 mg tweemaal daags gedurende 7 dagen had geen invloed op de steady-state-spiegel of renale klaring van lithium. Ziprasidon dat als aanvulling op lithium werd gedoseerd in een onderhoudsonderzoek bij bipolaire patiënten had geen invloed op de gemiddelde therapeutische lithiumspiegels.
Orale anticonceptiva
In vivo-onderzoeken hebben geen effect van ziprasidon op de farmacokinetiek van oestrogeen- of progesteroncomponenten aangetoond. Ziprasidon in een dosis van 20 mg tweemaal daags had geen invloed op de farmacokinetiek van gelijktijdig toegediende orale anticonceptiva, ethinylestradiol (0,03 mg) en levonorgestrel (0,15 mg).
dextromethorfan
In overeenstemming met in vitro resultaten toonde een onderzoek bij normale gezonde vrijwilligers aan dat ziprasidon het metabolisme van dextromethorfan, een CYP2D6-modelsubstraat, niet veranderde in zijn belangrijkste metaboliet, dextrorfan. Er was geen statistisch significante verandering in de verhouding dextromethorfan/dextrorfan in de urine.
Valproaat
Een farmacokinetische interactie van ziprasidon met valproaat is onwaarschijnlijk vanwege het ontbreken van gemeenschappelijke metabole routes voor de twee geneesmiddelen. Ziprasidon dat adjuvans bij valproaat werd gedoseerd in een onderhoudsonderzoek bij bipolaire patiënten had geen invloed op de gemiddelde therapeutische valproaatspiegels.
Andere gelijktijdige medicamenteuze therapie
Farmacokinetische populatieanalyse van schizofrene patiënten die deelnamen aan gecontroleerde klinische onderzoeken heeft geen bewijs opgeleverd voor klinisch significante farmacokinetische interacties met benztropine, propranolol of lorazepam.
Voedselinteractie
De absolute biologische beschikbaarheid van een dosis van 20 mg onder gevoede omstandigheden is ongeveer 60%. De absorptie van ziprasidon wordt tot het dubbele verhoogd in aanwezigheid van voedsel [zie: KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. Analyses van 17 placebogecontroleerde onderzoeken (modale duur van 10 weken), grotendeels bij patiënten die atypische antipsychotica gebruikten, lieten een risico op overlijden zien bij met geneesmiddelen behandelde patiënten van 1,6 tot 1,7 keer het risico op overlijden bij met placebo behandelde patiënten. In de loop van een typische 10 weken durende gecontroleerde studie was het sterftecijfer bij met geneesmiddelen behandelde patiënten ongeveer 4,5%, vergeleken met een percentage van ongeveer 2,6% in de placebogroep.
Hoewel de doodsoorzaken uiteenliepen, bleken de meeste sterfgevallen van cardiovasculaire (bijv. hartfalen, plotselinge dood) of infectieuze (bijv. longontsteking) van aard te zijn. GEODON is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose. [zien DOOS WAARSCHUWING: , Cerebrovasculaire bijwerkingen, waaronder beroerte, bij oudere patiënten met aan dementie gerelateerde psychose ].
Cerebrovasculaire bijwerkingen, waaronder beroerte, bij oudere patiënten met aan dementie gerelateerde psychose
In placebogecontroleerde onderzoeken bij oudere proefpersonen met dementie, hadden patiënten die waren gerandomiseerd naar risperidon, aripiprazol en olanzapine een hogere incidentie van beroerte en transiënte ischemische aanval, waaronder fatale beroerte. GEODON is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: DOOS WAARSCHUWING: en Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose ].
QT-verlenging en risico op plotselinge dood
Het gebruik van Ziprasidon moet worden vermeden in combinatie met andere geneesmiddelen waarvan bekend is dat ze het QTc-interval verlengen [zie CONTRA-INDICATIES en DRUG-INTERACTIES ]. Bovendien moeten clinici alert zijn op de identificatie van andere geneesmiddelen waarvan consequent is waargenomen dat ze het QTc-interval verlengen. Dergelijke geneesmiddelen mogen niet worden voorgeschreven met ziprasidon. Ziprasidon moet ook worden vermeden bij patiënten met een aangeboren lang QT-syndroom en bij patiënten met een voorgeschiedenis van hartritmestoornissen [zie CONTRA-INDICATIES ].
Een studie die het QT/QTc-verlengende effect van oraal ziprasidon rechtstreeks vergeleek met verschillende andere geneesmiddelen die effectief zijn bij de behandeling van schizofrenie, werd uitgevoerd bij vrijwilligers van patiënten. In de eerste fase van het onderzoek werden ECG's verkregen op het moment van maximale plasmaconcentratie wanneer het medicijn alleen werd toegediend. In de tweede fase van het onderzoek werden ECG's verkregen op het moment van maximale plasmaconcentratie terwijl het geneesmiddel gelijktijdig werd toegediend met een remmer van het CYP4503A4-metabolisme van het geneesmiddel.
In de eerste fase van het onderzoek werd de gemiddelde verandering in QTc vanaf baseline berekend voor elk medicijn, met behulp van een steekproefgebaseerde correctie die het effect van de hartslag op het QT-interval wegneemt. De gemiddelde toename van QTc vanaf baseline voor ziprasidon varieerde van ongeveer 9 tot 14 msec groter dan voor vier van de vergelijkende geneesmiddelen (risperidon, olanzapine, quetiapine en haloperidol), maar was ongeveer 14 msec minder dan de verlenging die werd waargenomen voor thioridazine.
In de tweede fase van het onderzoek werd het effect van ziprasidon op de QTc-lengte niet versterkt door de aanwezigheid van een metabole remmer (ketoconazol 200 mg tweemaal daags).
In placebogecontroleerde onderzoeken verlengde oraal ziprasidon het QTc-interval in vergelijking met placebo met ongeveer 10 msec bij de hoogste aanbevolen dagelijkse dosis van 160 mg. In klinische onderzoeken met oraal ziprasidon lieten de elektrocardiogrammen van 2/2988 (0,06%) patiënten die 80 mg GEODON kregen en 1/440 (0,23%) patiënten die placebo kregen QTc-intervallen zien die de potentieel klinisch relevante drempel van 500 msec overschreden. Bij de met ziprasidon behandelde patiënten suggereerde geen van beide gevallen een rol van ziprasidon. Eén patiënt had een voorgeschiedenis van verlengde QTc en een screeningsmeting van 489 msec; QTc was 503 msec tijdens behandeling met ziprasidon. De andere patiënt had een QTc van 391 msec aan het einde van de behandeling met ziprasidon en ondervond bij het overschakelen op thioridazine QTc-metingen van 518 en 593 msec.
Sommige geneesmiddelen die het QT/QTc-interval verlengen, zijn in verband gebracht met het optreden van torsade de pointes en met plotselinge onverklaarbare dood. De relatie tussen QT-verlenging en torsade de pointes is het duidelijkst voor grotere verhogingen (20 msec en meer), maar het is mogelijk dat kleinere QT/QTc-verlengingen ook het risico verhogen, of het verhogen bij daarvoor gevoelige personen. Hoewel torsade de pointes niet is waargenomen in verband met het gebruik van ziprasidon in premarketingonderzoeken en de ervaring te beperkt is om een verhoogd risico uit te sluiten, zijn er zeldzame postmarketingmeldingen (in aanwezigheid van meerdere verstorende factoren) [zie ONGEWENSTE REACTIES ].
Een onderzoek naar het QT/QTc-verlengende effect van intramusculair ziprasidon, met intramusculair haloperidol als controle, werd uitgevoerd bij patiëntvrijwilligers. In het onderzoek werden ECG's verkregen op het moment van maximale plasmaconcentratie na twee injecties met ziprasidon (20 mg en vervolgens 30 mg) of haloperidol (7,5 mg en vervolgens 10 mg) met een tussenpoos van vier uur. Merk op dat een dosis van 30 mg intramusculair ziprasidon 50% hoger is dan de aanbevolen therapeutische dosis. De gemiddelde verandering in QTc vanaf baseline werd berekend voor elk medicijn, met behulp van een steekproefgebaseerde correctie die het effect van de hartslag op het QT-interval wegneemt. De gemiddelde toename in QTc vanaf baseline voor ziprasidon was 4,6 msec na de eerste injectie en 12,8 msec na de tweede injectie. De gemiddelde toename van QTc vanaf baseline voor haloperidol was 6,0 msec na de eerste injectie en 14,7 msec na de tweede injectie. In deze studie hadden geen patiënten een QTc-interval van meer dan 500 msec.
Net als bij andere antipsychotica en placebo zijn plotselinge onverklaarbare sterfgevallen gemeld bij patiënten die ziprasidon in de aanbevolen doses gebruikten. De premarketingervaring voor ziprasidon bracht geen verhoogd risico op sterfte aan het licht voor ziprasidon in vergelijking met andere antipsychotica of placebo, maar de mate van blootstelling was beperkt, vooral voor de geneesmiddelen die als actieve controles en placebo werden gebruikt. Desalniettemin verhoogt de grotere verlenging van de QTc-lengte door ziprasidon in vergelijking met verschillende andere antipsychotica de mogelijkheid dat het risico op plotselinge dood groter is voor ziprasidon dan voor andere beschikbare geneesmiddelen voor de behandeling van schizofrenie. Met deze mogelijkheid moet rekening worden gehouden bij de keuze tussen alternatieve geneesmiddelen [zie INDICATIES ].
Bepaalde omstandigheden kunnen het risico op het optreden van torsade de pointes en/of plotselinge dood verhogen in verband met het gebruik van geneesmiddelen die het QTc-interval verlengen, waaronder (1) bradycardie; (2) hypokaliëmie of hypomagnesiëmie; (3) gelijktijdig gebruik van andere geneesmiddelen die het QTc-interval verlengen; en (4) aanwezigheid van aangeboren verlenging van het QT-interval.
Het wordt aanbevolen dat patiënten die in aanmerking komen voor behandeling met ziprasidon en die een risico lopen op significante elektrolytenstoornissen, in het bijzonder hypokaliëmie, baseline serumkalium- en magnesiummetingen hebben. Hypokaliëmie (en/of hypomagnesiëmie) kan het risico op QT-verlenging en aritmie verhogen. Hypokaliëmie kan het gevolg zijn van diuretische therapie, diarree en andere oorzaken. Patiënten met een laag serumkalium en/of magnesiumgehalte moeten die elektrolyten opnieuw krijgen voordat ze met de behandeling beginnen. Het is essentieel om de serumelektrolyten periodiek te controleren bij patiënten bij wie een diuretische therapie wordt geïntroduceerd tijdens de behandeling met ziprasidon. Aanhoudend verlengde QTc-intervallen kunnen ook het risico op verdere verlenging en aritmie verhogen, maar het is niet duidelijk of routinematige ECG-screeningmetingen effectief zijn bij het opsporen van dergelijke patiënten. Ziprasidon moet eerder worden vermeden bij patiënten met een voorgeschiedenis van significante cardiovasculaire aandoeningen, bijv. QT-verlenging, recent acuut myocardinfarct, niet-gecompenseerd hartfalen of hartritmestoornissen. Ziprasidon dient te worden gestaakt bij patiënten bij wie aanhoudende QTc-metingen >500 msec blijken te hebben.
Bij patiënten die ziprasidon gebruiken en symptomen ervaren die kunnen wijzen op het optreden van torsade de pointes, bijv. duizeligheid, hartkloppingen of syncope, moet de voorschrijver een verdere evaluatie starten, bijv. Holter-monitoring kan nuttig zijn.
Maligne neurolepticasyndroom (NMS)
Een potentieel fataal symptoomcomplex dat soms wordt aangeduid als maligne neurolepticasyndroom (MNS), is gemeld in verband met de toediening van antipsychotica. Klinische manifestaties van MNS zijn hyperpyrexie, spierstijfheid, veranderde mentale toestand en tekenen van autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen). Bijkomende symptomen kunnen zijn: verhoogde creatininefosfokinase, myoglobinurie (rabdomyolyse) en acuut nierfalen.
De diagnostische evaluatie van patiënten met dit syndroom is gecompliceerd. Om tot een diagnose te komen, is het belangrijk gevallen uit te sluiten waarin de klinische presentatie zowel een ernstige medische aandoening (bijv. longontsteking, systemische infectie, enz.) als onbehandelde of onvoldoende behandelde extrapiramidale tekenen en symptomen (EPS) omvat. Andere belangrijke overwegingen bij de differentiële diagnose zijn centrale anticholinerge toxiciteit, hitteberoerte, medicijnkoorts en primaire pathologie van het centrale zenuwstelsel (CZS).
De behandeling van MNS moet het volgende omvatten: (1) onmiddellijke stopzetting van antipsychotica en andere geneesmiddelen die niet essentieel zijn voor gelijktijdige therapie; (2) intensieve symptomatische behandeling en medische monitoring; en (3) behandeling van eventuele bijkomende ernstige medische problemen waarvoor specifieke behandelingen beschikbaar zijn. Er is geen algemene overeenstemming over specifieke farmacologische behandelingsregimes voor NMS.
Als een patiënt behandeling met antipsychotica nodig heeft na herstel van MNS, moet de mogelijke herintroductie van medicamenteuze therapie zorgvuldig worden overwogen. De patiënt moet zorgvuldig worden gecontroleerd, aangezien recidieven van MNS zijn gemeld.
Ernstige cutane bijwerkingen
Geneesmiddelreactie met eosinofilie en systemische symptomen (JURK)
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) is gemeld bij blootstelling aan ziprasidon. DRESS bestaat uit een combinatie van drie of meer van de volgende: huidreactie (zoals uitslag of exfoliatieve dermatitis), eosinofilie, koorts, lymfadenopathie en een of meer systemische complicaties zoals hepatitis, nefritis, pneumonitis, myocarditis en pericarditis. DRESS is soms dodelijk. Stop met ziprasidon als DRESS wordt vermoed.
Andere ernstige cutane bijwerkingen
Andere ernstige huidbijwerkingen, zoals het Stevens-Johnson-syndroom, zijn gemeld bij blootstelling aan ziprasidon. Ernstige cutane bijwerkingen zijn soms fataal. Stop met ziprasidon als ernstige huidbijwerkingen worden vermoed.
Tardieve dyskinesie
Een syndroom van mogelijk onomkeerbare, onwillekeurige, dyskinetische bewegingen kan optreden bij patiënten die worden behandeld met antipsychotica. Hoewel de prevalentie van het syndroom het hoogst lijkt te zijn bij ouderen, vooral bij oudere vrouwen, is het onmogelijk om te vertrouwen op prevalentieschattingen om bij aanvang van de antipsychotische behandeling te voorspellen welke patiënten het syndroom waarschijnlijk zullen ontwikkelen. Of antipsychotica verschillen in hun potentieel om tardieve dyskinesie te veroorzaken, is niet bekend.
Aangenomen wordt dat het risico op het ontwikkelen van tardieve dyskinesie en de kans dat het onomkeerbaar wordt, toeneemt naarmate de duur van de behandeling en de totale cumulatieve dosis antipsychotica die aan de patiënt worden toegediend toenemen. Het syndroom kan zich echter ontwikkelen, hoewel veel minder vaak, na relatief korte behandelingsperioden met lage doses.
Er is geen behandeling bekend voor vastgestelde gevallen van tardieve dyskinesie, hoewel het syndroom gedeeltelijk of volledig kan verdwijnen als de behandeling met antipsychotica wordt stopgezet. Behandeling met antipsychotica zelf kan echter de tekenen en symptomen van het syndroom onderdrukken (of gedeeltelijk) en kan daardoor mogelijk het onderliggende proces maskeren. Het effect dat symptomatische onderdrukking heeft op het lange termijn beloop van het syndroom is onbekend.
Gezien deze overwegingen moet ziprasidon zo worden voorgeschreven dat het optreden van tardieve dyskinesie het meest waarschijnlijk wordt voorkomen. Chronische behandeling met antipsychotica dient in het algemeen te worden voorbehouden aan patiënten die lijden aan een chronische ziekte waarvan (1) bekend is dat deze reageert op antipsychotica, en (2) voor wie alternatieve, even effectieve, maar mogelijk minder schadelijke behandelingen niet beschikbaar of geschikt zijn. Bij patiënten die wel een chronische behandeling nodig hebben, moet worden gestreefd naar de kleinste dosis en de kortste behandelingsduur die een bevredigende klinische respons oplevert. De noodzaak van voortzetting van de behandeling moet periodiek opnieuw worden beoordeeld.
Als er tekenen en symptomen van tardieve dyskinesie optreden bij een patiënt die ziprasidon gebruikt, dient te worden overwogen de behandeling te staken. Sommige patiënten kunnen echter ondanks de aanwezigheid van het syndroom toch een behandeling met ziprasidon nodig hebben.
Metabolische veranderingen
Atypische antipsychotica zijn in verband gebracht met metabole veranderingen die het cardiovasculaire/cerebrovasculaire risico kunnen verhogen. Deze metabole veranderingen omvatten hyperglykemie, dyslipidemie en gewichtstoename. Hoewel is aangetoond dat alle geneesmiddelen in de klasse enkele metabole veranderingen veroorzaken, heeft elk medicijn zijn eigen specifieke risicoprofiel.
Hyperglykemie en diabetes mellitus
Hyperglykemie en diabetes mellitus, in sommige gevallen extreem en geassocieerd met ketoacidose of hyperosmolair coma of overlijden, zijn gemeld bij patiënten die werden behandeld met atypische antipsychotica. Er zijn weinig meldingen geweest van hyperglykemie of diabetes bij patiënten die met GEODON werden behandeld. Hoewel er minder patiënten zijn behandeld met GEODON, is het niet bekend of deze beperktere ervaring de enige reden is voor het gebrek aan dergelijke rapporten. De beoordeling van de relatie tussen atypisch antipsychoticagebruik en glucoseafwijkingen wordt bemoeilijkt door de mogelijkheid van een verhoogd achtergrondrisico op diabetes mellitus bij patiënten met schizofrenie en de toenemende incidentie van diabetes mellitus in de algemene bevolking. Gezien deze confounders wordt de relatie tussen atypisch antipsychoticagebruik en hyperglykemiegerelateerde bijwerkingen niet volledig begrepen. Precieze risicoschattingen voor aan hyperglykemie gerelateerde bijwerkingen bij patiënten die worden behandeld met atypische antipsychotica zijn niet beschikbaar.
Patiënten met een vastgestelde diagnose diabetes mellitus die worden gestart met atypische antipsychotica, moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten met risicofactoren voor diabetes mellitus (bijv. obesitas, familiegeschiedenis van diabetes) die beginnen met een behandeling met atypische antipsychotica, moeten aan het begin van de behandeling en periodiek tijdens de behandeling een nuchtere bloedglucosetest ondergaan. Elke patiënt die met atypische antipsychotica wordt behandeld, moet worden gecontroleerd op symptomen van hyperglykemie, waaronder polydipsie, polyurie, polyfagie en zwakte. Patiënten die symptomen van hyperglykemie ontwikkelen tijdens behandeling met atypische antipsychotica, moeten een nuchtere bloedglucosetest ondergaan. In sommige gevallen is de hyperglykemie verdwenen toen het atypische antipsychoticum werd stopgezet; bij sommige patiënten was het echter nodig om de antidiabetische behandeling voort te zetten ondanks het stopzetten van het verdachte geneesmiddel.
Gepoolde gegevens van kortdurende, placebogecontroleerde onderzoeken bij schizofrenie en bipolaire stoornis worden weergegeven in tabellen 1-4. Merk op dat voor de onderzoeken met flexibele doses bij zowel schizofrenie als bipolaire stoornis, elke proefpersoon wordt gecategoriseerd als een lage (20-40 mg BID) of hoge (60-80 mg BID) dosis op basis van de modale dagelijkse dosis van de proefpersoon. In de tabellen met categorische veranderingen worden de percentages (kolom %) berekend als 100x(n/N).

In langetermijn (ten minste 1 jaar), placebogecontroleerde, flexibele-dosisonderzoeken bij schizofrenie, was de gemiddelde verandering ten opzichte van baseline in willekeurige glucose voor ziprasidon 20-40 mg BID -3,4 mg/dL (N=122); voor ziprasidon was 60-80 mg BID +1,3 mg/dL (N=10); en voor placebo was dit +0,3 mg/dL (N=71).
dyslipidemie
Bij patiënten die met atypische antipsychotica werden behandeld, zijn ongewenste veranderingen in de lipiden waargenomen. Gepoolde gegevens van kortdurende, placebogecontroleerde onderzoeken bij schizofrenie en bipolaire stoornis worden weergegeven in tabellen 5-8.
In langetermijn (ten minste 1 jaar), placebogecontroleerde, flexibele-dosisonderzoeken bij schizofrenie, was de gemiddelde verandering ten opzichte van baseline in willekeurige triglyceriden voor ziprasidon 20-40 mg BID +26,3 mg/dL (N=15); voor ziprasidon was 60-80 mg BID -39,3 mg/dL (N=10); en voor placebo was +12,9 mg/dL (N=9). In langetermijn (ten minste 1 jaar), placebogecontroleerde, flexibele-dosisonderzoeken bij schizofrenie, was de gemiddelde verandering ten opzichte van baseline in willekeurig totaal cholesterol voor ziprasidon 20-40 mg BID +2,5 mg/dL (N=14); voor ziprasidon was 60-80 mg BID -19,7 mg/dL (N=10); en voor placebo was -28,0 mg/dL (N=9).
Gewichtstoename
Gewichtstoename is waargenomen bij gebruik van atypische antipsychotica. Controle van het gewicht wordt aanbevolen. Gepoolde gegevens van kortdurende, placebogecontroleerde onderzoeken bij schizofrenie en bipolaire stoornis worden weergegeven in tabellen 9-10.
In langetermijn (ten minste 1 jaar), placebogecontroleerde, flexibele-dosisonderzoeken bij schizofrenie, was de gemiddelde verandering ten opzichte van het uitgangsgewicht voor ziprasidon 20-40 mg BID -2,3 kg (N=124); voor ziprasidon was 60-80 mg BID +2,5 kg (N=10); en voor placebo was -2,9 kg (N=72). In dezelfde langetermijnstudies was het aandeel proefpersonen met ≥ 7% gewichtstoename vanaf baseline voor ziprasidon 20-40 mg BID 5,6% (N=124); voor ziprasidon was 60-80 mg BID 20,0% (N=10), en voor placebo 5,6% (N=72). In een langetermijn (ten minste 1 jaar), placebogecontroleerd onderzoek met een vaste dosis bij schizofrenie, was de gemiddelde verandering ten opzichte van het uitgangsgewicht voor ziprasidon 20 mg tweemaal daags -2,6 kg (N=72); voor ziprasidon was 40 mg BID -3,3 kg (N=69); voor ziprasidon was 80 mg BID -2,8 kg (N=70) en voor placebo -3,8 kg (N=70). In hetzelfde langetermijnonderzoek naar schizofrenie met een vaste dosis was het aandeel proefpersonen met ≥ 7% gewichtstoename vanaf baseline voor ziprasidon 20 mg tweemaal daags 5,6% (N=72); voor ziprasidon 40 mg BID was 2,9% (N=69); voor ziprasidon was 80 mg tweemaal daags 5,7% (N=70) en voor placebo 2,9% (N=70).
Schizofrenie
De proporties van patiënten die voldeden aan een gewichtstoenamecriterium van ≥ 7% van het lichaamsgewicht werden vergeleken in een pool van vier 4- en 6 weken durende placebogecontroleerde klinische onderzoeken naar schizofrenie, waarbij een statistisch significant hogere incidentie van gewichtstoename voor ziprasidon werd onthuld (10% ) vergeleken met placebo (4%). Bij patiënten met ziprasidon werd een mediane gewichtstoename van 0,5 kg waargenomen in vergelijking met geen mediane gewichtsverandering bij placebopatiënten. In deze reeks klinische onderzoeken werd gewichtstoename gemeld als bijwerking bij respectievelijk 0,4% en 0,4% van de ziprasidon- en placebopatiënten. Tijdens langdurige therapie met ziprasidon liet een indeling van patiënten bij baseline op basis van de body mass index (BMI) de grootste gemiddelde gewichtstoename en de hoogste incidentie van klinisch significante gewichtstoename (> 7% van het lichaamsgewicht) zien bij patiënten met een lage BMI (27). Er was een gemiddelde gewichtstoename van 1,4 kg voor die patiënten met een "lage" baseline BMI, geen gemiddelde verandering voor patiënten met een "normale" BMI, en een gemiddeld gewichtsverlies van 1,3 kg voor patiënten die aan het programma begonnen met een "hoge" BMI.
Bipolaire stoornis
Tijdens een 6 maanden durende placebogecontroleerde bipolaire onderhoudsstudie bij volwassenen met ziprasidon als aanvulling op lithium of valproaat, was de incidentie van klinisch significante gewichtstoename (≥ 7% van het lichaamsgewicht) tijdens de dubbelblinde periode 5,6% voor zowel ziprasidon als en placebobehandelingsgroepen die de observatie van 6 maanden voor terugval voltooiden. Bij de interpretatie van deze bevindingen moet er rekening mee worden gehouden dat alleen patiënten die ziprasidon adequaat verdroegen, in de dubbelblinde fase van het onderzoek kwamen en dat er aanzienlijke uitval was tijdens de open-labelfase.
Uitslag
In premarketingonderzoeken met ziprasidon ontwikkelde ongeveer 5% van de patiënten huiduitslag en/of urticaria, waarbij de behandeling in ongeveer een zesde van deze gevallen werd stopgezet. Het optreden van huiduitslag was gerelateerd aan de dosis ziprasidon, hoewel de bevinding ook zou kunnen worden verklaard door de langere blootstellingstijd bij de patiënten met een hogere dosis. Verschillende patiënten met huiduitslag hadden tekenen en symptomen van geassocieerde systemische ziekte, bijv. verhoogde leukocyten. De meeste patiënten verbeterden onmiddellijk met aanvullende behandeling met antihistaminica of steroïden en/of na stopzetting van ziprasidon, en van alle patiënten die deze reacties ondervonden, werd gemeld dat ze volledig herstelden. Bij het optreden van huiduitslag waarvoor geen alternatieve etiologie kan worden vastgesteld, moet de behandeling met ziprasidon worden stopgezet.
Orthostatische hypotensie
Ziprasidon kan orthostatische hypotensie veroorzaken die gepaard gaat met duizeligheid, tachycardie en, bij sommige patiënten, syncope, vooral tijdens de initiële dosistitratieperiode, waarschijnlijk als gevolg van de α1-adrenerge antagonistische eigenschappen. Syncope werd gemeld bij 0,6% van de patiënten die met ziprasidon werden behandeld.
Ziprasidon moet met bijzondere voorzichtigheid worden gebruikt bij patiënten met bekende cardiovasculaire aandoeningen (voorgeschiedenis van myocardinfarct of ischemische hartziekte, hartfalen of geleidingsstoornissen), cerebrovasculaire aandoeningen of aandoeningen die patiënten vatbaar maken voor hypotensie (dehydratie, hypovolemie en behandeling met antihypertensiva). medicijnen).
Watervallen
Antipsychotica (waaronder GEODON) kunnen slaperigheid, orthostatische hypotensie en motorische en sensorische instabiliteit veroorzaken, wat kan leiden tot vallen en bijgevolg tot fracturen of ander letsel. Voor patiënten met ziekten, aandoeningen of medicijnen die deze effecten kunnen verergeren, volledige beoordeling van het valrisico bij het starten van een antipsychotische behandeling en herhaaldelijk voor patiënten die langdurige antipsychotische therapie ondergaan.
Leukopenie, neutropenie en agranulocytose
In klinische onderzoeken en postmarketingervaring zijn gevallen van leukopenie/neutropenie gemeld die tijdelijk gerelateerd zijn aan antipsychotica. Agranulocytose (inclusief gevallen met dodelijke afloop) is ook gemeld.
Mogelijke risicofactoren voor leukopenie/neutropenie zijn onder meer een reeds bestaand laag aantal witte bloedcellen (WBC) en een voorgeschiedenis van door geneesmiddelen geïnduceerde leukopenie/neutropenie. Bij patiënten met een reeds bestaande lage WBC of een voorgeschiedenis van geneesmiddelgeïnduceerde leukopenie/neutropenie moet hun volledige bloedbeeld (CBC) regelmatig worden gecontroleerd tijdens de eerste paar maanden van de behandeling en moeten GEODON staken bij het eerste teken van afname van WBC in afwezigheid van andere oorzakelijke factoren.
Patiënten met neutropenie moeten zorgvuldig worden gecontroleerd op koorts of andere symptomen of tekenen van infectie en onmiddellijk worden behandeld als dergelijke symptomen of tekenen optreden. Patiënten met ernstige neutropenie (absoluut aantal neutrofielen
epileptische aanvallen
Tijdens klinische onderzoeken kwamen epileptische aanvallen voor bij 0,4% van de patiënten die met ziprasidon werden behandeld. In veel van deze gevallen waren er verstorende factoren die mogelijk hebben bijgedragen aan het optreden van aanvallen. Zoals met andere antipsychotica, dient ziprasidon met voorzichtigheid te worden gebruikt bij patiënten met een voorgeschiedenis van convulsies of met aandoeningen die de drempel voor convulsies mogelijk verlagen, bijv. Alzheimer-dementie. Aandoeningen die de aanvalsdrempel verlagen, kunnen vaker voorkomen in een populatie van 65 jaar of ouder.
Dysfagie
Slokdarmdysmotiliteit en aspiratie zijn in verband gebracht met het gebruik van antipsychotica. Aspiratiepneumonie is een veelvoorkomende oorzaak van morbiditeit en mortaliteit bij oudere patiënten, in het bijzonder bij patiënten met gevorderde Alzheimerdementie. Ziprasidon en andere antipsychotica moeten met voorzichtigheid worden gebruikt bij patiënten met een risico op aspiratiepneumonie [zie DOOS WAARSCHUWING: ].
Hyperprolactinemie
Zoals met andere geneesmiddelen die dopamine D2-receptoren antagoniseren, verhoogt ziprasidon de prolactinespiegels bij mensen. Verhoogde prolactinespiegels werden ook waargenomen in dierstudies met deze verbinding en werden geassocieerd met een toename van borstklierneoplasie bij muizen; een soortgelijk effect werd niet waargenomen bij ratten [zie Niet-klinische toxicologie ]. Weefselkweekexperimenten geven aan dat ongeveer een derde van de menselijke borstkankers in vitro prolactine-afhankelijk is, een factor van potentieel belang als het voorschrijven van deze geneesmiddelen wordt overwogen bij een patiënt met eerder gedetecteerde borstkanker. Noch klinische studies noch epidemiologische studies die tot nu toe zijn uitgevoerd, hebben een verband aangetoond tussen chronische toediening van deze klasse geneesmiddelen en tumorigenese bij mensen; het beschikbare bewijs wordt op dit moment te beperkt geacht om sluitend te zijn.
Hoewel stoornissen zoals galactorroe, amenorroe, gynaecomastie en impotentie zijn gemeld met prolactineverhogende verbindingen, is de klinische betekenis van verhoogde serumprolactinespiegels voor de meeste patiënten onbekend. Langdurige hyperprolactinemie in combinatie met hypogonadisme kan leiden tot verminderde botdichtheid.
Potentieel voor cognitieve en motorische stoornissen
Slaperigheid was een vaak gemelde bijwerking bij patiënten die werden behandeld met ziprasidon. In de 4 en 6 weken durende placebogecontroleerde onderzoeken werd slaperigheid gemeld bij 14% van de patiënten die ziprasidon gebruikten, vergeleken met 7% van de placebopatiënten. Slaperigheid leidde tot stopzetting van de behandeling bij 0,3% van de patiënten in kortdurende klinische onderzoeken. Aangezien ziprasidon het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten worden gewaarschuwd voor het uitvoeren van activiteiten die mentale alertheid vereisen, zoals het besturen van een motorvoertuig (inclusief auto's) of het bedienen van gevaarlijke machines totdat ze redelijk zeker zijn dat therapie met ziprasidon niet hen nadelig beïnvloeden.
Priapisme
Eén geval van priapisme werd gerapporteerd in de premarketingdatabase. Hoewel de relatie tussen de reactie en het gebruik van ziprasidon niet is vastgesteld, is gemeld dat andere geneesmiddelen met alfa-adrenerge blokkerende effecten priapisme induceren, en het is mogelijk dat ziprasidon deze capaciteit deelt. Ernstig priapisme kan chirurgische ingreep vereisen.
Regeling lichaamstemperatuur
Hoewel niet gemeld met ziprasidon in premarketingonderzoeken, wordt een verstoring van het vermogen van het lichaam om de kerntemperatuur van het lichaam te verlagen toegeschreven aan antipsychotica. Passende zorg wordt geadviseerd bij het voorschrijven van ziprasidon aan patiënten die aandoeningen zullen ervaren die kunnen bijdragen aan een verhoging van de lichaamstemperatuur, bijv. zware inspanning, blootstelling aan extreme hitte, gelijktijdige toediening van medicatie met anticholinerge activiteit, of onderhevig zijn aan uitdroging.
Zelfmoord
De mogelijkheid van een zelfmoordpoging is inherent aan een psychotische ziekte of bipolaire stoornis, en nauw toezicht op patiënten met een hoog risico moet de medicamenteuze behandeling vergezellen. Voorschriften voor ziprasidon moeten worden geschreven voor de kleinste hoeveelheid capsules die consistent zijn met goed patiëntenbeheer om het risico op overdosering te verminderen.
Patiënten met bijkomende ziekten
Klinische ervaring met ziprasidon bij patiënten met bepaalde bijkomende systemische ziekten is beperkt [zie: Gebruik bij specifieke populaties ].
Ziprasidon is niet geëvalueerd of in noemenswaardige mate gebruikt bij patiënten met een recente voorgeschiedenis van een myocardinfarct of instabiele hartziekte. Patiënten met deze diagnoses werden uitgesloten van premarketing klinische onderzoeken. Vanwege het risico op QTc-verlenging en orthostatische hypotensie met ziprasidon is voorzichtigheid geboden bij hartpatiënten. [zien QT-verlenging en risico op plotselinge dood, orthostatische hypotensie ].
Laboratorium testen
Bij patiënten die in aanmerking komen voor een behandeling met ziprasidon en een risico lopen op significante elektrolytenstoornissen, moeten baseline serumkalium- en magnesiummetingen worden uitgevoerd. Laag serumkalium en magnesium moeten worden vervangen voordat met de behandeling wordt begonnen. Patiënten die tijdens de behandeling met Ziprasidon met diuretica worden gestart, hebben periodieke controle van het serumkalium en magnesium nodig. Ziprasidon moet worden gestaakt bij patiënten bij wie aanhoudende QTc-metingen >500 msec worden vastgesteld [zie QT-verlenging en risico op plotselinge dood ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Toedieningsinformatie voor capsules
Adviseer patiënten om GEODON-capsules heel in te nemen. De capsules niet openen, pletten of erop kauwen. Instrueer patiënten om GEODON-capsules met voedsel in te nemen voor een optimale opname. De absorptie van ziprasidon wordt tot het dubbele verhoogd in aanwezigheid van voedsel [zie: DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
QTc-verlenging
Adviseer patiënten om hun zorgverleners te informeren over het volgende: Geschiedenis van QT-verlenging; recent acuut myocardinfarct; niet-gecompenseerd hartfalen; het voorschrijven van andere geneesmiddelen die QT-verlenging hebben aangetoond; risico op significante elektrolytafwijkingen; en geschiedenis van hartritmestoornissen [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Instrueer patiënten om het begin van elke aandoening te melden die hen in gevaar brengt voor significante elektrolytstoornissen, in het bijzonder hypokaliëmie, inclusief maar niet beperkt tot het starten van diuretische therapie of langdurige diarree. Instrueer patiënten daarnaast om symptomen zoals duizeligheid, hartkloppingen of syncope aan de voorschrijver te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ernstige cutane bijwerkingen
Instrueer patiënten om zo spoedig mogelijk tekenen of symptomen aan hun zorgverlener te melden die verband kunnen houden met een geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) of met ernstige bijwerkingen van de huid, zoals het Stevens-Johnson-syndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
Adviseer zwangere vrouwen om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met GEODON. Adviseer patiënten dat GEODON extrapiramidale en/of ontwenningsverschijnselen (agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis) kan veroorzaken bij een pasgeborene. Adviseer patiënten dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan GEODON zijn blootgesteld [zie: Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven en GEODON 20 mg gebruiken om baby's te controleren op overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen) en om medische hulp in te roepen als ze deze symptomen opmerken [zie Gebruik bij specifieke populaties ].
Onvruchtbaarheid
Adviseer vrouwen met reproductief vermogen dat GEODON 80 mg de vruchtbaarheid kan verminderen als gevolg van een verhoging van de serumprolactinespiegels. De effecten op de vruchtbaarheid zijn omkeerbaar [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Levenslange carcinogeniteitsstudies werden uitgevoerd met ziprasidon bij Long Evans-ratten en CD-1-muizen. Ziprasidon werd gedurende 24 maanden via de voeding toegediend in doses van 2, 6 of 12 mg/kg/dag aan ratten en 50, 100 of 200 mg/kg/dag aan muizen (0,1 tot 0,6 en 1 tot 5 maal de maximale aanbevolen dosis voor de mens (MRHD) van 200 mg/dag op basis van respectievelijk mg/m2 lichaamsoppervlak). In de rattenstudie was er geen bewijs van een verhoogde incidentie van tumoren in vergelijking met controles. Bij mannelijke muizen was er geen toename van de incidentie van tumoren in vergelijking met controles. Bij vrouwelijke muizen waren er dosisgerelateerde verhogingen van de incidentie van hypofyse-adenoom en -carcinoom, en borstklieradenocarcinoom bij alle geteste doses (50 tot 200 mg/kg/dag of 1 tot 5 keer de MRHD op basis van mg/m2 oppervlakte). Proliferatieve veranderingen in de hypofyse en borstklieren van knaagdieren zijn waargenomen na chronische toediening van andere antipsychotica en worden beschouwd als prolactine-gemedieerd. Verhogingen van serumprolactine werden waargenomen in een voedingsonderzoek van 1 maand bij vrouwelijke, maar niet bij mannelijke, muizen bij 100 en 200 mg/kg/dag (of 2,5 en 5 keer de MRHD op basis van mg/m2 lichaamsoppervlak). Ziprasidon had geen effect op serumprolactine bij ratten in een voedingsonderzoek van 5 weken met de doses die werden gebruikt in het carcinogeniteitsonderzoek. De relevantie voor het risico bij de mens van de bevindingen van prolactine-gemedieerde endocriene tumoren bij knaagdieren is niet bekend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Mutagenese
Ziprasidon werd getest in de Ames-test op bacteriële mutatie, de in vitro-test op genmutatie van muizenlymfoom bij zoogdieren, de in vitro-test op chromosomale aberratie in menselijke lymfocyten en de in-vivo-test op chromosomale aberratie in beenmerg van muizen. Er was een reproduceerbare mutagene respons in de Ames-assay in één stam van S. typhimurium in afwezigheid van metabole activering. Positieve resultaten werden verkregen in zowel de in vitro genmutatietest bij zoogdiercellen als de in vitro chromosomale aberratietest in menselijke lymfocyten.
Aantasting van de vruchtbaarheid
Ziprasidon bleek de tijd tot copulatie te verlengen bij Sprague-Dawley-ratten in twee vruchtbaarheids- en vroege embryonale ontwikkelingsstudies met doses van 10 tot 160 mg/kg/dag (0,5 tot 8 maal de MRHD van 200 mg/dag op basis van mg/m2 oppervlakte). De vruchtbaarheidsgraad was verlaagd met 160 mg/kg/dag (8 keer de MRHD op basis van mg/m2 lichaamsoppervlak). Er was geen effect op de vruchtbaarheid bij 40 mg/kg/dag (2 maal de MRHD op basis van mg/m2 lichaamsoppervlak). Het effect op de vruchtbaarheid bleek bij het vrouwtje te zijn, aangezien de vruchtbaarheid niet werd aangetast wanneer mannetjes die 160 mg/kg/dag kregen (8 keer de MRHD op basis van mg/m2 lichaamsoppervlak) werden gedekt met onbehandelde vrouwtjes.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een zwangerschapsblootstellingsregister dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap zijn blootgesteld aan atypische antipsychotica, waaronder GEODON 40 mg. Zorgverleners worden aangemoedigd om patiënten te registreren door contact op te nemen met de National Pregnancy Registry for Atypical Antipsychotics op 1-866-961-2388 of online op http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risico Samenvatting
Pasgeborenen die tijdens het derde trimester zijn blootgesteld aan antipsychotica, waaronder GEODON, lopen risico op extrapiramidale en/of ontwenningsverschijnselen na de bevalling (zie Klinische overwegingen ). Over het geheel genomen beschikbare gegevens van gepubliceerde epidemiologische onderzoeken van zwangere vrouwen die zijn blootgesteld aan ziprasidon hebben geen geneesmiddelgerelateerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten aangetoond (zie Gegevens ). Er zijn risico's voor de moeder verbonden aan onbehandelde schizofrenie of bipolaire I-stoornis en met blootstelling aan antipsychotica, waaronder GEODON, tijdens de zwangerschap (zie Klinische overwegingen ).
In dierstudies veroorzaakte toediening van ziprasidon aan drachtige ratten en konijnen tijdens de organogenese ontwikkelingstoxiciteit bij doses die vergelijkbaar waren met de aanbevolen doses voor de mens, en was het teratogeen bij konijnen bij driemaal de maximaal aanbevolen dosis voor de mens (MRHD). Ratten die tijdens de dracht en lactatie aan ziprasidon werden blootgesteld, vertoonden een verhoogde perinatale sterfte van de jongen en een vertraagde neurologische gedrags- en functionele ontwikkeling van de nakomelingen bij doses die lager waren dan of vergelijkbaar waren met de therapeutische doses bij de mens (zie Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo/foetale risico
Er is een risico voor de moeder van onbehandelde schizofrenie of bipolaire I-stoornis, waaronder een verhoogd risico op terugval, ziekenhuisopname en zelfmoord. Schizofrenie en bipolaire I-stoornis zijn geassocieerd met verhoogde ongunstige perinatale uitkomsten, waaronder vroeggeboorte. Het is niet bekend of dit een direct gevolg is van de ziekte of andere comorbide factoren.
Foetale/neonatale bijwerkingen
Extrapiramidale en/of ontwenningsverschijnselen, waaronder agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis zijn gemeld bij pasgeborenen die tijdens het derde trimester van de zwangerschap werden blootgesteld aan antipsychotica, waaronder GEODON. Deze symptomen varieerden in ernst. Controleer pasgeborenen op extrapiramidale en/of ontwenningsverschijnselen en behandel de symptomen op de juiste manier. Sommige pasgeborenen herstelden binnen enkele uren of dagen zonder specifieke behandeling; anderen vereisten langdurige ziekenhuisopname.
Gegevens
Menselijke gegevens
Gepubliceerde gegevens uit observationele studies, geboorteregisters en casusrapporten over het gebruik van atypische antipsychotica tijdens de zwangerschap melden geen duidelijk verband met antipsychotica en ernstige geboorteafwijkingen. Een retrospectief cohortonderzoek uit een Medicaid-database van 9258 vrouwen die tijdens de zwangerschap aan antipsychotica waren blootgesteld, duidde niet op een algeheel verhoogd risico op ernstige geboorteafwijkingen.
Dierlijke gegevens
Wanneer ziprasidon werd toegediend aan drachtige konijnen tijdens de periode van organogenese, werd een verhoogde incidentie van foetale structurele afwijkingen (ventrikelseptumdefecten en andere cardiovasculaire misvormingen en nierveranderingen) waargenomen bij een dosis van 30 mg/kg/dag (3 maal de MRHD). van 200 mg/dag op basis van mg/m2 lichaamsoppervlak). Er waren geen aanwijzingen dat deze ontwikkelingseffecten secundair waren aan maternale toxiciteit. De ontwikkelingsdosis zonder effect was 10 mg/kg/dag (equivalent aan de MRHD op basis van een mg/m2 lichaamsoppervlak). Bij ratten werd embryofoetale toxiciteit (verminderd foetaal gewicht, vertraagde botvorming van het skelet) waargenomen na toediening van 10 tot 160 mg/kg/dag (0,5 tot 8 maal de MRHD op basis van mg/m2 lichaamsoppervlak) tijdens de organogenese of tijdens de dracht, maar er was geen bewijs van teratogeniteit. Doses van 40 en 160 mg/kg/dag (2 en 8 keer de MRHD op basis van mg/m2 lichaamsoppervlak) werden in verband gebracht met maternale toxiciteit. De ontwikkelingsdosis zonder effect is 5 mg/kg/dag (0,2 maal de MRHD op basis van mg/m2 lichaamsoppervlak).
Er was een toename van het aantal dood geboren jongen en een afname van de postnatale overleving gedurende de eerste 4 dagen van de lactatie bij de nakomelingen van vrouwelijke ratten die tijdens de dracht en lactatie werden behandeld met doses van 10 mg/kg/dag (0,5 maal de op MRHD gebaseerde op mg/m2 lichaamsoppervlak) of groter. Vertragingen in de ontwikkeling van de nakomelingen (verminderd gewicht van de pups) en neurologische gedragsstoornissen (oprichten van de ogen) werden waargenomen bij doses van 5 mg/kg/dag (0,2 maal de MRHD op basis van mg/m2 lichaamsoppervlak) of meer. Voor deze effecten is geen no-effect level vastgesteld.
Borstvoeding
Risico Samenvatting
Beperkte gegevens uit een gepubliceerd casusrapport wijzen op de aanwezigheid van ziprasidon in moedermelk. Hoewel er geen meldingen zijn van bijwerkingen bij zuigelingen die borstvoeding krijgen en zijn blootgesteld aan ziprasidon via de moedermelk, zijn er meldingen van overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen) bij zuigelingen die zijn blootgesteld aan andere atypische antipsychotica via de borst. melk (zie Klinische overwegingen ). Er is geen informatie over de effecten van ziprasidon op de melkproductie. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan GEODON en eventuele nadelige effecten op het kind dat borstvoeding krijgt van GEODON 20 mg of van de onderliggende aandoening van de moeder.
Klinische overwegingen
Baby's die aan GEODON zijn blootgesteld, moeten worden gecontroleerd op overmatige sedatie, prikkelbaarheid, slechte voeding en extrapiramidale symptomen (tremoren en abnormale spierbewegingen).
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
vrouwen
Op basis van de farmacologische werking van ziprasidon (D2-antagonisme), kan behandeling met GEODON 40 mg resulteren in een verhoging van de serumprolactinespiegels, wat kan leiden tot een omkeerbare vermindering van de vruchtbaarheid bij vrouwen met reproductief vermogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Niet-klinische toxicologie ].
Pediatrisch gebruik
De veiligheid en werkzaamheid van ziprasidon bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Van het totale aantal proefpersonen in klinische onderzoeken met ziprasidon was 2,4 procent 65 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. Desalniettemin zou de aanwezigheid van meerdere factoren die de farmacodynamische respons op ziprasidon zouden kunnen verhogen of een slechtere tolerantie of orthostase veroorzaken, leiden tot overweging van een lagere startdosis, langzamere titratie en zorgvuldige monitoring tijdens de initiële doseringsperiode voor sommige oudere patiënten.
Ziprasidon intramusculair is niet systematisch geëvalueerd bij oudere patiënten (65 jaar en ouder).
Nierfunctiestoornis
Omdat ziprasidon sterk wordt gemetaboliseerd, waarbij minder dan 1% van het geneesmiddel onveranderd wordt uitgescheiden, is het onwaarschijnlijk dat nierinsufficiëntie alleen een grote invloed heeft op de farmacokinetiek van ziprasidon. De farmacokinetiek van ziprasidon na 8 dagen toediening van 20 mg tweemaal daags was vergelijkbaar bij proefpersonen met verschillende gradaties van nierinsufficiëntie (n=27) en proefpersonen met een normale nierfunctie, wat aangeeft dat dosisaanpassing op basis van de mate van nierinsufficiëntie niet nodig is . Ziprasidon wordt niet verwijderd door hemodialyse.
Intramusculair ziprasidon is niet systematisch geëvalueerd bij oudere patiënten of bij patiënten met lever- of nierinsufficiëntie. Aangezien de cyclodextrine-hulpstof wordt geklaard door nierfiltratie, moet ziprasidon intramusculair met voorzichtigheid worden toegediend aan patiënten met een verminderde nierfunctie [zie KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Aangezien ziprasidon grotendeels door de lever wordt geklaard, zou de aanwezigheid van leverinsufficiëntie naar verwachting de AUC van ziprasidon verhogen; een onderzoek met meervoudige doses van 20 mg tweemaal daags gedurende 5 dagen bij proefpersonen (n=13) met klinisch significante (Childs-Pugh klasse A en B) cirrose bracht een verhoging van de AUC 0-12 van 13% en 34% bij Childs- Pugh Klasse A en B, respectievelijk, vergeleken met een gematchte controlegroep (n=14). Een halfwaardetijd van 7,1 uur werd waargenomen bij personen met cirrose vergeleken met 4,8 uur in de controlegroep.
Leeftijd en geslachtseffecten
In een onderzoek met meerdere doses (8 dagen behandeling) waarbij 32 proefpersonen betrokken waren, was er geen verschil in de farmacokinetiek van ziprasidon tussen mannen en vrouwen of tussen oudere (>65 jaar) en jonge (18 tot 45 jaar) proefpersonen. Bovendien heeft de farmacokinetische populatie-evaluatie van patiënten in gecontroleerde onderzoeken geen bewijs opgeleverd voor klinisch significante leeftijds- of geslachtsgerelateerde verschillen in de farmacokinetiek van ziprasidon. Doseringsaanpassingen voor leeftijd of geslacht worden daarom niet aanbevolen.
Roken
Op basis van in vitro-onderzoeken waarbij menselijke leverenzymen werden gebruikt, is ziprasidon geen substraat voor CYP1A2; roken zou daarom geen effect moeten hebben op de farmacokinetiek van ziprasidon. In overeenstemming met deze in vitro resultaten heeft de farmacokinetische evaluatie van de populatie geen significante farmacokinetische verschillen tussen rokers en niet-rokers aan het licht gebracht.
OVERDOSERING
Menselijke ervaring
In premarketingonderzoeken waarbij meer dan 5400 patiënten en/of normale proefpersonen betrokken waren, werd bij 10 patiënten een accidentele of opzettelijke overdosering van oraal ziprasidon gedocumenteerd. Al deze patiënten overleefden zonder gevolgen. Bij de patiënt die de grootste bevestigde hoeveelheid had ingenomen, 3.240 mg, waren de enige symptomen die werden gemeld minimale sedatie, onduidelijke spraak en voorbijgaande hypertensie (200/95).
Bijwerkingen die werden gemeld bij overdosering met ziprasidon waren extrapiramidale symptomen, slaperigheid, tremor en angst. [zien ONGEWENSTE REACTIES ]
Beheer van overdosering
In geval van acute overdosering, zorg voor een luchtweg en zorg voor voldoende zuurstofvoorziening en ventilatie. Intraveneuze toegang moet worden ingesteld en maagspoeling (na intubatie, als de patiënt bewusteloos is) en toediening van actieve kool samen met een laxeermiddel moeten worden overwogen. De mogelijkheid van obtundatie, toevallen of dystonische reactie van het hoofd en de nek na een overdosis kan een risico op aspiratie met geïnduceerd braken veroorzaken.
Cardiovasculaire monitoring moet onmiddellijk beginnen en moet continue elektrocardiografische monitoring omvatten om mogelijke aritmieën te detecteren. Als anti-aritmische therapie wordt toegediend, dragen disopyramide, procaïnamide en kinidine een theoretisch risico van additieve QT-verlengende effecten die mogelijk additief zijn aan die van ziprasidon.
Hypotensie en collaps van de bloedsomloop moeten worden behandeld met geschikte maatregelen, zoals intraveneuze vloeistoffen. Als sympathicomimetica worden gebruikt voor vasculaire ondersteuning, mogen epinefrine en dopamine niet worden gebruikt, aangezien bèta-stimulatie in combinatie met α1-antagonisme geassocieerd met ziprasidon hypotensie kan verergeren. Evenzo is het redelijk om te verwachten dat de alfa-adrenerge-blokkerende eigenschappen van bretylium additief kunnen zijn voor die van ziprasidon, wat resulteert in problematische hypotensie.
In geval van ernstige extrapiramidale symptomen moet anticholinerge medicatie worden toegediend. Er is geen specifiek tegengif voor ziprasidon en het is niet dialyseerbaar. De mogelijkheid van betrokkenheid van meerdere geneesmiddelen moet worden overwogen. Nauwgezet medisch toezicht en monitoring moeten worden voortgezet totdat de patiënt is hersteld.
CONTRA-INDICATIES
QT-verlenging
Vanwege de dosisgerelateerde verlenging van het QT-interval van ziprasidon en de bekende associatie van fatale aritmieën met QT-verlenging door sommige andere geneesmiddelen, is ziprasidon gecontra-indiceerd:
- bij patiënten met een bekende voorgeschiedenis van QT-verlenging (inclusief congenitaal lang QT-syndroom)
- bij patiënten met een recent acuut myocardinfarct
- bij patiënten met niet-gecompenseerd hartfalen
Er zijn geen farmacokinetische/farmacodynamische onderzoeken uitgevoerd tussen ziprasidon en andere geneesmiddelen die het QT-interval verlengen. Een additief effect van ziprasidon en andere geneesmiddelen die het QT-interval verlengen, kan niet worden uitgesloten. Daarom mag ziprasidon niet worden gegeven met:
- dofetilide, sotalol, kinidine, andere klasse Ia en III anti-aritmica, mesoridazine, thioridazine, chloorpromazine, droperidol, pimozide, sparfloxacine, gatifloxacine, moxifloxacine, halofantrine, mefloquine, pentamidine, arsenicumtrioxide, acetaat.
- andere geneesmiddelen waarvan QT-verlenging is aangetoond als een van hun farmacodynamische effecten en waarvan dit effect wordt beschreven in de volledige voorschrijfinformatie als een contra-indicatie of een omkaderde of vetgedrukte waarschuwing [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
overgevoeligheid
Ziprasidon is gecontra-indiceerd bij personen met een bekende overgevoeligheid voor het product.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van ziprasidon bij de behandeling van de vermelde indicaties zou kunnen worden gemedieerd door een combinatie van dopamine type 2 (D2) en serotonine type 2 (5HT2) antagonisme.
farmacodynamiek
Ziprasidon bindt met relatief hoge affiniteit aan de dopamine D2 en D3, serotonine 5HT2A, 5HT2C, 5HT1A, 5HT1D en α1-adrenerge receptoren (Ki's van respectievelijk 4,8, 7,2, 0,4, 1,3, 3,4, 2 en 10 nM), en met matige affiniteit voor de histamine H1-receptor (Ki=47 nM). Ziprasidon is een antagonist op de D2-, 5HT2A- en 5HT1D-receptoren en een agonist op de 5HT1A-receptor. Ziprasidon remde de synaptische heropname van serotonine en noradrenaline. Er werd geen merkbare affiniteit aangetoond voor andere geteste receptor/bindingsplaatsen, waaronder de cholinerge muscarinereceptor (IC50 >1 M).
Farmacokinetiek
Orale farmacokinetiek
De activiteit van Ziprasidon is voornamelijk te danken aan het moedergeneesmiddel. De farmacokinetiek van meervoudige doses ziprasidon is dosisproportioneel binnen het voorgestelde klinische dosisbereik, en accumulatie van ziprasidon is voorspelbaar bij meervoudige dosering. Eliminatie van ziprasidon vindt voornamelijk plaats via levermetabolisme met een gemiddelde terminale halfwaardetijd van ongeveer 7 uur binnen het voorgestelde klinische dosisbereik. Steady-state concentraties worden binnen één tot drie dagen na toediening bereikt. De gemiddelde schijnbare systemische klaring is 7,5 ml/min/kg. Het is onwaarschijnlijk dat ziprasidon interfereert met het metabolisme van geneesmiddelen die worden gemetaboliseerd door cytochroom P450-enzymen.
Absorptie
Ziprasidon wordt goed geabsorbeerd na orale toediening en bereikt piekplasmaconcentraties in 6 tot 8 uur. De absolute biologische beschikbaarheid van een dosis van 20 mg onder gevoede omstandigheden is ongeveer 60%. De absorptie van ziprasidon wordt tot het dubbele verhoogd in aanwezigheid van voedsel.
Verdeling
Ziprasidon heeft een gemiddeld schijnbaar distributievolume van 1,5 l/kg. Het is voor meer dan 99% gebonden aan plasma-eiwitten en bindt voornamelijk aan albumine en α1-zuurglycoproteïne. De in vitro plasma-eiwitbinding van ziprasidon werd niet veranderd door warfarine of propranolol, twee sterk eiwitgebonden geneesmiddelen, noch veranderde ziprasidon de binding van deze geneesmiddelen in menselijk plasma. Het potentieel voor geneesmiddelinteracties met ziprasidon als gevolg van verplaatsing is dus minimaal.
Metabolisme en eliminatie
Ziprasidon wordt uitgebreid gemetaboliseerd na orale toediening met slechts een kleine hoeveelheid uitgescheiden in de urine (
Intramusculaire farmacokinetiek
Systemische biologische beschikbaarheid
De biologische beschikbaarheid van intramusculair toegediend ziprasidon is 100%. Na intramusculaire toediening van enkelvoudige doses treden piekserumconcentraties doorgaans op ongeveer 60 minuten na de dosis of eerder en de gemiddelde halfwaardetijd (T½) varieert van twee tot vijf uur. Blootstelling neemt dosisafhankelijk toe en na drie dagen intramusculaire toediening wordt weinig accumulatie waargenomen.
Metabolisme en eliminatie
Hoewel het metabolisme en de eliminatie van IM ziprasidon niet systematisch zijn geëvalueerd, wordt niet verwacht dat de intramusculaire toedieningsroute de metabole routes verandert.
Klinische studies
Schizofrenie
De werkzaamheid van oraal ziprasidon bij de behandeling van schizofrenie werd geëvalueerd in 5 placebogecontroleerde onderzoeken, 4 kortetermijnonderzoeken (4 en 6 weken) en één onderhoudsonderzoek. Alle onderzoeken waren bij volwassen opgenomen patiënten, van wie de meeste voldeden aan de DSM III-R-criteria voor schizofrenie. Elke studie omvatte 2 tot 3 vaste doses ziprasidon en placebo. Vier van de 5 onderzoeken waren in staat om ziprasidon te onderscheiden van placebo; één kortdurend onderzoek deed dat niet. Hoewel een enkele haloperidol-arm met een vaste dosis als vergelijkende behandeling was opgenomen in een van de drie kortetermijnonderzoeken, was deze enkele studie niet voldoende om een betrouwbare en valide vergelijking van ziprasidon en haloperidol te geven.
In deze onderzoeken zijn verschillende instrumenten gebruikt om psychiatrische klachten en symptomen te beoordelen. De Brief Psychiatric Rating Scale (BPRS) en de Positive and Negative Syndrome Scale (PANSS) zijn beide multi-item inventarisaties van algemene psychopathologie die gewoonlijk worden gebruikt om de effecten van medicamenteuze behandeling bij schizofrenie te evalueren. Het BPRS-psychosecluster (conceptuele desorganisatie, hallucinerend gedrag, achterdocht en ongebruikelijke gedachteninhoud) wordt als een bijzonder nuttige subgroep beschouwd voor het beoordelen van actief psychotische schizofrene patiënten. Een tweede veelgebruikte beoordeling, de Clinical Global Impression (CGI), weerspiegelt de indruk van een ervaren waarnemer, volledig bekend met de manifestaties van schizofrenie, over de algehele klinische toestand van de patiënt. Daarnaast is in één studie de Scale for Assessing Negative Symptoms (SANS) gebruikt voor het beoordelen van negatieve symptomen.
De resultaten van de orale ziprasidon-onderzoeken bij schizofrenie volgen
- In een 4 weken durende, placebogecontroleerde studie (n=139) waarin 2 vaste doses ziprasidon (20 en 60 mg tweemaal daags) werden vergeleken met placebo, was alleen de 60 mg-dosis superieur aan placebo op de BPRS-totaalscore en de ernst van de CGI. scoren. Deze groep met een hogere dosis was niet superieur aan placebo op het BPRS-psychosecluster of op de SANS.
- In een 6 weken durende, placebogecontroleerde studie (n=302) waarin 2 vaste doses ziprasidon (40 en 80 mg tweemaal daags) werden vergeleken met placebo, waren beide dosisgroepen superieur aan placebo op de BPRS-totaalscore, de BPRS-psychosecluster, de CGI-ernstscore en de PANSS-totaalscores en de negatieve subschaalscores. Hoewel tweemaal daags 80 mg een numeriek groter effect had dan tweemaal daags 40 mg, was het verschil niet statistisch significant.
- In een 6 weken durende, placebogecontroleerde studie (n=419) waarin 3 vaste doses ziprasidon (20, 60 en 100 mg tweemaal daags) werden vergeleken met placebo, waren alle drie de dosisgroepen superieur aan placebo op de PANSS-totaalscore, de BPRS-totaalscore, het BPRS-psychosecluster en de CGI-ernstscore. Alleen de groep met een dosis van tweemaal daags 100 mg was superieur aan placebo op de PANSS-negatieve subschaalscore. Er was geen duidelijk bewijs voor een dosis-responsrelatie binnen het doseringsbereik van 20 mg tweemaal daags tot 100 mg tweemaal daags.
- In een 4 weken durende, placebogecontroleerde studie (n=200) waarin 3 vaste doses ziprasidon (5, 20 en 40 mg tweemaal daags) werden vergeleken, was geen van de dosisgroepen statistisch superieur aan placebo wat betreft enige uitkomst van belang.
- Er werd een onderzoek uitgevoerd bij stabiele chronische of subchronische (CGI-S ≤5 bij baseline) schizofrene intramurale patiënten (n=294) die minimaal twee maanden in het ziekenhuis waren opgenomen. Na een 3-daagse enkelblinde placebo-inloopperiode werden proefpersonen gerandomiseerd naar een van de 3 vaste doses ziprasidon (20 mg, 40 mg of 80 mg tweemaal daags) of placebo en geobserveerd op terugval. Patiënten werden geobserveerd voor "dreigende psychotische terugval", gedefinieerd als CGI-verbeteringsscore van ≤ 6 (veel slechter of zeer veel slechter) en/of scores ≤ 6 (matig ernstig) op de items vijandigheid of weigering van de PANSS op twee opeenvolgende dagen . Ziprasidon was significant superieur aan placebo in tijd tot terugval, zonder significant verschil tussen de verschillende dosisgroepen. Er waren onvoldoende gegevens om populatiesubsets te onderzoeken op basis van leeftijd en ras. Onderzoek van populatiesubsets op basis van geslacht bracht geen differentiële respons aan het licht.
Bipolaire I-stoornis (acute gemengde of manische episodes en onderhoudsbehandeling als aanvulling op lithium of valproaat)
Acute manische en gemengde episodes geassocieerd met bipolaire I-stoornis
De werkzaamheid van ziprasidon werd vastgesteld in 2 placebogecontroleerde, dubbelblinde monotherapieonderzoeken van 3 weken bij patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis, manische of gemengde episode met of zonder psychotische kenmerken. Primaire beoordelingsinstrumenten die werden gebruikt voor het beoordelen van manische symptomen in deze onderzoeken waren: (1) de Mania Rating Scale (MRS), die is afgeleid van de Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) met items gegroepeerd als het Manic Syndrome subschaal (verhoogde stemming, minder behoefte aan slaap, overmatige energie, overmatige activiteit, grootsheid), de subschaal Gedrag en ideatie (prikkelbaarheid, motorische hyperactiviteit, versnelde spraak, snelle gedachten, slecht beoordelingsvermogen) en verminderd inzicht; en (2) de Clinical Global Impression-Severity of Illness Scale (CGI-S), die werd gebruikt om de klinische significantie van de behandelingsrespons te beoordelen.
De resultaten van de orale ziprasidon-onderzoeken bij volwassen bipolaire I-stoornis, manische/gemengde episode volgen: in een 3 weken durende placebogecontroleerde studie (n=210) was de dosis ziprasidon 40 mg tweemaal daags op dag 1 en 80 mg tweemaal daags dagelijks op dag 2. Titratie binnen het bereik van 40-80 mg tweemaal daags (in stappen van 20 mg tweemaal daags) was toegestaan voor de duur van het onderzoek. Ziprasidon was significant effectiever dan placebo bij het verlagen van de MRS-totaalscore en de CGI-S-score. De gemiddelde dagelijkse dosis ziprasidon in deze studie was 132 mg. In een tweede 3 weken durende placebogecontroleerde studie (n=205) was de dosis ziprasidon 40 mg tweemaal daags op dag 1. Titratie binnen het bereik van 40-80 mg tweemaal daags (in stappen van 20 mg tweemaal daags) was toegestaan. voor de duur van de studie (vanaf dag 2). Ziprasidon was significant effectiever dan placebo bij het verlagen van de MRS-totaalscore en de CGI-S-score. De gemiddelde dagelijkse dosis ziprasidon in deze studie was 112 mg.
Onderhoudstherapie
De werkzaamheid van ziprasidon als aanvullende therapie bij lithium of valproaat bij de onderhoudsbehandeling van bipolaire I-stoornis werd vastgesteld in een placebogecontroleerd onderzoek bij patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis. De studie omvatte patiënten van wie de meest recente episode manisch of gemengd was, met of zonder psychotische kenmerken. In de open-labelfase moesten patiënten gedurende ten minste 8 weken worden gestabiliseerd op ziprasidon plus lithium of valproïnezuur om te worden gerandomiseerd. In de dubbelblinde gerandomiseerde fase zetten de patiënten de behandeling met lithium of valproïnezuur voort en werden ze gerandomiseerd om ofwel ziprasidon (tweemaal daags toegediend in totaal 80 mg tot 160 mg per dag) of placebo te krijgen. Over het algemeen gingen patiënten in de onderhoudsfase door met dezelfde dosis waarop ze waren gestabiliseerd tijdens de stabilisatiefase. Het primaire eindpunt in dit onderzoek was de tijd tot herhaling van een stemmingsepisode (manische, gemengde of depressieve episode) die interventie vereiste, wat werd gedefinieerd als een van de volgende: stopzetting vanwege een stemmingsepisode, klinische interventie voor een stemmingsepisode (bijv. start van medicatie of ziekenhuisopname), of Mania Rating Scale-score ≥ 18 of een MADRS-score ≥ 18 (op 2 opeenvolgende beoordelingen met een tussenpoos van niet meer dan 10 dagen). In de open-label stabilisatieperiode werden in totaal 584 proefpersonen behandeld. In de dubbelblinde randomisatieperiode werden 127 proefpersonen behandeld met ziprasidon en 112 proefpersonen met placebo. Ziprasidon was superieur aan placebo in het verlengen van de tijd tot herhaling van een stemmingsepisode. De soorten terugval die werden waargenomen, waren depressieve, manische en gemengde episodes. Depressieve, manische en gemengde episodes waren respectievelijk goed voor 53%, 34% en 13% van het totale aantal terugvalgebeurtenissen in het onderzoek.
Acute behandeling van agitatie bij schizofrenie
De werkzaamheid van intramusculair ziprasidon bij de behandeling van geagiteerde schizofrene patiënten werd vastgesteld in twee kortdurende, dubbelblinde onderzoeken met schizofrene proefpersonen die door de onderzoekers werden beschouwd als "acuut geagiteerd" en die intramusculaire antipsychotica nodig hadden. Bovendien moesten patiënten een score van 3 of meer hebben op ten minste 3 van de volgende items van de PANSS: angst, spanning, vijandigheid en opwinding. De werkzaamheid werd geëvalueerd door analyse van het gebied onder de curve (AUC) van de Behavioural Activity Rating Scale (BARS) en Clinical Global Impression (CGI) ernstclassificatie. De BARS is een zevenpuntsschaal met scores variërend van 1 (moeilijk of niet in staat om wakker te worden) tot 7 (gewelddadig, vereist terughoudendheid). Patiënten' scores op de BARS bij baseline waren meestal 5 (tekenen van openlijke activiteit [fysiek of verbaal], kalmeert met instructies) en vertoonden, zoals bepaald door onderzoekers, een mate van opwinding die intramusculaire therapie rechtvaardigde. Er waren maar weinig patiënten met een score hoger dan 5 op de BARS, aangezien de meest geagiteerde patiënten over het algemeen geen geïnformeerde toestemming konden geven voor deelname aan premarketing klinische onderzoeken.
In beide onderzoeken werden hogere intramusculaire doses ziprasidon vergeleken met een controledosis van 2 mg. In één onderzoek was de hogere dosis 20 mg, die tot 4 keer in de 24 uur van het onderzoek kon worden gegeven, met tussenpozen van niet minder dan 4 uur. In de andere studie was de hogere dosis 10 mg, die tot 4 keer in de 24 uur van de studie kon worden gegeven, met tussenpozen van niet minder dan 2 uur.
De resultaten van de intramusculaire ziprasidon-onderzoeken volgen
PATIËNT INFORMATIE
GEODON® Capsules (ziprasidon)
Informatie voor patiënten die GEODON gebruiken of hun zorgverleners
Dit overzicht bevat belangrijke informatie over GEODON. Het is niet bedoeld om de instructies van uw arts te vervangen. Lees deze informatie zorgvuldig door voordat u GEODON inneemt. Vraag uw arts of apotheker als u deze informatie niet begrijpt of als u meer wilt weten over GEODON.
Wat is GEODON 80 mg?
GEODON is een soort receptgeneesmiddel dat psychotrope wordt genoemd, ook bekend als een atypisch antipsychoticum. GEODON kan worden gebruikt voor de behandeling van symptomen van schizofrenie en acute manische of gemengde episodes geassocieerd met een bipolaire stoornis. GEODON 80 mg kan ook worden gebruikt als onderhoudsbehandeling van bipolaire stoornis indien toegevoegd aan lithium of valproaat.
Wie moet GEODON 20 mg nemen?
Alleen uw arts kan weten of GEODON geschikt voor u is. GEODON 20 mg kan aan u worden voorgeschreven als u schizofrenie of bipolaire stoornis heeft.
Symptomen van schizofrenie kunnen zijn:
- stemmen horen, dingen zien of dingen voelen die er niet zijn (hallucinaties)
- overtuigingen die niet waar zijn (wanen)
- ongewone achterdocht (paranoia)
- teruggetrokken worden van familie en vrienden
Symptomen van manische of gemengde episodes van een bipolaire stoornis kunnen zijn:
- extreem hoge of prikkelbare stemming
- verhoogde energie, activiteit en rusteloosheid
- snelle gedachten of heel snel praten
- gemakkelijk afgeleid
- weinig behoefte aan slaap
Als u reageert op GEODON 40 mg, kunnen uw symptomen verbeteren. Als u doorgaat met het innemen van GEODON 40 mg, is de kans kleiner dat uw symptomen terugkeren. Stop niet met het innemen van de capsules, ook niet als u zich beter voelt zonder dit eerst met uw arts te bespreken.
Het is ook belangrijk om te onthouden dat GEODON 40 mg capsules met voedsel moeten worden ingenomen.
Wat is de belangrijkste veiligheidsinformatie die ik moet weten over GEODON 20mg?
GEODON is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose. Oudere patiënten met de diagnose psychose gerelateerd aan dementie die worden behandeld met antipsychotica, lopen een verhoogd risico op overlijden in vergelijking met patiënten die worden behandeld met placebo (een suikerpil).
GEODON is een effectief medicijn voor de behandeling van de symptomen van schizofrenie en de manische of gemengde episodes van een bipolaire stoornis. Een mogelijke bijwerking is echter dat het de manier waarop de elektrische stroom in uw hart werkt meer kan veranderen dan bij sommige andere geneesmiddelen. De verandering is klein en het is niet bekend of dit schadelijk zal zijn, maar sommige andere geneesmiddelen die dit soort verandering veroorzaken, hebben in zeldzame gevallen gevaarlijke hartritmestoornissen veroorzaakt. Daarom mag GEODON alleen worden gebruikt nadat uw arts dit risico voor GEODON heeft afgewogen tegen de risico's en voordelen van andere medicijnen die beschikbaar zijn voor de behandeling van schizofrenie of bipolaire manische en gemengde episodes.
Uw risico op gevaarlijke veranderingen in het hartritme kan groter zijn als u bepaalde andere geneesmiddelen gebruikt en als u al bepaalde abnormale hartaandoeningen heeft. Daarom is het belangrijk om uw arts te informeren over alle andere geneesmiddelen die u gebruikt, inclusief geneesmiddelen zonder recept, supplementen en kruidengeneesmiddelen. U moet uw arts ook vertellen over eventuele hartproblemen die u heeft of heeft gehad.
Wie mag GEODON 40 mg NIET gebruiken?
Oudere patiënten met de diagnose psychose gerelateerd aan dementie. GEODON is niet goedgekeurd voor de behandeling van deze patiënten.
Alles wat de kans op een hartritmestoornis kan vergroten, moet worden vermeden. Neem GEODON 80 mg daarom niet in als:
- U heeft bepaalde hartaandoeningen, bijvoorbeeld een lang QT-syndroom, een recente hartaanval, ernstig hartfalen of bepaalde onregelmatigheden in het hartritme (bespreek de bijzonderheden met uw arts)
- gebruikt momenteel medicijnen die niet in combinatie met ziprasidon mogen worden ingenomen, bijvoorbeeld dofetilide, sotalol, kinidine, andere antiaritmica van klasse Ia en III, mesoridazine, thioridazine, chloorpromazine, droperidol, pimozide, sparfloxacine, gatifloxacine, moxifloantrine, halofantine , mefloquine, pentamidine, arseentrioxide, levomethadylacetaat, dolasetronmesylaat, probucol of tacrolimus.
Wat u uw arts moet vertellen voordat u met GEODON begint
Alleen uw arts kan beslissen of GEODON geschikt voor u is. Voordat u met GEODON begint, moet u uw arts informeren als u:
- een probleem heeft gehad met de manier waarop uw hart klopt of een hartgerelateerde ziekte of aandoening
- elke familiegeschiedenis van hartaandoeningen, inclusief een recente hartaanval
- problemen heeft gehad met flauwvallen of duizeligheid
- geneesmiddelen op recept gebruikt of onlangs heeft gebruikt
- vrij verkrijgbare medicijnen gebruikt die u zonder recept kunt kopen, inclusief natuurlijke/kruidengeneesmiddelen
- problemen met uw lever heeft gehad
- zwanger bent, mogelijk zwanger bent of van plan bent zwanger te worden
- borstvoeding geeft of van plan bent borstvoeding te geven
- zijn allergisch voor medicijnen
- ooit een allergische reactie heeft gehad op ziprasidon of op een van de andere bestanddelen van GEODON 20 mg capsules. Vraag uw arts of apotheker om een lijst van deze ingrediënten
- een laag kalium- of magnesiumgehalte in uw bloed heeft
Het kan zijn dat uw arts wil dat u aanvullende laboratoriumtests krijgt om te zien of GEODON 40 mg een geschikte behandeling voor u is.
GEODON en andere medicijnen
Er zijn enkele medicijnen die mogelijk onveilig zijn om te gebruiken bij het gebruik van GEODON, en er zijn enkele medicijnen die de werking van GEODON 40 mg kunnen beïnvloeden. Terwijl u GEODON gebruikt, moet u uw arts raadplegen voordat u begint met een nieuw recept of vrij verkrijgbare medicijnen, inclusief natuurlijke / kruidengeneesmiddelen.
Hoe GEODON in te nemen?
- Neem GEODON alleen in zoals voorgeschreven door uw arts.
- Slik GEODON capsules heel door. De capsules niet kauwen, pletten of openen.
- Neem GEODON 40 mg capsules in met voedsel.
- Het is het beste om GEODON 80 mg elke dag op hetzelfde tijdstip in te nemen.
- GEODON 80 mg kan enkele weken nodig hebben om te werken. Het is belangrijk om geduld te hebben.
- Verander uw dosis niet en stop niet met het innemen van uw geneesmiddel zonder toestemming van uw arts.
- Denk eraan uw capsules te blijven innemen, ook als u zich beter voelt.
Mogelijke bijwerkingen
Omdat deze problemen kunnen betekenen dat u een hartritmestoornis heeft, neem dan contact op met uw arts DIRECT als jij:
- Flauwvallen of bewustzijn verliezen
- Een verandering voelen in de manier waarop uw hart klopt (hartkloppingen)
Vaak voorkomende bijwerkingen van GEODON zijn de volgende en moeten ook met uw arts worden besproken als ze optreden:
- Zich ongewoon moe of slaperig voelen
- Misselijkheid of maagklachten
- Constipatie
- Duizeligheid
- Rusteloosheid
- Abnormale spierbewegingen, waaronder tremor, schuifelen en ongecontroleerde onwillekeurige bewegingen
- Diarree
- Uitslag
- Verhoogde hoest/loopneus
Als u bijwerkingen krijgt die u zorgen baren, neem dan contact op met uw arts. Het is vooral belangrijk om het uw arts te vertellen als u diarree, braken of een andere ziekte heeft waardoor u vocht kunt verliezen. Uw arts wil mogelijk uw bloed controleren om er zeker van te zijn dat u de juiste hoeveelheid belangrijke zouten heeft na dergelijke ziekten.
Vraag voor een lijst van alle gemelde bijwerkingen uw arts of apotheker om de GEODON Professional Bijsluiter.
Wat te doen bij een overdosis?
Bel in geval van een overdosis onmiddellijk uw arts of het antigifcentrum of ga naar de dichtstbijzijnde eerste hulpafdeling.
Andere belangrijke veiligheidsinformatie
Een ernstige aandoening die maligne neurolepticasyndroom (MNS) wordt genoemd, kan optreden bij alle antipsychotica, waaronder GEODON. Tekenen van MNS zijn onder meer zeer hoge koorts, stijve spieren, beven, verwardheid, zweten of een verhoogde hartslag en bloeddruk. MNS is een zeldzame maar ernstige bijwerking die fataal kan zijn. Vertel het uw arts daarom als u een van deze symptomen ervaart.
Geneesmiddelreactie met vertraagde aanvang genaamd geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) kan optreden bij ziprasidon. Tekenen van DRESS kunnen huiduitslag, koorts en gezwollen lymfeklieren zijn. Andere ernstige bijwerkingen van de huid (SCAR), zoals het Stevens-Johnson-syndroom kunnen optreden met ziprasidon. Tekenen van het Stevens-Johnson-syndroom kunnen huiduitslag met blaren omvatten, waaronder zweren in de mond, huidafscheiding, koorts en doelachtige vlekken op de huid. JURK en andere LITTEKENS zijn soms dodelijk; vertel het daarom onmiddellijk aan uw arts als u een van deze symptomen ervaart.
Bijwerkingen gerelateerd aan een hoge bloedsuikerspiegel (hyperglykemie), soms ernstig, zijn gemeld bij patiënten die werden behandeld met atypische antipsychotica. Er zijn weinig meldingen geweest van hyperglykemie of diabetes bij patiënten die met GEODON werden behandeld, en het is niet bekend of GEODON in verband wordt gebracht met deze reacties. Patiënten die met een atypisch antipsychoticum worden behandeld, moeten worden gecontroleerd op symptomen van hyperglykemie.
Duizeligheid veroorzaakt door een daling van uw bloeddruk kan optreden met GEODON, vooral wanneer u voor het eerst met dit medicijn begint of wanneer de dosis wordt verhoogd. Als dit gebeurt, pas dan op dat u niet te snel opstaat en praat met uw arts over het probleem.
Vertel uw arts voordat u GEODON inneemt als u:
- zwanger bent of van plan bent zwanger te worden.
- Als u zwanger wordt terwijl u GEODON 80 mg krijgt, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Atypische Antipsychotica. U kunt zich registreren door te bellen naar 1-866-961-2388 of ga naar: http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- borstvoeding geeft of van plan bent borstvoeding te geven. GEODON 40 mg kan in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden als u GEODON krijgt.
Omdat GEODON 80 mg slaperigheid kan veroorzaken, moet u voorzichtig zijn bij het bedienen van machines of het besturen van een motorvoertuig.
Aangezien medicijnen van dezelfde klasse als GEODON het vermogen van het lichaam om zich aan te passen aan warmte kunnen verstoren, is het het beste om situaties met hoge temperaturen of vochtigheid te vermijden.
Het is het beste om geen alcoholische dranken te nuttigen tijdens het gebruik van GEODON.
Bel je dokter direct als u meer heeft ingenomen dan de door uw arts voorgeschreven hoeveelheid GEODON.
Het is niet aangetoond dat GEODON veilig of effectief is bij de behandeling van kinderen en tieners onder de 18 jaar.
Houd GEODON 80 mg en alle geneesmiddelen buiten het bereik van kinderen.
Hoe bewaart u GEODON
Bewaar GEODON 20 mg capsules bij kamertemperatuur (59 ° F tot 86 ° F of 15 ° C tot 30 ° C).
Voor meer informatie over GEODON
Dit blad is slechts een samenvatting. GEODON 20 mg is een receptgeneesmiddel en alleen uw arts kan beslissen of het geschikt voor u is. Als u vragen heeft of meer informatie wilt over GEODON, neem dan contact op met uw arts of apotheker. U kunt ook een bezoek brengen aan www.geodon.com.
De etikettering van dit product is mogelijk bijgewerkt. Ga voor de meest recente voorschrijfinformatie naar www.pfizer.com
