Tofranil 25mg, 50mg, 75mg Imipramine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Tofranil en hoe wordt het gebruikt?
Tofranil 50 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van depressie te behandelen. Tofranil 25 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Tofranil behoort tot een klasse geneesmiddelen die antidepressiva, TCA's, worden genoemd.
Het is niet bekend of Tofranil veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Tofranil 50 mg?
Tofranil kan ernstige bijwerkingen veroorzaken, waaronder:
- stemmings- of gedragsveranderingen,
- ongerustheid,
- paniekaanvallen,
- Moeite met slapen,
- impulsief gedrag,
- prikkelbaarheid,
- agitatie,
- vijandigheid,
- agressie,
- rusteloosheid,
- hyperactiviteit (mentaal of fysiek),
- meer depressie,
- zelfmoordgedachten,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- duizeligheid,
- nieuwe of verergerende pijn op de borst,
- bonzende hartslagen,
- fladderend in je borst,
- plotselinge gevoelloosheid of zwakte,
- problemen met zicht, spraak of evenwicht,
- koorts,
- keelpijn,
- verwardheid,
- hallucinaties,
- ongewone gedachten of gedrag,
- pijnlijk of moeilijk plassen,
- toevallen, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Tofranil zijn:
- tintelend gevoel,
- zwakheid,
- gebrek aan coordinatie,
- droge mond,
- misselijkheid,
- braken,
- constipatie,
- diarree,
- visie verandert,
- in je oren rinkelen,
- borstwelling (zowel mannen als vrouwen),
- verminderde zin in seks,
- impotentie, en
- moeite met een orgasme
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Tofranil. Vraag uw arts of apotheker om meer informatie.
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van imipraminehydrochloride of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Imipraminehydrochloride is niet goedgekeurd voor gebruik bij pediatrische patiënten (zie: WAARSCHUWINGEN Klinische verslechtering en zelfmoordrisico; PREVENTIEVE MAATREGELEN Informatie voor patiënten; en PREVENTIEVE MAATREGELEN , pediatrisch gebruik).
OMSCHRIJVING
Tofranil™ wordt geleverd in tabletvorm voor orale toediening.
Tofranil 75 mg, imipraminehydrochloride USP, het oorspronkelijke tricyclische antidepressivum, is een lid van de dibenzazepine-groep van verbindingen. Het wordt 5-3-(dimethylamino)propyl-10,11-dihydro-5Hdibenz [b,f]-azepinemonohydrochloride genoemd. De structuurformule is:
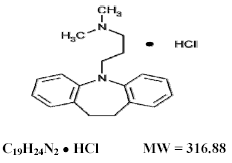
Imipramine hydrochloride USP is een wit tot gebroken wit, geurloos of praktisch geurloos kristallijn poeder. Het is vrij oplosbaar in water en in alcohol, oplosbaar in aceton en onoplosbaar in ether en benzeen.
inactieve ingredienten
Calciumfosfaat, celluloseverbindingen, docusaatnatrium, ijzeroxiden, magnesiumstearaat, polyethyleenglycol, povidon, natriumzetmeelglycolaat, sucrose, talk en titaniumdioxide.
INDICATIES
Depressie
Voor de verlichting van symptomen van depressie. Endogene depressie zal eerder worden verlicht dan andere depressieve toestanden. Een tot drie weken behandeling kan nodig zijn voordat optimale therapeutische effecten duidelijk zijn.
Enuresis bij kinderen
Kan nuttig zijn als tijdelijke aanvullende therapie bij het verminderen van enuresis bij kinderen van 6 jaar en ouder, nadat mogelijke organische oorzaken door geschikte tests zijn uitgesloten. Bij patiënten die overdag symptomen van frequentie en urgentie hebben, moet het onderzoek zo nodig mictiecystourethrografie en cystoscopie omvatten. De effectiviteit van de behandeling kan afnemen bij voortgezette toediening van het geneesmiddel.
DOSERING EN ADMINISTRATIE
Depressie
Lagere doseringen worden aanbevolen voor oudere patiënten en adolescenten. Lagere doseringen worden ook aanbevolen voor poliklinische patiënten in vergelijking met gehospitaliseerde patiënten die onder nauwlettend toezicht zullen staan. De dosering moet op een laag niveau worden gestart en geleidelijk worden verhoogd, waarbij zorgvuldig moet worden gelet op de klinische respons en eventuele aanwijzingen voor intolerantie. Na remissie kan onderhoudsmedicatie voor een langere periode nodig zijn, in de laagste dosis die remissie handhaaft.
Gebruikelijke dosis voor volwassenen
gehospitaliseerde patiënten
Aanvankelijk werd 100 mg/dag in verdeelde doses geleidelijk verhoogd tot 200 mg/dag zoals vereist. Als er na twee weken geen respons is, verhoog dan tot 250 tot 300 mg/dag.
poliklinische patiënten
Aanvankelijk werd 75 mg/dag verhoogd tot 150 mg/dag. Doseringen hoger dan 200 mg/dag worden niet aanbevolen. Onderhoud, 50 tot 150 mg/dag.
Adolescente en geriatrische patiënten
Aanvankelijk 30 tot 40 mg/dag; het is over het algemeen niet nodig om 100 mg/dag te overschrijden.
Enuresis bij kinderen
In eerste instantie moet een orale dosis van 25 mg/dag worden geprobeerd bij kinderen van 6 jaar en ouder. Medicatie moet een uur voor het slapengaan worden gegeven. Als er binnen een week geen bevredigende respons optreedt, verhoog dan de dosis tot 50 mg per nacht bij kinderen jonger dan 12 jaar; kinderen ouder dan 12 jaar kunnen tot 75 mg per nacht krijgen. Een dagelijkse dosis van meer dan 75 mg verhoogt de werkzaamheid niet en heeft de neiging de bijwerkingen te vergroten. Er zijn aanwijzingen dat het medicijn bij bedplassers in de vroege nacht effectiever is als het eerder en in verdeelde hoeveelheden wordt gegeven, dwz 25 mg halverwege de middag, herhaald voor het slapengaan. Er moet worden overwogen om een geneesmiddelvrije periode in te stellen na een adequaat therapeutisch onderzoek met een gunstige respons. De dosering moet geleidelijk worden afgebouwd in plaats van abrupt te worden stopgezet; dit kan de neiging tot terugval verminderen. Kinderen die terugvallen wanneer het medicijn wordt stopgezet, reageren niet altijd op een volgende behandelingskuur.
Een dosis van 2,5 mg/kg/dag mag niet worden overschreden. ECG-veranderingen van onbekende betekenis zijn gemeld bij pediatrische patiënten met doses die tweemaal zo hoog waren.
De veiligheid en werkzaamheid van Tofranil als tijdelijke aanvullende therapie voor enuresis nocturna bij kinderen jonger dan 6 jaar zijn niet vastgesteld.
HOE GELEVERD
De drie sterke punten van Tofranil ™ (imipramine hydrochloride USP) zijn als volgt beschikbaar:
– driehoekige, biconvexe, koraalroodbruine, met suiker omhulde tablet, bedrukt met aan de ene kant en “10” aan de andere kant in zwart.
Flessen van 30 NDC 0406-9920-03 Flessen van 100 NDC 0406-9920-01
– ronde, biconvexe, koraalroodbruine, met suiker omhulde tablet, bedrukt met aan de ene kant en “25” aan de andere kant in zwart.
Flessen van 30 NDC 0406-9921-03 Flessen van 100 NDC 0406-9921-01
– ronde, biconvexe, koraalroodbruine, met suiker omhulde tablet, bedrukt met aan de ene kant en “50” aan de andere kant in zwart.
Flessen van 30 NDC 0406-9922-03 Flessen van 100 NDC 0406-9922-01
Bewaren bij 20 ° tot 25 ° C (68 ° tot 77 ° F) (zie USP-gecontroleerde kamertemperatuur).
Doseer in een strakke container (USP) met een kindveilige sluiting.
Gefabriceerd door: Patheon Inc. Whitby, Ontario, Canada, L1N 5Z5. Herzien: april 2017
BIJWERKINGEN
Opmerking – Hoewel de onderstaande lijst enkele bijwerkingen bevat die niet zijn gemeld met dit specifieke geneesmiddel, vereisen de farmacologische overeenkomsten tussen de tricyclische antidepressiva dat elk van de reacties in overweging wordt genomen wanneer Tofranil 25 mg wordt toegediend.
Cardiovasculair: Orthostatische hypotensie, hypertensie, tachycardie, hartkloppingen, myocardinfarct, aritmieën, hartblok, ECG-veranderingen, neerslag van congestief hartfalen, beroerte.
Psychiatrisch: Verwarde toestanden (vooral bij ouderen) met hallucinaties, desoriëntatie, wanen; angst, rusteloosheid, opwinding; slapeloosheid en nachtmerries; hypomanie; verergering van psychose.
Neurologisch: Gevoelloosheid, tintelingen, paresthesieën van ledematen; coördinatiestoornissen, ataxie, tremoren; perifere neuropathie; extrapiramidale symptomen; toevallen, veranderingen in EEG-patronen; oorsuizen.
Anticholinergisch: Droge mond en, zelden, geassocieerde sublinguale adenitis; wazig zien, accommodatiestoornissen, mydriasis; constipatie, paralytische ileus; urineretentie, vertraagde mictie, verwijding van de urinewegen.
Allergisch: Huiduitslag, petechiën, urticaria, jeuk, fotosensibilisatie; oedeem (algemeen of van gezicht en tong); drugskoorts; kruisgevoeligheid met desipramine.
Hematologische: Beenmergdepressie inclusief agranulocytose; eosinofilie; purpura; trombocytopenie.
Gastro-intestinaal: Misselijkheid en braken, anorexia, epigastrische nood, diarree; eigenaardige smaak, stomatitis, buikkrampen, zwarte tong.
Endocrien: Gynaecomastie bij de man; borstvergroting en galactorroe bij de vrouw; verhoogd of verlaagd libido, impotentie; testiculaire zwelling; verhoging of verlaging van de bloedsuikerspiegel; ongepast antidiuretisch hormoon (ADH) secretiesyndroom.
Ander: Geelzucht (obstructief simuleren); veranderde leverfunctie; gewichtstoename of -verlies; transpiratie; blozen; urinaire frequentie; slaperigheid, duizeligheid, zwakte en vermoeidheid; hoofdpijn; parotis zwelling; alopecia; neiging tot vallen.
Ontwenningsverschijnselen: Hoewel dit niet indicatief is voor verslaving, kan abrupte stopzetting van de behandeling na langdurige therapie misselijkheid, hoofdpijn en malaise veroorzaken.
Opmerking – Bij enuretische kinderen die werden behandeld met Tofranil 75 mg waren de meest voorkomende bijwerkingen nervositeit, slaapstoornissen, vermoeidheid en milde gastro-intestinale stoornissen. Deze verdwijnen gewoonlijk tijdens voortgezette toediening van het geneesmiddel of wanneer de dosering wordt verlaagd. Andere gemelde reacties zijn onder meer constipatie, convulsies, angst, emotionele instabiliteit, syncope en collaps. Alle bijwerkingen die bij gebruik door volwassenen zijn gemeld, moeten in overweging worden genomen.
DRUG-INTERACTIES
Geneesmiddelen gemetaboliseerd door P450 2D6
De biochemische activiteit van het geneesmiddel metaboliserende isozym cytochroom P450 2D6 (debrisoquin hydroxylase) is verminderd in een subgroep van de blanke populatie (ongeveer 7% tot 10% van de blanken zijn zogenaamde "slechte metaboliseerders"); betrouwbare schattingen van de prevalentie van verminderde P450 2D6-isozymactiviteit onder Aziatische, Afrikaanse en andere populaties zijn nog niet beschikbaar. Slechte metaboliseerders hebben hoger dan verwachte plasmaconcentraties van tricyclische antidepressiva (TCA's) wanneer ze de gebruikelijke doses krijgen. Afhankelijk van de fractie van het geneesmiddel die door P450 2D6 wordt gemetaboliseerd, kan de toename van de plasmaconcentratie klein of vrij groot zijn (8-voudige toename van de plasma-AUC van de TCA).
Bovendien remmen bepaalde geneesmiddelen de activiteit van dit isozym en zorgen ervoor dat normale metaboliseerders lijken op slechte metaboliseerders. Een persoon die stabiel is op een bepaalde dosis TCA kan abrupt toxisch worden wanneer een van deze remmende geneesmiddelen als gelijktijdige therapie wordt gegeven. De geneesmiddelen die cytochroom P450 2D6 remmen, omvatten enkele die niet door het enzym worden gemetaboliseerd (kinidine; cimetidine) en vele die substraten zijn voor P450 2D6 (veel andere antidepressiva, fenothiazinen en de type 1C-antiaritmica propafenon en flecaïnide). Hoewel alle selectieve serotonineheropnameremmers (SSRI's), bijv. fluoxetine, sertraline en paroxetine, P450 2D6 remmen, kunnen ze variëren in de mate van remming. De mate waarin SSRI-TCA-interactie klinische problemen kan opleveren, hangt af van de mate van remming en de farmacokinetiek van de betrokken SSRI. Niettemin is voorzichtigheid geboden bij gelijktijdige toediening van TCA's met een van de SSRI's en ook bij het overschakelen van de ene klasse naar de andere. Van bijzonder belang is dat er voldoende tijd moet verstrijken voordat de TCA-behandeling wordt gestart bij een patiënt die wordt gestopt met fluoxetine, gezien de lange halfwaardetijd van de ouder en de actieve metaboliet (minimaal 5 weken kan nodig zijn).
Gelijktijdig gebruik van tricyclische antidepressiva met geneesmiddelen die cytochroom P450 2D6 kunnen remmen, kan lagere doses vereisen dan gewoonlijk wordt voorgeschreven voor het tricyclische antidepressivum of het andere geneesmiddel. Bovendien kan, wanneer een van deze andere geneesmiddelen uit de gelijktijdige therapie wordt gestaakt, een verhoogde dosis tricyclische antidepressiva nodig zijn. Het is wenselijk om de TCA-plasmaspiegels te controleren wanneer een TCA gelijktijdig wordt toegediend met een ander geneesmiddel waarvan bekend is dat het een remmer van P450 2D6 is.
De plasmaconcentratie van imipramine kan toenemen wanneer het geneesmiddel gelijktijdig wordt gegeven met leverenzymremmers (bijv. cimetidine, fluoxetine) en afnemen door gelijktijdige toediening met leverenzyminductoren (bijv. barbituraten, fenytoïne), en aanpassing van de dosering van imipramine kan daarom nodig zijn.
Bij incidentele gevoelige patiënten of bij degenen die anticholinergica krijgen (inclusief antiparkinsonmiddelen) kunnen bovendien de atropine-achtige effecten meer uitgesproken worden (bijv. paralytische ileus). Nauwlettend toezicht en zorgvuldige aanpassing van de dosering zijn vereist wanneer imipraminehydrochloride gelijktijdig met anticholinergica wordt toegediend.
Vermijd het gebruik van preparaten, zoals decongestiva en lokale anesthetica, die sympathicomimetische amines bevatten (bijv. epinefrine, norepinefrine), aangezien is gemeld dat tricyclische antidepressiva de effecten van catecholamines kunnen versterken.
Voorzichtigheid is geboden wanneer imipraminehydrochloride wordt gebruikt in combinatie met bloeddrukverlagende middelen. Imipraminehydrochloride kan de effecten van CZS-depressiva versterken.
Patiënten moeten worden gewaarschuwd dat imipraminehydrochloride de CZS-depressieve effecten van alcohol kan versterken (zie: WAARSCHUWINGEN ).
WAARSCHUWINGEN
Klinische verslechtering en zelfmoordrisico
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18 tot 24 jaar) met depressieve stoornis (MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in Tabel 1.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor imipraminehydrochloride moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat imipraminehydrochloride niet is goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder Tofranil, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
Kinderen
Een dosis van 2,5 mg/kg/dag Tofranil 25 mg mag bij kinderen niet worden overschreden. ECG-veranderingen van onbekende betekenis zijn gemeld bij pediatrische patiënten met doses die tweemaal zo hoog waren.
Uiterste voorzichtigheid is geboden wanneer dit geneesmiddel wordt gegeven aan: patiënten met hart- en vaatziekten vanwege de mogelijkheid van geleidingsstoornissen, aritmieën, congestief hartfalen, myocardinfarct, beroertes en tachycardie. Deze patiënten hebben hartbewaking nodig bij alle doseringsniveaus van het geneesmiddel;
patiënten met een voorgeschiedenis van urineretentie of een voorgeschiedenis van nauwekamerhoekglaucoom vanwege de anticholinerge eigenschappen van het geneesmiddel; patiënten met hyperthyreoïdie of patiënten die schildkliermedicatie gebruiken vanwege de mogelijkheid van cardiovasculaire toxiciteit;
patiënten met een voorgeschiedenis van convulsies, omdat is aangetoond dat dit geneesmiddel de drempel voor convulsies verlaagt;
patiënten die guanethidine, clonidine of soortgelijke middelen krijgen, aangezien Tofranil de farmacologische effecten van deze geneesmiddelen kan blokkeren;
patiënten die methylfenidaathydrochloride krijgen. Aangezien methylfenidaathydrochloride het metabolisme van 75 mg tofranil kan remmen, kan een neerwaartse aanpassing van de dosering van imipraminehydrochloride nodig zijn bij gelijktijdige toediening met methylfenidaathydrochloride.
Tofranil kan de CZS-onderdrukkende effecten van alcohol versterken. Daarom moet er rekening mee worden gehouden dat de gevaren die inherent zijn aan een zelfmoordpoging of accidentele overdosering met het geneesmiddel kunnen toenemen voor de patiënt die overmatige hoeveelheden alcohol gebruikt (zie PREVENTIEVE MAATREGELEN ).
Aangezien Tofranil de mentale en/of fysieke vermogens kan aantasten die nodig zijn voor het uitvoeren van potentieel gevaarlijke taken, zoals het besturen van een auto of machines, moet de patiënt dienovereenkomstig worden gewaarschuwd.
PREVENTIEVE MAATREGELEN
Algemeen
Er moet een ECG-opname worden gemaakt voordat wordt gestart met hogere dan gebruikelijke doses Tofranil en daarna met passende tussenpozen totdat steady-state is bereikt. (Patiënten met enig bewijs van hart- en vaatziekten hebben hartbewaking nodig bij alle doseringsniveaus van het geneesmiddel. Zie WAARSCHUWINGEN .) Oudere patiënten en patiënten met hartaandoeningen of een voorgeschiedenis van hartaandoeningen lopen een speciaal risico op het ontwikkelen van hartafwijkingen die verband houden met het gebruik van Tofranil.
Houd er rekening mee dat de mogelijkheid van zelfmoord bij ernstig depressieve patiënten inherent is aan de ziekte en kan aanhouden totdat er significante remissie optreedt. Dergelijke patiënten moeten tijdens de vroege fase van de behandeling met Tofranil 75 mg zorgvuldig worden gecontroleerd en kunnen ziekenhuisopname vereisen. Voorschriften moeten worden geschreven voor de kleinst mogelijke hoeveelheid. Hypomanische of manische episodes kunnen optreden, vooral bij patiënten met cyclische stoornissen. Dergelijke reacties kunnen het staken van het geneesmiddel noodzakelijk maken. Indien nodig kan Tofranil 75 mg worden hervat in een lagere dosering wanneer deze episodes zijn verlicht.
Toediening van een kalmeringsmiddel kan nuttig zijn bij het beheersen van dergelijke episodes.
Een activering van de psychose kan af en toe worden waargenomen bij schizofrene patiënten en kan een verlaging van de dosering en de toevoeging van een fenothiazine vereisen.
Gelijktijdige toediening van Tofranil 50 mg met elektroshocktherapie kan de risico's vergroten; een dergelijke behandeling moet worden beperkt tot die patiënten voor wie het essentieel is, aangezien er beperkte klinische ervaring is.
Patiënten die imipraminehydrochloride gebruiken, moeten overmatige blootstelling aan zonlicht vermijden, aangezien er meldingen zijn geweest van fotosensibilisatie.
Zowel verhoging als verlaging van de bloedsuikerspiegel zijn gemeld bij gebruik van imipraminehydrochloride.
Imipraminehydrochloride moet met voorzichtigheid worden gebruikt bij patiënten met een significant verminderde nier- of leverfunctie.
Bij patiënten die koorts en keelpijn krijgen tijdens de behandeling met imipraminehydrochloride, moeten leukocyten en differentiële bloedtellingen worden uitgevoerd. Imipraminehydrochloride moet worden stopgezet als er aanwijzingen zijn voor pathologische neutrofiele depressie.
Voorafgaand aan een electieve operatie moet imipraminehydrochloride worden gestaakt zolang de klinische situatie dit toelaat.
Informatie voor patiënten
Voorschrijvers of andere gezondheidswerkers moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van behandeling met imipraminehydrochloride en hen adviseren bij het juiste gebruik ervan. Een patiënt Medicatiegids over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties" is beschikbaar voor imipraminehydrochloride. De voorschrijver of gezondheidswerker moet patiënten, hun families en hun zorgverleners instrueren om de medicatiehandleiding te lezen en moet hen helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de medicatiehandleiding te bespreken en om antwoord te krijgen op eventuele vragen. De volledige tekst van de medicatiehandleiding is herdrukt aan het einde van dit document.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze optreden tijdens het gebruik van imipraminehydrochloride.
Patiënten moeten erop worden gewezen dat het gebruik van Tofranil lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen mogelijk worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn.
Klinische verslechtering en zelfmoordrisico
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten aan de voorschrijver van de patiënt of gezondheidswerker worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen die de patiënt vertoont. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak tot zeer nauwgezette monitoring en mogelijk wijzigingen in de medicatie.
Zwangerschap
Reproductiestudies bij dieren hebben geen overtuigende resultaten opgeleverd (zie ook: Dierlijke farmacologie ).
Er zijn geen goed gecontroleerde onderzoeken uitgevoerd bij zwangere vrouwen om het effect van Tofranil op de foetus te bepalen. Er zijn echter klinische meldingen geweest van aangeboren afwijkingen die verband houden met het gebruik van het geneesmiddel. Hoewel een causaal verband tussen deze effecten en het geneesmiddel niet kon worden vastgesteld, kan de mogelijkheid van foetaal risico door de maternale inname van Tofranil niet worden uitgesloten. Daarom mag Tofranil alleen worden gebruikt bij vrouwen die zwanger zijn of kunnen worden als de klinische toestand het mogelijke risico voor de foetus duidelijk rechtvaardigt.
Moeders die borstvoeding geven
Beperkte gegevens suggereren dat Tofranil 75 mg waarschijnlijk wordt uitgescheiden in de moedermelk. Als algemene regel geldt dat een vrouw die een geneesmiddel gebruikt, geen borstvoeding mag geven, aangezien de mogelijkheid bestaat dat het geneesmiddel wordt uitgescheiden in de moedermelk en schadelijk is voor het kind.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij de pediatrische populatie anders dan pediatrische patiënten met enuresis nocturna zijn niet vastgesteld (zie: DOOS WAARSCHUWING: en WAARSCHUWINGEN , Klinische verslechtering en zelfmoordrisico ). Iedereen die het gebruik van imipraminehydrochloride bij een kind of adolescent overweegt, moet de mogelijke risico's afwegen tegen de klinische noodzaak.
De veiligheid en werkzaamheid van het geneesmiddel als tijdelijke aanvullende therapie voor enuresis nocturna bij pediatrische patiënten jonger dan 6 jaar zijn niet vastgesteld.
De veiligheid van het geneesmiddel voor langdurig, chronisch gebruik als aanvullende therapie voor nachtelijke enuresis bij pediatrische patiënten van 6 jaar of ouder is niet vastgesteld; er moet worden overwogen om een geneesmiddelvrije periode in te stellen na een adequaat therapeutisch onderzoek met een gunstige respons.
Een dosis van 2,5 mg/kg/dag mag bij kinderen niet worden overschreden. ECG-veranderingen van onbekende betekenis zijn gemeld bij pediatrische patiënten met doses die tweemaal zo hoog waren.
Geriatrisch gebruik
In de literatuur zijn er vier goed gecontroleerde, gerandomiseerde, dubbelblinde, vergelijkende klinische onderzoeken met parallelle groepen uitgevoerd met Tofranil 50 mg bij de oudere populatie. Er waren in totaal 651 proefpersonen opgenomen in deze onderzoeken. Deze onderzoeken gaven geen vergelijking met jongere proefpersonen. Er waren geen aanvullende bijwerkingen vastgesteld bij ouderen.
Klinische onderzoeken met Tofranil 75 mg in de oorspronkelijke aanvraag omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Postmarketing klinische ervaring heeft geen verschillen in respons tussen oudere en jongere proefpersonen aangetoond. Over het algemeen moet de dosiskeuze voor ouderen voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van een grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
(Zie ook DOSERING EN ADMINISTRATIE , adolescent en Geriatrische patiënten .)
(Zie ook PREVENTIEVE MAATREGELEN , Algemeen. )
OVERDOSERING
Sterfgevallen kunnen optreden door overdosering met deze klasse geneesmiddelen. Inname van meerdere geneesmiddelen (inclusief alcohol) komt vaak voor bij opzettelijke tricyclische overdosering. Aangezien de behandeling complex en veranderlijk is, wordt aanbevolen dat de arts contact opneemt met een antigifcentrum voor actuele informatie over de behandeling. Tekenen en symptomen van toxiciteit ontwikkelen zich snel na tricyclische overdosering. Daarom is ziekenhuisbewaking zo snel mogelijk vereist.
Er is gemeld dat kinderen gevoeliger zijn dan volwassenen voor een acute overdosering van imipraminehydrochloride. Vooral een acute overdosis bij zuigelingen of jonge kinderen moet als ernstig en mogelijk fataal worden beschouwd.
manifestaties
Deze kunnen in ernst variëren, afhankelijk van factoren zoals de hoeveelheid geabsorbeerd geneesmiddel, de leeftijd van de patiënt en het interval tussen inname van het geneesmiddel en het begin van de behandeling. Kritische manifestaties van overdosering zijn onder meer hartritmestoornissen, ernstige hypotensie, convulsies en depressie van het CZS inclusief coma. Veranderingen in het elektrocardiogram, met name in de QRS-as of -breedte, zijn klinisch significante indicatoren van tricyclische toxiciteit.
Andere manifestaties van het CZS kunnen slaperigheid, verdoving, ataxie, rusteloosheid, agitatie, hyperactieve reflexen, spierstijfheid, athetoïde en choreiforme bewegingen omvatten.
Hartafwijkingen kunnen tachycardie en tekenen van congestief falen omvatten. Ademhalingsdepressie, cyanose, shock, braken, hyperpyrexie, mydriasis en diaforese kunnen ook aanwezig zijn.
Beheer
Maak een ECG en start onmiddellijk hartbewaking. Bescherm de luchtwegen van de patiënt, breng een intraveneuze lijn aan en start maagdecontaminatie. Minimaal 6 uur observatie met hartbewaking en observatie op tekenen van CZS of ademhalingsdepressie, hypotensie, hartritmestoornissen en/of geleidingsblokkades en toevallen is noodzakelijk. Als er tijdens deze periode tekenen van toxiciteit optreden, is uitgebreide monitoring vereist. Er zijn casusrapporten van patiënten die bezwijken aan fatale ritmestoornissen laat na een overdosis; deze patiënten hadden klinisch bewijs van significante vergiftiging voorafgaand aan de dood en de meeste kregen onvoldoende gastro-intestinale decontaminatie. Controle van de geneesmiddelspiegels in plasma mag geen leidraad zijn voor de behandeling van de patiënt.
Gastro-intestinale decontaminatie
Alle patiënten die verdacht worden van een tricyclische overdosis, moeten maagdarmontsmetting krijgen. Dit moet een maagspoeling met een groot volume omvatten, gevolgd door actieve kool. Als het bewustzijn verminderd is, moet de luchtweg worden afgesloten voordat er wordt gespoeld. Emesis is gecontra-indiceerd.
Cardiovasculair
Een maximale ledemaat-lead QRS-duur van ≥0,10 seconden kan de beste indicatie zijn voor de ernst van de overdosis. Intraveneus natriumbicarbonaat moet worden gebruikt om de serum-pH tussen 7,45 en 7,55 te houden. Als de pH-respons onvoldoende is, kan ook hyperventilatie worden toegepast. Gelijktijdig gebruik van hyperventilatie en natriumbicarbonaat moet met uiterste voorzichtigheid gebeuren, met frequente pH-controle. Een pH >7,60 of een pCO2
In zeldzame gevallen kan hemoperfusie gunstig zijn bij acute refractaire cardiovasculaire instabiliteit bij patiënten met acute toxiciteit. Van hemodialyse, peritoneale dialyse, wisseltransfusies en geforceerde diurese is echter in het algemeen gemeld dat ze niet effectief zijn bij tricyclische vergiftiging.
CNS
Bij patiënten met CZS-depressie wordt vroege intubatie geadviseerd vanwege het potentieel voor abrupte verslechtering. Epileptische aanvallen moeten onder controle worden gehouden met benzodiazepinen, of, als deze niet effectief zijn, andere anti-epileptica (bijv. fenobarbital, fenytoïne). Fysostigmine wordt niet aanbevolen, behalve voor de behandeling van levensbedreigende symptomen die niet reageerden op andere therapieën, en dan alleen in overleg met een antigifcentrum.
Psychiatrische follow-up
Aangezien overdosering vaak opzettelijk is, kunnen patiënten tijdens de herstelfase op andere manieren zelfmoord proberen te plegen. Psychiatrische verwijzing kan passend zijn.
Pediatrisch management
De principes voor het beheer van overdoseringen bij kinderen en volwassenen zijn vergelijkbaar. Het wordt sterk aanbevolen dat de arts contact opneemt met het plaatselijke antigifcentrum voor specifieke pediatrische behandeling.
CONTRA-INDICATIES
Gelijktijdig gebruik van monoamineoxidaseremmende verbindingen is gecontra-indiceerd. Hyperpyretische crises of ernstige convulsieve aanvallen kunnen optreden bij patiënten die dergelijke combinaties krijgen. De versterking van bijwerkingen kan ernstig of zelfs dodelijk zijn. Als het gewenst is om Tofranil te vervangen bij patiënten die een monoamineoxidaseremmer krijgen, moet er een zo lang interval zijn als de klinische situatie toelaat, met een minimum van 14 dagen. De aanvangsdosering moet laag zijn en verhogingen moeten geleidelijk en met voorzichtigheid worden voorgeschreven.
Het medicijn is gecontra-indiceerd tijdens de acute herstelperiode na een hartinfarct. Patiënten met een bekende overgevoeligheid voor deze verbinding mogen het medicijn niet krijgen. De mogelijkheid van kruisgevoeligheid voor andere dibenzazepineverbindingen moet in gedachten worden gehouden.
KLINISCHE FARMACOLOGIE
Het werkingsmechanisme van Tofranil 25 mg is niet zeker bekend. Het werkt echter niet primair door stimulatie van het centrale zenuwstelsel. Er wordt verondersteld dat het klinische effect het gevolg is van versterking van adrenerge synapsen door de opname van noradrenaline aan zenuwuiteinden te blokkeren. Men denkt dat het werkingsmechanisme van het medicijn bij het beheersen van enuresis bij kinderen los staat van het antidepressieve effect.
Dierfarmacologie en toxicologie
A. Acuut
Orale LD50-bereiken zijn als volgt:
Rat 355 tot 682 mg/kg Hond 100 tot 215 mg/kg
Afhankelijk van de dosering bij beide soorten gingen de toxische symptomen geleidelijk over van depressie, onregelmatige ademhaling en ataxie tot convulsies en overlijden.
B. Reproductie/teratogeen
De algemene evaluatie kan als volgt worden samengevat:
Oraal: Onafhankelijke onderzoeken bij drie soorten (rat, muis en konijn) hebben aangetoond dat wanneer Tofranil oraal wordt toegediend in doses tot ongeveer 2-1 / 2 maal de maximale dosis voor de mens bij de eerste 2 soorten en tot 25 maal de maximale menselijke dosis dosis bij de derde soort, is het geneesmiddel in wezen vrij van teratogeen potentieel. Bij de drie onderzochte soorten trad slechts één foetale afwijking op (bij het konijn) en in die studie was er eveneens een afwijking in de controlegroep. Er zijn echter aanwijzingen uit de rattenstudies dat enig systemisch en embryotoxisch potentieel aantoonbaar is. Dit uit zich in een kleinere worpgrootte, een lichte toename van het aantal doodgeborenen en een afname van het gemiddelde geboortegewicht.
