Lexapro 10mg, 20mg, 5mg Escitalopram Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Lexapro en hoe wordt het gebruikt?
Lexapro is een receptgeneesmiddel dat wordt gebruikt om de symptomen van depressieve stoornis en gegeneraliseerde angststoornis te behandelen. Lexapro kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Lexapro behoort tot een klasse geneesmiddelen die antidepressiva, SSRI's, worden genoemd.
- Het is niet bekend of Lexapro 10 mg veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Lexapro?
Lexapro kan ernstige bijwerkingen veroorzaken, waaronder:
- Buikpijn,
- Abnormale bloeding,
- Abnormale dromen,
- Allergie,
- wazig zien,
- tunnelvisie,
- pijn op de borst,
- verminderde concentratie,
- hemostase,
- oogpijn of zwelling,
- halo's rond lichten zien,
- race gedachten,
- ongewoon risicogedrag,
- gevoelens van extreem geluk of verdriet,
- hoofdpijn,
- maagzuur,
- opvliegers,
- verwardheid,
- onduidelijke spraak,
- ernstige zwakte,
- braken,
- verlies van coördinatie,
- onvast voelen,
- zeer stijve (starre) spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslag,
- trillingen, en
- duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Lexapro zijn:
- duizeligheid,
- slaperigheid,
- zwakheid,
- zweten,
- zich wankel of angstig voelen,
- slaapproblemen (slapeloosheid),
- droge mond,
- verlies van eetlust,
- misselijkheid,
- constipatie,
- geeuwen,
- gewichtsveranderingen,
- verminderde zin in seks,
- impotentie, en
- moeite met een orgasme
WAARSCHUWING
SUICIDALITEIT EN ANTIDEPRESSANTE DRUGS
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van Lexapro of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Lexapro 5 mg is niet goedgekeurd voor gebruik bij pediatrische patiënten jonger dan 12 jaar. [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN Klinische verslechtering en zelfmoordrisico, PATIËNT INFORMATIE , en Gebruik bij specifieke populaties : Pediatrisch gebruik].
OMSCHRIJVING
Lexapro® (escitalopram-oxalaat) is een oraal toegediende selectieve serotonineheropnameremmer (SSRI). Escitalopram is de zuivere senantiomeer (enkele isomeer) van het racemische bicyclische ftalaanderivaat citalopram. Escitalopramoxalaat wordt aangeduid als S-(+)-1-[3(dimethyl-amino)propyl]-1-(p-fluorfenyl)-5-ftalaancarbonitriloxalaat met de volgende structuurformule:
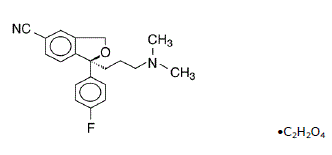
De molecuulformule is C20H21FN2O • C2H2O4 en het molecuulgewicht is 414,40.
Escitalopramoxalaat komt voor als een fijn, wit tot lichtgeel poeder en is goed oplosbaar in methanol en dimethylsulfoxide (DMSO), oplosbaar in isotone zoutoplossing, matig oplosbaar in water en ethanol, slecht oplosbaar in ethylacetaat en onoplosbaar in heptaan.
Lexapro (escitalopram oxalaat) is verkrijgbaar als tabletten of als drank.
Lexapro-tabletten zijn filmomhulde, ronde tabletten die escitalopramoxalaat bevatten in sterktes gelijk aan 5 mg, 10 mg en 20 mg escitaloprambase. De tabletten van 10 en 20 mg hebben een breukstreep. De tabletten bevatten ook de volgende inactieve ingrediënten: talk, croscarmellosenatrium, microkristallijne cellulose/colloïdaal siliciumdioxide en magnesiumstearaat. De filmomhulling bevat hypromellose, titaniumdioxide en polyethyleenglycol.
Lexapro 5 mg drank bevat escitalopramoxalaat overeenkomend met 1 mg/ml escitaloprambase. Het bevat ook de volgende inactieve ingrediënten: sorbitol, gezuiverd water, citroenzuur, natriumcitraat, appelzuur, glycerine, propyleenglycol, methylparaben, propylparaben en natuurlijke pepermuntsmaak.
INDICATIES
Ernstige depressieve stoornis
Lexapro (escitalopram) is geïndiceerd voor de acute en onderhoudsbehandeling van depressieve stoornis bij volwassenen en bij adolescenten van 12 tot 17 jaar [zie Klinische studies ].
Een depressieve episode (DSM-IV) impliceert een prominente en relatief aanhoudende (bijna elke dag gedurende ten minste 2 weken) depressieve of dysfore stemming die gewoonlijk het dagelijks functioneren verstoort, en omvat ten minste vijf van de volgende negen symptomen: depressieve stemming, verlies van interesse in gebruikelijke activiteiten, significante verandering in gewicht en/of eetlust, slapeloosheid of hypersomnie, psychomotorische agitatie of achterstand, verhoogde vermoeidheid, schuldgevoelens of waardeloosheid, vertraagd denken of verminderde concentratie, een zelfmoordpoging of zelfmoordgedachten.
Gegeneraliseerde angststoornis
Lexapro 20 mg is geïndiceerd voor de acute behandeling van gegeneraliseerde angststoornis (GAD) bij volwassenen [zie Klinische studies ].
Gegeneraliseerde angststoornis (DSM-IV) wordt gekenmerkt door overmatige angst en zorgen (bezorgde verwachting) die ten minste 6 maanden aanhouden en die de persoon moeilijk onder controle kan houden. Het moet gepaard gaan met ten minste 3 van de volgende symptomen: rusteloosheid of zich opgejaagd of gespannen voelen, snel vermoeid zijn, moeite met concentreren of geestesziekte, prikkelbaarheid, spierspanning en slaapstoornissen.
DOSERING EN ADMINISTRATIE
Lexapro 5 mg dient eenmaal daags te worden toegediend, 's morgens of' s avonds, met of zonder voedsel.
Ernstige depressieve stoornis
Eerste behandeling
adolescenten
De aanbevolen dosis Lexapro is eenmaal daags 10 mg. Een proef met flexibele dosering van Lexapro (10 tot 20 mg/dag) toonde de werkzaamheid van Lexapro aan [zie Klinische studies ]. Als de dosis wordt verhoogd tot 20 mg, moet dit na minimaal drie weken gebeuren.
volwassenen
De aanbevolen dosis Lexapro 10 mg is eenmaal daags 10 mg. Een proef met een vaste dosis Lexapro toonde de effectiviteit aan van zowel 10 mg als 20 mg Lexapro 5 mg, maar kon geen groter voordeel van 20 mg dan 10 mg aantonen [zie Klinische studies ]. Als de dosis wordt verhoogd tot 20 mg, moet dit na minimaal een week gebeuren.
Onderhoudsbehandeling
Men is het er algemeen over eens dat acute episodes van depressieve stoornis een aantal maanden of langer aanhoudende farmacologische therapie vereisen die verder gaan dan de respons op de acute episode. Systematische evaluatie van voortzetting van Lexapro 10 of 20 mg/dag bij volwassen patiënten met depressieve stoornis die reageerden tijdens het gebruik van Lexapro gedurende een 8 weken durende acute behandelingsfase, toonde een voordeel aan van een dergelijke onderhoudsbehandeling [zie Klinische studies ]. Desalniettemin moet de arts die ervoor kiest om Lexapro 5 mg gedurende langere perioden te gebruiken, periodiek de bruikbaarheid van het geneesmiddel op de lange termijn voor de individuele patiënt opnieuw evalueren. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling te bepalen.
Gegeneraliseerde angststoornis
Eerste behandeling
volwassenen
De aanbevolen startdosering van Lexapro is eenmaal daags 10 mg. Als de dosis wordt verhoogd tot 20 mg, moet dit na minimaal een week gebeuren.
Onderhoudsbehandeling
Gegeneraliseerde angststoornis wordt erkend als een chronische aandoening. De werkzaamheid van Lexapro bij de behandeling van GAS na 8 weken is niet systematisch onderzocht. De arts die ervoor kiest om Lexapro voor langere perioden te gebruiken, moet periodiek de bruikbaarheid van het geneesmiddel op de lange termijn voor de individuele patiënt opnieuw evalueren.
Scherm voor bipolaire stoornis voorafgaand aan het starten van Lexapro
Voordat de behandeling met Lexapro of een ander antidepressivum wordt gestart, moet u patiënten screenen op een persoonlijke familiegeschiedenis van bipolaire stoornis, manie of hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Speciale populaties
10 mg/dag is de aanbevolen dosis voor de meeste oudere patiënten en patiënten met leverinsufficiëntie.
Er is geen dosisaanpassing nodig voor patiënten met een lichte of matige nierfunctiestoornis. Lexapro moet met voorzichtigheid worden gebruikt bij patiënten met een ernstige nierfunctiestoornis.
Stopzetting van de behandeling met Lexapro
Symptomen geassocieerd met stopzetting van Lexapro 5 mg en andere SSRI's en SNRI's zijn gemeld [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Patiënten moeten op deze symptomen worden gecontroleerd wanneer de behandeling wordt stopgezet. Waar mogelijk wordt een geleidelijke verlaging van de dosis aanbevolen in plaats van abrupt stoppen. Als ondraaglijke symptomen optreden na een verlaging van de dosis of na stopzetting van de behandeling, kan worden overwogen om de eerder voorgeschreven dosis te hervatten. Vervolgens kan de arts doorgaan met het verlagen van de dosis, maar in een meer geleidelijk tempo.
Overschakelen van een patiënt naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen en het starten van de behandeling met Lexapro. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met Lexapro 20 mg voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen [zie CONTRA-INDICATIES ].
Gebruik van Lexapro met andere MAO-remmers zoals linezolid of methyleenblauw
Start Lexapro 5 mg niet bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen [zie CONTRA-INDICATIES ].
In sommige gevallen kan een patiënt die al wordt behandeld met Lexapro 10 mg dringend worden behandeld met linezolid of intraveneus methyleenblauw. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet Lexapro onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw kan worden toegediend. De patiënt moet gedurende 2 weken of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet, worden gecontroleerd op symptomen van het serotoninesyndroom. De therapie met Lexapro kan 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden hervat [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met Lexapro 10 mg is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten
Lexapro 10 mg tabletten zijn filmomhulde, ronde tabletten die escitalopramoxalaat bevatten in sterktes equivalent aan 5 mg, 10 mg en 20 mg escitaloprambase. De tabletten van 10 en 20 mg hebben een breukstreep. Bedrukt met "FL" aan de ene kant en "5", "10" of "20" aan de andere kant, afhankelijk van hun respectievelijke sterke punten.
Orale oplossing
Lexapro drank bevat escitalopramoxalaat overeenkomend met 1 mg/ml escitaloprambase (momenteel niet in de handel).
Opslag en behandeling
Tabletten
5 mg tabletten
Fles van 100 - NDC # 0456-2005-01
Wit tot gebroken wit, rond, niet gekerfd, filmomhuld. Opdruk "FL" aan de ene kant van de tablet en "5" aan de andere kant.
10 mg-tabletten
Fles van 100 - NDC 0456-2010-01 10 x 10 Eenheidsdosis - NDC # 0456-2010-63
Wit tot gebroken wit, rond, gekerfd, filmomhuld. Opdruk op de gescoorde zijde met "F" aan de linkerkant en "L" aan de rechterkant. Opdruk op de niet-gescoorde zijde met "10".
20 mg tabletten
Fles van 100 - NDC # 0456-2020-01 10 x 10 eenheidsdosis - NDC # 0456-2020-63
Wit tot gebroken wit, rond, gekerfd, filmomhuld. Opdruk op de gescoorde zijde met "F" aan de linkerkant en "L" aan de rechterkant. Opdruk op de niet-gescoorde zijde met "20".
Orale oplossing
5 mg/5 ml, pepermuntsmaak (240 ml) - NDC # 0456-2101-08. De drank wordt momenteel niet op de markt gebracht.
Opslag en behandeling
Bewaren bij 20°C tot 25°C (68°F tot 77°F); excursies toegestaan tot 15 tot 30°C (59° tot 86°F).
Gedistribueerd door: Allergan USA, Inc. Madison, NJ 07940. Herzien: september 2021
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
Gegevensbronnen klinisch onderzoek
Kindergeneeskunde (6 -17 jaar)
Bijwerkingen werden verzameld bij 576 pediatrische patiënten (286 Lexapro 5 mg, 290 placebo) met depressieve stoornis in dubbelblinde, placebogecontroleerde onderzoeken. De veiligheid en werkzaamheid van Lexapro 5 mg bij pediatrische patiënten jonger dan 12 jaar zijn niet vastgesteld.
volwassenen
Informatie over bijwerkingen voor Lexapro 5 mg werd verzameld van 715 patiënten met depressieve stoornis die werden blootgesteld aan escitalopram en van 592 patiënten die werden blootgesteld aan placebo in dubbelblinde, placebogecontroleerde onderzoeken. Nog eens 284 patiënten met een depressieve stoornis werden onlangs blootgesteld aan escitalopram in open-label onderzoeken. De informatie over bijwerkingen voor Lexapro bij patiënten met GAS werd verzameld van 429 patiënten die waren blootgesteld aan escitalopram en van 427 patiënten die waren blootgesteld aan placebo in dubbelblinde, placebogecontroleerde onderzoeken.
Bijwerkingen tijdens blootstelling werden voornamelijk verkregen door algemeen onderzoek en geregistreerd door klinische onderzoekers met behulp van terminologie naar eigen keuze. Bijgevolg is het niet mogelijk om een zinvolle schatting te geven van het aantal personen dat bijwerkingen ervaart zonder eerst vergelijkbare soorten gebeurtenissen te groeperen in een kleiner aantal gestandaardiseerde gebeurteniscategorieën. In de volgende tabellen en tabellen is standaard terminologie van de Wereldgezondheidsorganisatie (WHO) gebruikt om gerapporteerde bijwerkingen te classificeren.
De vermelde frequenties van bijwerkingen vertegenwoordigen het aandeel personen dat, ten minste eenmaal, een tijdens de behandeling optredende bijwerking van het vermelde type heeft ervaren. Een voorval werd beschouwd als optredend tijdens de behandeling als het voor de eerste keer optrad of verergerde tijdens het ontvangen van therapie na baseline-evaluatie.
Bijwerkingen die verband houden met stopzetting van de behandeling
Ernstige depressieve stoornis
Kindergeneeskunde (6 -17 jaar)
Bijwerkingen waren geassocieerd met stopzetting van 3,5% van de 286 patiënten die Lexapro kregen en 1% van de 290 patiënten die placebo kregen. De meest voorkomende bijwerking (incidentie ten minste 1% voor Lexapro 10 mg en meer dan placebo) geassocieerd met stopzetting was slapeloosheid (1% Lexapro, 0% placebo).
volwassenen
Van de 715 depressieve patiënten die Lexapro kregen in placebogecontroleerde onderzoeken, stopte 6% met de behandeling vanwege een bijwerking, vergeleken met 2% van de 592 patiënten die placebo kregen. In twee onderzoeken met een vaste dosis was de mate van stopzetting voor bijwerkingen bij patiënten die 10 mg/dag Lexapro 20 mg kregen niet significant verschillend van de mate van stopzetting voor bijwerkingen bij patiënten die placebo kregen. Het stopzettingspercentage voor bijwerkingen bij patiënten die waren toegewezen aan een vaste dosis van 20 mg/dag Lexapro was 10%, wat significant verschilde van het stopzettingspercentage voor bijwerkingen bij patiënten die 10 mg/dag Lexapro (4%) en placebo kregen. (3%). Bijwerkingen die verband hielden met het staken van ten minste 1% van de patiënten die werden behandeld met Lexapro 5 mg, en waarbij het aantal ten minste tweemaal zo hoog was als bij placebo, waren misselijkheid (2%) en ejaculatiestoornis (2% van de mannelijke patiënten).
Gegeneraliseerde angststoornis
volwassenen
Van de 429 GAD-patiënten die Lexapro 10-20 mg/dag kregen in placebogecontroleerde onderzoeken, stopte 8% met de behandeling vanwege een bijwerking, vergeleken met 4% van de 427 patiënten die placebo kregen. Bijwerkingen die verband hielden met het staken van ten minste 1% van de patiënten die werden behandeld met Lexapro 20 mg, en waarbij het percentage ten minste tweemaal het placebopercentage was, waren misselijkheid (2%), slapeloosheid (1%) en vermoeidheid (1 %).
Incidentie van bijwerkingen in placebo-gecontroleerde klinische onderzoeken
Ernstige depressieve stoornis
Kindergeneeskunde (6 -17 jaar)
Het algemene profiel van bijwerkingen bij pediatrische patiënten was over het algemeen vergelijkbaar met dat waargenomen in onderzoeken bij volwassenen, zoals weergegeven in tabel 2. De volgende bijwerkingen (exclusief die welke in tabel 2 staan en die waarvoor de gecodeerde termen niet informatief of misleidend waren) ) werden gemeld met een incidentie van ten minste 2% voor Lexapro en meer dan voor placebo: rugpijn, urineweginfectie, braken en verstopte neus.
volwassenen
De vaakst waargenomen bijwerkingen bij patiënten met Lexapro 10 mg (incidentie van ongeveer 5% of meer en ongeveer twee keer de incidentie bij placebopatiënten) waren slapeloosheid, ejaculatiestoornis (voornamelijk vertraagde ejaculatie), misselijkheid, toegenomen zweten, vermoeidheid en slaperigheid.
Tabel 2 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van tijdens de behandeling optredende bijwerkingen die voorkwamen bij 715 depressieve patiënten die Lexapro 20 mg kregen in doses variërend van 10 tot 20 mg/dag in placebogecontroleerde onderzoeken. Inbegrepen voorvallen zijn die optreden bij 2% of meer van de patiënten die werden behandeld met Lexapro 20 mg en waarbij de incidentie bij patiënten behandeld met Lexapro 10 mg hoger was dan de incidentie bij met placebo behandelde patiënten.
TABEL 2 Tijdens de behandeling optredende bijwerkingen waargenomen met een frequentie van ≥ 2% en meer dan placebo voor depressieve stoornis
Gegeneraliseerde angststoornis
volwassenen
De vaakst waargenomen bijwerkingen bij Lexapro-patiënten (incidentie van ongeveer 5% of meer en ongeveer twee keer de incidentie bij placebopatiënten) waren misselijkheid, ejaculatiestoornis (voornamelijk vertraagde ejaculatie), slapeloosheid, vermoeidheid, verminderd libido en anorgasmie.
somt de incidentie op, afgerond op het dichtstbijzijnde percentage van de tijdens de behandeling optredende bijwerkingen die voorkwamen bij 429 GAD-patiënten die Lexapro 10 tot 20 mg/dag kregen in placebogecontroleerde onderzoeken. Inbegrepen voorvallen zijn die optreden bij 2% of meer van de met Lexapro behandelde patiënten en waarbij de incidentie bij met Lexapro behandelde patiënten hoger was dan de incidentie bij met placebo behandelde patiënten.
TABEL 3 Tijdens de behandeling optredende bijwerkingen waargenomen met een frequentie van ≥ 2% en meer dan placebo voor gegeneraliseerde angststoornis
Dosisafhankelijkheid van bijwerkingen
De mogelijke dosisafhankelijkheid van vaak voorkomende bijwerkingen (gedefinieerd als een incidentie van ≥ 5% in de 10 mg of 20 mg Lexapro-groepen) werd onderzocht op basis van de gecombineerde incidentie van bijwerkingen in twee onderzoeken met een vaste dosis. De totale incidentie van bijwerkingen bij met 10 mg Lexapro behandelde patiënten (66%) was vergelijkbaar met die van de met placebo behandelde patiënten (61%), terwijl de incidentie bij 20 mg/dag met Lexapro behandelde patiënten hoger was (86 %). Tabel 4 toont vaak voorkomende bijwerkingen die voorkwamen in de 20 mg/dag Lexapro-groep met een incidentie die ongeveer tweemaal zo hoog was als die van de 10 mg/dag Lexapro 10 mg-groep en ongeveer tweemaal die van de placebogroep.
TABEL 4 Incidentie van vaak voorkomende bijwerkingen bij patiënten met depressieve stoornis
Mannelijke en vrouwelijke seksuele disfunctie met SSRI's
Hoewel veranderingen in seksueel verlangen, seksuele prestaties en seksuele bevrediging vaak optreden als manifestaties van een psychiatrische stoornis, kunnen ze ook een gevolg zijn van farmacologische behandeling. Er zijn met name aanwijzingen dat SSRI's dergelijke ongewenste seksuele ervaringen kunnen veroorzaken.
Betrouwbare schattingen van de incidentie en ernst van ongewenste ervaringen met seksuele begeerte, prestatie en bevrediging zijn echter moeilijk te verkrijgen, deels omdat patiënten en artsen misschien terughoudend zijn om ze te bespreken. Dienovereenkomstig onderschatten schattingen van de incidentie van ongewenste seksuele ervaringen en prestaties die in de productetikettering worden vermeld, hun werkelijke incidentie.
TABEL 5 Incidentie van seksuele bijwerkingen in placebogecontroleerde klinische onderzoeken
Er zijn geen adequaat opgezette onderzoeken naar seksuele disfunctie bij behandeling met escitalopram.
Priapisme is gemeld bij alle SSRI's.
Hoewel het moeilijk is om het precieze risico van seksuele disfunctie in verband met het gebruik van SSRI's te kennen, moeten artsen routinematig informeren naar dergelijke mogelijke bijwerkingen.
Veranderingen in vitale functies
Lexapro 5 mg- en placebogroepen werden vergeleken met betrekking tot (1) gemiddelde verandering ten opzichte van baseline in vitale functies (pols, systolische bloeddruk en diastolische bloeddruk) en (2) de incidentie van patiënten die voldeden aan de criteria voor mogelijk klinisch significante veranderingen ten opzichte van baseline in deze variabelen. Deze analyses brachten geen klinisch belangrijke veranderingen aan het licht in de vitale functies die verband hielden met de behandeling met Lexapro 20 mg. Bovendien bleek uit een vergelijking van liggende en staande metingen van de vitale functies bij proefpersonen die Lexapro 20 mg kregen, dat behandeling met Lexapro niet gepaard gaat met orthostatische veranderingen.
Gewichtsveranderingen
Patiënten die in gecontroleerde onderzoeken met Lexapro werden behandeld, verschilden niet van met placebo behandelde patiënten wat betreft klinisch belangrijke verandering in lichaamsgewicht.
Laboratoriumveranderingen
Lexapro 5 mg- en placebogroepen werden vergeleken met betrekking tot (1) gemiddelde verandering ten opzichte van baseline in verschillende serumchemie-, hematologie- en urineanalysevariabelen, en (2) de incidentie van patiënten die voldeden aan de criteria voor mogelijk klinisch significante veranderingen ten opzichte van baseline in deze variabelen. Deze analyses brachten geen klinisch belangrijke veranderingen aan het licht in laboratoriumtestparameters die verband houden met de behandeling met Lexapro.
ECG-wijzigingen
Elektrocardiogrammen van Lexapro (N=625) en placebo (N=527) groepen werden vergeleken met betrekking tot uitbijters gedefinieerd als proefpersonen met QTc-veranderingen van meer dan 60 msec vanaf baseline of absolute waarden van meer dan 500 ms na toediening, en proefpersonen met een hartslagverhoging tot meer dan 100 spm of daalt tot minder dan 50 spm met een verandering van 25% ten opzichte van de uitgangswaarde (respectievelijk tachycardie of bradycardie uitbijters). Geen van de patiënten in de Lexapro 20 mg-groep had een QTcF-interval >500 msec of een verlenging >60 msec vergeleken met 0,2% van de patiënten in de placebogroep. De incidentie van tachycarduitschieters was 0,2% in de Lexapro 5 mg- en de placebogroep. De incidentie van bradycardie uitbijters was 0,5% in de Lexapro 10 mg-groep en 0,2% in de placebogroep.
Het QTcF-interval werd geëvalueerd in een gerandomiseerde, placebo- en actieve (moxifloxacine 400 mg) gecontroleerde cross-over, escalerende studie met meerdere doses bij 113 gezonde proefpersonen. Het maximale gemiddelde (95% bovenste betrouwbaarheidsgrens) verschil met de placebo-arm was respectievelijk 4,5 (6,4) en 10,7 (12,7) msec voor 10 mg en supratherapeutisch 30 mg escitalopram eenmaal daags. Op basis van de vastgestelde blootstelling-responsrelatie is de voorspelde QTcF-verandering van de placebo-arm (95% betrouwbaarheidsinterval) onder de Cmax voor de dosis van 20 mg 6,6 (7,9) msec. Escitalopram 30 mg eenmaal daags gegeven resulteerde in een gemiddelde Cmax van 1,7 maal hoger dan de gemiddelde Cmax voor de maximaal aanbevolen therapeutische dosis bij steady state (20 mg). De blootstelling bij een supratherapeutische dosis van 30 mg is vergelijkbaar met de steady-state-concentraties die worden verwacht bij trage CYP2C19-metaboliseerders na een therapeutische dosis van 20 mg.
Andere reacties waargenomen tijdens de premarketingevaluatie van Lexapro
Hieronder volgt een lijst van bijwerkingen die tijdens de behandeling optreden, zoals gedefinieerd in de inleiding tot de ONGEWENSTE REACTIES rubriek, gerapporteerd door de 1428 patiënten die gedurende een periode van maximaal één jaar met Lexapro werden behandeld in dubbelblinde of open-label klinische onderzoeken tijdens de premarketingevaluatie. De lijst omvat niet de gebeurtenissen die al zijn vermeld in die gebeurtenissen waarvoor een medicijnveroorzaker ver verwijderd was en met een snelheid van minder dan 1% of lager dan die van placebo, die gebeurtenissen die zo algemeen waren dat ze niet informatief waren, en die gebeurtenissen die slechts één keer werden gemeld en die geen substantiële kans hadden om acuut levensbedreigend te zijn. Gebeurtenissen zijn gecategoriseerd per lichaamssysteem. Gebeurtenissen van groot klinisch belang worden beschreven in de: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN sectie.
Cardiovasculair -hypertensie, hartkloppingen.
Aandoeningen van het centrale en perifere zenuwstelsel - licht gevoel in het hoofd, migraine.
Maagdarmstelselaandoeningen -buikkramp, brandend maagzuur, gastro-enteritis.
Algemeen - allergie, pijn op de borst, koorts, opvliegers, pijn in ledematen.
Metabole en voedingsstoornissen -verhoogd gewicht.
Aandoeningen van het bewegingsapparaat - artralgie, myalgie kaakstijfheid.
Psychische stoornissen verhoogde eetlust, verminderde concentratie, prikkelbaarheid.
Voortplantingsstoornissen/vrouw - menstruatiekrampen, menstruatiestoornis.
Ademhalingsstelselaandoeningen - bronchitis, hoesten, verstopte neus, sinuscongestie, sinushoofdpijn.
Huid- en aanhangselsaandoeningen - uitslag.
Speciale zintuigen - wazig zien, oorsuizen.
Urinewegaandoeningen - vaak urineren, urineweginfectie.
Postmarketingervaring
Bijwerkingen gemeld na het op de markt brengen van escitalopram
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van Lexapro na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen: bloedarmoede, agranulocytis, aplastische anemie, hemolytische anemie, idiopathische trombocytopenie purpura, leukopenie, trombocytopenie.
Hartaandoeningen: atriale fibrillatie, bradycardie, hartfalen, myocardinfarct, tachycardie, torsade de pointes, ventriculaire aritmie, ventriculaire tachycardie.
Oor- en labyrintaandoeningen: hoogtevrees
Endocriene aandoeningen: diabetes mellitus, hyperprolactinemie, SIADH.
Oogaandoeningen: hoeksluiting glaucoom, diplopie, mydriasis, visuele stoornis.
Gastro-intestinale stoornis: dysfagie, gastro-intestinale bloeding, gastro-oesofageale reflux, pancreatitis, rectale bloeding.
Algemene aandoeningen en toedieningsplaatsvoorwaarden: abnormale gang, asthenie, oedeem, vallen, zich abnormaal voelen, malaise.
Lever- en galaandoeningen: fulminante hepatitis, leverfalen, levernecrose, hepatitis.
Immuunsysteemaandoeningen: allergische reactie, anafylaxie.
onderzoeken: bilirubine verhoogd, gewichtsafname, QT-verlenging op het elektrocardiogram, leverenzymen verhoogd, hypercholesterolemie, INR verhoogd, protrombine verlaagd.
Metabolisme en voedingsstoornissen: hyperglykemie, hypoglykemie, hypokaliëmie, hyponatriëmie.
Musculoskeletale en bindweefselaandoeningen: spierkramp, spierstijfheid, spierzwakte, rabdomyolyse.
Zenuwstelselaandoeningen: acathisie, amnesie, ataxie, choreoathetose, cerebrovasculair accident, dysartrie, dyskinesie, dystonie, extrapiramidale stoornissen, grand mal-aanvallen (of convulsies), hypo-esthesie, myoclonus, nystagmus, parkinsonisme, rusteloze benen, toevallen, syncope, tardieve dyskinesie, tremor.
Zwangerschap, kraambed en perinatale aandoeningen: spontane abortie.
Psychische stoornissen: acute psychose, agressie, agitatie, woede, angst, apathie, zelfmoord, verwardheid, depersonalisatie, verergerde depressie, delirium, waanvoorstellingen, desoriëntatie, onwerkelijk gevoel, hallucinaties (visueel en auditief), stemmingswisselingen, nervositeit, nachtmerrie, paniekreactie, paranoia , rusteloosheid, zelfbeschadiging of gedachten aan zelfbeschadiging, zelfmoordpoging, zelfmoordgedachten, zelfmoordneiging.
Nier- en urinewegaandoeningen: acuut nierfalen, dysurie, urineretentie.
Voortplantingsstelsel en borstaandoeningen: menorragie, priapisme.
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: dyspneu, epistaxis, longembolie, pulmonale hypertensie van de pasgeborene. Huid- en onderhuidaandoeningen: alopecia, angio-oedeem, dermatitis, ecchymose, erythema multiforme, fotosensitiviteitsreactie, Stevens-Johnson-syndroom, toxische epidermale necrolyse, urticaria.
Bloedvataandoeningen: diepe veneuze trombose, blozen, hypertensieve crisis, hypotensie, orthostatische hypotensie, flebitis, trombose.
DRUG-INTERACTIES
Monoamineoxidaseremmers (MAO-remmers)
[Zien DOSERING EN ADMINISTRATIE en , CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Serotonerge geneesmiddelen
[Zien DOSERING EN ADMINISTRATIE en , CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
triptanen
Er zijn zeldzame postmarketingmeldingen geweest van het serotoninesyndroom bij gebruik van een SSRI en een triptan. Als gelijktijdige behandeling van Lexapro 10 mg met een triptan klinisch gerechtvaardigd is, wordt zorgvuldige observatie van de patiënt geadviseerd, met name tijdens de start van de behandeling en bij dosisverhogingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CZS-medicijnen
Gezien de primaire effecten van escitalopram op het centrale zenuwstelsel, is voorzichtigheid geboden bij gebruik in combinatie met andere centraal werkende geneesmiddelen.
Alcohol
Hoewel Lexapro de cognitieve en motorische effecten van alcohol in een klinisch onderzoek niet versterkte, zoals bij andere psychotrope geneesmiddelen, wordt het gebruik van alcohol door patiënten die Lexapro gebruiken niet aanbevolen.
Geneesmiddelen die de hemostase verstoren (NSAID's, aspirine, warfarine, enz.)
De afgifte van serotonine door bloedplaatjes speelt een belangrijke rol bij hemostase. Epidemiologische studies van de case-control en cohort-opzet die een verband hebben aangetoond tussen het gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren en het optreden van bloedingen in het bovenste deel van het maagdarmkanaal, hebben ook aangetoond dat gelijktijdig gebruik van een NSAID of aspirine het risico op bloedingen kan vergroten. Veranderde antistollingseffecten, waaronder toegenomen bloedingen, zijn gemeld bij gelijktijdige toediening van SSRI's en SNRI's met warfarine. Patiënten die met warfarine worden behandeld, moeten zorgvuldig worden gecontroleerd wanneer Lexapro wordt gestart of stopgezet.
cimetidine
Bij proefpersonen die 21 dagen 40 mg/dag racemisch citalopram hadden gekregen, resulteerde gecombineerde toediening van 400 mg tweemaal daags cimetidine gedurende 8 dagen in een verhoging van de citalopram AUC en Cmax van respectievelijk 43% en 39%. De klinische betekenis van deze bevindingen is niet bekend.
Digoxine
Bij proefpersonen die 21 dagen 40 mg/dag racemisch citalopram hadden gekregen, had de gecombineerde toediening van citalopram en digoxine (enkele dosis van 1 mg) geen significante invloed op de farmacokinetiek van citalopram of digoxine.
Lithium
Gelijktijdige toediening van racemisch citalopram (40 mg/dag gedurende 10 dagen) en lithium (30 mmol/dag gedurende 5 dagen) had geen significant effect op de farmacokinetiek van citalopram of lithium. Desalniettemin moeten de plasmalithiumspiegels worden gecontroleerd met een passende aanpassing van de lithiumdosis in overeenstemming met de standaard klinische praktijk. Omdat lithium de serotonerge effecten van escitalopram kan versterken, is voorzichtigheid geboden bij gelijktijdige toediening van Lexapro 5 mg en lithium.
Pimozide en Celexa
In een gecontroleerde studie werd een enkele dosis pimozide 2 mg samen toegediend met racemisch citalopram 40 mg eenmaal daags gegeven gedurende 11 dagen geassocieerd met een gemiddelde verhoging van de QTc-waarden van ongeveer 10 msec vergeleken met pimozide alleen. Racemisch citalopram veranderde de gemiddelde AUC of Cmax van pimozide niet. Het mechanisme van deze farmacodynamische interactie is niet bekend.
Sumatriptan
Er zijn zeldzame postmarketingmeldingen geweest waarin patiënten werden beschreven met zwakte, hyperreflexie en coördinatiestoornissen na het gebruik van een SSRI en sumatriptan. Als gelijktijdige behandeling met sumatriptan en een SSRI (bijv. fluoxetine, fluvoxamine, paroxetine, sertraline, citalopram, escitalopram) klinisch gerechtvaardigd is, wordt passende observatie van de patiënt geadviseerd.
theofylline
Gecombineerde toediening van racemisch citalopram (40 mg/dag gedurende 21 dagen) en het CYP1A2-substraat theofylline (enkele dosis van 300 mg) had geen invloed op de farmacokinetiek van theofylline. Het effect van theofylline op de farmacokinetiek van citalopram werd niet geëvalueerd.
Warfarine
Toediening van 40 mg/dag racemisch citalopram gedurende 21 dagen had geen invloed op de farmacokinetiek van warfarine, een CYP3A4-substraat. De protrombinetijd was met 5% verhoogd, waarvan de klinische betekenis niet bekend is.
Carbamazepine
Gecombineerde toediening van racemisch citalopram (40 mg/dag gedurende 14 dagen) en carbamazepine (getitreerd tot 400 mg/dag gedurende 35 dagen) had geen significante invloed op de farmacokinetiek van carbamazepine, een CYP3A4-substraat. Hoewel de dalplasmaconcentraties van citalopram niet werden beïnvloed, moet, gezien de enzyminducerende eigenschappen van carbamazepine, de mogelijkheid worden overwogen dat carbamazepine de klaring van escitalopram zou kunnen verhogen als de twee geneesmiddelen gelijktijdig worden toegediend.
triazolam
Gecombineerde toediening van racemisch citalopram (getitreerd tot 40 mg/dag gedurende 28 dagen) en het CYP3A4-substraat triazolam (enkele dosis van 0,25 mg) had geen significante invloed op de farmacokinetiek van citalopram of triazolam.
Ketoconazol
Gecombineerde toediening van racemisch citalopram (40 mg) en ketoconazol (200 mg), een krachtige CYP3A4-remmer, verlaagde de Cmax en AUC van ketoconazol met respectievelijk 21% en 10% en had geen significante invloed op de farmacokinetiek van citalopram.
Ritonavir
Gecombineerde toediening van een enkele dosis ritonavir (600 mg), zowel een CYP3A4-substraat als een krachtige remmer van CYP3A4, en escitalopram (20 mg) had geen invloed op de farmacokinetiek van ritonavir of escitalopram.
CYP3A4- en -2C19-remmers
In vitro-onderzoeken wezen uit dat CYP3A4 en -2C19 de primaire enzymen zijn die betrokken zijn bij het metabolisme van escitalopram. Gelijktijdige toediening van escitalopram (20 mg) en ritonavir (600 mg), een krachtige remmer van CYP3A4, had echter geen significante invloed op de farmacokinetiek van escitalopram. Omdat escitalopram wordt gemetaboliseerd door meerdere enzymsystemen, is het mogelijk dat remming van een enkel enzym de klaring van escitalopram niet merkbaar vermindert.
Geneesmiddelen gemetaboliseerd door cytochroom P4502D6
In vitro-onderzoeken lieten geen remmend effect van escitalopram op CYP2D6 zien. Bovendien waren de steady-state-spiegels van racemisch citalopram niet significant verschillend bij trage metaboliseerders en extensieve CYP2D6-metaboliseerders na toediening van meerdere doses citalopram, wat suggereert dat het onwaarschijnlijk is dat gelijktijdige toediening, met escitalopram, van een geneesmiddel dat CYP2D6 remt, klinisch significante effecten zal hebben op het metabolisme van escitalopram. Er zijn echter beperkte in vivo gegevens die wijzen op een bescheiden CYP2D6-remmend effect voor escitalopram, dwz gelijktijdige toediening van escitalopram (20 mg/dag gedurende 21 dagen) met het tricyclische antidepressivum desipramine (enkele dosis van 50 mg), een substraat voor CYP2D6, resulteerde in een stijging van 40% in Cmax en een stijging van 100% in AUC van desipramine. De klinische betekenis van deze bevinding is niet bekend. Niettemin is voorzichtigheid geboden bij gelijktijdige toediening van escitalopram en geneesmiddelen die door CYP2D6 worden gemetaboliseerd.
Metoprolol
Toediening van 20 mg/dag Lexapro 20 mg gedurende 21 dagen aan gezonde vrijwilligers resulteerde in een stijging van 50% in Cmax en 82% in AUC van de bèta-adrenerge blokker metoprolol (gegeven in een enkele dosis van 100 mg). Verhoogde plasmaspiegels van metoprolol zijn in verband gebracht met verminderde cardioselectiviteit. Gelijktijdige toediening van Lexapro 5 mg en metoprolol had geen klinisch significant effect op de bloeddruk of hartslag.
Elektroconvulsietherapie (ECT)
Er zijn geen klinische onderzoeken naar het gecombineerde gebruik van ECT en escitalopram.
Drugsmisbruik en afhankelijkheid
Misbruik en afhankelijkheid
Lichamelijke en psychologische afhankelijkheid
Dierstudies suggereren dat de kans op misbruik van racemisch citalopram laag is. Lexapro 10 mg is niet systematisch onderzocht bij mensen vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. De klinische ervaring met Lexapro vóór het op de markt brengen bracht geen zoekgedrag naar geneesmiddelen aan het licht. Deze waarnemingen waren echter niet systematisch en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in hoeverre een geneesmiddel dat op het centrale zenuwstelsel actief is, zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen artsen Lexapro-patiënten zorgvuldig te evalueren op voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen en hen te observeren op tekenen van misbruik of misbruik (bijv. ontwikkeling van tolerantie, dosisverhogingen, gedrag bij het zoeken naar medicijnen).
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Zelfmoordgedachten en -gedrag bij adolescenten en jongvolwassenen
In gepoolde analyses van placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere klassen van antidepressiva) met ongeveer 77.000 volwassen patiënten en 4.500 pediatrische patiënten, was de incidentie van zelfmoordgedachten en -gedragingen bij de met antidepressiva behandelde patiënten van 24 jaar en jonger groter dan bij met placebo behandelde patiënten. Er was een aanzienlijke variatie in het risico op zelfmoordgedachten en -gedrag tussen geneesmiddelen, maar er werd een verhoogd risico vastgesteld bij jonge patiënten voor de meeste onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op zelfmoordgedachten en -gedrag bij de verschillende indicaties, met de hoogste incidentie bij patiënten met MDD. De verschillen tussen geneesmiddelen en placebo's in het aantal gevallen van suïcidale gedachten en gedragingen per 1000 behandelde patiënten worden gegeven in:
Het is niet bekend of het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen zich uitstrekt tot langdurig gebruik, dwz langer dan vier maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met MDD dat antidepressiva de herhaling van depressie vertragen en dat depressie zelf een risicofactor is voor zelfmoordgedachten en zelfmoordgedrag.
Controleer alle patiënten die met antidepressiva worden behandeld op enige indicatie voor klinische verergering en het optreden van zelfmoordgedachten en -gedragingen, vooral tijdens de eerste paar maanden van medicamenteuze behandeling en op tijdstippen van doseringswijzigingen. Raad familieleden of zorgverleners van patiënten aan om te controleren op gedragsveranderingen en om de zorgverlener te waarschuwen. Overweeg het therapeutische regime te wijzigen, met inbegrip van eventuele stopzetting van Lexapro, bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende zelfmoordgedachten of zelfmoordgedrag vertonen.
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld met SNRI's en SSRI's, waaronder Lexapro, alleen maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen, en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine aantasten (in het bijzonder MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid en intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen) toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van Lexapro 10 mg met MAO-remmers bedoeld voor de behandeling van psychiatrische stoornissen is gecontra-indiceerd. Lexapro 5 mg mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die Lexapro gebruikt. Lexapro moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart [zie: CONTRA-INDICATIES en DOSERING EN ADMINISTRATIE ].
Als gelijktijdig gebruik van Lexapro 5 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan, amfetamine en sint-janskruid klinisch gerechtvaardigd is, moeten patiënten op de hoogte worden gesteld van een mogelijk verhoogd risico op het serotoninesyndroom. , vooral tijdens de start van de behandeling en bij dosisverhogingen.

De behandeling met Lexapro en alle gelijktijdig gebruikte serotonerge middelen dient onmiddellijk te worden gestaakt als de bovenstaande voorvallen optreden en een ondersteunende symptomatische behandeling moet worden gestart.
Stopzetting van de behandeling met Lexapro
Tijdens het op de markt brengen van Lexapro en andere SSRI's en SNRI's (serotonine- en noradrenalineheropnameremmers), zijn er spontane meldingen geweest van bijwerkingen die optraden na stopzetting van deze geneesmiddelen, met name bij abrupte, waaronder de volgende: dysfore stemming, prikkelbaarheid, opwinding, duizeligheid, zintuiglijke stoornissen (bijv. paresthesieën zoals het gevoel van elektrische schokken), angst, verwardheid, hoofdpijn, lethargie, emotionele labiliteit, slapeloosheid en hypomanie. Hoewel deze voorvallen over het algemeen zelfbeperkend zijn, zijn er meldingen geweest van ernstige ontwenningsverschijnselen.
Patiënten moeten op deze symptomen worden gecontroleerd wanneer de behandeling met Lexapro wordt stopgezet. Waar mogelijk wordt een geleidelijke verlaging van de dosis aanbevolen in plaats van abrupt stoppen. Als ondraaglijke symptomen optreden na een verlaging van de dosis of na stopzetting van de behandeling, kan worden overwogen om de eerder voorgeschreven dosis te hervatten. Vervolgens kan de arts doorgaan met het verlagen van de dosis, maar in een meer geleidelijk tempo [zie DOSERING EN ADMINISTRATIE ].
epileptische aanvallen
Hoewel anticonvulsieve effecten van racemisch citalopram zijn waargenomen in dierstudies, is Lexapro niet systematisch geëvalueerd bij patiënten met een epileptische aandoening. Deze patiënten werden uitgesloten van klinische onderzoeken tijdens de premarketingtests van het product. In klinische onderzoeken met Lexapro 5 mg zijn gevallen van convulsies gemeld in verband met de behandeling met Lexapro. Net als andere geneesmiddelen die effectief zijn bij de behandeling van depressieve stoornis, dient Lexapro 20 mg met zorg te worden toegediend aan patiënten met een voorgeschiedenis van epileptische stoornis.
Activering van manie of hypomanie
Bij patiënten met een bipolaire stoornis kan de behandeling van een depressieve episode met Lexapro of een ander antidepressivum een gemengde/manische episode uitlokken. In placebogecontroleerde onderzoeken met Lexapro 20 mg bij depressieve stoornis werd activering van manie/hypomanie gemeld bij één (0,1%) van de 715 patiënten die werden behandeld met Lexapro 20 mg en bij geen van de 592 patiënten die werden behandeld met placebo. Er is één extra geval van hypomanie gemeld in verband met de behandeling met Lexapro 10 mg. Activering van manie/hypomanie is ook gemeld bij een klein deel van de patiënten met ernstige affectieve stoornissen die werden behandeld met racemisch citalopram en andere in de handel verkrijgbare geneesmiddelen die effectief zijn bij de behandeling van depressieve stoornis. Voordat de behandeling met Lexapro wordt gestart, moeten patiënten worden gescreend op een persoonlijke of familiale voorgeschiedenis van bipolaire stoornis, manie of hypomanie [zie DOSERING EN ADMINISTRATIE ].
Hyponatriëmie
Hyponatriëmie kan optreden als gevolg van behandeling met SSRI's en SNRI's, waaronder Lexapro. In veel gevallen lijkt deze hyponatriëmie het gevolg te zijn van het syndroom van inadequate secretie van antidiuretisch hormoon (SIADH) en was deze reversibel toen Lexapro 20 mg werd stopgezet. Gevallen met serumnatrium lager dan 110 mmol/L zijn gemeld. Oudere patiënten lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met SSRI's en SNRI's. Ook kunnen patiënten die diuretica gebruiken of die anderszins een volumedepletie hebben een groter risico lopen [zie: Geriatrisch gebruik ]. Bij patiënten met symptomatische hyponatriëmie moet worden overwogen om de behandeling met Lexapro stop te zetten en moet een passende medische interventie worden ingesteld.
Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Tekenen en symptomen die gepaard gaan met ernstigere en/of acute gevallen omvatten hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden.
Abnormale bloeding
SSRI's en SNRI's, waaronder Lexapro 20 mg, kunnen het risico op bloedingen verhogen. Gelijktijdig gebruik van aspirine, niet-steroïde anti-inflammatoire geneesmiddelen, warfarine en andere anticoagulantia kan het risico vergroten. Case-reports en epidemiologische studies (case-control en cohort-design) hebben een verband aangetoond tussen het gebruik van geneesmiddelen die de heropname van serotonine verstoren en het optreden van gastro-intestinale bloedingen. Bloedingen gerelateerd aan het gebruik van SSRI's en SNRI's varieerden van ecchymosen, hematomen, epistaxis en petechiën tot levensbedreigende bloedingen.
Patiënten moeten worden gewaarschuwd voor het risico op bloedingen bij gelijktijdig gebruik van Lexapro 20 mg en NSAID's, aspirine of andere geneesmiddelen die de stolling beïnvloeden.
Interferentie met cognitieve en motorische prestaties
In een onderzoek bij normale vrijwilligers veroorzaakte Lexapro 10 mg/dag geen aantasting van de intellectuele functie of psychomotorische prestaties. Omdat elk psychoactief medicijn het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten echter worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat de Lexapro-therapie geen invloed heeft op hun vermogen om dergelijke activiteiten uit te voeren.
Hoeksluiting glaucoom
Hoeksluiting glaucoom: de pupilverwijding die optreedt na gebruik van veel antidepressiva, waaronder Lexapro 20 mg, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
Gebruik bij patiënten met gelijktijdige ziekte
Klinische ervaring met Lexapro bij patiënten met bepaalde bijkomende systemische ziekten is beperkt. Voorzichtigheid is geboden bij het gebruik van Lexapro 5 mg bij patiënten met ziekten of aandoeningen die een veranderd metabolisme of hemodynamische reacties veroorzaken.
Lexapro is niet systematisch geëvalueerd bij patiënten met een recente voorgeschiedenis van een myocardinfarct of instabiele hartziekte. Patiënten met deze diagnoses werden over het algemeen uitgesloten van klinische onderzoeken tijdens de premarketingtests van het product.
Bij personen met een leverfunctiestoornis was de klaring van racemisch citalopram verlaagd en de plasmaconcentraties verhoogd. De aanbevolen dosis Lexapro bij patiënten met een leverfunctiestoornis is 10 mg/dag [zie: DOSERING EN ADMINISTRATIE ].
Omdat escitalopram uitgebreid wordt gemetaboliseerd, is de uitscheiding van onveranderd geneesmiddel in de urine een minder belangrijke eliminatieroute. Totdat een voldoende aantal patiënten met ernstige nierinsufficiëntie is geëvalueerd tijdens chronische behandeling met Lexapro 20 mg, moet het bij dergelijke patiënten echter met voorzichtigheid worden gebruikt [zie DOSERING EN ADMINISTRATIE ].
Seksuele disfunctie
Het gebruik van SSRI's, waaronder Lexapro, kan symptomen van seksuele disfunctie veroorzaken [zie: ONGEWENSTE REACTIES ]. Bij mannelijke patiënten kan het gebruik van SSRI's leiden tot vertraging of falen van de ejaculatie, verminderd libido en erectiestoornissen. Bij vrouwelijke patiënten kan het gebruik van SSRI's leiden tot een verminderd libido en een vertraagd of afwezig orgasme.
Het is belangrijk voor voorschrijvers om te informeren naar de seksuele functie voordat met Lexapro wordt gestart en om specifiek te informeren naar veranderingen in de seksuele functie tijdens de behandeling, omdat seksuele functie mogelijk niet spontaan wordt gemeld. Bij het evalueren van veranderingen in seksuele functie is het verkrijgen van een gedetailleerde geschiedenis (inclusief timing van het begin van de symptomen) belangrijk omdat seksuele symptomen andere oorzaken kunnen hebben, waaronder de onderliggende psychiatrische stoornis. Bespreek mogelijke managementstrategieën om patiënten te ondersteunen bij het nemen van weloverwogen beslissingen over de behandeling.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Suïcidale gedachten en gedrag
Adviseer patiënten, hun families en verzorgers te letten op het ontstaan van zelfmoordgedachten en -gedrag, vooral tijdens de behandeling en wanneer de dosis naar boven of beneden wordt aangepast, en instrueer hen om dergelijke symptomen aan hun zorgverlener te melden [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
serotonine syndroom
Patiënten moeten worden gewaarschuwd voor het risico op het serotoninesyndroom bij gelijktijdig gebruik van Lexapro met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen en sint-janskruid, en met geneesmiddelen die het metabolisme van serotonine (in het bijzonder MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Activering van manie of hypomanie
Adviseer patiënten en hun zorgverleners om te observeren op tekenen van activering van manie/hypomanie en instrueer hen om dergelijke symptomen aan de zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Abnormale bloeding
Patiënten moeten worden gewaarschuwd voor het gelijktijdig gebruik van Lexapro 5 mg en NSAID's, aspirine, warfarine of andere geneesmiddelen die de stolling beïnvloeden, aangezien gecombineerd gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren en deze middelen in verband zijn gebracht met een verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hoeksluiting glaucoom
Patiënten moeten erop worden gewezen dat het gebruik van Lexapro 5 mg lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen misschien worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Seksuele disfunctie
Adviseer patiënten dat het gebruik van Lexapro symptomen van seksuele disfunctie kan veroorzaken bij zowel mannelijke als vrouwelijke patiënten. Informeer patiënten dat ze eventuele veranderingen in de seksuele functie en mogelijke managementstrategieën met hun zorgverlener moeten bespreken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Aangezien escitalopram het actieve isomeer is van racemisch citalopram (Celexa), dienen de twee middelen niet gelijktijdig te worden toegediend. Patiënten moeten worden geadviseerd hun arts te informeren als zij geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, aangezien er een kans op interacties bestaat.
Voortzetting van de voorgeschreven therapie
Hoewel patiënten na 1 tot 4 weken verbetering kunnen merken met de behandeling met Lexapro 10 mg, moet hen worden geadviseerd de behandeling voort te zetten zoals voorgeschreven.
Interferentie met psychomotorische prestaties
Omdat psychoactieve drugs het beoordelingsvermogen, het denken of de motoriek kunnen aantasten, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat de Lexapro-therapie geen invloed heeft op hun vermogen om dergelijke activiteiten uit te voeren.
Alcohol
Patiënten moeten worden verteld dat, hoewel in experimenten met normale proefpersonen niet is aangetoond dat Lexapro 5 mg de mentale en motorische stoornissen veroorzaakt door alcohol verhoogt, het gelijktijdig gebruik van Lexapro 20 mg en alcohol bij depressieve patiënten niet wordt aanbevolen.
Zwangerschap
Adviseer zwangere vrouwen om hun zorgverleners op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met LEXAPRO. Adviseer patiënten dat LEXAPRO 10 mg later in de zwangerschap gebruikt kan leiden tot een verhoogd risico op neonatale complicaties die langdurige ziekenhuisopname, ademhalingsondersteuning, sondevoeding en/of aanhoudende pulmonale hypertensie (PPHN) van de pasgeborene vereisen [zie Gebruik bij specifieke populaties ].
Adviseer vrouwen dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan LEXAPRO zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven en LEXAPRO gebruiken om baby's te controleren op overmatige sedatie, rusteloosheid, opwinding, slechte voeding en slechte gewichtstoename en om medische hulp in te roepen als ze deze symptomen opmerken [zie Gebruik bij specifieke populaties ].
Behoefte aan een uitgebreid behandelprogramma
Lexapro 20 mg is geïndiceerd als een integraal onderdeel van een totaal behandelingsprogramma voor MDD dat andere maatregelen kan omvatten (psychologische, educatieve, sociale) voor patiënten met dit syndroom. Medicamenteuze behandeling is mogelijk niet geïndiceerd voor alle adolescenten met dit syndroom. De veiligheid en werkzaamheid van Lexapro 10 mg bij MDD zijn niet vastgesteld bij pediatrische patiënten jonger dan 12 jaar. Antidepressiva zijn niet bedoeld voor gebruik bij adolescenten die symptomen vertonen die secundair zijn aan omgevingsfactoren en/of andere primaire psychiatrische stoornissen. Passende onderwijsplaatsing is essentieel en psychosociale interventie is vaak nuttig. Wanneer corrigerende maatregelen alleen onvoldoende zijn, zal de beslissing om antidepressiva voor te schrijven afhangen van de beoordeling door de arts van de chroniciteit en ernst van de symptomen van de patiënt.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Racemisch citalopram werd in het dieet toegediend aan muizen van de NMRI/BOM-stam en ratten van de COBS WI-stam gedurende respectievelijk 18 en 24 maanden. Er was geen bewijs voor carcinogeniteit van racemisch citalopram bij muizen die tot 240 mg/kg/dag kregen. Er was een verhoogde incidentie van dunnedarmcarcinoom bij ratten die 8 of 24 mg/kg/dag racemisch citalopram kregen. Een dosis zonder effect voor deze bevinding werd niet vastgesteld. De relevantie van deze bevindingen voor de mens is niet bekend.
Mutagenese
Racemisch citalopram was mutageen in de in vitro bacteriële reverse-mutatietest (Ames-test) in 2 van de 5 bacteriestammen (Salmonella TA98 en TA1537) in afwezigheid van metabole activering. Het was clastogeen in de in vitro Chinese hamsterlongceltest voor chromosomale afwijkingen in aanwezigheid en afwezigheid van metabolische activering. Racemisch citalopram was niet mutageen in de in vitro voorwaartse genmutatietest bij zoogdieren (HPRT) in lymfoomcellen van muizen of in een gekoppelde in vitro/in vivo ongeplande DNA-synthese (UDS)-test in rattenlever. Het was niet clastogeen in de in vitro chromosomale aberratie-assay in menselijke lymfocyten of in twee in vivo micronucleus-assays bij muizen.
Aantasting van de vruchtbaarheid
Wanneer racemisch citalopram oraal werd toegediend aan 16 mannelijke en 24 vrouwelijke ratten vóór en tijdens de paring en dracht in doses van 32, 48 en 72 mg/kg/dag, was de paring bij alle doses verminderd en nam de vruchtbaarheid af bij doses ≥ 32 mg/kg/dag. De draagtijd werd verlengd tot 48 mg/kg/dag.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan antidepressiva zijn blootgesteld. Zorgaanbieders worden aangemoedigd om patiënten te registreren door de National Pregnancy Registry for Antidepressants te bellen op 1-844-405-6185 of online te bezoeken op https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Risico Samenvatting
Beschikbare gegevens uit gepubliceerde epidemiologische onderzoeken en postmarketingrapporten hebben geen verhoogd risico op ernstige geboorteafwijkingen of miskraam aangetoond. Er zijn risico's op aanhoudende pulmonale hypertensie van de pasgeborene (PPHN) (zie: Gegevens ) en slechte neonatale aanpassing (zie Klinische overwegingen ) met blootstelling aan selectieve serotonineheropnameremmers (SSRI's), waaronder LEXAPRO 5 mg, tijdens de zwangerschap. Er zijn risico's verbonden aan onbehandelde depressie tijdens de zwangerschap (zie: Klinische overwegingen ).
In reproductiestudies bij dieren is aangetoond dat zowel escitalopram als racemisch citalopram nadelige effecten hebben op de embryonale/foetale en postnatale ontwikkeling, inclusief foetale structurele afwijkingen, wanneer ze worden toegediend in doses die hoger zijn dan de therapeutische doses bij de mens (zie Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale risico en/of embryo/foetaal risico
Vrouwen die stoppen met antidepressiva hebben meer kans op een terugval van een ernstige depressie dan vrouwen die doorgaan met antidepressiva. Deze bevinding komt uit een prospectief longitudinaal onderzoek onder 201 zwangere vrouwen met een voorgeschiedenis van ernstige depressie, die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten. Overweeg het risico op onbehandelde depressie bij het stopzetten of wijzigen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Foetale/neonatale bijwerkingen
Pasgeborenen die laat in het derde trimester zijn blootgesteld aan SSRI's of SNRI's, waaronder Lexapro 5 mg, hebben complicaties ontwikkeld die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen. Dergelijke complicaties kunnen direct na de bevalling optreden. Gerapporteerde klinische bevindingen omvatten ademnood, cyanose, apneu, toevallen, temperatuurinstabiliteit, voedingsproblemen, braken, hypoglykemie, hypotonie, hypertonie, hyperreflexie, tremor, zenuwachtigheid, prikkelbaarheid en constant huilen. Deze kenmerken komen overeen met ofwel een direct toxisch effect van SSRI's en SNRI's of, mogelijk, een syndroom van stopzetting van het geneesmiddel. Opgemerkt moet worden dat in sommige gevallen het klinische beeld consistent is met het serotoninesyndroom [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gegevens
Menselijke gegevens
Blootstelling aan SSRI's, vooral later in de zwangerschap, kan het risico op PPHN verhogen. PPHN komt voor bij 1-2 per 1000 levendgeborenen in de algemene bevolking en is geassocieerd met aanzienlijke neonatale morbiditeit en mortaliteit.
Dierlijke gegevens
In een onderzoek naar de ontwikkeling van het embryo/de foetus bij ratten resulteerde orale toediening van escitalopram (56, 112 of 150 mg/kg/dag) aan drachtige dieren tijdens de periode van organogenese in een verminderd foetaal lichaamsgewicht en bijbehorende vertragingen in de ossificatie bij de twee hogere doses. [ongeveer ≥ 55 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 20 mg/dag op basis van mg/m2]. Maternale toxiciteit (klinische tekenen en verminderde lichaamsgewichtstoename en voedselconsumptie), mild bij 56 mg/kg/dag, was aanwezig bij alle dosisniveaus. De ontwikkelingsdosis zonder effect van 56 mg/kg/dag is ongeveer 27 maal de MRHD van 20 mg op basis van mg/m2. Bij geen van de geteste doses werden misvormingen waargenomen (tot wel 73 keer de MRHD op basis van mg/m2).
Wanneer vrouwtjesratten werden behandeld met escitalopram (6, 12, 24 of 48 mg/kg/dag) tijdens de dracht en tijdens het spenen, werd een licht verhoogde sterfte van nakomelingen en groeivertraging waargenomen bij 48 mg/kg/dag, wat ongeveer 23 keer de MRHD van 20 mg op basis van mg/m2. Bij deze dosis werd lichte maternale toxiciteit (klinische tekenen en verminderde lichaamsgewichtstoename en voedselconsumptie) waargenomen. Licht verhoogde nakomelingensterfte werd ook gezien bij 24 mg/kg/dag. De dosis zonder effect was 12 mg/kg/dag, wat ongeveer 6 keer de MRHD is van 20 mg op basis van mg/m2.
In twee onderzoeken naar de ontwikkeling van embryo's/foetussen bij ratten resulteerde orale toediening van racemisch citalopram (32, 56 of 112 mg/kg/dag) aan drachtige dieren tijdens de periode van organogenese in verminderde embryo/foetale groei en overleving en een verhoogde incidentie van foetale afwijkingen (inclusief cardiovasculaire en skeletafwijkingen) bij de hoge dosis, die ongeveer 18 keer de MRHD is van 60 mg/dag op basis van mg/m2. Deze dosis werd ook in verband gebracht met maternale toxiciteit (klinische symptomen, verminderde lichaamsgewichtstoename). De ontwikkelingsdosis zonder effect was 56 mg/kg/dag, wat ongeveer 9 keer de MRHD is op basis van mg/m2. In een onderzoek met konijnen werden geen nadelige effecten op de embryonale/foetale ontwikkeling waargenomen bij doses racemisch citalopram tot 16 mg/kg/dag, of ongeveer 5 maal de MRHD op basis van mg/m2. Zo werden ontwikkelingseffecten van racemisch citalopram waargenomen bij een maternaal toxische dosis bij ratten en niet bij konijnen.
Wanneer vrouwelijke ratten werden behandeld met racemisch citalopram (4,8, 12,8 of 32 mg/kg/dag) vanaf de late dracht tot aan het spenen, werd een verhoogde sterfte van de nakomelingen gedurende de eerste 4 dagen na de geboorte en een aanhoudende groeivertraging van de nakomelingen waargenomen bij de hoogste dosis, die is ongeveer 5 keer de MRHD van 60 mg op basis van mg/m2. De dosis zonder effect was 12,8 mg/kg/dag, wat ongeveer 2 keer de MRHD is op basis van mg/m2. Vergelijkbare effecten op de sterfte en groei van nakomelingen werden gezien wanneer moederdieren gedurende de hele dracht en vroege lactatie werden behandeld met doses 24 mg/kg/dag, ongeveer 4 keer de MRHD op basis van mg/m2. In dat onderzoek werd geen dosis zonder effect vastgesteld.
Borstvoeding
Risico Samenvatting
Gegevens uit de gepubliceerde literatuur melden de aanwezigheid van escitalopram en desmethylescitalopram in moedermelk (zie Gegevens ). Er zijn meldingen van overmatige sedatie, rusteloosheid, opwinding, slechte voeding en slechte gewichtstoename bij zuigelingen die zijn blootgesteld aan escitalopram via de moedermelk (zie Klinische overwegingen ),. Er zijn geen gegevens over de effecten van escitalopram of zijn metabolieten op de melkproductie. Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan LEXAPRO 5 mg en eventuele nadelige effecten op het kind dat borstvoeding krijgt van LEXAPRO of van de onderliggende maternale aandoening.
Klinische overwegingen
Baby's die zijn blootgesteld aan LEXAPRO 20 mg moeten worden gecontroleerd op overmatige sedatie, rusteloosheid, opwinding, slechte voeding en slechte gewichtstoename.
Gegevens
Uit een onderzoek onder 8 moeders die borstvoeding gaven op escitalopram met dagelijkse doses van 10-20 mg/dag bleek dat uitsluitend zuigelingen die borstvoeding kregen ongeveer 3,9% van de voor het gewicht van de moeder aangepaste dosis escitalopram en 1,7% van de voor het gewicht van de moeder aangepaste dosis desmethylcitalopram kregen. .
Pediatrisch gebruik
De veiligheid en werkzaamheid van Lexapro 10 mg zijn vastgesteld bij adolescenten (12 tot 17 jaar) voor de behandeling van depressieve stoornis [zie Klinische studies ]. Hoewel de onderhoudswerkzaamheid bij adolescente patiënten met depressieve stoornis niet systematisch is geëvalueerd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van escitalopram bij volwassenen en adolescente patiënten.
De veiligheid en werkzaamheid van Lexapro zijn niet vastgesteld bij pediatrische (jonger dan 12 jaar) patiënten met depressieve stoornis. In een 24 weken durende, open-label veiligheidsstudie bij 118 kinderen (in de leeftijd van 7 tot 11 jaar) met een depressieve stoornis, kwamen de veiligheidsbevindingen overeen met het bekende veiligheids- en verdraagbaarheidsprofiel voor Lexapro.
De veiligheid en werkzaamheid van Lexapro zijn niet vastgesteld bij pediatrische patiënten jonger dan 18 jaar met gegeneraliseerde angststoornis.
Verminderde eetlust en gewichtsverlies zijn waargenomen in verband met het gebruik van SSRI's. Daarom moet het gewicht en de groei regelmatig worden gecontroleerd bij kinderen en adolescenten die worden behandeld met een SSRI zoals Lexapro.
Geriatrisch gebruik
Ongeveer 6% van de 1144 patiënten die escitalopram kregen in gecontroleerde onderzoeken met Lexapro 10 mg bij depressieve stoornis en GAS was 60 jaar of ouder; oudere patiënten in deze onderzoeken kregen dagelijkse doses Lexapro tussen 10 en 20 mg. Het aantal oudere patiënten in deze onderzoeken was onvoldoende om adequaat te beoordelen op mogelijke differentiële werkzaamheids- en veiligheidsmaatregelen op basis van leeftijd. Niettemin kan een grotere gevoeligheid van sommige oudere personen voor de effecten van Lexapro niet worden uitgesloten.
SSRI's en SNRI's, waaronder Lexapro 5 mg, zijn in verband gebracht met gevallen van klinisch significante hyponatriëmie bij oudere patiënten, die mogelijk een groter risico lopen op deze bijwerking [zie Hyponatriëmie ].
In twee farmacokinetische onderzoeken was de halfwaardetijd van escitalopram bij oudere proefpersonen met ongeveer 50% verhoogd in vergelijking met jonge proefpersonen en was de Cmax onveranderd [zie KLINISCHE FARMACOLOGIE ]. 10 mg/dag is de aanbevolen dosis voor oudere patiënten [zie DOSERING EN ADMINISTRATIE ].
Van de 4422 patiënten in klinische onderzoeken met racemisch citalopram waren 1357 60 jaar en ouder, 1034 65 jaar en ouder en 457 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar nogmaals, een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
OVERDOSERING
Het volgende is gemeld bij overdosering van Lexapro-tabletten:
- Toevallen, die vertraagd kunnen zijn, en veranderde mentale toestand, waaronder coma.
- Cardiovasculaire toxiciteit, die vertraagd kan zijn, waaronder verlenging van het QRS- en QTc-interval, breedcomplexe tachyaritmieën en torsade de pointes. Hypertensie komt het meest voor, maar kan zelden hypotensie alleen of met gelijktijdige inname, waaronder alcohol, zien.
- Serotoninesyndroom (patiënten met een overdosering van meerdere geneesmiddelen met andere proserotonerge geneesmiddelen kunnen een hoger risico hebben).
Langdurige hartbewaking wordt aanbevolen bij inname van overdosering met Lexapro vanwege het risico op aritmie.
Bij patiënten die zich vroeg na een overdosis Lexapro presenteren, dient maag-darmontsmetting met actieve kool te worden overwogen.
Overweeg contact op te nemen met een antigifcentrum (1-800-221-2222) of een medisch toxicoloog voor aanbevelingen voor het beheer van overdosering.
CONTRA-INDICATIES
Monoamineoxidaseremmers (MAO-remmers)
Het gebruik van MAO-remmers die bedoeld zijn voor de behandeling van psychiatrische stoornissen met Lexapro of binnen 14 dagen na het stoppen van de behandeling met Lexapro 5 mg is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van Lexapro 20 mg binnen 14 dagen na het stoppen van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen is ook gecontra-indiceerd [zie DOSERING EN ADMINISTRATIE , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het starten van Lexapro 20 mg bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom [zie DOSERING EN ADMINISTRATIE , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pimozide
Gelijktijdig gebruik bij patiënten die pimozide gebruiken, is gecontra-indiceerd [zie: DRUG-INTERACTIES ].
Overgevoeligheid voor escitalopram of citalopram
Lexapro 20 mg is gecontra-indiceerd bij patiënten met een overgevoeligheid voor escitalopram of citalopram of voor een van de inactieve ingrediënten in Lexapro.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Aangenomen wordt dat het antidepressieve werkingsmechanisme van escitalopram, het S-enantiomeer van racemisch citalopram, verband houdt met de versterking van de serotonerge activiteit in het centrale zenuwstelsel (CZS) als gevolg van de remming van de neuronale heropname van serotonine in het CZS (5-HT).
farmacodynamiek
In-vitro- en in-vivo-onderzoeken bij dieren suggereren dat escitalopram een zeer selectieve serotonineheropnameremmer (SSRI) is met minimale effecten op de heropname van noradrenaline en dopamine. Escitalopram is ten minste 100 keer krachtiger dan de R-enantiomeer met betrekking tot remming van 5-HT-heropname en remming van 5-HT-neuronale ontstekingssnelheid. Tolerantie voor een model van antidepressief effect bij ratten werd niet veroorzaakt door langdurige (tot 5 weken) behandeling met escitalopram. Escitalopram heeft geen of een zeer lage affiniteit voor serotonerge (5-HT1-7) of andere receptoren, waaronder alfa- en bèta-adrenerge, dopamine (D1-5), histamine (H1-3), muscarine (M1-5) en benzodiazepine receptoren. Escitalopram bindt ook niet aan, of heeft een lage affiniteit voor, verschillende ionkanalen, waaronder Na+-, K+-, Cl- en Ca++-kanalen. Er wordt verondersteld dat antagonisme van muscarine-, histaminerge en adrenerge receptoren geassocieerd is met verschillende anticholinerge, sedatieve en cardiovasculaire bijwerkingen van andere psychotrope geneesmiddelen.
Farmacokinetiek
De farmacokinetiek van enkelvoudige en meervoudige doses van escitalopram is lineair en dosisproportioneel in een dosisbereik van 10 tot 30 mg/dag. De biotransformatie van escitalopram vindt voornamelijk in de lever plaats, met een gemiddelde terminale halfwaardetijd van ongeveer 27-32 uur. Bij eenmaal daagse dosering worden steady-state plasmaconcentraties binnen ongeveer een week bereikt. Bij steady-state was de mate van accumulatie van escitalopram in plasma bij jonge gezonde proefpersonen 2,2-2,5 keer de plasmaconcentraties waargenomen na een enkele dosis. De tablet- en drankdoseringsvormen van escitalopramoxalaat zijn bio-equivalent.
Absorptie en distributie
Na een enkelvoudige orale dosis (20 mg tablet of oplossing) escitalopram treden piekbloedspiegels op na ongeveer 5 uur. De absorptie van escitalopram wordt niet beïnvloed door voedsel.
De absolute biologische beschikbaarheid van citalopram is ongeveer 80% ten opzichte van een intraveneuze dosis en het distributievolume van citalopram is ongeveer 12 l/kg. Specifieke gegevens over escitalopram zijn niet beschikbaar.
De binding van escitalopram aan humane plasma-eiwitten is ongeveer 56%.
Metabolisme en eliminatie
Na orale toediening van escitalopram is de fractie van het geneesmiddel die in de urine wordt teruggevonden als escitalopram en S-demethylcitalopram (S-DCT) respectievelijk ongeveer 8% en 10%. De orale klaring van escitalopram is 600 ml/min, waarvan ongeveer 7% door renale klaring.
Escitalopram wordt gemetaboliseerd tot S-DCT en S-didemethylcitalopram (S-DDCT). Bij mensen is onveranderd escitalopram de belangrijkste verbinding in plasma. Bij steady state is de concentratie van de escitaloprammetaboliet S-DCT in plasma ongeveer een derde van die van escitalopram. Het niveau van S-DDCT was bij de meeste proefpersonen niet detecteerbaar. In vitro-onderzoeken tonen aan dat escitalopram ten minste 7 en 27 keer krachtiger is dan respectievelijk S-DCT en S-DDCT wat betreft de remming van de heropname van serotonine, wat suggereert dat de metabolieten van escitalopram niet significant bijdragen aan de antidepressieve werking van escitalopram. S-DCT en SDDCT hebben ook geen of een zeer lage affiniteit voor serotonerge (5-HT1-7) of andere receptoren, waaronder alfa- en bèta-adrenerge, dopamine (D1-5), histamine (H1-3), muscarine (M1- 5), en benzodiazepinereceptoren. S-DCT en S-DDCT binden ook niet aan verschillende ionkanalen, waaronder Na+-, K+-, Cl- en Ca++-kanalen.
In vitro-onderzoeken met humane levermicrosomen gaven aan dat CYP3A4 en CYP2C19 de primaire iso-enzymen zijn die betrokken zijn bij de N-demethylering van escitalopram.
Bevolkingssubgroepen
Leeftijd
adolescenten
In een onderzoek met een enkelvoudige dosis van 10 mg escitalopram daalde de AUC van escitalopram met 19% en nam de Cmax met 26% toe bij gezonde adolescente proefpersonen (12 tot 17 jaar) in vergelijking met volwassenen. Na meervoudige dosering van 40 mg/dag citalopram waren de eliminatiehalfwaardetijd van escitalopram, de steady-state Cmax en AUC vergelijkbaar bij patiënten met MDD (12 tot 17 jaar) vergeleken met volwassen patiënten. Bij adolescente patiënten is geen dosisaanpassing nodig.
Ouderen
De farmacokinetiek van escitalopram bij proefpersonen ≥ 65 jaar werd vergeleken met jongere proefpersonen in een onderzoek met enkelvoudige en meervoudige doses. De AUC en halfwaardetijd van escitalopram waren bij oudere proefpersonen met ongeveer 50% verhoogd en de Cmax was onveranderd. 10 mg is de aanbevolen dosis voor oudere patiënten [zie DOSERING EN ADMINISTRATIE ].
Geslacht
Op basis van gegevens uit onderzoeken met enkelvoudige en meervoudige doses waarbij escitalopram werd gemeten bij ouderen, jonge volwassenen en adolescenten, is geen dosisaanpassing op basis van geslacht nodig.
Verminderde leverfunctie
De orale klaring van citalopram was met 37% verminderd en de halfwaardetijd was verdubbeld bij patiënten met een verminderde leverfunctie in vergelijking met normale proefpersonen. 10 mg is de aanbevolen dosis escitalopram voor de meeste patiënten met een leverfunctiestoornis [zie: DOSERING EN ADMINISTRATIE ].
Verminderde nierfunctie
Bij patiënten met een lichte tot matige nierfunctiestoornis was de orale klaring van citalopram met 17% verminderd in vergelijking met normale proefpersonen. Aanpassing van de dosering voor dergelijke patiënten wordt niet aanbevolen. Er is geen informatie beschikbaar over de farmacokinetiek van escitalopram bij patiënten met een ernstig verminderde nierfunctie (creatinineklaring
Geneesmiddel-geneesmiddelinteracties
In vitro enzymremmingsgegevens lieten geen remmend effect van escitalopram op CYP3A4, -1A2, -2C9, -2C19 en -2E1 zien. Op basis van in vitro gegevens wordt verwacht dat escitalopram weinig remmend effect heeft op het in vivo metabolisme dat wordt gemedieerd door deze cytochromen. Hoewel in vivo gegevens om deze vraag te beantwoorden beperkt zijn, suggereren de resultaten van geneesmiddelinteractiestudies dat escitalopram, in een dosis van 20 mg, geen 3A4-remmend effect en een bescheiden 2D6-remmend effect heeft. Zien DRUG-INTERACTIES voor meer gedetailleerde informatie over beschikbare gegevens over geneesmiddelinteracties.
Dierlijke toxicologie en/of farmacologie
Netvliesveranderingen bij ratten
Pathologische veranderingen (degeneratie/atrofie) werden waargenomen in het netvlies van albinoratten in het 2 jaar durende carcinogeniteitsonderzoek met racemisch citalopram. Er was een toename in zowel de incidentie als de ernst van retinale pathologie bij zowel mannelijke als vrouwelijke ratten die 80 mg/kg/dag kregen. Soortgelijke bevindingen waren niet aanwezig bij ratten die gedurende twee jaar 24 mg/kg/dag racemisch citalopram kregen, bij muizen die gedurende 18 maanden tot 240 mg/kg/dag racemisch citalopram kregen, of bij honden die tot 20 mg/kg/dag kregen. dag van racemisch citalopram gedurende één jaar.
Er zijn geen aanvullende onderzoeken uitgevoerd om het mechanisme voor deze pathologie te onderzoeken en de mogelijke significantie van dit effect bij mensen is niet vastgesteld.
Cardiovasculaire veranderingen bij honden
In een eenjarig toxicologisch onderzoek stierven 5 van de 10 beagle-honden die orale racemisch citalopram-doses van 8 mg/kg/dag kregen, plotseling tussen week 17 en 31 na aanvang van de behandeling. Plotselinge sterfte werd niet waargenomen bij ratten bij doses racemisch citalopram tot 120 mg/kg/dag, die plasmaspiegels van citalopram en zijn metabolieten demethylcitalopram en didemethylcitalopram (DDCT) produceerden die vergelijkbaar waren met die waargenomen bij honden bij 8 mg/kg/dag. Een daaropvolgend onderzoek naar intraveneuze toediening toonde aan dat racemische DDCT bij beagle-honden QT-verlenging veroorzaakte, een bekende risicofactor voor de waargenomen uitkomst bij honden.
Klinische studies
Ernstige depressieve stoornis
adolescenten
De werkzaamheid van Lexapro als acute behandeling van depressieve stoornis bij adolescente patiënten werd vastgesteld in een 8 weken durende, flexibele dosis, placebogecontroleerde studie waarin Lexapro 10-20 mg/dag werd vergeleken met placebo bij poliklinische patiënten van 12 tot 17 jaar oud. inclusief die voldeden aan de DSM-IV-criteria voor depressieve stoornis. De primaire uitkomstmaat was verandering van baseline tot eindpunt in de Children's Depression Rating Scale - Revised (CDRS-R). In deze studie vertoonde Lexapro 5 mg een statistisch significant grotere gemiddelde verbetering in vergelijking met placebo op de CDRS-R.
De werkzaamheid van Lexapro bij de acute behandeling van depressieve stoornis bij adolescenten werd gedeeltelijk vastgesteld op basis van extrapolatie van het 8 weken durende, placebogecontroleerde, placebogecontroleerde onderzoek met racemisch citalopram 20-40 mg/dag. In dit poliklinische onderzoek bij kinderen en adolescenten van 7 tot 17 jaar die voldeden aan de DSM-IV-criteria voor depressieve stoornis, liet de behandeling met citalopram een statistisch significant grotere gemiddelde verbetering zien vanaf baseline, vergeleken met placebo, op de CDRS-R; de positieve resultaten voor deze studie kwamen grotendeels van de subgroep adolescenten.
Twee aanvullende, placebogecontroleerde MDD-onderzoeken met flexibele doses (één Lexapro-onderzoek bij patiënten van 7 tot 17 jaar en één citalopramonderzoek bij adolescenten) toonden geen werkzaamheid aan.
Hoewel de onderhoudswerkzaamheid bij adolescente patiënten niet systematisch is geëvalueerd, kan de onderhoudswerkzaamheid worden geëxtrapoleerd uit gegevens voor volwassenen, samen met vergelijkingen van de farmacokinetische parameters van escitalopram bij volwassenen en adolescente patiënten.
volwassenen
De werkzaamheid van Lexapro 5 mg voor de behandeling van depressieve stoornis werd vastgesteld in drie, 8 weken durende, placebogecontroleerde onderzoeken die werden uitgevoerd bij poliklinische patiënten tussen 18 en 65 jaar die voldeden aan de DSM-IV-criteria voor depressieve stoornis. De primaire uitkomstmaat in alle drie de onderzoeken was verandering van baseline tot eindpunt in de Montgomery Asberg Depression Rating Scale (MADRS).
Een studie met een vaste dosis vergeleek 10 mg/dag Lexapro en 20 mg/dag Lexapro met placebo en 40 mg/dag citalopram. De 10 mg/dag en 20 mg/dag Lexapro 5 mg behandelingsgroepen vertoonden een statistisch significant grotere gemiddelde verbetering vergeleken met placebo op de MADRS. De groepen van 10 mg en 20 mg Lexapro waren vergelijkbaar op deze uitkomstmaat.
In een tweede onderzoek met een vaste dosis van 10 mg/dag Lexapro en placebo, vertoonde de 10 mg/dag Lexapro-behandelingsgroep een statistisch significant grotere gemiddelde verbetering in vergelijking met placebo op de MADRS.
In een studie met flexibele doses, waarin Lexapro 20 mg, getitreerd tussen 10 en 20 mg/dag, werd vergeleken met placebo en citalopram, getitreerd tussen 20 en 40 mg/dag, vertoonde de behandelingsgroep met Lexapro 5 mg een statistisch significant grotere gemiddelde verbetering vergeleken met placebo op de MADRS.
Analyses van de relatie tussen behandeluitkomst en leeftijd, geslacht en ras suggereerden geen differentiële respons op basis van deze patiëntkenmerken.
In een onderzoek op langere termijn werden 274 patiënten die voldeden aan de (DSM-IV) criteria voor depressieve stoornis en die tijdens een eerste 8 weken durende open-label behandelingsfase met Lexapro 10 of 20 mg/dag hadden gereageerd, gerandomiseerd naar voortzetting van Lexapro. in dezelfde dosis, of voor placebo, gedurende maximaal 36 weken observatie voor terugval. Respons tijdens de open-label fase werd gedefinieerd als een verlaging van de MADRS-totaalscore tot ≤ 12. Terugval tijdens de dubbelblinde fase werd gedefinieerd als een verhoging van de MADRS-totaalscore tot ≥ 22, of stopzetting wegens onvoldoende klinische respons . Patiënten die Lexapro kregen, ondervonden een statistisch significant langere tijd tot terugval in vergelijking met degenen die placebo kregen.
Gegeneraliseerde angststoornis
De werkzaamheid van Lexapro 5 mg bij de acute behandeling van gegeneraliseerde angststoornis (GAD) werd aangetoond in drie, 8 weken durende, multicenter, flexibele dosis, placebogecontroleerde onderzoeken waarin Lexapro 10-20 mg/dag werd vergeleken met placebo bij volwassen poliklinische patiënten tussen 18 en 80 jaar oud die voldeden aan de DSM-IV-criteria voor GAD. In alle drie de onderzoeken liet Lexapro een statistisch significant grotere gemiddelde verbetering zien in vergelijking met placebo op de Hamilton Anxiety Scale (HAM-A).
Er waren te weinig patiënten in verschillende etnische groepen en leeftijdsgroepen om adequaat te kunnen beoordelen of Lexapro al dan niet differentiële effecten heeft in deze groepen. Er was geen verschil in respons op Lexapro tussen mannen en vrouwen.
PATIËNT INFORMATIE
Lexapro® (leks-a-pro) (escitalopram) Tabletten/orale oplossing
Lees de medicatiehandleiding die bij Lexapro wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze medicatiehandleiding vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling. Praat met uw zorgverlener als u iets niet begrijpt of waar u meer over wilt weten.
Wat is de belangrijkste informatie die ik over Lexapro 20 mg moet weten?
Lexapro 10 mg en andere antidepressiva kunnen ernstige bijwerkingen veroorzaken, waaronder:
Bewaar alle vervolgbezoeken bij uw zorgverlener en bel tussen bezoeken als u zich zorgen maakt over symptomen.
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 als zich een noodgeval voordoet, vooral als ze nieuw zijn, erger zijn of u zich zorgen maken:
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 in een noodgeval. Lexapro kan in verband worden gebracht met deze ernstige bijwerkingen:
Symptomen bij mannen kunnen zijn:
Symptomen bij vrouwen kunnen zijn:
Neem contact op met uw zorgverlener als u veranderingen in uw seksuele functie krijgt of als u vragen of zorgen heeft over seksuele problemen tijdens de behandeling met Lexapro. Er kunnen behandelingen zijn die uw zorgverlener kan voorstellen.
- Lexapro 5 mg en andere antidepressiva kunnen zelfmoordgedachten of -acties doen toenemen bij sommige kinderen, tieners of jonge volwassenen binnen de eerste paar maanden van de behandeling of wanneer de dosis wordt gewijzigd.
- Depressie of andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van suïcidale gedachten of acties.
- Let op deze veranderingen en bel onmiddellijk uw zorgverlener als u merkt:
- Nieuwe of plotselinge veranderingen in stemming, gedrag, acties, gedachten of gevoelens, vooral als ze ernstig zijn.
- Besteed bijzondere aandacht aan dergelijke veranderingen wanneer Lexapro 5 mg wordt gestart of wanneer de dosis wordt gewijzigd.
- pogingen om zelfmoord te plegen
- handelen op gevaarlijke impulsen
- agressief of gewelddadig handelen
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere depressie
- nieuwe of ergere angst- of paniekaanvallen
- zich geagiteerd, rusteloos, boos of prikkelbaar voelen
- Moeite met slapen
- een toename in activiteit of meer praten dan normaal voor u is
- andere ongewone veranderingen in gedrag of stemming
- agitatie, hallucinaties, coma of andere veranderingen in mentale toestand
- coördinatieproblemen of spiertrekkingen (overactieve reflexen)
- snelle hartslag, hoge of lage bloeddruk
- zweten of koorts
- misselijkheid, braken of diarree
- spierstijfheid
- moeite met ademhalen
- zwelling van het gezicht, de tong, de ogen of de mond
- uitslag, jeukende striemen (netelroos) of blaren, alleen of met koorts of gewrichtspijn
- sterk verhoogde energie
- ernstige slaapproblemen
- snelle gedachten
- roekeloos gedrag
- ongewoon grootse ideeën
- overmatig geluk of prikkelbaarheid
- meer of sneller praten dan normaal
- hoofdpijn
- zwakte of onvast gevoel
- verwarring, concentratie- of denkproblemen of geheugenproblemen
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
- Vertraagde ejaculatie of onvermogen om een ejaculatie te krijgen
- Verminderde zin in seks
- Problemen met het krijgen of behouden van een erectie
- Verminderde zin in seks
- Vertraagd orgasme of onvermogen om een orgasme te krijgen
Stop niet met Lexapro zonder eerst met uw zorgverlener te overleggen. Te snel stoppen met Lexapro 5 mg kan ernstige symptomen veroorzaken, waaronder:
- angst, prikkelbaarheid, hoog of laag humeur, rusteloosheid of veranderingen in slaapgewoonten
- hoofdpijn, zweten, misselijkheid, duizeligheid
- elektrische schokachtige sensaties, beven, verwarring
Wat is Lexapro?
Lexapro 20 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van depressie. Het is belangrijk om met uw zorgverlener te praten over de risico's van het behandelen van depressie en ook de risico's van het niet behandelen ervan. U dient alle behandelkeuzes met uw zorgverlener te bespreken. Lexapro wordt ook gebruikt voor de behandeling van:
- Depressieve stoornis (MDD)
- Gegeneraliseerde angststoornis (GAD)
Neem contact op met uw zorgverlener als u denkt dat uw toestand niet beter wordt met de behandeling met Lexapro.
Wie mag Lexapro 5 mg niet gebruiken?
Gebruik Lexapro 10 mg niet als u:
Mensen die Lexapro 20 mg op tijd innemen in de buurt van een MAO-remmer, kunnen ernstige of zelfs levensbedreigende bijwerkingen krijgen. Roep meteen medische hulp in als u een van deze symptomen heeft:
- allergisch bent voor escitalopram of citalopram of voor één van de bestanddelen van Lexapro. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in Lexapro.
- Neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, waaronder linezolid.
- Neem geen MAO-remmer binnen 2 weken na het stoppen met Lexapro 10 mg, tenzij uw arts u heeft gevraagd dit te doen
- Begin niet met Lexapro 20 mg als u de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw arts u heeft gevraagd dit te doen.
- hoge koorts
- ongecontroleerde spierspasmen
- stijve spieren
- snelle veranderingen in hartslag of bloeddruk
- verwardheid
- bewustzijnsverlies (uitvallen)
- Gebruik Lexapro niet met Orap® (pimozide) omdat het samen gebruiken van deze twee geneesmiddelen ernstige hartproblemen kan veroorzaken.
Wat moet ik mijn zorgverlener vertellen voordat ik Lexapro 20 mg inneem? Vraag ernaar als je het niet zeker weet.
Voordat u met Lexapro 20 mg begint, moet u uw zorgverlener informeren als u:
- Gebruikt u bepaalde medicijnen, zoals:
- Triptanen gebruikt om migrainehoofdpijn te behandelen
- Geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, waaronder tricyclische middelen, lithium, SSRI's, SNRI's, amfetaminen of antipsychotica
- tramadol
- Over-the-counter-supplementen zoals tryptofaan of sint-janskruid
- leverproblemen hebben
- nierproblemen hebben
- hartproblemen hebben
- epileptische aanvallen of convulsies heeft of heeft gehad
- een bipolaire stoornis of manie hebben;
- een laag natriumgehalte in uw bloed heeft
- een voorgeschiedenis van een beroerte hebben
- hoge bloeddruk hebben
- bloedingsproblemen heeft of heeft gehad
- zwanger bent of van plan bent zwanger te worden. Als u LEXAPRO laat in de zwangerschap inneemt, kan dit leiden tot een verhoogd risico op bepaalde problemen bij uw pasgeborene. Praat met uw zorgverlener over de voordelen en risico's van de behandeling van depressie tijdens de zwangerschap
- Als u zwanger wordt terwijl u LEXAPRO gebruikt, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Antidepressiva. U kunt zich aanmelden door te bellen naar 1-844-405-6185 of naar https://womensmentalhealth.org/clinicaland-researchprograms/zwangerschapregistry/antidepressants/ te gaan.
- borstvoeding geeft of van plan bent borstvoeding te geven. Lexapro kan in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden als u Lexapro gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Lexapro 10 mg en sommige geneesmiddelen kunnen met elkaar interageren, werken mogelijk niet zo goed of kunnen ernstige bijwerkingen veroorzaken.
Uw zorgverlener of apotheker kan u vertellen of het veilig is om Lexapro 20 mg samen met uw andere geneesmiddelen in te nemen. Start of stop geen medicijnen terwijl u Lexapro 10 mg gebruikt zonder eerst met uw zorgverlener te overleggen.
Als u Lexapro gebruikt, mag u geen andere geneesmiddelen gebruiken die escitalopram of citalopram bevatten, waaronder: Celexa.
Hoe moet ik Lexapro gebruiken?
- Neem Lexapro precies zoals voorgeschreven. Uw zorgverlener moet mogelijk de dosis Lexapro aanpassen totdat deze de juiste dosis voor u is.
- Lexapro 5 mg kan met of zonder voedsel worden ingenomen.
- Als u een dosis Lexapro bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem geen twee doses Lexapro tegelijkertijd in.
- Als u te veel Lexapro heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of antigifcentrum of vraag een spoedbehandeling.
Wat moet ik vermijden tijdens het gebruik van Lexapro?
Lexapro 5 mg kan slaperigheid veroorzaken of uw vermogen om beslissingen te nemen, helder te denken of snel te reageren beïnvloeden. U mag niet autorijden, zware machines bedienen of andere gevaarlijke activiteiten ondernemen totdat u weet welke invloed Lexapro op u heeft. Drink geen alcohol tijdens het gebruik van Lexapro.
Wat zijn de mogelijke bijwerkingen van Lexapro 20 mg?
Lexapro 10 mg kan ernstige bijwerkingen veroorzaken, waaronder alle van de informatie die wordt beschreven in het gedeelte "Wat is de belangrijkste informatie die ik over Lexapro moet weten?"
Veelvoorkomende mogelijke bijwerkingen bij mensen die Lexapro 5 mg gebruiken, zijn onder meer:
- Misselijkheid
- slaperigheid
- Zwakheid
- Duizeligheid
- Angstig voelen
- Moeite met slapen
- Seksuele problemen
- Zweten
- Schudden
- Geen honger hebben
- Droge mond
- Constipatie
- Infectie
- geeuwen
Andere bijwerkingen bij kinderen en adolescenten zijn onder meer:
- verhoogde dorst
- abnormale toename van spierbeweging of agitatie
- bloedneus
- moeilijk plassen
- zware menstruatie
- mogelijk vertraagde groeisnelheid en gewichtsverandering. De lengte en het gewicht van uw kind moeten tijdens de behandeling met Lexapro worden gecontroleerd.
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat. Dit zijn niet alle mogelijke bijwerkingen van Lexapro. Vraag uw zorgverlener of apotheker om meer informatie.
BEL UW ARTS VOOR MEDISCH ADVIES OVER BIJWERKINGEN. U MAG BIJWERKINGEN MELDEN AAN DE FDA OP 1-800-FDA-1088.
Hoe moet ik Lexapro 20 mg bewaren?
- Bewaar Lexapro bij 68 ° F tot 77 ° F (20 ° C tot 25 ° C); excursies toegestaan tot 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Houd de Lexapro-fles goed gesloten.
Houd Lexapro 10 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over Lexapro
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik Lexapro niet voor een aandoening waarvoor het niet is voorgeschreven. Geef Lexapro 10 mg niet aan andere mensen, ook niet als ze dezelfde aandoening hebben. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over Lexapro samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over Lexapro die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Voor meer informatie over Lexapro 20mg bel: 1-800-678-1605 of ga naar www.Lexapro.com.
Wat zijn de ingrediënten in Lexapro 20 mg?
Actief bestanddeel: escitalopramoxalaat Inactieve ingrediënten:
- talk, croscarmellosenatrium, microkristallijne cellulose/colloïdaal siliciumdioxide en magnesiumstearaat. De filmomhulling bevat hypromellose, titaniumdioxide en polyethyleenglycol.
- Orale oplossing: sorbitol, gezuiverd water, citroenzuur, natriumcitraat, appelzuur, glycerine, propyleenglycol, methylparaben, propylparaben en natuurlijke pepermuntsmaak (drank wordt momenteel niet op de markt gebracht).
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
