Pamelor 25mg Nortriptyline Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Pamelor 25 mg en hoe wordt het gebruikt?
Pamelor 25 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van depressie te behandelen. Pamelor 25 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Pamelor behoort tot een klasse geneesmiddelen die antidepressiva, TCA's, worden genoemd.
Het is niet bekend of Pamelor veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Pamelor 25 mg?
Pamelor kan ernstige bijwerkingen veroorzaken, waaronder:
- stemmingswisselingen,
- ongerustheid,
- paniekaanvallen,
- Moeite met slapen,
- impulsief gedrag,
- prikkelbaarheid,
- agitatie,
- vijandigheid,
- agressie,
- rusteloosheid,
- hyperactiviteit (mentaal of fysiek),
- verhoogde depressie,
- gedachten over jezelf pijn doen,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- rusteloze spierbewegingen in uw ogen, tong, kaak of nek,
- duizeligheid,
- hartinfarct,
- nieuwe of verergerende pijn op de borst,
- bonzende hartslagen,
- fladderend in je borst,
- plotselinge gevoelloosheid of zwakte,
- zichtproblemen,
- moeite met spraak of evenwicht,
- koorts,
- keelpijn,
- gemakkelijk blauwe plekken,
- ongewone bloeding,
- geel worden van de huid of ogen (geelzucht),
- pijnlijk of moeilijk plassen,
- snelle hartslag,
- overactieve reflexen,
- misselijkheid,
- braken,
- diarree,
- verlies van coördinatie, en
- flauwvallen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Pamelor zijn:
- misselijkheid,
- braken,
- verlies van eetlust,
- ongerustheid,
- slaapproblemen (slapeloosheid),
- droge mond,
- ongebruikelijke smaak,
- weinig of niet plassen,
- constipatie,
- visie verandert,
- zwelling van de borsten (bij mannen of vrouwen),
- verminderde zin in seks,
- impotentie, en
- moeite met een orgasme
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Pamelor. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van nortriptylinehydrochloride of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Nortriptylinehydrochloride is niet goedgekeurd voor gebruik bij pediatrische patiënten (zie: WAARSCHUWINGEN Klinische verslechtering en zelfmoordrisico; PATIËNT INFORMATIE ; en PREVENTIEVE MAATREGELEN , pediatrisch gebruik).
OMSCHRIJVING
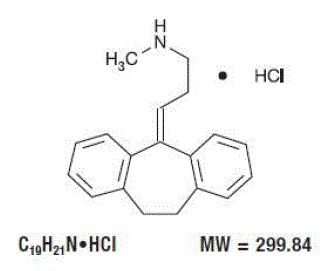
Pamelor™ (nortriptyline HCl) is 1-propaanamine, 3-(10,11-dihydro-5H-dibenzo[a,d]cyclohepten-5-ylideen)-N-methyl-hydrochloride.
De structuurformule is als volgt:
10 mg, 25 mg, 50 mg en 75 mg capsules
Actief ingrediënt
nortriptyline hydrochloride USP.
10 mg, 25 mg en 75 mg capsules
inactieve ingredienten
D&C Yellow #10, FD&C Yellow #6, gelatine, siliconenvloeistof, zetmeel en titaniumdioxide.
50 mg-capsules
inactieve ingredienten
gelatine, siliconenvloeistof, zetmeel en titaniumdioxide.
INDICATIES
Pamelor™ (nortriptyline HCl) is geïndiceerd voor de verlichting van symptomen van depressie. Endogene depressies worden eerder verlicht dan andere depressieve toestanden.
DOSERING EN ADMINISTRATIE
Pamelor 25 mg wordt niet aanbevolen voor kinderen.
Pamelor wordt oraal toegediend in de vorm van capsules. Lagere dan gebruikelijke doseringen worden aanbevolen voor oudere patiënten en adolescenten. Lagere doseringen worden ook aanbevolen voor poliklinische patiënten dan voor gehospitaliseerde patiënten die onder nauwlettend toezicht zullen staan. De arts moet de dosering op een laag niveau beginnen en deze geleidelijk verhogen, waarbij hij zorgvuldig de klinische respons en eventuele tekenen van intolerantie moet noteren. Na remissie kan onderhoudsmedicatie nodig zijn voor een langere periode met de laagste dosis die remissie handhaaft.
Als een patiënt lichte bijwerkingen krijgt, moet de dosering worden verlaagd. Het geneesmiddel moet onmiddellijk worden stopgezet als er bijwerkingen van ernstige aard of allergische manifestaties optreden.
Gebruikelijke dosis voor volwassenen
25 mg drie- of viermaal daags; de dosering moet op een laag niveau beginnen en zo nodig worden verhoogd. Als alternatief regime kan de totale dagelijkse dosering eenmaal per dag worden gegeven. Wanneer doses van meer dan 100 mg per dag worden toegediend, dienen de plasmaspiegels van nortriptyline te worden gecontroleerd en binnen het optimale bereik van 50 tot 150 ng/ml te worden gehouden. Doses hoger dan 150 mg/dag worden niet aanbevolen.
Oudere en adolescente patiënten
30 tot 50 mg/dag, in verdeelde doses, of de totale dagelijkse dosering kan eenmaal per dag worden gegeven.
Overschakelen van een patiënt naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen en het starten van de behandeling met Pamelor. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met Pamelor voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen ( CONTRA-INDICATIES ).
Gebruik van Pamelor 25 mg met andere MAO-remmers, zoals linezolid of methyleenblauw
Start Pamelor niet bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen (zie: CONTRA-INDICATIES ).
In sommige gevallen kan een patiënt die al met Pamelor wordt behandeld, dringend worden behandeld met linezolid of intraveneus methyleenblauw. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet Pamelor 25 mg onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw blauw kan worden toegediend. De patiënt moet gedurende twee weken of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet, worden gecontroleerd op symptomen van het serotoninesyndroom. De therapie met Pamelor kan 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden hervat (zie WAARSCHUWINGEN ).
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met Pamelor 25 mg is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik (zie: WAARSCHUWINGEN ).
HOE GELEVERD
Pamelor ™ (nortriptyline HCl) Capsules USP
Pamelor ™ (nortriptyline HCl) Capsules USP, equivalent aan 10 mg, 25 mg, 50 mg en 75 mg base, zijn als volgt verkrijgbaar:
10 mg : Lichtoranje ondoorzichtige dop bedrukt met “PAMELOR 10 mg” in zwart en witte ondoorzichtige romp bedrukt met “M” in zwart.
Flessen van 30: NDC 0406-9910-03
25 mg : Lichtoranje ondoorzichtige dop bedrukt met “PAMELOR 25 mg” in zwart en witte ondoorzichtige romp bedrukt met “M” in zwart.
Flessen van 30: NDC 0406-9911-03
50 mg : Witte ondoorzichtige dop met de opdruk “PAMELOR 50 mg” in zwart en witte ondoorzichtige romp met de opdruk “M” in het zwart.
Flessen van 30: NDC 0406-9912-03
75 mg Lichtoranje ondoorzichtige dop bedrukt met “PAMELOR 75 mg” in zwart en lichtoranje ondoorzichtige romp bedrukt met “M” in zwart.
Flessen van 30: NDC 0406-9913-03
Opslaan en afgeven
Bewaren bij 20 ° tot 25 ° C (68 ° tot 77 ° F) (zie USP-gecontroleerde kamertemperatuur).
Doseer in een strakke container (USP) met een kindveilige sluiting.
Mallinckrodt, het merk "M", het Mallinckrodt Pharmaceuticals-logo en andere merken zijn handelsmerken van een Mallinckrodt-bedrijf.
Gefabriceerd door: Patheon Inc. Whitby, Ontario, Canada. L1N 5Z5. Herzien: okt 2016
BIJWERKINGEN
Opmerking
In de volgende lijst zijn enkele bijwerkingen opgenomen die niet zijn gemeld met dit specifieke medicijn. De farmacologische overeenkomsten tussen de tricyclische antidepressiva vereisen echter dat met elk van de reacties rekening wordt gehouden wanneer nortriptyline wordt toegediend.
Cardiovasculair
Hypotensie, hypertensie, tachycardie, hartkloppingen, myocardinfarct, aritmieën, hartblok, beroerte.
Psychiatrisch
Verwarde toestanden (vooral bij ouderen) met hallucinaties, desoriëntatie, wanen; angst, rusteloosheid, opwinding; slapeloosheid, paniek, nachtmerries; hypomanie; verergering van psychose.
neurologisch
Gevoelloosheid, tintelingen, paresthesieën van ledematen; coördinatiestoornissen, ataxie, tremoren; perifere neuropathie; extrapiramidale symptomen; toevallen, verandering in EEG-patronen; oorsuizen.
anticholinergica
Droge mond en, zelden, geassocieerde sublinguale adenitis; wazig zien, accommodatiestoornis, mydriasis; constipatie, paralytische ileus; urineretentie, vertraagde mictie, verwijding van de urinewegen.
Allergisch
Huiduitslag, petechiën, urticaria, jeuk, fotosensibilisatie (vermijd overmatige blootstelling aan zonlicht); oedeem (algemeen of van gezicht en tong), geneesmiddelkoorts, kruisgevoeligheid met andere tricyclische geneesmiddelen.
hematologisch
Beenmergdepressie, inclusief agranulocytose; eosinofilie; purpura; trombocytopenie.
gastro-intestinaal
Misselijkheid en braken, anorexia, epigastrische nood, diarree, eigenaardige smaak, stomatitis, buikkrampen, zwarte tong.
endocrien
Gynaecomastie bij de man, borstvergroting en galactorroe bij de vrouw; verhoogd of verlaagd libido, impotentie; testiculaire zwelling; verhoging of verlaging van de bloedsuikerspiegel; syndroom van ongepaste secretie van ADH (antidiuretisch hormoon).
Ander
Geelzucht (simulerend obstructief), veranderde leverfunctie; gewichtstoename of -verlies; transpiratie; blozen; urinaire frequentie, nocturie; slaperigheid, duizeligheid, zwakte, vermoeidheid; hoofdpijn; parotis zwelling; alopecia.
Ontwenningsverschijnselen
Hoewel deze niet wijzen op verslaving, kan abrupte stopzetting van de behandeling na langdurige therapie misselijkheid, hoofdpijn en malaise veroorzaken.
Postmarketingervaring
De volgende bijwerking is gemeld tijdens het gebruik van Pamelor na goedkeuring. Omdat deze reactie vrijwillig wordt gerapporteerd vanuit een populatie van onbekende grootte, is het niet altijd mogelijk om de frequentie betrouwbaar te schatten.
Hartaandoeningen - Brugada-syndroom
Oogaandoeningen - hoekglaucoom
DRUG-INTERACTIES
Het is aangetoond dat toediening van reserpine tijdens behandeling met een tricyclisch antidepressivum bij sommige depressieve patiënten een "stimulerend" effect heeft.
Nauwlettend toezicht en zorgvuldige aanpassing van de dosering zijn vereist wanneer Pamelor 25 mg wordt gebruikt in combinatie met andere anticholinergica en sympathicomimetica.
Gelijktijdige toediening van cimetidine en tricyclische antidepressiva kan klinisch significante verhogingen van de plasmaconcentraties van het tricyclische antidepressivum veroorzaken. De patiënt moet worden geïnformeerd dat de reactie op alcohol overdreven kan zijn.
Een geval van significante hypoglykemie is gemeld bij een type II diabetespatiënt die op chloorpropamide (250 mg/dag) werd gehouden na toevoeging van nortriptyline (125 mg/dag).
Geneesmiddelen gemetaboliseerd door P450 2D6
De biochemische activiteit van het geneesmiddel metaboliserende isozym cytochroom P450 2D6 (debrisoquin hydroxylase) is verminderd in een subgroep van de blanke populatie (ongeveer 7% tot 10% van de blanken zijn zogenaamde "slechte metaboliseerders"); betrouwbare schattingen van de prevalentie van verminderde P450 2D6-isozymactiviteit onder Aziatische, Afrikaanse en andere populaties zijn nog niet beschikbaar. Slechte metaboliseerders hebben hoger dan verwachte plasmaconcentraties van tricyclische antidepressiva (TCA's) wanneer ze de gebruikelijke doses krijgen. Afhankelijk van de fractie van het geneesmiddel die door P450 2D6 wordt gemetaboliseerd, kan de toename van de plasmaconcentratie klein of vrij groot zijn (8-voudige toename van de plasma-AUC van de TCA).
Bovendien remmen bepaalde geneesmiddelen de activiteit van dit isozym en zorgen ervoor dat normale metaboliseerders lijken op slechte metaboliseerders. Een persoon die stabiel is op een bepaalde dosis TCA kan abrupt toxisch worden wanneer een van deze remmende geneesmiddelen als gelijktijdige therapie wordt gegeven. De geneesmiddelen die cytochroom P450 2D6 remmen, omvatten enkele die niet door het enzym worden gemetaboliseerd (kinidine; cimetidine) en vele die substraten zijn voor P450 2D6 (veel andere antidepressiva, fenothiazinen en de type 1C-antiaritmica propafenon en flecaïnide). Hoewel alle selectieve serotonineheropnameremmers (SSRI's), bijv. fluoxetine, sertraline en paroxetine, P450 2D6 remmen, kunnen ze variëren in de mate van remming. De mate waarin SSRI TCA-interacties klinische problemen kunnen opleveren, hangt af van de mate van remming en de farmacokinetiek van de betrokken SSRI. Niettemin is voorzichtigheid geboden bij gelijktijdige toediening van TCA's met een van de SSRI's en ook bij het overschakelen van de ene klasse naar de andere. Van bijzonder belang is dat er voldoende tijd moet verstrijken voordat de TCA-behandeling wordt gestart bij een patiënt die wordt gestopt met fluoxetine, gezien de lange halfwaardetijd van de ouder en de actieve metaboliet (minimaal 5 weken kan nodig zijn).
Gelijktijdig gebruik van tricyclische antidepressiva met geneesmiddelen die cytochroom P450 2D6 kunnen remmen, kan lagere doses vereisen dan gewoonlijk wordt voorgeschreven voor het tricyclische antidepressivum of het andere geneesmiddel. Bovendien kan, wanneer een van deze andere geneesmiddelen uit de gelijktijdige therapie wordt gestaakt, een verhoogde dosis tricyclische antidepressiva nodig zijn. Het is wenselijk om de TCA-plasmaspiegels te controleren wanneer een TCA gelijktijdig wordt toegediend met een ander geneesmiddel waarvan bekend is dat het een remmer van P450 2D6 is.
WAARSCHUWINGEN
Klinische verslechtering en zelfmoordrisico
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18 tot 24 jaar) met depressieve stoornis (MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.

De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in .
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor nortriptylinehydrochloride moeten worden geschreven voor de kleinste hoeveelheid capsules die consistent zijn met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat nortriptylinehydrochloride niet is goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
Patiënten met hart- en vaatziekten mogen Pamelor 25 mg alleen onder nauwlettend toezicht krijgen vanwege de neiging van het geneesmiddel om sinustachycardie te veroorzaken en de geleidingstijd te verlengen. Myocardinfarct, aritmie en beroertes zijn opgetreden. De antihypertensieve werking van guanethidine en soortgelijke middelen kan worden geblokkeerd. Vanwege de anticholinerge werking moet Pamelor met grote voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van urineretentie. Patiënten met een voorgeschiedenis van convulsies moeten nauwlettend worden gevolgd wanneer Pamelor 25 mg wordt toegediend, aangezien bekend is dat dit geneesmiddel de convulsieve drempel verlaagt. Grote voorzichtigheid is geboden als Pamelor wordt gegeven aan patiënten met hyperthyreoïdie of aan patiënten die schildkliermedicatie krijgen, aangezien zich hartritmestoornissen kunnen ontwikkelen.
Pamelor kan de mentale en/of fysieke vermogens aantasten die nodig zijn voor het uitvoeren van gevaarlijke taken, zoals het bedienen van machines of autorijden; daarom moet de patiënt dienovereenkomstig worden gewaarschuwd.
Overmatige alcoholconsumptie in combinatie met nortriptylinetherapie kan een versterkend effect hebben, wat kan leiden tot het gevaar van verhoogde zelfmoordpogingen of overdosering, vooral bij patiënten met een voorgeschiedenis van emotionele stoornissen of zelfmoordgedachten.
Gelijktijdige toediening van kinidine en nortriptyline kan resulteren in een significant langere plasmahalfwaardetijd, hogere AUC en lagere klaring van nortriptyline.
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld met SNRI's en SSRI's, waaronder Pamelor 25 mg, alleen maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine aantasten (met name MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid en intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen zijn: veranderingen in de mentale toestand (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire veranderingen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van Pamelor 25 mg met MAO-remmers bedoeld voor de behandeling van psychiatrische stoornissen is gecontra-indiceerd. Pamelor mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die Pamelor gebruikt. Pamelor 25 mg moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart (zie: CONTRA-INDICATIES en DOSERING EN ADMINISTRATIE ).
Als gelijktijdig gebruik van Pamelor 25 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan en sint-janskruid klinisch gerechtvaardigd is, moeten patiënten worden gewezen op een mogelijk verhoogd risico op het serotoninesyndroom, vooral tijdens de start van de behandeling en bij dosisverhogingen.
Behandeling met Pamelor 25 mg en alle gelijktijdig gebruikte serotonerge middelen dienen onmiddellijk te worden gestaakt als de bovenstaande voorvallen optreden en ondersteunende symptomatische behandeling moet worden gestart.
Ontmaskering van het Brugada-syndroom
Er zijn postmarketingmeldingen geweest van een mogelijk verband tussen behandeling met Pamelor en het ontmaskeren van het Brugada-syndroom. Brugada-syndroom is een aandoening die wordt gekenmerkt door syncope, abnormale elektrocardiografische (ECG) bevindingen en een risico op plotseling overlijden. Pamelor moet over het algemeen worden vermeden bij patiënten met het Brugada-syndroom of bij patiënten die verdacht worden van het hebben van het Brugada-syndroom.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder Pamelor 25 mg, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
Gebruik tijdens de zwangerschap
Veilig gebruik van Pamelor tijdens zwangerschap en borstvoeding is niet vastgesteld; daarom, wanneer het geneesmiddel wordt toegediend aan zwangere patiënten, moeders die borstvoeding geven of vrouwen in de vruchtbare leeftijd, moeten de mogelijke voordelen worden afgewogen tegen de mogelijke gevaren. Reproductiestudies bij dieren hebben geen overtuigende resultaten opgeleverd.
PREVENTIEVE MAATREGELEN
Informatie voor patiënten
Voorschrijvers of andere gezondheidswerkers moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van de behandeling met nortriptylinehydrochloride en hen adviseren bij het juiste gebruik ervan. Een patiënt Medicatiegids over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties" is beschikbaar voor nortriptylinehydrochloride. De voorschrijver of gezondheidswerker moet patiënten, hun families en hun zorgverleners instrueren om de medicatiehandleiding te lezen en moet hen helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de Medicatiegids en om antwoord te krijgen op al hun vragen. De volledige tekst van de medicatiehandleiding is herdrukt aan het einde van dit document.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze optreden tijdens het gebruik van nortriptylinehydrochloride.
Klinische verslechtering en zelfmoordrisico
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten aan de voorschrijver van de patiënt of gezondheidswerker worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen die de patiënt vertoont. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak tot zeer nauwgezette monitoring en mogelijk wijzigingen in de medicatie.
Het gebruik van Pamelor bij schizofrene patiënten kan leiden tot een verergering van de psychose of kan latente schizofrene symptomen activeren. Als het geneesmiddel wordt gegeven aan overactieve of geagiteerde patiënten, kan verhoogde angst en opwinding optreden. Bij manisch-depressieve patiënten kan Pamelor symptomen van de manische fase veroorzaken.
Lastige vijandigheid bij de patiënt kan worden opgewekt door het gebruik van Pamelor. Epileptiforme aanvallen kunnen gepaard gaan met de toediening ervan, zoals het geval is met andere geneesmiddelen in zijn klasse.
Wanneer het essentieel is, kan het medicijn worden toegediend met elektroconvulsietherapie, hoewel de risico's groter kunnen zijn. Stop met het medicijn gedurende enkele dagen, indien mogelijk, voorafgaand aan een electieve operatie.
De mogelijkheid van een zelfmoordpoging van een depressieve patiënt blijft bestaan na het starten van de behandeling; in dit verband is het belangrijk dat op elk moment een zo min mogelijk hoeveelheid geneesmiddel wordt afgegeven.
Zowel verhoging als verlaging van de bloedsuikerspiegel zijn gemeld.
Patiënten moeten erop worden gewezen dat het gebruik van Pamelor 25 mg lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen mogelijk worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn.
Monoamineoxidaseremmers (MAO-remmers)
(Zien CONTRA-INDICATIES , WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE .)
Serotonerge geneesmiddelen
(Zien CONTRA-INDICATIES , WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE .)
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld (zie: DOOS WAARSCHUWING: en WAARSCHUWINGEN , Klinische verergering en zelfmoordrisico). Iedereen die het gebruik van nortriptylinehydrochloride bij een kind of adolescent overweegt, moet de mogelijke risico's afwegen tegen de klinische noodzaak.
Geriatrisch gebruik
Klinische onderzoeken met Pamelor omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaring geeft aan dat, net als bij andere tricyclische antidepressiva, leverbijwerkingen (voornamelijk gekenmerkt door geelzucht en verhoogde leverenzymen) zeer zelden worden waargenomen bij geriatrische patiënten en dat sterfgevallen geassocieerd met cholestatische leverschade in geïsoleerde gevallen zijn gemeld. De cardiovasculaire functie, met name aritmieën en schommelingen in de bloeddruk, moet worden gecontroleerd. Er zijn ook meldingen geweest van verwardheid na toediening van tricyclische antidepressiva bij ouderen. Hogere plasmaconcentraties van de actieve nortriptylinemetaboliet, 10-hydroxynortriptyline, zijn ook gemeld bij oudere patiënten. Net als bij andere tricyclische antidepressiva moet de dosiskeuze voor een oudere patiënt gewoonlijk worden beperkt tot de kleinste effectieve totale dagelijkse dosis (zie DOSERING EN ADMINISTRATIE ).
OVERDOSERING
Sterfgevallen kunnen optreden door overdosering met deze klasse geneesmiddelen. Inname van meerdere geneesmiddelen (inclusief alcohol) komt vaak voor bij een opzettelijke overdosis tricyclische antidepressiva. Aangezien de behandeling complex en veranderlijk is, wordt aanbevolen dat de arts contact opneemt met een antigifcentrum voor actuele informatie over de behandeling. Tekenen en symptomen van toxiciteit ontwikkelen zich snel na een overdosis tricyclische antidepressiva, daarom is ziekenhuiscontrole zo snel mogelijk vereist.
manifestaties
Kritische manifestaties van overdosering zijn onder meer: hartritmestoornissen, ernstige hypotensie, shock, congestief hartfalen, longoedeem, convulsies en depressie van het CZS, inclusief coma. Veranderingen in het elektrocardiogram, met name in de QRS-as of -breedte, zijn klinisch significante indicatoren van tricyclische antidepressiva-toxiciteit.
Andere tekenen van overdosering kunnen zijn: verwardheid, rusteloosheid, verstoorde concentratie, voorbijgaande visuele hallucinaties, verwijde pupillen, agitatie, hyperactieve reflexen, stupor, slaperigheid, spierstijfheid, braken, hypothermie, hyperpyrexie of een van de acute symptomen vermeld onder ONGEWENSTE REACTIES . Er zijn meldingen geweest van patiënten die herstelden van een overdosering met nortriptyline tot 525 mg.
Beheer
Algemeen
Maak een ECG en start onmiddellijk hartbewaking. Bescherm de luchtwegen van de patiënt, breng een intraveneuze lijn aan en start maagdecontaminatie. Een minimum van zes uur observatie met hartbewaking en observatie op tekenen van CZS of ademhalingsdepressie, hypotensie, hartritmestoornissen en/of geleidingsblokkades en toevallen is noodzakelijk. Als er tijdens deze periode tekenen van toxiciteit optreden, is uitgebreide monitoring vereist. Er zijn casusrapporten van patiënten die bezwijken aan fatale ritmestoornissen laat na een overdosis; deze patiënten hadden klinisch bewijs van significante vergiftiging voorafgaand aan de dood en de meeste kregen onvoldoende gastro-intestinale decontaminatie. Controle van de geneesmiddelspiegels in plasma mag geen leidraad zijn voor de behandeling van de patiënt.
Gastro-intestinale decontaminatie
Alle patiënten die verdacht worden van een overdosis tricyclische antidepressiva, dienen maag-darmontsmetting te ondergaan. Dit moet een maagspoeling met een groot volume omvatten, gevolgd door actieve kool. Als het bewustzijn verminderd is, moet de luchtweg worden afgesloten voordat er wordt gespoeld. EMESIS IS GECONTRA-INDICEERD.
Cardiovasculair
Een maximale ledemaat-lead QRS-duur van ≥0,10 seconden kan de beste indicatie zijn voor de ernst van de overdosis. Intraveneus natriumbicarbonaat moet worden gebruikt om de serum-pH tussen 7,45 en 7,55 te houden. Als de pH-respons onvoldoende is, kan ook hyperventilatie worden toegepast. Gelijktijdig gebruik van hyperventilatie en natriumbicarbonaat moet met uiterste voorzichtigheid gebeuren, met frequente pH-controle. Een pH >7,60 of een pCO
CNS
Bij patiënten met CZS-depressie wordt vroege intubatie geadviseerd vanwege het potentieel voor abrupte verslechtering. Epileptische aanvallen moeten onder controle worden gehouden met benzodiazepinen, of, als deze niet effectief zijn, andere anti-epileptica (bijv. fenobarbital, fenytoïne). Fysostigmine wordt niet aanbevolen, behalve voor de behandeling van levensbedreigende symptomen die niet reageerden op andere therapieën, en dan alleen in overleg met een antigifcentrum.
Psychiatrische follow-up
Aangezien overdosering vaak opzettelijk is, kunnen patiënten tijdens de herstelfase op andere manieren zelfmoord proberen te plegen. Psychiatrische verwijzing kan passend zijn.
Pediatrisch management
De principes voor het beheer van overdoseringen bij kinderen en volwassenen zijn vergelijkbaar. Het wordt sterk aanbevolen dat de arts contact opneemt met het plaatselijke antigifcentrum voor specifieke pediatrische behandeling.
CONTRA-INDICATIES
Monoamineoxidaseremmers (MAO-remmers)
Het gebruik van MAO-remmers die bedoeld zijn voor de behandeling van psychiatrische stoornissen met Pamelor 25 mg of binnen 14 dagen na het stoppen van de behandeling met Pamelor 25 mg is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van Pamelor 25 mg binnen 14 dagen na het stoppen met een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen is ook gecontra-indiceerd (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Het starten van Pamelor 25 mg bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Overgevoeligheid voor tricyclische antidepressiva
Kruisgevoeligheid tussen Pamelor en andere dibenzazepines is een mogelijkheid.
Myocardinfarct
Pamelor 25 mg is gecontra-indiceerd tijdens de acute herstelperiode na een myocardinfarct.
KLINISCHE FARMACOLOGIE
Het mechanisme van stemmingsverhoging door tricyclische antidepressiva is op dit moment onbekend. Pamelor 25 mg is geen monoamineoxidaseremmer. Het remt de activiteit van diverse middelen zoals histamine, 5-hydroxytryptamine en acetylcholine. Het verhoogt het pressoreffect van noradrenaline maar blokkeert de pressorrespons van fenethylamine. Studies suggereren dat Pamelor 25 mg het transport, de afgifte en de opslag van catecholamines verstoort. Operante conditioneringstechnieken bij ratten en duiven suggereren dat Pamelor een combinatie van stimulerende en depressieve eigenschappen heeft.
PATIËNT INFORMATIE
Pamelor™ (nortriptyline HCl) Capsules USP
Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties
Lees de medicatiehandleiding die bij u of het antidepressivum van uw familielid wordt geleverd. Deze medicatiehandleiding gaat alleen over het risico op zelfmoordgedachten en -acties met antidepressiva.
Praat met uw zorgverlener of die van uw gezinslid over:
- alle risico's en voordelen van behandeling met antidepressiva
- alle behandelingskeuzes voor depressie of andere ernstige psychische aandoeningen
Wat is de belangrijkste informatie die ik moet weten over antidepressiva, depressie en andere ernstige psychische aandoeningen, en zelfmoordgedachten of -acties?
- Besteed veel aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel de zorgverlener meteen om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken aan de zorgverlener zoals gepland. Bel indien nodig de zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk een zorgverlener als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich erg geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Visuele problemen
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
Wie mag Pamelor niet gebruiken?
Neem Pamelor niet in als u:
- neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, inclusief het antibioticum linezolid.
- Gebruik geen MAO-remmer binnen 2 weken na het stoppen met Pamelor 25 mg, tenzij uw arts u heeft gevraagd dit te doen.
- Begin niet met Pamelor 25 mg als u de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw arts u heeft gevraagd dit te doen.
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met een zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken en ook de risico's van het niet behandelen ervan. Patiënten en hun families of andere zorgverleners moeten alle behandelkeuzes met de zorgverlener bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met de zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan de zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
- Niet alle antidepressiva die voor kinderen worden voorgeschreven, zijn door de FDA goedgekeurd voor gebruik bij kinderen. Praat met de zorgverlener van uw kind voor meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
