Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Seroquel 100 mg en hoe wordt het gebruikt?
Seroquel 50 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van schizofrenie, bipolaire I-stoornis, manie; Bipolaire stoornis, depressieve episodes; Bipolaire I-stoornis, onderhoud; en ernstige depressieve stoornis. Seroquel 50 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Seroquel behoort tot een klasse geneesmiddelen die antipsychotica wordt genoemd, 2e generatie; Antimanische middelen.
Het is niet bekend of Seroquel 200 mg veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Seroquel 50 mg?
Seroquel kan ernstige bijwerkingen veroorzaken, waaronder:
- ongecontroleerde spierbewegingen in uw gezicht (kauwen, smakken op de lippen, fronsen, tongbewegingen, knipperen of oogbewegingen),
- maskerachtig uiterlijk van het gezicht,
- moeite met slikken,
- problemen met spraak,
- duizeligheid,
- ernstige constipatie,
- pijnlijk of moeilijk plassen,
- wazig zien,
- tunnelvisie,
- oogpijn,
- halo's rond lichten zien,
- zeer stijve (starre) spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen,
- flauwvallen,
- verhoogde dorst,
- meer plassen,
- droge mond,
- fruitige ademgeur,
- koorts,
- rillingen,
- zweertjes in de mond,
- huidzweren,
- keelpijn,
- hoesten, en
- moeite met ademhalen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Seroquel zijn:
- spraakproblemen,
- duizeligheid,
- slaperigheid,
- vermoeidheid,
- gebrek aan energie,
- snelle hartslagen,
- verstopte neus,
- verhoogde eetlust,
- gewichtstoename,
- maagklachten,
- braken,
- constipatie,
- droge mond, en
- abnormale leverfunctietest
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Seroquel. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
VERHOOGDE STERFELIJKHEID BIJ OUDEREN PATINTEN MET DEMENTIEGERELATEERDE PSYCHOSE; en SUICIDALE GEDACHTEN EN GEDRAG
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Oudere patiënten met aan dementie gerelateerde psychose die worden behandeld met antipsychotica lopen een verhoogd risico op overlijden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ). SEROQUEL is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Suïcidale gedachten en gedrag
Antidepressiva verhoogden het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen in kortdurende onderzoeken. Deze onderzoeken lieten geen toename zien van het risico op zelfmoordgedachten en -gedrag bij gebruik van antidepressiva bij patiënten ouder dan 24 jaar; er was een vermindering van het risico bij gebruik van antidepressiva bij patiënten van 65 jaar en ouder (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Bij patiënten van alle leeftijden die beginnen met antidepressiva, moet u nauwlettend controleren op verergering en op het optreden van zelfmoordgedachten en -gedrag. Adviseer families en zorgverleners over de noodzaak van nauwkeurige observatie en communicatie met de voorschrijver (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
SEROQUEL 50 mg is niet goedgekeurd voor gebruik bij pediatrische patiënten jonger dan tien jaar (zie Gebruik bij specifieke populaties ).
OMSCHRIJVING
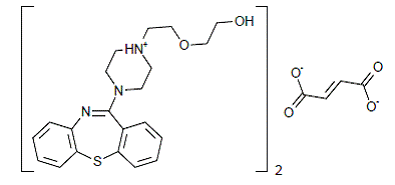
SEROQUEL® (quetiapinefumaraat) is een psychotroop middel dat behoort tot een chemische klasse, de dibenzothiazepinederivaten. De chemische aanduiding is 2-[2-(4-dibenzo [b,f] [1,4]thiazepin-11-yl-1-piperazinyl)ethoxy]-ethanolfumaraat (2:1) (zout). Het is aanwezig in tabletten als het fumaraatzout. Alle doses en tabletsterkten worden uitgedrukt als milligram base, niet als fumaraatzout. De molecuulformule is C42H50N6O4S2•C4H4O4 en het heeft een molecuulgewicht van 883,11 (fumaraatzout). De structuurformule is:
Quetiapinefumaraat is een wit tot gebroken wit kristallijn poeder dat matig oplosbaar is in water.
SEROQUEL wordt geleverd voor orale toediening als 25 mg (rond, perzik), 50 mg (rond, wit), 100 mg (rond, geel), 200 mg (rond, wit), 300 mg (capsulevormig, wit) en 400 mg (capsulevormige, gele) tabletten.
Inactieve ingrediënten zijn povidon, dibasisch dicalciumfosfaatdihydraat, microkristallijne cellulose, natriumzetmeelglycolaat, lactosemonohydraat, magnesiumstearaat, hypromellose, polyethyleenglycol en titaniumdioxide.
De tabletten van 25 mg bevatten rood ijzeroxide en geel ijzeroxide en de tabletten van 100 mg en 400 mg bevatten alleen geel ijzeroxide.
INDICATIES
Schizofrenie
SEROQUEL XR is geïndiceerd voor de behandeling van schizofrenie. De werkzaamheid van SEROQUEL XR bij schizofrenie werd vastgesteld in een onderzoek van 6 weken en een onderhoudsonderzoek bij volwassenen met schizofrenie. De werkzaamheid werd ondersteund door drie onderzoeken van 6 weken bij volwassenen met schizofrenie en een onderzoek van 6 weken bij adolescenten met schizofrenie (13-17 jaar) die werden behandeld met SEROQUEL (zie Klinische studies ].
Bipolaire stoornis
SEROQUEL 25 mg XR is geïndiceerd voor de acute behandeling van manische of gemengde episodes geassocieerd met bipolaire I-stoornis, zowel als monotherapie als als aanvulling op lithium of divalproex. De werkzaamheid van SEROQUEL XR bij manische of gemengde episodes van bipolaire I-stoornis werd vastgesteld in een studie van 3 weken bij volwassenen met manische of gemengde episodes geassocieerd met bipolaire I-stoornis. De werkzaamheid werd ondersteund door twee 12 weken durende monotherapiestudies en een 3 weken durende aanvullende studie bij volwassenen met manische episodes geassocieerd met bipolaire I-stoornis, evenals een 3 weken durende monotherapiestudie bij kinderen en adolescenten (10-17 jaar) met manische episodes geassocieerd met bipolaire I-stoornis behandeld met SEROQUEL [zie Klinische studies ].
SEROQUEL 100 mg XR is geïndiceerd voor de acute behandeling van depressieve episodes geassocieerd met een bipolaire stoornis. De werkzaamheid van SEROQUEL XR werd vastgesteld in een 8 weken durend onderzoek bij volwassenen met een bipolaire I of II stoornis en ondersteund door twee 8 weken durende onderzoeken bij volwassenen met een bipolaire I of II stoornis die werden behandeld met SEROQUEL [zie Klinische studies ].
SEROQUEL 100 mg XR is geïndiceerd voor de onderhoudsbehandeling van bipolaire I-stoornis, als aanvulling op lithium of divalproex. De werkzaamheid werd geëxtrapoleerd uit twee onderhoudsonderzoeken bij volwassenen met een bipolaire I-stoornis die werden behandeld met SEROQUEL. De effectiviteit van monotherapie voor de onderhoudsbehandeling van bipolaire I-stoornis is niet systematisch geëvalueerd in gecontroleerde klinische onderzoeken [zie: Klinische studies ].
Aanvullende behandeling van depressieve stoornis (MDD)
SEROQUEL 100 mg XR is geïndiceerd voor gebruik als aanvullende therapie bij antidepressiva voor de behandeling van MDD. De werkzaamheid van SEROQUEL XR als aanvullende therapie bij antidepressiva bij MDD werd vastgesteld in twee onderzoeken van 6 weken bij volwassenen met MDD die onvoldoende reageerden op behandeling met antidepressiva [zie Klinische studies ].
Speciale overwegingen bij de behandeling van pediatrische schizofrenie en bipolaire I-stoornis
Pediatrische schizofrenie en bipolaire I-stoornis zijn ernstige psychische stoornissen, maar de diagnose kan een uitdaging zijn. Voor pediatrische schizofrenie kunnen symptoomprofielen variabel zijn, en voor bipolaire I-stoornis kunnen patiënten variabele periodiciteitspatronen van manische of gemengde symptomen hebben. Het wordt aanbevolen om medicamenteuze therapie voor pediatrische schizofrenie en bipolaire I-stoornis alleen te starten nadat een grondige diagnostische evaluatie is uitgevoerd en zorgvuldige afweging is gemaakt van de risico's die gepaard gaan met medicamenteuze behandeling. Medicamenteuze behandeling voor zowel pediatrische schizofrenie als bipolaire I-stoornis is geïndiceerd als onderdeel van een totaal behandelprogramma dat vaak psychologische, educatieve en sociale interventies omvat.
DOSERING EN ADMINISTRATIE
Belangrijke administratie-instructies
SEROQUEL XR-tabletten moeten heel worden doorgeslikt en mogen niet worden gespleten, gekauwd of fijngemaakt.
Het wordt aanbevolen om SEROQUEL 50 mg XR zonder voedsel of met een lichte maaltijd in te nemen (ongeveer 300 calorieën) [zie KLINISCHE FARMACOLOGIE ].
SEROQUEL 25 mg XR dient eenmaal daags te worden toegediend, bij voorkeur 's avonds.
Aanbevolen dosering
De aanbevolen aanvangsdosis, titratie, dosisbereik en maximale SEROQUEL 50 mg XR-dosis voor elke goedgekeurde indicatie worden weergegeven in tabel 1 hieronder. Na de initiële dosering kunnen, indien nodig, aanpassingen naar boven of beneden worden gemaakt, afhankelijk van de klinische respons en verdraagbaarheid van de patiënt [zie Klinische studies ].
Onderhoudsbehandeling voor schizofrenie en bipolaire I-stoornis
Onderhoudsbehandeling
Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling en de juiste dosis voor een dergelijke behandeling te bepalen [zie: Klinische studies ].
Dosisaanpassingen bij oudere patiënten
Bij ouderen en bij patiënten die verzwakt zijn of aanleg hebben voor hypotensieve reacties moet worden overwogen de dosistitratie langzamer te laten verlopen en een lagere streefdosis te nemen [zie Gebruik bij specifieke populaties , en KLINISCHE FARMACOLOGIE ]. Indien geïndiceerd, dient dosisverhoging bij deze patiënten met voorzichtigheid te worden uitgevoerd.
Oudere patiënten moeten worden gestart met SEROQUEL XR 50 mg/dag en de dosis kan worden verhoogd in stappen van 50 mg/dag, afhankelijk van de klinische respons en verdraagbaarheid van de individuele patiënt.
Dosisaanpassingen bij patiënten met leverinsufficiëntie
Patiënten met leverinsufficiëntie dienen te worden gestart met SEROQUEL XR 50 mg/dag. De dosis kan dagelijks worden verhoogd in stappen van 50 mg/dag tot een effectieve dosis, afhankelijk van de klinische respons en verdraagbaarheid van de patiënt.
Dosisaanpassingen bij gebruik met CYP3A4-remmers
De dosis SEROQUEL XR dient te worden verlaagd tot een zesde van de oorspronkelijke dosis wanneer deze gelijktijdig wordt toegediend met een krachtige CYP3A4-remmer (bijv. ketoconazol, itraconazol, indinavir, ritonavir, nefazodon, enz.). Wanneer de CYP3A4-remmer wordt stopgezet, moet de dosis SEROQUEL XR met een factor 6 worden verhoogd (zie KLINISCHE FARMACOLOGIE en DRUG-INTERACTIES ].
Dosisaanpassingen bij gebruik met CYP3A4-inductoren
De dosis SEROQUEL XR moet worden verhoogd tot het 5-voudige van de oorspronkelijke dosis bij gebruik in combinatie met een chronische behandeling (bijv. langer dan 7-14 dagen) van een krachtige CYP3A4-inductor (bijv. fenytoïne, carbamazepine, rifampicine, avasimibe, St. Janskruid enz.). De dosis moet worden getitreerd op basis van de klinische respons en tolerantie van de individuele patiënt. Wanneer de CYP3A4-inductor wordt stopgezet, moet de dosis SEROQUEL 100 mg XR binnen 7-14 dagen worden verlaagd tot het oorspronkelijke niveau (zie KLINISCHE FARMACOLOGIE en DRUG-INTERACTIES ].
Herstarten van de behandeling bij patiënten die eerder waren stopgezet
Hoewel er geen gegevens zijn die specifiek betrekking hebben op het opnieuw starten van de behandeling, wordt aanbevolen dat bij het hervatten van de behandeling van patiënten die langer dan een week geen SEROQUEL 50 mg XR hebben gehad, het initiële doseringsschema moet worden gevolgd. Bij het herstarten van patiënten die minder dan een week geen SEROQUEL 300 mg XR hebben gehad, is het mogelijk dat geleidelijke dosisverhoging niet nodig is en kan de onderhoudsdosis opnieuw worden gestart.
Overschakelen van patiënten van SEROQUEL 50 mg tabletten naar SEROQUEL 100 mg XR tabletten
Patiënten die momenteel worden behandeld met SEROQUEL (formulering met onmiddellijke afgifte) kunnen worden overgezet op SEROQUEL XR met de equivalente totale dagelijkse dosis die eenmaal daags wordt ingenomen. Individuele dosisaanpassingen kunnen nodig zijn.
Overstappen van antipsychotica
Er zijn geen systematisch verzamelde gegevens over het specifiek overstappen van patiënten van andere antipsychotica op SEROQUEL 200 mg XR, of over gelijktijdige toediening met andere antipsychotica. Terwijl onmiddellijke stopzetting van de vorige antipsychotische behandeling voor sommige patiënten aanvaardbaar kan zijn, kan een meer geleidelijke stopzetting voor anderen het meest geschikt zijn. In alle gevallen moet de periode van overlappende toediening van antipsychotica worden geminimaliseerd. Bij het overstappen van depot-antipsychotica, indien medisch aangewezen, start de behandeling met SEROQUEL XR in plaats van de volgende geplande injectie. De noodzaak van voortzetting van bestaande medicatie voor extrapiramidaal syndroom moet periodiek opnieuw worden geëvalueerd.
HOE GELEVERD
Doseringsvormen en sterke punten
- 50 mg tabletten met verlengde afgifte zijn perzikkleurige, filmomhulde, capsulevormige, biconvexe, gegraveerde tabletten met aan de ene kant “XR 50” en glad aan de andere kant
- 150 mg tabletten met verlengde afgifte zijn witte, filmomhulde, capsulevormige, biconvexe, gegraveerde tabletten met aan de ene kant “XR 150” en glad aan de andere kant
- 200 mg tabletten met verlengde afgifte zijn gele, filmomhulde, capsulevormige, biconvexe, gegraveerde tabletten met aan de ene kant “XR 200” en glad aan de andere kant
- 300 mg tabletten met verlengde afgifte zijn lichtgele, filmomhulde, capsulevormige, biconvexe, gegraveerde tabletten met aan de ene kant “XR 300” en glad aan de andere kant
- 400 mg tabletten met verlengde afgifte zijn witte, filmomhulde, capsulevormige, biconvexe, gegraveerde tabletten met aan de ene kant “XR 400” en glad aan de andere kant
Opslag en behandeling
50 mg-tabletten ( NDC 0310-0280-60) perzikkleurige, filmomhulde, capsulevormige, biconvexe, gegraveerde tablet met “XR 50” aan de ene kant en glad aan de andere kant, worden geleverd in flessen van 60 tabletten.
150 mg-tabletten ( NDC 0310-0281-60) witte, filmomhulde, capsulevormige, biconvexe, gegraveerde tablet met “XR 150” aan de ene kant en glad aan de andere kant, worden geleverd in flessen van 60 tabletten.
200 mg-tabletten ( NDC 0310-0282-60) gele, filmomhulde, capsulevormige, biconvexe, gegraveerde tablet met “XR 200” aan de ene kant en glad aan de andere kant, worden geleverd in flessen van 60 tabletten.
300 mg-tabletten ( NDC 0310-0283-60) lichtgele, filmomhulde, capsulevormige, biconvexe, gegraveerde tablet met “XR 300” aan de ene kant en glad aan de andere kant, wordt geleverd in flessen van 60 tabletten.
400 mg-tabletten ( NDC 0310-0284-60) witte, filmomhulde, capsulevormige, biconvexe, gegraveerde tablet met “XR 400” aan de ene kant en glad aan de andere kant, worden geleverd in flessen van 60 tabletten.
Bewaar SEROQUEL XR bij 25°C (77°F); excursies toegestaan tot 15-30°C (59-86°F) [Zie USP ].
Gedistribueerd door: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Herzien: maart 2020
BIJWERKINGEN
De volgende bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Suïcidale gedachten en gedrag bij adolescenten en jonge volwassenen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cerebrovasculaire bijwerkingen, waaronder beroerte bij oudere patiënten met aan dementie gerelateerde psychose [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Maligne neurolepticasyndroom (MNS) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Metabole veranderingen (hyperglykemie, dyslipidemie, gewichtstoename) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Tardieve dyskinesie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- valt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stijgingen van de bloeddruk (kinderen en adolescenten) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leukopenie, neutropenie en agranulocytose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Staar [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypothyreoïdie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hyperprolactinemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Potentieel voor cognitieve en motorische stoornissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Regeling van de lichaamstemperatuur [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Dysfagie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stopzettingssyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Anticholinerge (antimuscarine) effecten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Klinische studie-ervaring
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
volwassenen
De onderstaande informatie is afgeleid van een database van klinische onderzoeken voor SEROQUEL 200 mg, bestaande uit meer dan 4300 patiënten. Deze database omvat 698 patiënten die zijn blootgesteld aan SEROQUEL voor de behandeling van bipolaire depressie, 405 patiënten die zijn blootgesteld aan SEROQUEL 200 mg voor de behandeling van acute bipolaire manie (monotherapie en aanvullende therapie), 646 patiënten die zijn blootgesteld aan SEROQUEL voor de onderhoudsbehandeling van bipolaire I-stoornis als adjuvans therapie en ongeveer 2600 patiënten en/of normale proefpersonen blootgesteld aan 1 of meer doses SEROQUEL 200 mg voor de behandeling van schizofrenie.
Van deze ongeveer 4.300 proefpersonen waren ongeveer 4000 (2300 bij schizofrenie, 405 bij acute bipolaire manie, 698 bij bipolaire depressie en 646 voor de onderhoudsbehandeling van bipolaire I-stoornis) patiënten die deelnamen aan onderzoeken naar de effectiviteit van meerdere doses, en hun ervaring kwam overeen met ongeveer 2400 patiëntjaren. De omstandigheden en duur van de behandeling met SEROQUEL 200 mg varieerden sterk en omvatten (in overlappende categorieën) open-label en dubbelblinde fasen van onderzoeken, klinische en poliklinische patiënten, onderzoeken met vaste doses en dosistitratie, en korte of langere termijn blootstelling. Bijwerkingen werden beoordeeld door het verzamelen van bijwerkingen, resultaten van lichamelijk onderzoek, vitale functies, gewichten, laboratoriumanalyses, ECG's en resultaten van oogheelkundig onderzoek.
De vermelde frequenties van bijwerkingen vertegenwoordigen het aantal personen dat ten minste één keer een bijwerking van het vermelde type heeft ervaren.
Bijwerkingen die verband houden met stopzetting van de behandeling in kortdurende, placebo-gecontroleerde onderzoeken
Schizofrenie
Over het algemeen was er weinig verschil in de incidentie van stopzetting vanwege bijwerkingen (4% voor SEROQUEL versus 3% voor placebo) in een pool van gecontroleerde onderzoeken. Stopzettingen als gevolg van slaperigheid (0,8% SEROQUEL 100 mg vs. 0% placebo) en hypotensie (0,4% SEROQUEL 200 mg vs. 0% placebo) werden echter beschouwd als geneesmiddelgerelateerd (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bipolaire stoornis
Manie
Over het algemeen waren de stopzettingen vanwege bijwerkingen 5,7% voor SEROQUEL 25 mg versus 5,1% voor placebo in monotherapie en 3,6% voor SEROQUEL versus 5,9% voor placebo in aanvullende therapie.
Depressie
Over het algemeen waren de stopzettingen vanwege bijwerkingen 12,3% voor SEROQUEL 300 mg versus 19,0% voor SEROQUEL 600 mg en 5,2% voor placebo.
Vaak waargenomen bijwerkingen in kortdurende, placebo-gecontroleerde onderzoeken
In de onderzoeken naar acute behandeling van schizofrenie (tot 6 weken) en bipolaire manie (tot 12 weken), werden de meest waargenomen bijwerkingen geassocieerd met het gebruik van SEROQUEL-monotherapie (incidentie van 5% of meer) en waargenomen met een snelheid op SEROQUEL die minstens tweemaal zo hoog was als die van placebo waren slaperigheid (18%), duizeligheid (11%), droge mond (9%), constipatie (8%), verhoogd ALT (5%), gewichtstoename (5%) en dyspepsie ( 5%).
Bijwerkingen die optreden bij een incidentie van 2% of meer bij met SEROQUEL behandelde patiënten in kortdurende, placebo-gecontroleerde onderzoeken
De voorschrijver dient zich ervan bewust te zijn dat de cijfers in de tabellen en tabellen niet kunnen worden gebruikt om de incidentie van bijwerkingen in de loop van de normale medische praktijk te voorspellen wanneer de patiëntkenmerken en andere factoren verschillen van die welke in de klinische onderzoeken heersten. Evenzo kunnen de genoemde frequenties niet worden vergeleken met cijfers die zijn verkregen uit andere klinische onderzoeken met verschillende behandelingen, toepassingen en onderzoekers. De aangehaalde cijfers bieden de voorschrijvende arts echter enige basis voor het schatten van de relatieve bijdrage van medicamenteuze en niet-medicamenteuze factoren aan de incidentie van bijwerkingen in de onderzochte populatie.
Tabel 9 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens acute behandeling van schizofrenie (tot 6 weken) en bipolaire manie (tot 12 weken) bij 2% of meer van de patiënten behandeld met SEROQUEL (doseringen variërend van van 75 tot 800 mg/dag) waarbij de incidentie bij patiënten behandeld met SEROQUEL hoger was dan de incidentie bij met placebo behandelde patiënten.
In de onderzoeken naar acute aanvullende therapie van bipolaire manie (tot 3 weken) waren de meest waargenomen bijwerkingen geassocieerd met het gebruik van SEROQUEL (incidentie van 5% of meer) en waargenomen met een snelheid van ten minste tweemaal die van placebo op SEROQUEL. slaperigheid (34%), droge mond (19%), asthenie (10%), constipatie (10%), buikpijn (7%), orthostatische hypotensie (7%), faryngitis (6%) en gewichtstoename (6 %).
Tabel 10 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens de behandeling (tot 3 weken) van acute manie bij 2% of meer van de patiënten die werden behandeld met SEROQUEL (doses variërend van 100 tot 800 mg/dag) als aanvullende therapie bij lithium en divalproex, waarbij de incidentie bij met SEROQUEL behandelde patiënten hoger was dan de incidentie bij met placebo behandelde patiënten.
In onderzoeken naar bipolaire depressie (tot 8 weken) waren de meest waargenomen bijwerkingen die verband hielden met het gebruik van SEROQUEL (incidentie van 5% of meer) en waargenomen met een snelheid van SEROQUEL 200 mg die ten minste tweemaal zo hoog was als die van placebo slaperigheid (57% ), droge mond (44%), duizeligheid (18%), constipatie (10%) en lethargie (5%).
Tabel 11 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens de behandeling (tot 8 weken) van bipolaire depressie bij 2% of meer van de patiënten die werden behandeld met SEROQUEL (doses van 300 en 600 mg/dag) waarbij de incidentie bij patiënten behandeld met SEROQUEL was hoger dan de incidentie bij met placebo behandelde patiënten.
Onderzoeken naar interacties op basis van geslacht, leeftijd en ras brachten geen klinisch relevante verschillen aan het licht in het optreden van bijwerkingen op basis van deze demografische factoren.
Dosisafhankelijkheid van bijwerkingen in kortdurende, placebo-gecontroleerde onderzoeken
Dosisgerelateerde bijwerkingen
Spontaan opgewekte bijwerkingen uit een onderzoek naar schizofrenie waarin vijf vaste doses SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg en 750 mg/dag) werden vergeleken met placebo, werden onderzocht op dosisgerelateerdheid van bijwerkingen. Logistische regressieanalyses lieten een positieve dosisrespons (p
Bijwerkingen in klinische onderzoeken met quetiapine en niet elders op het etiket vermeld:
De volgende bijwerkingen zijn ook gemeld met quetiapine: nachtmerries, overgevoeligheid en verhogingen van serumcreatinefosfokinase (niet geassocieerd met NMS), galactorroe, bradycardie (die kan optreden bij of nabij het begin van de behandeling en geassocieerd is met hypotensie en/of syncope ) verminderde bloedplaatjes, somnambulisme (en andere gerelateerde gebeurtenissen), verhogingen van gamma-GT-spiegels, hypothermie, dyspneu, eosinofilie, urineretentie, darmobstructie en priapisme.
Extrapiramidale symptomen (EPS)
Dystonie
Klasse-effect
Symptomen van dystonie, langdurige abnormale samentrekkingen van spiergroepen, kunnen optreden bij gevoelige personen tijdens de eerste paar dagen van de behandeling. Dystonische symptomen zijn onder meer: spasmen van de nekspieren, soms overgaand in een beklemmend gevoel in de keel, moeite met slikken, ademhalingsmoeilijkheden en/of uitpuilende tong. Hoewel deze symptomen bij lage doses kunnen optreden, komen ze vaker en ernstiger voor bij een hoge potentie en bij hogere doses antipsychotica van de eerste generatie. Een verhoogd risico op acute dystonie wordt waargenomen bij mannen en jongere leeftijdsgroepen.
Er werden vier methoden gebruikt om EPS te meten: (1) Simpson-Angus totale score (gemiddelde verandering ten opzichte van baseline) die Parkinsonisme en acathisie evalueert, (2) Barnes Akathisia Rating Scale (BARS) Global Assessment Score, (3) incidentie van spontane klachten van EPS (akathisie, akinesie, tandradstijfheid, extrapiramidaal syndroom, hypertonie, hypokinesie, nekstijfheid en tremor), en (4) gebruik van anticholinergica om EPS te behandelen.
volwassenen
Gegevens van een 6 weken durend klinisch onderzoek naar schizofrenie waarin vijf vaste doses SEROQUEL (75, 150, 300, 600, 750 mg/dag) werden vergeleken, leverden bewijs voor het ontbreken van extrapiramidale symptomen (EPS) en dosisgerelateerdheid voor EPS geassocieerd met SEROQUEL 100mg behandeling. Er werden drie methoden gebruikt om EPS te meten: (1) Simpson-Angus-totaalscore (gemiddelde verandering ten opzichte van baseline) die Parkinsonisme en acathisie evalueert, (2) incidentie van spontane klachten van EPS (akathisie, akinesie, tandradstijfheid, extrapiramidaal syndroom, hypertonie, hypokinesie, nekstijfheid en tremor), en (3) het gebruik van anticholinergica tegen EPS.
In Tabel 12 omvatte het dystonische voorval nekstijfheid, hypertonie, dystonie, spierrigiditeit, oculogyratie; parkinsonisme omvatte tandradstijfheid, tremor, kwijlen, hypokinesie; acathisie omvatte acathisie, psychomotorische agitatie; dyskinetische gebeurtenis omvatte tardieve dyskinesie, dyskinesie, choreoathetose; en andere extrapiramidale gebeurtenissen omvatten rusteloosheid, extrapiramidale stoornis, bewegingsstoornis.
De incidentiecijfers van Parkinsonisme, zoals gemeten door de Simpson-Angus-totaalscore voor placebo en de vijf vaste doses (75, 150, 300, 600, 750 mg/dag) waren: -0,6; -1,0, -1,2; -1,6; -1,8 en -1,8. Het percentage anticholinerge medicatie voor de behandeling van EPS voor placebo en de vijf vaste doses was: 14%; 11%; 10%; 8%; 12% en 11%.
In zes aanvullende placebogecontroleerde klinische onderzoeken (3 bij acute manie en 3 bij schizofrenie) waarbij variabele doses SEROQUEL werden gebruikt, waren er geen verschillen tussen de SEROQUEL- en placebobehandelingsgroepen in de incidentie van EPS, zoals beoordeeld door Simpson-Angus-totaalscores, spontane klachten van EPS en het gelijktijdig gebruik van anticholinergica om EPS te behandelen.
In twee placebogecontroleerde klinische onderzoeken voor de behandeling van bipolaire depressie met 300 mg en 600 mg SEROQUEL 100 mg, was de incidentie van bijwerkingen die mogelijk verband hielden met EPS 12% in beide dosisgroepen en 6% in de placebogroep. In deze onderzoeken was de incidentie van de afzonderlijke bijwerkingen (akathisie, extrapiramidale stoornis, tremor, dyskinesie, dystonie, rusteloosheid, onwillekeurige spiersamentrekkingen, psychomotorische hyperactiviteit en spierrigiditeit) over het algemeen laag en bedroeg in geen enkele behandelingsgroep meer dan 4%.
De 3 behandelingsgroepen waren vergelijkbaar in gemiddelde verandering in SAS-totaalscore en BARS Global Assessment-score aan het einde van de behandeling. Het gelijktijdig gebruik van anticholinergica kwam niet vaak voor en was vergelijkbaar in de drie behandelingsgroepen.
Kinderen en adolescenten
De onderstaande informatie is afgeleid van een database met klinische onderzoeken voor SEROQUEL 200 mg, bestaande uit meer dan 1000 pediatrische patiënten. Deze database omvat 677 patiënten die zijn blootgesteld aan SEROQUEL 200 mg voor de behandeling van schizofrenie en 393 kinderen en adolescenten (10-17 jaar oud) die zijn blootgesteld aan SEROQUEL voor de behandeling van acute bipolaire manie.
Bijwerkingen die verband houden met stopzetting van de behandeling in kortdurende, placebogecontroleerde onderzoeken
Schizofrenie
De incidentie van stopzetting vanwege bijwerkingen voor met quetiapine behandelde en met placebo behandelde patiënten was respectievelijk 8,2% en 2,7%. De bijwerking die leidde tot stopzetting bij 1% of meer van de patiënten op SEROQUEL en met een hogere incidentie dan placebo was slaperigheid (2,7% en 0% voor placebo).
Bipolaire Ik Manie
De incidentie van stopzetting vanwege bijwerkingen voor met quetiapine behandelde en met placebo behandelde patiënten was respectievelijk 11,4% en 4,4%. De bijwerkingen die leidden tot stopzetting bij 2% of meer van de patiënten op SEROQUEL en met een hogere incidentie dan placebo waren slaperigheid (4,1% vs. 1,1%) en vermoeidheid (2,1% vs. 0).
Vaak waargenomen bijwerkingen in kortdurende, placebo-gecontroleerde onderzoeken
Bij de behandeling van schizofrenie (tot 6 weken) waren de meest waargenomen bijwerkingen in verband met het gebruik van quetiapine bij adolescenten (incidentie van 5% of meer en incidentie van quetiapine ten minste tweemaal die voor placebo) slaperigheid (34%), duizeligheid (12%), droge mond (7%), tachycardie (7%).
Bij behandeling van bipolaire manie (tot 3 weken) waren de meest waargenomen bijwerkingen die verband hielden met het gebruik van quetiapine bij kinderen en adolescenten (incidentie van 5% of meer en incidentie van quetiapine ten minste tweemaal die voor placebo) slaperigheid (53%), duizeligheid (18%), vermoeidheid (11%), verhoogde eetlust (9%), misselijkheid (8%), braken (8%), tachycardie (7%), droge mond (7%) en gewichtstoename (6% ).
In een acuut (8 weken) SEROQUEL 100 mg XR-onderzoek bij kinderen en adolescenten (10-17 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, werden de meest waargenomen bijwerkingen geassocieerd met het gebruik van SEROQUEL XR (incidentie van 5% of meer en ten minste tweemaal die voor placebo) waren duizeligheid 7%, diarree 5%, vermoeidheid 5% en misselijkheid 5%.
Bijwerkingen die optreden met een incidentie van ≥ 2% bij met SEROQUEL 300 mg behandelde patiënten in kortdurende, placebogecontroleerde onderzoeken
Schizofrenie (adolescenten, 13-17 jaar oud)
De volgende bevindingen waren gebaseerd op een 6 weken durende placebogecontroleerde studie waarin quetiapine werd toegediend in doses van 400 of 800 mg/dag.
Tabel 13 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens de behandeling (tot 6 weken) van schizofrenie bij 2% of meer van de patiënten die werden behandeld met SEROQUEL (doses van 400 of 800 mg/dag) waarbij de incidentie bij patiënten behandeld met SEROQUEL was ten minste tweemaal de incidentie bij met placebo behandelde patiënten.
Bijwerkingen die mogelijk dosisgerelateerd waren met een hogere frequentie in de 800 mg-groep dan in de 400 mg-groep waren duizeligheid (8% vs. 15%), droge mond (4% vs. 10%) en tachycardie (6% vs. 11%).
Bipolaire ik-manie (kinderen en adolescenten van 10-17 jaar oud)
De volgende bevindingen waren gebaseerd op een 3 weken durende placebogecontroleerde studie waarin quetiapine werd toegediend in doses van 400 of 600 mg/dag.
Vaak waargenomen bijwerkingen
Bij behandeling van bipolaire manie (tot 3 weken) waren de meest waargenomen bijwerkingen die verband hielden met het gebruik van quetiapine bij kinderen en adolescenten (incidentie van 5% of meer en incidentie van quetiapine ten minste tweemaal die voor placebo) slaperigheid (53%), duizeligheid (18%), vermoeidheid (11%), verhoogde eetlust (9%), misselijkheid (8%), braken (8%), tachycardie (7%), droge mond (7%) en gewichtstoename (6% ).
Tabel 14 somt de incidentie op, afgerond op het dichtstbijzijnde percentage, van bijwerkingen die optraden tijdens de behandeling (tot 3 weken) van bipolaire manie bij 2% of meer van de patiënten die werden behandeld met SEROQUEL (doses van 400 of 600 mg/dag) waarbij de incidentie bij patiënten behandeld met SEROQUEL was hoger dan de incidentie bij met placebo behandelde patiënten.
Bijwerkingen die mogelijk dosisgerelateerd waren met een hogere frequentie in de 600 mg-groep dan in de 400 mg-groep waren slaperigheid (50% vs. 57%), misselijkheid (6% vs. 10%) en tachycardie (6% vs. 9%
Extrapiramidale symptomen
In een kortdurend placebogecontroleerd monotherapieonderzoek bij adolescente patiënten met schizofrenie (duur van 6 weken), was de geaggregeerde incidentie van extrapiramidale symptomen 12,9% (19/147) voor SEROQUEL 100 mg en 5,3% (4/75) voor placebo, hoewel de incidentie van de individuele bijwerkingen (akathisie, tremor, extrapiramidale stoornis, hypokinesie, rusteloosheid, psychomotorische hyperactiviteit, spierstijfheid, dyskinesie) in geen enkele behandelingsgroep hoger was dan 4,1%. In een kortdurend placebogecontroleerd monotherapieonderzoek bij kinderen en adolescenten met bipolaire manie (duur van 3 weken), was de geaggregeerde incidentie van extrapiramidale symptomen 3,6% (7/193) of SEROQUEL en 1,1% (1/90) voor placebo.
Tabel 15 geeft een lijst weer van patiënten met bijwerkingen die mogelijk geassocieerd zijn met extrapiramidale symptomen in het korte, placebogecontroleerde monotherapieonderzoek bij adolescente patiënten met schizofrenie (duur van 6 weken).
In tabellen 15-16 omvatte het dystonische voorval nekstijfheid, hypertonie en spierstijfheid; parkinsonisme omvatte tandradstijfheid en tremor; akathisie omvatte alleen akathisie; dyskinetische gebeurtenis omvatte tardieve dyskinesie, dyskinesie en choreoathetose; en andere extrapiramidale gebeurtenissen omvatten rusteloosheid en extrapiramidale stoornis.
Tabel 16 geeft een overzicht van patiënten met bijwerkingen geassocieerd met extrapiramidale symptomen in een kortdurend placebogecontroleerd monotherapieonderzoek bij kinderen en adolescente patiënten met bipolaire manie (duur van 3 weken).
Veranderingen in laboratorium, ECG en vitale functies waargenomen in klinische onderzoeken
Laboratoriumveranderingen
Aantal neutrofielen
volwassenen
In placebogecontroleerde klinische onderzoeken met monotherapie waarbij 3368 patiënten op quetiapinefumaraat en 1515 op placebo betrokken waren, was de incidentie van ten minste één voorval van het aantal neutrofielen WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Transaminase-verhogingen
volwassenen
Asymptomatische, voorbijgaande en omkeerbare verhogingen van serumtransaminasen (voornamelijk ALT) zijn gemeld. In schizofrenieonderzoeken bij volwassenen was het percentage patiënten met transaminaseverhogingen van >3 maal de bovengrens van het normale referentiebereik in een pool van 3 tot 6 weken durende placebogecontroleerde onderzoeken ongeveer 6% (29/483) voor SEROQUEL. vergeleken met 1% (3/194) voor placebo. In onderzoeken naar acute bipolaire manie bij volwassenen was het percentage patiënten met transaminaseverhogingen van >3 maal de bovengrens van het normale referentiebereik in een pool van placebogecontroleerde onderzoeken van 3 tot 12 weken ongeveer 1% voor zowel SEROQUEL (3 /560) en placebo (3/294). Deze verhogingen van leverenzymen traden gewoonlijk op binnen de eerste 3 weken van de medicamenteuze behandeling en keerden onmiddellijk terug naar het niveau van vóór het onderzoek bij voortzetting van de behandeling met SEROQUEL. In onderzoeken naar bipolaire depressie was het percentage patiënten met transaminaseverhogingen van >3 maal de bovengrens van het normale referentiebereik in twee 8 weken durende placebogecontroleerde onderzoeken 1% (5/698) voor SEROQUEL 50 mg en 2% (6/ 347) voor placebo.
Verminderde hemoglobine
volwassenen
In kortdurende placebogecontroleerde onderzoeken trad bij 8,3% (594/7155) van de met quetiapine behandelde patiënten verlagingen van hemoglobine tot ≤13 g/dl mannen, ≤12 g/dl vrouwen op ten minste één keer op, vergeleken met 6,2% ( 219/3536) van de met placebo behandelde patiënten. In een database van gecontroleerde en niet-gecontroleerde klinische onderzoeken traden bij 11% (2277/20729) van de met quetiapine behandelde patiënten verlagingen van hemoglobine tot ≤13 g/dl bij mannen en ≤12 g/dl bij vrouwen op.
Interferentie met urinegeneesmiddelenschermen
Er zijn literatuurrapporten die wijzen op vals-positieve resultaten in urine-enzymimmunoassays voor methadon en tricyclische antidepressiva bij patiënten die quetiapine hebben gebruikt. Voorzichtigheid is geboden bij de interpretatie van positieve urinetestresultaten voor geneesmiddelen voor deze geneesmiddelen, en bevestiging door alternatieve analytische technieken (bijv. chromatografische methoden) moet worden overwogen.
ECG-wijzigingen
volwassenen
Vergelijkingen tussen groepen voor gepoolde placebogecontroleerde onderzoeken brachten geen statistisch significante SEROQUEL/placebo-verschillen aan het licht in de proporties van patiënten die mogelijk belangrijke veranderingen in ECG-parameters ondervonden, waaronder QT-, QTc- en PR-intervallen. Het percentage patiënten dat aan de criteria voor tachycardie voldeed, werd echter vergeleken in vier placebogecontroleerde klinische onderzoeken van 3 tot 6 weken voor de behandeling van schizofrenie, waarbij een incidentie van 1% (4/399) voor SEROQUEL 100 mg werd onthuld in vergelijking met 0,6% (1 /156) incidentie voor placebo. In onderzoeken naar acute (monotherapie) bipolaire manie was het percentage patiënten dat aan de criteria voor tachycardie voldeed 0,5% (1/192) voor SEROQUEL 200 mg vergeleken met 0% (0/178) incidentie voor placebo. In onderzoeken naar acute bipolaire manie (aanvullende) was het percentage patiënten dat aan dezelfde criteria voldeed 0,6% (1/166) voor SEROQUEL 100 mg vergeleken met 0% (0/171) incidentie voor placebo. In bipolaire depressieonderzoeken hadden geen patiënten een hartslagverhoging tot> 120 slagen per minuut. Het gebruik van SEROQUEL 50 mg ging gepaard met een gemiddelde toename van de hartslag, beoordeeld door ECG, van 7 slagen per minuut vergeleken met een gemiddelde toename van 1 slag per minuut bij placebopatiënten. Deze lichte neiging tot tachycardie bij volwassenen kan verband houden met het potentieel van SEROQUEL om orthostatische veranderingen te induceren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Kinderen en adolescenten
In de studie naar acute (6 weken) schizofrenie bij adolescenten trad een verhoging van de hartslag (>110 bpm) op bij 5,2% (3/73) van de patiënten die SEROQUEL 400 mg kregen en 8,5% (5/74) van de patiënten die SEROQUEL 800 kregen. mg vergeleken met 0% (0/75) van de patiënten die placebo kregen. De gemiddelde verhogingen van de hartslag waren respectievelijk 3,8 bpm en 11,2 bpm voor de SEROQUEL 400 mg- en 800 mg-groepen, vergeleken met een verlaging van 3,3 bpm in de placebogroep [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In de studie naar acute (3 weken) bipolaire manie bij kinderen en adolescenten trad een verhoging van de hartslag (>110 bpm) op bij 1,1% (1/89) van de patiënten die SEROQUEL 400 mg kregen en bij 4,7% (4/85) van de patiënten die SEROQUEL 600 mg kregen in vergelijking met 0% (0/98) van de patiënten die placebo kregen. De gemiddelde verhogingen van de hartslag waren 12,8 bpm en 13,4 bpm voor respectievelijk de SEROQUEL 400 mg- en 600 mg-groepen, vergeleken met een verlaging van 1,7 bpm in de placebogroep [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In een acuut (8 weken) SEROQUEL XR-onderzoek bij kinderen en adolescenten (10-17 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, verhoogde hartslag (>110 bpm 10-12 jaar en 13-17 jaar) trad op bij 0% van de patiënten die SEROQUEL XR kregen en bij 1,2% van de patiënten die placebo kregen. De gemiddelde verhogingen van de hartslag waren 3,4 bpm voor SEROQUEL XR, vergeleken met 0,3 bpm in de placebogroep [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen werden vastgesteld tijdens de goedkeuring van SEROQUEL na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bijwerkingen die sinds de introductie op de markt zijn gemeld en die tijdelijk gerelateerd waren aan de behandeling met quetiapine, omvatten anafylactische reactie, cardiomyopathie, geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS), hyponatriëmie, myocarditis, nachtelijke enuresis, pancreatitis, retrograde amnesie, rabdomyolyse, syndroom van onjuiste secretie van antidiuretisch hormoon (SIADH), Stevens-Johnson-syndroom (SJS), toxische epidermale necrolyse (TEN), verlaagd aantal bloedplaatjes, ernstige leverreacties (waaronder hepatitis, levernecrose en leverfalen), agranulocytose, darmobstructie, ileus, colonischemie, urineretentie , slaapapneu en acute gegeneraliseerde exanthemateuze pustulosis (AGEP).
DRUG-INTERACTIES
Effect van andere geneesmiddelen op quetiapine
De risico's van het gebruik van SEROQUEL in combinatie met andere geneesmiddelen zijn niet uitgebreid geëvalueerd in systematische onderzoeken. Gezien de primaire CZS-effecten van SEROQUEL is voorzichtigheid geboden wanneer het wordt gebruikt in combinatie met andere centraal werkende geneesmiddelen. SEROQUEL 300 mg versterkte de cognitieve en motorische effecten van alcohol in een klinisch onderzoek bij proefpersonen met geselecteerde psychotische stoornissen, en alcoholische dranken moeten worden beperkt tijdens het gebruik van quetiapine.
Blootstelling aan quetiapine wordt verhoogd door de prototype CYP3A4-remmers (bijv. ketoconazol, itraconazol, indinavir, ritonavir, nefazodon, enz.) en verlaagd door de prototype CYP3A4-inductoren (bijv. fenytoïne, carbamazepine, rifampicine, avasimibe, sint-janskruid enz.) . Dosisaanpassing van quetiapine zal nodig zijn als het gelijktijdig wordt toegediend met krachtige CYP3A4-inductoren of -remmers.
CYP3A4-remmers
Gelijktijdige toediening van ketoconazol, een krachtige remmer van cytochroom CYP3A4, resulteerde in een significante toename van de blootstelling aan quetiapine. De dosis SEROQUEL 200 mg moet worden verlaagd tot een zesde van de oorspronkelijke dosis bij gelijktijdige toediening met een sterke CYP3A4-remmer (zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
CYP3A4-inductoren
Gelijktijdige toediening van quetiapine en fenytoïne, een CYP3A4-inductor, verhoogde de gemiddelde orale klaring van quetiapine met een factor vijf. Verhoogde doses SEROQUEL 50 mg tot 5-voudig kunnen nodig zijn om de symptomen van schizofrenie onder controle te houden bij patiënten die quetiapine en fenytoïne of andere bekende krachtige CYP3A4-inductoren krijgen (zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ]. Wanneer de CYP3A4-inductor wordt stopgezet, moet de dosis SEROQUEL 25 mg binnen 7-14 dagen worden verlaagd tot het oorspronkelijke niveau (zie DOSERING EN ADMINISTRATIE ].
De mogelijke effecten van verschillende gelijktijdig toegediende geneesmiddelen op de farmacokinetiek van quetiapine werden bestudeerd [zie: KLINISCHE FARMACOLOGIE ].
Effect van quetiapine op andere geneesmiddelen
Vanwege het potentieel om hypotensie te induceren, kan SEROQUEL 50 mg de effecten van bepaalde antihypertensiva versterken.
SEROQUEL 25 mg kan de effecten van levodopa en dopamine-agonisten tegenwerken.
Er zijn geen klinisch relevante farmacokinetische interacties van Seroquel met andere geneesmiddelen op basis van de CYP-route. Seroquel 50 mg en zijn metabolieten zijn niet-remmers van belangrijke metaboliserende CYP's (1A2, 2C9, 2C19, 2D6 en 3A4).
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
SEROQUEL is geen gereguleerde stof.
Misbruik
SEROQUEL is niet systematisch onderzocht, bij dieren of mensen, vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. Hoewel de klinische onderzoeken geen enkele neiging tot het zoeken naar drugs aan het licht brachten, waren deze waarnemingen niet systematisch en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in welke mate een geneesmiddel dat op het centrale zenuwstelsel werkt, zal worden misbruikt, omgeleid, en/of misbruikt zodra ze op de markt zijn gebracht. Daarom moeten patiënten zorgvuldig worden beoordeeld op een voorgeschiedenis van drugsmisbruik, en dergelijke patiënten moeten nauwlettend worden geobserveerd op tekenen van verkeerd gebruik of misbruik van SEROQUEL, bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar drugs.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. Analyse van 17 placebogecontroleerde onderzoeken (modale duur van 10 weken), voornamelijk bij patiënten die atypische antipsychotica gebruikten, onthulde een risico op overlijden bij met geneesmiddel behandelde patiënten van 1,6 tot 1,7 keer het risico op overlijden bij met placebo behandelde patiënten. In de loop van een typische 10 weken durende gecontroleerde studie was het sterftecijfer bij met geneesmiddelen behandelde patiënten ongeveer 4,5%, vergeleken met een percentage van ongeveer 2,6% in de placebogroep. Hoewel de doodsoorzaken uiteenliepen, bleken de meeste sterfgevallen van cardiovasculaire (bijv. hartfalen, plotselinge dood) of infectieuze (bijv. longontsteking) van aard te zijn. Observationele studies suggereren dat, net als bij atypische antipsychotica, behandeling met conventionele antipsychotica de mortaliteit kan verhogen. Het is niet duidelijk in hoeverre de bevindingen van verhoogde mortaliteit in observationele onderzoeken kunnen worden toegeschreven aan het antipsychoticum in tegenstelling tot bepaalde kenmerken van de patiënten. SEROQUEL is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: ].
Zelfmoordgedachten en -gedrag bij adolescenten en jongvolwassenen
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18-24 jaar) met depressieve stoornis (MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessief-compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in Tabel 2.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongewone gedragsveranderingen en de andere symptomen hierboven beschreven, evenals het ontstaan van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor SEROQUEL moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Voordat de behandeling met een antidepressivum, waaronder SEROQUEL, wordt gestart, moeten patiënten met depressieve symptomen echter adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie.
Cerebrovasculaire bijwerkingen, waaronder beroerte, bij oudere patiënten met aan dementie gerelateerde psychose
In placebogecontroleerde onderzoeken met risperidon, aripiprazol en olanzapine bij oudere proefpersonen met dementie, was er een hogere incidentie van cerebrovasculaire bijwerkingen (cerebrovasculaire accidenten en transiënte ischemische aanvallen), waaronder dodelijke ongevallen, vergeleken met met placebo behandelde proefpersonen. SEROQUEL is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie ook: GEVAARLIJKE WAARSCHUWING: en Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose ].
Maligne neurolepticasyndroom (NMS)
Een potentieel fataal symptoomcomplex dat soms wordt aangeduid als maligne neurolepticasyndroom (MNS), is gemeld in verband met de toediening van antipsychotica, waaronder SEROQUEL. Zeldzame gevallen van MNS zijn gemeld met SEROQUEL. Klinische manifestaties van MNS zijn hyperpyrexie, spierstijfheid, veranderde mentale toestand en tekenen van autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen). Bijkomende symptomen kunnen zijn: verhoogde creatininefosfokinase, myoglobinurie (rabdomyolyse) en acuut nierfalen.
De diagnostische evaluatie van patiënten met dit syndroom is gecompliceerd. Om tot een diagnose te komen, is het belangrijk gevallen uit te sluiten waarin de klinische presentatie zowel een ernstige medische aandoening (bijv. longontsteking, systemische infectie, enz.) als onbehandelde of onvoldoende behandelde extrapiramidale tekenen en symptomen (EPS) omvat. Andere belangrijke overwegingen bij de differentiële diagnose zijn centrale anticholinerge toxiciteit, hitteberoerte, medicijnkoorts en primaire pathologie van het centrale zenuwstelsel (CZS).
De behandeling van MNS moet het volgende omvatten: 1) onmiddellijke stopzetting van antipsychotica en andere geneesmiddelen die niet essentieel zijn voor gelijktijdige therapie; 2) intensieve symptomatische behandeling en medische monitoring; en 3) behandeling van eventuele bijkomende ernstige medische problemen waarvoor specifieke behandelingen beschikbaar zijn. Er is geen algemene overeenstemming over specifieke farmacologische behandelingsregimes voor NMS.
Als een patiënt behandeling met antipsychotica nodig heeft na herstel van MNS, moet de mogelijke herintroductie van medicamenteuze therapie zorgvuldig worden overwogen. De patiënt moet zorgvuldig worden gecontroleerd aangezien recidieven van MNS zijn gemeld.
Metabolische veranderingen
Atypische antipsychotica zijn in verband gebracht met metabole veranderingen, waaronder hyperglykemie/diabetes mellitus, dyslipidemie en gewichtstoename. Hoewel is aangetoond dat alle geneesmiddelen in de klasse enkele metabole veranderingen veroorzaken, heeft elk medicijn zijn eigen specifieke risicoprofiel. Bij sommige patiënten werd in klinische onderzoeken een verslechtering van meer dan één van de metabole parameters gewicht, bloedglucose en lipiden waargenomen. Veranderingen in deze metabole profielen moeten worden behandeld zoals klinisch aangewezen.
Hyperglykemie en diabetes mellitus
Hyperglykemie, in sommige gevallen extreem en geassocieerd met ketoacidose of hyperosmolair coma of overlijden, is gemeld bij patiënten die werden behandeld met atypische antipsychotica, waaronder quetiapine. De beoordeling van de relatie tussen atypisch antipsychoticagebruik en glucoseafwijkingen wordt bemoeilijkt door de mogelijkheid van een verhoogd achtergrondrisico op diabetes mellitus bij patiënten met schizofrenie en de toenemende incidentie van diabetes mellitus in de algemene bevolking. Gezien deze confounders wordt de relatie tussen atypisch antipsychoticagebruik en hyperglykemiegerelateerde bijwerkingen niet volledig begrepen. Epidemiologische onderzoeken wijzen echter op een verhoogd risico op hyperglykemiegerelateerde bijwerkingen bij patiënten die worden behandeld met de atypische antipsychotica. Precieze risicoschattingen voor aan hyperglykemie gerelateerde bijwerkingen bij patiënten die worden behandeld met atypische antipsychotica zijn niet beschikbaar.
Patiënten met een vastgestelde diagnose diabetes mellitus die worden gestart met atypische antipsychotica, moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten met risicofactoren voor diabetes mellitus (bijv. obesitas, familiegeschiedenis van diabetes) die beginnen met een behandeling met atypische antipsychotica, moeten aan het begin van de behandeling en periodiek tijdens de behandeling een nuchtere bloedglucosetest ondergaan. Elke patiënt die met atypische antipsychotica wordt behandeld, moet worden gecontroleerd op symptomen van hyperglykemie, waaronder polydipsie, polyurie, polyfagie en zwakte. Patiënten die symptomen van hyperglykemie ontwikkelen tijdens behandeling met atypische antipsychotica, moeten een nuchtere bloedglucosetest ondergaan. In sommige gevallen is de hyperglykemie verdwenen toen het atypische antipsychoticum werd stopgezet; bij sommige patiënten was het echter nodig om de antidiabetische behandeling voort te zetten ondanks het stopzetten van het verdachte geneesmiddel.
volwassenen
In een 24 weken durende studie (actief gecontroleerd, 115 patiënten behandeld met SEROQUEL), ontworpen om de glykemische status te evalueren met orale glucosetolerantietests van alle patiënten, was in week 24 de incidentie van een post-glucose-challenge glucosespiegel ≥200 mg/dl 1,7% en de incidentie van een nuchtere bloedglucosespiegel ≥126 mg/dL was 2,6%. De gemiddelde verandering in nuchtere glucose vanaf baseline was 3,2 mg/dL en de gemiddelde verandering in 2-uurs glucose vanaf baseline was -1,8 mg/dL voor quetiapine.
In 2 langdurige placebogecontroleerde, gerandomiseerde klinische ontwenningsonderzoeken voor onderhoud van bipolaire I-stoornis, gemiddelde blootstelling van 213 dagen voor SEROQUEL (646 patiënten) en 152 dagen voor placebo (680 patiënten), was de gemiddelde verandering in glucose ten opzichte van baseline +5,0 mg /dL voor SEROQUEL 100 mg en –0,05 mg/dL voor placebo. De voor blootstelling gecorrigeerde snelheid van een verhoogde bloedglucosespiegel (≥126 mg/dL) voor patiënten meer dan 8 uur sinds een maaltijd (sommige patiënten waren echter mogelijk niet uitgesloten van calorie-inname uit vloeistoffen tijdens de nuchtere periode) was 18,0 per 100 patiëntjaren voor SEROQUEL (10,7% van de patiënten; n=556) en 9,5 voor placebo per 100 patiëntjaren (4,6% van de patiënten; n=581).
Kinderen en adolescenten
In een placebogecontroleerd onderzoek naar monotherapie met SEROQUEL 25 mg bij adolescente patiënten (13-17 jaar) met schizofrenie (duur van 6 weken), was de gemiddelde verandering in nuchtere glucosespiegels voor SEROQUEL (n=138) in vergelijking met placebo (n=67) was – 0,75 mg/dL versus –1,70 mg/dL. In een placebogecontroleerd onderzoek naar monotherapie met SEROQUEL 300 mg bij kinderen en adolescenten (10-17 jaar) met bipolaire manie (duur van 3 weken), was de gemiddelde verandering in nuchtere glucosespiegel voor SEROQUEL (n=170) in vergelijking met placebo (n =81) was 3,62 mg/dL versus -1,17 mg/dL. Geen enkele patiënt in beide onderzoeken met een baseline normale nuchtere glucosespiegel (
In een placebogecontroleerd SEROQUEL XR-monotherapieonderzoek (duur van 8 weken) bij kinderen en adolescenten (1017 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, was de gemiddelde verandering in nuchtere glucosespiegels voor SEROQUEL 300 mg XR (n= 60) vergeleken met placebo (n=62) was 1,8 mg/dL versus 1,6 mg/dL. In deze studie waren er geen patiënten in de met SEROQUEL XR of placebo behandelde groepen met een baseline normale nuchtere glucosespiegel (126 mg/dL. Er was één patiënt in de SEROQUEL 25 mg XR-groep met een baseline borderline nuchtere glucosespiegel (>100 mg/dL en 126 mg/dL vergeleken met nul patiënten in de placebogroep.
dyslipidemie
volwassenen
Tabel 4 toont het percentage volwassen patiënten met veranderingen in totaal cholesterol, triglyceriden, LDL-cholesterol en HDL-cholesterol vanaf baseline volgens indicatie in klinische onderzoeken met SEROQUEL.
Kinderen en adolescenten
Tabel 5 toont het percentage kinderen en adolescenten met veranderingen in totaal cholesterol, triglyceriden, LDL-cholesterol en HDL-cholesterol vanaf baseline in klinische onderzoeken met SEROQUEL.
In een placebogecontroleerd SEROQUEL XR monotherapie-onderzoek (duur van 8 weken) bij kinderen en adolescenten (1017 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, was het percentage kinderen en adolescenten met verschuivingen in totaal cholesterol (≥ 200 mg/dL), triglyceriden (≥150 mg/dL), LDL-cholesterol (≥ 130 mg/dL) en HDL-cholesterol (≤40 mg/dL) vanaf baseline tot klinisch significante niveaus waren: totaal cholesterol 8% (7 /83) voor SEROQUEL 50 mg XR versus 6% (5/84) voor placebo; triglyceriden 28% (22/80) voor SEROQUEL 100 mg XR versus 9% (7/82) voor placebo; LDL-cholesterol 2% (2/86) voor SEROQUEL XR vs. 4% (3/85) voor placebo en HDL-cholesterol 20% (13/65) voor SEROQUEL XR vs. 15% (11/74) voor placebo.
Gewichtstoename
Gewichtstoename is waargenomen in klinische onderzoeken. Patiënten die quetiapine krijgen, dienen regelmatig hun gewicht te controleren.
volwassenen
In klinische onderzoeken met SEROQUEL 50 mg zijn de volgende gewichtstoenames gemeld.
Kinderen en adolescenten
In twee klinische onderzoeken met SEROQUEL 25 mg, één bij bipolaire manie en één bij schizofrenie, zijn gerapporteerde gewichtstoenames opgenomen in Tabel 7.
De gemiddelde verandering in lichaamsgewicht in de schizofrenie-studie was 2,0 kg in de SEROQUEL 25 mg-groep en -0,4 kg in de placebogroep en in de bipolaire manie-studie was deze 1,7 kg in de SEROQUEL 200 mg-groep en 0,4 kg in de placebogroep.
In een open-label onderzoek waarin patiënten uit de bovengenoemde twee pediatrische onderzoeken werden opgenomen, voltooide 63% van de patiënten (241/380) een behandeling van 26 weken met SEROQUEL. Na 26 weken behandeling was de gemiddelde toename van het lichaamsgewicht 4,4 kg. Vijfenveertig procent van de patiënten kwam ≥7% van hun lichaamsgewicht aan, niet gecorrigeerd voor normale groei. Om te corrigeren voor normale groei gedurende 26 weken, werd een toename van ten minste 0,5 standaarddeviatie ten opzichte van de uitgangswaarde in BMI gebruikt als maatstaf voor een klinisch significante verandering; 18,3% van de patiënten op SEROQUEL voldeed aan dit criterium na 26 weken behandeling.
In een klinisch onderzoek naar SEROQUEL XR bij kinderen en adolescenten (10-17 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, was het percentage patiënten met een gewichtstoename van ≥7% van het lichaamsgewicht op enig moment 15% ( 14/92) voor SEROQUEL 25 mg XR versus 10% (10/100) voor placebo. De gemiddelde verandering in lichaamsgewicht was 1,4 kg in de SEROQUEL 50 mg XR-groep versus 0,6 kg in de placebogroep.
Bij de behandeling van pediatrische patiënten met SEROQUEL 50 mg voor welke indicatie dan ook, moet de gewichtstoename worden vergeleken met de verwachte groei voor normale groei.
Tardieve dyskinesie
Een syndroom van mogelijk onomkeerbare, onwillekeurige, dyskinetische bewegingen kan optreden bij patiënten die worden behandeld met antipsychotica, waaronder quetiapine. Hoewel de prevalentie van het syndroom het hoogst lijkt te zijn bij ouderen, vooral bij oudere vrouwen, is het onmogelijk om te vertrouwen op prevalentieschattingen om bij aanvang van de antipsychotische behandeling te voorspellen welke patiënten het syndroom waarschijnlijk zullen ontwikkelen. Of antipsychotica verschillen in hun potentieel om tardieve dyskinesie te veroorzaken, is niet bekend.
Aangenomen wordt dat het risico op het ontwikkelen van tardieve dyskinesie en de kans dat het onomkeerbaar wordt, toeneemt naarmate de duur van de behandeling en de totale cumulatieve dosis antipsychotica die aan de patiënt worden toegediend toenemen. Het syndroom kan zich echter ontwikkelen, hoewel veel minder vaak, na relatief korte behandelingsperioden met lage doses of kan zelfs optreden na stopzetting van de behandeling.
Tardieve dyskinesie kan geheel of gedeeltelijk verdwijnen als de behandeling met antipsychotica wordt stopgezet. Behandeling met antipsychotica kan echter zelf de tekenen en symptomen van het syndroom onderdrukken (of gedeeltelijk) en kan daardoor mogelijk het onderliggende proces maskeren. Het effect dat symptomatische onderdrukking heeft op het lange termijn beloop van het syndroom is onbekend.
Gezien deze overwegingen moet SEROQUEL 50 mg worden voorgeschreven op een manier die het optreden van tardieve dyskinesie zo klein mogelijk maakt. Chronische antipsychotische behandeling moet in het algemeen worden gereserveerd voor patiënten die lijken te lijden aan een chronische ziekte waarvan (1) bekend is dat ze reageren op antipsychotica, en (2) voor wie alternatieve, even effectieve, maar mogelijk minder schadelijke behandelingen niet beschikbaar of geschikt zijn. . Bij patiënten die wel een chronische behandeling nodig hebben, moet worden gestreefd naar de kleinste dosis en de kortste behandelingsduur die een bevredigende klinische respons oplevert. De noodzaak van voortzetting van de behandeling moet periodiek opnieuw worden beoordeeld.

Als er tekenen en symptomen van tardieve dyskinesie optreden bij een patiënt die SEROQUEL 200 mg gebruikt, moet worden overwogen om het gebruik van het geneesmiddel te staken. Sommige patiënten kunnen echter ondanks de aanwezigheid van het syndroom behandeling met SEROQUEL 200 mg nodig hebben.
Hypotensie
Quetiapine kan orthostatische hypotensie veroorzaken die gepaard gaat met duizeligheid, tachycardie en, bij sommige patiënten, syncope, vooral tijdens de initiële dosistitratieperiode, waarschijnlijk als gevolg van de α1-adrenerge antagonistische eigenschappen. Syncope werd gemeld bij 1% (28/3265) van de patiënten die met SEROQUEL werden behandeld, vergeleken met 0,2% (2/954) met placebo en ongeveer 0,4% (2/527) met actieve controlegeneesmiddelen. Orthostatische hypotensie, duizeligheid en syncope kunnen tot vallen leiden.
SEROQUEL 25 mg moet met bijzondere voorzichtigheid worden gebruikt bij patiënten met bekende cardiovasculaire aandoeningen (voorgeschiedenis van myocardinfarct of ischemische hartziekte, hartfalen of geleidingsstoornissen), cerebrovasculaire aandoeningen of aandoeningen die patiënten vatbaar maken voor hypotensie (dehydratie, hypovolemie en behandeling met antihypertensiva). Het risico op orthostatische hypotensie en syncope kan worden geminimaliseerd door de aanvangsdosis te beperken tot tweemaal daags 25 mg [zie DOSERING EN ADMINISTRATIE ]. Als hypotensie optreedt tijdens de titratie naar de doeldosis, is een terugkeer naar de vorige dosis in het titratieschema aangewezen.
Watervallen
Atypische antipsychotica, waaronder SEROQUEL, kunnen slaperigheid, orthostatische hypotensie, motorische en sensorische instabiliteit veroorzaken, wat kan leiden tot vallen en bijgevolg tot fracturen of ander letsel. Voor patiënten met ziekten, aandoeningen of medicijnen die deze effecten kunnen verergeren, volledige beoordeling van het valrisico bij het starten van een antipsychotische behandeling en herhaaldelijk voor patiënten die langdurige antipsychotische therapie ondergaan.
Verhogingen van de bloeddruk (kinderen en adolescenten)
In placebogecontroleerde onderzoeken bij kinderen en adolescenten met schizofrenie (duur van 6 weken) of bipolaire manie (duur van 3 weken) was de incidentie van verhogingen van de systolische bloeddruk (≥20 mmHg) op elk moment 15,2% (51/335 ) voor SEROQUEL 50 mg en 5,5% (9/163) voor placebo; de incidentie van verhogingen van de diastolische bloeddruk (≥10 mmHg) op enig moment was 40,6% (136/335) voor SEROQUEL en 24,5% (40/163) voor placebo. In het 26 weken durende open-label klinische onderzoek ondervond één kind met een gerapporteerde voorgeschiedenis van hypertensie een hypertensieve crisis. De bloeddruk bij kinderen en adolescenten moet aan het begin van en periodiek tijdens de behandeling worden gemeten.
In een placebogecontroleerd klinisch SEROQUEL XR-onderzoek (duur van 8 weken) bij kinderen en adolescenten (10-17 jaar) met bipolaire depressie, waarbij de werkzaamheid niet werd vastgesteld, werd de incidentie van verhogingen op enig moment van de systolische bloeddruk (≥ 20 mmHg) was 6,5% (6/92) voor SEROQUEL XR en 6,0% (6/100) voor placebo; de incidentie van verhogingen van de diastolische bloeddruk (≥10 mmHg) op enig moment was 46,7% (43/92) voor SEROQUEL 25 mg XR en 36,0% (36/100) voor placebo.
Leukopenie, neutropenie en agranulocytose
In klinische onderzoeken en postmarketingervaring zijn gevallen van leukopenie/neutropenie gemeld die tijdelijk gerelateerd waren aan atypische antipsychotica, waaronder SEROQUEL. Agranulocytose is gemeld.
Agranulocytose (gedefinieerd als absoluut aantal neutrofielen
Mogelijke risicofactoren voor leukopenie/neutropenie zijn onder meer een reeds bestaand laag aantal witte bloedcellen (WBC) en een voorgeschiedenis van door geneesmiddelen geïnduceerde leukopenie/neutropenie. Bij patiënten met een reeds bestaande lage WBC of een voorgeschiedenis van geneesmiddelgeïnduceerde leukopenie/neutropenie dient het volledige bloedbeeld (CBC) tijdens de eerste paar maanden van de behandeling regelmatig te worden gecontroleerd en dient de behandeling met SEROQUEL 50 mg te worden gestaakt bij het eerste teken van een afname van de WBC in afwezigheid van andere oorzakelijke factoren.
Patiënten met neutropenie moeten zorgvuldig worden gecontroleerd op koorts of andere symptomen of tekenen van infectie en onmiddellijk worden behandeld als dergelijke symptomen of tekenen optreden. Patiënten met ernstige neutropenie (absoluut aantal neutrofielen
Staar
De ontwikkeling van cataract werd waargenomen in verband met de behandeling met quetiapine in chronische onderzoeken bij honden [zie Niet-klinische toxicologie ]. Lensveranderingen zijn ook waargenomen bij volwassenen, kinderen en adolescenten tijdens langdurige behandeling met SEROQUEL 100 mg, maar een causaal verband met het gebruik van SEROQUEL 200 mg is niet vastgesteld. Niettemin kan de mogelijkheid van lenticulaire veranderingen op dit moment niet worden uitgesloten. Daarom wordt aanbevolen om de lens te onderzoeken met methoden die geschikt zijn om cataractvorming te detecteren, zoals spleetlamponderzoek of andere geschikte gevoelige methoden, bij het begin van de behandeling of kort daarna, en met tussenpozen van 6 maanden tijdens chronische behandeling.
QT-verlenging
In klinische onderzoeken werd quetiapine niet geassocieerd met een aanhoudende verlenging van de QT-intervallen. Het QT-effect werd echter niet systematisch geëvalueerd in een grondige QT-studie. Tijdens postmarketingervaring zijn er gevallen gemeld van QT-verlenging bij patiënten die een overdosis quetiapine hadden genomen [zie: OVERDOSERING ], bij patiënten met een bijkomende ziekte, en bij patiënten die geneesmiddelen gebruiken waarvan bekend is dat ze een verstoring van de elektrolytenbalans veroorzaken of het QT-interval verlengen [zie DRUG-INTERACTIES ].
Het gebruik van quetiapine moet worden vermeden in combinatie met andere geneesmiddelen waarvan bekend is dat ze het QTc verlengen, waaronder klasse 1A antiaritmica (bijv. kinidine, procaïnamide) of klasse III antiaritmica (bijv. amiodaron, sotalol), antipsychotica (bijv. ziprasidon, chloorpromazine, thioridazine), antibiotica (bijv. gatifloxacine, moxifloxacine), of een andere klasse van medicijnen waarvan bekend is dat ze het QTc-interval verlengen (bijv. pentamidine, levomethadylacetaat, methadon).
Quetiapine moet ook worden vermeden in omstandigheden die het risico op het optreden van torsades de pointes en/of plotselinge dood kunnen verhogen, waaronder (1) een voorgeschiedenis van hartritmestoornissen zoals bradycardie; (2) hypokaliëmie of hypomagnesiëmie; (3) gelijktijdig gebruik van andere geneesmiddelen die het QTc-interval verlengen; en (4) aanwezigheid van aangeboren verlenging van het QT-interval.
Voorzichtigheid is ook geboden wanneer quetiapine wordt voorgeschreven aan patiënten met een verhoogd risico op QT-verlenging (bijv. hart- en vaatziekten, familiegeschiedenis van QT-verlenging, ouderen, congestief hartfalen en harthypertrofie).
epileptische aanvallen
Tijdens klinische onderzoeken traden toevallen op bij 0,5% (20/3490) van de patiënten die met SEROQUEL werden behandeld, vergeleken met 0,2% (2/954) met placebo en 0,7% (4/527) met actieve controlemiddelen. Zoals met andere antipsychotica, dient SEROQUEL 25 mg met voorzichtigheid te worden gebruikt bij patiënten met een voorgeschiedenis van convulsies of met aandoeningen die de drempel voor convulsies kunnen verlagen, bijv. Alzheimer-dementie. Aandoeningen die de aanvalsdrempel verlagen, kunnen vaker voorkomen in een populatie van 65 jaar of ouder.
Hypothyreoïdie
volwassenen
Klinische onderzoeken met quetiapine hebben dosisgerelateerde verlagingen van de schildklierhormoonspiegels aangetoond. De verlaging van het totale en vrije thyroxine (T4) van ongeveer 20% aan de bovenkant van het therapeutische dosisbereik was maximaal in de eerste zes weken van de behandeling en hield aan zonder aanpassing of progressie tijdens meer chronische therapie. In bijna alle gevallen ging het staken van de behandeling met quetiapine gepaard met een omkering van de effecten op totaal en vrij T4, ongeacht de duur van de behandeling. Het mechanisme waardoor quetiapine de schildklier-as beïnvloedt, is onduidelijk. Als er een effect is op de hypothalamus-hypofyse-as, is het mogelijk dat meting van TSH alleen de schildklierstatus van een patiënt niet nauwkeurig weergeeft. Daarom moeten zowel TSH als vrij T4, naast klinische beoordeling, worden gemeten bij baseline en bij follow-up.
In de aanvullende manie-onderzoeken, waarbij SEROQUEL 50 mg werd toegevoegd aan lithium of divalproex, had 12% (24/196) van de met SEROQUEL 200 mg behandelde patiënten vergeleken met 7% (15/203) van de met placebo behandelde patiënten verhoogde TSH-spiegels. Van de met SEROQUEL 300 mg behandelde patiënten met verhoogde TSH-spiegels hadden er 3 gelijktijdig lage vrije T4-spiegels (vrij T4
Ongeveer 0,7% (26/3489) van de SEROQUEL-patiënten ervoer TSH-verhogingen in monotherapie-onderzoeken. Sommige patiënten met TSH-verhogingen hadden een vervangende schildklierbehandeling nodig.
In alle onderzoeken met quetiapine was de incidentie van verschuivingen in schildklierhormonen en TSH1: afname van vrij T4 (5mIE/L), 4,9% (956/19412). Bij acht patiënten, bij wie TBG werd gemeten, waren de TBG-waarden onveranderd.
Tabel 8 toont de incidentie van deze verschuivingen in kortdurende placebogecontroleerde klinische onderzoeken.
In kortdurende placebogecontroleerde monotherapiestudies was de incidentie van wederzijdse verschuivingen in T3 en TSH 0,0% voor zowel quetiapine (1/4800) als placebo (0/2190) en voor T4 en TSH waren de verschuivingen 0,1% (7 /6154) voor quetiapine versus 0,0% (1/3007) voor placebo.
Kinderen en adolescenten
In acute placebogecontroleerde onderzoeken bij kinderen en adolescenten met schizofrenie (duur van 6 weken) of bipolaire manie (duur van 3 weken), de incidentie van verschuivingen voor schildklierfunctiewaarden op elk moment voor met SEROQUEL 100 mg behandelde patiënten en met placebo behandelde patiënten voor verhoogde TSH was respectievelijk 2,9% (8/280) vs. 0,7% (1/138), en voor verlaagd totaal thyroxine was respectievelijk 2,8% (8/289) vs. 0% (0/145). Van de met SEROQUEL behandelde patiënten met verhoogde TSH-spiegels had 1 gelijktijdig laag vrij T4-gehalte aan het einde van de behandeling.
Hyperprolactinemie
volwassenen
Tijdens klinische onderzoeken met quetiapine trad de incidentie van verschuivingen in prolactinespiegels naar een klinisch significante waarde op bij 3,6% (158/4416) van de patiënten die met quetiapine werden behandeld, vergeleken met 2,6% (51/1968) met placebo.
Kinderen en adolescenten
In acute placebogecontroleerde onderzoeken bij kinderen en adolescenten met bipolaire manie (duur van 3 weken) of schizofrenie (duur van 6 weken) werd de incidentie van verschuivingen in prolactinespiegels naar een waarde (>20 g/L mannen; >26 μg) /L vrouwen op enig moment) was 13,4% (18/134) voor SEROQUEL vergeleken met 4% (3/75) voor placebo bij mannen en 8,7% (9/104) voor SEROQUEL 25 mg vergeleken met 0% (0/39) voor placebo bij vrouwen.
Net als andere geneesmiddelen die dopamine D2-receptoren antagoniseren, verhoogt SEROQUEL 300 mg de prolactinespiegels bij sommige patiënten en de verhoging kan aanhouden tijdens chronische toediening. Hyperprolactinemie, ongeacht de etiologie, kan hypothalamische GnRH onderdrukken, wat resulteert in verminderde hypofyse-gonadotrofinesecretie. Dit kan op zijn beurt de reproductieve functie remmen door de gonadale steroïdogenese bij zowel vrouwelijke als mannelijke patiënten te verminderen. Galactorroe, amenorroe, gynaecomastie en impotentie zijn gemeld bij patiënten die prolactineverhogende verbindingen kregen. Langdurige hyperprolactinemie in combinatie met hypogonadisme kan leiden tot verminderde botdichtheid bij zowel vrouwelijke als mannelijke proefpersonen.
Weefselkweekexperimenten geven aan dat ongeveer een derde van de menselijke borstkankers in vitro afhankelijk is van prolactine, een factor van potentieel belang als het voorschrijven van deze geneesmiddelen wordt overwogen bij een patiënt met eerder ontdekte borstkanker. Zoals gebruikelijk is bij verbindingen die de afgifte van prolactine verhogen, werd neoplasie van borstklieren en eilandjes van de pancreas (mammadenocarcinomen, hypofyse en pancreasadenomen) waargenomen in carcinogeniteitsonderzoeken bij muizen en ratten. Noch klinische studies noch epidemiologische studies die tot nu toe zijn uitgevoerd, hebben een verband aangetoond tussen chronische toediening van deze klasse geneesmiddelen en tumorigenese bij mensen, maar het beschikbare bewijs is te beperkt om overtuigend te zijn [zie Niet-klinische toxicologie ].
Potentieel voor cognitieve en motorische stoornissen
Slaperigheid was een vaak gemelde bijwerking die werd gemeld bij patiënten die met SEROQUEL werden behandeld, vooral tijdens de periode van 3-5 dagen van de initiële dosistitratie. In onderzoeken naar schizofrenie werd slaperigheid gemeld bij 18% (89/510) van de patiënten die SEROQUEL 200 mg kregen, vergeleken met 11% (22/06) van de placebopatiënten. In onderzoeken naar acute bipolaire manie waarbij SEROQUEL 200 mg als monotherapie werd gebruikt, werd slaperigheid gemeld bij 16% (34/209) van de patiënten die 300 mg SEROQUEL kregen vergeleken met 4% van de placebopatiënten. In onderzoeken naar acute bipolaire manie waarbij SEROQUEL als aanvullende therapie werd gebruikt, werd slaperigheid gemeld bij 34% (66/196) van de patiënten die SEROQUEL kregen, vergeleken met 9% (19/203) van de placebopatiënten. In onderzoeken naar bipolaire depressie werd slaperigheid gemeld bij 57% (398/698) van de patiënten die SEROQUEL 50 mg kregen, vergeleken met 15% (51/347) van de placebopatiënten. Aangezien SEROQUEL 25 mg het beoordelingsvermogen, het denken of de motorische vaardigheden kan aantasten, moeten patiënten worden gewaarschuwd voor het uitvoeren van activiteiten die mentale alertheid vereisen, zoals het besturen van een motorvoertuig (inclusief auto's) of het bedienen van gevaarlijke machines totdat ze redelijk zeker zijn dat de behandeling met SEROQUEL werkt. hen niet nadelig beïnvloeden. Slaperigheid kan leiden tot vallen.
Regeling lichaamstemperatuur
Hoewel niet gemeld met SEROQUEL 100 mg, wordt een verstoring van het vermogen van het lichaam om de kerntemperatuur van het lichaam te verlagen toegeschreven aan antipsychotica. Bij het voorschrijven van SEROQUEL 300 mg wordt passende zorg geadviseerd aan patiënten die aandoeningen zullen ervaren die kunnen bijdragen aan een verhoging van de lichaamstemperatuur, bijv. zware inspanning, blootstelling aan extreme hitte, gelijktijdig gebruik van medicatie met anticholinerge activiteit, of onderhevig zijn aan uitdroging.
Dysfagie
Slokdarmdysmotiliteit en aspiratie zijn in verband gebracht met het gebruik van antipsychotica. Aspiratiepneumonie is een veelvoorkomende oorzaak van morbiditeit en mortaliteit bij oudere patiënten, in het bijzonder bij patiënten met gevorderde Alzheimerdementie. SEROQUEL 100 mg en andere antipsychotica moeten met voorzichtigheid worden gebruikt bij patiënten met een risico op aspiratiepneumonie.
Stopzettingssyndroom
Acute ontwenningsverschijnselen, zoals slapeloosheid, misselijkheid en braken zijn beschreven na abrupte stopzetting van atypische antipsychotica, waaronder SEROQUEL. In kortdurende placebogecontroleerde klinische onderzoeken met monotherapie met SEROQUEL 25 mg XR die een stopzettingsfase omvatten die stopzettingssymptomen evalueerde, was de geaggregeerde incidentie van patiënten die een of meer stopzettingssymptomen ondervonden na abrupte stopzetting 12,1% (241/1993) voor SEROQUEL XR en 6,7% (71/1065) voor placebo. De incidentie van de individuele bijwerkingen (dwz slapeloosheid, misselijkheid, hoofdpijn, diarree, braken, duizeligheid en prikkelbaarheid) was in geen enkele behandelingsgroep hoger dan 5,3% en verdween gewoonlijk na 1 week na stopzetting. Geleidelijke afbouw wordt geadviseerd. [zien Gebruik bij specifieke populaties ]
Anticholinerge (antimuscarine) effecten
Norquetiapine, een actieve metaboliet van quetiapine, heeft een matige tot sterke affiniteit voor verschillende muscarinereceptorsubtypen. Dit draagt bij aan anticholinerge bijwerkingen wanneer SEROQUEL 25 mg wordt gebruikt in therapeutische doses, gelijktijdig wordt ingenomen met andere anticholinerge geneesmiddelen of bij overdosering. SEROQUEL moet met voorzichtigheid worden gebruikt bij patiënten die medicijnen krijgen met anticholinerge (antimuscarine) effecten (zie OVERDOSERING en KLINISCHE FARMACOLOGIE ].
Constipatie was een vaak gemelde bijwerking bij patiënten die werden behandeld met quetiapine en vormt een risicofactor voor darmobstructie. Intestinale obstructie is gemeld met quetiapine, waaronder gevallen met fatale afloop bij patiënten die gelijktijdig meerdere geneesmiddelen kregen die de darmmotiliteit verminderen.
SEROQUEL 300 mg moet met voorzichtigheid worden gebruikt bij patiënten met een huidige diagnose of een voorgeschiedenis van urineretentie, klinisch significante prostaathypertrofie, constipatie of verhoogde intraoculaire druk.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering (Medicatiegids) te lezen.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze zich voordoen tijdens het gebruik van SEROQUEL.
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose Patiënten en zorgverleners moeten erop worden gewezen dat oudere patiënten met aan dementie gerelateerde psychose die worden behandeld met atypische antipsychotica, een verhoogd risico op overlijden hebben in vergelijking met placebo. Quetiapine is niet goedgekeurd voor oudere patiënten met aan dementie gerelateerde psychose [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Suïcidale gedachten en gedrag
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten aan de voorschrijver of zorgverlener van de patiënt worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen van de patiënt. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op suïcidaal denken en gedrag en duiden op een noodzaak van zeer nauwgezette monitoring en mogelijk veranderingen in de medicatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Maligne neurolepticasyndroom (NMS)
Patiënten moeten worden geadviseerd om eventuele tekenen of symptomen die verband kunnen houden met MNS aan hun arts te melden. Deze kunnen spierstijfheid en hoge koorts omvatten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hyperglykemie en diabetes mellitus
Patiënten moeten zich bewust zijn van de symptomen van hyperglykemie (hoge bloedsuikerspiegel) en diabetes mellitus. Patiënten bij wie diabetes is vastgesteld, patiënten met risicofactoren voor diabetes of patiënten die deze symptomen ontwikkelen tijdens de behandeling, moeten aan het begin van en periodiek tijdens de behandeling hun bloedglucose laten controleren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hyperlipidemie
Patiënten moeten erop worden gewezen dat verhogingen van totaal cholesterol, LDL-cholesterol en triglyceriden en verlagingen van HDL-cholesterol kunnen optreden. Patiënten moeten hun lipidenprofiel aan het begin van en periodiek tijdens de behandeling laten controleren [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gewichtstoename
Patiënten moeten erop worden gewezen dat ze gewichtstoename kunnen ervaren. Patiënten moeten hun gewicht regelmatig laten controleren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Orthostatische hypotensie
Patiënten moeten worden geïnformeerd over het risico van orthostatische hypotensie (symptomen zijn onder meer duizeligheid of een licht gevoel in het hoofd bij het opstaan, wat kan leiden tot vallen), vooral tijdens de periode van initiële dosistitratie, en ook bij herstart van de behandeling of verhoging van de dosis [ zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Verhoogde bloeddruk bij kinderen en adolescenten
Bij kinderen en adolescente patiënten moet hun bloeddruk worden gemeten aan het begin van en periodiek tijdens de behandeling [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Leukopenie/neutropenie
Patiënten met een reeds bestaande lage WBC of een voorgeschiedenis van geneesmiddelgeïnduceerde leukopenie/neutropenie moet worden geadviseerd dat hun CBC moet worden gecontroleerd tijdens het gebruik van SEROQUEL. Patiënten moeten het advies krijgen om zo snel mogelijk met hun arts te praten als ze koorts, griepachtige symptomen, keelpijn of een andere infectie hebben, aangezien dit het gevolg kan zijn van een zeer lage WBC, waardoor SEROQUEL 100 mg mogelijk moet worden toegediend. gestopt en/of behandeling gegeven [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Interferentie met cognitieve en motorische prestaties
Patiënten moeten worden geïnformeerd over het risico van slaperigheid of sedatie (wat kan leiden tot vallen), vooral tijdens de periode van initiële dosistitratie. Patiënten moeten worden gewaarschuwd voor het uitvoeren van activiteiten waarvoor mentale alertheid vereist is, zoals het besturen van een motorvoertuig (inclusief auto's) of het bedienen van machines, totdat ze redelijk zeker zijn dat de behandeling met quetiapine geen nadelige gevolgen voor hen heeft [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Blootstelling aan hitte en uitdroging
Patiënten moeten worden geadviseerd over passende zorg om oververhitting en uitdroging te voorkomen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Net als bij andere medicijnen, moeten patiënten worden geadviseerd om hun arts op de hoogte te stellen als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken [zie DRUG-INTERACTIES ].
Zwangerschap
Adviseer zwangere vrouwen om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met SEROQUEL. Adviseer patiënten dat SEROQUEL extrapiramidale en/of ontwenningsverschijnselen (agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis) kan veroorzaken bij een pasgeborene. Adviseer patiënten dat er een zwangerschapsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan SEROQUEL 25 mg zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Onvruchtbaarheid
Adviseer vrouwen met reproductief vermogen dat SEROQUEL de vruchtbaarheid kan verminderen als gevolg van een verhoging van de serumprolactinespiegels. De effecten op de vruchtbaarheid zijn omkeerbaar [zie Gebruik bij specifieke populaties ].
Behoefte aan een uitgebreid behandelprogramma
SEROQUEL is geïndiceerd als een integraal onderdeel van een totaal behandelingsprogramma voor adolescenten met schizofrenie en pediatrische bipolaire stoornis dat andere maatregelen kan omvatten (psychologische, educatieve en sociale). De werkzaamheid en veiligheid van SEROQUEL 100 mg zijn niet vastgesteld bij pediatrische patiënten jonger dan 13 jaar voor schizofrenie of jonger dan 10 jaar voor bipolaire manie. Passende onderwijsplaatsing is essentieel en psychosociale interventie is vaak nuttig. De beslissing om atypische antipsychotica voor te schrijven hangt af van de beoordeling door de arts van de chroniciteit en ernst van de symptomen van de patiënt [zie INDICATIES ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Carcinogeniteitsonderzoeken werden uitgevoerd bij C57BL-muizen en Wistar-ratten. Quetiapine werd via de voeding toegediend aan muizen in doses van 20, 75, 250 en 750 mg/kg en aan ratten via sondevoeding in doses van 25, 75 en 250 mg/kg gedurende twee jaar. Deze doses zijn gelijk aan 0,1, 0,5, 1,5 en 4,5 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak (muizen) of 0,3, 1 en 3 maal de MRHD op basis van mg/m2 lichaamsoppervlak (ratten). Er waren statistisch significante verhogingen van folliculaire adenomen van de schildklier bij mannelijke muizen bij doses van 1,5 en 4,5 maal de MRHD op basis van mg/m2 lichaamsoppervlak en bij mannelijke ratten bij een dosis van 3 maal de MRHD op mg/m2 lichaamsoppervlak. Borstklieradenocarcinomen waren statistisch significant verhoogd bij vrouwelijke ratten bij alle geteste doses (0,3, 1 en 3 keer de MRHD op basis van mg/m2 lichaamsoppervlak).
Adenomen van folliculaire schildkliercellen kunnen het gevolg zijn van chronische stimulatie van de schildklier door thyroïdstimulerend hormoon (TSH) als gevolg van een verhoogd metabolisme en een verhoogde klaring van thyroxine door de lever van knaagdieren. Veranderingen in TSH-, thyroxine- en thyroxineklaring consistent met dit mechanisme werden waargenomen in subchronische toxiciteitsonderzoeken bij ratten en muizen en in een 1-jarig toxiciteitsonderzoek bij ratten; de resultaten van deze onderzoeken waren echter niet definitief. De relevantie van de toename van adenomen van folliculaire schildkliercellen voor het risico bij de mens, door welk mechanisme dan ook, is niet bekend.
Van antipsychotica is aangetoond dat ze de prolactinespiegels bij knaagdieren chronisch verhogen. Serummetingen in een 1-jarig toxiciteitsonderzoek toonden aan dat quetiapine de mediane serumprolactinespiegels met respectievelijk een maximum van 32- en 13-voudig verhoogde bij mannelijke en vrouwelijke ratten. Na chronische toediening van andere antipsychotica is bij knaagdieren een toename van mammaire neoplasmata gevonden en deze worden geacht prolactine-gemedieerd te zijn. De relevantie van deze verhoogde incidentie van prolactine-gemedieerde borstkliertumoren bij ratten voor het risico bij de mens is niet bekend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Mutagenese
Quetiapine was niet mutageen of clastogeen in standaard genotoxiciteitstesten. Het mutagene potentieel van quetiapine werd getest in de in vitro Ames-test op bacteriële genmutatie en in de in vitro-test op genmutatie bij zoogdieren in ovariumcellen van Chinese hamsters. Het clastogene potentieel van quetiapine werd getest in de in vitro chromosomale aberratietest in gekweekte menselijke lymfocyten en in de in vivo beenmergmicronucleustest bij ratten tot 500 mg/kg, wat 6 keer de maximaal aanbevolen humane dosis is op basis van mg/m2. lichaamsoppervlak.
Aantasting van de vruchtbaarheid
Quetiapine verminderde de paring en vruchtbaarheid bij mannelijke Sprague-Dawley-ratten bij orale doses van 50 en 150 mg/kg of ongeveer 1 en 3 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak. Geneesmiddelgerelateerde effecten omvatten een toename van het interval om te paren en van het aantal paringen dat nodig is voor succesvolle impregnatie. Deze effecten werden nog steeds waargenomen bij 3 keer de MRHD, zelfs na een periode van twee weken zonder behandeling. De dosis zonder effect voor verminderde paring en vruchtbaarheid bij mannelijke ratten was 25 mg/kg, of 0,3 maal de MRHD-dosis op basis van mg/m2 lichaamsoppervlak. Quetiapine had een negatief effect op de paring en vruchtbaarheid bij vrouwelijke Sprague-Dawley-ratten bij een orale dosis van ongeveer 1 maal de MRHD van 800 mg/dag, gebaseerd op mg/m2 lichaamsoppervlak. Geneesmiddelgerelateerde effecten waren onder meer een afname van het aantal paringen en paringen resulterend in zwangerschap, en een toename van het interval om te paren. Een toename van onregelmatige oestruscycli werd waargenomen bij doses van 10 en 50 mg/kg, of ongeveer 0,1 en 1 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak. De dosis zonder effect bij vrouwelijke ratten was 1 mg/kg, of 0,01 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een zwangerschapsblootstellingsregister dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap zijn blootgesteld aan atypische antipsychotica, waaronder SEROQUEL 50 mg. Zorgverleners worden aangemoedigd om patiënten te registreren door contact op te nemen met de National Pregnancy Registry for Atypical Antipsychotics op 1-866-961-2388 of online op http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Risico Samenvatting
Pasgeborenen die tijdens het derde trimester aan antipsychotica (inclusief SEROQUEL) zijn blootgesteld, lopen risico op extrapiramidale en/of ontwenningsverschijnselen na de bevalling (zie Klinische overwegingen ). Over het geheel genomen beschikbare gegevens van gepubliceerde epidemiologische onderzoeken van zwangere vrouwen die zijn blootgesteld aan quetiapine hebben geen geneesmiddel-geassocieerd risico op ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten aangetoond (zie Gegevens ). Er zijn risico's voor de moeder verbonden aan onbehandelde schizofrenie, bipolaire I of depressieve stoornis, en met blootstelling aan antipsychotica, waaronder SEROQUEL 200 mg, tijdens de zwangerschap (zie Klinische overwegingen ).
In dierstudies trad embryo-foetale toxiciteit op, waaronder vertragingen in de botvorming van het skelet bij ongeveer 1 en 2 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 800 mg/dag bij zowel ratten als konijnen, en een verhoogde incidentie van carpale/tarsale buiging (lichte anomalie van zacht weefsel) bij konijnenfoetussen met ongeveer 2 keer de MRHD. Bovendien was het foetale gewicht bij beide soorten afgenomen. Maternale toxiciteit (waargenomen als verminderd lichaamsgewicht en/of sterfte) trad op bij 2 keer de MRHD bij ratten en ongeveer 1-2 keer de MRHD bij konijnen.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of foetale risico
Er is een risico voor de moeder door onbehandelde schizofrenie of bipolaire I-stoornis, waaronder een verhoogd risico op terugval, ziekenhuisopname en zelfmoord. Schizofrenie en bipolaire I-stoornis zijn geassocieerd met verhoogde ongunstige perinatale uitkomsten, waaronder vroeggeboorte. Het is niet bekend of dit een direct gevolg is van de ziekte of andere comorbide factoren.
Een prospectief, longitudinaal onderzoek volgde 201 zwangere vrouwen met een voorgeschiedenis van depressieve stoornis die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten. De vrouwen die tijdens de zwangerschap stopten met antidepressiva, hadden meer kans op een terugval van een ernstige depressie dan vrouwen die doorgingen met antidepressiva. Overweeg het risico op onbehandelde depressie bij het stopzetten of wijzigen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Foetale/neonatale bijwerkingen
Extrapiramidale en/of ontwenningsverschijnselen, waaronder agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsstoornis zijn gemeld bij pasgeborenen die tijdens het derde trimester van de zwangerschap werden blootgesteld aan antipsychotica, waaronder SEROQUEL 50 mg. Deze symptomen varieerden in ernst. Controleer pasgeborenen op extrapiramidale en/of ontwenningsverschijnselen en behandel de symptomen op de juiste manier. Sommige pasgeborenen herstelden binnen enkele uren of dagen zonder specifieke behandeling; anderen vereisten langdurige ziekenhuisopname.
Gegevens
Menselijke gegevens
Gepubliceerde gegevens uit observationele studies, geboorteregisters en casusrapporten over het gebruik van atypische antipsychotica tijdens de zwangerschap melden geen duidelijk verband met antipsychotica en ernstige geboorteafwijkingen. Een retrospectief cohortonderzoek uit een Medicaid-database van 9258 vrouwen die tijdens de zwangerschap aan antipsychotica werden blootgesteld, wees niet op een algeheel verhoogd risico op ernstige geboorteafwijkingen.
Dierlijke gegevens
Wanneer zwangere ratten en konijnen werden blootgesteld aan quetiapine tijdens de organogenese, was er geen teratogeen effect bij foetussen. Doses waren 25, 50 en 200 mg/kg bij ratten en 25, 50 en 100 mg/kg bij konijnen, wat ongeveer 0,3, 0,6 en 2 keer (ratten) en 0,6, 1 en 2 keer (konijnen) de MRHD is voor schizofrenie van 800 mg/dag op basis van mg/m2 lichaamsoppervlak. Er waren echter aanwijzingen voor embryo-foetale toxiciteit, waaronder vertragingen in de botvorming van het skelet bij ongeveer 1 en 2 keer de MRHD van 800 mg/dag bij zowel ratten als konijnen, en een verhoogde incidentie van carpale/tarsale buiging (kleine wekedelenafwijking) bij konijnenfoetussen bij ongeveer 2 keer de MRHD. Bovendien was het foetale gewicht bij beide soorten afgenomen. Maternale toxiciteit (waargenomen als verminderd lichaamsgewicht en/of sterfte) trad op bij 2 keer de MRHD bij ratten en ongeveer 1-2 keer de MRHD (alle geteste doses) bij konijnen.
In een peri/postnataal reproductieonderzoek bij ratten werden geen geneesmiddelgerelateerde effecten waargenomen wanneer drachtige moederdieren werden behandeld met quetiapine in doses van 0,01, 0,1 en 0,2 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak. In een voorlopig peri-/postnataal onderzoek waren er echter toenames in foetale en pupsterfte en afnames in het gemiddelde nestgewicht bij 3 keer de MRHD.
Borstvoeding
Risico Samenvatting
Beperkte gegevens uit gepubliceerde literatuur melden de aanwezigheid van quetiapine in moedermelk bij een relatieve zuigelingendosering van
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
vrouwen
Op basis van de farmacologische werking van quetiapine (D2-antagonisme), kan behandeling met SEROQUEL resulteren in een verhoging van de serumprolactinespiegels, wat kan leiden tot een omkeerbare vermindering van de vruchtbaarheid bij vrouwen met reproductief vermogen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pediatrisch gebruik
Over het algemeen waren de bijwerkingen die tijdens de klinische onderzoeken bij kinderen en adolescenten werden waargenomen vergelijkbaar met die bij de volwassen populatie, op enkele uitzonderingen na. Verhogingen van de systolische en diastolische bloeddruk kwamen voor bij kinderen en adolescenten en kwamen niet voor bij volwassenen. Orthostatische hypotensie kwam vaker voor bij volwassenen (4-7%) dan bij kinderen en adolescenten ( WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Schizofrenie
De werkzaamheid en veiligheid van SEROQUEL 50 mg bij de behandeling van schizofrenie bij adolescenten van 13-17 jaar werden aangetoond in een dubbelblind, placebogecontroleerd onderzoek van 6 weken [zie INDICATIES , DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ].
De veiligheid en werkzaamheid van SEROQUEL 300 mg bij pediatrische patiënten jonger dan 13 jaar met schizofrenie zijn niet vastgesteld.
Onderhoud
De veiligheid en werkzaamheid van SEROQUEL bij de onderhoudsbehandeling van bipolaire stoornis is niet vastgesteld bij pediatrische patiënten jonger dan 18 jaar. De veiligheid en werkzaamheid van SEROQUEL bij de onderhoudsbehandeling van schizofrenie is bij geen enkele patiëntenpopulatie vastgesteld, ook niet bij pediatrische patiënten.
Bipolaire manie
De werkzaamheid en veiligheid van SEROQUEL bij de behandeling van manie bij kinderen en adolescenten van 10-17 jaar met bipolaire I-stoornis werd aangetoond in een 3 weken durende, dubbelblinde, placebogecontroleerde, multicenter studie [zie INDICATIES , DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en Klinische studies ]. De veiligheid en werkzaamheid van SEROQUEL bij pediatrische patiënten jonger dan 10 jaar met bipolaire manie zijn niet vastgesteld.
Bipolaire depressie
De veiligheid en werkzaamheid van SEROQUEL 300 mg bij pediatrische patiënten jonger dan 18 jaar met bipolaire depressie zijn niet vastgesteld. Er is een klinische studie met SEROQUEL XR uitgevoerd bij kinderen en adolescenten (10-17 jaar) met bipolaire depressie, de werkzaamheid is niet vastgesteld.
Er werden enkele verschillen in de farmacokinetiek van quetiapine opgemerkt tussen kinderen/adolescenten (10-17 jaar) en volwassenen. Na correctie voor gewicht waren de AUC en Cmax van quetiapine respectievelijk 41% en 39% lager bij kinderen en adolescenten in vergelijking met volwassenen. De farmacokinetiek van de actieve metaboliet, norquetiapine, was vergelijkbaar tussen kinderen/adolescenten en volwassenen na correctie voor gewicht [zie KLINISCHE FARMACOLOGIE ].
Geriatrisch gebruik
Van de ongeveer 3700 patiënten in klinische onderzoeken met SEROQUEL 300 mg was 7% (232) 65 jaar of ouder. Over het algemeen waren er geen aanwijzingen voor een andere verdraagbaarheid van SEROQUEL bij ouderen dan bij jongere volwassenen. Desalniettemin zou de aanwezigheid van factoren die de farmacokinetische klaring kunnen verminderen, de farmacodynamische respons op SEROQUEL 200 mg kunnen verhogen of een slechtere tolerantie of orthostase veroorzaken, ertoe moeten leiden dat een lagere startdosis, langzamere titratie en zorgvuldige monitoring tijdens de initiële doseringsperiode in de ouderen. De gemiddelde plasmaklaring van SEROQUEL 25 mg was bij oudere patiënten met 30% tot 50% verminderd in vergelijking met jongere patiënten [zie: KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ].
Nierfunctiestoornis
Klinische ervaring met SEROQUEL bij patiënten met nierinsufficiëntie is beperkt [zie KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Aangezien quetiapine uitgebreid wordt gemetaboliseerd door de lever, worden hogere plasmaspiegels verwacht bij patiënten met leverinsufficiëntie. Bij deze populatie wordt een lage startdosis van 25 mg/dag aanbevolen en de dosis kan worden verhoogd in stappen van 25 mg/dag-50 mg/dag [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Menselijke ervaring
In klinische onderzoeken is overleving gemeld bij acute overdoses tot 30 gram quetiapine. De meeste patiënten die een overdosis hadden genomen, ondervonden geen bijwerkingen of herstelden volledig van de gemelde voorvallen. In een klinische studie is overlijden gemeld na een overdosis van 13,6 gram quetiapine alleen. Over het algemeen waren de gemelde tekenen en symptomen die als gevolg van een overdrijving van de bekende farmacologische effecten van het geneesmiddel, dwz slaperigheid, sedatie, tachycardie, hypotensie en anticholinerge toxiciteit, waaronder coma en delirium. Patiënten met reeds bestaande ernstige hart- en vaatziekten kunnen een verhoogd risico lopen op de effecten van een overdosis [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Eén geval, waarbij sprake was van een geschatte overdosis van 9600 mg, werd in verband gebracht met hypokaliëmie en eerstegraads hartblok. Tijdens postmarketingervaring zijn er gevallen gemeld van QT-verlenging bij overdosering.
Beheer van overdosering
Breng een luchtweg tot stand en onderhoud deze en zorg voor voldoende zuurstofvoorziening en ventilatie. Cardiovasculaire monitoring moet onmiddellijk beginnen en moet continue elektrocardiografische monitoring omvatten om mogelijke aritmieën te detecteren.
Passende ondersteunende maatregelen zijn de steunpilaar van het management. Neem voor de meest actuele informatie over de behandeling van overdosering met Seroquel XR contact op met een gecertificeerd regionaal antigifcentrum (1-800-222-1222).
CONTRA-INDICATIES
Overgevoeligheid voor quetiapine of voor een van de hulpstoffen in de SEROQUEL XR-formulering. Anafylactische reacties zijn gemeld bij patiënten die werden behandeld met SEROQUEL XR.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van quetiapine bij de vermelde indicaties is onduidelijk. De werkzaamheid van quetiapine bij deze indicaties zou echter gemedieerd kunnen worden door een combinatie van dopamine type 2 (D2) en serotonine type 2 (5HT2) antagonisme. De actieve metaboliet, N-desalkylquetiapine (norquetiapine), heeft een vergelijkbare activiteit op D2, maar een grotere activiteit op 5HT2A-receptoren dan het oorspronkelijke geneesmiddel (quetiapine).
farmacodynamiek
Quetiapine en zijn metaboliet, norquetiapine, hebben affiniteit voor meerdere neurotransmitterreceptoren met norquetiapinebinding met een hogere affiniteit dan quetiapine in het algemeen. De Ki-waarden voor quetiapine en norquetiapine bij de dopamine D1 zijn 428/99,8 nM, bij D2 626/489 nM, bij serotonine 5HT1A 1040/191 nM bij 5HT2A 38/2,9 nM, bij histamine H1 4,4/1,1 nM, bij muscarine M1 1086/ 38,3 nM, en bij adrenerge 1b 14,6/46,4 nM en, bij α2-receptoren 617/1290 nM, respectievelijk. Quetiapine en norquetiapine hebben geen merkbare affiniteit voor de benzodiazepinereceptoren.
Effect op QT-interval
In klinische onderzoeken werd quetiapine niet geassocieerd met een aanhoudende verlenging van de QT-intervallen. Het QT-effect werd echter niet systematisch geëvalueerd in een grondige QT-studie. Tijdens postmarketingervaring zijn er gevallen gemeld van QT-verlenging bij patiënten die een overdosis quetiapine hadden genomen [zie: OVERDOSERING ], bij patiënten met een bijkomende ziekte en bij patiënten die geneesmiddelen gebruiken waarvan bekend is dat ze een verstoring van de elektrolytenbalans veroorzaken of het QT-interval verlengen.
Farmacokinetiek
volwassenen
De activiteit van quetiapinefumaraat is voornamelijk te wijten aan het oorspronkelijke geneesmiddel. De farmacokinetiek van meervoudige doses van quetiapine is dosisproportioneel binnen het voorgestelde klinische dosisbereik, en accumulatie van quetiapine is voorspelbaar na meervoudige dosering. Eliminatie van quetiapine vindt voornamelijk plaats via levermetabolisme met een gemiddelde terminale halfwaardetijd van ongeveer 6 uur binnen het voorgestelde klinische dosisbereik. Steady-state concentraties zullen naar verwachting binnen twee dagen na toediening worden bereikt. Het is onwaarschijnlijk dat quetiapine interfereert met het metabolisme van geneesmiddelen die worden gemetaboliseerd door cytochroom P450-enzymen.
Kinderen en adolescenten
Bij steady state was de farmacokinetiek van de moederverbinding bij kinderen en adolescenten (10-17 jaar) vergelijkbaar met die bij volwassenen. Bij correctie voor dosis en gewicht waren de AUC en Cmax van de moederverbinding echter respectievelijk 41% en 39% lager bij kinderen en adolescenten dan bij volwassenen. Voor de actieve metaboliet norquetiapine waren de AUC en Cmax respectievelijk 45% en 31% hoger bij kinderen en adolescenten dan bij volwassenen. Na aanpassing voor dosis en gewicht was de farmacokinetiek van de metaboliet norquetiapine vergelijkbaar tussen kinderen en adolescenten en volwassenen [zie Gebruik bij specifieke populaties ].
Absorptie
Quetiapinefumaraat wordt snel geabsorbeerd na orale toediening en bereikt de piekplasmaconcentraties in 1,5 uur. De tabletformulering is 100% biologisch beschikbaar ten opzichte van de oplossing. De biologische beschikbaarheid van quetiapine wordt marginaal beïnvloed door toediening met voedsel, waarbij de Cmax- en AUC-waarden met respectievelijk 25% en 15% worden verhoogd.
Verdeling
Quetiapine wordt wijd verspreid door het lichaam met een schijnbaar distributievolume van 10±4 l/kg. Het is voor 83% gebonden aan plasma-eiwitten bij therapeutische concentraties. In vitro had quetiapine geen invloed op de binding van warfarine of diazepam aan humaan serumalbumine. Op hun beurt veranderde noch warfarine noch diazepam de binding van quetiapine.
Metabolisme en eliminatie
Na een enkelvoudige orale dosis 14C-quetiapine werd minder dan 1% van de toegediende dosis als onveranderd geneesmiddel uitgescheiden, wat aangeeft dat quetiapine in hoge mate wordt gemetaboliseerd. Ongeveer 73% en 20% van de dosis werd teruggevonden in respectievelijk de urine en de feces.
Quetiapine wordt uitgebreid gemetaboliseerd door de lever. De belangrijkste metabole routes zijn sulfoxidatie tot de sulfoxidemetaboliet en oxidatie tot de oorspronkelijke zuurmetaboliet; beide metabolieten zijn farmacologisch inactief. In vitro-onderzoeken met humane levermicrosomen hebben aangetoond dat het cytochroom P450 3A4-iso-enzym betrokken is bij het metabolisme van quetiapine tot zijn belangrijkste, maar inactieve, sulfoxidemetaboliet en bij het metabolisme van zijn actieve metaboliet N-desalkylquetiapine.
Leeftijd
De orale klaring van quetiapine was met 40% verminderd bij oudere patiënten (≥ 65 jaar, n=9) in vergelijking met jonge patiënten (n=12) en aanpassing van de dosering kan nodig zijn [zie DOSERING EN ADMINISTRATIE ].
Geslacht
Er is geen geslachtseffect op de farmacokinetiek van quetiapine.
Ras
Er is geen race-effect op de farmacokinetiek van quetiapine.
Roken
Roken heeft geen effect op de orale klaring van quetiapine.
Nierinsufficiëntie
Patiënten met een ernstige nierfunctiestoornis (Clcr=10-30 ml/min/1,73 m2, n=8) hadden een 25% lagere gemiddelde orale klaring dan normale proefpersonen (Clcr > 80 ml/min/1,73 m2, n=8), maar de plasmaconcentraties van quetiapine bij proefpersonen met nierinsufficiëntie lagen binnen het concentratiebereik dat wordt waargenomen bij normale proefpersonen die dezelfde dosis kregen. Aanpassing van de dosering is daarom bij deze patiënten niet nodig [zie: Gebruik bij specifieke populaties ].
Leverinsufficiëntie
Patiënten met een leverfunctiestoornis (n=8) hadden een 30% lagere gemiddelde orale klaring van quetiapine dan normale proefpersonen. Bij twee van de 8 patiënten met leverinsufficiëntie waren de AUC en Cmax 3 keer hoger dan de waarden die doorgaans bij gezonde proefpersonen werden waargenomen. Aangezien quetiapine uitgebreid wordt gemetaboliseerd door de lever, worden hogere plasmaspiegels verwacht bij de populatie met leverinsufficiëntie en kan een aanpassing van de dosering nodig zijn [zie DOSERING EN ADMINISTRATIE en GEBRUIK BIJ SPECIFIEKE POPULATIES ].
Onderzoek naar interactie tussen geneesmiddelen
De in vivo beoordelingen van het effect van andere geneesmiddelen op de farmacokinetiek van quetiapine zijn samengevat in Tabel 17 [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
In vitro enzymremmingsgegevens suggereren dat quetiapine en 9 van zijn metabolieten weinig remmend effect zouden hebben op het in vivo metabolisme dat wordt gemedieerd door cytochromen CYP 1A2, 2C9, 2C19, 2D6 en 3A4. Quetiapine in doses van 750 mg/dag had geen invloed op de farmacokinetiek van een enkele dosis van antipyrine, lithium of lorazepam (Tabel 18) [zie DRUG-INTERACTIES ].
Dierlijke toxicologie en/of farmacologie
Quetiapine veroorzaakte een dosisgerelateerde toename van pigmentafzetting in de schildklier in toxiciteitsstudies bij ratten die 4 weken of langer duurden en in een 2 jaar durende carcinogeniteitsstudie bij muizen. Doses waren 10, 25, 50, 75, 150 en 250 mg/kg in onderzoeken bij ratten, wat ongeveer 0,1, 0,3, 0,6, 1, 2 en 3 keer de MRHD van 800 mg/dag is, gebaseerd op mg/m2 lichaamsoppervlak. , respectievelijk. Doses in het carcinogeniteitsonderzoek bij muizen waren 20, 75, 250 en 750 mg/kg, wat ongeveer 0,1, 0,5, 1,5 en 4,5 keer de MRHD van 800 mg/dag is, gebaseerd op mg/m2 lichaamsoppervlak. Pigmentafzetting bleek onomkeerbaar bij ratten. De identiteit van het pigment kon niet worden vastgesteld, maar bleek samen met quetiapine te zijn gelokaliseerd in folliculaire epitheelcellen van de schildklier. De functionele effecten en de relevantie van deze bevinding voor het risico voor de mens zijn niet bekend.
Bij honden die quetiapine kregen gedurende 6 of 12 maanden, maar niet gedurende 1 maand, trad focale driehoekige cataracten op op de kruising van posterieure hechtingen in de buitenste cortex van de lens in een dosis van 100 mg/kg, of 4 maal de MRHD van 800 mg/dag op basis van mg/m2 lichaamsoppervlak. Deze bevinding kan te wijten zijn aan remming van de biosynthese van cholesterol door quetiapine. Quetiapine veroorzaakte een dosisgerelateerde verlaging van de plasmacholesterolspiegels in onderzoeken met herhaalde doses bij honden en apen; er was echter geen correlatie tussen plasmacholesterol en de aanwezigheid van cataracten bij individuele honden. Het verschijnen van delta-8cholestanol in plasma komt overeen met remming van een laat stadium in de biosynthese van cholesterol bij deze soorten. In een speciaal onderzoek bij met quetiapine behandelde vrouwelijke honden werd ook een verlaging van 25% van het cholesterolgehalte van de buitenste cortex van de lens waargenomen. Geneesmiddelgerelateerde cataracten zijn bij geen enkele andere soort waargenomen; in een 1 jaar durende studie bij apen werd echter een gestreept uiterlijk van het voorste lensoppervlak gedetecteerd bij 2/7 vrouwtjes bij een dosis van 225 mg/kg of 5,5 keer de MRHD van 800 mg/dag op basis van mg/m2 lichaam oppervlakte.
Klinische studies
Schizofrenie
Proeven op korte termijn-volwassenen
De werkzaamheid van SEROQUEL 50 mg bij de behandeling van schizofrenie werd vastgesteld in 3 kortdurende (6 weken) gecontroleerde onderzoeken met opgenomen patiënten met schizofrenie die voldeden aan de DSM III-R-criteria voor schizofrenie. Hoewel een enkele haloperidol-arm met een enkele vaste dosis werd opgenomen als vergelijkende behandeling in een van de drie onderzoeken, was deze groep met een enkele haloperidol-dosis ontoereikend om een betrouwbare en valide vergelijking te maken tussen SEROQUEL 200 mg en haloperidol.
In deze onderzoeken werden verschillende instrumenten gebruikt voor het beoordelen van psychiatrische tekenen en symptomen, waaronder de Brief Psychiatric Rating Scale (BPRS), een multi-iteminventarisatie van algemene psychopathologie die traditioneel wordt gebruikt om de effecten van medicamenteuze behandeling bij schizofrenie te evalueren. Het BPRS-psychosecluster (conceptuele desorganisatie, hallucinerend gedrag, achterdocht en ongebruikelijke gedachteninhoud) wordt als een bijzonder nuttige subgroep beschouwd voor het beoordelen van actief psychotische schizofrene patiënten. Een tweede traditionele beoordeling, de Clinical Global Impression (CGI), weerspiegelt de indruk van een ervaren waarnemer, volledig bekend met de manifestaties van schizofrenie, over de algehele klinische toestand van de patiënt.
De resultaten van de proeven volgen:
De primaire werkzaamheidsresultaten van deze drie onderzoeken naar de behandeling van schizofrenie bij volwassenen worden weergegeven in Tabel 19.
Onderzoek van subgroepen van de populatie (ras, geslacht en leeftijd) bracht geen differentiële respons op basis van ras of geslacht aan het licht, met een schijnbaar groter effect bij patiënten jonger dan 40 jaar in vergelijking met patiënten ouder dan 40 jaar. deze bevinding is niet bekend.
Adolescenten (leeftijd 13-17)
De werkzaamheid van SEROQUEL 300 mg bij de behandeling van schizofrenie bij adolescenten (13-17 jaar) werd aangetoond in een 6 weken durende, dubbelblinde, placebogecontroleerde studie (onderzoek 4). Patiënten die voldeden aan de diagnostische criteria van de DSM-IV voor schizofrenie werden gerandomiseerd in een van de drie behandelingsgroepen: SEROQUEL 400 mg/dag (n=73), SEROQUEL 800 mg/dag (n=74) of placebo (n=75). De studiemedicatie werd gestart met 50 mg/dag en op dag 2 verhoogd tot 100 mg/dag (verdeeld en twee- of driemaal per dag gegeven). Vervolgens werd de dosis getitreerd tot de streefdosis van 400 mg/dag of 800 mg/dag in stappen van 100 mg/dag, verdeeld en twee- of driemaal per dag gegeven. De primaire werkzaamheidsvariabele was de gemiddelde verandering ten opzichte van baseline in de totale positieve en negatieve syndroomschaal (PANSS).
SEROQUEL bij 400 mg/dag en 800 mg/dag was superieur aan placebo in de verlaging van de totale PANSS-score. De primaire werkzaamheidsresultaten van dit onderzoek bij de behandeling van schizofrenie bij adolescenten worden weergegeven in Tabel 19.
Bipolaire stoornis
Bipolaire I-stoornis, manische of gemengde afleveringen
volwassenen
De werkzaamheid van SEROQUEL bij de acute behandeling van manische episodes werd vastgesteld in 3 placebogecontroleerde onderzoeken bij patiënten die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis met manische episodes. Deze onderzoeken omvatten patiënten met of zonder psychotische kenmerken en sloten patiënten met snelle cycli en gemengde episodes uit. Van deze onderzoeken waren er 2 als monotherapie (12 weken) en 1 als aanvullende therapie (3 weken) bij lithium of divalproex. De belangrijkste uitkomsten in deze onderzoeken waren verandering ten opzichte van baseline in de Young Mania Rating Scale (YMRS)-score na 3 en 12 weken voor monotherapie en na 3 weken voor aanvullende therapie. Adjuvante therapie wordt gedefinieerd als de gelijktijdige start of daaropvolgende toediening van SEROQUEL 100 mg met lithium of divalproex.
Het primaire beoordelingsinstrument dat werd gebruikt voor het beoordelen van manische symptomen in deze onderzoeken was YMRS, een door clinici beoordeelde schaal met 11 items die traditioneel wordt gebruikt om de mate van manische symptomen (prikkelbaarheid, storend/agressief gedrag, slaap, verhoogde stemming, spraak, verhoogde activiteit, seksuele interesse, taal-/denkstoornis, gedachte-inhoud, uiterlijk en inzicht) in een bereik van 0 (geen manische kenmerken) tot 60 (maximale score).
De resultaten van de proeven volgen:
Monotherapie
De werkzaamheid van SEROQUEL bij de acute behandeling van bipolaire manie werd vastgesteld in 2 placebogecontroleerde onderzoeken. In twee onderzoeken van 12 weken (n=300, n=299) waarin SEROQUEL werd vergeleken met placebo, was SEROQUEL 300 mg superieur aan placebo wat betreft de verlaging van de YMRS-totaalscore in week 3 en 12. De meerderheid van de patiënten in deze onderzoeken die SEROQUEL 100 mg gebruikten werden gedoseerd tussen 400 mg/dag en 800 mg per dag (onderzoeken 1 en 2 in tabel 20).
Aanvullende therapie
In deze 3 weken durende placebogecontroleerde studie werden 170 patiënten met bipolaire manie (YMRS ≥20) gerandomiseerd om SEROQUEL 100 mg of placebo te krijgen als aanvullende behandeling bij lithium of divalproex. Patiënten kunnen al dan niet een adequate behandelingskuur met lithium of divalproex hebben gekregen voorafgaand aan randomisatie. SEROQUEL 50 mg was superieur aan placebo wanneer het werd toegevoegd aan alleen lithium of divalproex in de verlaging van de totale YMRS-score (onderzoek 3 in tabel 20).
De meerderheid van de patiënten in dit onderzoek die SEROQUEL 25 mg gebruikten, kregen een dosering tussen 400 mg/dag en 800 mg per dag. In een soortgelijk opgezet onderzoek (n=200) ging SEROQUEL gepaard met een verbetering van de YMRS-scores, maar vertoonde het geen superioriteit ten opzichte van placebo, mogelijk als gevolg van een hoger placebo-effect.
De primaire werkzaamheidsresultaten van deze onderzoeken bij de behandeling van manie bij volwassenen worden weergegeven in tabel 20.
Kinderen en adolescenten (10-17 jaar)
De werkzaamheid van SEROQUEL bij de acute behandeling van manische episodes geassocieerd met bipolaire I-stoornis bij kinderen en adolescenten (10-17 jaar) werd aangetoond in een 3 weken durende, dubbelblinde, placebogecontroleerde, multicenter studie (onderzoek 4 in Tabel 20). Patiënten die voldeden aan de diagnostische criteria van de DSM-IV voor een manische episode werden gerandomiseerd in een van de drie behandelingsgroepen: SEROQUEL 400 mg/dag (n=95), SEROQUEL 600 mg/dag (n=98) of placebo (n=91) . De studiemedicatie werd gestart met 50 mg/dag en op dag 2 verhoogd tot 100 mg/dag (verdeelde doses twee- of driemaal daags gegeven). Vervolgens werd de dosis getitreerd tot een streefdosis van 400 mg/dag of 600 mg/dag in stappen van 100 mg/dag, verdeeld over twee of drie keer per dag. De primaire werkzaamheidsvariabele was de gemiddelde verandering ten opzichte van baseline in de totale YMRS-score.
SEROQUEL 400 mg/dag en 600 mg/dag waren superieur aan placebo wat betreft de verlaging van de totale YMRS-score (tabel 20).
Bipolaire stoornis, depressieve episodes
volwassenen
De werkzaamheid van SEROQUEL 25 mg voor de acute behandeling van depressieve episodes geassocieerd met bipolaire stoornis werd vastgesteld in 2 identiek ontworpen, 8 weken durende, gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken (N=1045) (onderzoeken 5 en 6 in tabel 21) . Deze onderzoeken omvatten patiënten met een bipolaire I- of II-stoornis en patiënten met of zonder een snelle cyclus. Patiënten gerandomiseerd naar SEROQUEL 200 mg kregen eenmaal daags vaste doses van 300 mg of 600 mg toegediend.
Het primaire beoordelingsinstrument dat werd gebruikt om depressieve symptomen in deze onderzoeken te beoordelen, was de Montgomery-Asberg Depression Rating Scale (MADRS), een door clinici beoordeelde schaal met 10 items en scores variërend van 0 tot 60. Het primaire eindpunt in beide onderzoeken was de verandering van baseline in MADRS-score in week 8. In beide onderzoeken was SEROQUEL 50 mg superieur aan placebo wat betreft verlaging van de MADRS-score. Verbetering van de symptomen, gemeten aan de hand van verandering in de MADRS-score ten opzichte van placebo, werd waargenomen in beide onderzoeken op dag 8 (week 1) en daarna. In deze onderzoeken werd geen bijkomend voordeel gezien met de dosis van 600 mg. Voor de groep met een dosis van 300 mg werden statistisch significante verbeteringen ten opzichte van placebo waargenomen in de algehele kwaliteit van leven en tevredenheid met betrekking tot verschillende gebieden van functioneren, zoals gemeten met behulp van de Q-LES-Q(SF).
De primaire werkzaamheidsresultaten van deze onderzoeken bij de acute behandeling van depressieve episodes geassocieerd met bipolaire stoornis bij volwassenen worden weergegeven in Tabel 21.
Onderhoudsbehandeling als aanvulling op lithium of Divalproex
De werkzaamheid van SEROQUEL 100 mg bij de onderhoudsbehandeling van bipolaire I-stoornis werd vastgesteld in 2 placebogecontroleerde onderzoeken bij patiënten (n=1326) die voldeden aan de DSM-IV-criteria voor bipolaire I-stoornis (onderzoeken 7 en 8 in figuren 1 en 2). De onderzoeken omvatten patiënten van wie de meest recente episode manisch, depressief of gemengd was, met of zonder psychotische kenmerken. In de open-labelfase moesten patiënten ten minste 12 weken stabiel zijn op SEROQUEL plus lithium of divalproex om te worden gerandomiseerd. Gemiddeld waren patiënten 15 weken gestabiliseerd. In de randomisatiefase zetten de patiënten de behandeling met lithium of divalproex voort en werden gerandomiseerd om ofwel SEROQUEL (tweemaal daags toegediend in totaal 400 mg/dag tot 800 mg/dag) of placebo te krijgen. Ongeveer 50% van de patiënten was gestopt met de SEROQUEL-groep op dag 280 en 50% van de placebogroep was gestopt op dag 117 van de dubbelblinde behandeling. Het primaire eindpunt in deze onderzoeken was tijd tot herhaling van een stemmingsgebeurtenis (manische, gemengde of depressieve episode). Een stemmingsgebeurtenis werd gedefinieerd als het starten van medicatie of ziekenhuisopname voor een stemmingsepisode; YMRS-score ≥20 of MADRS-score ≥20 bij 2 opeenvolgende beoordelingen; of stopzetting van de studie vanwege een stemmingsstoornis (Figuur 1 en Figuur 2).
In beide onderzoeken was SEROQUEL superieur aan placebo wat betreft het verlengen van de tijd tot herhaling van een stemmingsgebeurtenis. Het behandeleffect was aanwezig voor toenemende tijd tot herhaling van zowel manische als depressieve episodes. Het effect van SEROQUEL was onafhankelijk van een specifieke subgroep (toegewezen stemmingsstabilisator, geslacht, leeftijd, ras, meest recente bipolaire episode of snelfietsverloop).
Figuur 1: Kaplan-Meier-curves van tijd tot herhaling van een stemmingsgebeurtenis (onderzoek 7)
Figuur 2: Kaplan-Meier-curves van tijd tot herhaling van een stemmingsgebeurtenis (onderzoek 8)
PATIËNT INFORMATIE
SEROQUEL (SER-oh-kwell)(quetiapinefumaraat) Tabletten
Lees deze medicatiehandleiding voordat u begint met het innemen van SEROQUEL en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
Wat is de belangrijkste informatie die ik over SEROQUEL moet weten?
SEROQUEL 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Praat met de zorgverlener van u of uw gezinslid over:
- alle risico's en voordelen van behandeling met antidepressiva.
- alle behandelingskeuzes voor depressie of andere ernstige psychische aandoeningen
- Antidepressiva kunnen bij sommige kinderen, tieners en jonge volwassenen zelfmoordgedachten of -acties doen toenemen in de eerste paar maanden van de behandeling.
- Depressie en andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van zelfmoordgedachten en -acties. Sommige mensen lopen een bijzonder hoog risico op zelfmoordgedachten of -acties. Deze omvatten mensen met (of een familiegeschiedenis van) depressie, bipolaire stoornis (ook wel manisch-depressieve stoornis genoemd) of zelfmoordgedachten of zelfmoordacties.
- Hoe kan ik suïcidale gedachten en acties bij mezelf of een familielid voorkomen en proberen te voorkomen?
- Besteed veel aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel de zorgverlener meteen om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken aan de zorgverlener zoals gepland. Bel indien nodig de zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk een zorgverlener als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich erg geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met uw zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken, en ook de risico's van het niet behandelen ervan. Patiënten en hun families of andere zorgverleners moeten alle behandelkeuzes met de zorgverlener bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met de zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan de zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
- Niet alle antidepressiva die voor kinderen worden voorgeschreven, zijn door de FDA goedgekeurd voor gebruik bij kinderen. Praat met de zorgverlener van uw kind voor meer informatie.
Wat is SEROQUEL 300 mg?
SEROQUEL 100 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van:
- schizofrenie bij mensen van 13 jaar of ouder
- bipolaire stoornis bij volwassenen, waaronder:
- depressieve episodes geassocieerd met bipolaire stoornis
- manische episodes geassocieerd met bipolaire I-stoornis alleen of met lithium of divalproex
- langdurige behandeling van bipolaire I-stoornis met lithium of divalproex
- manische episodes geassocieerd met bipolaire I-stoornis bij kinderen van 10-17 jaar oud
Het is niet bekend of SEROQUEL 100 mg veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat moet ik mijn zorgverlener vertellen voordat ik SEROQUEL 100 mg inneem?
Vertel uw zorgverlener voordat u SEROQUEL 200 mg inneemt als u:
- diabetes of hoge bloedsuikerspiegel in u of uw familie. Uw zorgverlener moet uw bloedsuikerspiegel controleren voordat u met SEROQUEL 300 mg begint, en ook tijdens de therapie
- hoge niveaus van totaal cholesterol, triglyceriden of LDL-cholesterol, of lage niveaus van HDL-cholesterol
- lage of hoge bloeddruk
- laag aantal witte bloedcellen
- staar
- toevallen
- abnormale schildkliertesten
- hoge prolactinespiegels
- hart problemen
- leverproblemen
- een andere medische aandoening
- zwangerschap of plannen om zwanger te worden. Het is niet bekend of SEROQUEL 100 mg schadelijk is voor uw ongeboren baby.
- Als u zwanger wordt terwijl u SEROQUEL krijgt, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Atypische Antipsychotica. U kunt zich registreren door te bellen naar 1-866-961-2388 of ga naar: http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- borstvoeding geeft of van plan bent borstvoeding te geven. SEROQUEL kan in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden als u SEROQUEL krijgt.
- als u een aandoening heeft of heeft gehad waarbij u uw blaas niet volledig kunt legen (urineretentie), een vergrote prostaat, constipatie of verhoogde druk in uw ogen heeft.
Vertel de zorgverlener over alle geneesmiddelen die u gebruikt of onlangs heeft gebruikt waaronder geneesmiddelen op recept, zelfzorggeneesmiddelen, kruidensupplementen en vitamines.
SEROQUEL 300 mg en andere geneesmiddelen kunnen elkaar beïnvloeden en ernstige bijwerkingen veroorzaken. SEROQUEL 200 mg kan de werking van andere geneesmiddelen beïnvloeden, en andere geneesmiddelen kunnen de werking van SEROQUEL 200 mg beïnvloeden.
Vertel het uw zorgverlener als u een urineonderzoek ondergaat, omdat SEROQUEL uw testresultaten kan beïnvloeden. Vertel degenen die de test geven dat u SEROQUEL gebruikt.
Hoe moet ik SEROQUEL innemen?
- Neem SEROQUEL precies zoals uw arts u zegt dat u het moet innemen. Verander de dosis niet zelf.
- Neem SEROQUEL 25 mg via de mond, met of zonder voedsel.
- Als u denkt dat u met SEROQUEL 25 mg moet stoppen, overleg dan eerst met uw zorgverlener. Als u plotseling stopt met het innemen van SEROQUEL, kunt u bijwerkingen krijgen zoals moeite met slapen of moeite met doorslapen (slapeloosheid), misselijkheid en braken.
- Als u een dosis SEROQUEL 25 mg bent vergeten, neem deze dan in zodra u eraan denkt. Als u dicht bij uw volgende dosis bent, sla dan de gemiste dosis over. Neem gewoon de volgende dosis op uw normale tijd. Neem geen 2 doses tegelijk in, tenzij uw zorgverlener u dat zegt. Als u niet zeker bent van uw dosering, neem dan contact op met uw zorgverlener.
Wat moet ik vermijden tijdens het gebruik van SEROQUEL 100 mg?
- Rijd niet, bedien geen machines of voer geen andere gevaarlijke activiteiten uit totdat u weet welke invloed SEROQUEL op u heeft. SEROQUEL kan u slaperig maken.
- Voorkom oververhitting of uitdroging.
- Oefen niet te veel.
- Blijf bij warm weer indien mogelijk binnen op een koele plaats.
- Blijf uit de zon. Draag niet te veel of zware kleding.
- Drink veel water.
- Drink geen alcohol tijdens het gebruik van SEROQUEL. Het kan sommige bijwerkingen van SEROQUEL verergeren.
Wat zijn mogelijke bijwerkingen van SEROQUEL 300 mg?
SEROQUEL 200 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zie "Wat is de belangrijkste informatie die ik moet weten over SEROQUEL 200 mg?"
- beroerte die tot de dood kan leiden, kan voorkomen bij oudere mensen met dementie die geneesmiddelen gebruiken zoals SEROQUEL
- maligne neurolepticasyndroom (MNS). MNS is een zeldzame maar zeer ernstige aandoening die kan optreden bij mensen die antipsychotica gebruiken, waaronder SEROQUEL. NMS kan de dood veroorzaken en moet in een ziekenhuis worden behandeld. Bel onmiddellijk uw zorgverlener als u ernstig ziek wordt en enkele of al deze symptomen heeft:
- hoge koorts
- overmatig zweten
- stijve spieren
- verwardheid
- veranderingen in uw ademhaling, hartslag en bloeddruk
- valt kan optreden bij sommige mensen die SEROQUEL gebruiken. Deze valpartijen kunnen ernstige verwondingen veroorzaken.
- hoge bloedsuikerspiegel (hyperglykemie). Een hoge bloedsuikerspiegel kan optreden als u al diabetes heeft of als u nog nooit diabetes heeft gehad. Een hoge bloedsuikerspiegel kan leiden tot:
- ophoping van zuur in uw bloed door ketonen (ketoacidose)
- coma
- dood
Bij sommige mensen die SEROQUEL gebruiken, kan een verhoging van de bloedsuikerspiegel optreden. Een extreem hoge bloedsuikerspiegel kan leiden tot coma of de dood. Als u diabetes heeft of risicofactoren voor diabetes heeft (zoals overgewicht of een familiegeschiedenis van diabetes), moet uw zorgverlener uw bloedsuikerspiegel controleren voordat u met SEROQUEL 50 mg begint en tijdens de behandeling. Bel uw zorgverlener als u een van deze symptomen van een hoge bloedsuikerspiegel (hyperglykemie) heeft tijdens het gebruik van SEROQUEL:
- erg dorstig voelen
- meer moet plassen dan normaal
- voel me erg hongerig
- zich zwak of moe voelen
- misselijk worden in je maag
- verward voelen, of je adem ruikt fruitig
- hoog vetgehalte in uw bloed (verhoogd cholesterol en triglyceriden). Hoge vetgehaltes kunnen optreden bij mensen die met SEROQUEL worden behandeld. Het kan zijn dat u geen symptomen heeft, dus uw zorgverlener kan besluiten uw cholesterol en triglyceriden te controleren tijdens uw behandeling met SEROQUEL.
- gewichtstoename (gewichtstoename). Gewichtstoename komt vaak voor bij mensen die SEROQUEL gebruiken, dus u en uw zorgverlener moeten uw gewicht regelmatig controleren. Praat met uw zorgverlener over manieren om gewichtstoename onder controle te houden, zoals het eten van een gezond, uitgebalanceerd dieet en lichaamsbeweging.
- bewegingen die u niet kunt beheersen in uw gezicht, tong of andere lichaamsdelen (tardieve dyskinesie). Dit kunnen tekenen zijn van een ernstige aandoening. Tardieve dyskinesie verdwijnt mogelijk niet, zelfs niet als u stopt met het innemen van SEROQUEL. Tardieve dyskinesie kan ook beginnen nadat u bent gestopt met het innemen van SEROQUEL.
- verlaagde bloeddruk (orthostatische hypotensie), waaronder duizeligheid of flauwvallen veroorzaakt door een plotselinge verandering in hartslag en bloeddruk bij te snel opstaan vanuit een zittende of liggende positie.
- verhoging van de bloeddruk bij kinderen en tieners. Uw zorgverlener dient de bloeddruk bij kinderen en adolescenten te controleren voordat met SEROQUEL wordt gestart en tijdens de behandeling.
- laag aantal witte bloedcellen. Vertel het uw zorgverlener zo snel mogelijk als u koorts, griepachtige symptomen of een andere infectie heeft, aangezien dit het gevolg kan zijn van een zeer laag aantal witte bloedcellen. Uw zorgverlener kan uw witte bloedcelspiegel controleren om te bepalen of verdere behandeling of andere actie nodig is.
- staar
- toevallen
- abnormale schildkliertesten. Uw zorgverlener kan bloedonderzoek doen om uw schildklierhormoonspiegel te controleren.
- verhogingen van prolactinespiegels
- slaperigheid, sufheid, zich moe voelen, moeite met denken en normale activiteiten doen
- verhoogde lichaamstemperatuur
- Moeite met slikken
- moeite met slapen of moeite met doorslapen (slapeloosheid), misselijkheid of braken als u plotseling stopt met het innemen van SEROQUEL. Deze symptomen verbeteren meestal 1 week nadat u ze begint te krijgen.
De meest voorkomende bijwerkingen van SEROQUEL 50 mg zijn:
Bij volwassenen:
- slaperigheid
- plotselinge daling van de bloeddruk bij het opstaan
- gewichtstoename
- traagheid
- abnormale levertesten
- maagklachten
- droge mond
- duizeligheid
- zwakheid
- buikpijn
- constipatie
- keelpijn
Bij kinderen en adolescenten:
- slaperigheid
- duizeligheid
- vermoeidheid
- misselijkheid
- droge mond
- gewichtstoename
- verhoogde eetlust
- braken
- hoge hartslag
Dit zijn niet alle mogelijke bijwerkingen van SEROQUEL. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik SEROQUEL 100 mg bewaren?
- Bewaar SEROQUEL 100 mg bij kamertemperatuur, tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
- Houd SEROQUEL en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van SEROQUEL
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik SEROQUEL niet voor een aandoening waarvoor het niet is voorgeschreven. Geef SEROQUEL niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over SEROQUEL samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw apotheker of zorgverlener om informatie vragen over SEROQUEL 100 mg die is geschreven voor gezondheidswerkers.
Ga voor meer informatie naar www.SEROQUEL.com of bel 1-800-236-9933.
Wat zijn de ingrediënten in SEROQUEL 200 mg?
Actief ingrediënt: quetiapinefumaraat
Inactieve ingredienten: povidon, dibasisch dicalciumfosfaatdihydraat, microkristallijne cellulose, natriumzetmeelglycolaat, lactosemonohydraat, magnesiumstearaat, hypromellose, polyethyleenglycol en titaniumdioxide. De tabletten van 25 mg bevatten rood en geel ijzeroxide. De tabletten van 100 mg en 400 mg bevatten alleen geel ijzeroxide.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
