Paxil 10mg, 20mg, 30mg, 40mg Paroxetine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Paxil en hoe wordt het gebruikt?
Paxil 20 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van depressie, obsessief-compulsieve stoornis (OCS), paniekstoornis, sociale fobie, gegeneraliseerde angststoornis, posttraumatische stressstoornis (PTSS) en premenstruele dysohorische stoornissen (PMDD). Paxil kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Paxil 40 mg behoort tot een klasse geneesmiddelen die antidepressiva, SSRI's, worden genoemd.
- Het is niet bekend of Paxil veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Paxil 30 mg?
Paxil 10 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- race gedachten,
- verminderde behoefte aan slaap,
- ongewoon risicogedrag,
- gevoelens van extreem geluk of verdriet,
- spraakzamer zijn dan normaal,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- ongebruikelijke botpijn of gevoeligheid, zwelling of blauwe plekken,
- veranderingen in gewicht,
- veranderingen in eetlust,
- gemakkelijk blauwe plekken,
- ongewone bloeding uit uw neus, mond, vagina of rectum,
- bloed ophoesten,
- zeer stijve of stijve spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen,
- flauwvallen,
- hoofdpijn,
- verwardheid,
- onduidelijke spraak,
- ernstige zwakte,
- verlies van coördinatie, en
- onvast voelen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Paxil 30 mg zijn:
- visie verandert,
- zwakheid,
- slaperigheid,
- duizeligheid,
- vermoeidheid,
- zweten,
- ongerustheid,
- schudden,
- slaapproblemen (slapeloosheid),
- verlies van eetlust,
- misselijkheid,
- braken,
- diarree,
- constipatie,
- droge mond,
- infectie,
- hoofdpijn,
- verminderde zin in seks,
- impotentie,
- abnormale ejaculatie, en
- moeite met een orgasme
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van PAXIL 40 mg of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. PAXIL 30 mg is niet goedgekeurd voor gebruik bij pediatrische patiënten. (Zie WAARSCHUWINGEN: Klinische verergering en zelfmoordrisico, PATINTINFORMATIE en VOORZORGSMAATREGELEN: Gebruik bij kinderen.)
OMSCHRIJVING
PAXIL (paroxetine hydrochloride) is een oraal toegediend psychotroop geneesmiddel. Het is het hydrochloridezout van een fenylpiperidineverbinding die chemisch wordt geïdentificeerd als (-)-trans-4R-(4'fluorfenyl)-3S-[(3',4'-methyleendioxyfenoxy)methyl] piperidinehydrochloride-hemihydraat en heeft de empirische formule van C19H20FNO3•HCl•½H2O. Het molecuulgewicht is 374,8 (329,4 als vrije base). De structuurformule van paroxetinehydrochloride is:
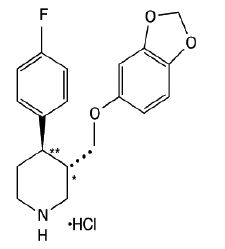
Paroxetine hydrochloride is een geurloos, gebroken wit poeder met een smeltpuntbereik van 120 °C tot 138 °C en een oplosbaarheid van 5,4 mg/ml in water.
Elke filmomhulde tablet bevat als volgt paroxetinehydrochloride equivalent aan paroxetine: 10 mg geel (met breukstreep); 20 mg-roze (gescoord); 30 mg-blauw, 40 mg-groen. Inactieve ingrediënten bestaan uit dibasisch calciumfosfaatdihydraat, hypromellose, magnesiumstearaat, polyethyleenglycolen, polysorbaat 80, natriumzetmeelglycolaat, titaniumdioxide en 1 of meer van de volgende: D&C Red No. 30 aluminiumlak, D&C Yellow No. 10 aluminiumlak , FD&C blauw nr. 2 aluminiumlak, FD&C geel nr. 6 aluminiumlak.
Schorsing voor orale toediening
Elke 5 ml oranjekleurige vloeistof met sinaasappelsmaak bevat paroxetinehydrochloride, equivalent aan paroxetine, 10 mg. Inactieve ingrediënten bestaan uit polacriline-kalium, microkristallijne cellulose, propyleenglycol, glycerine, sorbitol, methylparaben, propylparaben, natriumcitraatdihydraat, watervrij citroenzuur, natriumsacharine, smaakstoffen, FD & C Yellow No. 6 aluminiummeer en simethiconemulsie, USP.
INDICATIES
PAXIL 20 mg is geïndiceerd bij volwassenen voor de behandeling van:
- Depressieve stoornis (MDD)
- Obsessieve compulsieve stoornis (OCS)
- Paniekstoornis (PD)
- Sociale angststoornis (SAD)
- Gegeneraliseerde angststoornis (GAD)
- Posttraumatische stressstoornis (PTSS)
DOSERING EN ADMINISTRATIE
Administratie Informatie
Dien PAXIL als een enkele dagelijkse dosis 's ochtends toe, met of zonder voedsel.
Schud de orale suspensie goed voor toediening.
Aanbevolen dosering voor MDD, OCD, PD en PTSD
De aanbevolen startdoseringen en maximale doseringen van PAXIL 20 mg bij patiënten met MDD, OCS, PD en PTSD worden weergegeven in Tabel 1.
Bij patiënten met een onvoldoende respons de dosering verhogen in stappen van 10 mg per dag met tussenpozen van ten minste 1 week, afhankelijk van de verdraagbaarheid.
Aanbevolen dosering voor SAD en GAD
SAD
De aanvangs- en aanbevolen dosering bij patiënten met SAD is 20 mg per dag. In klinische onderzoeken werd de werkzaamheid van PAXIL 30 mg aangetoond bij patiënten die een dosering kregen van 20 mg tot 60 mg per dag. Hoewel de veiligheid van PAXIL is geëvalueerd bij patiënten met SAD bij doses tot 60 mg per dag, suggereert de beschikbare informatie geen bijkomend voordeel voor doses hoger dan 20 mg per dag [zie Klinische studies ].
GAD
De aanvangs- en aanbevolen dosering bij patiënten met GAS is 20 mg per dag. In klinische onderzoeken werd de werkzaamheid van PAXIL 10 mg bij GAS aangetoond bij patiënten die een dosering kregen van 20 mg tot 50 mg per dag. Er is niet voldoende bewijs om een groter voordeel te suggereren van doses hoger dan 20 mg per dag [zie: Klinische studies ].
Bij patiënten met een onvoldoende respons de dosering verhogen in stappen van 10 mg per dag met tussenpozen van ten minste 1 week, afhankelijk van de verdraagbaarheid.
Scherm voor bipolaire stoornis voorafgaand aan het starten van PAXIL
Voordat de behandeling met PAXIL 10 mg of een ander antidepressivum wordt gestart, moet u patiënten screenen op een persoonlijke of familiale voorgeschiedenis van bipolaire stoornis, manie of hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Aanbevolen dosering voor oudere patiënten, patiënten met ernstige nierinsufficiëntie en patiënten met ernstige leverinsufficiëntie
De aanbevolen aanvangsdosering is 10 mg per dag voor oudere patiënten, patiënten met ernstige nierinsufficiëntie en patiënten met ernstige leverinsufficiëntie. De dosering mag niet hoger zijn dan 40 mg/dag.
Overschakelen van patiënten naar of van een monoamineoxidaseremmer (MAOI)
Er moeten ten minste 14 dagen verstrijken tussen het stoppen met een monoamineoxidaseremmer (MAO-remmer en het starten van PAXIL. Bovendien moeten er ten minste 14 dagen verstrijken na het stoppen met PAXIL voordat een MAO-remmer wordt gestart (zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzetting van de behandeling met PAXIL
Bijwerkingen kunnen optreden na stopzetting van PAXIL (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verlaag de dosering geleidelijk in plaats van abrupt te stoppen met PAXIL waar mogelijk.
HOE GELEVERD
Doseringsvormen en sterke punten
PAXIL-tabletten zijn beschikbaar als:
- 10 mg gele tablet met breukgleuf aan de voorkant gegraveerd met “PAXIL” en aan de achterkant met “10”.
- 20 mg roze tablet met breukgleuf aan de voorkant gegraveerd met “PAXIL” en aan de achterkant met “20”.
- Blauwe tablet van 30 mg, op de voorkant gegraveerd met “PAXIL” en op de achterkant met “30”.
- Groene tablet van 40 mg, op de voorkant gegraveerd met “PAXIL” en op de achterkant met “40”.
PAXIL 20 mg orale suspensie is beschikbaar als:
- 10 mg/5 ml oranjekleurige suspensie met sinaasappelsmaak in flessen met 250 ml.
Opslag en behandeling
PAXIL (paroxetine) tabletten zijn ovale tabletten die worden geleverd als:
Bewaar tabletten tussen 15° en 30°C (59° en 86°F).
PAXIL (paroxetine) orale suspensie wordt geleverd als:
Bewaar suspensie bij of beneden 25°C (77°F)
Gefabriceerd door: Apotex Inc., Toronto, Ontario, Canada M9L 1T9. Herzien: februari 2021
BIJWERKINGEN
De volgende bijwerkingen zijn in meer detail opgenomen in andere rubrieken van de voorschrijfinformatie:
- Overgevoeligheidsreacties op paroxetine [zie CONTRA-INDICATIES ]
- Suïcidale gedachten en gedragingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Embryofetale en neonatale toxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Activering van manie/hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stopzettingssyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Botbreuk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De veiligheidsgegevens voor PAXIL zijn afkomstig van:
- 6 weken durende klinische onderzoeken bij MDD-patiënten die eenmaal daags 20 mg tot 50 mg PAXIL kregen
- 12 weken durende klinische onderzoeken bij OCS-patiënten die eenmaal daags 20 mg tot 60 mg PAXIL kregen
- Klinische onderzoeken van 10 tot 12 weken bij PD-patiënten die eenmaal daags PAXIL 10 mg tot 60 mg kregen
- 12 weken durende klinische onderzoeken bij patiënten met SAD die eenmaal daags 20 mg tot 50 mg PAXIL kregen
- 8 weken durende klinische onderzoeken bij GAS-patiënten die eenmaal daags PAXIL 10 mg tot 50 mg kregen
- 12 weken durende klinische onderzoeken bij PTSS-patiënten die eenmaal daags 20 mg tot 50 mg PAXIL kregen
Bijwerkingen die leiden tot stopzetting
Twintig procent (1.199/6.145) van de patiënten behandeld met PAXIL in klinische onderzoeken bij MDD en 16,1% (84/522), 11,8% (64/542), 9,4% (44/469), 10,7% (79/735), en 11,7% (79/676) van de patiënten die met PAXIL werden behandeld in klinische onderzoeken naar respectievelijk SAD, OCS, PD, GAS en PTSD, stopten met de behandeling vanwege een bijwerking. De meest voorkomende bijwerkingen (≥1%) geassocieerd met stopzetting (dwz die bijwerkingen geassocieerd met uitval met een snelheid van ongeveer twee keer of meer voor PAXIL 10 mg in vergelijking met placebo) worden weergegeven in Tabel 3:
Meest voorkomende bijwerkingen
De vaakst waargenomen bijwerkingen geassocieerd met het gebruik van PAXIL (incidentie van 5% of meer en ten minste tweemaal die voor placebo) waren:
MDD
Asthenie, zweten, misselijkheid, verminderde eetlust, slaperigheid, duizeligheid, slapeloosheid, tremor, nervositeit, ejaculatiestoornis en andere mannelijke genitale aandoeningen.
OCS
Misselijkheid, droge mond, verminderde eetlust, constipatie, duizeligheid, slaperigheid, tremor, zweten, impotentie en abnormale ejaculatie.
PD
Asthenie, zweten, verminderde eetlust, verminderd libido, tremor, abnormale ejaculatie, vrouwelijke genitale aandoeningen en impotentie.
SAD
Zweten, misselijkheid, droge mond, constipatie, verminderde eetlust, slaperigheid, tremor, verminderd libido, geeuw, abnormale ejaculatie, vrouwelijke genitale aandoeningen en impotentie.
GAD
Asthenie, infectie, constipatie, verminderde eetlust, droge mond, misselijkheid, verminderd libido, slaperigheid, tremor, zweten en abnormale ejaculatie.
PTSS
Asthenie, zweten, misselijkheid, droge mond, diarree, verminderde eetlust, slaperigheid, verminderd libido, abnormale ejaculatie, vrouwelijke geslachtsstoornissen en impotentie.
Bijwerkingen bij patiënten met MDD
Tabel 4 geeft de bijwerkingen weer die optraden met een incidentie van 1% of meer en meer dan placebo in klinische onderzoeken van met PAXIL behandelde patiënten met MDD.
Bijwerkingen bij patiënten met OCS, PD en SAD
Tabel 5 geeft bijwerkingen weer die optraden met een frequentie van 2% of meer in klinische onderzoeken bij patiënten met OCS, PD en SAD.
Bijwerkingen bij patiënten met GAD en PTSD
Tabel 6 geeft bijwerkingen weer die optraden met een frequentie van 2% of meer in klinische onderzoeken bij patiënten met GAS en PTSS.
Dosisafhankelijke bijwerkingen
MDD
Een vergelijking van het percentage bijwerkingen in een onderzoek met een vaste dosis waarin PAXIL10 mg, 20 mg, 30 mg en 40 mg eenmaal daags werd vergeleken met placebo bij de behandeling van MDD, bracht dosisafhankelijke bijwerkingen aan het licht, zoals weergegeven in Tabel 7:
OCS
In een onderzoek met een vaste dosis waarin placebo en PAXIL 20 mg, 40 mg en 60 mg werden vergeleken bij de behandeling van OCS, was er geen duidelijke relatie tussen bijwerkingen en de dosis PAXIL 30 mg waaraan patiënten waren toegewezen.
PD
In een onderzoek met een vaste dosis waarin placebo en PAXIL 10 mg, 20 mg en 40 mg werden vergeleken bij de behandeling van PD, bleken de volgende bijwerkingen dosisafhankelijk te zijn: asthenie, droge mond, angst, verminderd libido, tremor en abnormale ejaculatie.
SAD
In een onderzoek met een vaste dosis waarin placebo en PAXIL 20 mg, 40 mg en 60 mg bij de behandeling van SAD werden vergeleken, was er voor de meeste bijwerkingen geen duidelijk verband tussen bijwerkingen en de dosis PAXIL 10 mg waaraan patiënten waren toegewezen. .
GAD
In een onderzoek met een vaste dosis waarin placebo en PAXIL 20 mg en 40 mg werden vergeleken bij de behandeling van GAS, bleken de volgende bijwerkingen dosisafhankelijk te zijn: asthenie, constipatie en abnormale ejaculatie.
PTSS
In een onderzoek met een vaste dosis waarin placebo en PAXIL 20 mg en 40 mg werden vergeleken bij de behandeling van PTSS, bleken de volgende bijwerkingen dosisafhankelijk te zijn: impotentie en abnormale ejaculatie.
Mannelijke en vrouwelijke seksuele disfunctie
Hoewel veranderingen in seksueel verlangen, seksuele prestaties en seksuele bevrediging vaak optreden als manifestaties van een psychiatrische stoornis, kunnen ze ook een gevolg zijn van SSRI-behandeling. Betrouwbare schattingen van de incidentie en ernst van ongewenste ervaringen met seksuele begeerte, prestaties en bevrediging zijn echter moeilijk te verkrijgen, deels omdat patiënten en zorgverleners misschien terughoudend zijn om ze te bespreken. Dienovereenkomstig kunnen schattingen van de incidentie van ongewenste seksuele ervaringen en prestaties die in de etikettering worden genoemd, hun werkelijke incidentie onderschatten.
Het percentage patiënten dat symptomen van seksuele disfunctie meldt bij mannen en vrouwen met MDD, OCS, PD, SAD, GAD en PTSD wordt weergegeven in Tabel 8.
Behandeling met PAXIL 20 mg is in verband gebracht met verschillende gevallen van priapisme. In die gevallen met een bekende uitkomst herstelden de patiënten zonder gevolgen.
Hallucinaties
In gepoolde klinische onderzoeken met PAXIL werden hallucinaties waargenomen bij 0,2% van de met PAXIL behandelde patiënten vergeleken met 0,1% van de patiënten die placebo kregen.
Minder vaak voorkomende bijwerkingen
De volgende bijwerkingen traden op tijdens de klinische onderzoeken met PAXIL en zijn niet elders in de etikettering vermeld.
Bijwerkingen zijn gecategoriseerd per lichaamssysteem en gerangschikt in afnemende frequentie volgens de volgende definities: Frequente bijwerkingen zijn bijwerkingen die bij 1 of meer gelegenheden optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij 1/100 tot 1/1.000 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij minder dan 1/1.000 patiënten.
Lichaam als geheel
Onregelmatig: allergische reactie, koude rillingen, gezichtsoedeem, malaise, nekpijn; zelden: Adrenerge syndroom, cellulitis, moniliasis, nekstijfheid, bekkenpijn, peritonitis, sepsis, zweer.
Cardiovasculair systeem
Frequent: Hypertensie, tachycardie; zeldzaam: bradycardie, hematoom, hypotensie, migraine, orthostatische hypotensie, syncope; zelden: Angina pectoris, aritmieknoop, atriale fibrillatie, bundeltakblok, cerebrale ischemie, cerebrovasculair accident, congestief hartfalen, hartblok, laag hartminuutvolume, myocardinfarct, myocardischemie, bleekheid, flebitis, longembolie, supraventriculaire extrasystolen, tromboflebitis trombose, spataderen, vasculaire hoofdpijn, ventriculaire extrasystolen.
Spijsverteringsstelsel
Onregelmatig: bruxisme, colitis, dysfagie, oprisping, gastritis, gastro-enteritis, gingivitis, glossitis, verhoogde speekselvloed, abnormale leverfunctietests, rectale bloeding, ulceratieve stomatitis; zelden: Afteuze stomatitis, bloederige diarree, boulimia, cardiospasme, cholelithiasis, duodenitis, enteritis, oesofagitis, fecale impacties, fecale incontinentie, tandvleesbloeding, hematemesis, hepatitis, ileitis, ileus, darmobstructie, geelzucht, melena, mondzweren, maagzweer, speekselkliervergroting, sialadenitis, maagzweer, stomatitis, tongverkleuring, tongoedeem, tandcariës.
Endocrien systeem
Zelden: Diabetes mellitus, struma, hyperthyreoïdie, hypothyreoïdie, thyreoïditis.
Hemische en lymfatische systemen
Onregelmatig: bloedarmoede, leukopenie, lymfadenopathie, purpura; zelden: Abnormale erytrocyten, basofilie, verhoogde bloedingstijd, eosinofilie, hypochrome anemie, bloedarmoede door ijzertekort, leukocytose, lymfoedeem, abnormale lymfocyten, lymfocytose, microcytische anemie, monocytose, normocytische anemie, trombocytemie, trombocytopenie.
Metabool en nutritioneel
Frequent: Gewichtstoename; zeldzaam: oedeem, perifeer oedeem, SGOT verhoogd, SGPT verhoogd, dorst, gewichtsverlies; zelden: Alkalische fosfatase verhoogd, bilirubinemie, BUN verhoogd, creatininefosfokinase verhoogd, uitdroging, gamma-globulinen verhoogd, jicht, hypercalciëmie, hypercholesteremie, hyperglykemie, hyperkaliëmie, hyperfosfatemie, hypocalciëmie, hypoglykemie, hypokaliëmie, hyponatriëmie, ketose verhoogd, melkzuurdehydrogenase stikstof (NPN) verhoogd.
Musculoskeletaal systeem
Frequent: Artralgie; zeldzaam: artritis, artrose; zelden: Bursitis, myositis, osteoporose, gegeneraliseerde spasmen, tenosynovitis, tetanie.
Zenuwstelsel
Frequent: emotionele labiliteit, duizeligheid; zeldzaam: Abnormaal denken, alcoholmisbruik, ataxie, dystonie, dyskinesie, euforie, vijandigheid, hypertonie, hypesthesie, hypokinesie, coördinatiestoornissen, gebrek aan emotie, verhoogd libido, manische reactie, neurose, verlamming, paranoïde reactie; zelden: Abnormale gang, akinesie, antisociale reactie, afasie, choreoathetose, circumorale paresthesieën, convulsie, delirium, wanen, diplopie, drugsverslaving, dysartrie, extrapiramidaal syndroom, fasciculaties, grand mal convulsie, hyperalgesie, hysterie, manisch-depressieve reactie, meningitis, myelitis, neuralgie, neuropathie, nystagmus, perifere neuritis, psychotische depressie, psychose, reflexen verminderd, reflexen verhoogd, stupor, torticollis, trismus, ontwenningssyndroom.
Ademhalingssysteem
Onregelmatig: astma, bronchitis, kortademigheid, epistaxis, hyperventilatie, longontsteking, respiratoire griep; zelden: emfyseem, bloedspuwing, hik, longfibrose, longoedeem, verhoogd sputum, stridor, stemverandering.
Huid en aanhangsels
Frequent: pruritus; zeldzaam: Acne, alopecia, contactdermatitis, droge huid, ecchymose, eczeem, herpes simplex, lichtgevoeligheid, urticaria; zelden: angio-oedeem, erythema nodosum, erythema multiforme, exfoliatieve dermatitis, schimmeldermatitis, furunculose; herpes zoster, hirsutisme, maculopapulaire uitslag, seborroe, huidverkleuring, huidhypertrofie, huidzweer, verminderd zweten, vesiculobulleuze uitslag.
Speciale zintuigen
Vaak: Tinnitus; zeldzaam: afwijking van accommodatie, conjunctivitis, oorpijn, oogpijn, keratoconjunctivitis, mydriasis, otitis media; zelden: Amblyopie, anisocorie, blefaritis, cataract, conjunctivaal oedeem, hoornvlieszweer, doofheid, exophthalmus, oogbloeding, glaucoom, hyperacusis, nachtblindheid, otitis externa, parosmie, fotofobie, ptosis, retinale bloeding, smaakverlies, gezichtsvelddefect.
Urogenitaal systeem
Onregelmatig: Amenorroe, borstpijn, cystitis, dysurie, hematurie, menorragie, nocturie, polyurie, pyurie, urine-incontinentie, urineretentie, urinaire urgentie, vaginitis; zelden: abortus, borstatrofie, borstvergroting, endometriumaandoening, epididymitis, borstvoeding bij vrouwen, fibrocystische borst, niersteen, nierpijn, leukorroe, mastitis, metrorragie, nefritis, oligurie, salpingitis, urethritis, urineafgietsels, baarmoederkrampen, uroliet, vaginaal bloeding, vaginale moniliasis.
Postmarketingervaring
De volgende reacties zijn vastgesteld tijdens het gebruik van PAXIL na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting van de frequentie ervan of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Acute pancreatitis, verhoogde leverfunctietesten (de ernstigste gevallen waren overlijden als gevolg van levernecrose en sterk verhoogde transaminasen geassocieerd met ernstige leverdisfunctie), Guillain-Barré-syndroom, Stevens-Johnson-syndroom, toxische epidermale necrolyse, syndroom van ongepaste ADH-secretie, prolactinemie en galactorroe; extrapiramidale symptomen waaronder acathisie, bradykinesie, tandradstijfheid, oogcrisis die in verband is gebracht met gelijktijdig gebruik van pimozide; status epilepticus, acuut nierfalen, pulmonale hypertensie, allergische alveolitis, anafylaxie, eclampsie, laryngismus, optische neuritis, porfyrie, rustelozebenensyndroom (RLS), ventrikelfibrilleren, ventriculaire tachycardie (inclusief torsade de pointes), hemolytische anemie, voorvallen gerelateerd aan verminderde hematopoëse (inclusief aplastische anemie, pancytopenie, beenmergaplasie en agranulocytose), vasculitische syndromen (zoals Henoch-Schönlein purpura) en vroeggeboorte bij zwangere vrouwen. Er is een geval gemeld van ernstige hypotensie wanneer PAXIL 20 mg werd toegevoegd aan een chronische behandeling met metoprolol.
DRUG-INTERACTIES
Tabel 9 geeft klinisch significante geneesmiddelinteracties met PAXIL weer.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Zelfmoordgedachten en -gedrag bij adolescenten en jongvolwassenen
In gepoolde analyses van placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere klassen van antidepressiva) met ongeveer 77.000 volwassen patiënten en 4.500 pediatrische patiënten, was de incidentie van zelfmoordgedachten en zelfmoordgedrag bij met antidepressiva behandelde patiënten van 24 jaar en jonger groter dan in met placebo behandelde patiënten. Er was een aanzienlijke variatie in het risico op zelfmoordgedachten en -gedrag tussen geneesmiddelen, maar er werd een verhoogd risico vastgesteld bij jonge patiënten voor de meeste onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op zelfmoordgedachten en -gedrag bij de verschillende indicaties, met de hoogste incidentie bij patiënten met MDD. De verschillen tussen geneesmiddelen en placebo's in het aantal gevallen van suïcidale gedachten en gedragingen per 1000 behandelde patiënten worden gegeven in Tabel 2.
PAXIL 30 mg is niet goedgekeurd voor gebruik bij pediatrische patiënten.
Het is niet bekend of het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen zich uitstrekt tot langdurig gebruik, dwz langer dan vier maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met MDD dat antidepressiva de herhaling van depressie vertragen en dat depressie zelf een risicofactor is voor zelfmoordgedachten en zelfmoordgedrag.
Controleer alle patiënten die met antidepressiva worden behandeld op enige indicatie voor klinische verergering en het optreden van zelfmoordgedachten en -gedragingen, vooral tijdens de eerste paar maanden van medicamenteuze behandeling en op tijdstippen van doseringswijzigingen. Raad familieleden of zorgverleners van patiënten aan om te controleren op gedragsveranderingen en om de zorgverlener te waarschuwen. Overweeg het therapeutische regime te veranderen, inclusief mogelijk het staken van PAXIL, bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende zelfmoordgedachten of -gedrag vertonen.
serotonine syndroom
SSRI's, waaronder PAXIL, kunnen het serotoninesyndroom veroorzaken, een mogelijk levensbedreigende aandoening. Het risico is verhoogd bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine verstoren, dwz MAO-remmers [zie MAO-remmers] CONTRA-INDICATIES , DRUG-INTERACTIES ]. Het serotoninesyndroom kan ook optreden wanneer deze geneesmiddelen alleen worden gebruikt.
Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree).
Gelijktijdig gebruik van PAXIL met MAO-remmers is gecontra-indiceerd. Start bovendien niet met PAXIL 30 mg bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Als het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die PAXIL 10 mg gebruikt, stop dan met PAXIL 40 mg voordat de behandeling met de MAO-remmer wordt gestart (zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
Controleer alle patiënten die PAXIL 20 mg gebruiken op het optreden van het serotoninesyndroom. Beëindig de behandeling met PAXIL 20 mg en alle gelijktijdig gebruikte serotonerge middelen onmiddellijk als de bovenstaande symptomen optreden, en start een ondersteunende symptomatische behandeling. Als gelijktijdig gebruik van PAXIL met andere serotonerge geneesmiddelen klinisch gerechtvaardigd is, informeer de patiënten dan over het verhoogde risico op het serotoninesyndroom en controleer op symptomen.
Geneesmiddelinteracties die leiden tot QT-verlenging
De CYP2D6-remmende eigenschappen van paroxetine kunnen de plasmaspiegels van thioridazine en pimozide verhogen. Aangezien alleen thioridazine en pimozide een verlenging van het QTc-interval veroorzaken en het risico op ernstige ventriculaire aritmieën verhogen, is het gebruik van PAXIL 40 mg gecontra-indiceerd in combinatie met thioridazine en pimozide [zie CONTRA-INDICATIES , DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Embryofetale en neonatale toxiciteit
PAXIL kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Epidemiologische onderzoeken hebben aangetoond dat zuigelingen die in het eerste trimester van de zwangerschap aan paroxetine zijn blootgesteld, een verhoogd risico hebben op cardiovasculaire misvormingen. Blootstelling aan paroxetine in de late zwangerschap kan leiden tot een verhoogd risico op aanhoudende pulmonale hypertensie van de pasgeborene (PPNH) en/of neonatale complicaties die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen.
Als PAXIL 20 mg tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van PAXIL 30 mg, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus [zie Gebruik bij specifieke populaties ].
Verhoogd risico op bloedingen
Geneesmiddelen die de remming van de heropname van serotonine verstoren, waaronder PAXIL 40 mg, verhogen het risico op bloedingen. Gelijktijdig gebruik van aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), andere antibloedplaatjesgeneesmiddelen, warfarine en andere anticoagulantia kunnen dit risico vergroten. Case-reports en epidemiologische studies (case-control en cohort-design) hebben een verband aangetoond tussen het gebruik van geneesmiddelen die de heropname van serotonine verstoren en het optreden van gastro-intestinale bloedingen. Bloedingen die verband houden met geneesmiddelen die de heropname van serotonine verstoren, varieerden van ecchymosen, hematomen, epistaxis en petechiën tot levensbedreigende bloedingen.
Informeer patiënten over het verhoogde risico op bloedingen bij gelijktijdig gebruik van PAXIL 20 mg en plaatjesaggregatieremmers of anticoagulantia. Voor patiënten die warfarine gebruiken, moet u zorgvuldig de internationale genormaliseerde verhouding volgen.
Activering van manie of hypomanie
Bij patiënten met een bipolaire stoornis kan de behandeling van een depressieve episode met PAXIL 30 mg of een ander antidepressivum een gemengde/manische episode uitlokken. Tijdens gecontroleerde klinische onderzoeken met PAXIL trad hypomanie of manie op bij ongeveer 1% van de met PAXIL behandelde unipolaire patiënten vergeleken met 1,1% van de actieve controle en 0,3% van de met placebo behandelde unipolaire patiënten. Voordat u begint met de behandeling met PAXIL 20 mg, moet u patiënten screenen op een persoonlijke of familiale voorgeschiedenis van bipolaire stoornis, manie of hypomanie.
Stopzettingssyndroom
Bijwerkingen na stopzetting van serotonerge antidepressiva, vooral na abrupte stopzetting, zijn onder meer: misselijkheid, zweten, dysfore stemming, prikkelbaarheid, opwinding, duizeligheid, sensorische stoornissen (bijv. paresthesie, zoals het gevoel van elektrische schokken), tremor, angst, verwardheid, hoofdpijn, lethargie, emotionele labiliteit, slapeloosheid, hypomanie, oorsuizen en toevallen. Een geleidelijke verlaging van de dosering in plaats van abrupte stopzetting wordt waar mogelijk aanbevolen [zie DOSERING EN ADMINISTRATIE ].
Tijdens klinische onderzoeken naar GAS en PTSD werden geleidelijke verlagingen van de dagelijkse dosis met 10 mg/dag met wekelijkse intervallen gevolgd door 1 week met 20 mg/dag gebruikt voordat de behandeling werd stopgezet. De volgende bijwerkingen werden gemeld met een incidentie van 2% of meer voor PAXIL 20 mg en waren minstens twee keer zo hoog als voor placebo: Abnormale dromen, paresthesie en duizeligheid Bij pediatrische patiënten zijn bijwerkingen gemeld na stopzetting van de behandeling met PAXIL. De veiligheid en werkzaamheid van PAXIL bij pediatrische patiënten zijn niet vastgesteld [zie: GEVAARLIJKE WAARSCHUWING: , Zelfmoordgedachten en -gedrag bij adolescenten en jongvolwassenen , Gebruik bij specifieke populaties ].
epileptische aanvallen
PAXIL 10 mg tabletten en orale suspensie zijn niet systematisch geëvalueerd bij patiënten met epileptische aandoeningen. Patiënten met een voorgeschiedenis van epileptische aanvallen werden uitgesloten van klinische onderzoeken. Tijdens klinische onderzoeken kwamen aanvallen voor bij 0,1% van de patiënten die met PAXIL werden behandeld. PAXIL moet met voorzichtigheid worden voorgeschreven aan patiënten met een epileptische aandoening. Stop met PAXIL 30 mg bij elke patiënt die epileptische aanvallen ontwikkelt.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na gebruik van veel antidepressiva, waaronder PAXIL, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan. Gevallen van geslotenhoekglaucoom geassocieerd met het gebruik van PAXIL 40 mg zijn gemeld. Vermijd het gebruik van antidepressiva, waaronder PAXIL, bij patiënten met onbehandelde anatomisch nauwe hoeken.
Hyponatriëmie
Hyponatriëmie kan optreden als gevolg van behandeling met SSRI's, waaronder PAXIL. Gevallen met serumnatrium lager dan 110 mmol/L zijn gemeld. Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Tekenen en symptomen die gepaard gaan met ernstigere en/of acute gevallen omvatten hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden. In veel gevallen lijkt deze hyponatriëmie het gevolg te zijn van het syndroom van ongepaste antidiuretisch hormoonsecretie (SIADH).
Bij patiënten met symptomatische hyponatriëmie, stop met PAXIL en start een geschikte medische interventie. Oudere patiënten, patiënten die diuretica gebruiken en patiënten met volumedepletie lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met SSRI's (zie Gebruik bij specifieke populaties ].
Vermindering van de werkzaamheid van Tamoxifen
Sommige onderzoeken hebben aangetoond dat de werkzaamheid van tamoxifen, gemeten aan de hand van het risico op terugval/mortaliteit van borstkanker, kan worden verminderd bij gelijktijdig gebruik van PAXIL als gevolg van de onomkeerbare remming van CYP2D6 door paroxetine en lagere bloedspiegels van tamoxifen (zie DRUG-INTERACTIES ]. Eén studie suggereert dat het risico kan toenemen bij een langere duur van gelijktijdige toediening. Andere studies hebben een dergelijk risico echter niet aangetoond. Wanneer tamoxifen wordt gebruikt voor de behandeling of preventie van borstkanker, dienen voorschrijvers te overwegen een alternatief antidepressivum te gebruiken met weinig of geen CYP2D6-remming.
Bot fractuur
Epidemiologische onderzoeken naar het risico op botbreuken tijdens blootstelling aan sommige antidepressiva, waaronder SSRI's, hebben een verband gemeld tussen behandeling met antidepressiva en fracturen. Er zijn meerdere mogelijke oorzaken voor deze waarneming en het is niet bekend in hoeverre het fractuurrisico direct toe te schrijven is aan SSRI-behandeling.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Suïcidale gedachten en gedrag
Adviseer patiënten en zorgverleners om te zoeken naar het optreden van suïcidaliteit, vooral vroeg tijdens de behandeling en wanneer de dosering naar boven of naar beneden wordt aangepast, en instrueer hen om dergelijke symptomen aan de zorgverlener te melden [zie GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
serotonine syndroom
Pas op voor patiënten met het risico op het serotoninesyndroom, met name bij gelijktijdig gebruik van PAXIL met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen, sint-janskruid en met geneesmiddelen die het metabolisme van serotonine (met name MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid). Instrueer patiënten om contact op te nemen met hun zorgverlener of te melden bij de eerste hulp als ze tekenen of symptomen van het serotoninesyndroom ervaren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Gelijktijdige medicatie
Adviseer patiënten om hun arts te informeren als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, aangezien er een kans is op interacties tussen geneesmiddelen [zie WAARSCHUWING EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Verhoogd risico op bloedingen
Informeer patiënten over het gelijktijdig gebruik van PAXIL met aspirine, NSAID's, andere plaatjesaggregatieremmers, warfarine of andere anticoagulantia, omdat het gecombineerde gebruik in verband is gebracht met een verhoogd risico op bloedingen. Adviseer patiënten om hun zorgverleners te informeren als ze medicijnen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te nemen die het risico op bloedingen verhogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Activering van manie/hypomanie
Adviseer patiënten en hun zorgverleners om te observeren op tekenen van activering van manie/hypomanie en instrueer hen om dergelijke symptomen aan de zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzettingssyndroom
Adviseer patiënten om niet abrupt te stoppen met PAXIL 40 mg en om een eventueel afbouwschema met hun zorgverlener te bespreken. Informeer patiënten dat bijwerkingen kunnen optreden wanneer PAXIL wordt stopgezet [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Toedieningsinformatie voor orale suspensie
Instrueer patiënten om de orale suspensie goed te schudden voor toediening [zie DOSERING EN ADMINISTRATIE ].
Allergische reacties
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze een allergische reactie ontwikkelen, zoals huiduitslag, netelroos, zwelling of ademhalingsmoeilijkheden [zie ONGEWENSTE REACTIES ].
Embryo-foetale toxiciteit
Adviseer vrouwen over het mogelijke risico voor de foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ]. Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling vanwege het risico voor de foetus.
Verpleegkunde
Adviseer vrouwen om hun zorgverlener op de hoogte te stellen als ze een baby borstvoeding geven [zie Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Twee jaar durende carcinogeniteitsonderzoeken werden uitgevoerd bij knaagdieren die paroxetine in de voeding kregen in een dosering van 1, 5 en 25 mg/kg/dag (muizen) en 1, 5 en 20 mg/kg/dag (ratten). Deze doses zijn tot 2,0 (muis) en 3,2 (rat) maal de MRHD van 75 mg op basis van mg/m2. Er was een significant groter aantal mannelijke ratten in de groep met een hoge dosis met reticulumcelsarcomen (1/100, 0/50, 0/50 en 4/50 voor controlegroepen, groepen met een lage, middelhoge en hoge dosis). , respectievelijk) en een significant verhoogde lineaire trend over dosisgroepen voor het optreden van lymforeticulaire tumoren bij mannelijke ratten. Vrouwelijke ratten werden niet beïnvloed. Hoewel er een dosisgerelateerde toename was in het aantal tumoren bij muizen, was er geen geneesmiddelgerelateerde toename in het aantal muizen met tumoren. De relevantie van deze bevindingen voor de mens is niet bekend.

Mutagenese
Paroxetine veroorzaakte geen genotoxische effecten in een reeks van 5 in vitro en 2 in vivo testen die het volgende omvatten: Bacteriële mutatietest, muislymfoommutatietest, ongeplande DNA-synthesetest en tests voor cytogenetische afwijkingen in vivo in beenmerg en in vitro van muizen in menselijke lymfocyten en in een dominante letale test bij ratten.
Aantasting van de vruchtbaarheid
Sommige klinische onderzoeken hebben aangetoond dat SSRI's (inclusief paroxetine) de kwaliteit van het sperma kunnen beïnvloeden tijdens behandeling met SSRI's, wat bij sommige mannen de vruchtbaarheid kan beïnvloeden.
Een verlaagd zwangerschapspercentage werd gevonden in reproductiestudies bij ratten bij een dosis paroxetine van 15 mg/kg/dag, wat 2,4 keer de MRHD is van 75 mg op basis van mg/m2. In toxiciteitsonderzoeken gedurende 2 tot 52 weken traden onomkeerbare laesies op in het voortplantingsstelsel van mannelijke ratten. Deze laesies bestonden uit vacuolatie van epididymaal tubulair epitheel bij 50 mg/kg/dag en atrofische veranderingen in de tubuli seminiferi van de testikels met gestopte spermatogenese bij 25 mg/kg/dag (8,2 en 4,1 maal de MRHD van 75 mg op een mg/dag). m2 basis).
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie D [Zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Epidemiologische onderzoeken hebben aangetoond dat zuigelingen die in het eerste trimester van de zwangerschap aan paroxetine zijn blootgesteld, een verhoogd risico hebben op aangeboren afwijkingen, met name cardiovasculaire afwijkingen. Als paroxetine tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van paroxetine, dient u de patiënte te informeren over het mogelijke gevaar voor de foetus.
Klinische overwegingen
Tenzij de voordelen van paroxetine voor de moeder voortzetting van de behandeling rechtvaardigen, moet worden overwogen de behandeling met paroxetine te staken of over te schakelen op een ander antidepressivum [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Voor
- Een onderzoek op basis van Zweedse nationale registergegevens toonde aan dat zuigelingen die tijdens de zwangerschap aan paroxetine werden blootgesteld (n = 815) een verhoogd risico hadden op cardiovasculaire misvormingen (2% risico bij aan paroxetine blootgestelde zuigelingen) in vergelijking met de gehele registerpopulatie (1% risico), voor een odds ratio (OR) van 1,8 (95% betrouwbaarheidsinterval 1,1 tot 2,8). Bij de aan paroxetine blootgestelde zuigelingen werd geen toename van het risico op algehele aangeboren afwijkingen gezien. De hartafwijkingen bij de aan paroxetine blootgestelde zuigelingen waren voornamelijk ventrikelseptumdefecten (VSD's) en atriale septumdefecten (ASS). Septumdefecten variëren in ernst van die welke spontaan verdwijnen tot die waarvoor een operatie nodig is.
- Een afzonderlijke retrospectieve cohortstudie uit de Verenigde Staten (gegevens van United Healthcare) evalueerde 5.956 baby's van moeders die antidepressiva kregen toegediend tijdens het eerste trimester (n = 815 voor paroxetine). Deze studie toonde een trend naar een verhoogd risico op cardiovasculaire malformaties voor paroxetine (risico van 1,5%) in vergelijking met andere antidepressiva (risico van 1%), voor een OR van 1,5 (95% betrouwbaarheidsinterval 0,8 tot 2,9). Van de 12 aan paroxetine blootgestelde zuigelingen met cardiovasculaire misvormingen hadden 9 VSD's. Deze studie suggereerde ook een verhoogd risico op algemene ernstige aangeboren afwijkingen inclusief cardiovasculaire defecten voor paroxetine (4% risico) in vergelijking met andere (2% risico) antidepressiva (OR 1,8; 95% betrouwbaarheidsinterval 1,2 tot 2,8).
- Twee grote case-control-onderzoeken met afzonderlijke databases, elk met >9.000 gevallen van geboorteafwijkingen en >4.000 controles, toonden aan dat het gebruik van paroxetine door de moeder tijdens het eerste trimester van de zwangerschap gepaard ging met een 2- tot 3-voudig verhoogd risico op uitstroom van het rechterventrikel obstructies van de luchtwegen. In één onderzoek was de OR 2,5 (95% betrouwbaarheidsinterval, 1,0 tot 6,0, 7 blootgestelde zuigelingen) en in de andere studie was de OR 3,3 (95% betrouwbaarheidsinterval, 1,3 tot 8,8, 6 blootgestelde zuigelingen).
Andere studies hebben wisselende resultaten gevonden over de vraag of er een verhoogd risico was op algemene, cardiovasculaire of specifieke aangeboren afwijkingen. Een meta-analyse van epidemiologische gegevens over een periode van 16 jaar (1992 tot 2008) over het gebruik van paroxetine in het eerste trimester tijdens de zwangerschap en aangeboren misvormingen omvatte de bovengenoemde onderzoeken naast andere (n = 17 onderzoeken die algemene misvormingen omvatten en n = 14 onderzoeken met cardiovasculaire misvormingen; n = 20 verschillende onderzoeken). Hoewel onderhevig aan beperkingen, suggereerde deze meta-analyse een toegenomen optreden van cardiovasculaire malformaties (prevalentie odds ratio [POR] 1,5; 95% betrouwbaarheidsinterval 1,2 tot 1,9) en algehele malformaties (POR 1,2; 95% betrouwbaarheidsinterval 1,1 tot 1,4) met paroxetine gebruik tijdens het eerste trimester. Het was in deze meta-analyse niet mogelijk om vast te stellen in hoeverre de waargenomen prevalentie van cardiovasculaire misvormingen zou kunnen hebben bijgedragen aan die van algemene misvormingen, en evenmin was het mogelijk om te bepalen of specifieke soorten cardiovasculaire misvormingen zouden kunnen hebben bijgedragen aan de waargenomen prevalentie van alle cardiovasculaire misvormingen.
Tenzij de voordelen van paroxetine voor de moeder voortzetting van de behandeling rechtvaardigen, moet worden overwogen de behandeling met paroxetine te staken of over te schakelen op een ander antidepressivum [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Voor vrouwen die zwanger willen worden of in het eerste trimester van hun zwangerschap zijn, mag paroxetine alleen worden gestart na overweging van de andere beschikbare behandelingsopties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Behandeling van zwangere vrouwen tijdens hun derde trimester
Pasgeborenen die laat in het derde trimester zijn blootgesteld aan SSRI's of serotonine- en noradrenalineheropnameremmers (SNRI's), waaronder PAXIL 40 mg, hebben complicaties ontwikkeld die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen. Dergelijke complicaties kunnen direct na de bevalling optreden. Gerapporteerde klinische bevindingen omvatten ademnood, cyanose, apneu, toevallen, temperatuurinstabiliteit, voedingsproblemen, braken, hypoglykemie, hypotonie, hypertonie, hyperreflexie, tremor, zenuwachtigheid, prikkelbaarheid en constant huilen. Deze kenmerken komen overeen met ofwel een direct toxisch effect van SSRI's en SNRI's of, mogelijk, een syndroom van stopzetting van het geneesmiddel. Opgemerkt moet worden dat in sommige gevallen het klinische beeld consistent is met het serotoninesyndroom [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Blootstelling aan SSRI's tijdens de late zwangerschap kan een verhoogd risico hebben op aanhoudende pulmonale hypertensie van de pasgeborene (PPHN). PPHN komt voor bij 1 tot 2 per 1.000 levendgeborenen in de algemene bevolking en wordt geassocieerd met aanzienlijke neonatale morbiditeit en mortaliteit. In een retrospectieve case-control studie onder 377 vrouwen van wie de baby's werden geboren met PPHN en 836 vrouwen van wie de baby's gezond werden geboren, was het risico op het ontwikkelen van PPHN ongeveer zes keer hoger voor baby's die na de 20e week van de zwangerschap aan SSRI's werden blootgesteld in vergelijking met baby's die tijdens de zwangerschap niet waren blootgesteld aan antidepressiva.
Er zijn ook postmarketingmeldingen geweest van vroeggeboorten bij zwangere vrouwen die zijn blootgesteld aan paroxetine of andere SSRI's.
Bij de behandeling van een zwangere vrouw met paroxetine tijdens het derde trimester moet de arts zowel de mogelijke risico's als de voordelen van de behandeling zorgvuldig overwegen. Een prospectief longitudinaal onderzoek onder 201 vrouwen met een voorgeschiedenis van ernstige depressie die aan het begin van de zwangerschap euthymisch waren. De vrouwen die tijdens de zwangerschap stopten met antidepressiva, hadden meer kans op een terugval van een ernstige depressie dan vrouwen die doorgingen met antidepressiva.
Dierlijke bevindingen
Reproductieonderzoeken werden uitgevoerd met doses tot 50 mg/kg/dag bij ratten en 6 mg/kg/dag bij konijnen die werden toegediend tijdens de organogenese. Deze doses zijn ongeveer 6 (rat) en minder dan 2 (konijn) maal de maximaal aanbevolen dosis voor de mens (MRHD – 75 mg) op basis van mg/m2. Deze onderzoeken hebben geen aanwijzingen opgeleverd voor ontwikkelingseffecten. Bij ratten was er echter een toename van de sterfte van jongen tijdens de eerste 4 dagen van de lactatie wanneer de dosering plaatsvond tijdens het laatste trimester van de dracht en werd voortgezet tijdens de lactatie. Dit effect trad op bij een dosis van 1 mg/kg/dag wat hoger is dan de MRHD op basis van mg/m2. De dosis zonder effect voor de mortaliteit van rattenjongen werd niet bepaald. De oorzaak van deze sterfgevallen is niet bekend.
Moeders die borstvoeding geven
Net als veel andere geneesmiddelen wordt paroxetine uitgescheiden in de moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen van PAXIL 20 mg, moet worden besloten of zuigelingen die borstvoeding geven moeten worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid van PAXIL bij pediatrische patiënten zijn niet vastgesteld [zie: DOOS WAARSCHUWING: ]. De werkzaamheid werd niet aangetoond in drie placebogecontroleerde onderzoeken bij 752 met PAXIL behandelde pediatrische patiënten met MDD.
Antidepressiva verhogen het risico op zelfmoordgedachten en -gedrag bij pediatrische patiënten [zie: GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verminderde eetlust en gewichtsverlies zijn waargenomen in verband met het gebruik van SSRI's.
In placebogecontroleerde klinische onderzoeken uitgevoerd met pediatrische patiënten, werden de volgende bijwerkingen gemeld bij ten minste 2% van de pediatrische patiënten die met PAXIL werden behandeld en kwamen ze voor met een frequentie die ten minste tweemaal zo hoog was als die bij pediatrische patiënten die placebo kregen: emotionele labiliteit (inclusief zelfbeschadiging zelfmoordgedachten, zelfmoordpoging, huilen en stemmingswisselingen), vijandigheid, verminderde eetlust, tremor, zweten, hyperkinesie en agitatie.
Bijwerkingen na stopzetting van de behandeling met PAXIL in de pediatrische klinische onderzoeken die een afbouwfaseregime omvatten, dat optrad bij ten minste 2% van de patiënten en met een frequentie van ten minste tweemaal die van placebo, waren: emotionele labiliteit (inclusief zelfmoordgedachten, zelfmoord poging, stemmingswisselingen en tranenvloed), nervositeit, duizeligheid, misselijkheid en buikpijn.
Geriatrisch gebruik
In klinische premarketingonderzoeken met PAXIL 10 mg was 17% van de met PAXIL behandelde patiënten (ongeveer 700) 65 jaar of ouder. Farmacokinetische onderzoeken lieten een verminderde klaring zien bij ouderen en een lagere startdosis wordt aanbevolen; er werden echter geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen oudere en jongere patiënten [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
SSRI's, waaronder PAXIL, zijn in verband gebracht met gevallen van klinisch significante hyponatriëmie bij oudere patiënten, die mogelijk een groter risico lopen op deze bijwerking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nier- en leverfunctiestoornis
Verhoogde plasmaconcentraties van paroxetine komen voor bij patiënten met nier- en leverinsufficiëntie. De aanvangsdosering van PAXIL moet worden verlaagd bij patiënten met een ernstige nierfunctiestoornis en bij patiënten met een ernstige leverfunctiestoornis [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Menselijke ervaring
Sinds de introductie van PAXIL 30 mg in de Verenigde Staten zijn wereldwijd spontane gevallen van opzettelijke of onopzettelijke overdosering tijdens behandeling met paroxetine gemeld. Deze omvatten overdoses met alleen paroxetine en in combinatie met andere stoffen. Er zijn meldingen van sterfgevallen waarbij alleen paroxetine betrokken lijkt te zijn.
Vaak gemelde bijwerkingen die verband houden met overdosering met paroxetine zijn slaperigheid, coma, misselijkheid, tremor, tachycardie, verwardheid, braken en duizeligheid. Andere opvallende tekenen en symptomen die zijn waargenomen bij overdoses met paroxetine (alleen of met andere stoffen) zijn onder meer mydriasis, convulsies (inclusief status epilepticus), ventriculaire ritmestoornissen (inclusief torsade de pointes), hypertensie, agressieve reacties, syncope, hypotensie, stupor, bradycardie, dystonie , rabdomyolyse, symptomen van leverdisfunctie (waaronder leverfalen, levernecrose, geelzucht, hepatitis en leversteatose), serotoninesyndroom, manische reacties, myoclonus, acuut nierfalen en urineretentie.
Beheer van overdosering
Er zijn geen specifieke antidota voor PAXIL bekend. Als overdosering optreedt, bel dan uw antigifcentrum op 1-800-222-1222 voor de laatste aanbevelingen.
CONTRA-INDICATIES
PAXIL is gecontra-indiceerd bij patiënten:
- Gebruik of binnen 14 dagen na het stoppen van MAO-remmers (inclusief de MAO-remmers linezolid en intraveneus methyleenblauw) vanwege een verhoogd risico op het serotoninesyndroom (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- Inname van thioridazine vanwege het risico op QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ]
- Inname van pimozide vanwege het risico op QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- Met bekende overgevoeligheid (bijv. anafylaxie, angio-oedeem, Stevens-Johnson-syndroom) voor paroxetine of een van de inactieve ingrediënten in PAXIL (zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van PAXIL bij de behandeling van MDD, SAD, OCD\, PD, GAD en PTSD is onbekend, maar er wordt aangenomen dat het verband houdt met de versterking van de serotonerge activiteit in het centrale zenuwstelsel als gevolg van remming van de neuronale heropname van serotonine (5-hydroxytryptamine, 5-HT).
farmacodynamiek
Studies met klinisch relevante doses bij mensen hebben aangetoond dat paroxetine de opname van serotonine in menselijke bloedplaatjes blokkeert. In vitro-onderzoeken bij dieren suggereren ook dat paroxetine een krachtige en zeer selectieve remmer is van de neuronale serotonineheropname (SSRI) en slechts zeer zwakke effecten heeft op de neuronale heropname van noradrenaline en dopamine.
Farmacokinetiek
Niet-lineariteit in de farmacokinetiek wordt waargenomen bij toenemende doses PAXIL.
In een meta-analyse van paroxetine uit 4 onderzoeken bij gezonde vrijwilligers na meervoudige doseringen van 20 mg/dag tot 40 mg/dag, vertoonden mannen geen significant lagere Cmax of AUC dan vrouwen.
Absorptie
Paroxetinehydrochloride wordt volledig geabsorbeerd na orale toediening van een oplossing van het hydrochloridezout. In een onderzoek waarin normale mannelijke proefpersonen (n = 15) 30 mg tabletten per dag kregen gedurende 30 dagen, werden bij de meeste proefpersonen de steady-state paroxetineconcentraties bereikt na ongeveer 10 dagen, hoewel het bij een occasionele patiënt aanzienlijk langer kan duren. Bij steady state waren de gemiddelde waarden van Cmax, Tmax, Cmin en T½ 61,7 ng/ml (CV 45%), 5,2 uur. (CV 10%), 30,7 ng/ml (CV 67%) en 21,0 uur (CV 32%), respectievelijk. De steady-state Cmax- en Cmin-waarden waren ongeveer 6 en 14 keer wat zou worden voorspeld op basis van onderzoeken met enkelvoudige doses. Steady-state blootstelling aan geneesmiddelen op basis van AUC0-24 was ongeveer 8 keer groter dan zou zijn voorspeld op basis van gegevens over enkelvoudige doses bij deze proefpersonen. De overmatige accumulatie is een gevolg van het feit dat 1 van de enzymen die paroxetine metaboliseert gemakkelijk verzadigbaar is.
Paroxetine is even biologisch beschikbaar uit de orale suspensie en tablet.
Effect van voedsel
De effecten van voedsel op de biologische beschikbaarheid van paroxetine zijn onderzocht bij proefpersonen die een enkele dosis met en zonder voedsel kregen. De AUC was slechts licht verhoogd (6%) wanneer het geneesmiddel met voedsel werd toegediend, maar de Cmax was 29% hoger, terwijl de tijd om de piekplasmaconcentratie te bereiken afnam van 6,4 uur na toediening tot 4,9 uur.
Verdeling
Paroxetine wordt door het hele lichaam gedistribueerd, inclusief het CZS, waarbij slechts 1% in het plasma achterblijft.
Ongeveer 95% en 93% van paroxetine wordt bij respectievelijk 100 ng/ml en 400 ng/ml aan plasma-eiwitten gebonden. Onder klinische omstandigheden zouden de paroxetineconcentraties normaal gesproken lager zijn dan 400 ng/ml. Paroxetine verandert de in vitro eiwitbinding van fenytoïne of warfarine niet.
Eliminatie
Metabolisme
De gemiddelde eliminatiehalfwaardetijd is ongeveer 21 uur (CV 32%) na orale dosering van 30 mg tabletten per dag gedurende 30 dagen PAXIL.
In steady-state dosisproportionaliteitsstudies met oudere en niet-oudere patiënten, bij doses van 20 mg tot 40 mg per dag voor ouderen en 20 mg tot 50 mg per dag voor niet-ouderen, werd enige niet-lineariteit waargenomen in beide populaties, wat opnieuw een verzadigbare metabole route weerspiegelt. . In vergelijking met de Cmin-waarden na 20 mg per dag waren de waarden na 40 mg per dag slechts ongeveer 2 tot 3 keer groter dan verdubbeld.
Paroxetine wordt uitgebreid gemetaboliseerd na orale toediening. De belangrijkste metabolieten zijn polaire en geconjugeerde producten van oxidatie en methylering, die gemakkelijk worden geklaard. Conjugaten met glucuronzuur en sulfaat overheersen, en belangrijke metabolieten zijn geïsoleerd en geïdentificeerd. Gegevens geven aan dat de metabolieten niet meer dan 1/50 van de potentie van de moederverbinding hebben om de opname van serotonine te remmen. Het metabolisme van paroxetine wordt gedeeltelijk bewerkstelligd door CYP2D6. Verzadiging van dit enzym bij klinische doses lijkt verantwoordelijk te zijn voor de niet-lineariteit van de paroxetinekinetiek bij toenemende dosis en toenemende behandelingsduur. De rol van dit enzym in het paroxetinemetabolisme suggereert ook mogelijke interacties tussen geneesmiddelen [zie: DRUG-INTERACTIES ]. Het farmacokinetische gedrag van paroxetine is niet geëvalueerd bij proefpersonen met een tekort aan CYP2D6 (slechte metaboliseerders).
uitscheiding
Ongeveer 64% van een dosis paroxetine van 30 mg orale oplossing werd uitgescheiden in de urine met 2% als de moederverbinding en 62% als metabolieten gedurende een periode van 10 dagen na toediening. Ongeveer 36% werd uitgescheiden in de feces (waarschijnlijk via de gal), meestal als metabolieten en minder dan 1% als de moederverbinding gedurende de periode van 10 dagen na toediening.
Geneesmiddelinteractiestudies
Er zijn klinisch significante, bekende geneesmiddelinteracties tussen paroxetine en andere geneesmiddelen [zie: DRUG-INTERACTIES ].
Figuur 1. Impact van paroxetine op de farmacokinetiek van gelijktijdig toegediende geneesmiddelen (logschaal)
Figuur 2. Impact van gelijktijdig toegediende geneesmiddelen op de farmacokinetiek van paroxetine
theofylline
Er zijn meldingen van verhoogde theofyllinespiegels in verband met behandeling met PAXIL gemeld. Hoewel deze interactie niet formeel is onderzocht, wordt aanbevolen de theofyllinespiegels te controleren wanneer deze geneesmiddelen gelijktijdig worden toegediend.
Geneesmiddelen gemetaboliseerd door cytochroom CYP3A4
Een in vivo interactieonderzoek waarbij paroxetine en terfenadine, een substraat voor CYP3A4, gelijktijdig onder steady-state-omstandigheden werden toegediend, toonde geen effect van paroxetine op de farmacokinetiek van terfenadine aan. Bovendien hebben in vitro-onderzoeken aangetoond dat ketoconazol, een krachtige remmer van de CYP3A4-activiteit, minstens 100 keer krachtiger is dan paroxetine als een remmer van het metabolisme van verschillende substraten voor dit enzym, waaronder terfenadine, astemizol, cisapride, triazolam en cyclosporine. De mate van remming van de CYP3A4-activiteit door paroxetine is naar verwachting niet van klinische betekenis.
Specifieke populaties
De impact van specifieke populaties op de farmacokinetiek van paroxetine wordt weergegeven in figuur 3.
De aanbevolen startdosering en maximale dosering van PAXIL is verlaagd bij oudere patiënten, patiënten met ernstige nierfunctiestoornis en patiënten met ernstige leverfunctiestoornis [zie DOSERING EN ADMINISTRATIE ].
Figuur 3. Impact van specifieke populatie op de farmacokinetiek van paroxetine (logschaal)
Klinische studies
Ernstige depressieve stoornis
De werkzaamheid van PAXIL voor de behandeling van depressieve stoornis (MDD) is vastgesteld in 6 placebogecontroleerde onderzoeken bij patiënten met MDD (in de leeftijd van 18 tot 73 jaar). In deze onderzoeken bleek PAXIL statistisch significant effectiever te zijn dan placebo bij de behandeling van MDD door ten minste 2 van de volgende maatregelen: Hamilton Depression Rating Scale (HDRS), de Hamilton depressieve stemming-item en de Clinical Global Impression (CGI)- Ernst van de ziekte. PAXIL was statistisch significant beter dan placebo in de verbetering van de HDRS-subfactorscores, waaronder het item depressieve stemming, slaapverstoringsfactor en angstfactor.
De werkzaamheid op lange termijn van PAXIL 10 mg voor de behandeling van MDD bij poliklinische patiënten werd aangetoond in een gerandomiseerd onderzoek naar ontwenningsverschijnselen. Patiënten die reageerden op PAXIL (HDRS-totaalscore
Obsessief-compulsieve stoornis
De werkzaamheid van PAXIL bij de behandeling van obsessieve-compulsieve stoornis (OCS) werd aangetoond in twee 12 weken durende multicenter placebogecontroleerde onderzoeken bij volwassen poliklinische patiënten (onderzoeken 1 en 2). Patiënten hadden matige tot ernstige OCS (DSM-IIIR) met gemiddelde baselinescores op de Yale Brown Obsessive Compulsive Scale (YBOCS) totale score variërend van 23 tot 26. In onderzoek 1, een onderzoek naar het dosisbereik, kregen patiënten vaste dagelijkse doses van PAXIL 20 mg, 40 mg of 60 mg. Onderzoek 1 toonde aan dat dagelijkse doses PAXIL 40 mg en 60 mg effectief zijn bij de behandeling van OCS. Patiënten die doses PAXIL 40 mg en 60 mg kregen, ondervonden een gemiddelde verlaging van respectievelijk ongeveer 6 en 7 punten op de YBOCS-totaalscore, die statistisch significant groter was dan de geschatte 4-punts verlaging bij 20 mg en een verlaging van 3 punten in de met placebo behandelde patiënten. Studie 2 was een studie met flexibele doseringen waarin PAXIL 20 mg tot 60 mg per dag werd vergeleken met clomipramine 25 mg tot 250 mg per dag of placebo). In deze studie ondervonden patiënten die PAXIL kregen een gemiddelde afname van ongeveer 7 punten op de YBOCS-totaalscore, wat statistisch significant groter was dan de gemiddelde afname van ongeveer 4 punten bij met placebo behandelde patiënten.
De volgende tabel geeft de uitkomstclassificatie per behandelgroep op Global Improvement-items van de Clinical Global Impression (CGI)-schaal voor onderzoek 1.
Subgroepanalyses gaven niet aan dat er verschillen waren in behandeluitkomsten als functie van leeftijd of geslacht.
De werkzaamheid op lange termijn van PAXIL voor de behandeling van OCS werd vastgesteld in een langdurige verlenging van onderzoek 1. Patiënten die reageerden op PAXIL tijdens de dubbelblinde fase van 3 maanden en een verlenging van 6 maanden op open-label PAXIL 20 mg tot 60 mg per dag werden gerandomiseerd naar PAXIL 10 mg of placebo in een 6 maanden durende dubbelblinde terugvalpreventiefase. Patiënten die gerandomiseerd waren naar PAXIL hadden statistisch significant minder kans op terugval dan met placebo behandelde patiënten.
Paniekstoornis
De werkzaamheid van PAXIL 20 mg bij de behandeling van paniekstoornis (PD) werd aangetoond in drie multicenter, placebogecontroleerde onderzoeken van 10 tot 12 weken bij volwassen poliklinische patiënten (onderzoeken 1, 2 en 3). Patiënten hadden PD (DSM-IIIR), met of zonder agorafobie. In deze onderzoeken bleek PAXIL statistisch significant effectiever te zijn dan placebo bij de behandeling van PD door ten minste 2 van de 3 maten van paniekaanvalfrequentie en op de Clinical Global Impression Severity of Illness-score.
Studie 1 was een 10 weken durend onderzoek naar dosisbereik; patiënten kregen vaste doses PAXIL 10 mg, 20 mg of 40 mg per dag of placebo. Er werd alleen een statistisch significant verschil met placebo waargenomen voor de groep met PAXIL 40 mg per dag. Op het eindpunt was 76% van de patiënten die PAXIL 40 mg per dag kregen, vrij van paniekaanvallen, vergeleken met 44% van de met placebo behandelde patiënten.
Studie 2 was een 12 weken durende studie met flexibele doseringen waarin PAXIL 10 mg werd vergeleken met 60 mg per dag en placebo. Op het eindpunt was 51% van de met PAXIL behandelde patiënten vrij van paniekaanvallen vergeleken met 32% van de met placebo behandelde patiënten.
Studie 3 was een 12 weken durende studie met flexibele doseringen waarin PAXIL 10 mg tot 60 mg per dag werd vergeleken met placebo bij patiënten die gelijktijdig gestandaardiseerde cognitieve gedragstherapie kregen. Op het eindpunt vertoonde 33% van de met PAXIL behandelde patiënten een vermindering tot 0 of 1 paniekaanvallen vergeleken met 14% van de met placebo behandelde patiënten.
In onderzoeken 2 en 3 was de gemiddelde PAXIL-dosis voor voltooide patiënten op het eindpunt ongeveer 40 mg per dag.
De werkzaamheid op lange termijn van PAXIL 10 mg bij PD werd aangetoond in een verlenging van onderzoek 1. Patiënten die reageerden op PAXIL 20 mg tijdens de dubbelblinde fase van 10 weken en tijdens een dubbelblinde verlengingsfase van 3 maanden werden gerandomiseerd naar PAXIL 10 mg. mg, 20 mg of 40 mg per dag of placebo in een dubbelblinde terugvalpreventiefase van 3 maanden. Patiënten die gerandomiseerd waren naar PAXIL 20 mg hadden statistisch significant minder kans op terugval dan met placebo behandelde patiënten.
Subgroepanalyses gaven niet aan dat er verschillen waren in behandeluitkomsten als functie van leeftijd of geslacht.
Sociale angststoornis
De werkzaamheid van PAXIL bij de behandeling van sociale angststoornis (SAD) werd aangetoond in drie 12 weken durende, multicenter, placebogecontroleerde onderzoeken (Studies 1, 2 en 3) bij volwassen poliklinische patiënten met SAD (DSM-IV). In deze onderzoeken werd de werkzaamheid van PAXIL 30 mg vergeleken met placebo beoordeeld op basis van (1) het aandeel responders, zoals gedefinieerd door een Clinical Global Impression (CGI) Improvement-score van 1 (zeer sterk verbeterd) of 2 (veel verbeterd). ), en (2) verandering van baseline in de Liebowitz Social Anxiety Scale (LSAS).
Studies 1 en 2 waren studies met flexibele doseringen waarin PAXIL 20 mg werd vergeleken met 50 mg per dag en placebo. PAXIL toonde statistisch significante superioriteit ten opzichte van placebo op zowel het CGI-verbeteringscriterium als de Liebowitz Social Anxiety Scale (LSAS). In onderzoek 1 voor patiënten die week 12 voltooiden, was 69% van de met PAXIL behandelde patiënten vergeleken met 29% van de met placebo behandelde patiënten CGI-verbeteringsresponders. In onderzoek 2 waren de respons op CGI-verbetering respectievelijk 77% en 42% voor de met PAXIL en placebo behandelde patiënten.
Studie 3 was een 12 weken durende studie waarin vaste doses PAXIL 20 mg, 40 mg of 60 mg per dag werden vergeleken met placebo. PAXIL 20 mg was statistisch significant superieur aan placebo op zowel de LSAS-totaalscore als het CGI-verbeteringsresponscriterium; er waren trends voor superioriteit ten opzichte van placebo voor de PAXIL 40 mg en 60 mg dagelijkse dosisgroepen. Er was in deze studie geen indicatie van enig bijkomend voordeel voor doses hoger dan 20 mg per dag.
Subgroepanalyses wezen over het algemeen niet op verschillen in behandelingsresultaten als functie van leeftijd, ras of geslacht.
Gegeneraliseerde angststoornis
De werkzaamheid van PAXIL bij de behandeling van gegeneraliseerde angststoornis (GAD) werd aangetoond in twee 8 weken durende, multicenter, placebogecontroleerde onderzoeken (onderzoeken 1 en 2) bij volwassen poliklinische patiënten met GAS (DSM-IV).
Onderzoek 1 was een onderzoek van 8 weken waarin vaste doses PAXIL 20 mg of 40 mg per dag werden vergeleken met placebo. Doses van PAXIL 20 mg of 40 mg bleken beide statistisch significant beter te zijn dan placebo op de totale score van de Hamilton Rating Scale for Anxiety (HAM-A).
Er was niet voldoende bewijs in deze studie om een groter voordeel voor de dagelijkse dosis PAXIL 40 mg te suggereren in vergelijking met de dagelijkse dosis van 20 mg.
Studie 2 was een studie met flexibele doses waarin PAXIL 20 mg werd vergeleken met 50 mg per dag en placebo. PAXIL toonde statistisch significante superioriteit ten opzichte van placebo op de totale score van de Hamilton Rating Scale for Anxiety (HAM-A).
Een derde studie, een studie met flexibele doses waarin PAXIL 20 mg tot 50 mg per dag werd vergeleken met placebo, toonde geen statistisch significante superioriteit van PAXIL ten opzichte van placebo op de totale score van de Hamilton Rating Scale for Anxiety (HAM-A), de primaire uitkomst.
Subgroepanalyses wezen niet op verschillen in behandelresultaten als functie van ras of geslacht. Er waren onvoldoende oudere patiënten om subgroepanalyses op basis van leeftijd uit te voeren.
In een langetermijnonderzoek werden 566 patiënten die voldeden aan de DSM-IV-criteria voor GAD en die hadden gereageerd tijdens een enkelblinde, 8 weken durende acute behandelingsfase met PAXIL 20 mg tot 50 mg per dag, gerandomiseerd naar voortzetting van PAXIL 30 mg op hun dezelfde dosis, of placebo, gedurende maximaal 24 weken observatie voor terugval. De respons tijdens de enkelblinde fase werd gedefinieerd door een afname van ≥2 punten ten opzichte van de uitgangswaarde op de CGI-Severity of Illness-schaal, tot een score van ≤3. Terugval tijdens de dubbelblinde fase werd gedefinieerd als een toename van ≥2 punten ten opzichte van de uitgangswaarde op de CGI-Severity of Illness-schaal tot een score van ≥4, of intrekking wegens gebrek aan werkzaamheid. Patiënten die PAXIL 40 mg bleven krijgen, ondervonden een statistisch significant lager terugvalpercentage in de daaropvolgende 24 weken in vergelijking met degenen die placebo kregen.
Post-traumatische stress-stoornis
De werkzaamheid van PAXIL 20 mg bij de behandeling van posttraumatische stressstoornis (PTSS) werd aangetoond in twee 12 weken durende, multicenter, placebogecontroleerde onderzoeken (onderzoeken 1 en 2) bij volwassen poliklinische patiënten die voldeden aan de DSM-IV-criteria voor PTSS. De gemiddelde duur van PTSS-symptomen voor de 2 onderzoeken samen was 13 jaar (variërend van 0,1 jaar tot 57 jaar). Het percentage patiënten met secundaire MDD of niet-PTSS angststoornissen in de gecombineerde 2 onderzoeken was respectievelijk 41% (356 van de 858 patiënten) en 40% (345 van de 858 patiënten). De uitkomst van het onderzoek werd beoordeeld aan de hand van (1) de door de arts toegediende PTSD-schaal, deel 2 (CAPS-2) score en (2) de Clinical Global Impression-Global Improvement Scale (CGI-I). De CAPS-2 is een multi-item instrument dat 3 aspecten van PTSS meet met de volgende symptoomclusters: Herbeleving/intrusie, vermijding/verdoving en hyperarousal. De 2 primaire uitkomsten voor elk onderzoek waren (1) verandering van baseline naar eindpunt op de CAPS-2 totaalscore (17 items), en (2) percentage responders op de CGI-I, waarbij responders werden gedefinieerd als patiënten met een score van 1 (zeer veel verbeterd) of 2 (veel verbeterd).
Studie 1 was een 12 weken durende studie waarin vaste doses PAXIL 20 mg of 40 mg per dag werden vergeleken met placebo. Doses van PAXIL 20 mg en 40 mg bleken statistisch significant beter te zijn dan placebo bij verandering ten opzichte van baseline voor de CAPS-2-totaalscore en bij het percentage responders op de CGI-I. Er was niet voldoende bewijs in deze studie om een groter voordeel te suggereren voor de dagelijkse dosis van 40 mg in vergelijking met de dagelijkse dosis van 20 mg.
Studie 2 was een 12 weken durende studie met flexibele doseringen waarin PAXIL 20 mg tot 50 mg per dag werd vergeleken met placebo. PAXIL 40 mg bleek significant beter te zijn dan placebo bij verandering ten opzichte van baseline voor de CAPS-2-totaalscore en bij het percentage responders op de CGI-I.
Een derde studie, een studie met flexibele doseringen waarin PAXIL 20 mg tot 50 mg per dag werd vergeleken met placebo, toonde aan dat PAXIL 20 mg statistisch significant superieur was aan placebo op verandering ten opzichte van baseline voor de totale CAPS-2-score, maar niet op het percentage responders op de CGI -L.
De meerderheid van de patiënten in deze onderzoeken waren vrouwen (68% vrouwen: 377 van de 551 proefpersonen in onderzoek 1 en 66% vrouwen: 202 van de 303 proefpersonen in onderzoek 2). Subgroepanalyses wezen niet op verschillen in behandeluitkomsten als functie van geslacht. Er waren onvoldoende patiënten van 65 jaar en ouder of niet-blanke om subgroepanalyses uit te voeren op basis van respectievelijk leeftijd of ras.
PATIËNT INFORMATIE
PAXIL® (PAX-il)(paroxetine) tabletten & orale suspensie
Wat is de belangrijkste informatie die ik over PAXIL moet weten?
PAXIL kan ernstige bijwerkingen veroorzaken, waaronder:
- Verhoogd risico op zelfmoordgedachten of -acties. PAXIL 10 mg en andere antidepressiva kunnen bij sommige mensen van 24 jaar en jonger zelfmoordgedachten en -acties doen toenemen, vooral binnen de eerste paar maanden van de behandeling of wanneer de dosis wordt gewijzigd. PAXIL is niet bedoeld voor gebruik bij kinderen.
- Depressie of andere psychische aandoeningen zijn de belangrijkste oorzaken van zelfmoordgedachten en -acties.
Hoe kan ik suïcidale gedachten en acties voorkomen en proberen te voorkomen?
- Let goed op eventuele veranderingen, vooral plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens of als u zelfmoordgedachten of -acties ontwikkelt. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosering wordt gewijzigd.
- Bel onmiddellijk uw zorgverlener om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden of als u zelfmoordgedachten of -acties ontwikkelt.
- Houd alle vervolgbezoeken met uw zorgverlener zoals gepland. Bel indien nodig uw zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel uw zorgverlener of schakel onmiddellijk medische hulp in als u een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- pogingen om zelfmoord te plegen
- agressief of gewelddadig handelen
- nieuwe of ergere depressie
- zich geagiteerd, rusteloos, boos of prikkelbaar voelen
- een toename in activiteit en meer praten dan normaal voor u is
- handelen op gevaarlijke impulsen
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere angst- of paniekaanvallen
- Moeite met slapen
- andere ongewone veranderingen in gedrag of stemming
Wat is PAXIL?
PAXIL 30 mg is een receptgeneesmiddel dat wordt gebruikt bij volwassenen voor de behandeling van:
- Een bepaald type depressie genaamd Major Depressive Disorder (MDD)
- Obsessieve-compulsieve stoornis (OCS)
- Paniekstoornis (PD)
- Sociale angststoornis (SAD)
- Gegeneraliseerde angststoornis (GAD)
- Posttraumatische stressstoornis (PTSS)
Neem PAXIL niet in als u:
- neem een monoamineoxidaseremmer (MAOI)
- zijn gestopt met het gebruik van een MAO-remmer in de afgelopen 14 dagen
- worden behandeld met het antibioticum linezolid of het intraveneuze methyleenblauw
- nemen pimozide
- nemen thioridazine
- allergisch bent voor paroxetine of voor één van de bestanddelen van PAXIL. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in PAXIL.
Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer of een van deze geneesmiddelen gebruikt, waaronder het antibioticum linezolid of intraveneus methyleenblauw.
Begin niet met het innemen van een MAO-remmer gedurende ten minste 14 dagen nadat u bent gestopt met de behandeling met PAXIL.
Vertel uw zorgverlener voordat u PAXIL gebruikt over al uw medische aandoeningen, ook als u:
- hartproblemen hebben
- bloedingsproblemen heeft of heeft gehad
- een bipolaire stoornis, manie of hypomanie heeft of een familiegeschiedenis heeft
- epileptische aanvallen of convulsies heeft of heeft gehad
- glaucoom heeft (hoge druk in het oog)
- een laag natriumgehalte in uw bloed heeft
- botproblemen hebben
- nier- of leverproblemen heeft
- zwanger bent of van plan bent zwanger te worden. PAXIL 40 mg kan uw ongeboren baby schaden. Praat met uw zorgverlener over de risico's voor uw ongeboren baby als u PAXIL gebruikt tijdens de zwangerschap. Vertel het uw zorgverlener meteen als u zwanger wordt of denkt zwanger te zijn tijdens de behandeling met PAXIL.
- borstvoeding geeft of van plan bent borstvoeding te geven. PAXIL gaat over in uw moedermelk. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens de behandeling met PAXIL.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
PAXIL en sommige andere geneesmiddelen kunnen elkaar beïnvloeden en mogelijk ernstige bijwerkingen veroorzaken. PAXIL 30 mg kan de werking van andere geneesmiddelen beïnvloeden en andere geneesmiddelen kunnen de werking van PAXIL beïnvloeden.
Vertel het uw zorgverlener vooral als u:
- geneesmiddelen die worden gebruikt om migrainehoofdpijn te behandelen, triptanen genaamd
- tricyclische antidepressiva
- fentanyl
- lithium
- tramadol
- tryptofaan
- buspiron
- amfetaminen
- Sint-janskruid
- geneesmiddelen die de bloedstolling kunnen beïnvloeden, zoals aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), warfarine
- diuretica
- tamoxifen
- geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, waaronder selectieve serontonineheropname (SSRI's) en serotonine-noradrenalineheropnameremmers (SNRI's)
Vraag uw zorgverlener als u niet zeker weet of u een van deze geneesmiddelen gebruikt. Uw zorgverlener kan u vertellen of het veilig is om PAXIL 10 mg samen met uw andere geneesmiddelen in te nemen.
Start of stop geen andere geneesmiddelen tijdens de behandeling met PAXIL zonder eerst met uw zorgverlener te overleggen. Als u plotseling stopt met PAXIL, kunt u ernstige bijwerkingen krijgen. Zien, "Wat zijn de mogelijke bijwerkingen van PAXIL 20 mg?"
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om aan uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik PAXIL gebruiken?
- Neem PAXIL precies zoals voorgeschreven. Uw zorgverlener moet mogelijk de dosis PAXIL 30 mg aanpassen totdat deze de juiste dosis voor u is.
- Neem PAXIL 1 keer per dag in de ochtend.
- PAXIL 30 mg kan met of zonder voedsel worden ingenomen.
- Als u PAXIL suspensie voor oraal gebruik inneemt, schud de suspensie dan goed voordat u deze inneemt.
- Als u te veel PAXIL heeft ingenomen, bel dan uw antigifcentrum op 1-800-222-1222 of ga meteen naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
Wat zijn mogelijke bijwerkingen van PAXIL 10 mg?
PAXIL 40 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien, “Wat is de belangrijkste informatie die ik over PAXIL moet weten?”
- Serotonine syndroom. Een mogelijk levensbedreigend probleem genaamd serotoninesyndroom kan optreden als u PAXIL 20 mg samen met bepaalde andere geneesmiddelen gebruikt. Zie "Wie mag PAXIL niet gebruiken?" Bel uw zorgverlener of ga meteen naar de eerste hulp van het dichtstbijzijnde ziekenhuis als u een van de volgende tekenen en symptomen van het serotoninesyndroom heeft:
- agitatie
- dingen zien of horen die niet echt zijn (hallucinaties)
- verwardheid
- coma
- snelle hartslag
- veranderingen in bloeddruk
- duizeligheid
- zweten
- blozen
- hoge lichaamstemperatuur (hyperthermie)
- trillen (tremoren), stijve spieren of spiertrekkingen
- verlies van coördinatie
- toevallen
- misselijkheid, braken, diarree
- Oogproblemen (hoekglaucoom). PAXIL 10 mg kan bij mensen met bepaalde andere oogaandoeningen een soort oogprobleem veroorzaken dat geslotenhoekglaucoom wordt genoemd. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen. Bel uw zorgverlener als u oogpijn, veranderingen in uw gezichtsvermogen of zwelling of roodheid in of rond het oog heeft.
- Geneesmiddel interacties. Het gebruik van PAXIL 20 mg met bepaalde andere geneesmiddelen, waaronder thioridazine en pimozide, kan het risico op het ontwikkelen van een ernstig hartprobleem, QT-verlenging genaamd, verhogen.
- Toevallen (convulsies).
- Manische afleveringen. Manische episodes kunnen optreden bij mensen met een bipolaire stoornis die PAXIL gebruiken. Symptomen kunnen zijn:
- sterk verhoogde energie
- snelle gedachten
- ongewoon grootse ideeën
- meer of sneller praten dan normaal
- ernstige slaapproblemen
- roekeloos gedrag
- overmatig geluk of prikkelbaarheid
- Stopzetting syndroom. Plotseling stoppen met PAXIL 20 mg kan ernstige bijwerkingen veroorzaken. Uw zorgverlener wil mogelijk uw dosis langzaam verlagen. Symptomen kunnen zijn:
- misselijkheid
- zweten
- veranderingen in je humeur
- prikkelbaarheid en opwinding
- duizeligheid
- elektrische schok gevoel (paresthesie)
- tremor
- ongerustheid
- verwardheid
- hoofdpijn
- vermoeidheid
- problemen met slapen
- hypomanie
- oorsuizen (tinnitus)
- toevallen
- Laag natriumgehalte in uw bloed (hyponatriëmie). Lage natriumspiegels in uw bloed, die ernstig kunnen zijn en de dood kunnen veroorzaken, kunnen optreden tijdens de behandeling met PAXIL. Ouderen en mensen die bepaalde medicijnen gebruiken, lopen mogelijk een groter risico op het ontwikkelen van lage natriumspiegels in uw bloed. Tekenen en symptomen kunnen zijn:
- hoofdpijn
- moeite met concentreren
- geheugen verandert
- verwardheid
- zwakte en onvastheid op uw voeten, wat kan leiden tot vallen
In meer ernstige of meer plotselinge gevallen omvatten tekenen en symptomen:
- dingen zien of horen die niet echt zijn (hallucinaties)
- flauwvallen
- toevallen
- coma
- stoppen met ademen (ademstilstand)
- Abnormale bloeding. Het gebruik van PAXIL met aspirine, NSAID's of bloedverdunners kan dit risico verhogen. Vertel uw zorgverlener over ongebruikelijke bloedingen of blauwe plekken.
- Botbreuken.
De meest voorkomende bijwerkingen van PAXIL 10 mg zijn:
- mannelijke en vrouwelijke seksuele functieproblemen
- constipatie
- diarree
- droge mond
- problemen met slapen
- nervositeit
- zweten
- geeuwen
- zwakte (asthenie)
- verminderde eetlust
- duizeligheid
- infectie
- misselijkheid
- slaperigheid
- trillen (tremor)
Dit zijn niet alle mogelijke bijwerkingen van PAXIL.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik PAXIL bewaren?
- Bewaar PAXIL-tabletten tussen 59 ° F en 86 ° F (15 ° C tot 30 ° C).
- Bewaar PAXIL 10 mg orale suspensie bij of beneden 77 ° F (25 ° C).
Houd PAXIL en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van PAXIL.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik PAXIL niet voor een aandoening waarvoor het niet is voorgeschreven. Geef PAXIL niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw zorgverlener of apotheker om informatie vragen over PAXIL die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in PAXIL 30 mg?
Actief ingrediënt: paroxetine hydrochloride
Inactieve ingredienten:
dibasisch calciumfosfaatdihydraat, hypromellose, magnesiumstearaat, polyethyleenglycolen, polysorbaat 80, natriumzetmeelglycolaat, titaniumdioxide en 1 of meer van de volgende: D&C Red No. 30 aluminiumlak, D&C Yellow No. 10 aluminiumlak, FD&C Blue Nee 2 aluminiumlak, FD&C geel nr. 6 aluminiumlak
Orale suspensie: citroenzuur (watervrij), FD&C geel nr. 6, smaakstoffen, glycerine, methylparaben, microkristallijne cellulose en carboxymethylcellulose-natrium, polacriline-kalium, propyleenglycol, propylparaben, gezuiverd water, sacharine-natrium, simethiconemulsie en natriumcitraat (dihydraat)
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
