Remeron 15mg, 30mg Mirtazapine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat zijn Remeron en hoe wordt het gebruikt?
Remeron is een receptgeneesmiddel dat wordt gebruikt om symptomen van depressie te behandelen. Remeron 30 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Remeron behoort tot een klasse geneesmiddelen die antidepressiva, alfa-2-antagonisten worden genoemd; Antidepressiva, andere.
Het is niet bekend of Remeron 30 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Remeron 30 mg?
Remeron kan ernstige bijwerkingen veroorzaken, waaronder:
- rusteloos voelen,
- race gedachten,
- verminderde behoefte aan slaap,
- ongewoon risicogedrag,
- gevoelens van extreem geluk of verdriet,
- spraakzamer zijn dan normaal,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- duizeligheid,
- koorts,
- rillingen,
- keelpijn,
- zweertjes in de mond,
- veranderingen in gewicht of eetlust,
- ernstige uitslag, blaren of zwelling op de handpalmen of de voetzolen,
- convulsies (toevallen),
- hoofdpijn,
- verwardheid,
- onduidelijke spraak,
- ernstige zwakte,
- braken,
- verlies van coördinatie, en
- onvast voelen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Remeron zijn:
- slaperigheid,
- duizeligheid,
- vreemde dromen,
- droge mond,
- constipatie,
- verhoogde eetlust, en
- gewichtstoename
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Remeron. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van REMERON® (mirtazapine) tabletten of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische behoefte. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. REMERON is niet goedgekeurd voor gebruik bij pediatrische patiënten. (Zie WAARSCHUWINGEN: Klinische verslechtering en zelfmoordrisico, PATINTINFORMATIE en VOORZORGSMAATREGELEN: Gebruik bij kinderen)
OMSCHRIJVING
REMERON® (mirtazapine) tabletten zijn een oraal toegediend medicijn. Mirtazapine heeft een tetracyclische chemische structuur en behoort tot de piperazino-azepinegroep van verbindingen. Het wordt 1,2,3,4,10,14b-hexahydro-2-methylpyrazino [2,1-a] pyrido [2,3-c] benzazepine genoemd en heeft de empirische formule van C17H19N3. Het molecuulgewicht is 265,36. De structuurformule is de volgende en het is het racemische mengsel:
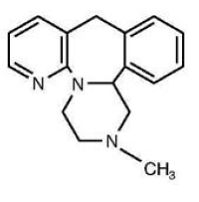
Mirtazapine is een wit tot roomwit kristallijn poeder dat slecht oplosbaar is in water.
REMERON wordt geleverd voor orale toediening als filmomhulde tabletten met breukgleuf die 15 of 30 mg mirtazapine bevatten, en filmomhulde tabletten zonder breuklijn die 45 mg mirtazapine bevatten. Elke tablet bevat ook maïszetmeel, hydroxypropylcellulose, magnesiumstearaat, colloïdaal siliciumdioxide, lactose en andere inactieve ingrediënten.
INDICATIES
REMERON (mirtazapine) Tabletten zijn geïndiceerd voor de behandeling van depressieve stoornis.
De werkzaamheid van REMERON bij de behandeling van depressieve stoornis werd vastgesteld in 6 weken durende gecontroleerde onderzoeken met poliklinische patiënten van wie de diagnoses het meest overeenkwamen met de diagnostische en statistische handleiding voor psychische stoornissen - 3e editie (DSM-III) categorie van depressieve stoornis (zie KLINISCHE FARMACOLOGIE ).
Een depressieve episode (DSM-IV) impliceert een prominente en relatief aanhoudende (bijna elke dag gedurende minstens 2 weken) depressieve of dysfore stemming die gewoonlijk het dagelijks functioneren verstoort, en omvat minstens 5 van de volgende 9 symptomen: depressieve stemming, verlies van interesse in gebruikelijke activiteiten, significante verandering in gewicht en/of eetlust, slapeloosheid of hypersomnie, psychomotorische agitatie of vertraging, verhoogde vermoeidheid, schuldgevoelens of waardeloosheid, vertraagd denken of verminderde concentratie, een zelfmoordpoging of zelfmoordgedachten.
De werkzaamheid van REMERON 15 mg bij gehospitaliseerde depressieve patiënten is niet voldoende onderzocht.
De werkzaamheid van REMERON 15 mg bij het handhaven van een respons bij patiënten met depressieve stoornis gedurende maximaal 40 weken na 8 tot 12 weken initiële open-label behandeling werd aangetoond in een placebogecontroleerd onderzoek. Desalniettemin moet de arts die ervoor kiest om REMERON 15 mg gedurende langere perioden te gebruiken, periodiek de bruikbaarheid van het geneesmiddel op lange termijn voor de individuele patiënt opnieuw evalueren (zie KLINISCHE FARMACOLOGIE ).
DOSERING EN ADMINISTRATIE
Eerste behandeling
De aanbevolen startdosering voor REMERON (mirtazapine) tabletten is 15 mg/dag, toegediend in een enkele dosis, bij voorkeur 's avonds voor het slapengaan. In de gecontroleerde klinische onderzoeken die de werkzaamheid van REMERON bij de behandeling van depressieve stoornis vaststelden, was het effectieve dosisbereik over het algemeen 15 tot 45 mg/dag. Hoewel de relatie tussen dosis en bevredigende respons bij de behandeling van depressieve stoornis voor REMERON 15 mg niet voldoende is onderzocht, kunnen patiënten die niet reageren op de initiële dosis van 15 mg baat hebben bij dosisverhogingen tot een maximum van 45 mg/dag. REMERON heeft een eliminatiehalfwaardetijd van ongeveer 20 tot 40 uur; daarom dienen dosisveranderingen niet te worden aangebracht met tussenpozen van minder dan 1 tot 2 weken om voldoende tijd te hebben voor evaluatie van de therapeutische respons op een bepaalde dosis.
Ouderen en patiënten met nier- of leverinsufficiëntie
De klaring van mirtazapine is verminderd bij oudere patiënten en bij patiënten met een matige tot ernstige nier- of leverfunctiestoornis. De voorschrijver dient zich er daarom van bewust te zijn dat de plasmaspiegels van mirtazapine verhoogd kunnen zijn bij deze patiëntengroepen, vergeleken met de spiegels waargenomen bij jongere volwassenen zonder nier- of leverfunctiestoornis (zie PREVENTIEVE MAATREGELEN en KLINISCHE FARMACOLOGIE ).
Onderhoud/verlengde behandeling
Men is het er algemeen over eens dat acute episodes van depressie een aantal maanden of langer aanhoudende farmacologische therapie vereisen die verder gaan dan de respons op de acute episode. Systematische evaluatie van REMERON (mirtazapine)-tabletten heeft aangetoond dat de werkzaamheid ervan bij depressieve stoornissen tot 40 weken na 8 tot 12 weken initiële behandeling met een dosis van 15 tot 45 mg/dag behouden blijft (zie KLINISCHE FARMACOLOGIE ). Op basis van deze beperkte gegevens is het niet bekend of de dosis REMERON 30 mg die nodig is voor de onderhoudsbehandeling al dan niet identiek is aan de dosis die nodig is om een eerste respons te bereiken. Patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van een onderhoudsbehandeling en de juiste dosis voor een dergelijke behandeling te bepalen.
Overschakelen van een patiënt naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het staken van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen en het starten van de behandeling met REMERON (mirtazapine) tabletten. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met REMERON 30 mg voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen (zie CONTRA-INDICATIES ).
Gebruik van REMERON 15 mg met andere MAO-remmers, zoals linezolid of methyleenblauw
Start REMERON 15 mg niet bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen (zie: CONTRA-INDICATIES ).
In sommige gevallen kan een patiënt die al wordt behandeld met REMERON 30 mg dringend worden behandeld met linezolid of intraveneus methyleenblauw. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet REMERON 30 mg onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw blauw kan worden toegediend. De patiënt moet gedurende 2 weken of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet, worden gecontroleerd op symptomen van het serotoninesyndroom. De therapie met REMERON 30 mg kan 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw worden hervat (zie WAARSCHUWINGEN ).
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met REMERON is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik (zie: WAARSCHUWINGEN ).
Stopzetting van de behandeling met REMERON
Symptomen die verband houden met het stopzetten of verlagen van de dosering van REMERON 15 mg tabletten zijn gemeld. Patiënten moeten op deze en andere symptomen worden gecontroleerd wanneer de behandeling wordt stopgezet of wanneer de dosering wordt verlaagd. Waar mogelijk wordt een geleidelijke verlaging van de dosis gedurende meerdere weken aanbevolen in plaats van abrupt te stoppen. Als ondraaglijke symptomen optreden na verlaging van de dosis of na stopzetting van de behandeling, moet dosistitratie worden beheerd op basis van de klinische respons van de patiënt (zie PREVENTIEVE MAATREGELEN en ONGEWENSTE REACTIES ).
Informatie voor patiënten
Patiënten moeten erop worden gewezen dat het gebruik van REMERON lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen misschien worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn.
HOE GELEVERD
REMERON (mirtazapine) tabletten worden geleverd als:
15 mg-tabletten — ovaal, gekerfd, geel, gecoat, met "Organon" ingeslagen aan de ene kant en "T3Z" aan de andere kant.
Flessen van 30 NDC 0052-0105-30
30 mg-tabletten — ovaal, gekerfd, roodbruin, gecoat, met "Organon" ingeslagen aan de ene kant en "T5Z" aan de andere kant.
Flessen van 30 NDC 0052-0107-30
45 mg-tabletten — ovaal, wit, gecoat, met aan de ene kant “Organon” ingeslagen en aan de andere kant “T7Z”.
Flessen van 30 NDC 0052-0109-30
Opslag
Bewaren bij 20°C tot 25°C (68°F tot 77°F); excursies toegestaan tot 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen licht en vocht.
Gefabriceerd voor: Merck Sharp & Dohme Corp., een dochteronderneming van Merck & Co., Inc., Whitehouse Station, NJ 08889, VS. Gefabriceerd door: NV Organon, Oss, Nederland, een dochteronderneming van Merck & Co., Inc., Whitehouse Station, NJ 08889, VS. Herzien: juli 2016
BIJWERKINGEN
Geassocieerd met stopzetting van de behandeling
Ongeveer 16% van de 453 patiënten die REMERON (mirtazapine) tabletten kregen in Amerikaanse 6 weken durende gecontroleerde klinische onderzoeken stopte met de behandeling vanwege een bijwerking, vergeleken met 7% van de 361 met placebo behandelde patiënten in die onderzoeken. De meest voorkomende voorvallen (≥ 1%) die verband houden met stopzetting en die als geneesmiddelgerelateerd worden beschouwd (dwz die voorvallen die verband houden met uitval met een frequentie die ten minste tweemaal zo groot is als die van placebo) zijn opgenomen in Tabel 2.
Vaak waargenomen bijwerkingen in door de VS gecontroleerde klinische onderzoeken
De vaakst waargenomen bijwerkingen die verband houden met het gebruik van REMERON (mirtazapine) tabletten (incidentie van 5% of meer) en niet waargenomen bij een equivalente incidentie bij met placebo behandelde patiënten (REMERON-incidentie minstens tweemaal die voor placebo) staan vermeld in de tabel 3.
Bijwerkingen die optreden bij een incidentie van 1% of meer bij met REMERON behandelde patiënten
Tabel 4 somt bijwerkingen op die optraden met een incidentie van 1% of meer, en die vaker voorkwamen dan in de placebogroep, bij met REMERON (mirtazapine) tabletten behandelde patiënten die deelnamen aan kortdurende Amerikaanse placebogecontroleerde onderzoeken waarbij patiënten gedoseerd in een bereik van 5 tot 60 mg/dag. Deze tabel toont het percentage patiënten in elke groep die op enig moment tijdens hun behandeling ten minste 1 episode van een gebeurtenis hadden. Gemelde bijwerkingen werden geclassificeerd met behulp van een standaard op COSTART gebaseerde woordenboekterminologie.
De voorschrijver dient zich ervan bewust te zijn dat deze cijfers niet kunnen worden gebruikt om de incidentie van bijwerkingen in de loop van de gebruikelijke medische praktijk te voorspellen wanneer de kenmerken van de patiënt en andere factoren verschillen van die in de klinische onderzoeken. Evenzo kunnen de genoemde frequenties niet worden vergeleken met cijfers die zijn verkregen uit andere onderzoeken met verschillende behandelingen, toepassingen en onderzoekers. De aangehaalde cijfers bieden de voorschrijvende arts echter enige basis voor het schatten van de relatieve bijdrage van medicamenteuze en niet-medicamenteuze factoren aan de incidentie van bijwerkingen in de bestudeerde populatie.
ECG-wijzigingen
De elektrocardiogrammen voor 338 patiënten die REMERON (mirtazapine) tabletten kregen en 261 patiënten die placebo kregen in 6 weken durende, placebogecontroleerde onderzoeken werden geanalyseerd. Verlenging in QTc ≥ 500 msec werd niet waargenomen bij met mirtazapine behandelde patiënten; gemiddelde verandering in QTc was +1,6 msec voor mirtazapine en - 3,1 msec voor placebo. Mirtazapine ging gepaard met een gemiddelde verhoging van de hartslag van 3,4 bpm, vergeleken met 0,8 bpm voor placebo. De klinische betekenis van deze veranderingen is niet bekend.
Het effect van REMERON (mirtazapine) op het QTc-interval werd beoordeeld in een klinisch gerandomiseerd onderzoek met placebo en positieve (moxifloxacine) controles met 54 gezonde vrijwilligers met behulp van blootstellingsresponsanalyse. Dit onderzoek toonde een positieve relatie aan tussen mirtazapineconcentraties en verlenging van het QTc-interval. De mate van QT-verlenging die werd waargenomen met zowel 45 mg (therapeutische) als 75 mg (supratherapeutische) doses mirtazapine was echter niet op een niveau dat algemeen als klinisch relevant wordt beschouwd.
Andere bijwerkingen waargenomen tijdens de premarketingevaluatie van REMERON
Tijdens de premarketingbeoordeling werden in klinische onderzoeken meerdere doses REMERON (mirtazapine) tabletten toegediend aan 2796 patiënten. De omstandigheden en duur van blootstelling aan mirtazapine varieerden sterk en omvatten (in overlappende categorieën) open en dubbelblinde onderzoeken, ongecontroleerde en gecontroleerde onderzoeken, klinische en poliklinische onderzoeken, onderzoeken met vaste doses en titratie. Ongewenste gebeurtenissen in verband met deze blootstelling werden geregistreerd door klinische onderzoekers met behulp van terminologie naar eigen keuze. Bijgevolg is het niet mogelijk om een zinvolle schatting te geven van het aantal personen dat bijwerkingen ervaart zonder eerst soortgelijke soorten ongewenste voorvallen te groeperen in een kleiner aantal gestandaardiseerde gebeurteniscategorieën.
In de volgende tabellen werden gerapporteerde bijwerkingen geclassificeerd met behulp van een standaard op COSTART gebaseerde woordenboekterminologie. De gepresenteerde frequenties vertegenwoordigen daarom het aandeel van de 2796 patiënten die werden blootgesteld aan meerdere doses REMERON en die een voorval van het genoemde type op zijn minst 1 keer hebben meegemaakt tijdens het ontvangen van REMERON. Alle gemelde gebeurtenissen zijn inbegrepen, behalve die welke al in tabel 4 zijn vermeld, die bijwerkingen die zijn ondergebracht onder COSTART-termen die ofwel overdreven algemeen ofwel overdreven specifiek zijn om niet-informatief te zijn, en die gebeurtenissen waarvoor een medicijnoorzaak zeer ver weg was.
Het is belangrijk te benadrukken dat, hoewel de gemelde voorvallen tijdens de behandeling met REMERON 30 mg optraden, ze er niet noodzakelijk door werden veroorzaakt.
Gebeurtenissen worden verder gecategoriseerd per lichaamssysteem en gerangschikt in afnemende frequentie volgens de volgende definities: frequente bijwerkingen zijn bijwerkingen die bij 1 of meer gevallen optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn die voorkomen bij 1/100 tot 1/1000 patiënten; zeldzame voorvallen zijn die bij minder dan 1/1000 patiënten. Alleen die gebeurtenissen die nog niet in tabel 4 zijn vermeld, verschijnen in deze lijst. Gebeurtenissen van groot klinisch belang worden ook beschreven in de secties WAARSCHUWINGEN en VOORZORGSMAATREGELEN.
Lichaam als geheel: frequent: malaise, buikpijn, acuut abdominaal syndroom; zeldzaam: koude rillingen, koorts, gezichtsoedeem, zweer, fotosensibiliteitsreactie, nekstijfheid, nekpijn, opgezette buik; zelden: cellulitis, substernale pijn op de borst.
Cardiovasculair systeem: frequent: hypertensie, vasodilatatie; zeldzaam: angina pectoris, myocardinfarct, bradycardie, ventriculaire extrasystolen, syncope, migraine, hypotensie; zelden: atriale aritmie, bigeminy, vasculaire hoofdpijn, longembolie, cerebrale ischemie, cardiomegalie, flebitis, linkerhartfalen.
Spijsverteringsstelsel: vaak: braken, anorexia; zeldzaam: oprispingen, glossitis, cholecystitis, misselijkheid en braken, tandvleesbloeding, stomatitis, colitis, abnormale leverfunctietesten; zelden: tongverkleuring, ulceratieve stomatitis, speekselkliervergroting, verhoogde speekselvloed, darmobstructie, pancreatitis, afteuze stomatitis, levercirrose, gastritis, gastro-enteritis, orale moniliasis, tongoedeem.
Endocrien systeem: zelden: struma, hypothyreoïdie.
Hemic en lymfatisch systeem: zelden: lymfadenopathie, leukopenie, petechiën, anemie, trombocytopenie, lymfocytose, pancytopenie.
Metabole en voedingsstoornissen: frequent: dorst; zeldzaam: uitdroging, gewichtsverlies; zelden: jicht, verhoogde SGOT, abnormale genezing, verhoogde zure fosfatase, verhoogde SGPT, diabetes mellitus, hyponatriëmie.
Musculoskeletaal systeem: frequent: myasthenie, artralgie; zeldzaam: artritis, tenosynovitis; zelden: pathologische fractuur, osteoporosefractuur, botpijn, myositis, peesruptuur, artrose, bursitis.
Zenuwstelsel: vaak: hypesthesie, apathie, depressie, hypokinesie, duizeligheid, spiertrekkingen, opwinding, angst, geheugenverlies, hyperkinesie, paresthesie; zeldzaam: ataxie, delirium, wanen, depersonalisatie, dyskinesie, extrapiramidaal syndroom, verhoogd libido, abnormale coördinatie, dysartrie, hallucinaties, manische reactie, neurose, dystonie, vijandigheid, verhoogde reflexen, emotionele labiliteit, euforie, paranoïde reactie; zelden: afasie, nystagmus, acathisie (psychomotorische rusteloosheid), stupor, dementie, diplopie, drugsverslaving, verlamming, grand mal convulsie, hypotonie, myoclonus, psychotische depressie, ontwenningssyndroom, serotoninesyndroom.
Ademhalingssysteem: vaak: toegenomen hoest, sinusitis; zeldzaam: epistaxis, bronchitis, astma, longontsteking; zelden: verstikking, laryngitis, pneumothorax, hik.
Huid en aanhangsels: vaak: jeuk, uitslag; zeldzaam: acne, exfoliatieve dermatitis, droge huid, herpes simplex, alopecia; zelden: urticaria, herpes zoster, huidhypertrofie, seborroe, huidzweer.
Speciale zintuigen: zeldzaam: oogpijn, abnormale accommodatie, conjunctivitis, doofheid, keratoconjunctivitis, traanstoornis, geslotenhoekglaucoom, hyperacusis, oorpijn; zelden: blefaritis, gedeeltelijke voorbijgaande doofheid, middenoorontsteking, smaakverlies, parosmie.
Urogenitaal systeem: frequent: urineweginfectie; zeldzaam: niersteen, cystitis, dysurie, urine-incontinentie, urineretentie, vaginitis, hematurie, borstpijn, amenorroe, dysmenorroe, leukorroe, impotentie; zelden: polyurie, urethritis, metrorragie, menorragie, abnormale ejaculatie, stuwing van de borsten, borstvergroting, urinaire urgentie.
Andere bijwerkingen waargenomen tijdens postmarketingevaluatie van REMERON
Bijwerkingen die sinds de introductie op de markt zijn gemeld en die tijdelijk (maar niet noodzakelijk causaal) verband hielden met de behandeling met mirtazapine, omvatten gevallen van de ventriculaire aritmie Torsades de Pointes. In de meeste van deze gevallen waren echter gelijktijdige geneesmiddelen betrokken. Gevallen van ernstige huidreacties, waaronder Stevens-Johnson-syndroom, bulleuze dermatitis, erythema multiforme en toxische epidermale necrolyse zijn ook gemeld. Verhoogde bloedspiegels van creatinekinase en rabdomyolyse zijn ook gemeld.
Drugsmisbruik en afhankelijkheid
Klasse gereguleerde stof
REMERON (mirtazapine) Tabletten zijn geen gereguleerde stof.
Fysieke en psychologische afhankelijkheid
REMERON (mirtazapine) Tabletten zijn niet systematisch onderzocht bij dieren of mensen vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. Hoewel de klinische onderzoeken geen neiging tot enig zoekgedrag naar drugs aan het licht brachten, waren deze waarnemingen niet systematisch en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in welke mate een geneesmiddel dat op het centrale zenuwstelsel werkt, zal worden misbruikt, omgeleid en /of misbruikt als het eenmaal op de markt is gebracht. Patiënten moeten daarom zorgvuldig worden beoordeeld op voorgeschiedenis van drugsmisbruik en dergelijke patiënten moeten nauwlettend worden geobserveerd op tekenen van misbruik of misbruik van REMERON (bijv. ontwikkeling van tolerantie, dosisverhogingen, gedrag bij het zoeken naar geneesmiddelen).
DRUG-INTERACTIES
Net als bij andere geneesmiddelen is de mogelijkheid van interactie door een verscheidenheid aan mechanismen (bijv. farmacodynamische, farmacokinetische remming of verbetering, enz.) een mogelijkheid (zie KLINISCHE FARMACOLOGIE ).
Monoamineoxidaseremmers
(Zien CONTRA-INDICATIES , WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE .)
Serotonerge geneesmiddelen
(Zien CONTRA-INDICATIES en WAARSCHUWINGEN .)
Geneesmiddelen die het levermetabolisme beïnvloeden
Het metabolisme en de farmacokinetiek van REMERON (mirtazapine) tabletten kunnen worden beïnvloed door de inductie of remming van geneesmiddelmetaboliserende enzymen.
Geneesmiddelen die worden gemetaboliseerd door en/of cytochroom P450-enzymen remmen
CYP-enzyminductoren
(deze onderzoeken gebruikten beide geneesmiddelen in een stabiele toestand)
fenytoïne
Bij gezonde mannelijke patiënten (n=18) verhoogde fenytoïne (200 mg per dag) de klaring van mirtazapine (30 mg per dag) met een factor 2, wat resulteerde in een verlaging van de gemiddelde plasmaconcentraties van mirtazapine met 45%. Mirtazapine had geen significante invloed op de farmacokinetiek van fenytoïne.
Carbamazepine
Bij gezonde mannelijke patiënten (n=24) verhoogde carbamazepine (400 mg tweemaal daags) de klaring van mirtazapine (15 mg tweemaal daags) ongeveer 2-voudig, wat resulteerde in een verlaging van de gemiddelde plasmaconcentraties van mirtazapine met 60%.
Wanneer fenytoïne, carbamazepine of een andere inductor van levermetabolisme (zoals rifampicine) wordt toegevoegd aan de behandeling met mirtazapine, moet de dosis mirtazapine mogelijk worden verhoogd. Als de behandeling met een dergelijk geneesmiddel wordt stopgezet, kan het nodig zijn de dosis mirtazapine te verlagen.
CYP-enzymremmers
cimetidine
Bij gezonde mannelijke patiënten (n=12), wanneer cimetidine, een zwakke remmer van CYP1A2, CYP2D6 en CYP3A4, toegediend in een dosis van 800 mg tweemaal daags bij steady-state, gelijktijdig werd toegediend met mirtazapine (30 mg per dag) in steady-state, de Area Under the Curve (AUC) van mirtazapine steeg met meer dan 50%. Mirtazapine veroorzaakte geen relevante veranderingen in de farmacokinetiek van cimetidine. De dosis mirtazapine moet mogelijk worden verlaagd wanneer een gelijktijdige behandeling met cimetidine wordt gestart, of moet worden verhoogd wanneer de behandeling met cimetidine wordt stopgezet.
Ketoconazol
Bij gezonde, mannelijke, blanke patiënten (n=24) verhoogde gelijktijdige toediening van de krachtige CYP3A4-remmer ketoconazol (200 mg tweemaal daags gedurende 6,5 dagen) de piekplasmaspiegels en de AUC van een enkelvoudige dosis van 30 mg mirtazapine met ongeveer 40% en respectievelijk 50%.
Voorzichtigheid is geboden bij gelijktijdige toediening van mirtazapine met krachtige CYP3A4-remmers, HIV-proteaseremmers, azol-antischimmelmiddelen, erytromycine of nefazodon.
Paroxetine
In een in vivo interactieonderzoek bij gezonde patiënten met CYP2D6-extensieve metaboliseerders (n=24), veroorzaakte mirtazapine (30 mg/dag) bij steady-state geen relevante veranderingen in de farmacokinetiek van paroxetine bij steady-state (40 mg/dag), een CYP2D6-remmer.
Andere interacties tussen geneesmiddelen
Amitriptyline
Bij gezonde patiënten met CYP2D6-extensieve metaboliseerders (n=32) veroorzaakte amitriptyline (75 mg per dag) bij steady state geen relevante veranderingen in de farmacokinetiek van mirtazapine in steady state (30 mg per dag); mirtazapine veroorzaakte ook geen relevante veranderingen in de farmacokinetiek van amitriptyline.
Warfarine
Bij gezonde mannelijke proefpersonen (n=16) veroorzaakte mirtazapine (30 mg per dag) bij steady-state een kleine (0,2) maar statistisch significante toename van de International Normalised Ratio (INR) bij proefpersonen die werden behandeld met warfarine. Aangezien bij een hogere dosis mirtazapine een meer uitgesproken effect niet kan worden uitgesloten, is het raadzaam de INR te controleren bij gelijktijdige behandeling van warfarine en mirtazapine.
Lithium
Er zijn geen relevante klinische effecten of significante veranderingen in de farmacokinetiek waargenomen bij gezonde mannelijke proefpersonen die gelijktijdig werden behandeld met subtherapeutische lithiumspiegels (600 mg/dag gedurende 10 dagen) in steady state en een enkelvoudige dosis van 30 mg mirtazapine. De effecten van hogere doses lithium op de farmacokinetiek van mirtazapine zijn niet bekend.
Risperidon
In een in vivo, niet-gerandomiseerd, interactieonderzoek toonden proefpersonen (n=6) die behandeling met een antipsychoticum en antidepressivum nodig hadden, aan dat mirtazapine (30 mg per dag) bij steady state geen invloed had op de farmacokinetiek van risperidon (tot 3 mg bod).
Alcohol
Gelijktijdige toediening van alcohol (overeenkomend met 60 g) had een minimaal effect op de plasmaspiegels van mirtazapine (15 mg) bij 6 gezonde mannelijke proefpersonen. Er werd echter aangetoond dat de door REMERON veroorzaakte verslechtering van cognitieve en motorische vaardigheden samengaat met die van alcohol. Dienovereenkomstig moeten patiënten worden geadviseerd alcohol te vermijden tijdens het gebruik van REMERON.
diazepam
Gelijktijdige toediening van diazepam (15 mg) had een minimaal effect op de plasmaspiegels van mirtazapine (15 mg) bij 12 gezonde proefpersonen. Er is echter aangetoond dat de verslechtering van de motorische vaardigheden die wordt veroorzaakt door REMERON 30 mg, samengaat met die veroorzaakt door diazepam. Dienovereenkomstig moeten patiënten worden geadviseerd diazepam en andere soortgelijke geneesmiddelen te vermijden tijdens het gebruik van REMERON.
QTc-verlengende medicijnen
Het risico op QT-verlenging en/of ventriculaire aritmieën (bijv. Torsades de Pointes) kan verhoogd zijn bij gelijktijdig gebruik van geneesmiddelen die het QTc-interval verlengen (bijv. sommige antipsychotica en antibiotica) en in geval van overdosering met mirtazapine (zie ONGEWENSTE REACTIES en OVERDOSERING secties).
WAARSCHUWINGEN
Klinische verslechtering en zelfmoordrisico
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18-24 jaar) met depressieve stoornis (MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit bij verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel vs. placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in Tabel 1.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor REMERON (mirtazapine) Tabletten moeten worden geschreven voor de kleinste hoeveelheid tabletten in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat REMERON (mirtazapine) tabletten niet zijn goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
Agranulocytose
In klinische premarketingonderzoeken ontwikkelden 2 (1 met het syndroom van Sjögren) van de 2796 patiënten die werden behandeld met REMERON (mirtazapine) tabletten agranulocytose [absoluut aantal neutrofielen (ANC)
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld met SNRI's en SSRI's, waaronder REMERON 30 mg, alleen maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron en sint-janskruid), en met geneesmiddelen die het metabolisme van serotonine aantasten (in het bijzonder MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid en intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van REMERON 15 mg met MAO-remmers bedoeld voor de behandeling van psychiatrische stoornissen is gecontra-indiceerd. REMERON mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die REMERON gebruikt. REMERON 15 mg moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart (zie: CONTRA-INDICATIES en DOSERING EN ADMINISTRATIE ).
Als gelijktijdig gebruik van REMERON 30 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan en sint-janskruid klinisch gerechtvaardigd is, moet u zich bewust zijn van een mogelijk verhoogd risico op het serotoninesyndroom, vooral tijdens start van de behandeling en dosisverhogingen.
De behandeling met REMERON 30 mg en alle gelijktijdig gebruikte serotonerge middelen moet onmiddellijk worden stopgezet als de bovenstaande voorvallen optreden en er moet een ondersteunende symptomatische behandeling worden gestart.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder REMERON 15 mg, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
QT-verlenging en torsades de pointes
Het effect van REMERON (mirtazapine) op het QTc-interval werd beoordeeld in een klinisch gerandomiseerd onderzoek met placebo en positieve (moxifloxacine) controles met 54 gezonde vrijwilligers met behulp van blootstellingsresponsanalyse. Dit onderzoek toonde een positieve relatie aan tussen mirtazapineconcentraties en verlenging van het QTc-interval. De mate van QT-verlenging die werd waargenomen met zowel 45 mg (therapeutische) als 75 mg (supratherapeutische) doses mirtazapine was echter niet op een niveau dat algemeen als klinisch relevant wordt beschouwd. Tijdens het postmarketinggebruik van mirtazapine zijn gevallen van QT-verlenging, torsades de pointes, ventriculaire tachycardie en plotselinge dood gemeld (zie ONGEWENSTE REACTIES ). De meeste meldingen deden zich voor in verband met overdosering of bij patiënten met andere risicofactoren voor QT-verlenging, waaronder gelijktijdig gebruik van QTc-verlengende geneesmiddelen (zie DRUG-INTERACTIES en OVERDOSERING secties). Voorzichtigheid is geboden wanneer REMERON wordt voorgeschreven aan patiënten met een bekende cardiovasculaire aandoening of een familiegeschiedenis van QT-verlenging, en bij gelijktijdig gebruik met andere geneesmiddelen waarvan wordt aangenomen dat ze het QTc-interval verlengen.
PREVENTIEVE MAATREGELEN
Algemeen
Stopzetting Symptomen
Er zijn meldingen geweest van bijwerkingen na stopzetting van REMERON (mirtazapine)-tabletten (vooral wanneer abrupt), inclusief maar niet beperkt tot het volgende: duizeligheid, abnormale dromen, sensorische stoornissen (inclusief paresthesie en elektrische schokken), agitatie, angst, vermoeidheid, verwardheid, hoofdpijn, tremor, misselijkheid, braken en zweten, of andere symptomen die van klinische betekenis kunnen zijn. De meerderheid van de gemelde gevallen is mild en zelfbeperkend. Hoewel deze zijn gemeld als bijwerkingen, moet men zich realiseren dat deze symptomen verband kunnen houden met een onderliggende ziekte.
Patiënten die momenteel REMERON gebruiken, mogen de behandeling NIET abrupt staken vanwege het risico op ontwenningsverschijnselen. Op het moment dat een medische beslissing wordt genomen om de behandeling met REMERON stop te zetten, wordt een geleidelijke verlaging van de dosis aanbevolen in plaats van een abrupte stopzetting.
Acathisie/psychomotorische rusteloosheid
Het gebruik van antidepressiva is in verband gebracht met de ontwikkeling van acathisie, gekenmerkt door een subjectief onaangename of verontrustende rusteloosheid en behoefte om te bewegen, vaak vergezeld van een onvermogen om stil te zitten of te staan. Dit is het meest waarschijnlijk in de eerste paar weken van de behandeling. Bij patiënten die deze symptomen ontwikkelen, kan het verhogen van de dosis nadelig zijn.
Hyponatriëmie
Hyponatriëmie is zeer zelden gemeld bij het gebruik van mirtazapine. Voorzichtigheid is geboden bij risicopatiënten, zoals oudere patiënten of patiënten die gelijktijdig worden behandeld met geneesmiddelen waarvan bekend is dat ze hyponatriëmie veroorzaken.
Slaperigheid
In door de VS gecontroleerde onderzoeken werd slaperigheid gemeld bij 54% van de patiënten die werden behandeld met REMERON (mirtazapine) tabletten, vergeleken met 18% voor placebo en 60% voor amitriptyline. In deze onderzoeken resulteerde slaperigheid in stopzetting van 10,4% van de met REMERON behandelde patiënten, vergeleken met 2,2% voor placebo. Het is onduidelijk of er al dan niet tolerantie ontstaat voor de slaperige effecten van REMERON. Vanwege de mogelijk significante effecten van REMERON 30 mg op prestatievermindering, moeten patiënten worden gewaarschuwd voor activiteiten die alertheid vereisen totdat ze het effect van het geneesmiddel op hun eigen psychomotorische prestaties hebben kunnen beoordelen (zie PATIËNT INFORMATIE ).
Duizeligheid
In door de VS gecontroleerde onderzoeken werd duizeligheid gemeld bij 7% van de patiënten die met REMERON werden behandeld, vergeleken met 3% voor placebo en 14% voor amitriptyline. Het is onduidelijk of er tolerantie ontstaat voor de duizeligheid die wordt waargenomen in verband met het gebruik van REMERON.
Verhoogde eetlust/gewichtstoename
In door de VS gecontroleerde onderzoeken werd een toename van de eetlust gemeld bij 17% van de patiënten die werden behandeld met REMERON 30 mg, vergeleken met 2% voor placebo en 6% voor amitriptyline. In dezelfde onderzoeken werd een gewichtstoename van ≥ 7% van het lichaamsgewicht gemeld bij 7,5% van de patiënten die met mirtazapine werden behandeld, vergeleken met 0% voor placebo en 5,9% voor amitriptyline. In een pool van premarketingstudies in de VS, waaronder veel patiënten voor langdurige, open-labelbehandeling, stopte 8% van de patiënten die REMERON 30 mg kregen vanwege gewichtstoename. In een 8 weken durende pediatrische klinische studie met doses tussen 15 en 45 mg/dag, had 49% van de met REMERON behandelde patiënten een gewichtstoename van ten minste 7%, vergeleken met 5,7% van de met placebo behandelde patiënten (zie PREVENTIEVE MAATREGELEN : Pediatrisch gebruik ).
Cholesterol/triglyceriden
In door de VS gecontroleerde onderzoeken werden niet-nuchtere cholesterolverhogingen tot ≥ 20% boven de bovengrens van normaal waargenomen bij 15% van de patiënten die werden behandeld met REMERON 30 mg, vergeleken met 7% voor placebo en 8% voor amitriptyline. In dezelfde onderzoeken werden niet-nuchtere verhogingen van triglyceriden tot ≥ 500 mg/dl waargenomen bij 6% van de met mirtazapine behandelde patiënten, vergeleken met 3% voor placebo en 3% voor amitriptyline.
Transaminase-verhogingen
Klinisch significante verhogingen van ALAT (SGPT) (≥ 3 maal de bovengrens van het normale bereik) werden waargenomen bij 2,0% (8/244) van de patiënten die werden blootgesteld aan REMERON 30 mg in een pool van kortlopende gecontroleerde onderzoeken in de VS, vergeleken met 0,3% (1/328) van de placebopatiënten en 2,0% (3/181) van de amitriptylinepatiënten. De meeste van deze patiënten met verhoogde ALAT-waarden ontwikkelden geen tekenen of symptomen die verband hielden met een verminderde leverfunctie. Terwijl sommige patiënten werden gestaakt vanwege de ALT-verhogingen, keerden de enzymspiegels in andere gevallen terug naar normaal ondanks voortgezette behandeling met REMERON. REMERON moet met voorzichtigheid worden gebruikt bij patiënten met een verminderde leverfunctie (zie: KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ).
Activering van manie/hypomanie
Manie/hypomanie trad op bij ongeveer 0,2% (3/1299 patiënten) van de met REMERON behandelde patiënten in Amerikaanse onderzoeken. Hoewel de incidentie van manie/hypomanie erg laag was tijdens de behandeling met mirtazapine, moet het voorzichtig worden gebruikt bij patiënten met een voorgeschiedenis van manie/hypomanie.
Hartinfarct
In klinische premarketingonderzoeken werd slechts 1 aanval gemeld bij de 2796 Amerikaanse en niet-Amerikaanse patiënten die met REMERON werden behandeld. Er zijn echter geen gecontroleerde onderzoeken uitgevoerd bij patiënten met een voorgeschiedenis van epileptische aanvallen. Daarom is voorzichtigheid geboden wanneer mirtazapine bij deze patiënten wordt gebruikt.
Gebruik bij patiënten met gelijktijdige ziekte
Klinische ervaring met REMERON bij patiënten met gelijktijdige systemische ziekte is beperkt. Dienovereenkomstig is voorzichtigheid geboden bij het voorschrijven van mirtazapine aan patiënten met ziekten of aandoeningen die het metabolisme of de hemodynamische reacties beïnvloeden.
REMERON is niet systematisch geëvalueerd of in noemenswaardige mate gebruikt bij patiënten met een recente voorgeschiedenis van een myocardinfarct of andere significante hartziekte. REMERON werd in verband gebracht met significante orthostatische hypotensie in vroege klinische farmacologische onderzoeken met normale vrijwilligers. Orthostatische hypotensie werd zelden waargenomen in klinische onderzoeken met depressieve patiënten. REMERON 15 mg moet met voorzichtigheid worden gebruikt bij patiënten met een bekende cardiovasculaire of cerebrovasculaire aandoening die kan worden verergerd door hypotensie (voorgeschiedenis van myocardinfarct, angina of ischemische beroerte) en bij aandoeningen die patiënten vatbaar maken voor hypotensie (dehydratie, hypovolemie en behandeling met antihypertensiva). medicatie).
De klaring van mirtazapine is verminderd bij patiënten met een matige [glomerulaire filtratiesnelheid (GFR)=11 - 39 ml/min/1,73 m²] en ernstige [GFR KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ).
Informatie voor patiënten
Voorschrijvers of andere gezondheidswerkers moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van de behandeling met REMERON (mirtazapine) tabletten en hen adviseren bij het juiste gebruik ervan. Een patiënt Medicatiegids over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties" is beschikbaar voor REMERON. De voorschrijver of zorgverlener moet patiënten, hun families en hun zorgverleners instrueren om de Medicatiegids en zou hen moeten helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de Medicatiegids en om antwoord te krijgen op al hun vragen. De volledige tekst van de Medicatiegids wordt herdrukt aan het einde van dit document.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze zich voordoen tijdens het gebruik van REMERON.
Klinische verslechtering en zelfmoordrisico
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten aan de voorschrijver van de patiënt of gezondheidswerker worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen die de patiënt vertoont. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak tot zeer nauwgezette monitoring en mogelijk wijzigingen in de medicatie.
Agranulocytose
Patiënten die REMERON krijgen, moeten worden gewaarschuwd voor het risico op het ontwikkelen van agranulocytose. Patiënten moeten het advies krijgen om contact op te nemen met hun arts als ze een indicatie van een infectie ervaren, zoals koorts, koude rillingen, keelpijn, ulceratie van de slijmvliezen of andere mogelijke tekenen van infectie. Bijzondere aandacht moet worden besteed aan griepachtige klachten of andere symptomen die op een infectie kunnen wijzen.
Interferentie met cognitieve en motorische prestaties
REMERON 15 mg kan het beoordelingsvermogen, het denken en in het bijzonder de motoriek aantasten vanwege het duidelijke kalmerende effect. De slaperigheid die gepaard gaat met het gebruik van mirtazapine kan de rijvaardigheid, het vermogen om machines te bedienen of taken uit te voeren die alertheid vereisen, verminderen. Daarom moeten patiënten worden gewaarschuwd voor het ondernemen van gevaarlijke activiteiten totdat ze er redelijk zeker van zijn dat de behandeling met REMERON hun vermogen om dergelijke activiteiten uit te voeren niet nadelig beïnvloedt.
Therapiecursus afronden
Hoewel patiënten na 1 tot 4 weken verbetering kunnen merken met de behandeling met REMERON 15 mg, moet hen worden geadviseerd de behandeling voort te zetten zoals voorgeschreven.
Gelijktijdige medicatie
Patiënten moeten worden geadviseerd hun arts te informeren als zij geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, aangezien er een kans bestaat dat REMERON wisselwerkingen heeft met andere geneesmiddelen.
Patiënten moeten bewust worden gemaakt van een mogelijk verhoogd risico op het serotoninesyndroom als gelijktijdig gebruik van REMERON 15 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan en sint-janskruid klinisch gerechtvaardigd is, vooral tijdens de start van de behandeling en bij dosisverhogingen.
Alcohol
Het is aangetoond dat de aantasting van cognitieve en motorische vaardigheden die door REMERON wordt veroorzaakt, samengaat met die van alcohol. Dienovereenkomstig moeten patiënten worden geadviseerd alcohol te vermijden tijdens het gebruik van mirtazapine.
Zwangerschap
Patiënten moeten worden geadviseerd om hun arts op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met REMERON.
Verpleegkunde
Patiënten moeten worden geadviseerd om hun arts op de hoogte te stellen als ze borstvoeding geven aan een baby.
Laboratorium testen
Er worden geen routinematige laboratoriumtests aanbevolen.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Er zijn carcinogeniteitsonderzoeken uitgevoerd met mirtazapine dat via de voeding werd toegediend in doses van 2, 20 en 200 mg/kg/dag aan muizen en van 2, 20 en 60 mg/kg/dag aan ratten. De hoogste gebruikte doses zijn ongeveer 20 en 12 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 45 mg/dag op basis van mg/m² bij respectievelijk muizen en ratten. Er was een verhoogde incidentie van hepatocellulair adenoom en carcinoom bij mannelijke muizen bij de hoge dosis. Bij ratten was er een toename van hepatocellulair adenoom bij vrouwtjes bij de middelhoge en hoge doses en bij hepatocellulaire tumoren en folliculair adenoom/cystadenoom van de schildklier en carcinoom bij mannetjes bij de hoge dosis. De gegevens suggereren dat de bovenstaande effecten mogelijk gemedieerd kunnen worden door niet-genotoxische mechanismen, waarvan de relevantie voor de mens niet bekend is.
De doses die in het muizenonderzoek werden gebruikt, waren mogelijk niet hoog genoeg om het carcinogene potentieel van REMERON (mirtazapine) tabletten volledig te karakteriseren.
Mutagenese
Mirtazapine was niet mutageen of clastogeen en veroorzaakte geen algemene DNA-schade zoals bepaald in verschillende genotoxiciteitstesten: Ames-test, in vitro genmutatietest in V 79-cellen van de Chinese hamster, in vitro zusterchromatidenuitwisselingstest in gekweekte konijnenlymfocyten, in vivo beenmerg micronucleustest bij ratten en ongeplande DNA-synthesetest in HeLa-cellen.
Aantasting van de vruchtbaarheid
In een vruchtbaarheidsonderzoek bij ratten werd mirtazapine gegeven in doses tot 100 mg/kg [20 maal de maximaal aanbevolen dosis voor de mens (MRHD) op basis van mg/m2]. Paring en conceptie werden niet beïnvloed door het medicijn, maar de oestrische cyclus werd verstoord bij doses die 3 of meer keer de MRHD waren, en pre-implantatieverliezen traden op bij 20 keer de MRHD.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Voortplantingsonderzoeken bij drachtige ratten en konijnen met doses tot respectievelijk 100 mg/kg en 40 mg/kg [respectievelijk 20 en 17 maal de maximaal aanbevolen dosis voor de mens (MRHD) op basis van mg/m²], hebben geen bewijs opgeleverd voor teratogene effecten. Bij ratten was er echter een toename van postimplantatieverliezen bij moederdieren die met mirtazapine werden behandeld. Er was een toename van het aantal jongensterfte tijdens de eerste 3 dagen van de lactatie en een afname van het geboortegewicht van de pups. De oorzaak van deze sterfgevallen is niet bekend. De effecten traden op bij doses die 20 keer de MRHD waren, maar niet bij 3 keer de MRHD, op basis van mg/m². Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Moeders die borstvoeding geven
Omdat sommige REMERON in de moedermelk kunnen worden uitgescheiden, is voorzichtigheid geboden wanneer REMERON (mirtazapine) tabletten worden toegediend aan vrouwen die borstvoeding geven.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld (zie: GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN : Klinische verslechtering en zelfmoordrisico ). Twee placebogecontroleerde onderzoeken bij 258 pediatrische patiënten met MDD zijn uitgevoerd met REMERON (mirtazapine) tabletten en de gegevens waren niet voldoende om een claim voor gebruik bij pediatrische patiënten te ondersteunen. Iedereen die het gebruik van REMERON 30 mg bij een kind of adolescent overweegt, moet de mogelijke risico's afwegen tegen de klinische noodzaak.
In een 8 weken durende pediatrische klinische studie met doses tussen 15 en 45 mg/dag, had 49% van de met REMERON behandelde patiënten een gewichtstoename van ten minste 7%, vergeleken met 5,7% van de met placebo behandelde patiënten. De gemiddelde gewichtstoename was 4 kg (2 kg SD) voor met REMERON behandelde patiënten versus 1 kg (2 kg SD) voor met placebo behandelde patiënten (zie PREVENTIEVE MAATREGELEN : Verhoogde eetlust/gewichtstoename ).
Geriatrisch gebruik
Ongeveer 190 oudere personen (≥ 65 jaar) namen deel aan klinische onderzoeken met REMERON (mirtazapine) tabletten. Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden (75%) en het risico op verminderde klaring van dit geneesmiddel is groter bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering. Sederende medicijnen kunnen bij ouderen verwarring en oversedatie veroorzaken. In deze groep werden geen ongebruikelijke nadelige leeftijdsgerelateerde verschijnselen vastgesteld. Farmacokinetische studies lieten een verminderde klaring zien bij ouderen. Voorzichtigheid is geboden bij het toedienen van REMERON aan oudere patiënten (zie: KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE ).
OVERDOSERING
Menselijke ervaring
Er is zeer beperkte ervaring met overdosering van REMERON (mirtazapine) tabletten. In klinische premarketingonderzoeken waren er 8 meldingen van overdosering van REMERON, alleen of in combinatie met andere farmacologische middelen. De enige dood door overdosis die werd gemeld tijdens het gebruik van REMERON was in combinatie met amitriptyline en chloorprothixeen in een niet-Amerikaanse klinische studie. Op basis van de plasmaspiegels was de ingenomen dosis REMERON 15 mg 30 tot 45 mg, terwijl de plasmaspiegels van amitriptyline en chloorprothixeen toxisch bleken te zijn. Alle andere gevallen van overdosering vóór het in de handel brengen resulteerden in volledig herstel. Tekenen en symptomen die in verband met overdosering werden gemeld, waren onder meer desoriëntatie, slaperigheid, verminderd geheugen en tachycardie. Er waren geen meldingen van ECG-afwijkingen, coma of convulsies na overdosering met alleen REMERON.
Op basis van postmarketingrapporten is er echter een mogelijkheid van ernstigere gevolgen (inclusief dodelijke afloop) bij doseringen die veel hoger zijn dan de therapeutische dosis, vooral bij gemengde overdoses. In deze gevallen zijn ook QT-verlenging en torsades de pointes gemeld (zie: DRUG-INTERACTIES en ONGEWENSTE REACTIES secties).
Beheer van overdosis
De behandeling moet bestaan uit die algemene maatregelen die worden genomen bij de behandeling van overdosering met een geneesmiddel dat effectief is bij de behandeling van depressieve stoornissen. Zorg voor een adequate luchtweg, zuurstofvoorziening en ventilatie. Monitor ECG-parameters (inclusief hartritme) en vitale functies. Algemene ondersteunende en symptomatische maatregelen worden ook aanbevolen. Inductie van braken wordt niet aanbevolen. Maagspoeling met een orogastrische sonde met grote diameter en geschikte luchtwegbescherming, indien nodig, kan geïndiceerd zijn als deze kort na inname of bij symptomatische patiënten wordt uitgevoerd. Er moet actieve kool worden toegediend. Er is geen ervaring met het gebruik van geforceerde diurese, dialyse, hemoperfusie of wisseltransfusie bij de behandeling van overdosering met mirtazapine. Er zijn geen specifieke antidota bekend voor mirtazapine.
Overweeg bij het behandelen van overdosering de mogelijkheid van betrokkenheid van meerdere geneesmiddelen. De arts moet overwegen contact op te nemen met een antigifcentrum voor aanvullende informatie over de behandeling van een overdosis. Telefoonnummers van gecertificeerde antigifcentra staan vermeld in de Physicians' Desk Reference (PDR).
CONTRA-INDICATIES
overgevoeligheid
REMERON (mirtazapine) Tabletten zijn gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor mirtazapine of voor een van de hulpstoffen.
Monoamineoxidaseremmers
Het gebruik van monoamineoxidaseremmers (MAO-remmers) bedoeld voor de behandeling van psychiatrische stoornissen met REMERON 15 mg tabletten of binnen 14 dagen na het stoppen van de behandeling met REMERON 15 mg is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van REMERON 15 mg binnen 14 dagen na het stoppen van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen is ook gecontra-indiceerd (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Het starten van REMERON bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
KLINISCHE FARMACOLOGIE
farmacodynamiek
Het werkingsmechanisme van REMERON (mirtazapine) tabletten, net als bij andere geneesmiddelen die effectief zijn bij de behandeling van depressieve stoornis, is onbekend.
Bewijs verzameld in preklinische onderzoeken suggereert dat mirtazapine de centrale noradrenerge en serotonerge activiteit verbetert. Deze onderzoeken hebben aangetoond dat mirtazapine werkt als een antagonist op centrale presynaptische α2-adrenerge remmende autoreceptoren en heteroreceptoren, een werking waarvan wordt aangenomen dat deze leidt tot een toename van de centrale noradrenerge en serotonerge activiteit.
Mirtazapine is een krachtige antagonist van de 5-HT2- en 5-HT3-receptoren. Mirtazapine heeft geen significante affiniteit voor de 5-HT1A- en 5-HT1B-receptoren.
Mirtazapine is een krachtige antagonist van histamine (H1)-receptoren, een eigenschap die de prominente sedatieve effecten ervan kan verklaren.
Mirtazapine is een matige perifere α-adrenerge antagonist, een eigenschap die de occasionele orthostatische hypotensie die in verband met het gebruik ervan is gemeld, kan verklaren.
Mirtazapine is een matige antagonist van de muscarinereceptoren, een eigenschap die de relatief lage incidentie van anticholinerge bijwerkingen in verband met het gebruik ervan kan verklaren.
Farmacokinetiek
REMERON (mirtazapine) Tabletten worden snel en volledig geabsorbeerd na orale toediening en hebben een halfwaardetijd van ongeveer 20 tot 40 uur. Piekplasmaconcentraties worden bereikt binnen ongeveer 2 uur na een orale dosis. De aanwezigheid van voedsel in de maag heeft een minimaal effect op zowel de snelheid als de mate van absorptie en vereist geen dosisaanpassing.
Mirtazapine wordt uitgebreid gemetaboliseerd na orale toediening. De belangrijkste routes van biotransformatie zijn demethylering en hydroxylering gevolgd door glucuronideconjugatie. In-vitrogegevens van humane levermicrosomen geven aan dat cytochroom 2D6 en 1A2 betrokken zijn bij de vorming van de 8-hydroxymetaboliet van mirtazapine, terwijl cytochroom 3A verantwoordelijk wordt geacht voor de vorming van de N-desmethyl- en N-oxide-metaboliet. Mirtazapine heeft een absolute biologische beschikbaarheid van ongeveer 50%. Het wordt voornamelijk uitgescheiden via de urine (75%) en 15% in de feces. Verschillende ongeconjugeerde metabolieten bezitten farmacologische activiteit maar zijn in zeer lage concentraties in het plasma aanwezig. De (-) enantiomeer heeft een eliminatiehalfwaardetijd die ongeveer twee keer zo lang is als de (+) enantiomeer en bereikt daarom plasmaspiegels die ongeveer 3 keer zo hoog zijn als die van de (+) enantiomeer.
Plasmaspiegels zijn lineair gerelateerd aan de dosis over een dosisbereik van 15 tot 80 mg. De gemiddelde eliminatiehalfwaardetijd van mirtazapine na orale toediening varieert van ongeveer 20 tot 40 uur in subgroepen van leeftijd en geslacht, waarbij vrouwen van alle leeftijden significant langere eliminatiehalfwaardetijden vertonen dan mannen (gemiddelde halfwaardetijd van 37 uur voor vrouwen versus 26 uur). voor mannen). Steady-state plasmaspiegels van mirtazapine worden binnen 5 dagen bereikt, met een accumulatie van ongeveer 50% (accumulatieratio = 1,5).
Mirtazapine is voor ongeveer 85% gebonden aan plasma-eiwitten in een concentratiebereik van 0,01 tot 10 mcg/ml.
Speciale populaties
geriatrische
Na orale toediening van REMERON (mirtazapine) tabletten 20 mg/dag gedurende 7 dagen aan proefpersonen van verschillende leeftijden (bereik, 25 - 74), was de orale klaring van mirtazapine bij ouderen verminderd in vergelijking met de jongere proefpersonen. De verschillen waren het meest opvallend bij mannen, met een 40% lagere klaring bij oudere mannen in vergelijking met jongere mannen, terwijl de klaring bij oudere vrouwen slechts 10% lager was in vergelijking met jongere vrouwen. Voorzichtigheid is geboden bij het toedienen van REMERON 30 mg aan oudere patiënten (zie: PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ).
Kindergeneeskunde
De veiligheid en werkzaamheid van mirtazapine bij pediatrische patiënten zijn niet vastgesteld (zie: PREVENTIEVE MAATREGELEN ).
Geslacht
De gemiddelde eliminatiehalfwaardetijd van mirtazapine na orale toediening varieert van ongeveer 20 tot 40 uur in leeftijds- en geslachtssubgroepen, waarbij vrouwen van alle leeftijden significant langere eliminatiehalfwaardetijden vertonen dan mannen (gemiddelde halfwaardetijd van 37 uur voor vrouwen vs. 26 uur voor mannen) (zie Farmacokinetiek ).
Ras
Er zijn geen klinische onderzoeken uitgevoerd om het effect van ras op de farmacokinetiek van REMERON te evalueren.
Nierinsufficiëntie
De dispositie van mirtazapine is onderzocht bij patiënten met verschillende gradaties van nierfunctie. Eliminatie van mirtazapine is gecorreleerd met de creatinineklaring. De totale lichaamsklaring van mirtazapine was met ongeveer 30% verminderd bij patiënten met een matige (Clcr=11 - 39 ml/min/1,73 m²) en ongeveer 50% bij patiënten met een ernstige (Clcr= PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ).
Leverinsufficiëntie
Na een enkelvoudige orale dosis van 15 mg REMERON was de orale klaring van mirtazapine bij patiënten met een leverfunctiestoornis met ongeveer 30% afgenomen in vergelijking met patiënten met een normale leverfunctie. Voorzichtigheid is geboden bij het toedienen van REMERON aan patiënten met een verminderde leverfunctie (zie: PREVENTIEVE MAATREGELEN en DOSERING EN ADMINISTRATIE ).
Klinische onderzoeken die effectiviteit aantonen
De werkzaamheid van REMERON (mirtazapine) tabletten als behandeling voor depressieve stoornis werd vastgesteld in 4 placebogecontroleerde onderzoeken van 6 weken bij volwassen poliklinische patiënten die voldeden aan de DSM-III-criteria voor depressieve stoornis. Patiënten werden getitreerd met mirtazapine in een doseringsbereik van 5 mg tot 35 mg/dag. In het algemeen hebben deze onderzoeken aangetoond dat mirtazapine superieur is aan placebo op ten minste 3 van de volgende 4 metingen: 21-item Hamilton Depression Rating Scale (HDRS) totale score; HDRS depressieve stemming Item; CGI-ernstscore; en Montgomery en Asberg Depression Rating Scale (MADRS). Superioriteit van mirtazapine ten opzichte van placebo werd ook gevonden voor bepaalde factoren van de HDRS, waaronder angst/somatisatiefactor en slaapverstoringsfactor. De gemiddelde dosis mirtazapine voor patiënten die deze 4 onderzoeken voltooiden, varieerde van 21 tot 32 mg/dag. Een vijfde onderzoek met een vergelijkbare opzet maakte gebruik van een hogere dosis (tot 50 mg) per dag en toonde ook effectiviteit aan.
Onderzoek van leeftijds- en geslachtssubsets van de populatie bracht geen differentiële responsiviteit aan het licht op basis van deze subgroepen.
In een onderzoek op langere termijn werden patiënten die voldeden aan de (DSM-IV) criteria voor depressieve stoornis en die reageerden tijdens een initiële 8 tot 12 weken acute behandeling op REMERON 30 mg gerandomiseerd naar voortzetting van REMERON 15 mg of placebo gedurende maximaal 40 weken van observatie voor terugval. Respons tijdens de open fase werd gedefinieerd als het behalen van een HAM-D 17 totale score van ≤ 8 en een CGI-verbeteringsscore van 1 of 2 bij 2 opeenvolgende bezoeken, beginnend met week 6 van de 8 tot 12 weken in de open-label fase van de studie. Terugval tijdens de dubbelblinde fase werd bepaald door de individuele onderzoekers. Patiënten die een voortzetting van de behandeling met REMERON 30 mg kregen, ondervonden significant lagere terugvalpercentages gedurende de daaropvolgende 40 weken in vergelijking met degenen die placebo kregen. Dit patroon werd aangetoond bij zowel mannelijke als vrouwelijke patiënten.
PATIËNT INFORMATIE
REMERON® (rem' - e - ron) (mirtazapine) Tabletten
Wat is de belangrijkste informatie die ik over REMERON® moet weten?
REMERON 15 mg en andere antidepressiva kunnen ernstige bijwerkingen veroorzaken, waaronder:
1. Suïcidale gedachten of acties:
- REMERON 30 mg en andere antidepressiva kunnen bij sommige kinderen, tieners of jonge volwassenen zelfmoordgedachten of -acties doen toenemen in de eerste paar maanden van de behandeling of wanneer de dosis wordt gewijzigd.
- Depressie of andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van suïcidale gedachten of acties.
- Let op deze veranderingen en bel onmiddellijk uw zorgverlener als u merkt:
- Nieuwe of plotselinge veranderingen in stemming, gedrag, acties, gedachten of gevoelens, vooral als ze ernstig zijn.
- Besteed bijzondere aandacht aan dergelijke veranderingen wanneer REMERON wordt gestart of wanneer de dosis wordt gewijzigd.
Bewaar alle vervolgbezoeken bij uw zorgverlener en bel tussen bezoeken als u zich zorgen maakt over symptomen.
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 als zich een noodgeval voordoet, vooral als ze nieuw zijn, erger zijn of u zich zorgen maken:
- pogingen om zelfmoord te plegen
- handelen op gevaarlijke impulsen
- agressief of gewelddadig handelen
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere depressie
- nieuwe of ergere angst- of paniekaanvallen
- zich geagiteerd, rusteloos, boos of prikkelbaar voelen
- Moeite met slapen
- een toename in activiteit of meer praten dan normaal voor u is
- andere ongewone veranderingen in gedrag of stemming
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft, of bel 911 in een noodgeval. REMERON kan in verband worden gebracht met deze ernstige bijwerkingen:
2. Manische episodes:
- sterk verhoogde energie
- roekeloos gedrag
- meer of sneller praten dan normaal
- ernstige slaapproblemen
- ongewoon grootse ideeën
- snelle gedachten
- overmatig geluk of prikkelbaarheid
3. Verminderde witte bloedcellen neutrofielen genaamd, die nodig zijn om infecties te bestrijden. Vertel het uw arts als u een indicatie heeft van een infectie zoals koorts, koude rillingen, keelpijn of mond- of neuszweren, vooral symptomen die op griep lijken.
4. Serotoninesyndroom. Deze aandoening kan levensbedreigend zijn en kan bestaan uit:
- agitatie, hallucinaties, coma of andere veranderingen in mentale toestand
- snelle hartslag, hoge of lage bloeddruk
- misselijkheid, braken of diarree
- coördinatieproblemen of spiertrekkingen (overactieve reflexen)
- zweten of koorts
- spierstijfheid
5. Visuele problemen
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
6. Toevallen
7. Laag zoutgehalte (natrium) in het bloed.
Ouderen lopen hier mogelijk een groter risico op. Symptomen kunnen zijn:
- hoofdpijn
- verwarring, concentratie- of denkproblemen of geheugenproblemen
- zwakte of onvast gevoel
8. Slaperigheid. Het is het beste om te nemen REMERON dicht bij bedtijd.
9. Ernstige huidreacties: Bel onmiddellijk uw arts als u een of alle van de volgende symptomen heeft:
- ernstige huiduitslag met zwelling van de huid (ook op de handpalmen en voetzolen)
- pijnlijke roodheid van de huid, blaren of zweren op het lichaam of in de mond
10. Ernstige allergische reacties: moeite met ademhalen, zwelling van het gezicht, de tong, de ogen of de mond
- uitslag, jeukende striemen (netelroos) of blaren, alleen of met koorts of gewrichtspijn
11. Toename van eetlust of gewicht. Bij kinderen en adolescenten moet de lengte en het gewicht tijdens de behandeling worden gecontroleerd.
12. Verhoogde cholesterol- en triglyceridenspiegels in uw bloed
Stop REMERON 15 mg niet zonder eerst met uw zorgverlener te overleggen. Te snel stoppen met REMERON 15 mg kan mogelijk ernstige symptomen veroorzaken, waaronder:
- duizeligheid
- vermoeidheid
- tintelend gevoel
- abnormale dromen
- verwardheid
- misselijkheid, braken
- agitatie
- hoofdpijn
- zweten
- ongerustheid
- schudden
Wat is REMERON 15 mg?
REMERON 15 mg is een receptgeneesmiddel dat wordt gebruikt om depressie te behandelen. Het is belangrijk om met uw zorgverlener te praten over de risico's van het behandelen van depressie en ook de risico's van het niet behandelen ervan. U dient alle behandelkeuzes met uw zorgverlener te bespreken.
Neem contact op met uw zorgverlener als u denkt dat uw toestand niet verbetert met de behandeling met REMERON.
Wie mag REMERON 15 mg niet gebruiken?
Neem REMERON niet in:
- als u allergisch bent voor mirtazapine of voor één van de bestanddelen van REMERON. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in REMERON.
- als u een monoamineoxidaseremmer (MAOI) gebruikt. Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, inclusief het antibioticum linezolid.
- Gebruik geen MAO-remmer binnen 2 weken na het stoppen met REMERON, tenzij uw zorgverlener u heeft gevraagd dit te doen.
- Begin niet met REMERON als u de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw zorgverlener u heeft gevraagd dit te doen.
Mensen die REMERON 15 mg op tijd innemen in de buurt van een MAO-remmer, kunnen ernstige of zelfs levensbedreigende bijwerkingen krijgen. Roep meteen medische hulp in als u een van deze symptomen heeft:
- hoge koorts
- snelle veranderingen in hartslag of bloeddruk
- ongecontroleerde spierspasmen
- verwardheid
- stijve spieren
- bewustzijnsverlies (uitvallen)
Wat moet ik mijn zorgverlener vertellen voordat ik REMERON inneem?
Voordat u REMERON inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- bepaalde medicijnen gebruikt, zoals:
- Triptanen gebruikt om migrainehoofdpijn te behandelen
- Geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, waaronder tricyclische middelen, lithium, SSRI's, SNRI's of antipsychotica
- Tramadol gebruikt om pijn te behandelen
- Over-the-counter supplementen zoals tryptofaan of sint-janskruid
- Fenytoïne, carbamazepine of rifampicine (deze geneesmiddelen kunnen uw bloedspiegels van REMERON verlagen)
- Cimetidine of ketoconazol (deze geneesmiddelen kunnen uw bloedspiegels van REMERON verhogen)
- Geneesmiddelen die uw hartritme kunnen beïnvloeden (zoals bepaalde antibiotica en sommige antipsychotica)
- hebben of hebben gehad:
- leverproblemen
- nierproblemen
- hartproblemen of bepaalde aandoeningen die uw hartritme kunnen veranderen
- toevallen of convulsies
- bipolaire stoornis of manie
- een neiging om duizelig of flauw te worden
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of REMERON schadelijk is voor uw ongeboren baby. Praat met uw zorgverlener over de voordelen en risico's van de behandeling van depressie tijdens de zwangerschap
- borstvoeding geeft of van plan bent borstvoeding te geven. Sommige REMERON kunnen in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens het gebruik van REMERON
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. REMERON en sommige geneesmiddelen kunnen met elkaar interageren, werken mogelijk niet zo goed of kunnen ernstige bijwerkingen veroorzaken.
Uw zorgverlener of apotheker kan u vertellen of het veilig is om REMERON 15 mg samen met uw andere geneesmiddelen in te nemen. Start of stop geen geneesmiddel terwijl u REMERON gebruikt zonder eerst met uw zorgverlener te overleggen. Als u REMERON 30 mg gebruikt, mag u geen andere geneesmiddelen gebruiken die mirtazapine bevatten, waaronder REMERON 30 mg SolTab®.
Hoe moet ik REMERON innemen?
- Neem REMERON precies zoals voorgeschreven. Het kan zijn dat uw zorgverlener de dosis REMERON 15 mg moet aanpassen totdat deze de juiste dosis voor u is.
- Neem REMERON elke dag op hetzelfde tijdstip in, bij voorkeur 's avonds voor het slapengaan.
- Slik REMERON 15 mg door zoals aangegeven.
- Het is gebruikelijk dat antidepressiva zoals REMERON enkele weken duren voordat u zich beter begint te voelen. Stop niet met het innemen van REMERON 15 mg als u niet meteen resultaat voelt.
- Stop niet met het innemen van REMERON 15 mg of verander de dosis niet zonder eerst met uw arts te overleggen, ook niet als u zich beter voelt.
- REMERON kan met of zonder voedsel worden ingenomen.
- Als u een dosis van REMERON 30 mg bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem niet twee doses REMERON 15 mg tegelijk in.
- Als u te veel REMERON 15 mg heeft ingenomen, bel onmiddellijk uw zorgverlener of antigifcentrum, of vraag een spoedbehandeling. De tekenen van een overdosis REMERON (zonder andere medicijnen of alcohol) zijn onder meer:
- verwardheid,
- geheugenproblemen
- slaperigheid
- verhoogde hartslag.
De symptomen van een mogelijke overdosering kunnen veranderingen in uw hartritme (snelle, onregelmatige hartslag) of flauwvallen zijn, wat symptomen kunnen zijn van een levensbedreigende aandoening die bekend staat als torsades de pointes.
Wat moet ik vermijden tijdens het gebruik van REMERON 15 mg?
- REMERON kan slaperigheid veroorzaken of uw vermogen om beslissingen te nemen, helder te denken of snel te reageren beïnvloeden. U mag niet autorijden, zware machines bedienen of andere gevaarlijke activiteiten ondernemen totdat u weet welke invloed REMERON op u heeft.
- Vermijd het drinken van alcohol of het gebruik van diazepam (een geneesmiddel dat bijvoorbeeld wordt gebruikt voor angst, slapeloosheid en toevallen) of soortgelijke geneesmiddelen terwijl u REMERON gebruikt. Als u niet zeker weet of bepaalde medicijnen kunnen worden ingenomen met REMERON 30 mg, bespreek dit dan met uw arts.
Wat zijn de mogelijke bijwerkingen van REMERON?
REMERON kan ernstige bijwerkingen veroorzaken:
- Zie "Wat is de belangrijkste informatie die ik over REMERON moet weten?"
De meest voorkomende bijwerkingen van REMERON zijn:
- slaperigheid
- constipatie
- verhoogde eetlust
- duizeligheid
- gewichtstoename
- droge mond abnormale dromen
Dit zijn niet alle mogelijke bijwerkingen van REMERON.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik REMERON verscheuren?
- Bewaar REMERON 15 mg bij kamertemperatuur tussen 20 °C en 25 °C (68 °F tot 77 °F).
- Houd REMERON 15 mg uit de buurt van licht.
- Houd de REMERON 30 mg fles goed gesloten.
Houd REMERON 30 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van REMERON.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik REMERON 15 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef REMERON niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw apotheker of zorgverlener om informatie vragen over REMERON 30 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in REMERON 15 mg?
Actief ingrediënt: mirtazapine
Inactieve ingredienten :
- 15mg-tabletten: Zetmeel (maïs), hydroxypropylcellulose, magnesiumstearaat, colloïdaal siliciumdioxide, lactose, hypromellose, polyethyleenglycol 8000, titaniumdioxide, ijzeroxide (geel).
- 30mg-tabletten: Zetmeel (maïs), hydroxypropylcellulose, magnesiumstearaat, colloïdaal siliciumdioxide, lactose, hypromellose, polyethyleenglycol 8000, titaniumdioxide, ijzeroxide (geel), ijzeroxide (rood).
- 45 mg-tabletten: Zetmeel (maïs), hydroxypropylcellulose, magnesiumstearaat, colloïdaal siliciumdioxide, lactose, hypromellose, polyethyleenglycol 8000, titaniumdioxide.
