Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Cymbalta en hoe wordt het gebruikt?
Cymbalta is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van symptomen van depressieve stoornis, diabetische perifere neuropathische pijn, gegeneraliseerde angststoornis, fibromyalgie en chronische spierpijn. Cymbalta kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Cymbalta behoort tot een klasse geneesmiddelen die antidepressiva, SNRI's en fibromyalgiemiddelen worden genoemd.
- Het is niet bekend of Cymbalta veilig en effectief is bij kinderen jonger dan 7 jaar.
Wat zijn de mogelijke bijwerkingen van Cymbalta 20 mg?
Cymbalta kan ernstige bijwerkingen veroorzaken, waaronder:
- bonzende hartslagen of fladderen in uw borst,
- duizeligheid,
- gemakkelijk blauwe plekken,
- ongewone bloeding,
- visie verandert,
- pijnlijk of moeilijk plassen,
- impotentie,
- seksuele problemen,
- rechtszijdige pijn in de bovenbuik,
- jeuk,
- donkere urine,
- geel worden van de huid of ogen (geelzucht),
- hoofdpijn,
- verwardheid,
- onduidelijke spraak,
- ernstige zwakte,
- braken,
- verlies van coördinatie,
- onvast voelen,
- race gedachten,
- verhoogde energie,
- roekeloos gedrag,
- extreem gelukkig of prikkelbaar voelen,
- praten meer dan normaal, en
- ernstige slaapproblemen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Cymbalta zijn:
- slaperigheid,
- misselijkheid,
- constipatie,
- verlies van eetlust,
- droge mond, en
- toegenomen zweten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cymbalta. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
SUICIDALE GEDACHTEN EN GEDRAG
Antidepressiva verhoogden het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen in kortdurende onderzoeken. Deze onderzoeken lieten geen toename zien van het risico op zelfmoordgedachten en -gedrag bij gebruik van antidepressiva bij patiënten ouder dan 24 jaar; er was een vermindering van het risico bij gebruik van antidepressiva bij patiënten van 65 jaar en ouder [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bij patiënten van alle leeftijden die beginnen met antidepressiva, moet u nauwlettend controleren op verergering en op het optreden van zelfmoordgedachten en -gedrag. Adviseer familie en zorgverleners over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OMSCHRIJVING
CYMBALTA® (duloxetine capsules met vertraagde afgifte) is een selectieve serotonine- en norepinefrineheropnameremmer (SSNRI) voor orale toediening. De chemische aanduiding is (+)-(S)-N-methyl-γ-(1-naftyloxy)-2-thiofeenpropylaminehydrochloride. De empirische formule is C18H19NOS•HCl, wat overeenkomt met een molecuulgewicht van 333,88. De structuurformule is:
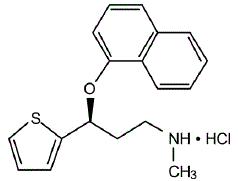
Duloxetinehydrochloride is een witte tot licht bruinwitte vaste stof, die slecht oplosbaar is in water.
Elke capsule bevat maagsapresistente korrels van 22,4, 33,7 of 67,3 mg duloxetinehydrochloride, overeenkomend met respectievelijk 20, 30 of 60 mg duloxetine. Deze enterisch gecoate korrels zijn ontworpen om afbraak van het geneesmiddel in de zure omgeving van de maag te voorkomen. Inactieve ingrediënten zijn onder meer FD & C Blue No. 2, gelatine, hypromellose, hydroxypropylmethylcelluloseacetaatsuccinaat, natriumlaurylsulfaat, sucrose, suikerbolletjes, talk, titaniumdioxide en triethylcitraat. De capsules van 20 en 60 mg bevatten ook geel ijzeroxide.
INDICATIES
CYMBALTA® is geïndiceerd voor de behandeling van:
- Depressieve stoornis bij volwassenen
- Gegeneraliseerde angststoornis bij volwassenen en pediatrische patiënten van 7 jaar en ouder
- Diabetische perifere neuropathische pijn bij volwassenen
- Fibromyalgie bij volwassenen en pediatrische patiënten van 13 jaar en ouder
- chronische musculoskeletale pijn bij volwassenen
DOSERING EN ADMINISTRATIE
Belangrijke administratie-instructies
Dien CYMBALTA oraal toe (met of zonder maaltijden) en slik het geheel door. Niet kauwen of fijnmaken, en open de capsule met vertraagde afgifte niet en strooi de inhoud niet over voedsel of meng met vloeistoffen, omdat deze acties de enterische coating kunnen aantasten. Als een dosis CYMBALTA 20 mg is vergeten, neem de gemiste dosis dan in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem de volgende dosis op het normale tijdstip. Neem niet twee doses CYMBALTA 60 mg tegelijkertijd in.
Dosering voor de behandeling van depressieve stoornissen bij volwassenen
De aanbevolen startdosering bij volwassenen met MDD is 40 mg/dag (toegediend als 20 mg tweemaal daags) tot 60 mg/dag (toegediend ofwel eenmaal daags of als 30 mg tweemaal daags). Voor sommige patiënten kan het wenselijk zijn om te beginnen met 30 mg eenmaal daags gedurende 1 week, zodat patiënten kunnen wennen aan 30 mg CYMBALTA alvorens te verhogen naar 60 mg eenmaal daags. Hoewel een dosis van 120 mg/dag effectief bleek te zijn, is er geen bewijs dat doses hoger dan 60 mg/dag extra voordelen opleveren. Evalueer regelmatig opnieuw om de noodzaak van een onderhoudsbehandeling en de juiste dosering voor een dergelijke behandeling te bepalen.
Dosering voor de behandeling van gegeneraliseerde angststoornis
Aanbevolen dosering bij volwassenen jonger dan 65 jaar
Voor de meeste volwassenen jonger dan 65 jaar met GAS, start CYMBALTA 60 mg eenmaal daags. Voor sommige patiënten kan het wenselijk zijn om te beginnen met 30 mg eenmaal daags gedurende 1 week, zodat patiënten kunnen wennen aan 40 mg CYMBALTA alvorens te verhogen naar 60 mg eenmaal daags. Hoewel een eenmaal daagse dosering van 120 mg effectief bleek te zijn, is er geen bewijs dat doses hoger dan 60 mg/dag extra voordeel opleveren. Als desondanks wordt besloten om de dosering te verhogen tot meer dan 60 mg eenmaal daags, verhoog dan de dosering in stappen van 30 mg eenmaal daags. Evalueer regelmatig opnieuw om de voortdurende noodzaak van onderhoudsbehandeling en de juiste dosering voor een dergelijke behandeling te bepalen.
Aanbevolen dosering bij geriatrische patiënten
Start bij geriatrische patiënten met GAS CYMBALTA met een dosering van 30 mg eenmaal daags gedurende 2 weken voordat een verhoging tot de streefdosis van 60 mg/dag wordt overwogen. Daarna kunnen patiënten baat hebben bij doses hoger dan 60 mg eenmaal daags. Als wordt besloten om de dosis te verhogen tot meer dan 60 mg eenmaal daags, verhoog de dosis dan in stappen van 30 mg eenmaal daags. De maximale bestudeerde dosis was 120 mg per dag.
Aanbevolen dosering bij pediatrische patiënten van 7 tot 17 jaar
Start CYMBALTA 30 mg bij pediatrische patiënten van 7 tot 17 jaar met GAD in een dosering van 30 mg eenmaal daags gedurende 2 weken voordat een verhoging tot 60 mg eenmaal daags wordt overwogen. Het aanbevolen doseringsbereik is 30 tot 60 mg eenmaal daags. Sommige patiënten kunnen baat hebben bij doseringen van meer dan 60 mg eenmaal daags. Als wordt besloten om de dosis te verhogen tot meer dan 60 mg eenmaal daags, verhoog dan de dosering in stappen van 30 mg eenmaal daags. De maximale bestudeerde dosis was 120 mg per dag.
Dosering voor de behandeling van diabetische perifere neuropathische pijn bij volwassenen
Dien eenmaal daags 60 mg toe aan volwassenen met diabetische perifere neuropathische pijn. Er is geen bewijs dat doseringen hoger dan 60 mg eenmaal daags extra significant voordeel opleveren en de hogere dosering wordt duidelijk minder goed verdragen. Voor patiënten voor wie verdraagbaarheid een punt van zorg is, kan een lagere startdosis worden overwogen.
Aangezien diabetes vaak gecompliceerd wordt door nierziekte, overweeg dan een lagere startdosering en geleidelijke verhoging van de dosering voor patiënten met nierinsufficiëntie [zie: Dosering bij patiënten met leverinsufficiëntie of ernstige nierinsufficiëntie en Gebruik bij specifieke populaties ].
Dosering voor de behandeling van fibromyalgie
Aanbevolen dosering bij volwassenen
De aanbevolen dosering CYMBALTA is 60 mg eenmaal daags bij volwassenen met fibromyalgie. Begin de behandeling met 30 mg eenmaal daags gedurende 1 week, zodat patiënten kunnen wennen aan 20 mg CYMBALTA voordat ze worden verhoogd tot 60 mg eenmaal daags. Sommige patiënten kunnen reageren op de startdosering. Er is geen bewijs dat doseringen hoger dan 60 mg/dag extra voordeel opleveren, zelfs niet bij patiënten die niet reageren op een dosering van 60 mg/dag, en hogere doseringen werden in verband gebracht met een hoger aantal bijwerkingen.
Aanbevolen dosering bij pediatrische patiënten van 13 tot 17 jaar
De aanbevolen startdosering van CYMBALTA 60 mg bij pediatrische patiënten van 13-17 jaar met fibromyalgie is 30 mg eenmaal daags. De dosering kan worden verhoogd tot 60 mg eenmaal daags op basis van respons en verdraagbaarheid.
Dosering voor de behandeling van chronische musculoskeletale pijn bij volwassenen
De aanbevolen dosering CYMBALTA is 60 mg eenmaal daags bij volwassenen met chronische musculoskeletale pijn. Begin de behandeling met 30 mg eenmaal daags gedurende één week, zodat patiënten kunnen wennen aan CYMBALTA voordat ze worden verhoogd tot 60 mg eenmaal daags. Er is geen bewijs dat hogere doseringen extra voordeel opleveren, zelfs niet bij patiënten die niet reageren op een eenmaal daagse dosering van 60 mg, en hogere doseringen worden geassocieerd met een hoger aantal bijwerkingen [zie Klinische studies ].
Dosering bij patiënten met leverinsufficiëntie of ernstige nierinsufficiëntie
Vermijd het gebruik bij patiënten met chronische leverziekte of cirrose [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Vermijd het gebruik bij patiënten met ernstige nierinsufficiëntie, GFR WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Stoppen met CYMBALTA
Bijwerkingen na stopzetting van CYMBALTA, na abrupte of geleidelijke stopzetting, zijn onder meer: duizeligheid, hoofdpijn, misselijkheid, diarree, paresthesie, prikkelbaarheid, braken, slapeloosheid, angst, hyperhidrose en vermoeidheid. Een geleidelijke verlaging van de dosering in plaats van abrupte stopzetting wordt waar mogelijk aanbevolen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Overschakelen van een patiënt naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen en het starten van de behandeling met CYMBALTA. Omgekeerd moet er ten minste 5 dagen worden gewacht na het stoppen met CYMBALTA 60 mg voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen [zie CONTRA-INDICATIES ].
Gebruik van CYMBALTA met andere MAO-remmers zoals linezolid of methyleenblauw
Start CYMBALTA niet bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen [zie CONTRA-INDICATIES ].
In sommige gevallen kan een patiënt die al met CYMBALTA wordt behandeld, dringend worden behandeld met linezolid of intraveneus methyleenblauw. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet CYMBALTA onmiddellijk worden stopgezet en linezolid of intraveneuze methyleenblauw kan worden toegediend. De patiënt moet gedurende 5 dagen of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet, worden gecontroleerd op symptomen van het serotoninesyndroom. De therapie met CYMBALTA kan worden hervat 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met CYMBALTA is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
CYMBALTA is verkrijgbaar als capsules met vertraagde afgifte:
- 20 mg ondoorzichtige groene capsules bedrukt met “Lilly 3235 20 mg”
- 30 mg ondoorzichtige witte en blauwe capsules bedrukt met “Lilly 3240 30 mg”
- 60 mg ondoorzichtige groene en blauwe capsules bedrukt met “Lilly 3270 60 mg”
CYMBALTA (duloxetine capsules met vertraagde afgifte) is verkrijgbaar in de volgende sterktes, kleuren, opdrukken en presentaties:
Opslag en behandeling
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP-gecontroleerde kamertemperatuur].
Op de markt gebracht door: Lilly USA, LLC Indianapolis, IN 46285, VS. Herzien: juli 2021
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Suïcidale gedachten en gedrag bij kinderen, adolescenten en jongvolwassenen [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Orthostatische hypotensie, vallen en syncope [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige huidreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stopzettingssyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Activering van manie/hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Gesloten hoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoogde bloeddruk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Klinisch belangrijke geneesmiddelinteracties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Urinaire aarzeling en retentie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Seksuele disfunctie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De vermelde frequenties van bijwerkingen vertegenwoordigen het deel van de patiënten dat, ten minste eenmaal, één tijdens de behandeling optredende bijwerking van het vermelde type heeft ervaren. Een reactie werd als opkomend tijdens de behandeling beschouwd als deze voor het eerst optrad of verergerde tijdens de behandeling na evaluatie van de baseline.
Bijwerkingen bij volwassenen
Database voor klinische proeven voor volwassenen
De hieronder beschreven gegevens weerspiegelen de blootstelling aan CYMBALTA in placebogecontroleerde onderzoeken bij volwassenen voor MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), en FM (N=1294). De leeftijdsgroep in deze gepoolde populatie was 17 tot 89 jaar. In deze gepoolde populatie waren 66%, 61%, 61%, 43% en 94% van de volwassen patiënten vrouw; en 82%, 73%, 85%, 74% en 86% van de volwassen patiënten waren blank in respectievelijk de MDD-, GAD-, OA- en CLBP-, DPNP- en FM-populaties. De meeste patiënten kregen CYMBALTA-doseringen van in totaal 60 tot 120 mg per dag [zie: Klinische studies ]. De onderstaande gegevens bevatten geen resultaten van het onderzoek waarin de werkzaamheid van CYMBALTA 30 mg voor de behandeling van GAS bij patiënten ≥ 65 jaar oud werd beoordeeld (onderzoek GAD-5) [zie Klinische studies ]; de bijwerkingen die bij deze geriatrische populatie werden waargenomen, waren echter over het algemeen vergelijkbaar met de bijwerkingen bij de totale volwassen populatie.
Bijwerkingen die leiden tot stopzetting van de behandeling in placebogecontroleerde onderzoeken bij volwassenen
Ernstige depressieve stoornis
Ongeveer 8,4% (319/3779) van de met CYMBALTA behandelde patiënten in placebogecontroleerde onderzoeken bij volwassenen voor MDD stopte de behandeling vanwege een bijwerking, vergeleken met 4,6% (117/2536) van de met placebo behandelde patiënten. Misselijkheid (CYMBALTA 1,1%, placebo 0,4%) was de enige bijwerking die werd gemeld als reden voor stopzetting en die als geneesmiddelgerelateerd werd beschouwd (dwz stopzetting trad op bij ten minste 1% van de met CYMBALTA behandelde patiënten en met een snelheid van ten minste ten minste tweemaal die van met placebo behandelde patiënten).
Gegeneraliseerde angststoornis
Ongeveer 13,7% (139/1018) van de met CYMBALTA behandelde patiënten in placebogecontroleerde onderzoeken bij volwassenen voor GAD stopte met de behandeling vanwege een bijwerking, vergeleken met 5% (38/767) voor met placebo behandelde patiënten. Vaak voorkomende bijwerkingen die als reden voor stopzetting werden gemeld en die als geneesmiddelgerelateerd werden beschouwd (zoals hierboven gedefinieerd), waren misselijkheid (CYMBALTA 3,3%, placebo 0,4%) en duizeligheid (CYMBALTA 1,3%, placebo 0,4%).
Diabetische perifere neuropathische pijn
Ongeveer 12,9% (117/906) van de met CYMBALTA behandelde patiënten in placebogecontroleerde onderzoeken bij volwassenen voor DPNP stopte met de behandeling vanwege een bijwerking, vergeleken met 5,1% (23/448) voor met placebo behandelde patiënten. Vaak voorkomende bijwerkingen die als reden voor stopzetting werden gemeld en die als geneesmiddelgerelateerd werden beschouwd (zoals hierboven gedefinieerd), waren misselijkheid (CYMBALTA 3,5%, placebo 0,7%), duizeligheid (CYMBALTA 1,2%, placebo 0,4%) en slaperigheid (CYMBALTA 1,1%). , placebo 0%).
Fibromyalgie
Ongeveer 17,5% (227/1294) van de met CYMBALTA behandelde patiënten in 3 tot 6 maanden durende placebogecontroleerde onderzoeken bij volwassenen voor FM stopte de behandeling vanwege een bijwerking, vergeleken met 10,1% (96/955) voor met placebo behandelde patiënten . Bijwerkingen gemeld als reden voor stopzetting en beschouwd als geneesmiddelgerelateerd (zoals hierboven gedefinieerd) omvatten misselijkheid (CYMBALTA 2,0%, placebo 0,5%), hoofdpijn (CYMBALTA 1,2%, placebo 0,3%), slaperigheid (CYMBALTA 1,1%, placebo 0%) en vermoeidheid (CYMBALTA 1,1%, placebo 0,1%).
Chronische pijn als gevolg van artrose
Ongeveer 15,7% (79/503) van de met CYMBALTA behandelde patiënten in 13 weken durende, placebogecontroleerde onderzoeken bij volwassenen voor chronische pijn als gevolg van artrose stopte de behandeling vanwege een bijwerking, vergeleken met 7,3% (37/508) voor placebo- behandelde patiënten. Bijwerkingen die als reden voor stopzetting werden gemeld en die als geneesmiddelgerelateerd werden beschouwd (zoals hierboven gedefinieerd), omvatten misselijkheid (CYMBALTA 2,2%, placebo 1%).
Chronische lage rugpijn
Ongeveer 16,5% (99/600) van de met CYMBALTA behandelde patiënten in 13 weken durende, placebogecontroleerde onderzoeken bij volwassenen voor CLBP stopte de behandeling vanwege een bijwerking, vergeleken met 6,3% (28/441) voor met placebo behandelde patiënten. Bijwerkingen die als reden voor stopzetting werden gemeld en die als geneesmiddelgerelateerd werden beschouwd (zoals hierboven gedefinieerd), omvatten misselijkheid (CYMBALTA 3%, placebo 0,7%) en slaperigheid (CYMBALTA 1%, placebo 0%).
Meest voorkomende bijwerkingen bij onderzoeken bij volwassenen
De vaakst waargenomen bijwerkingen bij met CYMBALTA behandelde patiënten (zoals hierboven gedefinieerd) waren:
- Diabetische perifere neuropathische pijn: misselijkheid, slaperigheid, verminderde eetlust, constipatie, hyperhidrose en droge mond.
- Fibromyalgie: misselijkheid, droge mond, constipatie, slaperigheid, verminderde eetlust, hyperhidrose en opwinding.
- Chronische pijn door artrose: misselijkheid, vermoeidheid, constipatie, droge mond, slapeloosheid, slaperigheid en duizeligheid.
- Chronische lage rugpijn: misselijkheid, droge mond, slapeloosheid, slaperigheid, constipatie, duizeligheid en vermoeidheid.
De vaakst waargenomen bijwerkingen bij met CYMBALTA behandelde patiënten in alle gepoolde volwassen populaties (dwz MDD, GAD, DPNP, FM, OA en CLBP) (incidentie van ten minste 5% en ten minste tweemaal de incidentie bij met placebo behandelde patiënten) waren misselijkheid, droge mond, slaperigheid, constipatie, verminderde eetlust en hyperhidrose.
Tabel 2 geeft de incidentie weer van bijwerkingen in placebogecontroleerde onderzoeken voor goedgekeurde volwassen populaties (dwz MDD, GAD, DPNP, FM, OA en CLBP) die optraden bij 5% of meer van de met CYMBALTA behandelde patiënten en met een incidentie hoger dan met placebo behandelde patiënten.
Bijwerkingen bij gepoolde MDD- en GAD-onderzoeken bij volwassenen
Tabel 3 geeft de incidentie weer van bijwerkingen in MDD- en GAD-placebogecontroleerde onderzoeken bij volwassenen die optraden bij 2% of meer van de met CYMBALTA behandelde patiënten en met een incidentie die groter was dan bij de met placebo behandelde patiënten.
Bijwerkingen in de DPNP-, FM-, OA- en CLBP-onderzoeken voor volwassenen
Tabel 4 geeft de incidentie weer van bijwerkingen die optraden bij 2% of meer van de met CYMBALTA behandelde patiënten (bepaald vóór afronding) in de premarketing acute fase van placebogecontroleerde DPNP-, FM-, OA- en CLBP- placebogecontroleerde onderzoeken bij volwassenen en met een incidentie hoger dan met placebo behandelde patiënten.
Effecten op mannelijke en vrouwelijke seksuele functies bij volwassenen met MDD
Veranderingen in seksueel verlangen, seksuele prestaties en seksuele bevrediging treden vaak op als uitingen van psychiatrische stoornissen of diabetes, maar ze kunnen ook een gevolg zijn van farmacologische behandeling. Omdat wordt aangenomen dat ongewenste seksuele reacties vrijwillig te weinig worden gerapporteerd, werd de Arizona Sexual Experience Scale (ASEX), een gevalideerde maatstaf die is ontworpen om seksuele bijwerkingen te identificeren, prospectief gebruikt in 4 MDD placebogecontroleerde onderzoeken bij volwassenen (Studies MDD-1, MDD-2 , MDD-3 en MDD-4) [zie Klinische studies ]. De ASEX-schaal bevat vijf vragen die betrekking hebben op de volgende aspecten van seksueel functioneren: 1) zin in seks, 2) gemak van opwinding, 3) vermogen om een erectie te krijgen (mannen) of smering (vrouwen), 4) gemak van het bereiken van een orgasme, en 5) orgasmebevrediging. Positieve getallen duiden op een verslechtering van de seksuele functie vanaf baseline. Negatieve getallen duiden op een verbetering ten opzichte van een baseline niveau van disfunctie, dat vaak wordt gezien bij depressieve patiënten.
In deze onderzoeken ondervonden met CYMBALTA behandelde mannelijke patiënten significant meer seksuele disfunctie, zoals gemeten aan de hand van de totale score op de ASEX en het vermogen om een orgasme te bereiken, dan met placebo behandelde mannelijke patiënten (zie ). Met CYMBALTA behandelde vrouwelijke patiënten ondervonden niet meer seksuele disfunctie dan met placebo behandelde vrouwelijke patiënten, gemeten aan de hand van de ASEX-totaalscore. Zorgverleners dienen routinematig te informeren naar mogelijke seksuele bijwerkingen bij met CYMBALTA behandelde patiënten.
Veranderingen in vitale functies bij volwassenen
In placebogecontroleerde klinische onderzoeken bij goedgekeurde volwassen populaties voor verandering van baseline tot eindpunt, hadden met CYMBALTA behandelde patiënten gemiddelde stijgingen van 0,23 mm Hg in systolische bloeddruk (SBP) en 0,73 mm Hg in diastolische bloeddruk (DBP) vergeleken met gemiddelde dalingen van 1,09 mm Hg bij SBP en 0,55 mm Hg bij DBP bij met placebo behandelde patiënten. Er was geen significant verschil in de frequentie van aanhoudende (3 opeenvolgende bezoeken) verhoogde bloeddruk [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Behandeling met CYMBALTA 20 mg, gedurende maximaal 26 weken in placebogecontroleerde onderzoeken bij goedgekeurde volwassen populaties, veroorzaakte doorgaans een kleine verhoging van de hartslag voor verandering van baseline tot eindpunt vergeleken met placebo van maximaal 1,37 slagen per minuut (verhoging van 1,20 slagen per minuut bij met CYMBALTA behandelde patiënten, afname van 0,17 slagen per minuut bij met placebo behandelde patiënten).
Laboratoriumveranderingen bij volwassenen
Behandeling met CYMBALTA ging in placebogecontroleerde klinische onderzoeken bij goedgekeurde volwassen populaties gepaard met kleine gemiddelde verhogingen van baseline tot eindpunt in ALT, AST, CPK en alkalische fosfatase; zeldzame, bescheiden, voorbijgaande, abnormale waarden werden waargenomen voor deze analyten bij met CYMBALTA behandelde patiënten in vergelijking met met placebo behandelde patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Hoge bicarbonaat, cholesterol en abnormaal (hoog of laag) kalium werden vaker waargenomen bij met CYMBALTA behandelde patiënten dan bij met placebo behandelde patiënten.
Andere bijwerkingen waargenomen tijdens de klinische studie Evaluatie van CYMBALTA bij volwassenen
Hieronder volgt een lijst van bijwerkingen die zijn gemeld door patiënten die werden behandeld met CYMBALTA 40 mg in klinische onderzoeken bij volwassenen. In klinische onderzoeken met alle goedgekeurde volwassen populaties werden 34.756 patiënten behandeld met CYMBALTA. Hiervan nam 27% (9337) CYMBALTA 60 mg gedurende ten minste 6 maanden en 12% (4317) nam CYMBALTA gedurende ten minste een jaar. De volgende lijst is niet bedoeld om reacties op te nemen (1) die al in eerdere tabellen of elders in de etikettering zijn vermeld, (2) waarvoor een medicijnoorzaak ver weg was, (3) die zo algemeen waren dat ze niet informatief waren, (4) die waren niet geacht significante klinische implicaties te hebben, of (5) die optraden met een snelheid gelijk aan of lager dan die van placebo.
Reacties worden gecategoriseerd per lichaamssysteem volgens de volgende definities: frequente bijwerkingen zijn bijwerkingen die optreden bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij 1/100 tot 1/1000 patiënten; zeldzame reacties zijn reacties die voorkomen bij minder dan 1/1000 patiënten.
- Hartaandoeningen - Frequent: hartkloppingen; Onregelmatig: myocardinfarct, tachycardie en Takotsubo-cardiomyopathie.
- Oor- en labyrintaandoeningen - Frequent: duizeligheid; Onregelmatig: oorpijn en tinnitus.
- Endocriene aandoeningen - Onregelmatig: hypothyreoïdie.
- Oogaandoeningen - Frequent: wazig zien; Onregelmatig: diplopie, droge ogen en slechtziendheid.
- Maagdarmstelselaandoeningen - Frequent: winderigheid; Onregelmatig: dysfagie, oprispingen, gastritis, gastro-intestinale bloeding, halitose en stomatitis; Zelden: maagzweer.
- Algemene aandoeningen en toedieningsplaatsvoorwaarden - Frequent: koude rillingen/rillingen; Onregelmatig: vallen, zich abnormaal voelen, het warm en/of koud hebben, malaise en dorst; Zelden: loopstoornis.
- Infecties en parasitaire aandoeningen - Onregelmatig: gastro-enteritis en laryngitis.
- onderzoeken Frequent: gewichtstoename, gewichtsafname; Onregelmatig: bloedcholesterol verhoogd.
- Metabolisme en voedingsstoornissen - Onregelmatig: uitdroging en hyperlipidemie; Zelden: dyslipidemie.
- Musculoskeletale en bindweefselaandoeningen - Frequent: musculoskeletale pijn; Onregelmatig: spierstrakheid en spiertrekkingen.
- Zenuwstelselaandoeningen - Frequent: dysgeusie, lethargie en paresthesie/hypo-esthesie; Onregelmatig: aandachtsstoornis, dyskinesie, myoclonus en slaap van slechte kwaliteit; Zelden: dysartrie.
- Psychische stoornissen - Frequent: abnormale dromen en slaapstoornissen; Onregelmatig: apathie, bruxisme, desoriëntatie/verwardheid, prikkelbaarheid, stemmingswisselingen en zelfmoordpoging; Zelden: voltooide zelfmoord.
- Nier- en urinewegaandoeningen - Frequent: urinaire frequentie; Onregelmatig: dysurie, mictie-urgentie, nocturie, polyurie en abnormale urinegeur.
- Voortplantingsstelsel- en borstaandoeningen - Frequent: anorgasmie/orgasme abnormaal; Onregelmatig: symptomen van de menopauze, seksuele disfunctie en testiculaire pijn; Zelden: menstruatiestoornis.
- Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen Frequent: geeuwen, orofaryngeale pijn; Onregelmatig: keelstrakheid.
- Huid- en onderhuidaandoeningen - Frequent: jeuk; Onregelmatig: koud zweet, contact met dermatitis, erytheem, verhoogde neiging tot blauwe plekken, nachtelijk zweten en fotosensitiviteitsreactie; Zelden: ecchymose.
- Bloedvataandoeningen - Frequent: opvliegers; Onregelmatig: blozen, orthostatische hypotensie en perifere kou.
Bijwerkingen waargenomen in placebogecontroleerde klinische onderzoeken bij pediatrische patiënten
Database van pediatrische klinische onderzoeken
De hieronder beschreven gegevens weerspiegelen de blootstelling aan CYMBALTA (N=567) bij pediatrische patiënten in de leeftijd van 7 tot 18 jaar uit twee placebogecontroleerde onderzoeken van 10 weken bij patiënten met MDD (N=341) (onderzoeken MDD-6 en MDD- 7), een 10 weken durende placebogecontroleerde studie naar GAD (N=135) (Studie GAD-6) en een 13 weken durende studie naar fibromyalgie (N=91). CYMBALTA 60 mg is niet goedgekeurd voor de behandeling van MDD bij pediatrische patiënten [zie: Gebruik bij specifieke populaties ]. Van de met CYMBALTA behandelde patiënten in deze onderzoeken was 36% 7 tot 11 jaar oud (64% was tussen 12 en 18 jaar oud), 55% was vrouw en 69% was blank. Patiënten kregen 30 tot 120 mg CYMBALTA per dag tijdens placebogecontroleerde onderzoeken naar acute behandeling. In de pediatrische MDD-, GAD- en fibromyalgie-onderzoeken met een duur van maximaal 40 weken, waren er 988 CYMBALTA-behandelde pediatrische patiënten in de leeftijd van 7 tot 17 jaar (de meeste patiënten kregen 30-120 mg per dag) - 35% was 7 tot 11 jaar leeftijd (65% was 12 tot 17 jaar oud) en 56% was vrouw.
Meest voorkomende bijwerkingen in pediatrische onderzoeken
De meest voorkomende bijwerkingen (≥5% bij met CYMBALTA behandelde patiënten en ten minste tweemaal de incidentie van met placebo behandelde patiënten) bij alle gepoolde pediatrische populaties (MDD, GAD en fibromyalgie) waren verminderd gewicht, verminderde eetlust, misselijkheid, braken, vermoeidheid en diarree.
Bijwerkingen bij pediatrische patiënten van 7 tot 17 jaar oud met MDD en GAD
Het bijwerkingenprofiel dat werd waargenomen in klinische onderzoeken bij pediatrische patiënten in de leeftijd van 7 tot 18 jaar met MDD en GAD was consistent met het bijwerkingenprofiel dat werd waargenomen in klinische onderzoeken bij volwassenen. De meest voorkomende (≥ 5% en tweemaal placebo) bijwerkingen die in deze klinische onderzoeken bij kinderen werden waargenomen, waren: misselijkheid, diarree, gewichtsafname en duizeligheid.
Tabel 6 geeft de incidentie weer van bijwerkingen in MDD en GAD pediatrische placebogecontroleerde onderzoeken die optraden bij meer dan 2% van de patiënten die met CYMBALTA werden behandeld en met een incidentie die groter was dan bij patiënten die met placebo werden behandeld. CYMBALTA is niet goedgekeurd voor de behandeling van MDD bij pediatrische patiënten [zie: Gebruik bij specifieke populaties ].
Andere bijwerkingen die optraden met een incidentie van minder dan 2% en die werden gemeld door meer met CYMBALTA behandelde patiënten dan met placebo behandelde patiënten in klinische onderzoeken naar MDD en GAD bij kinderen waren onder meer: abnormale dromen (inclusief nachtmerries), angst, blozen (inclusief opvliegers) ), hyperhidrose, hartkloppingen, verhoogde pols en tremor (CYMBALTA 20 mg is niet goedgekeurd voor de behandeling van pediatrische patiënten met MDD).
De meest gemelde symptomen na stopzetting van CYMBALTA 30 mg in klinische onderzoeken naar MDD en GAD bij kinderen waren hoofdpijn, duizeligheid, slapeloosheid en buikpijn (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Groei (lengte en gewicht) bij pediatrische patiënten van 7 tot 17 jaar met GAD en MDD
Verminderde eetlust en gewichtsverlies zijn waargenomen in verband met het gebruik van SSRI's en SNRI's. Met CYMBALTA behandelde pediatrische patiënten in klinische onderzoeken ondervonden een gemiddelde gewichtsafname van 0,1 kg na 10 weken, vergeleken met een gemiddelde gewichtstoename van ongeveer 0,9 kg bij met placebo behandelde pediatrische patiënten. Het aantal patiënten dat een klinisch significante gewichtsafname ondervond (≥ 3,5%) was groter in de CYMBALTA-groep dan in de placebogroep (respectievelijk 16% en 6%). Vervolgens, gedurende de ongecontroleerde verlengingsperioden van 4 tot 6 maanden, neigden de met CYMBALTA behandelde patiënten gemiddeld naar herstel naar hun verwachte baseline-gewichtspercentiel op basis van populatiegegevens van leeftijds- en geslachtsgenoten.
In onderzoeken tot 9 maanden ervoeren met CYMBALTA behandelde pediatrische patiënten een toename in lengte van gemiddeld 1,7 cm (2,2 cm toename bij patiënten van 7 tot 11 jaar en 1,3 cm toename bij patiënten van 12 tot 17 jaar). Hoewel tijdens deze onderzoeken een toename van de lengte werd waargenomen, werd een gemiddelde afname van 1% van het lengtepercentiel waargenomen (afname van 2% bij patiënten van 7 tot 11 jaar en toename van 0,3% bij patiënten van 12 tot 17 jaar). Gewicht en lengte moeten regelmatig worden gecontroleerd bij pediatrische patiënten die worden behandeld met CYMBALTA (zie: Gebruik bij specifieke populaties ].
Bijwerkingen bij pediatrische patiënten van 13 tot 17 jaar oud met fibromyalgie
Tabel 7 geeft de incidentie weer van bijwerkingen in een pediatrische placebogecontroleerde studie met fibromyalgie (onderzoek FM-4) die optrad bij meer dan 5% van de patiënten die werden behandeld met CYMBALTA 30 mg en met een incidentie die groter was dan bij patiënten behandeld met placebo [zie Klinische studies ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van CYMBALTA na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bijwerkingen die sinds de introductie op de markt zijn gemeld en die tijdelijk verband hielden met de behandeling met CYMBALTA 40 mg en die niet elders in de etikettering worden genoemd, zijn onder meer: acute pancreatitis, anafylactische reactie, agressie en woede (vooral vroeg in de behandeling of na stopzetting van de behandeling), angioneurotisch oedeem, geslotenhoekglaucoom, colitis (microscopisch of niet gespecificeerd), cutane vasculitis (soms geassocieerd met systemische betrokkenheid), extrapiramidale stoornis, galactorroe, gynaecologische bloeding, hallucinaties, hyperglykemie, hyperprolactinemie, overgevoeligheid, hypertensieve crisis, spierspasme, huiduitslag, rustelozebenensyndroom, toevallen na stopzetting van de behandeling, supraventriculaire aritmie, tinnitus (na stopzetting van de behandeling), trismus en urticaria.
DRUG-INTERACTIES
Zowel CYP1A2 als CYP2D6 zijn verantwoordelijk voor het metabolisme van duloxetine.
Remmers van CYP1A2
Wanneer CYMBALTA 60 mg gelijktijdig werd toegediend met fluvoxamine 100 mg, een krachtige CYP1A2-remmer, aan mannelijke proefpersonen (n=14) werd de AUC van duloxetine ongeveer 6 keer verhoogd, de Cmax ongeveer 2,5 keer verhoogd en de t1/2 van duloxetine werd ongeveer 3-voudig toegenomen. Andere geneesmiddelen die het CYP1A2-metabolisme remmen, zijn onder meer cimetidine en chinolon-antimicrobiële middelen zoals ciprofloxacine en enoxacine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Remmers van CYP2D6
Gelijktijdig gebruik van CYMBALTA (40 mg eenmaal daags) met paroxetine (20 mg eenmaal daags) verhoogde de concentratie van duloxetine AUC met ongeveer 60%, en een grotere mate van remming wordt verwacht bij hogere doses paroxetine. Soortgelijke effecten zouden worden verwacht met andere krachtige CYP2D6-remmers (bijv. fluoxetine, kinidine) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Dubbele remming van CYP1A2 en CYP2D6
Gelijktijdige toediening van CYMBALTA 40 mg tweemaal daags met fluvoxamine 100 mg, een krachtige CYP1A2-remmer, aan proefpersonen met een trage metabolisering van CYP2D6 (n=14) resulteerde in een zesvoudige toename van de AUC en Cmax van duloxetine.
Geneesmiddelen die de hemostase verstoren (bijv. NSAID's, aspirine en warfarine)
De afgifte van serotonine door bloedplaatjes speelt een belangrijke rol bij hemostase. Epidemiologische studies van de case-control en cohort-opzet die een verband hebben aangetoond tussen het gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren en het optreden van bloedingen in het bovenste deel van het maagdarmkanaal, hebben ook aangetoond dat gelijktijdig gebruik van een NSAID of aspirine dit risico op bloedingen kan vergroten. Veranderde antistollingseffecten, waaronder toegenomen bloedingen, zijn gemeld bij gelijktijdige toediening van SSRI's of SNRI's met warfarine. Gelijktijdige toediening van warfarine (2-9 mg eenmaal daags) onder steady state-omstandigheden met CYMBALTA 60 of 120 mg eenmaal daags gedurende maximaal 14 dagen bij gezonde proefpersonen (n=15) veranderde de INR niet significant ten opzichte van de uitgangswaarde (gemiddelde INR-veranderingen varieerden van 0,05 tot +0,07). De totale farmacokinetiek van warfarine (eiwitgebonden plus vrij geneesmiddel) (AUCτ,ss, Cmax,ss of tmax,ss) voor zowel R- als S-warfarine werd niet veranderd door duloxetine. Vanwege het mogelijke effect van duloxetine op de bloedplaatjes, moeten patiënten die met warfarine worden behandeld, zorgvuldig worden gecontroleerd wanneer CYMBALTA wordt gestart of stopgezet (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Lorazepam
Onder steady-state-omstandigheden voor CYMBALTA (60 mg Q 12 uur) en lorazepam (2 mg Q 12 uur) werd de farmacokinetiek van duloxetine niet beïnvloed door gelijktijdige toediening.
Temazepam
Onder steady-state-omstandigheden voor CYMBALTA (20 mg qhs) en temazepam (30 mg qhs) werd de farmacokinetiek van duloxetine niet beïnvloed door gelijktijdige toediening.
Geneesmiddelen die de maagzuurgraad beïnvloeden
CYMBALTA heeft een enterische coating die bestand is tegen oplossen totdat het een segment van het maagdarmkanaal bereikt waar de pH hoger is dan 5,5. In extreem zure omstandigheden kan CYMBALTA 20 mg, niet beschermd door de enterische coating, hydrolyse ondergaan om naftol te vormen. Voorzichtigheid is geboden bij het gebruik van CYMBALTA 30 mg bij patiënten met aandoeningen die de maaglediging kunnen vertragen (bijv. sommige diabetici). Geneesmiddelen die de gastro-intestinale pH verhogen, kunnen leiden tot een eerdere afgifte van duloxetine. Gelijktijdige toediening van CYMBALTA 60 mg met aluminium- en magnesiumbevattende antacida (51 mEq) of CYMBALTA met famotidine had echter geen significant effect op de snelheid of mate van absorptie van duloxetine na toediening van een orale dosis van 40 mg.
Geneesmiddelen gemetaboliseerd door CYP1A2
In vitro geneesmiddelinteractiestudies tonen aan dat duloxetine geen CYP1A2-activiteit induceert. Daarom wordt geen toename van het metabolisme van CYP1A2-substraten (bijv. theofylline, cafeïne) als gevolg van inductie verwacht, hoewel er geen klinische onderzoeken naar inductie zijn uitgevoerd. Duloxetine is een remmer van de CYP1A2-isovorm in in vitro onderzoeken, en in twee klinische onderzoeken was de gemiddelde (90% betrouwbaarheidsinterval) toename van de theofylline AUC 7% (1%-15%) en 20% (13%-27%) bij gelijktijdige toediening met CYMBALTA (60 mg tweemaal daags).
Geneesmiddelen gemetaboliseerd door CYP2D6
Duloxetine is een matige remmer van CYP2D6. Wanneer CYMBALTA werd toegediend (in een dosis van 60 mg tweemaal daags) in combinatie met een enkelvoudige dosis van 50 mg desipramine, een CYP2D6-substraat, nam de AUC van desipramine drievoudig toe (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelen gemetaboliseerd door CYP2C9
Resultaten van in vitro-onderzoeken tonen aan dat duloxetine de activiteit niet remt. In een klinische studie werd de farmacokinetiek van S-warfarine, een CYP2C9-substraat, niet significant beïnvloed door duloxetine [zie Geneesmiddelen die de hemostase verstoren (bijv. NSAID's, aspirine en warfarine) ].
Geneesmiddelen gemetaboliseerd door CYP3A
Resultaten van in vitro-onderzoeken tonen aan dat duloxetine de CYP3A-activiteit niet remt of induceert. Daarom wordt geen toename of afname van het metabolisme van CYP3A-substraten (bijv. orale anticonceptiva en andere steroïde middelen) als gevolg van inductie of remming verwacht, hoewel er geen klinische onderzoeken zijn uitgevoerd.
Geneesmiddelen gemetaboliseerd door CYP2C19
Resultaten van in vitro-onderzoeken tonen aan dat duloxetine de CYP2C19-activiteit bij therapeutische concentraties niet remt. Remming van het metabolisme van CYP2C19-substraten wordt daarom niet verwacht, hoewel er geen klinische onderzoeken zijn uitgevoerd.
Monoamineoxidaseremmers (MAO-remmers)
[Zien DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Serotonerge geneesmiddelen
[Zien DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Alcohol
Wanneer CYMBALTA 40 mg en ethanol enkele uren na elkaar werden toegediend, zodat de piekconcentraties van beide zouden samenvallen, verhoogde CYMBALTA de door alcohol veroorzaakte beschadiging van mentale en motorische vaardigheden niet.
In de database van klinische onderzoeken met CYMBALTA hadden drie met CYMBALTA behandelde patiënten leverbeschadiging zoals blijkt uit verhogingen van ALAT en totale bilirubine, met tekenen van obstructie. In elk van deze gevallen was er sprake van aanzienlijk intercurrent ethanolgebruik en dit kan hebben bijgedragen aan de waargenomen afwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CZS-medicijnen
[Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelen die sterk gebonden zijn aan plasma-eiwit
Omdat duloxetine sterk aan plasma-eiwitten gebonden is, kan toediening van CYMBALTA 30 mg aan een patiënt die een ander geneesmiddel neemt dat sterk aan eiwit gebonden is, verhoogde vrije concentraties van het andere geneesmiddel veroorzaken, wat mogelijk kan leiden tot bijwerkingen. Gelijktijdige toediening van CYMBALTA (60 of 120 mg) met warfarine (2-9 mg), een sterk eiwitgebonden geneesmiddel, resulteerde echter niet in significante veranderingen in INR en in de farmacokinetiek van totaal S- of totaal R-. warfarine (eiwitgebonden plus gratis medicijn) [zie Geneesmiddelen die de hemostase verstoren (bijv. NSAID's, aspirine en warfarine) ].
Drugsmisbruik en afhankelijkheid
Misbruik
In dierstudies vertoonde duloxetine geen barbituraatachtig (depressivum) misbruikpotentieel.
Hoewel CYMBALTA niet systematisch bij mensen is onderzocht vanwege het potentieel voor misbruik, waren er in de klinische onderzoeken geen aanwijzingen voor het zoeken naar geneesmiddelen. Het is echter niet mogelijk om op basis van premarketingervaring te voorspellen in hoeverre een geneesmiddel dat actief is op het centrale zenuwstelsel zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen artsen patiënten zorgvuldig te evalueren op een voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen, hen te observeren op tekenen van verkeerd gebruik of misbruik van CYMBALTA (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar medicijnen).
Afhankelijkheid
In onderzoeken naar drugsverslaving liet duloxetine geen afhankelijkheidsverwekkend vermogen zien bij ratten.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jonge volwassenen
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling.
Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (1824 jaar) met een depressieve stoornis ( MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. Het risico op verschillen (geneesmiddel versus placebo) was echter relatief stabiel binnen leeftijdsgroepen en indicaties. Deze risicoverschillen (drug-placebo verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden gegeven in Tabel 1.
In geen van de pediatrische CYMBALTA-onderzoeken traden zelfmoorden op. Er waren zelfmoorden in de onderzoeken met CYMBALTA 20 mg voor volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van CYMBALTA op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Als de beslissing is genomen om de behandeling te staken, moet de medicatie zo snel mogelijk worden afgebouwd, maar met de erkenning dat stopzetting gepaard kan gaan met bepaalde symptomen [zie DOSERING EN ADMINISTRATIE en Stopzettingssyndroom ] voor beschrijvingen van de risico's van stopzetting van CYMBALTA.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor CYMBALTA moeten worden geschreven voor de kleinste hoeveelheid capsules in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat CYMBALTA niet is goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
Hepatotoxiciteit
Er zijn meldingen geweest van leverfalen, soms fataal, bij patiënten die met CYMBALTA werden behandeld. Deze gevallen hebben zich voorgedaan als hepatitis met buikpijn, hepatomegalie en verhoging van de transaminasespiegels tot meer dan twintig keer de bovengrens van normaal (ULN) met of zonder geelzucht, wat wijst op een gemengd of hepatocellulair patroon van leverbeschadiging. CYMBALTA 30 mg dient te worden gestaakt bij patiënten die geelzucht of ander bewijs van klinisch significante leverdisfunctie ontwikkelen en mag niet worden hervat tenzij een andere oorzaak kan worden vastgesteld.
Gevallen van cholestatische geelzucht met minimale verhoging van de transaminasespiegels zijn ook gemeld. Andere postmarketingrapporten geven aan dat verhoogde transaminasen, bilirubine en alkalische fosfatase zijn opgetreden bij patiënten met chronische leverziekte of cirrose.
CYMBALTA verhoogde het risico op verhoging van de serumtransaminasespiegels in klinische onderzoeken in het ontwikkelingsprogramma. Verhogingen van levertransaminase leidden tot stopzetting van 0,3% (92/34.756) van de met CYMBALTA behandelde patiënten. Bij de meeste patiënten was de mediane tijd tot detectie van de transaminaseverhoging ongeveer twee maanden. In placebogecontroleerde onderzoeken bij volwassenen, bij patiënten met normale en abnormale baseline-ALAT-waarden, trad een verhoging van de ALAT >3 maal de ULN op bij 1,25% (144/11.496) van de met CYMBALTA behandelde patiënten vergeleken met 0,45% (39/8716) van placebo -behandelde patiënten. In placebogecontroleerde onderzoeken bij volwassenen met een vaste-dosisopzet was er bewijs van een dosis-responsrelatie van CYMBALTA voor ALT- en ASAT-verhoging van respectievelijk >3 maal de ULN en >5 maal de ULN.
Omdat het mogelijk is dat CYMBALTA en alcohol op elkaar inwerken om leverbeschadiging te veroorzaken of dat CYMBALTA 20 mg een reeds bestaande leverziekte kan verergeren, mag CYMBALTA niet worden voorgeschreven aan patiënten met aanzienlijk alcoholgebruik of aanwijzingen voor chronische leverziekte.
Orthostatische hypotensie, vallen en syncope
Orthostatische hypotensie, vallen en syncope zijn gemeld bij patiënten die werden behandeld met de aanbevolen doseringen van CYMBALTA. Syncope en orthostatische hypotensie treden meestal op in de eerste week van de behandeling, maar kunnen op elk moment tijdens de behandeling met CYMBALTA optreden, vooral na dosisverhogingen. Het risico op vallen lijkt verband te houden met de mate van orthostatische verlaging van de bloeddruk (BP) en met andere factoren die het onderliggende risico op vallen kunnen vergroten.
In een analyse van patiënten uit alle placebogecontroleerde onderzoeken rapporteerden patiënten die werden behandeld met CYMBALTA 20 mg een hoger percentage vallen in vergelijking met patiënten die met placebo werden behandeld. Het risico lijkt verband te houden met de aanwezigheid van orthostatische verlaging van de bloeddruk. Het risico op verlaging van de bloeddruk kan groter zijn bij patiënten die gelijktijdig geneesmiddelen gebruiken die orthostatische hypotensie induceren (zoals antihypertensiva) of die krachtige CYP1A2-remmers zijn (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Klinisch belangrijke geneesmiddelinteracties ] en bij patiënten die CYMBALTA 20 mg gebruiken in doses hoger dan 60 mg per dag. Bij patiënten die symptomatische orthostatische hypotensie, vallen en/of syncope ervaren tijdens de behandeling met CYMBALTA 40 mg, moet worden overwogen om de dosis te verlagen of te stoppen met CYMBALTA.
Het risico op vallen bleek ook evenredig te zijn met het onderliggende risico op vallen van een patiënt en leek gestaag toe te nemen met de leeftijd. Aangezien geriatrische patiënten doorgaans een hoger onderliggend risico op vallen hebben vanwege een hogere prevalentie van risicofactoren zoals het gebruik van meerdere medicijnen, medische comorbiditeiten en loopstoornissen, is de impact van het ouder worden op zich onduidelijk. Valpartijen met ernstige gevolgen, waaronder fracturen en ziekenhuisopnames, zijn gemeld bij gebruik van CYMBALTA 30 mg [zie: ONGEWENSTE REACTIES ].
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld met SNRI's en SSRI's, waaronder CYMBALTA 60 mg, alleen maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen). , en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine verminderen (in het bijzonder MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid en intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van CYMBALTA 30 mg met MAO-remmers is gecontra-indiceerd. CYMBALTA 60 mg mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die CYMBALTA gebruikt. CYMBALTA moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart [zie: DOSERING EN ADMINISTRATIE en CONTRA-INDICATIES ].
Als gelijktijdig gebruik van CYMBALTA 20 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan, amfetaminen en sint-janskruid klinisch gerechtvaardigd is, moeten patiënten op de hoogte worden gesteld van een mogelijk verhoogd risico op het serotoninesyndroom. , vooral tijdens de start van de behandeling en bij dosisverhogingen. Behandeling met CYMBALTA 60 mg en alle gelijktijdig gebruikte serotonerge middelen, moet onmiddellijk worden gestaakt als de bovenstaande gebeurtenissen optreden en ondersteunende symptomatische behandeling moet worden gestart.
Verhoogd risico op bloedingen
Geneesmiddelen die de remming van de heropname van serotonine verstoren, waaronder CYMBALTA, kunnen het risico op bloedingen verhogen. Case-reports en epidemiologische studies (case-control en cohort-design) hebben een verband aangetoond tussen het gebruik van geneesmiddelen die de heropname van serotonine verstoren en het optreden van gastro-intestinale bloedingen. Een postmarketingonderzoek toonde een hogere incidentie van postpartumbloedingen aan bij moeders die CYMBALTA gebruikten. Andere bloedingen die verband houden met het gebruik van SSRI's en SNRI's varieerden van ecchymosen, hematomen, epistaxis en petechiën tot levensbedreigende bloedingen. Gelijktijdig gebruik van aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), warfarine en andere anticoagulantia kan dit risico vergroten.
Informeer patiënten over het risico op bloedingen bij gelijktijdig gebruik van CYMBALTA en NSAID's, aspirine of andere geneesmiddelen die de stolling beïnvloeden (zie DRUG-INTERACTIES ].
Ernstige huidreacties
Ernstige huidreacties, waaronder erythema multiforme en Stevens-Johnson-syndroom (SJS), kunnen optreden bij CYMBALTA. Het aantal meldingen van SJS in verband met het gebruik van CYMBALTA overschrijdt de achtergrondincidentie bij de algemene bevolking voor deze ernstige huidreactie (1 tot 2 gevallen per miljoen persoonsjaren). Door onderrapportage wordt algemeen aangenomen dat het rapportagepercentage een onderschatting is.
CYMBALTA dient te worden gestaakt bij het eerste optreden van blaren, huiduitslag, slijmvlieserosie of enig ander teken van overgevoeligheid als er geen andere etiologie kan worden vastgesteld.
Stopzettingssyndroom
Symptomen van stopzetting zijn systematisch geëvalueerd bij patiënten die CYMBALTA gebruiken. Na abrupte of geleidelijke stopzetting in placebogecontroleerde klinische onderzoeken bij volwassenen, traden de volgende symptomen op bij 1% of meer en in een significant hoger percentage bij met CYMBALTA behandelde patiënten vergeleken met degenen die stopten met placebo: duizeligheid, hoofdpijn, misselijkheid, diarree, paresthesie, prikkelbaarheid, braken, slapeloosheid, angst, hyperhidrose en vermoeidheid.
Tijdens het op de markt brengen van andere SSRI's en SNRI's (serotonine- en noradrenalineheropnameremmers) zijn er spontane meldingen geweest van bijwerkingen die optraden na stopzetting van deze geneesmiddelen, met name bij abrupte, waaronder de volgende: dysfore stemming, prikkelbaarheid, opwinding, duizeligheid, sensorische stoornissen ( bijvoorbeeld paresthesieën zoals elektrische schokken), angst, verwardheid, hoofdpijn, lethargie, emotionele labiliteit, slapeloosheid, hypomanie, oorsuizen en toevallen. Hoewel deze voorvallen over het algemeen zelfbeperkend zijn, is van sommige gemeld dat ze ernstig zijn.
Patiënten moeten op deze symptomen worden gecontroleerd wanneer de behandeling met CYMBALTA wordt stopgezet. Waar mogelijk wordt een geleidelijke verlaging van de dosis aanbevolen in plaats van abrupt stoppen. Als ondraaglijke symptomen optreden na een verlaging van de dosis of na stopzetting van de behandeling, kan worden overwogen om de eerder voorgeschreven dosis te hervatten. Vervolgens kan de zorgverlener doorgaan met het verlagen van de dosis, maar in een meer geleidelijk tempo [zie DOSERING EN ADMINISTRATIE ].
Activering van manie/hypomanie
In placebogecontroleerde onderzoeken bij volwassenen bij patiënten met MDD werd activering van manie of hypomanie gemeld bij 0,1% (4/3779) van de met CYMBALTA behandelde patiënten en 0,04% (1/2536) van de met placebo behandelde patiënten. Er werd geen activering van manie of hypomanie gemeld in placebogecontroleerde onderzoeken naar DPNP, GAD, fibromyalgie of chronische musculoskeletale pijn. Activering van manie of hypomanie is gemeld bij een klein deel van de patiënten met stemmingsstoornissen die werden behandeld met andere in de handel verkrijgbare geneesmiddelen die effectief waren bij de behandeling van depressieve stoornis. Net als bij deze andere middelen dient CYMBALTA 60 mg met voorzichtigheid te worden gebruikt bij patiënten met een voorgeschiedenis van manie.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na gebruik van veel antidepressiva, waaronder CYMBALTA, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan.
epileptische aanvallen
CYMBALTA is niet systematisch geëvalueerd bij patiënten met een epileptische aandoening en dergelijke patiënten werden uitgesloten van klinische onderzoeken. In placebogecontroleerde klinische onderzoeken bij volwassenen kwamen convulsies/convulsies voor bij 0,02% (3/12.722) van de patiënten die werden behandeld met CYMBALTA 60 mg en bij 0,01% (1/9513) van de patiënten die werden behandeld met placebo. CYMBALTA moet met zorg worden voorgeschreven aan patiënten met een voorgeschiedenis van epileptische aanvallen.
Verhogingen van de bloeddruk
In placebogecontroleerde klinische onderzoeken bij volwassenen bij de goedgekeurde volwassen populaties van baseline tot eindpunt, werd behandeling met CYMBALTA in verband gebracht met gemiddelde stijgingen van 0,5 mm Hg in systolische bloeddruk en 0,8 mm Hg in diastolische bloeddruk vergeleken met gemiddelde dalingen van 0,6 mm Hg systolische en 0,3 mm Hg diastolisch bij met placebo behandelde patiënten. Er was geen significant verschil in de frequentie van aanhoudende (3 opeenvolgende bezoeken) verhoogde bloeddruk. In een klinisch farmacologisch onderzoek dat was opgezet om de effecten van CYMBALTA 60 mg op verschillende parameters te evalueren, waaronder bloeddruk bij supratherapeutische doses met een versnelde dosistitratie, waren er aanwijzingen voor verhogingen van de bloeddruk in liggende houding bij doses tot 200 mg tweemaal daags (ongeveer 3,3 maal daags). de maximaal aanbevolen dosering). Bij de hoogste dosis van 200 mg tweemaal daags was de stijging van de gemiddelde hartslag 5,0 tot 6,8 slagen en de stijging van de gemiddelde bloeddruk was 4,7 tot 6,8 mm Hg (systolisch) en 4,5 tot 7 mm Hg (diastolisch) tot 12 uur na toediening .
De bloeddruk moet worden gemeten voordat de behandeling wordt gestart en periodiek tijdens de behandeling worden gemeten [zie: ONGEWENSTE REACTIES ].
Klinisch belangrijke geneesmiddelinteracties
Zowel CYP1A2 als CYP2D6 zijn verantwoordelijk voor het metabolisme van CYMBALTA.
Potentieel voor andere geneesmiddelen om CYMBALTA te beïnvloeden
CYP1A2-remmers
Gelijktijdige toediening van CYMBALTA 40 mg met krachtige CYP1A2-remmers moet worden vermeden (zie DRUG-INTERACTIES ].
CYP2D6-remmers
Omdat CYP2D6 betrokken is bij het metabolisme van CYMBALTA, wordt verwacht dat gelijktijdig gebruik van CYMBALTA met krachtige remmers van CYP2D6 leidt tot hogere concentraties (gemiddeld 60%) van CYMBALTA (zie DRUG-INTERACTIES ].
Potentieel voor CYMBALTA 30 mg om andere geneesmiddelen te beïnvloeden
Geneesmiddelen gemetaboliseerd door CYP2D6
Gelijktijdige toediening van CYMBALTA 20 mg met geneesmiddelen die uitgebreid worden gemetaboliseerd door CYP2D6 en die een smalle therapeutische index hebben, waaronder bepaalde antidepressiva (tricyclische antidepressiva [TCA's], zoals nortriptyline, amitriptyline en imipramine), fenothiazinen en type 1C antiaritmica (bijv. propafenon, flecaïnide), moet met voorzichtigheid worden benaderd. Plasma TCA-concentraties moeten mogelijk worden gecontroleerd en de dosis van de TCA moet mogelijk worden verlaagd als een TCA gelijktijdig wordt toegediend met CYMBALTA. Vanwege het risico op ernstige ventriculaire aritmieën en plotselinge dood, mogelijk geassocieerd met verhoogde plasmaspiegels van thioridazine, dienen CYMBALTA 30 mg en thioridazine niet gelijktijdig te worden toegediend [zie DRUG-INTERACTIES ].
Andere klinisch belangrijke geneesmiddelinteracties
Alcohol
Het gelijktijdig gebruik van CYMBALTA 40 mg met zware alcoholinname kan gepaard gaan met ernstig leverletsel. Om deze reden mag CYMBALTA 60 mg niet worden voorgeschreven aan patiënten met aanzienlijk alcoholgebruik [zie: Hepatotoxiciteit en DRUG-INTERACTIES ].
CZS-werkende medicijnen
Gezien de primaire effecten van CYMBALTA op het centrale zenuwstelsel, moet het met voorzichtigheid worden gebruikt wanneer het wordt ingenomen in combinatie met of als vervanging voor andere centraal werkende geneesmiddelen, waaronder geneesmiddelen met een vergelijkbaar werkingsmechanisme [zie Klinisch belangrijke geneesmiddelinteracties en DRUG-INTERACTIES ].
Hyponatriëmie
Hyponatriëmie kan optreden als gevolg van behandeling met SSRI's en SNRI's, waaronder CYMBALTA. In veel gevallen lijkt deze hyponatriëmie het gevolg te zijn van het syndroom van ongepaste antidiuretisch hormoonsecretie (SIADH). Gevallen met serumnatrium lager dan 110 mmol/L zijn gemeld bij gebruik van CYMBALTA 40 mg en leken reversibel te zijn wanneer CYMBALTA werd stopgezet. Geriatrische patiënten lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met SSRI's en SNRI's. Ook kunnen patiënten die diuretica gebruiken of die anderszins een volumedepletie hebben een groter risico lopen [zie: Gebruik bij specifieke populaties ]. Bij patiënten met symptomatische hyponatriëmie moet worden overwogen om de behandeling met CYMBALTA te staken en er moet passende medische interventie worden ingesteld.
Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Ernstigere en/of acute gevallen zijn in verband gebracht met hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden.
Gebruik bij patiënten met gelijktijdige ziekte
Klinische ervaring met CYMBALTA bij patiënten met gelijktijdige systemische ziekten is beperkt. Er is geen informatie over het effect dat veranderingen in de maagmotiliteit kunnen hebben op de stabiliteit van de enterische coating van CYMBALTA. In extreem zure omstandigheden kan CYMBALTA, niet beschermd door de enterische coating, hydrolyse ondergaan om naftol te vormen. Voorzichtigheid is geboden bij het gebruik van CYMBALTA bij patiënten met aandoeningen die de maaglediging kunnen vertragen (bijv. sommige diabetici).
CYMBALTA 30 mg is niet systematisch geëvalueerd bij patiënten met een recente voorgeschiedenis van een myocardinfarct of instabiele coronaire hartziekte. Patiënten met deze diagnoses werden over het algemeen uitgesloten van klinische onderzoeken tijdens de premarketingtests van het product.
Leverfunctiestoornis
Vermijd het gebruik bij patiënten met chronische leverziekte of cirrose [zie: DOSERING EN ADMINISTRATIE , Hepatotoxiciteit , en Gebruik bij specifieke populaties ].
Ernstige nierfunctiestoornis
Vermijd het gebruik bij patiënten met ernstige nierinsufficiëntie, GFR DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Glycemische controle bij patiënten met diabetes
Zoals waargenomen in DPNP-onderzoeken, verslechterde de behandeling met CYMBALTA 30 mg de glykemische controle bij sommige patiënten met diabetes. In drie klinische onderzoeken met CYMBALTA voor de behandeling van neuropathische pijn geassocieerd met diabetische perifere neuropathie [zie Klinische studies ], de gemiddelde duur van diabetes was ongeveer 12 jaar, de gemiddelde nuchtere bloedglucose op baseline was 176 mg/dL en de gemiddelde hemoglobine A1c (HbA1c) bij baseline was 7,8%. In de 12 weken durende acute behandelingsfase van deze onderzoeken werd CYMBALTA in verband gebracht met een kleine verhoging van de gemiddelde nuchtere bloedglucose in vergelijking met placebo. In de verlengingsfase van deze onderzoeken, die tot 52 weken duurden, steeg de gemiddelde nuchtere bloedglucose met 12 mg/dL in de CYMBALTA 40 mg-groep en daalde met 11,5 mg/dL in de routinezorggroep. HbA1c nam toe met 0,5% in de groep met CYMBALTA 40 mg en met 0,2% in de groep met routinematige zorg.
Urinaire aarzeling en retentie
CYMBALTA 60 mg zit in een klasse geneesmiddelen waarvan bekend is dat ze de resistentie van de urethra beïnvloeden. Als zich symptomen van urinaire aarzeling ontwikkelen tijdens de behandeling met CYMBALTA 20 mg, moet rekening worden gehouden met de mogelijkheid dat deze mogelijk verband houden met het geneesmiddel.
Tijdens postmarketingervaring zijn gevallen van urineretentie waargenomen. In sommige gevallen van urineretentie in verband met het gebruik van CYMBALTA 60 mg was ziekenhuisopname en/of katheterisatie nodig.
Seksuele disfunctie
Het gebruik van SNRI's, waaronder CYMBALTA 60 mg, kan symptomen van seksuele disfunctie veroorzaken [zie: ONGEWENSTE REACTIES ]. Bij mannelijke patiënten kan het gebruik van SNRI leiden tot vertraging of falen van de ejaculatie, verminderd libido en erectiestoornissen. Bij vrouwelijke patiënten kan het gebruik van SNRI resulteren in een verminderd libido en een vertraagd of afwezig orgasme.
Het is belangrijk voor voorschrijvers om te informeren naar de seksuele functie voordat met CYMBALTA 40 mg wordt gestart en om specifiek te informeren naar veranderingen in de seksuele functie tijdens de behandeling, omdat seksuele functie mogelijk niet spontaan wordt gemeld. Bij het evalueren van veranderingen in seksuele functie is het verkrijgen van een gedetailleerde geschiedenis (inclusief timing van het begin van de symptomen) belangrijk omdat seksuele symptomen andere oorzaken kunnen hebben, waaronder de onderliggende psychiatrische stoornis. Bespreek mogelijke managementstrategieën om patiënten te ondersteunen bij het nemen van weloverwogen beslissingen over de behandeling.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Suïcidale gedachten en gedrag
Adviseer patiënten, hun families en hun verzorgers te letten op het ontstaan van zelfmoordgedachten en zelfmoordgedrag, vooral tijdens de behandeling en wanneer de dosis naar boven of naar beneden wordt aangepast en instrueer hen om dergelijke symptomen aan hun zorgverlener te melden [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Administratie
Adviseer patiënten om CYMBALTA 20 mg in zijn geheel door te slikken en de capsule niet te kauwen, fijn te maken of te openen (de inhoud niet op voedsel sprenkelen of vermengen met vloeistoffen), omdat deze acties de enterische coating kunnen aantasten.
Hepatotoxiciteit
Informeer patiënten dat ernstige leverproblemen, soms fataal, zijn gemeld bij patiënten die met CYMBALTA werden behandeld. Instrueer patiënten om met hun zorgverlener te praten als ze jeuk, pijn in de rechterbovenbuik, donkere urine of gele huid/ogen krijgen tijdens het gebruik van CYMBALTA, wat tekenen kan zijn van leverproblemen. Instrueer patiënten om met hun zorgverlener te praten over hun alcoholgebruik. Het gebruik van CYMBALTA bij zware alcoholinname kan gepaard gaan met ernstig leverletsel [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Alcohol
Hoewel CYMBALTA de door alcohol veroorzaakte beschadiging van mentale en motorische vaardigheden niet verhoogt, kan gelijktijdig gebruik van CYMBALTA met zware alcoholconsumptie gepaard gaan met ernstig leverletsel (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Orthostatische hypotensie, vallen en syncope
Adviseer patiënten over het risico van orthostatische hypotensie, vallen en syncope, vooral tijdens de periode van eerste gebruik en daaropvolgende dosisverhoging, en in combinatie met gelijktijdig gebruik van geneesmiddelen die het orthostatische effect van CYMBALTA kunnen versterken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
serotonine syndroom
Pas op voor patiënten met het risico op serotoninesyndroom bij gelijktijdig gebruik van CYMBALTA 30 mg en andere serotonerge middelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan, amfetaminen en sint-janskruid [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ]. Adviseer patiënten over de tekenen en symptomen die gepaard gaan met het serotoninesyndroom, waaronder veranderingen in de mentale toestand (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire veranderingen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Waarschuw patiënten om onmiddellijk medische hulp in te roepen als ze deze symptomen ervaren.
Verhoogd risico op bloedingen
Pas op voor patiënten met gelijktijdig gebruik van CYMBALTA 30 mg en NSAID's, aspirine, warfarine of andere geneesmiddelen die de stolling beïnvloeden, aangezien gecombineerd gebruik van psychotrope geneesmiddelen die de heropname van serotonine verstoren en deze middelen in verband zijn gebracht met een verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Ernstige huidreacties
Let op patiënten dat CYMBALTA ernstige huidreacties kan veroorzaken. Dit moet mogelijk in een ziekenhuis worden behandeld en kan levensbedreigend zijn. Raad patiënten aan om onmiddellijk hun arts te bellen of noodhulp te krijgen als ze huidblaren, vervellende uitslag, zweren in hun mond, netelroos of andere allergische reacties hebben [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzetting van de behandeling
Instrueer patiënten dat stopzetting van CYMBALTA 30 mg gepaard kan gaan met symptomen zoals duizeligheid, hoofdpijn, misselijkheid, diarree, paresthesie, prikkelbaarheid, braken, slapeloosheid, angst, hyperhidrose en vermoeidheid, en moet worden geadviseerd hun doseringsschema niet te wijzigen of te stoppen CYMBALTA gebruiken zonder hun zorgverlener te raadplegen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Activering van manie of hypomanie
Screen patiënten met depressieve symptomen adequaat op het risico van een bipolaire stoornis (bijv. familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie) voordat de behandeling met CYMBALTA wordt gestart. Adviseer patiënten om alle tekenen of symptomen van een manische reactie te melden, zoals sterk verhoogde energie, ernstige slaapproblemen, snelle gedachten, roekeloos gedrag, meer of sneller praten dan normaal, ongewoon grootse ideeën en overmatig geluk of prikkelbaarheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hoeksluiting glaucoom
Adviseer patiënten dat het gebruik van CYMBALTA 40 mg lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen misschien worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
epileptische aanvallen
Adviseer patiënten om hun zorgverlener te informeren als ze een voorgeschiedenis hebben van epileptische aandoeningen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Effecten op de bloeddruk
Pas op voor patiënten dat CYMBALTA 60 mg een verhoging van de bloeddruk kan veroorzaken [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdige medicatie
Adviseer patiënten om hun zorgverlener te informeren als ze medicijnen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken, aangezien er een kans op interacties is [zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en DRUG-INTERACTIES ].
Hyponatriëmie
Adviseer patiënten dat hyponatriëmie is gemeld als gevolg van behandeling met SNRI's en SSRI's, waaronder CYMBALTA. Adviseer patiënten over de tekenen en symptomen van hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].

Gelijktijdige ziekten
Adviseer patiënten om hun zorgverlener te informeren over al hun medische aandoeningen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Urinaire aarzeling en retentie
CYMBALTA zit in een klasse geneesmiddelen die het plassen kunnen beïnvloeden. Instrueer patiënten om hun zorgverlener te raadplegen als ze problemen krijgen met de urinestroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Seksuele disfunctie
Adviseer patiënten dat het gebruik van CYMBALTA 40 mg symptomen van seksuele disfunctie kan veroorzaken bij zowel mannelijke als vrouwelijke patiënten. Informeer patiënten dat ze eventuele veranderingen in de seksuele functie en mogelijke managementstrategieën met hun zorgverlener moeten bespreken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
- Adviseer vrouwen om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met CYMBALTA.
- Adviseer zwangere vrouwen of patiënten die zwanger willen worden dat het gebruik van CYMBALTA 40 mg in de maand voor de bevalling kan leiden tot een verhoogd risico op postpartumbloeding en het risico op neonatale complicaties die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen.
- Adviseer zwangere vrouwen dat er een risico is op terugval bij het staken van antidepressiva.
- Adviseer patiënten dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan duloxetine zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven en die CYMBALTA 30 mg gebruiken om baby's te controleren op sedatie, slechte voeding en slechte gewichtstoename en om medische hulp in te roepen als ze deze symptomen opmerken [zie Gebruik bij specifieke populaties ].
Interferentie met psychomotorische prestaties
CYMBALTA 30 mg kan in verband worden gebracht met sedatie en duizeligheid. Waarschuw patiënten daarom voor het bedienen van gevaarlijke machines, waaronder auto's, totdat ze er redelijk zeker van zijn dat CYMBALTA-therapie hun vermogen om dergelijke activiteiten uit te voeren niet beïnvloedt.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Duloxetine werd gedurende 2 jaar via de voeding aan muizen en ratten toegediend.
Bij vrouwelijke muizen die 140 mg/kg/dag duloxetine kregen (3 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 120 mg/dag gegeven aan kinderen op basis van mg/m2), was er een verhoogde incidentie van hepatocellulaire adenomen en carcinomen. De dosis zonder effect was 50 mg/kg/dag (1 keer de MRHD gegeven aan kinderen). De tumorincidentie was niet verhoogd bij mannelijke muizen die duloxetine kregen in doses tot 100 mg/kg/dag (2 maal de MRHD die aan kinderen werd gegeven).
Bij ratten verhoogden voedingsdoses duloxetine tot 27 mg/kg/dag bij vrouwtjes (1 keer de MRHD gegeven aan kinderen) en tot 36 mg/kg/dag bij mannetjes (1,4 keer de MRHD gegeven aan kinderen) de voorkomen van tumoren.
Mutagenese
Duloxetine was niet mutageen in de in vitro bacteriële reverse-mutatietest (Ames-test) en was niet clastogeen in een in vivo chromosomale aberratietest in beenmergcellen van muizen. Bovendien was duloxetine niet genotoxisch in een in vitro voorwaartse genmutatietest bij zoogdieren in lymfoomcellen van muizen of in een in vitro ongeplande DNA-synthese (UDS) test in primaire hepatocyten van ratten, en induceerde het in vivo geen uitwisseling van zusterchromatiden in beenmerg van Chinese hamsters .
Aantasting van de vruchtbaarheid
Duloxetine oraal toegediend aan mannelijke of vrouwelijke ratten voorafgaand aan en tijdens de paring in doses tot 45 mg/kg/dag (3 maal de MRHD gegeven aan adolescenten op basis van mg/m2) veranderde de paring of vruchtbaarheid niet.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan CYMBALTA zijn blootgesteld. Neem voor aanmelding contact op met het CYMBALTA Pregnancy Registry op 1-866-814-6975 of www.cymbalta 20mgpregnancyregistry.com.
Risico Samenvatting
Gegevens uit een postmarketing retrospectief cohortonderzoek geven aan dat het gebruik van duloxetine in de maand voor de bevalling gepaard kan gaan met een verhoogd risico op postpartumbloeding. Gegevens uit gepubliceerde literatuur en uit een retrospectief cohortonderzoek na het in de handel brengen hebben geen duidelijk met het geneesmiddel geassocieerd risico op ernstige geboorteafwijkingen of andere nadelige ontwikkelingsresultaten aangetoond (zie Gegevens ). Er zijn risico's verbonden aan onbehandelde depressie en fibromyalgie tijdens de zwangerschap, en aan blootstelling aan SNRI's en SSRI's, waaronder CYMBALTA, tijdens de zwangerschap (zie Klinische overwegingen ).
Bij ratten en konijnen die werden behandeld met duloxetine tijdens de periode van organogenese, was het foetale gewicht afgenomen, maar er waren geen aanwijzingen voor ontwikkelingseffecten bij doses tot respectievelijk 3 en 6 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 120 mg/dag gegeven voor adolescenten op een mg/m2 basis. Wanneer duloxetine oraal werd toegediend aan drachtige ratten tijdens de dracht en lactatie, waren het gewicht van de pups bij de geboorte en de overleving van de pups tot 1 dag postpartum verlaagd bij een dosis die tweemaal zo hoog was als de MRHD die aan adolescenten werd gegeven op basis van mg/m2. Bij deze dosis werden pupgedrag waargenomen dat consistent was met verhoogde reactiviteit, zoals verhoogde schrikreactie op geluid en verminderde gewenning aan locomotorische activiteit. De groei na het spenen werd niet negatief beïnvloed.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Vrouwen die stoppen met antidepressiva tijdens de zwangerschap hebben meer kans op een terugval van een ernstige depressie dan vrouwen die doorgaan met antidepressiva. Deze bevinding komt uit een prospectief, longitudinaal onderzoek dat 201 zwangere vrouwen met een voorgeschiedenis van depressieve stoornis volgde die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten. Overweeg het risico op onbehandelde depressie bij het stopzetten of wijzigen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Zwangere vrouwen met fibromyalgie lopen een verhoogd risico op nadelige maternale en babyuitkomsten, waaronder premature premature breuk van de vliezen, vroeggeboorte, klein voor de zwangerschapsduur, intra-uteriene groeibeperking, placenta-disruptie en veneuze trombose. Het is niet bekend of deze nadelige maternale en foetale uitkomsten een direct gevolg zijn van fibromyalgie of andere comorbide factoren.
Maternale bijwerkingen
Het gebruik van duloxetine in de maand voor de bevalling kan gepaard gaan met een verhoogd risico op postpartumbloeding [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Foetale/neonatale bijwerking
Pasgeborenen die laat in het derde trimester aan CYMBALTA en andere SNRI's of SSRI's zijn blootgesteld, hebben complicaties ontwikkeld die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen. Dergelijke complicaties kunnen direct na de bevalling optreden. Gerapporteerde klinische bevindingen omvatten ademnood, cyanose, apneu, toevallen, temperatuurinstabiliteit, voedingsproblemen, braken, hypoglykemie, hypotonie, hypertonie, hyperreflexie, tremor, zenuwachtigheid, prikkelbaarheid en constant huilen. Deze bevindingen komen overeen met ofwel een direct toxisch effect van de SNRI's of SSRI's, of mogelijk een syndroom van stopzetting van het geneesmiddel. Opgemerkt moet worden dat in sommige gevallen het klinische beeld consistent is met het serotoninesyndroom [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gegevens
Menselijke gegevens
Gegevens van een postmarketing retrospectief cohortonderzoek op basis van claims vonden een verhoogd risico op postpartumbloeding bij 955 zwangere vrouwen die in de laatste maand van de zwangerschap waren blootgesteld aan duloxetine in vergelijking met 4.128.460 niet-blootgestelde zwangere vrouwen (aangepast relatief risico: 1,53; 95% BI: 1,08-2,18 ). Dezelfde studie vond geen klinisch betekenisvolle toename van het risico op ernstige geboorteafwijkingen in de vergelijking van 2532 vrouwen die in het eerste trimester van de zwangerschap aan duloxetine waren blootgesteld met 1.284.827 niet-blootgestelde vrouwen na correctie voor verschillende verstorende factoren. Methodologische beperkingen zijn onder meer mogelijke resterende confounding, verkeerde classificatie van blootstelling en resultaten, gebrek aan directe metingen van de ernst van de ziekte en gebrek aan informatie over alcoholgebruik, voeding en blootstelling aan vrij verkrijgbare medicijnen.
Dierlijke gegevens
In reproductiestudies bij dieren is aangetoond dat duloxetine nadelige effecten heeft op de embryonale/foetale en postnatale ontwikkeling.
Wanneer duloxetine oraal werd toegediend aan drachtige ratten en konijnen tijdens de periode van organogenese, waren er geen aanwijzingen voor misvormingen of ontwikkelingsvariaties bij doses tot 45 mg/kg/dag [respectievelijk 3 en 6 maal de MRHD van 120 mg/dag gegeven aan adolescenten op een mg/m2 basis]. Het foetale gewicht nam echter af bij deze dosis, met een dosis zonder effect van 10 mg/kg/dag (ongeveer gelijk aan de MRHD bij ratten en 2 maal de MRHD bij konijnen).
Wanneer duloxetine oraal werd toegediend aan drachtige ratten tijdens de dracht en lactatie, was de overleving van de pups tot 1 dag postpartum en het lichaamsgewicht van de pups bij de geboorte en tijdens de lactatieperiode verminderd bij een dosis van 30 mg/kg/dag (2 maal de MRHD die werd gegeven). voor adolescenten op een mg/m2 basis); de dosis zonder effect was 10 mg/kg/dag. Bovendien werden gedragingen waargenomen die consistent waren met verhoogde reactiviteit, zoals verhoogde schrikreactie op geluid en verminderde gewenning aan locomotorische activiteit, waargenomen bij pups na maternale blootstelling aan 30 mg/kg/dag. De groei na het spenen en de reproductieprestaties van het nageslacht werden niet nadelig beïnvloed door maternale behandeling met duloxetine.
Borstvoeding
Risico Samenvatting
Gegevens uit gepubliceerde literatuur melden de aanwezigheid van duloxetine in moedermelk (zie: Gegevens ). Er zijn meldingen van sedatie, slechte voeding en slechte gewichtstoename bij zuigelingen die via de moedermelk aan duloxetine zijn blootgesteld (zie Klinische overwegingen ). Er zijn geen gegevens over het effect van duloxetine op de melkproductie.
Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan CYMBALTA en eventuele nadelige effecten op het kind dat borstvoeding krijgt van CYMBALTA of van de onderliggende maternale aandoening.
Klinische overwegingen
Baby's die aan CYMBALTA zijn blootgesteld, moeten worden gecontroleerd op sedatie, slechte voeding en slechte gewichtstoename.
Gegevens
De beschikbaarheid van CYMBALTA 60 mg werd onderzocht bij 6 vrouwen die borstvoeding gaven en die ten minste 12 weken postpartum waren en ervoor hadden gekozen hun zuigelingen te spenen. De vrouwen kregen gedurende 3,5 dagen tweemaal daags 40 mg CYMBALTA 60 mg. De piekconcentratie gemeten in moedermelk trad op met een mediaan van 3 uur na de dosis. De hoeveelheid CYMBALTA in moedermelk was ongeveer 7 mcg/dag tijdens die dosis; de geschatte dagelijkse zuigelingendosis was ongeveer 2 mcg/kg/dag, wat minder is dan 1% van de maternale dosis. De aanwezigheid van CYMBALTA 40 mg metabolieten in moedermelk is niet onderzocht.
Pediatrisch gebruik
De veiligheid en werkzaamheid van CYMBALTA 60 mg zijn vastgesteld voor de behandeling van gegeneraliseerde angststoornis (GAD) bij patiënten van 7 tot 17 jaar en voor de behandeling van juveniel fibromyalgiesyndroom bij patiënten van 13 tot 17 jaar. De veiligheid en werkzaamheid van CYMBALTA 20 mg zijn niet vastgesteld bij pediatrische patiënten met depressieve stoornis (MDD), diabetische perifere neuropathische pijn of chronische musculoskeletale pijn.
Antidepressiva verhoogden het risico op suïcidale gedachten en gedrag bij pediatrische patiënten. Controleer alle pediatrische patiënten die worden behandeld met antidepressiva op klinische verslechtering en het optreden van zelfmoordgedachten en -gedragingen, vooral tijdens de eerste paar maanden van de behandeling of op tijdstippen van doseringswijzigingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Voer regelmatig controle uit van het gewicht en de groei bij pediatrische patiënten die met CYMBALTA worden behandeld [zie: ONGEWENSTE REACTIES ].
Gegeneraliseerde angststoornis
Het gebruik van CYMBALTA voor de behandeling van GAD bij patiënten van 7 tot 17 jaar wordt ondersteund door een placebogecontroleerd onderzoek van 10 weken (GAD-6). De studie omvatte 272 pediatrische patiënten met GAS, van wie 47% 7 tot 11 jaar oud was (53% was 12 tot 17 jaar oud). CYMBALTA toonde superioriteit ten opzichte van placebo, zoals gemeten aan de hand van een grotere verbetering in de Pediatric Anxiety Rating Scale (PAS) voor de GAD-ernstscore [zie Klinische studies ].
De veiligheid en werkzaamheid van CYMBALTA 20 mg voor de behandeling van GAS bij pediatrische patiënten jonger dan 7 jaar zijn niet vastgesteld.
Fibromyalgie
Het gebruik van CYMBALTA voor de behandeling van fibromyalgie bij patiënten van 13 tot 17 jaar wordt ondersteund door een 13 weken durende placebogecontroleerde studie bij 184 patiënten met juveniel fibromyalgiesyndroom (onderzoek FM-4). CYMBALTA toonde verbetering ten opzichte van placebo op het primaire eindpunt, verandering van baseline tot einde van de behandeling op de Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-uurs gemiddelde pijnernstclassificatie [zie Klinische studies ].
De veiligheid en werkzaamheid van CYMBALTA voor de behandeling van fibromyalgie bij patiënten jonger dan 13 jaar zijn niet vastgesteld.
Ernstige depressieve stoornis
De veiligheid en werkzaamheid van CYMBALTA zijn niet vastgesteld bij pediatrische patiënten voor de behandeling van MDD.
De werkzaamheid van CYMBALTA werd niet aangetoond in twee 10 weken durende, placebogecontroleerde onderzoeken met 800 pediatrische patiënten van 7 tot 17 jaar met MDD (MDD-6 en MDD-7). Noch CYMBALTA, noch een actieve controle (goedgekeurd voor de behandeling van MDD bij kinderen) was superieur aan placebo.
De meest frequent waargenomen bijwerkingen in de MDD pediatrische klinische onderzoeken waren misselijkheid, hoofdpijn, gewichtsverlies en buikpijn. Verminderde eetlust en gewichtsverlies zijn waargenomen in verband met het gebruik van SSRI's en SNRI's.
Toxicologische gegevens bij jonge dieren
Toediening van duloxetine aan jonge ratten vanaf postnatale dag 21 (spenen) tot postnatale dag 90 (volwassene) resulteerde in een verminderd lichaamsgewicht dat aanhield tot in de volwassenheid, maar herstelde toen de medicamenteuze behandeling werd stopgezet; enigszins vertraagde (~1,5 dagen) seksuele rijping bij vrouwen, zonder enig effect op de vruchtbaarheid; en een vertraging bij het leren van een complexe taak op volwassen leeftijd, die niet werd waargenomen nadat de medicamenteuze behandeling was stopgezet. Deze effecten werden waargenomen bij de hoge dosis van 45 mg/kg/dag (2 maal de MRHD voor een kind); het niveau zonder effect was 20 mg/kg/dag (≈1 maal de MRHD, voor een kind).
Geriatrisch gebruik
Geriatrische blootstelling in premarketing klinische onderzoeken van CYMBALTA
- Van de 2.418 patiënten in MDD-onderzoeken was 6% (143) 65 jaar of ouder.
- Van de 1041 patiënten in CLBP-onderzoeken was 21% (221) 65 jaar of ouder.
- Van de 487 patiënten in OA-onderzoeken was 41% (197) 65 jaar of ouder.
- Van de 1.074 patiënten in de DPNP-onderzoeken was 33% (357) 65 jaar of ouder.
- Van de 1.761 patiënten in FM-onderzoeken was 8% (140) 65 jaar of ouder.
In de MDD-, GAD-, DPNP-, FM-, OA- en CLBP-onderzoeken werden in het algemeen geen verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere volwassen patiënten, en andere gerapporteerde klinische ervaring heeft geen verschillen in respons tussen deze geriatrische en jongere patiënten aangetoond. volwassen patiënten, maar een grotere gevoeligheid van sommige oudere patiënten kan niet worden uitgesloten.
SSRI's en SNRI's, waaronder CYMBALTA, zijn in verband gebracht met klinisch significante hyponatriëmie bij geriatrische patiënten, die mogelijk een groter risico lopen op deze bijwerking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In een analyse van gegevens van alle placebogecontroleerde onderzoeken rapporteerden met CYMBALTA behandelde patiënten een hoger valpercentage dan met placebo behandelde patiënten. Het verhoogde risico lijkt evenredig te zijn met het onderliggende risico op vallen van een patiënt. Het onderliggende risico lijkt gestaag toe te nemen met de leeftijd. Aangezien geriatrische patiënten een hogere prevalentie hebben van risicofactoren voor vallen, zoals medicatie, medische comorbiditeiten en loopstoornissen, is de impact van het stijgen van de leeftijd op zichzelf op vallen tijdens behandeling met CYMBALTA 30 mg onduidelijk. Valpartijen met ernstige gevolgen, waaronder botbreuken en ziekenhuisopnames, zijn gemeld bij gebruik van CYMBALTA [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
De farmacokinetiek van duloxetine na een enkelvoudige dosis van 40 mg werd vergeleken bij gezonde oudere vrouwen (65 tot 77 jaar) en gezonde vrouwen van middelbare leeftijd (32 tot 50 jaar). Er was geen verschil in de Cmax, maar de AUC van duloxetine was iets (ongeveer 25%) hoger en de halfwaardetijd ongeveer 4 uur langer bij oudere vrouwen. Farmacokinetische populatieanalyses suggereren dat de typische waarden voor klaring afnemen met ongeveer 1% voor elk jaar tussen 25 en 75 jaar; maar leeftijd als voorspellende factor verklaart slechts een klein percentage van de variabiliteit tussen patiënten. Aanpassing van de dosering op basis van de leeftijd van de volwassen patiënt is niet nodig.
Geslacht
De halfwaardetijd van duloxetine is vergelijkbaar bij mannen en vrouwen. Dosisaanpassing op basis van geslacht is niet nodig.
Rookstatus
De biologische beschikbaarheid (AUC) van duloxetine lijkt bij rokers met ongeveer een derde te zijn verminderd. Doseringsaanpassingen worden niet aanbevolen voor rokers.
Ras
Er is geen specifiek farmacokinetisch onderzoek uitgevoerd om de effecten van ras te onderzoeken.
Leverfunctiestoornis
Bij patiënten met een klinisch duidelijke leverfunctiestoornis is het metabolisme en de eliminatie van duloxetine verminderd. Na een enkelvoudige dosis van 20 mg CYMBALTA 20 mg hadden 6 cirrotische patiënten met een matige leverfunctiestoornis (Child-Pugh-klasse B) een gemiddelde plasmaklaring van duloxetine die ongeveer 15% was van die van gezonde proefpersonen van dezelfde leeftijd en geslacht, met een 5-voudige toename in gemiddelde blootstelling (AUC). Hoewel de Cmax bij de patiënten met cirrose vergelijkbaar was met de normale waarden, was de halfwaardetijd ongeveer 3 keer langer [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ernstige nierfunctiestoornis
Er zijn beperkte gegevens beschikbaar over de effecten van CYMBALTA 40 mg bij patiënten met terminale nierziekte (ESRD). Na een enkelvoudige dosis van 60 mg CYMBALTA 20 mg waren de Cmax- en AUC-waarden ongeveer 100% hoger bij patiënten met ESRD die chronische intermitterende hemodialyse ondergingen dan bij personen met een normale nierfunctie. De eliminatiehalfwaardetijd was echter vergelijkbaar in beide groepen. De AUC's van de belangrijkste circulerende metabolieten, 4-hydroxyduloxetineglucuronide en 5-hydroxy, 6methoxyduloxetinesulfaat, grotendeels uitgescheiden in de urine, waren ongeveer 7 tot 9 keer hoger en zouden naar verwachting verder toenemen bij meervoudige doseringen. Populatie-farmacokinetische analyses suggereren dat lichte tot matige nierinsufficiëntie (geschatte CrCl 30-80 ml/min) geen significant effect heeft op de schijnbare klaring van duloxetine [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OVERDOSERING
Tekenen en symptomen
Tijdens postmarketingervaring zijn fatale gevolgen gemeld voor acute overdoses van CYMBALTA 60 mg, voornamelijk met gemengde overdoses, maar ook met alleen CYMBALTA 20 mg, inclusief 1000 mg CYMBALTA (ongeveer 8,3 maal de maximaal aanbevolen dosering). Tekenen en symptomen van overdosering (CYMBALTA alleen of met gemengde geneesmiddelen) omvatten slaperigheid, coma, serotoninesyndroom, toevallen, syncope, tachycardie, hypotensie, hypertensie en braken.
Beheer van een overdosis
Er is geen specifiek antidotum voor een overdosering met CYMBALTA 60 mg, maar als het serotoninesyndroom optreedt, kan een specifieke behandeling (zoals met cyproheptadine en/of temperatuurbeheersing) worden overwogen.
In het geval van een acute overdosering met CYMBALTA 30 mg, dient de behandeling te bestaan uit de algemene maatregelen die worden genomen bij de behandeling van een overdosis met een geneesmiddel, zoals het verzekeren van een adequate luchtweg, oxygenatie en ventilatie en het bewaken van het hartritme en de vitale functies. Maagspoeling met een orogastrische sonde met grote diameter en geschikte luchtwegbescherming, indien nodig, kan geïndiceerd zijn als deze kort na inname of bij symptomatische patiënten wordt uitgevoerd. Inductie van braken wordt niet aanbevolen.
Geactiveerde kool kan nuttig zijn bij het beperken van de absorptie van duloxetine uit het maagdarmkanaal. Het is aangetoond dat toediening van actieve kool de AUC en Cmax van duloxetine met gemiddeld een derde verlaagt, hoewel sommige patiënten een beperkt effect van actieve kool hadden. Vanwege het grote distributievolume van duloxetine is het onwaarschijnlijk dat geforceerde diurese, dialyse, hemoperfusie en wisseltransfusie gunstig zijn.
Bij het behandelen van overdosering moet de mogelijkheid van betrokkenheid van meerdere geneesmiddelen worden overwogen. Een specifieke waarschuwing betreft patiënten die overdoseren met CYMBALTA 60 mg en tricyclische antidepressiva. In een dergelijk geval kan een verminderde klaring van de oorspronkelijke tricyclische stof en/of zijn actieve metaboliet de kans op klinisch significante gevolgen vergroten en de tijd verlengen die nodig is voor nauwkeurige medische observatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Overweeg contact op te nemen met een antigifcentrum (1-800-222-1222 of www.poison.org) voor aanvullende informatie over de behandeling van overdosering.
CONTRA-INDICATIES
Het gebruik van MAO-remmers die bedoeld zijn voor de behandeling van psychiatrische stoornissen met CYMBALTA 40 mg of binnen 5 dagen na het stoppen van de behandeling met CYMBALTA is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van CYMBALTA binnen 14 dagen na het stoppen van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen is gecontra-indiceerd [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Het starten van CYMBALTA 30 mg bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Hoewel de exacte mechanismen van de antidepressiva, centrale pijnremmende en anxiolytische werking van duloxetine bij mensen onbekend zijn, wordt aangenomen dat deze werkingen verband houden met de versterking van de serotonerge en noradrenerge activiteit in het CZS.
farmacodynamiek
Preklinische studies hebben aangetoond dat duloxetine een krachtige remmer is van de heropname van neuronale serotonine en noradrenaline en een minder krachtige remmer van de heropname van dopamine. Duloxetine heeft in vitro geen significante affiniteit voor dopaminerge, adrenerge, cholinerge, histaminerge, opioïde, glutamaat en GABA-receptoren. Duloxetine remt monoamineoxidase (MAO) niet.
CYMBALTA zit in een klasse geneesmiddelen waarvan bekend is dat ze de resistentie van de urethra beïnvloeden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cardiale elektrofysiologie
Het effect van CYMBALTA 160 mg en 200 mg tweemaal daags toegediend (respectievelijk 2,7 en 3,3 maal de maximaal aanbevolen dosering) tot steady-state werd geëvalueerd in een gerandomiseerd, dubbelblind, tweerichtingscross-overonderzoek bij 117 gezonde vrouwelijke volwassen proefpersonen. Er werd geen verlenging van het QT-interval gedetecteerd. CYMBALTA 40 mg lijkt geassocieerd te zijn met concentratieafhankelijke maar niet klinisch relevante QT-verkorting.
Farmacokinetiek
Duloxetine heeft een eliminatiehalfwaardetijd van ongeveer 12 uur (bereik 8 tot 17 uur) en de farmacokinetiek ervan is dosisproportioneel over het therapeutische bereik. Steady-state plasmaconcentraties worden doorgaans bereikt na 3 dagen toediening. Eliminatie van duloxetine vindt voornamelijk plaats via levermetabolisme waarbij twee P450-isozymen, CYP1A2 en CYP2D6, betrokken zijn.
Absorptie
Na orale toediening van CYMBALTA 30 mg wordt duloxetinehydrochloride goed geabsorbeerd. Er is een mediane vertraging van 2 uur tot de absorptie begint (Tlag), met maximale plasmaconcentraties (Cmax) van duloxetine 6 uur na de dosis. Er is een vertraging van 3 uur in de absorptie en een toename van een derde in de schijnbare klaring van duloxetine na een avonddosis in vergelijking met een ochtenddosis.
Effect van voedsel
Voedsel heeft geen invloed op de Cmax van duloxetine, maar vertraagt de tijd om de piekconcentratie te bereiken van 6 tot 10 uur en het vermindert de mate van absorptie (AUC) marginaal met ongeveer 10%.
Verdeling
Het schijnbare distributievolume is gemiddeld ongeveer 1640 l. Duloxetine is sterk gebonden (> 90%) aan eiwitten in humaan plasma en bindt voornamelijk aan albumine en α1-zuurglycoproteïne. De interactie tussen duloxetine en andere sterk eiwitgebonden geneesmiddelen is niet volledig onderzocht. De plasma-eiwitbinding van duloxetine wordt niet beïnvloed door nier- of leverinsufficiëntie.
Eliminatie
Metabolisme
Biotransformatie en dispositie van duloxetine bij mensen zijn vastgesteld na orale toediening van 14C-gelabeld duloxetine. Duloxetine omvat ongeveer 3% van het totale radioactief gelabelde materiaal in het plasma, wat aangeeft dat het een uitgebreid metabolisme ondergaat tot talrijke metabolieten. De belangrijkste biotransformatieroutes voor duloxetine omvatten oxidatie van de naftylring gevolgd door conjugatie en verdere oxidatie. Zowel CYP1A2 als CYP2D6 katalyseren de oxidatie van de naftylring in vitro. Metabolieten die in plasma worden aangetroffen, zijn onder meer 4-hydroxyduloxetineglucuronide en 5hydroxy, 6-methoxyduloxetinesulfaat.
uitscheiding
Er zijn veel extra metabolieten in de urine geïdentificeerd, waarvan sommige slechts kleine eliminatieroutes vertegenwoordigen. Er zijn slechts sporen (
Specifieke populaties
Pediatrische patiënten
De steady-state plasmaconcentratie van duloxetine was vergelijkbaar bij pediatrische patiënten van 7 tot 17 jaar en volwassen patiënten. De gemiddelde steady-state duloxetineconcentratie was bij deze pediatrische populatie ongeveer 30% lager dan bij volwassen patiënten. De door het model voorspelde steady-state plasmaconcentraties van duloxetine bij pediatrische patiënten van 7 tot 17 jaar waren meestal binnen het concentratiebereik dat werd waargenomen bij volwassen patiënten en overschreden het concentratiebereik bij volwassenen niet.
Klinische studies
Overzicht van de klinische onderzoeken
De werkzaamheid van CYMBALTA 60 mg is vastgesteld bij de volgende populaties in adequate en goed gecontroleerde onderzoeken:
Depressieve stoornis (MDD)
4 kortdurende (onderzoeken MDD-1, MDD-2, MDD-3 en MDD-4) en 1 onderhoudsonderzoek (onderzoek MDD-5) bij volwassenen [zie Ernstige depressieve stoornis bij volwassenen ].
Gegeneraliseerde angststoornis (GAD)
3 kortetermijnonderzoeken bij volwassenen (onderzoeken GAD-1, GAD-2 en GAD-3), 1 onderhoudsonderzoek bij volwassenen (onderzoek GAD-4), 1 kortetermijnonderzoek bij geriatrische patiënten (onderzoek GAD-5), en 1 kortdurend onderzoek bij pediatrische patiënten van 7 tot 17 jaar (onderzoek GAD-6) [zie: Gegeneraliseerde angststoornis ].
Diabetische perifere neuropathische pijn (DPNP)
Twee onderzoeken van 12 weken bij volwassenen (onderzoeken DPNP-1 en DPNP-2) [zie Diabetische perifere neuropathische pijn bij volwassenen ].
Fibromyalgie (FM)
Twee onderzoeken bij volwassenen (een van 3 maanden en een van 6 maanden) (onderzoeken FM-1 en FM-2) en een onderzoek van 13 weken bij pediatrische patiënten van 13 tot 17 jaar (onderzoek FM-4) [zie Fibromyalgie ].
Chronische musculoskeletale pijn
Twee onderzoeken van 12 tot 13 weken bij volwassen patiënten met chronische lage-rugpijn (CLBP) (onderzoeken CLBP-1 en CLBP-3) en één onderzoek van 13 weken bij volwassen patiënten met chronische pijn als gevolg van osteoartritis (OA) (onderzoek OA -1) [zie Chronische musculoskeletale pijn bij volwassenen ].
Daarnaast wordt hieronder een samenvatting gegeven van de volgende onderzoeken die de werkzaamheid niet hebben aangetoond: onderzoek FM-3 (een onderzoek van 16 weken bij volwassen patiënten met fibromyalgie), onderzoek CLBP-2 (een onderzoek van 13 weken bij volwassen patiënten met CLBP) en Onderzoek OA-2 (een onderzoek van 13 weken bij volwassen patiënten met chronische pijn als gevolg van artrose).
Ernstige depressieve stoornis bij volwassenen
De werkzaamheid van CYMBALTA als behandeling voor MDD bij volwassenen werd vastgesteld in 4 gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken met vaste doses bij volwassen poliklinische patiënten (18 tot 83 jaar) die voldeden aan de DSM-IV-criteria voor MDD:
- In onderzoeken MDD-1 en MDD-2 werden patiënten gerandomiseerd naar CYMBALTA 60 mg eenmaal daags (respectievelijk N=123 en N=128) of placebo (respectievelijk N=122 en N=139) gedurende 9 weken
- In onderzoek MDD-3 werden patiënten gerandomiseerd naar CYMBALTA 20 of 40 mg tweemaal daags (respectievelijk N=86 en N=91) of placebo (N=89) gedurende 8 weken
- In onderzoek MDD-4 werden patiënten gerandomiseerd naar CYMBALTA 40 of 60 mg tweemaal daags (respectievelijk N=95 en N=93) of placebo (N=93) gedurende 8 weken.
In alle vier de onderzoeken vertoonde CYMBALTA 40 mg superioriteit ten opzichte van placebo, gemeten aan de hand van een verbetering van de 17-item Hamilton Depression Rating Scale (HAMD-17) totale score (zie ). Er is geen bewijs dat doses hoger dan 60 mg/dag extra voordelen opleveren.
In al deze klinische onderzoeken suggereerden analyses van de relatie tussen behandeluitkomst en leeftijd, geslacht en ras geen verschil in responsiviteit op basis van deze patiëntkenmerken.
Onderzoek MDD-1 CYMBALTA (60 mg/dag)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
In onderzoek MDD-5 kregen 533 volwassen patiënten die aan de DSM-IV-criteria voor MDD voldeden, eenmaal daags 60 mg CYMBALTA gedurende een eerste 12 weken durende open-label behandelingsfase. Tweehonderd achtenzeventig patiënten die reageerden op open-labelbehandeling [gedefinieerd als voldoend aan de volgende criteria in week 10 en 12: een HAMD-17 totale score ≤9, Clinical Global Impressions of Severity (CGI-S) ≤2, en niet voldoen aan de DSM-IV-criteria voor MDD] werden willekeurig toegewezen aan voortzetting van CYMBALTA in dezelfde dosering (N=136) of aan placebo (N=142) gedurende 6 maanden.
In onderzoek MDD-5 ondervonden patiënten op CYMBALTA een statistisch significant langere tijd tot terugval van depressie dan patiënten op placebo (zie Figuur 1 ). Terugval werd gedefinieerd als een toename van de CGI-S-score van ≥ 2 punten vergeleken met die verkregen in week 12, evenals het voldoen aan de DSM-IV-criteria voor MDD bij 2 opeenvolgende bezoeken met een tussenpoos van ten minste 2 weken, waarbij de 2 weken durende pas bij het tweede bezoek moest aan het temporele criterium worden voldaan.
Figuur 1: Cumulatief aandeel van volwassen patiënten met MDD-recidief (onderzoek MDD-5)
Gegeneraliseerde angststoornis
GAD-onderzoeken bij volwassenen (inclusief geriatrische patiënten)
De werkzaamheid van CYMBALTA 20 mg bij de behandeling van gegeneraliseerde angststoornis (GAD) werd vastgesteld in 1 gerandomiseerde, dubbelblinde, placebogecontroleerde studie met een vaste dosis en 2 gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken met een flexibele dosis bij volwassen poliklinische patiënten tussen 18 en 83 jaar oud die voldoen aan de DSM-IV-criteria voor GAD (respectievelijk onderzoeken GAD-1, GAD-2 en GAD-3).
In de onderzoeken GAD-1 en GAD-2 was de startdosis 60 mg eenmaal daags (omwille van de verdraagbaarheid was titratie naar 30 mg eenmaal daags toegestaan; de dosering kon worden verhoogd tot 60 mg eenmaal daags). Vijftien procent van de patiënten werd naar beneden getitreerd. Onderzoek GAD-3 had een aanvangsdosis van 30 mg eenmaal daags gedurende 1 week voordat deze werd verhoogd tot 60 mg eenmaal daags.
Studies GAD-2 en GAD-3 betroffen dosistitratie met CYMBALTA-doses variërend van 60 mg eenmaal daags tot 120 mg eenmaal daags (N=168 en N=162) vergeleken met placebo (N=159 en N=161) over een periode van 10 behandelperiode van een week. De gemiddelde dosering voor voltooiers op het eindpunt in deze onderzoeken was 104,8 mg/dag. Onderzoek GAD-1 evalueerde CYMBALTA 60 mg doseringen van 60 mg eenmaal daags (N=168) en 120 mg eenmaal daags (N=170) vergeleken met placebo (N=175) gedurende een behandelingsperiode van 9 weken. Hoewel een dosis van 120 mg/dag effectief bleek te zijn, is er geen bewijs dat doses hoger dan 60 mg/dag extra voordeel opleveren.
In alle 3 onderzoeken vertoonde CYMBALTA superioriteit ten opzichte van placebo, zoals gemeten aan de hand van een grotere verbetering van de Hamilton Anxiety Scale (HAM-A) totale score (zie ) en door de Sheehan Disability Scale (SDS) algemene functionele stoornisscore. De SDS is een samengestelde meting van de mate waarin emotionele symptomen het functioneren van de patiënt verstoren in 3 levensdomeinen: werk/school, sociaal leven/vrijetijdsbesteding en gezinsleven/thuisverantwoordelijkheden.
In onderzoek GAD-4 ontvingen 887 patiënten die voldeden aan de DSM-IV-TR-criteria voor GAD CYMBALTA 60 mg tot 120 mg eenmaal daags tijdens een initiële 26 weken durende open-label behandelingsfase. Vierhonderdnegenentwintig patiënten die reageerden op open-label behandeling [gedefinieerd als voldoend aan de volgende criteria in week 24 en 26: een afname vanaf baseline HAM-A totale score met ten minste 50% tot een score niet hoger dan 11, en een Clinical Global Impressions of Improvement (CGI-Improvement) score van 1 of 2] werd willekeurig toegewezen aan voortzetting van CYMBALTA 30 mg in dezelfde dosering (N=216) of aan placebo (N=213) en werden geobserveerd voor terugval. Van de gerandomiseerde patiënten had 73% ten minste 10 weken een responderstatus. Terugval werd gedefinieerd als een toename van de CGI-ernstscore met ten minste 2 punten tot een score ≥4 en een MINI-diagnose (Mini-International Neuropsychiatric Interview) van GAD (exclusief duur), of stopzetting wegens gebrek aan werkzaamheid. Patiënten die CYMBALTA gebruikten, ondervonden een statistisch significant langere tijd tot terugval van GAS dan patiënten die placebo gebruikten (zie: Figuur 2 ).
Subgroepanalyses gaven niet aan dat er verschillen waren in behandeluitkomsten als functie van leeftijd of geslacht.
GAD-onderzoek bij geriatrische patiënten
De werkzaamheid van CYMBALTA bij de behandeling van patiënten 65 jaar met GAD werd vastgesteld in een 10 weken durende, gerandomiseerde, dubbelblinde, placebogecontroleerde studie met flexibele dosis bij volwassenen ≥65 jaar die aan de DSM-IV-criteria voldeden voor GAD (onderzoek GAD-5). In onderzoek GAD-5 was de startdosis 30 mg eenmaal daags gedurende 2 weken voordat verdere dosisverhogingen in stappen van 30 mg in behandelingsweken 2, 4 en 7 tot 120 mg eenmaal daags waren toegestaan op basis van het oordeel van de onderzoeker over de klinische respons en verdraagbaarheid. De gemiddelde dosering voor patiënten die de 10 weken durende acute behandelingsfase voltooiden was 51 mg. Patiënten die werden behandeld met CYMBALTA (N=151) vertoonden een significant grotere verbetering in vergelijking met placebo (N=140) op de gemiddelde verandering van baseline tot eindpunt, zoals gemeten aan de hand van de HAM-A-totaalscore (zie ).
GAD-onderzoek bij pediatrische patiënten van 7 tot 17 jaar oud
De werkzaamheid van CYMBALTA bij de behandeling van pediatrische patiënten van 7 tot 17 jaar met GAS werd vastgesteld in 1 gerandomiseerde, dubbelblinde, placebogecontroleerde studie met flexibele doses bij pediatrische poliklinische patiënten met GAS (op basis van DSM-IV-criteria) (onderzoek GAD-6).
In onderzoek GAD-6 was de startdosering 30 mg eenmaal daags gedurende 2 weken. Verdere dosisverhogingen in stappen van 30 mg tot 120 mg eenmaal daags waren toegestaan op basis van het oordeel van de onderzoeker over de klinische respons en verdraagbaarheid. De gemiddelde dosering voor patiënten die de 10 weken durende behandelingsfase voltooiden was 57,6 mg/dag. In deze studie toonde CYMBALTA (N=135) superioriteit ten opzichte van placebo (N=137) vanaf baseline tot eindpunt, zoals gemeten door grotere verbetering in de Pediatric Anxiety Rating Scale (PAS) voor de ernst van GAD (zie ).
Figuur 2: Cumulatief aandeel van volwassen patiënten met GAD-recidief (onderzoek GAD-4)
Diabetische perifere neuropathische pijn bij volwassenen
De werkzaamheid van CYMBALTA 30 mg voor de behandeling van neuropathische pijn geassocieerd met diabetische perifere neuropathie bij volwassenen werd vastgesteld in 2 gerandomiseerde, 12 weken durende, dubbelblinde, placebogecontroleerde onderzoeken met vaste doses bij volwassen patiënten met diabetische perifere neuropathische pijn (DPNP). ) gedurende ten minste 6 maanden (onderzoek DPNP-1 en onderzoek DPNP-2). Aan deze onderzoeken namen in totaal 791 patiënten deel, van wie er 592 (75%) de onderzoeken voltooiden. Patiënten die deelnamen, hadden diabetes mellitus type I of II met een diagnose van pijnlijke distale symmetrische sensorimotorische polyneuropathie gedurende ten minste 6 maanden. De patiënten hadden een pijnscore van ≥4 op een 11-puntsschaal variërend van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Patiënten mochten, naast CYMBALTA, maximaal 4 gram paracetamol per dag gebruiken als dat nodig is voor pijn. Patiënten noteerden dagelijks hun pijn in een dagboek.
In beide onderzoeken werd CYMBALTA 60 mg eenmaal daags of 60 mg tweemaal daags vergeleken met placebo. In onderzoek DPNP-1 werd CYMBALTA 20 mg bovendien vergeleken met placebo. Een totaal van 457 patiënten (342 CYMBALTA, 115 placebo) namen deel aan onderzoek DPNP-1 en een totaal van 334 patiënten (226 CYMBALTA, 108 placebo) namen deel aan onderzoek DPNP-2.
Behandeling met CYMBALTA 60 mg één of twee keer per dag verbeterde statistisch significant de gemiddelde pijnscores van het eindpunt ten opzichte van baseline en verhoogde het aantal patiënten met een vermindering van ten minste 50% in pijnscores ten opzichte van baseline. Voor verschillende gradaties van verbetering van pijn vanaf baseline tot eindpunt van de studie, tonen figuren 3 en 4 de fractie patiënten die die mate van verbetering bereikten in respectievelijk onderzoeken DPNP-1 en DPNP-2. De cijfers zijn cumulatief, zodat patiënten bij wie de verandering ten opzichte van baseline bijvoorbeeld 50% is, ook worden meegenomen bij elk verbeteringsniveau onder de 50%. Patiënten die de studie niet voltooiden, kregen een verbetering van 0% toegewezen. Sommige patiënten ervoeren al in week 1 een afname van de pijn, die gedurende het hele onderzoek aanhield.
Figuur 3: Percentage volwassen DPNP-patiënten dat verschillende niveaus van pijnverlichting bereikt, gemeten aan de hand van de 24-uurs gemiddelde pijnernst (onderzoek DPNP-1)
Figuur 4: Percentage volwassen DPNP-patiënten dat verschillende niveaus van pijnverlichting bereikt, gemeten aan de hand van de 24-uurs gemiddelde pijnernst (onderzoek DPNP-2)
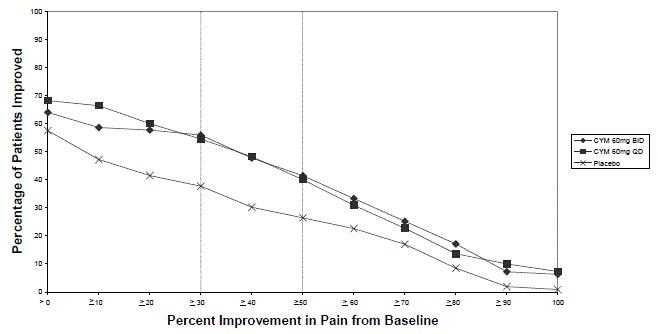
Fibromyalgie
Volwassen proeven bij fibromyalgie
De werkzaamheid van CYMBALTA voor de behandeling van fibromyalgie bij volwassenen werd vastgesteld in twee gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken met een vaste dosis bij volwassen patiënten die voldeden aan de criteria van het American College of Rheumatology voor fibromyalgie (een voorgeschiedenis van wijdverspreide pijn gedurende 3 maanden). en pijn aanwezig op 11 of meer van de 18 specifieke gevoelige punten). Studie FM-1 duurde drie maanden en omvatte alleen vrouwelijke patiënten. Studie FM-2 duurde zes maanden en omvatte mannelijke en vrouwelijke patiënten. Ongeveer 25% van de deelnemers had een comorbide diagnose van MDD. Studies FM1 en FM-2 namen in totaal 874 patiënten op, van wie 541 (62%) de studies voltooiden. Een totaal van 354 patiënten (234 CYMBALTA 40 mg, 120 placebo) namen deel aan onderzoek FM-1 en een totaal van 520 patiënten (376 CYMBALTA, 144 placebo) namen deel aan onderzoek FM-2 (5% man, 95% vrouw). De patiënten hadden een pijnscore van 6,5 op een 11-puntsschaal van 0 (geen pijn) tot 10 (ergst mogelijke pijn).
Studies FM-1 en FM-2 vergeleken CYMBALTA 60 mg eenmaal daags of 120 mg dagelijks (gegeven in verdeelde doses in onderzoek FM-1 en als een enkele dagelijkse dosis in onderzoek FM-2) met placebo. Studie FM-2 vergeleek bovendien CYMBALTA 20 mg met placebo tijdens de eerste drie maanden van een zes maanden durende studie.
Behandeling met CYMBALTA 60 mg of 120 mg per dag verbeterde statistisch significant de gemiddelde pijnscores van het eindpunt ten opzichte van baseline en verhoogde het percentage patiënten met een vermindering van ten minste 50% in pijnscore ten opzichte van baseline. Pijnvermindering werd waargenomen bij patiënten met en zonder comorbide MDD. De mate van pijnvermindering kan echter groter zijn bij patiënten met comorbide MDD. Voor verschillende gradaties van verbetering van pijn vanaf baseline tot eindpunt van de studie, tonen figuren 5 en 6 de fractie patiënten die die mate van verbetering bereikten in respectievelijk onderzoeken FM-1 en FM-2. De cijfers zijn cumulatief, zodat patiënten bij wie de verandering ten opzichte van baseline bijvoorbeeld 50% is, ook worden meegenomen bij elk verbeteringsniveau onder de 50%. Patiënten die de studie niet voltooiden, kregen een verbetering van 0% toegewezen. Sommige patiënten ervoeren al in week 1 een afname van de pijn, die gedurende het hele onderzoek aanhield. Verbetering werd ook aangetoond op metingen van functie (Fibromyalgia Impact Questionnaires) en globale indruk van verandering van de patiënt (BGA). Geen van beide onderzoeken toonde een voordeel aan van 120 mg in vergelijking met 60 mg, en een hogere dosering ging gepaard met meer bijwerkingen en voortijdige stopzetting van de behandeling.
Figuur 5: Percentage volwassen fibromyalgiepatiënten dat verschillende niveaus van pijnverlichting bereikt op het eindpunt van het onderzoek, gemeten aan de hand van de 24-uurs gemiddelde pijnernst (onderzoek FM-1)
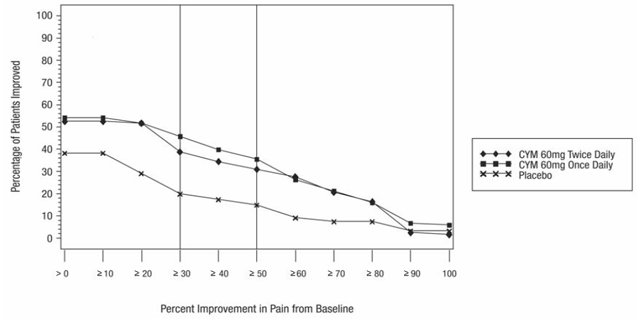
Figuur 6: Percentage volwassen fibromyalgiepatiënten dat verschillende niveaus van pijnverlichting bereikt op het eindpunt van het onderzoek, gemeten aan de hand van de 24-uurs gemiddelde pijnernst (onderzoek FM-2)
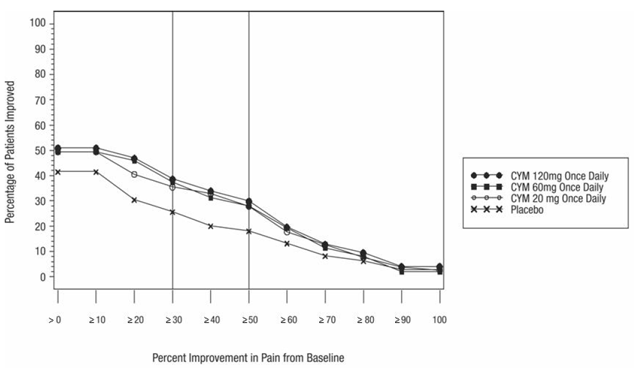
Bovendien werd het voordeel van optitratie bij non-responders op CYMBALTA bij 60 mg/dag geëvalueerd in een afzonderlijk onderzoek (onderzoek FM-3). Volwassen patiënten werden aanvankelijk acht weken lang open-label behandeld met CYMBALTA 60 mg eenmaal daags. Vervolgens werden degenen die deze fase voltooiden gerandomiseerd naar dubbelblinde behandeling met CYMBALTA van 60 mg eenmaal daags of 120 mg eenmaal daags. Responders werden gedefinieerd als patiënten die aan het einde van de 8 weken durende behandeling een pijnvermindering van ten minste 30% hadden ten opzichte van de uitgangswaarde. Patiënten die na 8 weken non-responders waren, voldeden niet meer aan de responscriteria aan het einde van 60 weken behandeling als ze blind werden getitreerd naar CYMBALTA 120 mg in vergelijking met degenen die blind werden voortgezet met CYMBALTA 60 mg.
Pediatrische proef bij fibromyalgie
CYMBALTA werd onderzocht bij 184 pediatrische patiënten van 13 tot 17 jaar met juveniel fibromyalgiesyndroom in een 13 weken durende, placebogecontroleerde studie (studie FM-4). In onderzoek FM-4 voltooiden 149 (81%) patiënten het onderzoek. CYMBALTA (N=91) werd gestart met een dosering van 30 mg eenmaal daags gedurende één week en getitreerd tot 60 mg eenmaal daags gedurende 12 weken, voor zover getolereerd. De gemiddelde dosering voor patiënten die de 12 weken durende behandelingsfase voltooiden was 49 mg/dag. CYMBALTA toonde verbetering ten opzichte van placebo op het primaire eindpunt [verandering van baseline tot einde van behandeling op de Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-uurs gemiddelde pijnernstbeoordeling] met een p-waarde van 0,052 vanaf de vooraf gespecificeerde primaire analyse, en p-waarden variërend van 0,011-0,020 van gevoeligheidsanalyses die baselinewaarden toekenden aan ontbrekende beoordelingen van sommige patiënten die de studie om verschillende redenen niet voltooiden. De patiënten hadden een baseline BPI van 5,7. Voor verschillende graden van verbetering van pijn vanaf baseline tot onderzoekseindpunt, toont figuur 7 de fractie patiënten die die mate van verbetering bereikten in onderzoek FM-4.
Figuur 7: Percentage pediatrische patiënten in de leeftijd van 13 tot 17 jaar met juveniel fibromyalgiesyndroom dat verschillende niveaus van pijnverlichting bereikte in week 12 (onderzoek FM-4)a
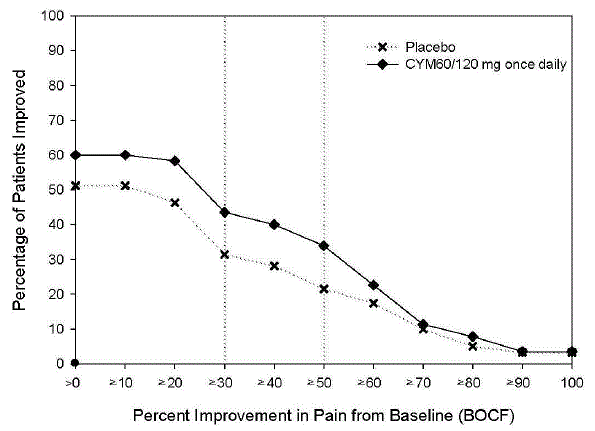
Chronische musculoskeletale pijn bij volwassenen
CYMBALTA is geïndiceerd voor de behandeling van chronische musculoskeletale pijn bij volwassenen. Dit is vastgesteld in onderzoeken bij volwassen patiënten met chronische lage rugpijn en chronische pijn als gevolg van artrose.
Proeven bij chronische lage rugpijn bij volwassenen
De werkzaamheid van CYMBALTA 60 mg bij chronische lage-rugpijn (CLBP) bij volwassenen werd beoordeeld in twee dubbelblinde, placebogecontroleerde, gerandomiseerde klinische onderzoeken met een duur van 13 weken (onderzoeken CLBP-1 en CLBP-2) en één van 12 -weken duur (CLBP-3). Studies CLBP-1 en CLBP-3 hebben de werkzaamheid van CYMBALTA bij de behandeling van CLBP aangetoond. Patiënten in alle onderzoeken hadden geen tekenen van radiculopathie of spinale stenose.
Studie CLBP-1
Tweehonderd zesendertig volwassen patiënten (N=115 op CYMBALTA 40 mg, N=121 op placebo) namen deel en 182 (77%) voltooiden de 13 weken durende behandelingsfase. Na 7 weken behandeling werd bij de met CYMBALTA behandelde patiënten met minder dan 30% vermindering van de gemiddelde dagelijkse pijn en die 60 mg eenmaal daags konden verdragen, hun CYMBALTA-dosering op dubbelblinde wijze verhoogd tot 120 mg eenmaal daags voor de rest van het proces. Patiënten hadden een gemiddelde pijnscore van 6 op een numerieke beoordelingsschaal van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Na 13 weken behandeling hadden patiënten die CYMBALTA 60-120 mg per dag gebruikten een significant grotere pijnvermindering dan patiënten die placebo gebruikten. Randomisatie werd gestratificeerd op basis van de baseline NSAID's-gebruiksstatus van de patiënten. Subgroepanalyses gaven niet aan dat er verschillen waren in behandelresultaten als functie van het gebruik van NSAID's.
Studie CLBP-2
Vierhonderdvier patiënten werden gerandomiseerd om vaste doseringen van CYMBALTA 60 mg per dag of een overeenkomende placebo te krijgen (N=59 op CYMBALTA 20 mg, N=116 op CYMBALTA 60 mg, N=112 op CYMBALTA 120 mg, N=117 op placebo) en 267 (66%) voltooiden de volledige proefperiode van 13 weken. Na 13 weken behandeling vertoonde geen van de drie doseringen van CYMBALTA 30 mg een statistisch significant verschil in pijnvermindering in vergelijking met placebo.
Studie CLBP-3
Vierhonderd en één patiënten werden gerandomiseerd om vaste doses CYMBALTA 60 mg per dag of placebo te krijgen (N=198 op CYMBALTA 20 mg, N=203 op placebo), en 303 (76%) voltooiden het onderzoek. Patiënten hadden een gemiddelde pijnscore van 6 op een numerieke beoordelingsschaal van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Na 12 weken behandeling hadden patiënten die CYMBALTA 60 mg per dag gebruikten een significant grotere pijnvermindering in vergelijking met patiënten die placebo gebruikten.
Voor verschillende gradaties van verbetering van pijn vanaf baseline tot eindpunt van de studie, tonen de figuren 8 en 9 de fractie patiënten in onderzoeken CLBP-1 en CLBP-3 die respectievelijk die mate van verbetering bereikten. De cijfers zijn cumulatief, zodat patiënten bij wie de verandering ten opzichte van baseline bijvoorbeeld 50% is, ook worden meegenomen bij elk verbeteringsniveau onder de 50%. Patiënten die de studie niet voltooiden, kregen de waarde 0% verbetering toegewezen.
Figuur 8: Percentage volwassen patiënten met CLBP dat verschillende niveaus van pijnverlichting bereikt, gemeten aan de hand van de gemiddelde pijnintensiteit van 24 uur (onderzoek CLBP-1)
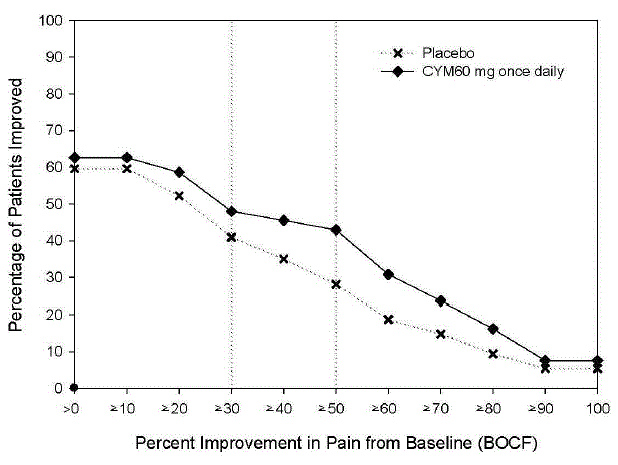
Figuur 9: Percentage volwassen patiënten met CLBP dat verschillende niveaus van pijnverlichting bereikt, gemeten aan de hand van de gemiddelde pijnintensiteit van 24 uur (onderzoek CLBP-3)
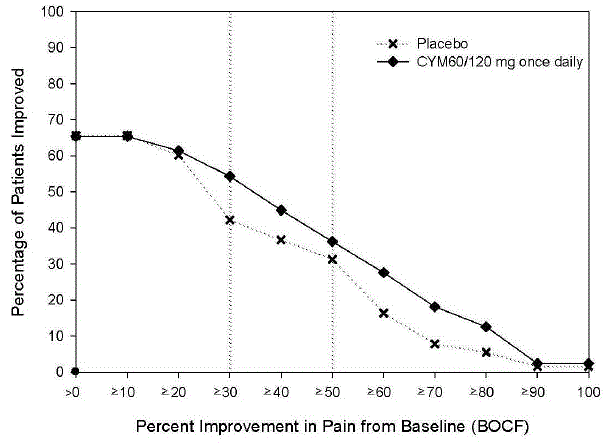
Proeven bij chronische pijn als gevolg van artrose bij volwassenen
De werkzaamheid van CYMBALTA bij chronische pijn als gevolg van osteoartritis (OA) bij volwassenen werd beoordeeld in 2 dubbelblinde, placebogecontroleerde, gerandomiseerde klinische onderzoeken met een duur van 13 weken (onderzoek OA-1 en onderzoek OA-2). Alle patiënten in beide onderzoeken voldeden aan de klinische en radiografische ACR-criteria voor classificatie van idiopathische artrose van de knie. Randomisatie werd gestratificeerd op basis van de baseline NSAID's-gebruiksstatus van de patiënten.
Patiënten die aan CYMBALTA waren toegewezen, startten in beide onderzoeken met de behandeling met een dosis van 30 mg eenmaal daags gedurende één week. Na de eerste week werd de dosis CYMBALTA verhoogd tot 60 mg eenmaal daags. Na 7 weken behandeling met CYMBALTA 60 mg eenmaal daags, in onderzoek OA-1 bij patiënten met een suboptimale respons op de behandeling (
Studie OA-1
Tweehonderdzesenvijftig patiënten (N=128 op CYMBALTA 30 mg, N=128 op placebo) namen deel en 204 (80%) voltooiden het onderzoek. Patiënten hadden een gemiddelde pijnscore van 6 op een numerieke beoordelingsschaal van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Na 13 weken behandeling hadden patiënten die CYMBALTA 20 mg gebruikten een significant grotere pijnvermindering dan patiënten die placebo gebruikten. Subgroepanalyses gaven niet aan dat er verschillen waren in behandelresultaten als functie van het gebruik van NSAID's.
Studie OA-2
Tweehonderdeenendertig patiënten (N=111 op CYMBALTA 30 mg, N=120 op placebo) namen deel en 173 (75%) voltooiden het onderzoek. Patiënten hadden een gemiddelde basislijnpijn van 6 op een numerieke beoordelingsschaal variërend van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Na 13 weken behandeling vertoonden patiënten die CYMBALTA 20 mg gebruikten geen significant grotere pijnvermindering dan patiënten die placebo gebruikten.
In onderzoek OA-1, voor verschillende graden van verbetering van pijn vanaf baseline tot onderzoekseindpunt, toont figuur 10 de fractie patiënten die die mate van verbetering bereikten. Het cijfer is cumulatief, zodat patiënten bij wie de verandering ten opzichte van baseline bijvoorbeeld 50% is, ook worden meegenomen bij elk verbeteringsniveau onder de 50%. Patiënten die de studie niet voltooiden, kregen de waarde 0% verbetering toegewezen.
Afbeelding 10: Percentage volwassen patiënten met artrose dat verschillende niveaus van pijnverlichting bereikt, gemeten aan de hand van 24-uursgemiddelde pijnernst (onderzoek OA-1)
PATIËNT INFORMATIE
Cymbalta® [sim-BALL-tah] (duloxetine capsules met vertraagde afgifte)
Lees deze medicatiehandleiding voordat u Cymbalta® gaat gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling.
Praat met uw zorgverlener over:
- alle risico's en voordelen van behandeling met antidepressiva
- alle behandelingskeuzes voor depressie of andere ernstige psychische aandoeningen
Wat is de belangrijkste informatie die ik moet weten over antidepressiva, depressie, andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties?
- Besteed veel aandacht aan veranderingen in stemming, gedrag, acties, gedachten of gevoelens, vooral plotselinge veranderingen. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel onmiddellijk uw zorgverlener om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken met uw zorgverlener zoals gepland. Bel indien nodig uw zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen of gevoelens heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren. Bel in geval van nood 911.
- pogingen om zelfmoord te plegen
- handelen op gevaarlijke impulsen
- agressief handelen, boos of gewelddadig zijn
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere depressie
- nieuwe of ergere angst
- paniekaanvallen
- zich erg geagiteerd of rusteloos voelen
- nieuwe of ergere prikkelbaarheid
- Moeite met slapen
- een extreme toename van activiteit of praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met een zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken en ook de risico's van het niet behandelen ervan. Patiënten dienen alle behandelkeuzes met uw zorgverlener te bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met uw zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan uw zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
Wat is Cymbalta 60 mg?
Cymbalta is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van een bepaald type depressie, genaamd MajorDepressive Disorder (MDD). Cymbalta 20 mg behoort tot een klasse geneesmiddelen die bekend staat als SNRI's (orserotonine-noradrenalineheropnameremmers).
Cymbalta 60 mg wordt ook gebruikt voor de behandeling of behandeling van:
- Gegeneraliseerde angststoornis (GAD)
- Diabetische perifere neuropathische pijn (DPNP)
- Fibromyalgie (FM)
- Chronische musculoskeletale pijn
Wie mag Cymbalta niet gebruiken?
Gebruik Cymbalta 20 mg niet als u:
- neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, waaronder het antibioticum linezolid of intraveneus methyleenblauw.
- Gebruik geen MAO-remmer binnen 5 dagen na het stoppen met Cymbalta, tenzij uw zorgverlener u heeft gevraagd dit te doen.
- Begin niet met Cymbalta als u in de afgelopen 14 dagen bent gestopt met het gebruik van een MAO-remmer, tenzij uw zorgverlener u hierom heeft gevraagd.
Mensen die Cymbalta 60 mg in de buurt van een MAO-remmer innemen, kunnen een ernstig probleem hebben dat serotoninesyndroom wordt genoemd (zie "Wat zijn de mogelijke bijwerkingen van Cymbalta 60 mg?").
Wat moet ik mijn zorgverlener vertellen voordat ik Cymbalta inneem?
Vertel uw zorgverlener voordat u met Cymbalta begint als u:
- hartproblemen of hoge bloeddruk heeft
- diabetes hebt (behandeling met Cymbalta 40 mg maakt het voor sommige mensen met diabetes moeilijker om hun bloedsuikerspiegel onder controle te houden)
- leverproblemen hebben
- nierproblemen hebben
- glaucoom hebben
- epileptische aanvallen of convulsies heeft of heeft gehad
- een bipolaire stoornis of manie hebben;
- een laag natriumgehalte in uw bloed heeft
- een vertraagde maaglediging hebben
- bloedingsproblemen heeft of heeft gehad
- zwanger bent of van plan bent zwanger te worden. Cymbalta kan uw ongeboren baby schaden. Praat met uw zorgverlener over het risico voor uw ongeboren baby als u Cymbalta gebruikt tijdens de zwangerschap.
- Vertel het uw zorgverlener meteen als u zwanger wordt of denkt zwanger te zijn tijdens de behandeling met Cymbalta.
- Als u zwanger wordt terwijl u Cymbalta 30 mg gebruikt, overleg dan met uw zorgverlener over registratie bij het Cymbalta Pregnancy Registry. U kunt zich registreren door te bellen naar 1-866-8146975 of door naar www.cymbalta 40mgpregnancyregistry.com te gaan. Het doel van dit register is het volgen van de zwangerschapsuitkomsten bij vrouwen die op enig moment tijdens de zwangerschap met Cymbalta zijn behandeld.
- borstvoeding geeft of van plan bent borstvoeding te geven. Cymbalta gaat over in uw moedermelk en kan schadelijk zijn voor uw baby. Praat met uw zorgverlener over de beste manier om uw baby te voeden terwijl u Cymbalta gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief geneesmiddelen op recept en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Cymbalta en sommige geneesmiddelen kunnen een wisselwerking met elkaar hebben, werken mogelijk niet zo goed of kunnen ernstige bijwerkingen veroorzaken.
Vertel het uw zorgverlener vooral als u:
- triptanen gebruikt voor de behandeling van migrainehoofdpijn
- geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, waaronder tricyclische geneesmiddelen, lithium, buspiron, SSRI's, SNRI's of MAO-remmers
- tramadol en fentanyl
- amfetaminen
- cimetidine
- de antibiotica ciprofloxacine, enoxacine
- geneesmiddel om een onregelmatige hartslag te behandelen (zoals propafenon, flecaïnide, kinidine)
- theofylline
- de bloedverdunner warfarine (Coumadin, Jantoven)
- niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) (zoals ibuprofen, naproxen of aspirine).
- vrij verkrijgbare supplementen zoals tryptofaan of sint-janskruid
- thioridazine (Mellaril). Mellaril samen met Cymbalta kan ernstige hartritmeproblemen of plotselinge dood veroorzaken.
Vraag uw zorgverlener om een lijst van deze geneesmiddelen als u het niet zeker weet.
Gebruik Cymbalta niet met een ander geneesmiddel dat duloxetine bevat.
Hoe moet ik Cymbalta 60 mg innemen?
- Neem Cymbalta precies in zoals uw zorgverlener u zegt dat u het moet innemen. Uw zorgverlener moet mogelijk de dosis Cymbalta 20 mg aanpassen totdat deze de juiste dosis voor u is.
- Slik Cymbalta heel door. Kauw of plet Cymbalta niet.
- De capsule niet openen en niet op voedsel strooien of met vloeistoffen mengen. Het openen van de capsule kan van invloed zijn op hoe goed Cymbalta werkt.
- Cymbalta kan met of zonder voedsel worden ingenomen.
- Als u een dosis Cymbalta 30 mg bent vergeten, neem dan de vergeten dosis in zodra u eraan denkt. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem uw volgende dosis op het normale tijdstip. Neem niet tegelijkertijd twee doses Cymbalta 30 mg in.
- Als u te veel Cymbalta heeft ingenomen, bel dan onmiddellijk uw zorgverlener of antigifcentrum op 1800-222-1222 of vraag een spoedbehandeling.
- Wanneer u overstapt van een ander antidepressivum op Cymbalta, wil uw zorgverlener mogelijk eerst de dosis van het oorspronkelijke antidepressivum verlagen om mogelijk bijwerkingen te voorkomen.
Wat moet ik vermijden tijdens het gebruik van Cymbalta?
- Cymbalta kan slaperigheid veroorzaken of uw vermogen om beslissingen te nemen, helder te denken of snel te reageren beïnvloeden. U mag niet autorijden, zware machines bedienen of andere gevaarlijke activiteiten uitvoeren totdat u weet welke invloed Cymbalta op u heeft.
- Het gelijktijdig gebruik van Cymbalta met zware alcoholinname kan gepaard gaan met ernstig leverletsel. Vermijd zwaar alcoholgebruik tijdens het gebruik van Cymbalta.
Wat zijn de mogelijke bijwerkingen van Cymbalta?
Cymbalta 30 mg kan ernstige bijwerkingen veroorzaken, waaronder: Zie "Wat is de belangrijkste informatie die ik over Cymbalta moet weten?"
Veelvoorkomende mogelijke bijwerkingen bij mensen die Cymbalta 20 mg gebruiken, zijn onder meer:
Symptomen bij mannen kunnen zijn:
Symptomen bij vrouwen kunnen zijn:
Neem contact op met uw zorgverlener als u veranderingen in uw seksuele functie krijgt of als u vragen of zorgen heeft over seksuele problemen tijdens de behandeling met CYMBALTA. Er kunnen behandelingen zijn die uw zorgverlener kan voorstellen.
- jeuk
- pijn in de rechter bovenbuik
- donkere urine
- gele huid of ogen
- vergrote lever
- verhoogde leverenzymen
- uw bloeddruk verhogen.
- uw bloeddruk verlagen bij het staan en duizeligheid of flauwvallen veroorzaken, meestal wanneer u voor het eerst met Cymbalta begint of wanneer u de dosis verhoogt.
- het risico op vallen verhogen, vooral bij ouderen.
- agitatie, hallucinaties, coma of andere veranderingen in mentale toestand
- coördinatieproblemen of spiertrekkingen (overactieve reflexen)
- snelle hartslag, hoge of lage bloeddruk
- zweten of koorts
- misselijkheid, braken of diarree
- spierstijfheid
- duizeligheid
- blozen
- tremor
- toevallen
- ongerustheid
- prikkelbaarheid
- moe voelen of problemen met slapen
- hoofdpijn
- zweten
- duizeligheid
- elektrische schok-achtige sensaties
- braken of misselijkheid
- diarree
- sterk verhoogde energie
- ernstige slaapproblemen
- snelle gedachten
- roekeloos gedrag
- ongewoon grootse ideeën
- overmatig geluk of prikkelbaarheid
- meer of sneller praten dan normaal
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
- hoofdpijn
- zwakte of onvast gevoel
- verwarring, concentratie- of denkproblemen of geheugenproblemen
- verhoogde urinestroom
- kan niet plassen
- vertraagde ejaculatie of onvermogen om een ejaculatie te krijgen
- verminderde zin in seks
- problemen met het krijgen of behouden van een erectie
- verminderde zin in seks
- vertraagd orgasme of onvermogen om een orgasme te krijgen
De meest voorkomende bijwerkingen van Cymbalta 20 mg zijn:
- misselijkheid
- droge mond
- slaperigheid
- vermoeidheid
- constipatie
- verlies van eetlust
- toegenomen zweten
- duizeligheid
Vaak voorkomende bijwerkingen bij kinderen en adolescenten die Cymbalta 20 mg gebruiken, zijn onder meer:
- misselijkheid
- verminderd gewicht
- duizeligheid
Bijwerkingen bij volwassenen kunnen ook optreden bij kinderen en jongeren tot 18 jaar die Cymbalta gebruiken. Bij kinderen en adolescenten moet de lengte en het gewicht tijdens de behandeling worden gecontroleerd.
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cymbalta. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan 1800-FDA-1088.
Hoe moet ik Cymbalta 40 mg bewaren?
Bewaar Cymbalta bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
Houd Cymbalta en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van Cymbalta.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan vermeld in een medicatiehandleiding. Gebruik Cymbalta niet voor een aandoening waarvoor het niet is voorgeschreven. Geef Cymbalta 20 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over Cymbalta samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over Cymbalta die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Bel 1-800-545-5979 voor meer informatie.
Wat zijn de ingrediënten in Cymbalta 30 mg?
Actief bestanddeel: duloxetinehydrochloride
Inactieve ingredienten:
FD&C Blue No. 2, gelatine, hypromellose, hydroxypropylmethylcelluloseacetaatsuccinaat, natriumlaurylsulfaat, sucrose, suikerbolletjes, talk, titaniumdioxide en triethylcitraat. De capsules van 20 en 60 mg bevatten ook geel ijzeroxide.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
