Depressie behandeling: Celexa 10mg, 20mg Citalopram Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Celexa en hoe wordt het gebruikt?
Celexa is een receptgeneesmiddel dat wordt gebruikt om de symptomen van depressie te behandelen. Celexa kan alleen of in combinatie met andere medicijnen worden gebruikt.
Celexa 20 mg behoort tot een klasse geneesmiddelen die antidepressiva, SSRI's, worden genoemd.
Wat zijn de mogelijke bijwerkingen van Celexa?
Celexa kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- hoofdpijn met pijn op de borst en ernstige duizeligheid,
- flauwvallen,
- snelle of bonzende hartslag,
- zeer stijve (starre) spieren,
- koorts of hoge koorts,
- zweten,
- verwardheid,
- trillingen,
- agitatie,
- hallucinaties,
- overactieve reflexen,
- misselijkheid,
- braken,
- diarree,
- verlies van coördinatie,
- hoofdpijn,
- onduidelijke spraak,
- ernstige zwakte, en
- onvast voelen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Celexa 20 mg zijn:
- geheugen problemen,
- moeite met concentreren,
- hoofdpijn,
- slaperigheid,
- droge mond,
- meer zweten,
- gevoelloosheid of tintelingen,
- verhoogde eetlust,
- misselijkheid,
- diarree,
- gas,
- snelle hartslagen,
- wankel voelen,
- slaapprobleem (slapeloosheid),
- zich moe voelen,
- verkoudheidsverschijnselen (verstopte neus, niezen, keelpijn),
- gewichtsveranderingen, en
- moeite met een orgasme
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Celexa. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van Celexa of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Celexa 10 mg is niet goedgekeurd voor gebruik bij pediatrische patiënten. (Zie WAARSCHUWINGEN: Klinische verergering en zelfmoordrisico, PATINTINFORMATIE en VOORZORGSMAATREGELEN: Gebruik bij kinderen.)
OMSCHRIJVING
Celexa® (citalopram HBr) is een oraal toegediende selectieve serotonineheropnameremmer (SSRI) met een chemische structuur die geen verband houdt met die van andere SSRI's of van tricyclische, tetracyclische of andere beschikbare antidepressiva. Citalopram HBr is een racemisch bicyclisch ftalaanderivaat dat wordt aangeduid als (±)-1-(3-dimethylaminopropyl)-1-(4-fluorfenyl)-1,3-dihydroisobenzofuran-5-carbonitril, HBr met de volgende structuurformule:
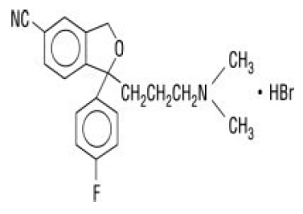
De molecuulformule is C20H22BrFN2O en het molecuulgewicht is 405,35.
Citalopram HBr komt voor als een fijn, wit tot gebroken wit poeder. Citalopram HBr is slecht oplosbaar in water en oplosbaar in ethanol.
Celexa (citalopram hydrobromide) is alleen verkrijgbaar in tabletvorm.
Celexa 10 mg zijn filmomhulde, ovale tabletten die citalopram HBr bevatten in een sterkte gelijk aan 10 mg citaloprambase. Celexa 20 mg en 40 mg zijn filmomhulde, ovale tabletten met breukgleuf die citalopram HBr bevatten in een sterkte die overeenkomt met 20 mg of 40 mg citaloprambase. De tabletten bevatten ook de volgende inactieve ingrediënten: copolyvidon, maïszetmeel, natriumcrosscarmellose, glycerine, lactosemonohydraat, magnesiumstearaat, hypromellose, microkristallijne cellulose, polyethyleenglycol en titaniumdioxide. IJzeroxiden worden gebruikt als kleurstoffen in de beige (10 mg) en roze (20 mg) tabletten.
INDICATIES
CELEXA 20 mg is geïndiceerd voor de behandeling van depressieve stoornis (MDD) bij volwassenen [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Aanbevolen dosering
Dien CELEXA eenmaal daags toe, met of zonder voedsel, in een aanvangsdosering van 20 mg eenmaal daags, met een verhoging tot een maximale dosering van 40 mg eenmaal daags met een interval van niet minder dan een week.
Doseringen hoger dan 40 mg eenmaal daags worden niet aanbevolen vanwege het risico op QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Scherm voor bipolaire stoornis voorafgaand aan het starten van CELEXA
Voordat u begint met de behandeling met CELEXA 20 mg of een ander antidepressivum, moet u patiënten screenen op een persoonlijke of familiale voorgeschiedenis van bipolaire stoornis, manie of hypomanie [Zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Aanbevolen dosering voor specifieke populaties
De maximale aanbevolen dosering van CELEXA 10 mg voor patiënten ouder dan 60 jaar, patiënten met leverinsufficiëntie en voor trage metaboliseerders van CYP2C19 is eenmaal daags 20 mg [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , KLINISCHE FARMACOLOGIE ].
Doseringsaanpassingen bij gelijktijdig gebruik van CYP2C19-remmers
De maximale aanbevolen dosering van CELEXA 20 mg bij gelijktijdig gebruik met een CYP2C19-remmer is 20 mg eenmaal daags [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Overschakelen van patiënten naar of van een monoamineoxidaseremmer Antidepressivum
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een monoamineoxidaseremmer (MAO-remmer) antidepressivum en het starten van de behandeling met CELEXA. Omgekeerd moeten er ten minste 14 dagen verstrijken na het stoppen met CELEXA voordat met een MAOI-antidepressivum wordt begonnen [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzetting van de behandeling met CELEXA
Bijwerkingen kunnen optreden na stopzetting van CELEXA [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verlaag de dosering geleidelijk in plaats van CELEXA abrupt te stoppen wanneer mogelijk.
HOE GELEVERD
Doseringsvormen en sterke punten
CELEXA 10 mg tabletten zijn verkrijgbaar als:
- 10 mg: beige, ovaal met aan de ene kant "FP" bedrukt, aan de andere kant "10 mg" bedrukt
- 20 mg: roze, ovaal, met een breukstreep met "F" opgedrukt op de linkerkant van de breukstreep en "P" opgedrukt op de rechterkant van de breukstreep, "20 mg" opgedrukt op de niet-gestreepte kant
- 40 mg: wit, ovaal, met een breukstreep met “F” opdruk op de linkerkant van de breukstreep en “P” opdruk op de rechterkant van de breukstreep, “40 mg” opdruk op de niet-gestreepte kant
CELEXA (citalopram) tabletten worden als volgt geleverd:
Opslag en behandeling
CELEXA 10 mg tabletten moeten worden bewaard bij 20-25°C (68 tot 77°F); excursies toegestaan tussen 15 en 30°C (59-86°F) [zie USP-gecontroleerde kamertemperatuur ].
Gedistribueerd door: Allergan USA, Inc. Herzien: februari 2022
BIJWERKINGEN
De volgende bijwerkingen worden in andere secties van de etikettering in meer detail besproken:
- Overgevoeligheidsreacties [zie CONTRA-INDICATIES ]
- Suïcidale gedachten en gedrag bij adolescenten en jonge volwassenen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- QT-verlenging en torsade de pointes [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoogd risico op bloedingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Activering van manie of hypomanie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Stopzettingssyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hyponatriëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Seksuele disfunctie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
De veiligheid van CELEXA 20 mg omvatte blootstelling aan citalopram bij patiënten en/of gezonde proefpersonen uit 3 verschillende onderzoeksgroepen: 429 gezonde proefpersonen in klinische farmacologische/farmacokinetische onderzoeken; 4.422 blootstellingen van patiënten in gecontroleerde en ongecontroleerde klinische onderzoeken, wat overeenkomt met ongeveer 1.370 blootstellingsjaren van de patiënt. Daarnaast waren er meer dan 19.000 blootstellingen uit voornamelijk open-label, Europese postmarketingonderzoeken. De omstandigheden en duur van de behandeling met CELEXA 10 mg varieerden sterk en omvatten (in overlappende categorieën) open-label en dubbelblinde onderzoeken, klinische en poliklinische onderzoeken, onderzoeken met vaste doses en dosistitratie, en kortdurende en langdurige blootstelling .
Bijwerkingen die verband houden met stopzetting van de behandeling
Van de 1.063 patiënten met MDD die CELEXA 10 mg kregen in doses variërend van 10 mg tot 80 mg eenmaal daags in placebogecontroleerde onderzoeken met een duur tot 6 weken, stopte 16% met de behandeling vanwege een bijwerking, vergeleken met 8% van de 446 patiënten placebo krijgen. De bijwerkingen geassocieerd met stopzetting (dwz geassocieerd met stopzetting bij ten minste 1% van de met CELEXA behandelde patiënten met een snelheid die ten minste tweemaal zo groot is als die van placebo) worden weergegeven in Tabel 2.
Tabel 3 somt de incidentie op van bijwerkingen die optraden bij 1.063 patiënten met MDD die CELEXA 20 mg kregen in doses variërend van 10 mg tot 80 mg eenmaal daags in placebogecontroleerde onderzoeken met een duur van maximaal 6 weken.
De meest voorkomende bijwerking die optrad bij met CELEXA behandelde patiënten met een incidentie van 5% of meer en ten minste tweemaal de incidentie bij placebopatiënten was ejaculatiestoornis (voornamelijk vertraagde ejaculatie) bij mannelijke patiënten (zie tabel 3).
Dosisafhankelijke bijwerkingen
De mogelijke relatie tussen de dosering van CELEXA 10 mg en de incidentie van bijwerkingen werd onderzocht in een onderzoek met een vaste dosis bij patiënten met MDD die placebo of CELEXA 10 mg, 20 mg 40 mg of 60 mg kregen (1,5 maal de maximaal aanbevolen dosering) . Een positieve dosisrespons (p
Mannelijke en vrouwelijke seksuele disfunctie met SSRI's
Hoewel veranderingen in seksueel verlangen, seksuele prestaties en seksuele bevrediging vaak optreden als manifestaties van een psychiatrische stoornis, kunnen ze ook een gevolg zijn van SSRI-behandeling. Betrouwbare schattingen van de incidentie en ernst van ongewenste ervaringen met seksuele begeerte, prestatie en bevrediging zijn echter moeilijk te verkrijgen, deels omdat patiënten en zorgverleners misschien terughoudend zijn om erover te praten. Dienovereenkomstig kunnen schattingen van de incidentie van ongewenste seksuele ervaringen en prestaties die in de etikettering worden genoemd, hun werkelijke incidentie onderschatten.
Tabel 4 geeft de incidentie weer van seksuele bijwerkingen die zijn gemeld door ten minste 2% van de mannelijke patiënten die CELEXA 20 mg gebruikten in een pool van placebogecontroleerde klinische onderzoeken bij patiënten met depressie.
Bij vrouwelijke depressieve patiënten die CELEXA 20 mg kregen, was de gerapporteerde incidentie van verminderd libido en anorgasmie respectievelijk 1,3% (n=638 vrouwen) en 1,1% (n=252 vrouwen).
Gewichtsveranderingen
Patiënten die in gecontroleerde onderzoeken met CELEXA werden behandeld, vertoonden een gewichtsverlies van ongeveer 0,5 kg vergeleken met geen verandering bij placebopatiënten.
ECG-wijzigingen
In een grondig QT-onderzoek bleek CELEXA geassocieerd te zijn met een dosisafhankelijke toename van het QTc-interval.
Elektrocardiogrammen van CELEXA (N=802) en placebo (N=241) groepen werden vergeleken met betrekking tot uitbijters gedefinieerd als proefpersonen met QTc-veranderingen van meer dan 60 msec vanaf baseline of absolute waarden meer dan 500 ms na toediening, en proefpersonen met een hartslagverhoging tot meer dan 100 spm of daalt tot minder dan 50 spm met een verandering van 25% ten opzichte van de uitgangswaarde (respectievelijk tachycardie of bradycardie uitbijters). In de CELEXA-groep had 1,9% van de patiënten een verandering ten opzichte van baseline in QTcF >60 msec vergeleken met 1,2% van de patiënten in de placebogroep. Geen van de patiënten in de placebogroep had een QTcF >500 msec na toediening van de dosis, vergeleken met 0,5% van de patiënten in de CELEXA 10 mg-groep. De incidentie van tachycarduitschieters was 0,5% in de CELEXA-groep en 0,4% in de placebogroep. De incidentie van bradycardie uitbijters was 0,9% in de CELEXA 10 mg-groep en 0,4% in de placebogroep.
Andere bijwerkingen waargenomen tijdens de premarketingevaluatie van CELEXA
De volgende lijst van bijwerkingen bevat geen reacties die: 1) zijn opgenomen in Tabel 3 of elders in de etikettering, 2) waarvoor een medicijnveroorzaker ver weg was, 3) die zo algemeen waren dat ze niet informatief waren, en die welke alleen voorkomen in één patiënt.
Bijwerkingen worden gecategoriseerd per lichaamssysteem en gerangschikt in afnemende frequentie volgens de volgende definities: frequente bijwerkingen zijn bijwerkingen die een of meer keren voorkomen bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij minder dan 1/100 patiënten tot 1/1000 patiënten; zeldzame bijwerkingen zijn bijwerkingen die voorkomen bij minder dan 1/1000 patiënten.
Cardiovasculair - Frequent: tachycardie, orthostatische hypotensie, hypotensie. Onregelmatig: hypertensie, bradycardie, oedeem (extremiteiten), angina pectoris, extrasystolen, hartfalen, blozen, myocardinfarct, cerebrovasculair accident, myocardischemie. Zelden: voorbijgaande ischemische aanval, flebitis, atriale fibrillatie, hartstilstand, bundeltakblok.
Aandoeningen van het centrale en perifere zenuwstelsel - Frequent: paresthesie, migraine. Onregelmatig: hyperkinesie, duizeligheid, hypertonie, extrapiramidale stoornis, krampen in de benen, onwillekeurige spiersamentrekkingen, hypokinesie, neuralgie, dystonie, abnormale gang, hypesthesie, ataxie. Zelden: abnormale coördinatie, hyperesthesie, ptosis, stupor.
Endocriene aandoeningen - Zelden: hypothyreoïdie, struma, gynaecomastie.
Maagdarmstelselaandoeningen -Vaak: verhoogd speeksel, winderigheid. Onregelmatig: gastritis, gastro-enteritis, stomatitis, oprispingen, aambeien, dysfagie, tandenknarsen, gingivitis, oesofagitis. Zelden: colitis, maagzweer, cholecystitis, cholelithiasis, zweer in de twaalfvingerige darm, gastro-oesofageale reflux, glossitis, geelzucht, diverticulitis, rectale bloeding, hikken.
Algemeen -Onregelmatig : opvliegers, rigors, alcoholintolerantie, syncope, griepachtige symptomen. Zelden: hooikoorts.
Hemische en lymfatische aandoeningen -Onregelmatig: purpura, bloedarmoede, epistaxis, leukocytose, leukopenie, lymfadenopathie. Zelden: longembolie, granulocytopenie, lymfocytose, lymfopenie, hypochrome anemie, stollingsstoornis, tandvleesbloeding.
Metabole en voedingsstoornissen -Vaak: gewichtsafname, gewichtstoename. Onregelmatig: verhoogde leverenzymen, dorst, droge ogen, verhoogde alkalische fosfatase, abnormale glucosetolerantie. Zelden: bilirubinemie, hypokaliëmie, obesitas, hypoglykemie, hepatitis, uitdroging.
Aandoeningen van het bewegingsapparaat -Onregelmatig: artritis, spierzwakte, skeletpijn. Zelden: bursitis, osteoporose.
Psychische stoornissen -Vaak: verminderde concentratie, geheugenverlies, apathie, depressie, verhoogde eetlust, verergerde depressie, zelfmoordpoging, verwardheid. Onregelmatig: verhoogd libido, agressieve reactie, paroniria, drugsverslaving, depersonalisatie, hallucinatie, euforie, psychotische depressie, waanvoorstelling, paranoïde reactie, emotionele labiliteit, paniekreactie, psychose. Zelden: katatonische reactie, melancholie.
Voortplantingsstoornissen/vrouw* - Vaak: amenorroe. Onregelmatig: galactorroe, borstpijn, borstvergroting, vaginale bloeding. (*% alleen gebaseerd op vrouwelijke proefpersonen: 2955)
Ademhalingsstelselaandoeningen -Vaak: hoesten. Onregelmatig: bronchitis, dyspneu, longontsteking. Zelden: astma, laryngitis, bronchospasme, pneumonitis, verhoogd sputum.
Huid- en aanhangselsaandoeningen - Vaak: uitslag, jeuk. Onregelmatig: fotosensitiviteitsreactie, urticaria, acne, huidverkleuring, eczeem, alopecia, dermatitis, droge huid, psoriasis. Zelden: hypertrichose, verminderd zweten, melanose, keratitis, cellulitis, pruritus ani.
Speciale zintuigen - Frequent: abnormale accommodatie, smaakperversie. Onregelmatig: tinnitus, conjunctivitis, oogpijn. Zelden: mydriasis, fotofobie, diplopie, abnormale tranenvloed, cataract, smaakverlies.
Urinewegaandoeningen - Vaak: polyurie. Onregelmatig: mictiefrequentie, urine-incontinentie, urineretentie, dysurie. Zelden: gezichtsoedeem, hematurie, oligurie, pyelonefritis, niersteen, nierpijn.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik na goedkeuring van citalopram, het racemaat, of escitalopram, de S-enantiomeer van citalopram. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen: hemolytische anemie, trombocytopenie, verlaagd protrombine
Hartaandoeningen: torsade de pointes, ventriculaire aritmie, QT verlengd
Endocriene aandoeningen: hyperprolactinemie
Oogaandoeningen: gesloten hoek glaucoom
Maagdarmstelselaandoeningen: gastro-intestinale bloeding, pancreatitis
Algemene aandoeningen en administratieve sitevoorwaarden: ontwenningsverschijnselen
Lever- en galaandoeningen: levernecrose
Immuunsysteemaandoeningen: anafylaxie, allergische reactie
Musculoskeletale en bindweefselaandoeningen: rabdomyolyse
Zenuwstelselaandoeningen: grand mal convulsie(s), myoclonus, choreoathetose, dyskinesie, acathisie, nystagmus
Zwangerschap, kraambed en perinatale aandoeningen: spontane abortie
Psychische stoornissen: delirium
Nier- en urinewegaandoeningen: acuut nierfalen
Voortplantingsstelsel en borstaandoeningen: priapisme
Huid- en onderhuidaandoeningen: Stevens-Johnson-syndroom, epidermale necrolyse, angio-oedeem, erythema multiforme, ecchymose
Bloedvataandoeningen: trombose
DRUG-INTERACTIES
Tabel 5 geeft klinisch belangrijke geneesmiddelinteracties met CELEXA weer.
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
CELEXA (citalopram HBr) is geen gereguleerde stof.
Misbruik
Dierstudies suggereren dat de kans op misbruik van CELEXA 20 mg laag is. CELEXA is niet systematisch onderzocht bij mensen vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. De klinische ervaring met CELEXA vóór het op de markt brengen bracht geen zoekgedrag naar geneesmiddelen aan het licht. Deze waarnemingen waren echter niet systematisch en het is niet mogelijk om op basis van deze beperkte ervaring te voorspellen in hoeverre een op het CZS actief geneesmiddel zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen zorgverleners CELEXA 20 mg-patiënten zorgvuldig te evalueren op voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen en hen te observeren op tekenen van misbruik of misbruik (bijv. ontwikkeling van tolerantie, dosisverhogingen, gedrag bij het zoeken naar medicijnen).
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Suïcidale gedachten en gedrag bij adolescenten en jonge volwassenen
In gepoolde analyses van placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere klassen van antidepressiva) met ongeveer 77.000 volwassen patiënten en 4.500 pediatrische patiënten, was de incidentie van zelfmoordgedachten en -gedragingen bij met antidepressiva behandelde patiënten van 24 jaar en jonger groter dan bij met placebo behandelde patiënten. Er was een aanzienlijke variatie in het risico op zelfmoordgedachten en -gedrag tussen drugs, maar er was een verhoogd risico vastgesteld bij jonge patiënten voor de meeste onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op zelfmoordgedachten en -gedrag bij de verschillende indicaties, met de hoogste incidentie bij patiënten met MDD. De verschillen tussen geneesmiddelen en placebo's in het aantal gevallen van suïcidale gedachten en gedragingen per 1000 behandelde patiënten worden gegeven in Tabel 1.
Het is niet bekend of het risico op zelfmoordgedachten en -gedrag bij kinderen, adolescenten en jongvolwassenen zich uitstrekt tot langdurig gebruik, dwz langer dan vier maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met MDD dat antidepressiva de herhaling van depressie vertragen en dat depressie zelf een risicofactor is voor zelfmoordgedachten en zelfmoordgedrag.
Controleer alle met antidepressiva behandelde patiënten op klinische verslechtering en het optreden van zelfmoordgedachten en -gedragingen, vooral tijdens de eerste paar maanden van medicamenteuze behandeling en op tijdstippen van doseringswijzigingen. Raad familieleden of zorgverleners van patiënten aan om te controleren op gedragsveranderingen en om de zorgverlener te waarschuwen. Overweeg het therapeutische regime te veranderen, inclusief mogelijk het staken van CELEXA, bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende zelfmoordgedachten of suïcidale gedragingen hebben.
QT-verlenging en torsade de pointes
CELEXA veroorzaakt dosisafhankelijke QTc-verlenging een ECG-afwijking die in verband is gebracht met torsade de pointes (TdP), ventriculaire tachycardie en plotselinge dood, die allemaal zijn waargenomen in postmarketingrapporten voor citalopram [zie ONGEWENSTE REACTIES ].
Vanwege het risico op QTc-verlenging bij hogere doses CELEXA 20 mg, wordt aanbevolen om CELEXA niet te geven in doses hoger dan eenmaal daags 40 mg (zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
CELEXA moet worden vermeden bij patiënten met een aangeboren lang QT-syndroom, bradycardie, hypokaliëmie of hypomagnesiëmie, recent acuut myocardinfarct of niet-gecompenseerd hartfalen, tenzij de voordelen opwegen tegen de risico's voor een bepaalde patiënt. CELEXA moet ook worden vermeden bij patiënten die andere geneesmiddelen gebruiken die het QTc-interval verlengen [zie DRUG-INTERACTIES ]. Dergelijke geneesmiddelen omvatten klasse 1A (bijv. kinidine, procaïnamide) of klasse III (bijv. amiodaron, sotalol) anti-aritmische medicatie, antipsychotische medicatie (bijv. chloorpromazine, thioridazine), antibiotica (bijv. gatifloxacine, moxifloxacine) of een andere klasse van medicijnen waarvan bekend is dat het het QTc-interval verlengt (bijv. pentamidine, levomethadylacetaat, methadon).
De dosis citalopram moet bij bepaalde populaties worden beperkt. De maximale dosis moet worden beperkt tot 20 mg eenmaal daags bij patiënten die trage CYP2C19-metaboliseerders zijn of die patiënten die gelijktijdig cimetidine of een andere CYP2C19-remmer krijgen, aangezien hogere citalopramblootstellingen te verwachten zijn. De maximale dosis moet ook worden beperkt tot 20 mg eenmaal daags bij patiënten met leverinsufficiëntie en bij patiënten ouder dan 60 jaar vanwege verwachte hogere blootstellingen [zie DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES , Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
In bepaalde omstandigheden wordt elektrolyt- en/of ECG-bewaking aanbevolen. Bij patiënten die in aanmerking komen voor behandeling met CELEXA 20 mg en een risico lopen op significante elektrolytenstoornissen, dienen baseline serumkalium- en magnesiummetingen met periodieke controle te worden uitgevoerd. Hypokaliëmie (en/of hypomagnesiëmie) kan het risico op QTc-verlenging en aritmie verhogen en moet vóór aanvang van de behandeling worden gecorrigeerd en periodiek worden gecontroleerd. ECG-monitoring wordt aanbevolen bij patiënten voor wie het gebruik van CELEXA 10 mg niet wordt aanbevolen, tenzij de voordelen duidelijk opwegen tegen de risico's voor een bepaalde patiënt (zie bovenstaande ). Deze omvatten patiënten met de hierboven vermelde hartaandoeningen en patiënten die andere geneesmiddelen gebruiken die het QTc-interval kunnen verlengen.
Stop met CELEXA 10 mg bij patiënten bij wie aanhoudende QTc-metingen >500 ms blijken te zijn. Als patiënten die CELEXA gebruiken symptomen krijgen die kunnen wijzen op het optreden van hartritmestoornissen, bijv. duizeligheid, hartkloppingen of syncope, dient de voorschrijver een vervolgonderzoek te starten, inclusief hartbewaking.
serotonine syndroom
SSRI's, waaronder CELEXA 20 mg, kunnen het serotoninesyndroom, een mogelijk levensbedreigende aandoening, versnellen. Het risico is verhoogd bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine verstoren, dwz MAO-remmers [zie CONTRA-INDICATIES , DRUG-INTERACTIES ]. Het serotoninesyndroom kan ook optreden wanneer deze geneesmiddelen alleen worden gebruikt. Symptomen van het serotoninesyndroom werden waargenomen bij 0,1% van de MDD-patiënten die werden behandeld met CELEXA 20 mg in klinische premarketingonderzoeken.
Tekenen en symptomen van serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree).
Gelijktijdig gebruik van CELEXA met MAO-remmers is gecontra-indiceerd. Start bovendien niet met CELEXA 20 mg bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie). Als het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die CELEXA 10 mg gebruikt, stop dan met CELEXA 20 mg voordat de behandeling met de MAO-remmer wordt gestart (zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
Controleer alle patiënten die CELEXA 20 mg gebruiken op het optreden van het serotoninesyndroom. Stop de behandeling met CELEXA en alle gelijktijdig gebruikte serotonerge middelen onmiddellijk als de bovenstaande symptomen optreden, en start een ondersteunende symptomatische behandeling. Als gelijktijdig gebruik van CELEXA met andere serotonerge geneesmiddelen klinisch gerechtvaardigd is, informeer de patiënten dan over het verhoogde risico op het serotoninesyndroom en controleer op symptomen.
Verhoogd risico op bloedingen
Geneesmiddelen die de remming van de heropname van serotonine verstoren, waaronder CELEXA 20 mg, verhogen het risico op bloedingen. Gelijktijdig gebruik van aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), andere antibloedplaatjesgeneesmiddelen, warfarine en andere anticoagulantia kunnen dit risico vergroten. Case-reports en epidemiologische studies (case-control en cohort-design) hebben een verband aangetoond tussen het gebruik van geneesmiddelen die de heropname van serotonine verstoren en het optreden van gastro-intestinale bloedingen. Bloedingen die verband houden met geneesmiddelen die de heropname van serotonine verstoren, varieerden van ecchymose, hematoom, epistaxis en petechiën tot levensbedreigende bloedingen.
Informeer patiënten over het verhoogde risico op bloedingen bij gelijktijdig gebruik van CELEXA 20 mg en plaatjesaggregatieremmers of anticoagulantia. Voor patiënten die warfarine gebruiken, moet u zorgvuldig de internationale genormaliseerde ratio volgen [zie DRUG-INTERACTIES ].
Activering van manie of hypomanie
Bij patiënten met een bipolaire stoornis kan de behandeling van een depressieve episode met CELEXA of een ander antidepressivum een gemengde/manische episode uitlokken. In gecontroleerde klinische onderzoeken werden patiënten met een bipolaire stoornis uitgesloten; symptomen van manie of hypomanie werden echter gemeld bij 0,1% van de niet-gediagnosticeerde patiënten die met CELEXA werden behandeld. Voordat de behandeling met CELEXA 10 mg wordt gestart, moeten patiënten worden gescreend op een persoonlijke of familiale voorgeschiedenis van bipolaire stoornis, manie of hypomanie [zie DOSERING EN ADMINISTRATIE ].
Stopzettingssyndroom
Bijwerkingen na stopzetting van serotonerge antidepressiva, vooral na abrupte stopzetting, zijn onder meer: misselijkheid, zweten, dysfore stemming, prikkelbaarheid, opwinding, duizeligheid, sensorische stoornissen (bijv. paresthesie, zoals het gevoel van elektrische schokken), tremor, angst, verwardheid, hoofdpijn, lethargie, emotionele labiliteit, slapeloosheid, hypomanie, oorsuizen en toevallen. Een geleidelijke verlaging van de dosering in plaats van abrupte stopzetting wordt waar mogelijk aanbevolen [zie DOSERING EN ADMINISTRATIE ].
epileptische aanvallen
CELEXA 20 mg is niet systematisch geëvalueerd bij patiënten met epileptische aandoeningen. Patiënten met een voorgeschiedenis van epileptische aanvallen werden uitgesloten van klinische onderzoeken. In klinische onderzoeken met CELEXA 20 mg kwamen epileptische aanvallen voor bij 0,3% van de patiënten die met CELEXA werden behandeld (een percentage van één patiënt per 98 jaar blootstelling) en 0,5% van de patiënten die werden behandeld met placebo (een percentage van één patiënt per 50 jaar blootstelling). CELEXA 10 mg moet met voorzichtigheid worden voorgeschreven aan patiënten met een epileptische aandoening.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na gebruik van veel antidepressiva, waaronder CELEXA, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft ondergaan. Vermijd het gebruik van antidepressiva, waaronder CELEXA, bij patiënten met onbehandelde anatomisch nauwe hoeken.
Hyponatriëmie
Hyponatriëmie kan optreden als gevolg van behandeling met SSRI's, waaronder CELEXA. Gevallen van serumnatrium lager dan 110 mmol/L zijn gemeld. Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Tekenen en symptomen die gepaard gaan met ernstigere en/of acute gevallen omvatten hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden. In veel gevallen lijkt deze hyponatriëmie het gevolg te zijn van het syndroom van ongepaste antidiuretisch hormoonsecretie (SIADH).
Bij patiënten met symptomatische hyponatriëmie, stop met CELEXA en start geschikte medische interventie. Oudere patiënten, patiënten die diuretica gebruiken en patiënten met volumedepletie lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met SSRI's (zie Gebruik bij specifieke populaties ].
Seksuele disfunctie
Het gebruik van SSRI's, waaronder CELEXA, kan symptomen van seksuele disfunctie veroorzaken [zie: ONGEWENSTE REACTIES ]. Bij mannelijke patiënten kan het gebruik van SSRI's leiden tot vertraging of falen van de ejaculatie, verminderd libido en erectiestoornissen. Bij vrouwelijke patiënten kan het gebruik van SSRI's leiden tot een verminderd libido en een vertraagd of afwezig orgasme.
Het is belangrijk voor voorschrijvers om te informeren naar de seksuele functie voordat met CELEXA wordt gestart en om specifiek te informeren naar veranderingen in de seksuele functie tijdens de behandeling, omdat seksuele functie mogelijk niet spontaan wordt gemeld. Bij het evalueren van veranderingen in seksuele functie is het verkrijgen van een gedetailleerde geschiedenis (inclusief timing van het begin van de symptomen) belangrijk omdat seksuele symptomen andere oorzaken kunnen hebben, waaronder de onderliggende psychiatrische stoornis. Bespreek mogelijke managementstrategieën om patiënten te ondersteunen bij het nemen van weloverwogen beslissingen over de behandeling.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Suïcidale gedachten en gedrag
Adviseer patiënten en zorgverleners om te zoeken naar het optreden van suïcidaliteit, vooral vroeg tijdens de behandeling en wanneer de dosering naar boven of naar beneden wordt aangepast, en instrueer hen om dergelijke symptomen aan de zorgverlener te melden [zie GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
QT-verlenging en torsade de pointes
Adviseer patiënten om onmiddellijk hun zorgverlener te raadplegen als ze zich zwak voelen, het bewustzijn verliezen of hartkloppingen hebben. Instrueer patiënten om hun zorgverlener te informeren dat ze CELEXA gebruiken voordat ze nieuwe medicijnen nemen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
serotonine syndroom
Pas op voor patiënten met het risico op het serotoninesyndroom, vooral bij gelijktijdig gebruik van CELEXA 20 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron, amfetaminen, sint-janskruid en met geneesmiddelen die het metabolisme van serotonine aantasten (met name MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid). Instrueer patiënten om contact op te nemen met hun zorgverlener of te melden bij de eerste hulp als ze tekenen of symptomen van het serotoninesyndroom ervaren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Verhoogd risico op bloedingen
Informeer patiënten over het gelijktijdig gebruik van CELEXA 10 mg met aspirine, NSAID's, andere plaatjesaggregatieremmers, warfarine of andere anticoagulantia, omdat het gecombineerde gebruik in verband is gebracht met een verhoogd risico op bloedingen. Adviseer patiënten om hun zorgverleners te informeren als ze medicijnen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te nemen die het risico op bloedingen verhogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].

Activering van manie of hypomanie
Adviseer patiënten en hun zorgverleners om te observeren op tekenen van activering van manie/hypomanie en instrueer hen om dergelijke symptomen aan de zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzettingssyndroom
Adviseer patiënten om niet abrupt te stoppen met CELEXA en om een afbouwschema met hun zorgverlener te bespreken. Informeer patiënten dat bijwerkingen kunnen optreden wanneer CELEXA 20 mg wordt stopgezet [Zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Seksuele disfunctie
Adviseer patiënten dat het gebruik van CELEXA symptomen van seksuele disfunctie kan veroorzaken bij zowel mannelijke als vrouwelijke patiënten. Informeer patiënten dat ze eventuele veranderingen in de seksuele functie en mogelijke managementstrategieën met hun zorgverlener moeten bespreken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
- Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de behandeling met CELEXA [zie: Gebruik bij specifieke populaties ].
- Adviseer patiënten dat CELEXA laat in de zwangerschap kan leiden tot een verhoogd risico op neonatale complicaties die langdurige ziekenhuisopname, ademhalingsondersteuning, sondevoeding en/of aanhoudende pulmonale hypertensie van de pasgeborene (PPHN) vereisen (zie Gebruik bij specifieke populaties ].
- Adviseer vrouwen dat er een register voor blootstelling aan zwangerschap is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan citalopram zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven om baby's te controleren op overmatige sedatie, rusteloosheid, opwinding, slechte voeding en slechte gewichtstoename en om medische hulp in te roepen als ze deze symptomen opmerken [zie Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Citalopram verhoogde de incidentie van dunnedarmcarcinoom bij ratten die gedurende 24 maanden werden behandeld met doses van 8 en 24 mg/kg/dag in de voeding, wat respectievelijk ongeveer 2 en 6 keer de maximale aanbevolen dosis voor de mens (MRHD) van 40 mg is. op basis van mg/m² lichaamsoppervlak. Een no-effect level (NOEL) voor deze bevinding werd niet vastgesteld.
Citalopram verhoogde de incidentie van tumoren niet bij muizen die gedurende 18 maanden werden behandeld met doses tot 240 mg/kg/dag in de voeding, wat ongeveer 30 keer de MRDH is van 40 mg op basis van mg/m² lichaamsoppervlak.
Mutagenese
Citalopram was mutageen in de in vitro bacteriële reverse-mutatietest (Ames-test) in 2 van de 5 bacteriestammen (Salmonella TA98 en TA1537) in afwezigheid van metabole activering. Het was clastogeen in de in vitro Chinese hamsterlongceltest voor chromosomale afwijkingen in aanwezigheid en afwezigheid van metabolische activering. Citalopram was niet mutageen in de in vitro voorwaartse genmutatietest bij zoogdieren (HPRT) in lymfoomcellen van muizen of in de in vitro/in vivo ongeplande DNA-synthese (UDS)-test in rattenlever. Het was niet clastogeen in de in vitro chromosomale aberratie-assay in menselijke lymfocyten of in twee in vivo micronucleus-assays bij muizen.
Aantasting van de vruchtbaarheid
Citalopram werd oraal toegediend aan vrouwelijke en mannelijke ratten in doses van 32, 48 en 72 mg/kg/dag voorafgaand aan en tijdens de paring en voortzetting van de dracht. Deze doses zijn ongeveer 8, 12 en 17 keer de MRHD van 40 mg op basis van mg/m² lichaamsoppervlak. De paring en vruchtbaarheid waren verminderd bij doses 32 mg/kg/dag, wat ongeveer 8 keer de MRHD is.
De draagtijd werd verlengd met 48 mg/kg/dag, wat ongeveer 12 keer de MRHD is.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan antidepressiva zijn blootgesteld. Zorgverleners worden aangemoedigd om patiënten te registreren door de National Pregnancy Registry for Antidepressants te bellen op 1-844-405-6185 of online te bezoeken op https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Risico Samenvatting
Beschikbare gegevens uit gepubliceerde epidemiologische onderzoeken en postmarketingrapporten met citalopramgebruik tijdens de zwangerschap hebben geen verhoogd risico op ernstige geboorteafwijkingen of miskraam aangetoond. Gepubliceerde onderzoeken hebben aangetoond dat de citalopramspiegels in zowel navelstrengbloed als vruchtwater vergelijkbaar zijn met die waargenomen in maternaal serum. Er zijn risico's op aanhoudende pulmonale hypertensie van de pasgeborene (PPHN) (zie: Gegevens ) en/of slechte neonatale aanpassing met blootstelling aan selectieve serotonineheropnameremmers (SSRI's), waaronder CELEXA, tijdens de zwangerschap. Er zijn ook risico's verbonden aan onbehandelde depressie tijdens de zwangerschap (zie: Klinische overwegingen ).
In reproductiestudies bij dieren veroorzaakte citalopram nadelige effecten op het embryo/de foetus bij doses die maternale toxiciteit veroorzaakten (zie: Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij de klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Vrouwen die stoppen met antidepressiva tijdens de zwangerschap hebben meer kans op een terugval van een ernstige depressie dan vrouwen die doorgaan met antidepressiva. Deze bevinding komt uit een prospectief longitudinaal onderzoek onder 201 zwangere vrouwen met een voorgeschiedenis van depressieve stoornis die aan het begin van de zwangerschap euthymisch waren en antidepressiva gebruikten. Overweeg het risico op onbehandelde depressie bij het stopzetten of wijzigen van de behandeling met antidepressiva tijdens de zwangerschap en postpartum.
Foetale/neonatale bijwerkingen
Pasgeborenen die laat in het derde trimester aan CELEXA en andere SSRI's zijn blootgesteld, hebben complicaties ontwikkeld die langdurige ziekenhuisopname, ademhalingsondersteuning en sondevoeding vereisen. Dergelijke complicaties kunnen direct na de bevalling optreden. Gerapporteerde klinische bevindingen omvatten ademnood, cyanose, apneu, toevallen, temperatuurinstabiliteit, voedingsproblemen, braken, hypoglykemie, hypotonie, hypertonie, hyperreflexie, tremor, zenuwachtigheid, prikkelbaarheid en constant huilen. Deze bevindingen komen overeen met ofwel een direct toxisch effect van SSRI's of mogelijk een syndroom van stopzetting van het geneesmiddel. Opgemerkt moet worden dat in sommige gevallen het klinische beeld consistent is met het serotoninesyndroom [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gegevens
Menselijke gegevens
Blootstelling tijdens de late zwangerschap aan SSRI's kan een verhoogd risico hebben op aanhoudende pulmonale hypertensie van de pasgeborene (PPHN). PPHN komt voor bij 1-2 per 1.000 levendgeborenen in de algemene bevolking en wordt geassocieerd met aanzienlijke neonatale morbiditeit en mortaliteit.
Dierlijke gegevens
Citalopram werd oraal toegediend aan drachtige ratten tijdens de periode van organogenese in doses van 32, 56 en 112 mg/kg/dag, wat ongeveer 8, 14 en 27 keer de maximale aanbevolen humane dosis (MRHD) van 40 mg is, gebaseerd op op mg/m² lichaamsoppervlak. Citalopram veroorzaakte maternale toxiciteit van klinische symptomen van het CZS en verminderde gewichtstoename bij 112 mg/kg/dag, wat 27 keer de MRHD is. Bij deze maternaal toxische dosis verminderde citalopram de groei en overleving van embryo/foetus en verhoogde foetale afwijkingen (inclusief cardiovasculaire en skeletafwijkingen). Het NOAEL-niveau voor maternale en embryofoetale toxiciteit is 56 mg/kg/dag, wat ongeveer 14 keer de MRHD is.
Citalopram werd oraal toegediend aan drachtige konijnen tijdens de periode van organogenese in doses tot 16 mg/kg/dag, wat ongeveer 8 keer de MRHD is van 40 mg, gebaseerd op mg/m² lichaamsoppervlak. Er werd geen maternale of embryofoetale toxiciteit waargenomen. De NOAEL voor maternale en embryofoetale toxiciteit is 16 mg/kg/dag, wat ongeveer 8 keer de MRHD is.
Citalopram werd oraal toegediend aan drachtige ratten tijdens late dracht- en lactatieperioden in doses van 4,8, 12,8 en 32 mg/kg/dag, wat ongeveer 1, 3 en 8 keer de MRHD van 40 mg is, gebaseerd op mg/m² lichaam oppervlakte. Citalopram verhoogde de sterfte van de nakomelingen tijdens de eerste 4 dagen van geboorte en verminderde de groei van de nakomelingen bij 32 mg/kg/dag, wat ongeveer 8 keer de MRHD is. De NOAEL voor ontwikkelingstoxiciteit is 12,8 mg/kg/dag, wat ongeveer 3 keer de MRHD is. In een afzonderlijke studie werden vergelijkbare effecten op de sterfte en groei van nakomelingen gezien wanneer moederdieren tijdens de dracht en vroege lactatie werden behandeld met doses 24 mg/kg/dag, wat ongeveer 6 keer de MRHD is. In dat onderzoek is geen NOAEL vastgesteld.
Borstvoeding
Risico Samenvatting
Gegevens uit de gepubliceerde literatuur melden de aanwezigheid van citalopram in moedermelk bij relatieve zuigelingendoses variërend van 0,7 tot 9,4% van de voor het gewicht van de moeder aangepaste dosering en een melk/plasmaverhouding variërend van 0,78 tot 4,3. Er zijn meldingen van zuigelingen die borstvoeding krijgen en die zijn blootgesteld aan citalopram en die prikkelbaarheid, rusteloosheid, overmatige slaperigheid, verminderde voeding en gewichtsverlies ervaren (zie Klinische overwegingen ). Er is geen informatie over effecten van citalopram op de melkproductie.
Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan CELEXA 20 mg en eventuele nadelige effecten op het kind dat borstvoeding krijgt van CELEXA 20 mg of van de onderliggende maternale aandoening.
Klinische overwegingen
Controleer zuigelingen die borstvoeding geven op bijwerkingen, zoals prikkelbaarheid, rusteloosheid, overmatige slaperigheid, verminderde voeding en gewichtsverlies.
Pediatrisch gebruik
De veiligheid en werkzaamheid van CELEXA zijn niet vastgesteld bij pediatrische patiënten. Er zijn twee placebogecontroleerde onderzoeken bij 407 pediatrische patiënten met MDD uitgevoerd met CELEXA 20 mg, en de gegevens waren niet voldoende om het gebruik bij pediatrische patiënten te ondersteunen.
Antidepressiva verhogen het risico op zelfmoordgedachten en -gedrag bij pediatrische patiënten [zie: GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verminderde eetlust en gewichtsverlies zijn waargenomen in verband met het gebruik van SSRI's bij pediatrische patiënten.
Geriatrisch gebruik
Van de 4422 patiënten in klinische onderzoeken met CELEXA 20 mg waren 1357 60 jaar en ouder, 1034 65 jaar en ouder en 457 75 jaar en ouder. In twee farmacokinetische onderzoeken was de AUC van citalopram verhoogd met respectievelijk 23% en 30% bij proefpersonen ≥ 60 jaar in vergelijking met jongere proefpersonen, en de halfwaardetijd was verhoogd met respectievelijk 30% en 50% [zie KLINISCHE FARMACOLOGIE ]. Daarom is de maximaal aanbevolen dosering bij patiënten van 60 jaar en ouder lager dan bij jongere patiënten [zie: DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
SSRI's, waaronder CELEXA, zijn in verband gebracht met gevallen van klinisch significante hyponatriëmie bij oudere patiënten, die mogelijk een groter risico lopen op deze bijwerking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Leverfunctiestoornis
Verhoogde blootstelling aan citalopram komt voor bij patiënten met leverinsufficiëntie. De maximaal aanbevolen dosering van CELEXA 10 mg is lager bij patiënten met leverinsufficiëntie [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Het volgende is gemeld bij overdosering van Celexa-tabletten:
- Toevallen, die vertraagd kunnen zijn, en veranderde mentale toestand, waaronder coma.
- Cardiovasculaire toxiciteit, die vertraagd kan zijn, waaronder verlenging van het QRS- en QTc-interval, breedcomplexe tachyaritmieën en torsade de pointes. Hypertensie komt het meest voor, maar kan zelden hypotensie alleen of met gelijktijdige inname, waaronder alcohol, zien.
- Serotoninesyndroom (patiënten met een overdosering van meerdere geneesmiddelen met andere proserotonerge geneesmiddelen kunnen een hoger risico hebben).
Langdurige hartbewaking wordt aanbevolen bij inname van overdosering met Celexa vanwege het risico op aritmie. Bij patiënten die zich vroeg na een overdosis Celexa 10 mg presenteren, moet gastro-intestinale decontaminatie met actieve kool worden overwogen. Overweeg contact op te nemen met een Antigifcentrum (1-800-221-2222) of een medisch toxicoloog voor aanvullende aanbevelingen voor het beheer van overdosering.
CONTRA-INDICATIES
CELEXA is gecontra-indiceerd bij patiënten:
- inname, of binnen 14 dagen na het stoppen, van MAO-remmers (inclusief MAO-remmers zoals linezolid of intraveneus methyleenblauw) vanwege een verhoogd risico op het serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- pimozide gebruiken vanwege het risico op QT-verlenging [zie DRUG-INTERACTIES ].
- met bekende overgevoeligheid voor citalopram of voor een van de inactieve ingrediënten in CELEXA. Reacties omvatten angio-oedeem en anafylaxie [zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van citalopram is onduidelijk, maar er wordt aangenomen dat het verband houdt met de versterking van de serotonerge activiteit in het centrale zenuwstelsel (CZS) als gevolg van de remming van de neuronale heropname van serotonine in het CZS (5-HT).
farmacodynamiek
In vitro en in vivo dierstudies suggereren dat citalopram een selectieve serotonineheropnameremmer (SSRI) is met minimale effecten op de neuronale heropname van noradrenaline (NE) en dopamine (DA).
Citalopram heeft geen of een zeer lage affiniteit voor 5-HT1A, 5-HT2A, dopamine D1 en D2, α1-, α2- en β-adrenerge, histamine H1, gamma-aminoboterzuur (GABA), muscarine-cholinerge en benzodiazepine-receptoren.
Cardiale elektrofysiologie
Individueel gecorrigeerd QTc (QTcNi)-interval werd geëvalueerd in een gerandomiseerde, placebo en actieve (moxifloxacine 400 mg) gecontroleerde cross-over, escalerende studie met meerdere doses bij 119 gezonde proefpersonen. Het maximale gemiddelde (bovengrens van het 95% eenzijdige betrouwbaarheidsinterval) verschil met placebo was 8,5 (10,8) en 18,5 (21,0) msec voor respectievelijk 20 mg en 60 mg (1,5 maal de maximaal aanbevolen dosering) citalopram. Op basis van de vastgestelde blootstelling-responsrelatie is de voorspelde QTcNi-verandering ten opzichte van placebo (bovengrens van het eenzijdige betrouwbaarheidsinterval van 95%) onder de Cmax voor de dosis van 40 mg 12,6 (14,3) msec [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Farmacokinetiek
De farmacokinetiek van enkelvoudige en meervoudige doses van citalopram is lineair en dosisproportioneel in een dosisbereik van 10 tot 40 mg/dag. De biotransformatie van citalopram vindt voornamelijk in de lever plaats, met een gemiddelde terminale halfwaardetijd van ongeveer 35 uur. Bij eenmaal daagse dosering worden de steady-state plasmaconcentraties binnen ongeveer een week bereikt. Bij steady-state wordt verwacht dat de mate van accumulatie van citalopram in plasma, gebaseerd op de halfwaardetijd, 2,5 keer de plasmaconcentratie is die wordt waargenomen na een enkele dosis.
Absorptie
Na een enkelvoudige orale dosis (40 mg tablet) citalopram treden piekbloedspiegels op na ongeveer 4 uur. De absolute biologische beschikbaarheid van citalopram was ongeveer 80% ten opzichte van een intraveneuze dosis, en de absorptie wordt niet beïnvloed door voedsel.
Verdeling
Het distributievolume van citalopram is ongeveer 12 l/kg en de binding van citalopram (CT), demethylcitalopram (DCT) en didemethylcitalopram (DDCT) aan humane plasma-eiwitten is ongeveer 80%.
Eliminatie
Metabolisme
Citalopram wordt gemetaboliseerd tot demethylcitalopram (DCT), didemethylcitalopram (DDCT), citalopram-N-oxide en een gedeamineerd propionzuurderivaat. Bij mensen is onveranderd citalopram de belangrijkste verbinding in plasma. Bij steady state zijn de concentraties van de metabolieten van citalopram, DCT en DDCT, in plasma respectievelijk ongeveer de helft en een tiende van die van het oorspronkelijke geneesmiddel. In vitro-onderzoeken tonen aan dat citalopram ten minste 8 keer krachtiger is dan zijn metabolieten bij de remming van de heropname van serotonine, wat suggereert dat de geëvalueerde metabolieten waarschijnlijk niet significant bijdragen aan de antidepressieve werking van citalopram.
In vitro-onderzoeken met humane levermicrosomen gaven aan dat CYP3A4 en CYP2C19 de primaire isozymen zijn die betrokken zijn bij de N-demethylering van citalopram.
uitscheiding
Na intraveneuze toediening van citalopram was de fractie van het geneesmiddel die in de urine werd teruggevonden als citalopram en DCT respectievelijk ongeveer 10% en 5%. De systemische klaring van citalopram was 330 ml/min, waarvan ongeveer 20% door renale klaring.
Specifieke populaties
Geriatrische patiënten
De farmacokinetiek van citalopram bij proefpersonen ≥ 60 jaar werd vergeleken met jongere proefpersonen in twee normale onderzoeken met vrijwilligers. In een onderzoek met een enkelvoudige dosis waren de AUC en halfwaardetijd van citalopram bij proefpersonen ≥ 60 jaar met respectievelijk 30% en 50% verhoogd, terwijl ze in een onderzoek met meervoudige doses respectievelijk met 23% en 30% waren verhoogd [ zien DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ].
Mannelijke en vrouwelijke patiënten
In drie farmacokinetische onderzoeken (totaal N=32) was de AUC van citalopram bij vrouwen anderhalf tot twee keer zo groot als bij mannen. Dit verschil werd niet waargenomen in vijf andere farmacokinetische onderzoeken (totaal N=114). In klinische onderzoeken werden geen verschillen in steady-state-serumconcentraties van citalopram waargenomen tussen mannen (N=237) en vrouwen (N=388). Er waren geen geslachtsverschillen in de farmacokinetiek van DCT en DDCT.
Patiënten met leverinsufficiëntie
De orale klaring van citalopram was met 37% verminderd en de halfwaardetijd was verdubbeld bij patiënten met een verminderde leverfunctie in vergelijking met normale proefpersonen [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties ].
Patiënten met nierinsufficiëntie
Bij patiënten met een lichte tot matige nierfunctiestoornis was de orale klaring van citalopram met 17% verminderd in vergelijking met normale proefpersonen. Aanpassing van de dosering voor dergelijke patiënten wordt niet aanbevolen. Er is geen informatie beschikbaar over de farmacokinetiek van citalopram bij patiënten met een ernstige nierfunctiestoornis (creatinineklaring
CYP2C19 Slechte metaboliseerders
Bij trage metaboliseerders van CYP2C19 waren de steady-state Cmax en AUC van citalopram verhoogd met respectievelijk 68% en 107% [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CYP2D6 Slechte metaboliseerders
De steady-state-spiegels van citalopram waren niet significant verschillend bij trage metaboliseerders en uitgebreide metaboliseerders van CYP2D6.
Geneesmiddelinteractiestudies
In vitro-gegevens over enzymremming lieten geen remmend effect van citalopram op CYP3A4, -2C9 of -2E1 zien, maar suggereerden wel dat het een zwakke remmer van CYP1A2, -2D6 en -2C19 is. Van citalopram wordt verwacht dat het weinig remmend effect heeft op het in vivo metabolisme dat door deze enzymen wordt gemedieerd. De in vivo gegevens om deze vraag te beantwoorden zijn echter beperkt.
CYP3A4- en CYP2C19-remmers
Aangezien CYP3A4 en CYP2C19 de primaire enzymen zijn die betrokken zijn bij het metabolisme van citalopram, wordt verwacht dat krachtige remmers van CYP3A4 (bijv. ketoconazol, itraconazol en macrolide-antibiotica) en remmers van CYP2C19 (bijv. omeprazol, cimetidine) de klaring van citalopram. Gelijktijdige toediening van citalopram en de krachtige CYP3A4-remmer ketoconazol had echter geen significante invloed op de farmacokinetiek van citalopram. 20 mg/dag is de maximaal aanbevolen dosis citalopram bij patiënten die gelijktijdig cimetidine of een andere CYP2C19-remmer gebruiken, vanwege het risico op QT-verlenging (zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
cimetidine
Bij proefpersonen die 21 dagen 40 mg/dag CELEXA 10 mg hadden gekregen, resulteerde gecombineerde toediening van 400 mg tweemaal daags cimetidine gedurende 8 dagen in een verhoging van de citalopram AUC en Cmax van respectievelijk 43% en 39% [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
CYP2D6-remmers
Het is onwaarschijnlijk dat gelijktijdige toediening van een geneesmiddel dat CYP2D6 remt met citalopram klinisch significante effecten heeft op het metabolisme van citalopram, op basis van de onderzoeksresultaten bij trage CYP2D6-metaboliseerders.
Digoxine
Bij proefpersonen die 21 dagen 40 mg/dag CELEXA 20 mg hadden gekregen, had de gecombineerde toediening van CELEXA en digoxine (enkele dosis van 1 mg) geen significante invloed op de farmacokinetiek van citalopram of digoxine.
Lithium
Gelijktijdige toediening van CELEXA (40 mg/dag gedurende 10 dagen) en lithium (30 mmol/dag gedurende 5 dagen) had geen significant effect op de farmacokinetiek van citalopram of lithium.
Pimozide
In een gecontroleerd onderzoek werd een enkelvoudige dosis pimozide 2 mg samen toegediend met citalopram 40 mg eenmaal daags gedurende 11 dagen geassocieerd met een gemiddelde verhoging van de QTc-waarden van ongeveer 10 msec vergeleken met pimozide alleen. Citalopram veranderde de gemiddelde AUC of Cmax van pimozide niet. Het mechanisme van deze farmacodynamische interactie is niet bekend [zie: CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
theofylline
Gecombineerde toediening van CELEXA (40 mg/dag gedurende 21 dagen) en het CYP1A2-substraat theofylline (enkele dosis van 300 mg) had geen invloed op de farmacokinetiek van theofylline. Het effect van theofylline op de farmacokinetiek van citalopram werd niet geëvalueerd.
Warfarine
Toediening van 40 mg/dag CELEXA gedurende 21 dagen had geen invloed op de farmacokinetiek van warfarine, een CYP3A4-substraat. De protrombinetijd was met 5% verhoogd, waarvan de klinische betekenis niet bekend is.
Carbamazepine
Gecombineerde toediening van CELEXA (40 mg/dag gedurende 14 dagen) en carbamazepine (getitreerd tot 400 mg/dag gedurende 35 dagen) had geen significante invloed op de farmacokinetiek van carbamazepine, een CYP3A4-substraat. Hoewel de dalplasmaspiegels van citalopram niet werden beïnvloed, moet, gezien de enzyminducerende eigenschappen van carbamazepine, de mogelijkheid worden overwogen dat carbamazepine de klaring van citalopram zou kunnen verhogen als de twee geneesmiddelen gelijktijdig worden toegediend.
triazolam
Gecombineerde toediening van CELEXA (getitreerd tot 40 mg/dag gedurende 28 dagen) en het CYP3A4-substraat triazolam (enkele dosis van 0,25 mg) had geen significante invloed op de farmacokinetiek van citalopram of triazolam.
Ketoconazol
Gecombineerde toediening van CELEXA (40 mg) en ketoconazol (200 mg) verlaagde de Cmax en AUC van ketoconazol met respectievelijk 21% en 10% en had geen significante invloed op de farmacokinetiek van citalopram.
Metoprolol
Toediening van 40 mg/dag CELEXA 20 mg gedurende 22 dagen resulteerde in een tweevoudige verhoging van de plasmaspiegels van de bètaadrenerge blokker metoprolol. Verhoogde plasmaspiegels van metoprolol zijn in verband gebracht met verminderde cardioselectiviteit. Gelijktijdige toediening van CELEXA 10 mg en metoprolol had geen klinisch significant effect op de bloeddruk of hartslag.
Imipramine en andere tricyclische antidepressiva (TCA's)
In vitro-onderzoeken suggereren dat citalopram een relatief zwakke remmer van CYP2D6 is. Gelijktijdige toediening van CELEXA (40 mg/dag gedurende 10 dagen) met de TCA imipramine (enkele dosis van 100 mg), een substraat voor CYP2D6, had geen significante invloed op de plasmaconcentraties van imipramine of citalopram. De concentratie van de imipraminemetaboliet desipramine was echter met ongeveer 50% verhoogd. De klinische betekenis van de desipramineverandering is niet bekend.
Dierlijke toxicologie en/of farmacologie
Netvliesveranderingen bij ratten
Pathologische veranderingen (degeneratie/atrofie) werden waargenomen in het netvlies van albinoratten in het 2 jaar durende carcinogeniteitsonderzoek met citalopram. Er was een toename van zowel de incidentie als de ernst van retinale pathologie bij zowel mannelijke als vrouwelijke ratten die 80 mg/kg/dag kregen, wat ongeveer 19 keer de MRHD is van 40 mg op basis van mg/m² lichaamsoppervlak. Soortgelijke bevindingen waren niet aanwezig bij ratten die gedurende twee jaar werden behandeld met een dosis van 24 mg/kg/dag, bij muizen die gedurende 18 maanden werden behandeld met doses tot 240 mg/kg/dag, of bij honden die gedurende één jaar werden behandeld met doses tot maximaal 240 mg/kg/dag. 20 mg/kg/dag, wat respectievelijk ongeveer 6, 29 en 17 keer de MRHD is, gebaseerd op mg/m² lichaamsoppervlak.
Er zijn geen aanvullende onderzoeken uitgevoerd om het mechanisme voor deze pathologie te onderzoeken en de mogelijke significantie van dit effect bij mensen is niet vastgesteld.
Klinische studies
De werkzaamheid van CELEXA als behandeling van depressieve stoornis werd vastgesteld in twee placebogecontroleerde onderzoeken (van 4 tot 6 weken) bij volwassen poliklinische patiënten (18-66 jaar) die voldeden aan de DSM-III- of DSM-III-R-criteria voor depressieve stoornis (MDD) (onderzoeken 1 en 2).
Onderzoek 1, een 6 weken durend onderzoek waarin patiënten vaste CELEXA 10 mg doses van 10 mg, 20 mg, 40 mg en 60 mg per dag kregen, toonde aan dat CELEXA 40 per dag en 60 mg per dag (1,5 maal de maximaal aanbevolen dagelijkse dosering) effectief zoals gemeten door de Hamilton Depression Rating Scale (HAMD) totale score, het primaire eindpunt voor werkzaamheid. De HAMD-17 is een 17-item, door clinici beoordeelde schaal die wordt gebruikt om de ernst van depressieve symptomen te beoordelen. Scores op de HAMD-17 variëren van 0 tot 52, waarbij hogere scores wijzen op een ernstigere depressie. Dit onderzoek liet geen duidelijk effect zien van de dagelijkse dosis van 10 mg en 20 mg, en de dagelijkse dosis van 60 mg was niet effectiever dan de dagelijkse dosis van 40 mg. Vanwege het risico op QTc-verlenging en ventriculaire aritmieën is de maximale aanbevolen dosering van CELEXA 10 mg eenmaal daags 40 mg.
In onderzoek 2, een 4 weken durende, placebogecontroleerde studie bij patiënten met MDD, was de aanvangsdosis 20 mg per dag, gevolgd door titratie tot de maximaal getolereerde dosis of een maximale dosis van 80 mg per dag (2 maal de maximaal aanbevolen dagelijkse dosering). ). Patiënten die werden behandeld met CELEXA 20 mg vertoonden een statistisch significant grotere verbetering dan placebopatiënten op de totale HAMD-score, het primaire eindpunt voor werkzaamheid. In drie aanvullende placebogecontroleerde onderzoeken bij patiënten met MDD was het verschil in respons op de behandeling tussen patiënten die CELEXA kregen en patiënten die placebo kregen niet statistisch significant.
In twee langetermijnstudies werden patiënten met MDD die tijdens een initiële 6 of 8 weken acute behandeling op CELEXA 10 mg hadden gereageerd, gerandomiseerd naar voortzetting van CELEXA 10 mg of placebo. In één onderzoek kregen patiënten vaste doses CELEXA 20 mg of 40 mg per dag en in het tweede onderzoek kregen patiënten flexibele doses CELEXA 20 mg per dag tot 60 mg per dag (1,5 maal de maximaal aanbevolen dagelijkse dosering). In beide onderzoeken ondervonden patiënten die een voortgezette behandeling met CELEXA kregen statistisch significant lagere terugvalpercentages gedurende de daaropvolgende 6 maanden in vergelijking met degenen die placebo kregen. In het onderzoek met vaste dosis was het verminderde percentage terugval van depressie vergelijkbaar bij patiënten die dagelijks 20 mg of 40 mg CELEXA kregen. Vanwege het risico op QTc-verlenging en ventriculaire aritmieën is de maximale aanbevolen dosering van CELEXA 20 mg eenmaal daags 40 mg.
Analyses van de relatie tussen behandeluitkomst en leeftijd, geslacht en ras suggereerden geen differentiële respons op basis van deze patiëntkenmerken.
PATIËNT INFORMATIE
CELEXA® (Suh-leks-uh) (citalopram) Tabletten, voor oraal gebruik
Wat is de belangrijkste informatie die ik over CELEXA moet weten?
CELEXA 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Verhoogd risico op zelfmoordgedachten en -acties. CELEXA 10 mg en andere antidepressiva kunnen bij sommige kinderen, adolescenten en jongvolwassenen zelfmoordgedachten en -acties doen toenemen. vooral tijdens de eerste paar maanden van de behandeling of wanneer de dosis wordt gewijzigd. CELEXA is niet bestemd voor gebruik bij kinderen.
- Depressie en andere psychische aandoeningen zijn de belangrijkste oorzaken van zelfmoordgedachten en -acties.
Hoe kan ik suïcidale gedachten en acties bij mezelf of een familielid voorkomen en proberen te voorkomen?
- Let goed op eventuele veranderingen, vooral plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens, of als u zelfmoordgedachten of -acties ontwikkelt. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel onmiddellijk uw zorgverlener om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken met uw zorgverlener zoals gepland. Bel indien nodig uw zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel uw zorgverlener of zoek onmiddellijk medische hulp als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- nieuwe of ergere depressie
- zich erg geagiteerd of rusteloos voelen
- moeite met slapen (slapeloosheid)
- agressief handelen, boos of gewelddadig zijn
- een extreme toename van activiteit of praten (manie)
- pogingen om zelfmoord te plegen
- nieuwe of ergere angst
- handelen op gevaarlijke impulsen
- paniekaanvallen
- nieuwe of ergere prikkelbaarheid
- andere ongewone veranderingen in gedrag of stemming
Wat is CELEXA?
CELEXA 10 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van een bepaald type depressie, de zogenaamde depressieve stoornis (MDD), bij volwassenen.
Het is niet bekend of CELEXA 10 mg veilig en effectief is voor gebruik bij kinderen.
Wie mag CELEXA niet gebruiken?
Neem CELEXA niet in als u:
- neem een monoamineoxidaseremmer (MAOI)
- zijn gestopt met het gebruik van een MAO-remmer in de afgelopen 14 dagen
- worden behandeld met het antibioticum linezolid of intraveneus methyleenblauw
- neem pimozide
- allergisch bent voor citalopram of voor één van de bestanddelen van CELEXA. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in CELEXA.
Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, waaronder MAO-remmers zoals linezolid of intraveneus methyleenblauw.
Begin niet met het innemen van een MAO-remmer gedurende ten minste 14 dagen nadat u bent gestopt met de behandeling met CELEXA.
Voordat u CELEXA inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- een familiegeschiedenis van zelfmoord, depressie, bipolaire stoornis, manie of hypomanie heeft of heeft gehad
- een abnormaal hartritme heeft dat QT-verlenging wordt genoemd
- hartproblemen heeft of heeft gehad, waaronder een hartaanval, hartfalen, abnormaal hartritme of lang QT-syndroom
- een laag kalium-, magnesium- of natriumgehalte in uw bloed heeft
- bloedingsproblemen heeft of heeft gehad
- epileptische aanvallen heeft of heeft gehad (convulsies)
- hoge druk in het oog hebben (glaucoom)
- nier- of leverproblemen heeft of heeft gehad
- zwanger bent of van plan bent zwanger te worden. CELEXA 20 mg kan uw ongeboren baby schaden. Het gebruik van CELEXA laat in de zwangerschap kan leiden tot een verhoogd risico op bepaalde problemen bij uw pasgeborene. Praat met uw zorgverlener over de risico's en voordelen van de behandeling van depressie tijdens de zwangerschap.
- Vertel het uw zorgverlener meteen als u zwanger wordt of denkt zwanger te zijn tijdens de behandeling met CELEXA.
- Er is een zwangerschapsregister voor vrouwen die tijdens de zwangerschap aan CELEXA zijn blootgesteld. Het doel van het register is om informatie te verzamelen over de gezondheid van vrouwen die zijn blootgesteld aan CELEXA en hun baby. Als u zwanger wordt tijdens de behandeling met CELEXA 10 mg, overleg dan met uw zorgverlener over registratie bij het Nationaal Zwangerschapsregister voor Antidepressiva. U kunt zich registreren door te bellen naar 1-844-405-6185 of door online te gaan naar https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of CELEXA in uw moedermelk terechtkomt. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens de behandeling met CELEXA.
- Als u borstvoeding geeft tijdens de behandeling met CELEXA 20 mg, neem dan onmiddellijk contact op met uw zorgverlener als uw baby slaperig of onrustig wordt, of niet goed eet of aankomt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
CELEXA 10 mg en andere geneesmiddelen kunnen elkaar beïnvloeden en mogelijk ernstige bijwerkingen veroorzaken. CELEXA kan de werking van andere geneesmiddelen beïnvloeden en andere geneesmiddelen kunnen de werking van CELEXA beïnvloeden.
Vertel het uw zorgverlener vooral als u:
- geneesmiddelen voor de behandeling van migrainehoofdpijn bekend als triptanen
- tricyclische antidepressiva
- fentanyl
- lithium
- tramadol
- tryptofaan
- buspiron
- amfetaminen
- St. Janskruid
- geneesmiddelen die de bloedstolling kunnen beïnvloeden, zoals aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) en warfarine
- diuretica
- methadon
- gatifloxacine of moxifloxacine
- geneesmiddelen die worden gebruikt om uw hartslag of ritme onder controle te houden (antiaritmica)
- geneesmiddelen voor de behandeling van stemmings-, angst-, psychotische of denkstoornissen, waaronder selectieve serotonineheropnameremmers (SSRI's) en serotonine-noradrenalineheropnameremmers (SNRI's)
Vraag uw zorgverlener als u niet zeker weet of u een van deze geneesmiddelen gebruikt. Uw zorgverlener kan u vertellen of het veilig is om CELEXA 10 mg samen met uw andere geneesmiddelen in te nemen.
Start of stop geen andere geneesmiddelen tijdens de behandeling met CELEXA zonder eerst met uw zorgverlener te overleggen. Als u plotseling stopt met CELEXA, kunt u ernstige bijwerkingen krijgen. Zien, “Wat zijn de mogelijke bijwerkingen van CELEXA?”
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om aan uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik CELEXA 10 mg innemen?
- Neem CELEXA 20 mg precies in zoals uw arts u zegt dat u het moet innemen. Verander uw dosis niet en stop niet met het innemen van CELEXA zonder eerst met uw zorgverlener te overleggen.
- Uw zorgverlener moet mogelijk de dosis CELEXA aanpassen totdat deze de juiste dosis voor u is.
- Neem CELEXA 1 keer per dag in met of zonder voedsel.
- Als u te veel CELEXA 20 mg heeft ingenomen, bel dan uw zorgverlener of antigifcentrum op 1-800-222-1222, of ga meteen naar de dichtstbijzijnde eerste hulpafdeling van het ziekenhuis.
Wat zijn de mogelijke bijwerkingen van CELEXA 20 mg?
CELEXA kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien, “Wat is de belangrijkste informatie die ik over CELEXA moet weten?”
- Hartritme problemen. CELEXA kan een ernstige verandering in uw hartslag veroorzaken (een snelle of onregelmatige hartslag) die de dood tot gevolg kan hebben. Vertel het uw zorgverlener meteen als u zich flauw voelt of flauwvalt, of als u een verandering in uw hartslag heeft.
- Serotonine syndroom. Het gebruik van CELEXA kan een mogelijk levensbedreigend probleem veroorzaken dat serotoninesyndroom wordt genoemd. Het risico op het ontwikkelen van het serotoninesyndroom is verhoogd wanneer CELEXA 20 mg samen met bepaalde andere geneesmiddelen wordt ingenomen. Zien, “Wie mag CELEXA niet gebruiken?” Bel uw zorgverlener of ga direct naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis als u een van de volgende tekenen en symptomen van het serotoninesyndroom heeft:
- agitatie
- dingen zien of horen die niet echt zijn (hallucinaties)
- verwardheid
- coma
- snelle hartslag
- bloeddruk verandert
- duizeligheid
- zweten
- blozen
- hoge lichaamstemperatuur (hyperthermie)
- tremoren, stijve spieren of spiertrekkingen
- verlies van coördinatie
- toevallen
- misselijkheid, braken, diarree
- Verhoogd risico op bloedingen. Het gebruik van CELEXA 20 mg met aspirine, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), warfarine of bloedverdunners kan dit risico vergroten. Vertel uw zorgverlener meteen over ongebruikelijke bloedingen of blauwe plekken.
- Manische afleveringen. Manische episodes kunnen optreden bij mensen met een bipolaire stoornis die CELEXA gebruiken. Symptomen kunnen zijn:
- sterk verhoogde energie
- ernstige slaapproblemen
- snelle gedachten
- roekeloos gedrag
- ongewoon grootse ideeën
- overmatig geluk of prikkelbaarheid
- meer of sneller praten dan normaal
- Stopzetting syndroom. Plotseling stoppen met CELEXA 20 mg kan ernstige bijwerkingen veroorzaken. Uw zorgverlener wil mogelijk uw dosis langzaam verlagen. Symptomen kunnen zijn:
- misselijkheid
- zweten
- veranderingen in je humeur
- hoofdpijn
- prikkelbaarheid en opwinding
- vermoeidheid
- duizeligheid
- problemen met slapen
- elektrische schok sensatie (paresthesie)
- hypomanie
- ongerustheid
- oorsuizen (tinnitus)
- verwardheid
- toevallen
- Toevallen (convulsies).
- Oogproblemen (hoekglaucoom). Veel antidepressiva, waaronder CELEXA, kunnen een bepaald type oogprobleem veroorzaken dat geslotenhoekglaucoom wordt genoemd. Bel uw zorgverlener als u veranderingen in uw gezichtsvermogen of oogpijn heeft.
- Laag natriumgehalte in uw bloed (hyponatriëmie). Een laag natriumgehalte in uw bloed kan ernstig zijn en de dood veroorzaken. Ouderen lopen hier mogelijk een groter risico op. Vertel het uw zorgverlener meteen als u tijdens de behandeling met CELEXA tekenen of symptomen krijgt van een laag natriumgehalte in uw bloed. Tekenen en symptomen van een laag natriumgehalte in uw bloed kunnen zijn:
- hoofdpijn
- moeite met concentreren
- geheugen verandert
- verwardheid
- zwakte en onvastheid op uw voeten, wat kan leiden tot vallen
In ernstige of meer plotselinge gevallen omvatten tekenen en symptomen:
-
- hallucinaties (dingen zien of horen die niet echt zijn)
- flauwvallen
- toevallen
- coma
- stoppen met ademen
- dood
- Seksuele problemen (disfunctie). Het gebruik van selectieve serotonineheropnameremmers (SSRI's), waaronder CELEXA, kan seksuele problemen veroorzaken.
Symptomen bij mannen kunnen zijn:
- Vertraagde ejaculatie of onvermogen om een ejaculatie te krijgen
- Verminderde zin in seks
- Problemen met het krijgen of behouden van een erectie
Symptomen bij vrouwen kunnen zijn:
- Verminderde zin in seks
- Vertraagd orgasme of onvermogen om een orgasme te krijgen
Neem contact op met uw zorgverlener als u tijdens de behandeling met DRIZALMA SPRINKLE veranderingen in uw seksuele functie krijgt of als u vragen of zorgen heeft over seksuele problemen. Er kunnen behandelingen zijn die uw zorgverlener kan voorstellen.
De meest voorkomende bijwerking van CELEXA is een vertraagde ejaculatie.
Dit zijn niet alle mogelijke bijwerkingen van CELEXA.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik CELEXA bewaren?
- Bewaar CELEXA bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
- Houd CELEXA 20 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van CELEXA
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik CELEXA 20 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef CELEXA niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw zorgverlener of apotheker om informatie vragen over CELEXA die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in CELEXA?
Actief ingrediënt: citalopram hydrobromide
Inactieve ingredienten: copolyvidon, maïszetmeel, natriumcrosscarmellose, glycerine, lactosemonohydraat, magnesiumstearaat, hypromellose, microkristallijne cellulose, polyethyleenglycol, titaniumdioxide en ijzerdioxide om te kleuren.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
