Voltaren 100mg, 50mg Diclofenac Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Voltaren en hoe wordt het gebruikt?
Voltaren wordt gebruikt voor de behandeling van symptomen van pijn die gepaard gaan met reumatoïde artritis, osteoartritis, spondylitis ankylopoetica, dysmenorroe en milde tot matige pijn. Voltaren 100 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Voltaren behoort tot een klasse geneesmiddelen die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd.
Wat zijn de mogelijke bijwerkingen van Voltaren 50 mg?
Voltaren kan ernstige bijwerkingen veroorzaken, waaronder:
- hoofdpijn,
- honger,
- zweten,
- prikkelbaarheid,
- duizeligheid,
- misselijkheid,
- snelle hartslag,
- zich angstig of wankel voelen,
- gevoelloosheid of tintelingen in uw handen, armen, benen of voeten,
- zwakte in uw armen, handen, benen of voeten,
- brandende pijn in uw armen, handen, benen of voeten,
- ernstige stemmings- of gedragsveranderingen,
- nervositeit,
- verwardheid,
- agitatie,
- paranoia,
- hallucinaties,
- geheugen problemen,
- moeite met concentreren,
- zelfmoordgedachten,
- pees breuk,
- plotselinge pijn,
- zwelling,
- blauwe plekken,
- tederheid,
- stijfheid,
- bewegingsproblemen,
- een knappend of ploffend geluid in een van uw gewrichten,
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- fladderend in je borst,
- kortademigheid,
- huiduitslag,
- ademhalingsproblemen,
- toevallen (convulsies),
- ernstige hoofdpijn,
- zichtproblemen,
- pijn achter je ogen,
- pijn in de bovenbuik,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen (geelzucht)
en medische hulp als u een van de hierboven genoemde symptomen heeft.
De meest voorkomende bijwerkingen van Voltaren zijn:
- indigestie,
- gas,
- buikpijn,
- misselijkheid,
- braken,
- diarree,
- constipatie,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- verstopte neus,
- jeuk,
- toegenomen zweten,
- verhoogde bloeddruk, en
- zwelling of pijn in uw armen of benen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Voltaren. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
HEPATOXICITEIT, CARDIAC TOXICITEIT, EMBRYO-FOETALE TOXICITEIT
Cardiovasculaire trombotische gebeurtenissen
- Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) veroorzaken een verhoogd risico op ernstige cardiovasculaire trombotische voorvallen, waaronder myocardinfarct en beroerte, die fataal kunnen zijn. Dit risico kan vroeg in de behandeling optreden en kan toenemen met de duur van het gebruik (zie WAARSCHUWINGEN).
- VOLTAREN® is gecontra-indiceerd bij coronaire bypassoperaties (CABG) (zie CONTRA-INDICATIES, WAARSCHUWINGEN).
Gastro-intestinale bloedingen, ulceraties en perforaties
- NSAID's veroorzaken een verhoogd risico op ernstige gastro-intestinale (GI) bijwerkingen, waaronder bloedingen, ulceratie en perforatie van de maag of darmen, die fataal kunnen zijn. Deze gebeurtenissen kunnen op elk moment tijdens het gebruik en zonder waarschuwingssymptomen optreden. Oudere patiënten en patiënten met een voorgeschiedenis van ulcus pepticum en/of gastro-intestinale bloeding lopen een groter risico op ernstige gastro-intestinale voorvallen. (zie WAARSCHUWINGEN).
OMSCHRIJVING
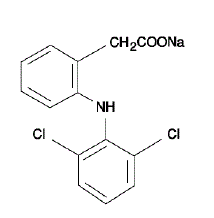
VOLTAREN® (diclofenac natrium enterisch omhulde tabletten) is een benzeen-azijnzuurderivaat. VOLTAREN 50 mg is verkrijgbaar als tabletten met vertraagde afgifte (enterisch omhulde) van 75 mg (lichtroze) voor orale toediening. Diclofenacnatrium is een wit of licht geelachtig kristallijn poeder en is slecht oplosbaar in water bij 25°C. De chemische naam is 2-[(2,6-dichloorfenyl)amino]benzeenazijnzuur, mononatriumzout. Het molecuulgewicht is 318,14. De molecuulformule is C14H10Cl2NNaO2 en heeft de volgende structuurformule:
De inactieve ingrediënten in VOLTAREN zijn: hydroxypropylmethylcellulose, ijzeroxide, lactose, magnesiumstearaat, methacrylzuurcopolymeer, microkristallijne cellulose, polyethyleenglycol, povidon, propyleenglycol, natriumhydroxide, natriumzetmeelglycolaat, talk, titaniumdioxide.
INDICATIES
Overweeg zorgvuldig de mogelijke voordelen en risico's van VOLTAREN® (diclofenac natrium enterisch omhulde tabletten) en andere behandelingsopties voordat u besluit VOLTAREN te gebruiken. Gebruik de laagste effectieve dosis voor de kortste duur in overeenstemming met de individuele behandeldoelen van de patiënt (zie: WAARSCHUWINGEN ; Maagbloeding , Ulceratie , en Perforatie ).
VOLTAREN wordt aangegeven:
- voor verlichting van de tekenen en symptomen van artrose
- voor verlichting van de tekenen en symptomen van reumatoïde artritis
- voor acuut of langdurig gebruik ter verlichting van tekenen en symptomen van spondylitis ankylopoetica
DOSERING EN ADMINISTRATIE
Overweeg zorgvuldig de mogelijke voordelen en risico's van VOLTAREN® (diclofenac natrium enterisch omhulde tabletten) en andere behandelingsopties voordat u besluit VOLTAREN te gebruiken. Gebruik de laagste effectieve dosis voor de kortste duur in overeenstemming met de individuele behandeldoelen van de patiënt (zie: WAARSCHUWINGEN ; Gastro-intestinale bloeding, ulceratie en perforatie ).
Na het observeren van de respons op de initiële therapie met VOLTAREN 100 mg, moeten de dosis en frequentie worden aangepast aan de behoeften van de individuele patiënt.
Voor de verlichting van artrose is de aanbevolen dosering 100 tot 150 mg/dag in verdeelde doses (50 mg tweemaal daags of driemaal daags, of 75 mg tweemaal daags).
Voor de verlichting van reumatoïde artritis is de aanbevolen dosering 150 tot 200 mg/dag in verdeelde doses (50 mg driemaal daags of viermaal daags of 75 mg tweemaal daags).
Voor de verlichting van spondylitis ankylopoetica is de aanbevolen dosering 100 tot 125 mg/dag, viermaal daags toegediend als 25 mg, indien nodig met een extra dosis van 25 mg voor het slapengaan.
Verschillende formuleringen van diclofenac [VOLTAREN® (diclofenac natrium enterisch omhulde tabletten); VOLTAREN®ÂXR (diclofenac-natriumtabletten met verlengde afgifte); CATAFLAM® (diclofenac kalium tabletten met onmiddellijke afgifte)] zijn niet noodzakelijk bio-equivalent, zelfs als de milligramsterkte hetzelfde is.
HOE GELEVERD
VOLTAREN® (diclofenac-natrium enterisch omhulde tabletten) - 75 mg
Lichtroze, biconvexe, driehoekige, maagsapresistente tabletten (aan één kant bedrukt met 'VOLTAREN 75' in zwarte inkt)
Flessen van 100 NDC 0028-0264-01
Bewaren bij kamertemperatuur 20°C tot 25°C (68°F tot 77°F); excursies toegestaan tussen 15°C en 30°C (59°F en 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Beschermen tegen vocht. Doseer in een strakke container (USP).
Gedistribueerd door: Novartis Pharmaceuticals Corporation East Hanover, NJ 07936. Herzien: april 2021
BIJWERKINGEN
De volgende bijwerkingen worden in andere secties van de etikettering in meer detail besproken:
- Cardiovasculaire trombotische gebeurtenissen (zie WAARSCHUWINGEN )
- GI-bloeding, ulceratie en perforatie (zie WAARSCHUWINGEN )
- Hepatotoxiciteit (zie WAARSCHUWINGEN )
- Hypertensie (zie WAARSCHUWINGEN )
- Hartfalen en oedeem (zie WAARSCHUWINGEN )
- Niertoxiciteit en hyperkaliëmie (zie WAARSCHUWINGEN )
- Anafylactische reacties (zie WAARSCHUWINGEN )
- Ernstige huidreacties (zie WAARSCHUWINGEN )
- Hematologische toxiciteit (zie WAARSCHUWINGEN )
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Bij patiënten die VOLTAREN® (diclofenac natrium enterisch omhulde tabletten) of andere NSAID's gebruiken, zijn de meest gemelde bijwerkingen die optreden bij ongeveer 1% tot 10% van de patiënten: Gastro-intestinale ervaringen, waaronder: buikpijn, obstipatie, diarree, dyspepsie, winderigheid, grove bloeding/perforatie, brandend maagzuur, misselijkheid, maagdarmzweren (maag/twaalfvingerige darm) en braken.
Abnormale nierfunctie, bloedarmoede, duizeligheid, oedeem, verhoogde leverenzymen, hoofdpijn, verlengde bloedingstijd, pruritus, huiduitslag en oorsuizen. Bijkomende bijwerkingen die af en toe worden gemeld, zijn onder meer:
Lichaam als geheel: koorts, infectie, sepsis
Cardiovasculair systeem: congestief hartfalen, hypertensie, tachycardie, syncope
Spijsverteringsstelsel: droge mond, oesofagitis, maag-/maagzweren, gastritis, gastro-intestinale bloeding, glossitis, hematemesis, hepatitis, geelzucht
Hemic en lymfatisch systeem: ecchymose, eosinofilie, leukopenie, melena, purpura, rectale bloeding, stomatitis, trombocytopenie
Metabool en voedingswaarde: gewichtsveranderingen
Zenuwstelsel: angst, asthenie, verwardheid, depressie, droomafwijkingen, slaperigheid, slapeloosheid, malaise, nervositeit, paresthesie, slaperigheid, tremoren, duizeligheid
Ademhalingssysteem: astma, dyspnoe
Huid en aanhangsels: alopecia, lichtgevoeligheid, zweten verhoogd
Speciale zintuigen: wazig zien
Urogenitaal systeem: cystitis, dysurie, hematurie, interstitiële nefritis, oligurie/polyurie, proteïnurie, nierfalen
Andere bijwerkingen die zelden voorkomen zijn:
Lichaam als geheel: anafylactische reacties, veranderingen in eetlust, overlijden
Cardiovasculair systeem: aritmie, hypotensie, myocardinfarct, hartkloppingen, vasculitis
Spijsverteringsstelsel: colitis, oprispingen, fulminante hepatitis met en zonder geelzucht, leverfalen, levernecrose, pancreatitis
Hemic en lymfatisch systeem: agranulocytose, hemolytische anemie, aplastische anemie, lymfadenopathie, pancytopenie
Metabool en voedingswaarde: hyperglykemie
Zenuwstelsel: convulsies, coma, hallucinaties, meningitis
Ademhalingssysteem: ademhalingsdepressie, longontsteking
Huid en aanhangsels: angio-oedeem, toxische epidermale necrolyse, erythema multiforme, exfoliatieve dermatitis, Stevens-Johnson-syndroom, urticaria
Speciale zintuigen: conjunctivitis, slechthorendheid
OVERDOSERING
Symptomen na acute overdosering met NSAID's waren doorgaans beperkt tot lethargie, slaperigheid, misselijkheid, braken en epigastrische pijn, die over het algemeen reversibel waren met ondersteunende zorg. Gastro-intestinale bloedingen zijn opgetreden. Hypertensie, acuut nierfalen, ademhalingsdepressie en coma zijn opgetreden, maar waren zeldzaam (zie: WAARSCHUWINGEN ; Cardiovasculaire trombotische gebeurtenissen, gastro-intestinale bloedingen, ulceratie en hypertensie, niertoxiciteit en hyperkaliëmie ).
Beheer patiënten met symptomatische en ondersteunende zorg na een overdosering met NSAID's. Er zijn geen specifieke antidota. Overweeg braken en/of actieve kool (60 tot 100 gram bij volwassenen, 1 tot 2 gram per kg lichaamsgewicht bij pediatrische patiënten) en/of osmotische catharsis bij symptomatische patiënten die binnen vier uur na inname worden waargenomen of bij patiënten met een grote overdosis ( 5 tot 10 keer de aanbevolen dosering). Geforceerde diurese, alkalisering van urine, hemodialyse of hemoperfusie zijn mogelijk niet nuttig vanwege de hoge eiwitbinding.
Neem voor meer informatie over een behandeling met overdosering contact op met een antigifcentrum (1-800-222-1222).
DRUG-INTERACTIES
Zie Tabel 2 voor klinisch significante geneesmiddelinteracties met diclofenac.
WAARSCHUWINGEN
Cardiovasculaire trombotische gebeurtenissen
Klinische onderzoeken met verschillende COX-2-selectieve en niet-selectieve NSAID's met een duur tot 3 jaar hebben een verhoogd risico op ernstige cardiovasculaire (CV) trombotische voorvallen aangetoond, waaronder myocardinfarct (MI) en beroerte, die fataal kunnen zijn. Op basis van beschikbare gegevens is het onduidelijk dat het risico op CV trombotische voorvallen gelijk is voor alle NSAID's. De relatieve toename van ernstige CV trombotische voorvallen ten opzichte van baseline, veroorzaakt door het gebruik van NSAID's, lijkt vergelijkbaar te zijn bij degenen met en zonder bekende CV ziekte of risicofactoren voor CV ziekte. Patiënten met bekende CV ziekte of risicofactoren hadden echter een hogere absolute incidentie van overmatige ernstige CV trombotische voorvallen, vanwege hun verhoogde baseline percentage. Sommige observationele studies vonden dat dit verhoogde risico op ernstige CV trombotische voorvallen al in de eerste weken van de behandeling begon. De toename van het cardiovasculaire trombotische risico is het meest consistent waargenomen bij hogere doses.
Gebruik de laagst effectieve dosis voor de kortst mogelijke duur om het potentiële risico op een ongunstige CV-gebeurtenis bij met NSAID behandelde patiënten te minimaliseren. Artsen en patiënten moeten alert blijven op de ontwikkeling van dergelijke gebeurtenissen, gedurende de gehele behandelingskuur, zelfs als er geen eerdere CV-symptomen zijn. Patiënten moeten worden geïnformeerd over de symptomen van ernstige CV-gebeurtenissen en de te nemen stappen als deze zich voordoen.
Er is geen consistent bewijs dat gelijktijdig gebruik van aspirine het verhoogde risico op ernstige CV trombotische voorvallen geassocieerd met NSAID-gebruik vermindert. Het gelijktijdig gebruik van aspirine en een NSAID, zoals diclofenac, verhoogt het risico op ernstige gastro-intestinale (GI) gebeurtenissen (zie WAARSCHUWINGEN ; Maagbloeding , Ulceratie , en Perforatie ).
Status Post coronaire bypassoperatie (CABG)
Twee grote, gecontroleerde, klinische onderzoeken met een COX-2-selectieve NSAID voor de behandeling van pijn in de eerste 10 tot 14 dagen na CABG-chirurgie vonden een verhoogde incidentie van myocardinfarct en beroerte. NSAID's zijn gecontra-indiceerd bij CABG (zie: CONTRA-INDICATIES ).
Post-MI-patiënten
Observationele studies uitgevoerd in het Deense Nationale Register hebben aangetoond dat patiënten die in de post-MI-periode met NSAID's werden behandeld een verhoogd risico hadden op een her-infarct, CV-gerelateerd overlijden en mortaliteit door alle oorzaken vanaf de eerste week van de behandeling. In hetzelfde cohort was de incidentie van overlijden in het eerste jaar na MI 20 per 100 persoonsjaren bij NSAID-behandelde patiënten vergeleken met 12 per 100 persoonsjaren bij niet-NSAID-blootgestelde patiënten. Hoewel het absolute sterftecijfer enigszins daalde na het eerste jaar na MI, bleef het verhoogde relatieve risico op overlijden bij NSAID-gebruikers gedurende ten minste de volgende vier jaar van follow-up bestaan.
Vermijd het gebruik van VOLTAREN bij patiënten met een recent MI, tenzij verwacht wordt dat de voordelen opwegen tegen het risico op terugkerende CV trombotische voorvallen. Als VOLTAREN wordt gebruikt bij patiënten met een recent MI, moet u de patiënten controleren op tekenen van cardiale ischemie.
Gastro-intestinale bloedingen, ulceraties en perforaties
NSAID's, waaronder diclofenac, veroorzaken ernstige gastro-intestinale (GI) bijwerkingen, waaronder ontsteking, bloeding, ulceratie en perforatie van de slokdarm, maag, dunne darm of dikke darm, die fataal kan zijn. Deze ernstige bijwerkingen kunnen op elk moment optreden, met of zonder waarschuwingssymptomen, bij patiënten die worden behandeld met NSAID's. Slechts één op de vijf patiënten, die een ernstige bijwerking van het bovenste deel van het maagdarmkanaal ontwikkelen bij behandeling met NSAID's, is symptomatisch. Zweren van het bovenste deel van het maagdarmkanaal, grove bloeding of perforatie veroorzaakt door NSAID's kwamen voor bij ongeveer 1% van de patiënten die gedurende 3 tot 6 maanden werden behandeld en bij ongeveer 2% tot 4% van de patiënten die gedurende een jaar werden behandeld. Zelfs kortdurende therapie is echter niet zonder risico.
Risicofactoren voor GI-bloeding, ulceratie en perforatie
Patiënten met een voorgeschiedenis van ulcus pepticum en/of gastro-intestinale bloeding die NSAID's gebruiken, hadden een meer dan 10-voudig verhoogd risico op het ontwikkelen van een gastro-intestinale bloeding in vergelijking met patiënten zonder deze risicofactoren. Andere factoren die het risico op gastro-intestinale bloedingen verhogen bij patiënten die met NSAID's worden behandeld, zijn onder meer een langere behandeling met NSAID's, gelijktijdig gebruik van orale corticosteroïden, aspirine, anticoagulantia of selectieve serotonineheropnameremmers (SSRI's); roken, alcoholgebruik, hogere leeftijd en een slechte algemene gezondheidstoestand. De meeste postmarketingmeldingen van fatale GI-voorvallen kwamen voor bij oudere of verzwakte patiënten. Bovendien lopen patiënten met gevorderde leverziekte en/of coagulopathie een verhoogd risico op gastro-intestinale bloedingen.
Strategieën OM DE GI-risico's bij NSAID-behandelde patiënten TE MINIMALISEREN
- Gebruik de laagste effectieve dosering voor de kortst mogelijke duur.
- Vermijd toediening van meer dan één NSAID tegelijk
- Vermijd het gebruik bij patiënten met een hoger risico, tenzij verwacht wordt dat de voordelen opwegen tegen het verhoogde risico op bloedingen. Overweeg voor dergelijke patiënten, evenals voor patiënten met actieve gastro-intestinale bloedingen, andere alternatieve therapieën dan NSAID's.
- Blijf alert op tekenen en symptomen van gastro-intestinale ulceratie en bloeding tijdens NSAID-therapie.
- Als een ernstige GI-bijwerking wordt vermoed, start dan onmiddellijk met evaluatie en behandeling en stop met VOLTAREN 50 mg totdat een ernstige GI-bijwerking is uitgesloten.
- Bij gelijktijdig gebruik van een lage dosis aspirine voor cardiale profylaxe, moet u de patiënten nauwkeuriger controleren op tekenen van gastro-intestinale bloeding (zie PREVENTIEVE MAATREGELEN ; Geneesmiddelinteracties ).
Hepatotoxiciteit
In klinische onderzoeken met producten die diclofenac bevatten, werden betekenisvolle verhogingen (dwz meer dan 3 keer de bovengrens van normaal [ULN]) van aspartaataminotransferase (AST) (ook bekend als SGOT) waargenomen bij ongeveer 2% van ongeveer 5700 patiënten op enige tijd tijdens de behandeling met diclofenac (alanine-aminotransferase [ALT] werd niet in alle onderzoeken gemeten).
In een groot, open-label, gecontroleerd onderzoek bij 3700 patiënten die gedurende 2 tot 6 maanden met oraal diclofenacnatrium werden behandeld, werden de patiënten eerst gecontroleerd na 8 weken en werden 1200 patiënten opnieuw gecontroleerd na 24 weken. Betekenisvolle verhogingen van ALAT en/of ASAT kwamen voor bij ongeveer 4% van de patiënten en omvatten duidelijke verhogingen (groter dan 8 keer de ULN) bij ongeveer 1% van de 3700 patiënten. In dat open-label onderzoek werd een hogere incidentie van borderline (minder dan 3 maal de ULN), matige (3 tot 8 maal de ULN) en duidelijke (groter dan 8 maal de ULN) verhogingen van ALAT of ASAT waargenomen bij patiënten diclofenac krijgen in vergelijking met andere NSAID's. Verhogingen van transaminasen werden vaker gezien bij patiënten met artrose dan bij patiënten met reumatoïde artritis.
Bijna alle betekenisvolle verhogingen van transaminasen werden gedetecteerd voordat patiënten symptomatisch werden. Tijdens de eerste 2 maanden van de behandeling met diclofenac traden abnormale testen op bij 42 van de 51 patiënten in alle onderzoeken die duidelijke transaminaseverhogingen ontwikkelden.
In postmarketingrapporten zijn gevallen van geneesmiddelgeïnduceerde hepatotoxiciteit gemeld in de eerste maand en in sommige gevallen de eerste 2 maanden van de behandeling, maar dit kan op elk moment tijdens de behandeling met diclofenac optreden. Postmarketingsurveillance heeft gevallen gemeld van ernstige leverreacties, waaronder levernecrose, geelzucht, fulminante hepatitis met en zonder geelzucht en leverfalen. Sommige van deze gemelde gevallen resulteerden in sterfgevallen of levertransplantaties.
In een Europees retrospectief populatiegebaseerd, patiëntgecontroleerd onderzoek werden 10 gevallen van door diclofenac veroorzaakte, door geneesmiddelen veroorzaakte leverbeschadiging bij huidig gebruik vergeleken met niet-gebruik van diclofenac geassocieerd met een statistisch significante 4-voudige aangepaste oddsratio van leverbeschadiging. In dit specifieke onderzoek, gebaseerd op een totaal aantal van 10 gevallen van leverbeschadiging geassocieerd met diclofenac, nam de aangepaste oddsratio verder toe met vrouwelijk geslacht, doses van 150 mg of meer en een gebruiksduur van meer dan 90 dagen.
Artsen dienen de transaminasen bij aanvang en periodiek te meten bij patiënten die langdurig met diclofenac worden behandeld, omdat zich ernstige levertoxiciteit kan ontwikkelen zonder dat er symptomen optreden. De optimale tijden voor het maken van de eerste en volgende transaminasemetingen zijn niet bekend. Op basis van gegevens uit klinische onderzoeken en postmarketingervaringen dienen transaminasen binnen 4 tot 8 weken na het starten van de behandeling met diclofenac te worden gecontroleerd. Er kunnen echter op elk moment tijdens de behandeling met diclofenac ernstige leverreacties optreden.
Als abnormale levertesten aanhouden of verergeren, als zich klinische tekenen en/of symptomen ontwikkelen die overeenkomen met een leverziekte, of als systemische verschijnselen optreden (bijv. eosinofilie, huiduitslag, buikpijn, diarree, donkere urine, enz.), moet VOLTAREN onmiddellijk worden stopgezet .
Informeer patiënten over de waarschuwingssignalen en symptomen van hepatotoxiciteit (bijv. misselijkheid, vermoeidheid, lethargie, diarree, jeuk, geelzucht, gevoeligheid van het rechter bovenste kwadrant en "griepachtige" symptomen). Als zich klinische tekenen en symptomen ontwikkelen die overeenkomen met een leverziekte, of als systemische verschijnselen optreden (bijv. eosinofilie, huiduitslag, enz.), stop dan onmiddellijk met VOLTAREN en voer een klinische evaluatie van de patiënt uit.
Om het potentiële risico op een bijwerking van de lever bij patiënten die met VOLTAREN worden behandeld tot een minimum te beperken, moet de laagst mogelijke effectieve dosis worden gebruikt voor de kortst mogelijke duur. Wees voorzichtig bij het gelijktijdig voorschrijven van VOLTAREN 100 mg met geneesmiddelen waarvan bekend is dat ze mogelijk hepatotoxisch zijn (bijv. paracetamol, antibiotica, anti-epileptica).
Hypertensie
NSAID's, waaronder VOLTAREN 100 mg, kunnen leiden tot het ontstaan van hypertensie of verergering van reeds bestaande hypertensie, die beide kunnen bijdragen aan de verhoogde incidentie van CV-voorvallen. Patiënten die angiotensineconverterend enzym (ACE)-remmers, thiazidendiuretica of lisdiuretica gebruiken, kunnen een verminderde respons op deze therapieën hebben wanneer ze NSAID's gebruiken (zie PREVENTIEVE MAATREGELEN ; DRUG-INTERACTIES ).
Controleer de bloeddruk (BP) tijdens de start van de NSAID-behandeling en tijdens de behandeling.
Hartfalen en oedeem
De meta-analyse van Coxib en traditionele NSAID Trialists' Collaboration van gerandomiseerde gecontroleerde onderzoeken toonde een ongeveer 2-voudige toename van ziekenhuisopnames voor hartfalen aan bij met COX-2 selectief behandelde patiënten en niet-selectieve NSAID-behandelde patiënten in vergelijking met met placebo behandelde patiënten. In een Deense National Registry-studie van patiënten met hartfalen verhoogde het gebruik van NSAID's het risico op MI, ziekenhuisopname voor hartfalen en overlijden.
Bovendien zijn vochtretentie en oedeem waargenomen bij sommige patiënten die met NSAID's werden behandeld. Het gebruik van diclofenac kan de CV-effecten van verschillende therapeutische middelen die worden gebruikt om deze medische aandoeningen te behandelen (bijv. diuretica, ACE-remmers of angiotensinereceptorblokkers [ARB’s]) afzwakken (zie DRUG-INTERACTIES ).
Vermijd het gebruik van VOLTAREN bij patiënten met ernstig hartfalen, tenzij verwacht wordt dat de voordelen opwegen tegen het risico op verergering van hartfalen. Als VOLTAREN 50 mg wordt gebruikt bij patiënten met ernstig hartfalen, controleer de patiënten dan op tekenen van verergering van hartfalen.
Niertoxiciteit en hyperkaliëmie
Niertoxiciteit
Langdurige toediening van NSAID's heeft geresulteerd in renale papillaire necrose en ander nierletsel.
Niertoxiciteit is ook waargenomen bij patiënten bij wie renale prostaglandines een compenserende rol spelen bij het in stand houden van de nierperfusie. Bij deze patiënten kan toediening van een NSAID een dosisafhankelijke vermindering van de vorming van prostaglandine veroorzaken en, in tweede instantie, van de renale bloedstroom, wat een duidelijke nierdecompensatie kan veroorzaken. Patiënten met het grootste risico op deze reactie zijn patiënten met een verminderde nierfunctie, uitdroging, hypovolemie, hartfalen, leverdisfunctie, patiënten die diuretica en ACE-remmers of ARB's gebruiken, en ouderen. Stopzetting van de NSAID-therapie wordt meestal gevolgd door herstel naar de toestand van voor de behandeling.
Er is geen informatie beschikbaar uit gecontroleerde klinische onderzoeken over het gebruik van VOLTAREN 100 mg bij patiënten met gevorderde nierziekte. De effecten op de nieren van VOLTAREN 50 mg kunnen de progressie van nierdisfunctie versnellen bij patiënten met een reeds bestaande nierziekte.
Corrigeer de volumestatus bij gedehydrateerde of hypovolemische patiënten voordat met VOLTAREN wordt begonnen. Controleer de nierfunctie bij patiënten met nier- of leverinsufficiëntie, hartfalen, uitdroging of hypovolemie tijdens het gebruik van VOLTAREN (zie DRUG-INTERACTIES ). Vermijd het gebruik van VOLTAREN bij patiënten met gevorderde nierziekte, tenzij verwacht wordt dat de voordelen opwegen tegen het risico op verslechtering van de nierfunctie. Als VOLTAREN 50 mg wordt gebruikt bij patiënten met gevorderde nierziekte, controleer de patiënten dan op tekenen van verslechtering van de nierfunctie.
Hyperkaliëmie
Verhogingen van de serumkaliumconcentratie, waaronder hyperkaliëmie, zijn gemeld bij gebruik van NSAID's, zelfs bij sommige patiënten zonder nierfunctiestoornis. Bij patiënten met een normale nierfunctie zijn deze effecten toegeschreven aan een toestand van hyporeninemisch-hypoaldosteronisme.
Anafylactische reacties
Diclofenac is in verband gebracht met anafylactische reacties bij patiënten met en zonder bekende overgevoeligheid voor diclofenac en bij patiënten met aspirinegevoelig astma (zie CONTRA-INDICATIES , WAARSCHUWINGEN ; Exacerbatie van astma gerelateerd aan aspirinegevoeligheid ).
Exacerbatie van astma gerelateerd aan aspirinegevoeligheid
Een subpopulatie van patiënten met astma kan aspirinegevoelig astma hebben, waaronder chronische rhinosinusitis gecompliceerd door neuspoliepen; ernstige, mogelijk fatale bronchospasmen; en/of intolerantie voor aspirine en andere NSAID's. Omdat kruisreactiviteit tussen aspirine en andere NSAID's is gemeld bij dergelijke aspirinegevoelige patiënten, is Voltaren 100 mg gecontra-indiceerd bij patiënten met deze vorm van aspirinegevoeligheid (zie CONTRA-INDICATIES ). Als VOLTAREN 100 mg wordt gebruikt bij patiënten met reeds bestaand astma (waarvan geen gevoeligheid voor aspirine bekend is), moet u de patiënten controleren op veranderingen in de tekenen en symptomen van astma.
Ernstige huidreacties
NSAID's, waaronder diclofenac, kunnen ernstige huidbijwerkingen veroorzaken, zoals exfoliatieve dermatitis, Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), die fataal kan zijn. Deze ernstige gebeurtenissen kunnen zonder waarschuwing plaatsvinden. Informeer patiënten over de tekenen en symptomen van ernstige huidreacties en stop het gebruik van VOLTAREN bij het eerste optreden van huiduitslag of enig ander teken van overgevoeligheid. VOLTAREN is gecontra-indiceerd bij patiënten met eerdere ernstige huidreacties op NSAID's (zie: CONTRA-INDICATIES ).
Geneesmiddelreactie met eosinofilie en systemische symptomen (JURK)
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) is gemeld bij patiënten die NSAID's gebruiken, zoals VOLTAREN. Sommige van deze voorvallen waren fataal of levensbedreigend. DRESS presenteert zich meestal, maar niet uitsluitend, met koorts, huiduitslag, lymfadenopathie en/of zwelling van het gezicht. Andere klinische manifestaties kunnen zijn: hepatitis, nefritis, hematologische afwijkingen, myocarditis of myositis. Soms kunnen de symptomen van DRESS lijken op een acute virale infectie. Eosinofilie is vaak aanwezig. Omdat deze aandoening variabel is in zijn presentatie, kunnen andere orgaansystemen die hier niet zijn vermeld, bij betrokken zijn. Het is belangrijk op te merken dat vroege manifestaties van overgevoeligheid, zoals koorts of lymfadenopathie, aanwezig kunnen zijn, ook al is huiduitslag niet duidelijk. Als dergelijke tekenen of symptomen aanwezig zijn, stop dan met VOLTAREN 50 mg en evalueer de patiënt onmiddellijk.
Foetale toxiciteit
Voortijdige sluiting van foetale ductus arteriosus
Vermijd het gebruik van NSAID's, inclusief VOLTAREN 50 mg, bij zwangere vrouwen bij een zwangerschapsduur van ongeveer 30 weken en later. NSAID's, waaronder VOLTAREN 50 mg, verhogen het risico op voortijdige sluiting van de foetale ductus arteriosus rond deze zwangerschapsduur.
Oligohydramnion/neonatale nierinsufficiëntie
Het gebruik van NSAID's, waaronder VOLTAREN, bij een zwangerschapsduur van ongeveer 20 weken of later in de zwangerschap kan foetale nierdisfunctie veroorzaken, wat kan leiden tot oligohydramnion en, in sommige gevallen, neonatale nierfunctiestoornis. Deze nadelige resultaten worden gemiddeld gezien na dagen tot weken behandeling, hoewel oligohydramnion zelden al 48 uur na het starten van NSAID's is gemeld. Oligohydramnion is vaak, maar niet altijd, reversibel bij stopzetting van de behandeling. Complicaties van langdurige oligohydramnion kunnen bijvoorbeeld contracturen van ledematen en vertraagde longrijping omvatten. In sommige postmarketinggevallen van verminderde neonatale nierfunctie waren invasieve procedures, zoals wisseltransfusie of dialyse, vereist.
Als behandeling met NSAID's nodig is tussen ongeveer 20 weken en 30 weken zwangerschap, beperk dan het gebruik van VOLTAREN tot de laagst mogelijke effectieve dosis en de kortst mogelijke duur. Overweeg echografie van het vruchtwater als de behandeling met Voltaren 50 mg langer duurt dan 48 uur. Stop met VOLTAREN 100 mg als oligohydramnion optreedt en volg de klinische praktijk op (zie: PREVENTIEVE MAATREGELEN ; Zwangerschap ).
Hematologische toxiciteit
Bloedarmoede is opgetreden bij met NSAID behandelde patiënten. Dit kan te wijten zijn aan occult of grof bloedverlies, vochtretentie of een onvolledig beschreven effect op erytropoëse. Als een met VOLTAREN behandelde patiënt tekenen of symptomen van bloedarmoede heeft, controleer hemoglobine of hematocriet.
NSAID's, waaronder VOLTAREN 100 mg, kunnen het risico op bloedingen verhogen. Comorbiditeit, zoals stollingsstoornissen, gelijktijdig gebruik van warfarine, andere anticoagulantia, plaatjesaggregatieremmers (bijv. aspirine), serotonineheropnameremmers (SSRI's) en serotonine-noradrenalineheropnameremmers (SNRI's) kunnen dit risico verhogen. Controleer deze patiënten op tekenen van bloeding (zie: DRUG-INTERACTIES ).
PREVENTIEVE MAATREGELEN
Algemeen
Van VOLTAREN® (diclofenac-natrium enterisch omhulde tabletten) kan niet worden verwacht dat het corticosteroïden vervangt of corticosteroïde-insufficiëntie behandelt. Abrupt staken van de behandeling met corticosteroïden kan leiden tot verergering van de ziekte. Patiënten die langdurig met corticosteroïden worden behandeld, dienen hun therapie langzaam af te bouwen als wordt besloten de corticosteroïden stop te zetten en de patiënt moet nauwlettend worden geobserveerd op tekenen van bijwerkingen, waaronder bijnierinsufficiëntie en verergering van symptomen van artritis.
De farmacologische activiteit van VOLTAREN 50 mg bij het verminderen van koorts en ontsteking kan het nut van deze diagnostische symptomen bij het opsporen van complicaties van veronderstelde niet-infectieuze, pijnlijke aandoeningen verminderen.

Informatie voor patiënten
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ) bij elk verstrekt recept. Informeer patiënten, families of hun verzorgers over de volgende informatie voordat de behandeling met VOLTAREN wordt gestart en periodiek tijdens de lopende therapie.
Cardiovasculaire trombotische gebeurtenissen
Adviseer patiënten alert te zijn op de symptomen van cardiovasculaire trombotische voorvallen, waaronder pijn op de borst, kortademigheid, zwakte of onduidelijke spraak, en om elk van deze symptomen onmiddellijk aan hun zorgverlener te melden (zie WAARSCHUWINGEN ; Cardiovasculaire trombotische gebeurtenissen ).
Gastro-intestinale bloedingen, ulceraties en perforaties
Adviseer patiënten om symptomen van ulceraties en bloedingen, waaronder epigastrische pijn, dyspepsie, melena en hematemesis, aan hun zorgverlener te melden. In de setting van gelijktijdig gebruik van een lage dosis aspirine voor hartprofylaxe, informeer patiënten over het verhoogde risico op de tekenen en symptomen van gastro-intestinale bloeding (zie WAARSCHUWING ; Maagbloeding , Ulceratie , en Perforatie ).
Hepatotoxiciteit
Informeer patiënten over de waarschuwingssignalen en symptomen van hepatotoxiciteit (bijv. misselijkheid, vermoeidheid, lethargie, jeuk, diarree, geelzucht, gevoeligheid van het rechter bovenste kwadrant en "griepachtige" symptomen). Als deze zich voordoen, instrueer patiënten om te stoppen met VOLTAREN 50 mg en onmiddellijk medische therapie te zoeken (zie: WAARSCHUWINGEN ; Hepatotoxiciteit ).
Hartfalen en oedeem
Adviseer patiënten alert te zijn op de symptomen van congestief hartfalen, waaronder kortademigheid, onverklaarbare gewichtstoename of oedeem, en om contact op te nemen met hun zorgverlener als dergelijke symptomen optreden (zie WAARSCHUWINGEN ; Hartfalen en oedeem ).
Anafylactische reacties
Informeer patiënten over de tekenen van een anafylactische reactie (bijv. ademhalingsmoeilijkheden, zwelling van het gezicht of de keel). Instrueer patiënten om onmiddellijk noodhulp te zoeken als deze zich voordoen (zie WAARSCHUWINGEN ; Anafylactische reacties ).
Ernstige huidreacties, waaronder JURK
Adviseer patiënten om onmiddellijk te stoppen met VOLTAREN 50 mg als ze huiduitslag of koorts krijgen en neem zo snel mogelijk contact op met hun zorgverlener (zie WAARSCHUWINGEN ; Ernstige huidreacties ).
Vrouwelijke vruchtbaarheid
Adviseer vrouwen in de vruchtbare leeftijd die zwanger willen worden dat NSAID's, waaronder VOLTAREN 50 mg, in verband kunnen worden gebracht met een omkeerbare vertraging van de eisprong (zie PREVENTIEVE MAATREGELEN ; Carcinogenese, mutagenese, verminderde vruchtbaarheid ).
Foetale toxiciteit
Informeer zwangere vrouwen om het gebruik van VOLTAREN en andere NSAID's te vermijden vanaf 30 weken zwangerschap vanwege het risico op voortijdige sluiting van de foetale ductus arteriosus. Als behandeling met VOLTAREN nodig is voor een zwangere vrouw met een zwangerschapsduur van ongeveer 20 tot 30 weken, vertel haar dan dat ze mogelijk moet worden gecontroleerd op oligohydramnion als de behandeling langer dan 48 uur aanhoudt. (zien WAARSCHUWINGEN ; Foetale toxiciteit , PREVENTIEVE MAATREGELEN , Zwangerschap ).
Vermijd gelijktijdig gebruik van NSAID's
Informeer patiënten dat gelijktijdig gebruik van VOLTAREN 50 mg met andere NSAID's of salicylaten (bijv. diflunisal, salsalaat) niet wordt aanbevolen vanwege het verhoogde risico op gastro-intestinale toxiciteit en weinig of geen toename van de werkzaamheid (zie WAARSCHUWINGEN ; Maagbloeding , Ulceratie , en Perforatie en geneesmiddelinteracties ). Waarschuw patiënten dat NSAID's aanwezig kunnen zijn in vrij verkrijgbare medicijnen voor de behandeling van verkoudheid, koorts of slapeloosheid.
Gebruik van NSAID's en een lage dosis aspirine
Informeer patiënten om geen lage dosis aspirine gelijktijdig met VOLTAREN te gebruiken totdat ze met hun zorgverlener hebben gesproken (zie DRUG-INTERACTIES ).
Maskeren van ontsteking en koorts
De farmacologische activiteit van VOLTAREN bij het verminderen van ontstekingen, en mogelijk koorts, kan het nut van diagnostische symptomen bij het opsporen van infecties verminderen.
Laboratoriumbewaking
Omdat ernstige gastro-intestinale bloedingen, hepatotoxiciteit en nierbeschadiging kunnen optreden zonder waarschuwingssymptomen of tekenen, kunt u overwegen om patiënten die een langdurige NSAID-behandeling ondergaan, periodiek te controleren met een CBC en een chemieprofiel (zie WAARSCHUWINGEN ; Maagbloeding , Ulceratie en perforatie , en Hepatotoxiciteit ).
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Langdurige carcinogeniteitsstudies bij ratten die diclofenacnatrium kregen tot 2 mg/kg/dag (ongeveer 0,1 maal de maximaal aanbevolen dosis voor de mens (MRHD) van VOLTAREN 50 mg, 200 mg/dag, gebaseerd op een vergelijking van het lichaamsoppervlak (BSA)) hebben aangetoond dat geen significante toename van de incidentie van tumoren. Een 2-jarig carcinogeniteitsonderzoek uitgevoerd bij muizen die diclofenacnatrium gebruikten in doses tot 0,3 mg/kg/dag (ongeveer 0,007 keer de MRHD op basis van BSA-vergelijking) bij mannen en 1 mg/kg/dag (ongeveer 0,02 keer de MRHD op basis van BSA-vergelijking) bij vrouwen bracht geen oncogeen potentieel aan het licht.
Mutagenese
Diclofenacnatrium vertoonde geen mutagene activiteit in in vitro puntmutatietesten in zoogdier- (muizenlymfoom) en microbiële (gist, Ames) testsystemen en was niet-mutageen in verschillende in-vitro- en in-vivo-tests bij zoogdieren, waaronder dominante letale en mannelijke germinale chromosomale chromosomale onderzoeken in muizen, en kernafwijkingen en chromosomale aberratiestudies bij Chinese hamsters.
Aantasting van de vruchtbaarheid
Diclofenac-natrium toegediend aan mannelijke en vrouwelijke ratten in een dosering van 4 mg/kg/dag (ongeveer 0, 2 maal de MRHD op basis van BSA-vergelijking) had geen invloed op de vruchtbaarheid.
Op basis van het werkingsmechanisme kan het gebruik van door prostaglandine gemedieerde NSAID's, waaronder VOLTAREN 100 mg, het scheuren van de eierstokfollikels vertragen of voorkomen, wat bij sommige vrouwen in verband is gebracht met omkeerbare onvruchtbaarheid. Gepubliceerde dierstudies hebben aangetoond dat toediening van prostaglandinesyntheseremmers de potentie heeft om prostaglandine-gemedieerde folliculaire ruptuur die nodig is voor ovulatie te verstoren. Kleine studies bij vrouwen die werden behandeld met NSAID's hebben ook een omkeerbare vertraging van de eisprong aangetoond. Overweeg het stopzetten van NSAID's, inclusief VOLTAREN 100 mg, bij vrouwen die moeite hebben om zwanger te worden of die een onvruchtbaarheidsonderzoek ondergaan.
Zwangerschap
Risico Samenvatting
Het gebruik van NSAID's, waaronder VOLTAREN, kan voortijdige sluiting van de foetale ductus arteriosus en foetale nierdisfunctie veroorzaken, wat kan leiden tot oligohydramnion en, in sommige gevallen, neonatale nierfunctiestoornis. Vanwege deze risico's, beperk de dosis en de duur van het gebruik van VOLTAREN tussen ongeveer 20 en 30 weken zwangerschap, en vermijd het gebruik van VOLTAREN bij ongeveer 30 weken zwangerschap en later in de zwangerschap (zie WAARSCHUWINGEN ; Foetale toxiciteit ).
Voortijdige sluiting van foetale ductus arteriosus
Gebruik van NSAID's, waaronder VOLTAREN 100 mg, bij een zwangerschapsduur van ongeveer 30 weken of later in de zwangerschap verhoogt het risico op voortijdige sluiting van de foetale ductus arteriosus.
Oligohydramnion/neonatale nierinsufficiëntie
Het gebruik van NSAID's bij een zwangerschapsduur van ongeveer 20 weken of later in de zwangerschap is in verband gebracht met gevallen van foetale nierfunctiestoornis die leidt tot oligohydramnion en in sommige gevallen tot neonatale nierfunctiestoornis.
Er zijn geen adequate en goed gecontroleerde onderzoeken naar VOLTAREN 100 mg bij zwangere vrouwen.
Gegevens uit observationele onderzoeken met betrekking tot mogelijke embryofoetale risico's van NSAID-gebruik bij vrouwen in het eerste of tweede trimester van de zwangerschap zijn niet overtuigend.
In reproductiestudies bij dieren werd geen bewijs van teratogeniteit waargenomen bij muizen, ratten of konijnen die diclofenac kregen tijdens de periode van organogenese in doses tot respectievelijk ongeveer 0,5, 0,5 en 1 maal de maximaal aanbevolen dosis voor de mens (MRHD) van VOLTAREN , 200 mg/dag, ondanks de aanwezigheid van maternale en foetale toxiciteit bij deze doses (zie: Gegevens ).
Op basis van gepubliceerde diergegevens is aangetoond dat prostaglandinen een belangrijke rol spelen bij de vasculaire permeabiliteit van het endometrium, de implantatie van blastocysten en de decidualisatie. In dierstudies resulteerde toediening van prostaglandinesyntheseremmers, zoals diclofenac, in een verhoogd pre- en postimplantatieverlies. Van prostaglandinen is ook aangetoond dat ze een belangrijke rol spelen bij de ontwikkeling van de foetale nieren. In gepubliceerde dierstudies is gemeld dat remmers van de prostaglandinesynthese de nierontwikkeling schaden bij toediening in klinisch relevante doses.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie(s) is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Foetale/neonatale bijwerkingen
Voortijdige sluiting van foetale ductus arteriosus:
Vermijd het gebruik van NSAID's bij vrouwen bij een zwangerschapsduur van ongeveer 30 weken en later in de zwangerschap, omdat NSAID's, waaronder VOLTAREN, voortijdige sluiting van de foetale ductus arteriosus kunnen veroorzaken (zie WAARSCHUWINGEN ; Foetale toxiciteit ).
Oligohydramnion/neonatale nierfunctiestoornis:
Als een NSAID nodig is bij een zwangerschapsduur van ongeveer 20 weken of later in de zwangerschap, beperk het gebruik dan tot de laagst mogelijke effectieve dosis en de kortst mogelijke duur. Als de behandeling met VOLTAREN 50 mg langer duurt dan 48 uur, overweeg dan om te controleren met echografie op oligohydramnion. Als oligohydramnion optreedt, stop dan met VOLTAREN en volg de klinische praktijk op (zie: WAARSCHUWINGEN ; Foetale toxiciteit ).
Gegevens
Menselijke gegevens
Voortijdige sluiting van foetale ductus arteriosus:
Gepubliceerde literatuur meldt dat het gebruik van NSAID's bij een zwangerschapsduur van ongeveer 30 weken en later in de zwangerschap voortijdige sluiting van de foetale ductus arteriosus kan veroorzaken.
Oligohydramnion/neonatale nierfunctiestoornis:
Gepubliceerde onderzoeken en postmarketingrapporten beschrijven het gebruik van NSAID's door de moeder bij een zwangerschapsduur van ongeveer 20 weken of later in verband met foetale nierdisfunctie, leidend tot oligohydramnion en in sommige gevallen neonatale nierfunctiestoornis. Deze nadelige resultaten worden gemiddeld gezien na dagen tot weken behandeling, hoewel oligohydramnion zelden al 48 uur na het starten van NSAID's is gemeld. In veel gevallen, maar niet in alle, was de afname van het vruchtwater van voorbijgaande aard en reversibel na stopzetting van het medicijn. Er is een beperkt aantal gevallen gemeld van gebruik van NSAID's door de moeder en neonatale nierdisfunctie zonder oligohydramnion, waarvan sommige onomkeerbaar waren. Sommige gevallen van neonatale nierdisfunctie vereisten behandeling met invasieve procedures, zoals wisseltransfusie of dialyse.
Methodologische beperkingen van deze postmarketingonderzoeken en -rapporten omvatten het ontbreken van een controlegroep; beperkte informatie over dosis, duur en timing van blootstelling aan geneesmiddelen; en gelijktijdig gebruik van andere medicijnen. Deze beperkingen maken het niet mogelijk om een betrouwbare schatting te maken van het risico op nadelige foetale en neonatale uitkomsten bij gebruik van NSAID's door de moeder. Omdat de gepubliceerde veiligheidsgegevens over neonatale uitkomsten voornamelijk betrekking hadden op premature baby's, is de generaliseerbaarheid van bepaalde gerapporteerde risico's voor de voldragen baby die door gebruik door de moeder aan NSAID's is blootgesteld, onzeker.
Dierlijke gegevens
Voortplantings- en ontwikkelingsstudies bij dieren hebben aangetoond dat toediening van diclofenacnatrium tijdens de organogenese geen teratogeniteit veroorzaakte ondanks de inductie van maternale toxiciteit en foetale toxiciteit bij muizen bij orale doses tot 20 mg/kg/dag (ongeveer 0,5 maal de maximaal aanbevolen dosis voor de mens [MRHD] ] van VOLTAREN, 200 mg/dag, gebaseerd op vergelijking van het lichaamsoppervlak (BSA), en bij ratten en konijnen bij orale doses tot 10 mg/kg/dag (respectievelijk ongeveer 0,5 en 1 maal de MRHD op basis van BSA vergelijking). In een onderzoek waarbij drachtige ratten oraal 2 of 4 mg/kg diclofenac (0,1 en 0,2 maal de MRHD op basis van BSA) kregen toegediend vanaf dag 15 van de dracht tot dag van borstvoeding 21, werd significante maternale toxiciteit (peritonitis, mortaliteit) opgemerkt. Deze voor de moeder toxische doses waren geassocieerd met dystokie, verlengde zwangerschap, verminderd foetaal gewicht en groei, en verminderde overleving van de foetus. Van diclofenac is aangetoond dat het de placentabarrière passeert bij muizen, ratten en mensen.
Arbeid of levering
Er zijn geen onderzoeken naar de effecten van VOLTAREN tijdens de bevalling of bevalling. In dierstudies remmen NSAID's, waaronder diclofenac, de prostaglandinesynthese, veroorzaken ze een vertraagde bevalling en verhogen ze de incidentie van doodgeboorte.
Moeders die borstvoeding geven
Risico Samenvatting
Op basis van de beschikbare gegevens kan diclofenac aanwezig zijn in de moedermelk. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan VOLTAREN en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van de VOLTAREN 100 mg of van de onderliggende maternale aandoening.
Gegevens
Een vrouw die oraal werd behandeld met een diclofenaczout, 150 mg/dag, had een diclofenacspiegel in melk van 100 mcg/l, wat overeenkomt met een zuigelingendosis van ongeveer 0,03 mg/kg/dag. Diclofenac was niet aantoonbaar in moedermelk bij 12 vrouwen die diclofenac gebruikten (na ofwel 100 mg/dag oraal gedurende 7 dagen of een enkelvoudige intramusculaire dosis van 50 mg, toegediend in de periode onmiddellijk na de bevalling).
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Oudere patiënten lopen, vergeleken met jongere patiënten, een groter risico op NSAID-gerelateerde ernstige cardiovasculaire, gastro-intestinale en/of renale bijwerkingen. Als het verwachte voordeel voor de oudere patiënt opweegt tegen deze mogelijke risico's, begin dan met de dosering aan de lage kant van het doseringsbereik en controleer de patiënten op bijwerkingen (zie WAARSCHUWINGEN ; Cardiovasculaire trombotische gebeurtenissen , gastro-intestinaal Bloeding, ulceratie en perforatie, levertoxiciteit, niertoxiciteit en hyperkaliëmie, VOORZORGSMAATREGELEN; laboratoriumbewaking).
Van diclofenac is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op bijwerkingen van dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren (zie KLINISCHE FARMACOLOGIE , ONGEWENSTE REACTIES ).
OVERDOSERING
Geen informatie verstrekt
CONTRA-INDICATIES
VOLTAREN® is gecontra-indiceerd bij de volgende patiënten:
- Bekende overgevoeligheid (bijv. anafylactische reacties en ernstige huidreacties) voor diclofenac of voor een van de bestanddelen van het geneesmiddel (zie WAARSCHUWINGEN ; Anafylactische reacties , Ernstige huidreacties ).
- Voorgeschiedenis van astma, urticaria of andere allergische reacties na inname van aspirine of andere NSAID's. Ernstige, soms fatale, anafylactische reacties op NSAID's zijn gemeld bij dergelijke patiënten (zie: WAARSCHUWINGEN ; Anafylactische reactie , Exacerbatie van astma gerelateerd aan aspirinegevoeligheid ).
- In de setting van coronaire bypass-transplantaat (CABG) chirurgie (zie: WAARSCHUWINGEN ; Cardiovasculaire trombotische gebeurtenissen ).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Diclofenac heeft pijnstillende, ontstekingsremmende en koortswerende eigenschappen.
Het werkingsmechanisme van VOLTAREN 100 mg is, net als dat van andere NSAID's, niet volledig bekend, maar omvat remming van cyclo-oxygenase (COX-1 en COX-2).
Diclofenac is een krachtige remmer van de prostaglandinesynthese in vitro. Diclofenac-concentraties die tijdens de behandeling worden bereikt, hebben in vivo effecten veroorzaakt. Prostaglandinen sensibiliseren afferente zenuwen en versterken de werking van bradykinine bij het induceren van pijn in diermodellen. Prostaglandinen zijn mediatoren van ontstekingen. Omdat diclofenac een remmer is van de prostaglandinesynthese, kan het werkingsmechanisme het gevolg zijn van een afname van prostaglandinen in perifere weefsels.
Farmacokinetiek
Absorptie
Diclofenac wordt 100% geabsorbeerd na orale toediening vergeleken met intraveneuze (IV) toediening zoals gemeten aan de hand van urineterugwinning. Vanwege het first-pass-metabolisme is echter slechts ongeveer 50% van de geabsorbeerde dosis systemisch beschikbaar (zie tabel 1). Voedsel heeft geen significant effect op de mate van absorptie van diclofenac. Er is echter gewoonlijk een vertraging in het begin van de absorptie van 1 tot 4,5 uur en een verlaging van de piekplasmaspiegels van minder dan 20%.
Verdeling
Het schijnbare distributievolume (V/F) van diclofenacnatrium is 1,4 l/kg.
Diclofenac is voor meer dan 99% gebonden aan humane serumeiwitten, voornamelijk aan albumine. De serumeiwitbinding is constant over het concentratiebereik (0,15 tot 105 mcg/ml) dat wordt bereikt met de aanbevolen doses.
Diclofenac diffundeert in en uit de gewrichtsvloeistof. Diffusie in het gewricht vindt plaats wanneer de plasmaspiegels hoger zijn dan die in de gewrichtsvloeistof, waarna het proces omkeert en de gewrichtsvloeistofspiegels hoger zijn dan de plasmaspiegels. Het is niet bekend of diffusie in het gewricht een rol speelt bij de werkzaamheid van diclofenac.
Eliminatie
Metabolisme
Er zijn vijf diclofenacmetabolieten geïdentificeerd in humaan plasma en urine. De metabolieten omvatten 4'Âhydroxy-, 5-hydroxy-, 3'-hydroxy-, 4',5-dihydroxy- en 3'-hydroxy-4'-methoxy-diclofenac. De belangrijkste metaboliet van diclofenac, 4'-hydroxy-diclofenac, heeft een zeer zwakke farmacologische activiteit. De vorming van 4-hydroxydiclofenac wordt voornamelijk gemedieerd door CYP2C9. Zowel diclofenac als zijn oxidatieve metabolieten ondergaan glucuronidering of sulfatering gevolgd door uitscheiding via de gal. Acylglucuronidering gemedieerd door UGT2B7 en oxidatie gemedieerd door CYP2C8 kunnen ook een rol spelen bij het diclofenacmetabolisme. CYP3A4 is verantwoordelijk voor de vorming van minder belangrijke metabolieten, 5-hydroxy- en 3'-hydroxy-diclofenac. Bij patiënten met nierdisfunctie waren de piekconcentraties van de metabolieten 4'-hydroxy- en 5-hydroxy-diclofenac ongeveer 50% en 4% van de oorspronkelijke verbinding na een enkelvoudige orale dosering vergeleken met 27% en 1% bij normale gezonde proefpersonen.
uitscheiding
Diclofenac wordt geëlimineerd via metabolisme en daaropvolgende uitscheiding via de urine en de gal van het glucuronide en de sulfaatconjugaten van de metabolieten. Er wordt weinig of geen vrij onveranderd diclofenac uitgescheiden in de urine. Ongeveer 65% van de dosis wordt uitgescheiden in de urine en ongeveer 35% in de gal als conjugaten van onveranderd diclofenac plus metabolieten. Omdat eliminatie via de nieren geen significante eliminatieroute is voor onveranderd diclofenac, is een dosisaanpassing bij patiënten met lichte tot matige nierdisfunctie niet nodig. De terminale halfwaardetijd van onveranderd diclofenac is ongeveer 2 uur.
Speciale populaties
pediatrisch
De farmacokinetiek van VOLTAREN is niet onderzocht bij pediatrische patiënten.
Ras
Farmacokinetische verschillen als gevolg van ras zijn niet vastgesteld.
Leverfunctiestoornis
Het levermetabolisme is verantwoordelijk voor bijna 100% van de eliminatie van VOLTAREN 100 mg, dus patiënten met een leveraandoening kunnen lagere doses VOLTAREN 50 mg nodig hebben in vergelijking met patiënten met een normale leverfunctie.
Nierfunctiestoornis
De farmacokinetiek van diclofenac is onderzocht bij personen met nierinsufficiëntie. Er zijn geen verschillen in de farmacokinetiek van diclofenac gevonden in onderzoeken bij patiënten met nierinsufficiëntie. Bij patiënten met nierinsufficiëntie (inulineklaring 60 tot 90, 30 tot 60 en minder dan 30 ml/min; N = 6 in elke groep), waren de AUC-waarden en eliminatiesnelheid vergelijkbaar met die bij gezonde proefpersonen. .
Onderzoek naar geneesmiddelinteracties
Voriconazol
Bij gelijktijdige toediening met voriconazol (remmer van het CYP2C9-, 2C19- en 3A4-enzym), namen de Cmax en AUC van diclofenac toe met respectievelijk 114% en 78% (zie DRUG-INTERACTIES ).
Aspirine
Wanneer NSAID's werden toegediend met aspirine, was de eiwitbinding van NSAID's verminderd, hoewel de klaring van vrije NSAID's niet veranderde. De klinische betekenis van deze interactie is niet bekend. Zie tabel 2 voor klinisch significante geneesmiddelinteracties van NSAID's met aspirine (zie: DRUG-INTERACTIES ).
PATIËNT INFORMATIE
Medicatiegids
VOLTAREN® (Vowl-tar-uhn) (diclofenac-natrium) omhulde tabletten
Wat is de belangrijkste informatie die ik moet weten over geneesmiddelen die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd?
NSAID's kunnen ernstige bijwerkingen veroorzaken, waaronder:
- Verhoogd risico op een hartaanval of beroerte die tot de dood kan leiden. Dit risico kan vroeg in de behandeling optreden en kan toenemen:
- met toenemende doses NSAID's
- bij langer gebruik van NSAID's
Gebruik geen NSAID's vlak voor of na een hartoperatie die een "coronaire bypass-transplantaat (CABG)" wordt genoemd. Vermijd het gebruik van NSAID's na een recente hartaanval, tenzij uw zorgverlener u dat zegt. U heeft mogelijk een verhoogd risico op een nieuwe hartaanval als u NSAID's gebruikt na een recente hartaanval.
- Verhoogd risico op bloedingen, zweren en tranen (perforatie) van de slokdarm (buis die van de mond naar de maag loopt), maag en darmen:
- elk moment tijdens gebruik
- zonder waarschuwingssymptomen
- dat kan de dood veroorzaken
Het risico op het krijgen van een maagzweer of bloeding neemt toe met:
- voorgeschiedenis van maagzweren, of maag- of darmbloedingen bij gebruik van NSAID's
- geneesmiddelen gebruiken die "corticosteroïden", "anticoagulantia", "SSRI's" of "SNRI's" worden genoemd
- toenemende doses NSAID's
- langer gebruik van NSAID's
- roken
- alcohol drinken
- oudere leeftijd
- slechte gezondheid
- gevorderde leverziekte
- bloedingsproblemen
NSAID's mogen alleen worden gebruikt:
- precies zoals voorgeschreven
- in de laagst mogelijke dosis voor uw behandeling
- voor de kortst benodigde tijd
Wat zijn NSAID's?
NSAID's worden gebruikt voor de behandeling van pijn en roodheid, zwelling en hitte (ontsteking) door medische aandoeningen, zoals verschillende soorten artritis, menstruatiekrampen en andere soorten kortdurende pijn.
Wie mag geen NSAID's gebruiken?
Gebruik geen NSAID's:
- als u een astma-aanval, netelroos of een andere allergische reactie heeft gehad met aspirine of andere NSAID's.
- vlak voor of na een bypassoperatie van het hart.
Vertel uw zorgverlener voordat u NSAID's gebruikt over al uw medische aandoeningen, ook als u:
- lever- of nierproblemen heeft
- hoge bloeddruk hebben
- astma hebben
- zwanger bent of van plan bent zwanger te worden. Het gebruik van NSAID's na ongeveer 20 weken zwangerschap of later kan schadelijk zijn voor uw ongeboren baby. Als u gedurende meer dan 2 dagen NSAID's moet gebruiken wanneer u tussen de 20 en 30 weken zwanger bent, moet uw zorgverlener mogelijk de hoeveelheid vocht in uw baarmoeder rond uw baby controleren. Na ongeveer 30 weken zwangerschap mag u geen NSAID's meer gebruiken.
- borstvoeding geeft of van plan bent borstvoeding te geven.
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept of vrij verkrijgbare medicijnen, vitamines of kruidensupplementen. NSAID's en sommige andere geneesmiddelen kunnen met elkaar interageren en ernstige bijwerkingen veroorzaken. Begin niet met het innemen van een nieuw geneesmiddel zonder eerst met uw zorgverlener te overleggen.
Wat zijn de mogelijke bijwerkingen van NSAID's?
NSAID's kunnen ernstige bijwerkingen veroorzaken, waaronder:
Zie "Wat is de belangrijkste informatie die ik moet weten over geneesmiddelen die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd)?"
- nieuwe of ergere hoge bloeddruk
- hartfalen
- leverproblemen, waaronder leverfalen
- nierproblemen, waaronder nierfalen
- lage rode bloedcellen (bloedarmoede)
- levensbedreigende huidreacties
- levensbedreigende allergische reacties
- Andere bijwerkingen van NSAID's zijn onder meer: maagpijn, constipatie, diarree, gas, brandend maagzuur, misselijkheid, braken, duizeligheid
Schakel onmiddellijk noodhulp in als u een van de volgende symptomen heeft:
- kortademigheid of moeite met ademhalen
- pijn op de borst
- zwakte in een deel of zijkant van uw lichaam
- onduidelijke spraak
- zwelling van het gezicht of de keel
Stop met het gebruik van uw NSAID en bel onmiddellijk uw zorgverlener als u een van de volgende symptomen krijgt:
- misselijkheid
- bloed overgeven
- vermoeider of zwakker dan normaal
- diarree
- jeuk
- er zit bloed in uw stoelgang of het is zwart en plakkerig als teer
- je huid of ogen zien er geel uit
- indigestie of maagpijn
- griepachtige symptomen
- ongebruikelijke gewichtstoename
- huiduitslag of blaren met koorts
- zwelling van de armen en benen, handen en voeten
Als u te veel van uw NSAID heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of roep medische hulp in.
Dit zijn niet alle mogelijke bijwerkingen van NSAID's. Vraag uw zorgverlener of apotheker om meer informatie over NSAID's. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA1088
Overige informatie over NSAID's.
- Aspirine is een NSAID-medicijn, maar het verhoogt de kans op een hartaanval niet. Aspirine kan bloedingen in de hersenen, maag en darmen veroorzaken. Aspirine kan ook zweren in de maag en darmen veroorzaken.
- Sommige NSAID's worden zonder recept in lagere doses verkocht (zonder recept verkrijgbaar). Praat met uw zorgverlener voordat u vrij verkrijgbare NSAID's langer dan 10 dagen gebruikt.
Algemene informatie over het veilige en effectieve gebruik van NSAID's.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik NSAID's niet voor een aandoening waarvoor het niet is voorgeschreven. Geef geen NSAID's aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Als u meer informatie wilt over NSAID's, neem dan contact op met uw zorgverlener. U kunt uw apotheker of zorgverlener om informatie vragen over NSAID's die zijn geschreven voor gezondheidswerkers.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration. Herzien: april 2021
