Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Neurontin en hoe wordt het gebruikt?
Neurontin 400 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van zenuwpijn en toevallen te behandelen. Neurontin kan alleen of in combinatie met andere medicijnen worden gebruikt.
Neurontin is een GABA-analoog, anti-epilepticum.
Het is niet bekend of Neurontin veilig en effectief is bij kinderen jonger dan 3 jaar.
Wat zijn de mogelijke bijwerkingen van Neurontin 400 mg?
Neurontin kan ernstige bijwerkingen veroorzaken, waaronder:
- verhoogde aanvallen
- ernstige zwakte of vermoeidheid
- problemen met evenwicht of spierbeweging
- pijn in de bovenbuik
- pijn op de borst
- nieuwe of verergerende hoest met koorts
- moeite met ademhalen
- ernstige tintelingen of gevoelloosheid
- snelle oog beweging
- weinig of geen plassen
- pijnlijk of moeilijk plassen
- zwelling in uw voeten of enkels
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Neurontin zijn:
- hoofdpijn
- duizeligheid
- slaperigheid
- vermoeidheid
- zwelling in uw handen of voeten
- problemen met uw ogen
- coördinatieproblemen
- De meest voorkomende bijwerkingen van Neurontin 600 mg bij kinderen zijn:
- koorts
- misselijkheid
- braken
- gedragsveranderingen
- geheugenproblemen
- moeite met concentreren
- rusteloos, vijandig of agressief handelen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Neurontin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Het werkzame bestanddeel in NEURONTIN-capsules, -tabletten en -drank is gabapentine, dat de chemische naam 1-(aminomethyl)cyclohexaanazijnzuur heeft.
De molecuulformule van gabapentine is C9H17NO2 en het molecuulgewicht is 171,24. De structuurformule van gabapentine is:
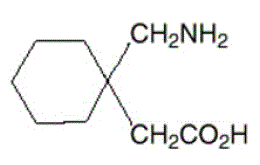
Gabapentine is een witte tot gebroken witte kristallijne vaste stof met een pKa1 van 3,7 en een pKa2 van 10,7. Het is vrij oplosbaar in water en zowel basische als zure waterige oplossingen. De logaritme van de verdelingscoëfficiënt (noctanol/0,05M fosfaatbuffer) bij pH 7,4 is –1,25.
Elke capsule van 100 mg Neurontin bevat 100 mg, 300 mg of 400 mg gabapentine en de volgende inactieve ingrediënten: lactose, maïszetmeel, talk, gelatine, titaniumdioxide, FD&C Blue No. 2, geel ijzeroxide (alleen 300 mg en 400 mg) , en rood ijzeroxide (alleen 400 mg).
Elke Neurontin-tablet bevat 600 mg of 800 mg gabapentine en de volgende inactieve ingrediënten: poloxameer 407, copovidon, maïszetmeel, magnesiumstearaat, hydroxypropylcellulose, talk en candelillawas
Neurontin drank bevat 250 mg gabapentine per 5 ml (50 mg per ml) en de volgende inactieve ingrediënten: glycerine, xylitol, gezuiverd water en kunstmatige, koele aardbei-anijssmaak.
INDICATIES
NEURONTIN® is geïndiceerd voor:
- Beheer van postherpetische neuralgie bij volwassenen
- Adjuvante therapie bij de behandeling van aanvallen met partieel begin, met en zonder secundaire generalisatie, bij volwassenen en pediatrische patiënten van 3 jaar en ouder met epilepsie
DOSERING EN ADMINISTRATIE
Dosering voor postherpetische neuralgie
Bij volwassenen met postherpetische neuralgie kan NEURONTIN op dag 1 worden gestart als een enkele dosis van 300 mg, op dag 2 als 600 mg/dag (300 mg tweemaal daags) en op dag 3 als 900 mg/dag (300 mg driemaal daags). keer per dag). De dosis kan vervolgens naar behoefte worden verhoogd voor pijnverlichting tot een dosis van 1800 mg/dag (600 mg driemaal daags). In klinische onderzoeken werd de werkzaamheid aangetoond over een reeks doses van 1800 mg/dag tot 3600 mg/dag met vergelijkbare effecten over het hele dosisbereik; in deze klinische onderzoeken werd het extra voordeel van het gebruik van doses hoger dan 1800 mg/dag echter niet aangetoond.
Dosering voor epilepsie met gedeeltelijk beginnende aanvallen
Patiënten van 12 jaar en ouder
De startdosering is driemaal daags 300 mg. De aanbevolen onderhoudsdosering van NEURONTIN is driemaal daags 300 mg tot 600 mg. Doseringen tot 2400 mg/dag werden goed verdragen in langdurige klinische onderzoeken. Doses van 3600 mg/dag zijn ook toegediend aan een klein aantal patiënten voor een relatief korte duur en werden goed verdragen. Dien NEURONTIN driemaal daags toe met capsules van 300 mg of 400 mg, of tabletten van 600 mg of 800 mg. De maximale tijd tussen doses mag niet langer zijn dan 12 uur.
Pediatrische patiënten van 3 tot 11 jaar
Het aanvangsdosisbereik is 10 mg/kg/dag tot 15 mg/kg/dag, verdeeld over drie doses, en de aanbevolen onderhoudsdosis wordt bereikt door opwaartse titratie over een periode van ongeveer 3 dagen. De aanbevolen onderhoudsdosering van NEURONTIN bij patiënten van 3 tot 4 jaar is 40 mg/kg/dag, verdeeld over drie doses. De aanbevolen onderhoudsdosering van NEURONTIN 100 mg bij patiënten van 5 tot 11 jaar is 25 mg/kg/dag tot 35 mg/kg/dag, verdeeld over drie doses. NEURONTIN 300 mg kan worden toegediend als de drank, capsule of tablet, of door combinaties van deze formuleringen te gebruiken. Doseringen tot 50 mg/kg/dag werden goed verdragen in een langdurig klinisch onderzoek. Het maximale tijdsinterval tussen doses mag niet langer zijn dan 12 uur.
Dosisaanpassing bij patiënten met nierinsufficiëntie
Aanpassing van de dosering bij patiënten van 12 jaar en ouder met een nierfunctiestoornis of die hemodialyse ondergaan, wordt als volgt aanbevolen (zie bovenstaande doseringsaanbevelingen voor effectieve doses bij elke indicatie):
TABEL 1: NEURONTIN-dosering op basis van de nierfunctie
Creatinineklaring (CLCr) is moeilijk te meten bij poliklinische patiënten. Bij patiënten met een stabiele nierfunctie kan de creatinineklaring redelijk goed worden geschat met behulp van de vergelijking van Cockcroft en Gault:
Het gebruik van NEURONTIN bij patiënten jonger dan 12 jaar met een verminderde nierfunctie is niet onderzocht.
Dosering bij ouderen
Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij de keuze van de dosis en moet de dosis worden aangepast op basis van de creatinineklaringswaarden bij deze patiënten.
Administratie Informatie
Dien NEURONTIN oraal toe met of zonder voedsel.
NEURONTIN 100 mg capsules moeten heel worden doorgeslikt met water.
Informeer patiënten dat, als ze de breukstreep van 600 mg of 800 mg NEURONTIN tablet verdelen om een halve tablet toe te dienen, ze de ongebruikte halve tablet als de volgende dosis moeten innemen. Halve tabletten die niet binnen 28 dagen na het verdelen van de tablet met breukstreep zijn gebruikt, moeten worden weggegooid.
Als de dosis NEURONTIN wordt verlaagd, stopgezet of vervangen door een ander medicijn, moet dit geleidelijk gebeuren over een periode van minimaal 1 week (naar goeddunken van de voorschrijver kan een langere periode nodig zijn).
HOE GELEVERD
Doseringsvormen en sterke punten
Capsules
- 100 mg: witte harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/100 mg” op de dop
- 300 mg: gele harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/300 mg” op de dop
- 400 mg: oranje harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/400 mg” op de dop
Tabletten
- 600 mg: witte elliptische filmomhulde tabletten met breukgleuf met aan één kant de inscriptie “NT” en “16”
- 800 mg: witte elliptische filmomhulde tabletten met breukgleuf met aan één kant de inscriptie “NT” en “26”
Orale oplossing
- 250 mg per 5 ml (50 mg per ml), heldere kleurloze tot lichtgele oplossing
Opslag en behandeling
NEURONTIN (gabapentine) capsules, tabletten en drank worden als volgt geleverd:
100 mg-capsules
Witte harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/100 mg” op de dop; beschikbaar in:
Flessen van 100: NDC 0071-0803-24
300 mg-capsules
Gele harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/300 mg” op de dop; beschikbaar in:
Flessen van 100: NDC 0071-0805-24 Eenheidsdosis 50's: NDC 0071-0805-40
400 mg-capsules
Oranje harde gelatinecapsules bedrukt met “PD” op de romp en “Neurontin/400 mg” op de dop; beschikbaar in:
Flessen van 100: NDC 0071-0806-24 Eenheidsdosis 50's: NDC 0071-0806-40
600 mg tabletten
Witte elliptische filmomhulde tabletten met breukgleuf met de inscriptie "NT" en "16" aan één zijde; beschikbaar in:
Flessen van 100: NDC 0071-0513-24
800 mg-tabletten
Witte elliptische filmomhulde tabletten met breukgleuf met de inscriptie "NT" en "26" aan één zijde; beschikbaar in:
Flessen van 100: NDC 0071-0401-24
250 mg per 5 ml orale oplossing
Heldere kleurloze tot lichtgele oplossing; elke 5 ml drank bevat 250 mg gabapentine; beschikbaar in:
Glazen flessen met 470 ml: NDC 0071-2012-23 Flessen met 470 ml: NDC 0071-2012-44
Bewaar NEURONTIN 400 mg tabletten en capsules bij 25 ° C (77 ° F); excursies toegestaan tussen 15°C en 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Bewaar NEURONTIN orale oplossing gekoeld, 2 ° C tot 8 ° C (36 ° F tot 46 ° F).
Gedistribueerd door: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Herzien: december 2020
BIJWERKINGEN
De volgende ernstige bijwerkingen worden in andere rubrieken in meer detail besproken:
- Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) / overgevoeligheid voor meerdere organen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Anafylaxie en angio-oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Slaperigheid/sedatie en duizeligheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ontwenning Versnelde aanval, status Epilepticus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Suïcidaal gedrag en ideatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ademhalingsdepressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Neuropsychiatrische bijwerkingen (pediatrische patiënten van 3 tot 12 jaar) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Plotselinge en onverklaarbare dood bij patiënten met epilepsie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Postherpetische neuralgie
De meest voorkomende bijwerkingen die verband hielden met het gebruik van NEURONTIN bij volwassenen, die niet met een equivalente frequentie werden gezien bij met placebo behandelde patiënten, waren duizeligheid, slaperigheid en perifeer oedeem.
In de 2 gecontroleerde onderzoeken naar postherpetische neuralgie stopte 16% van de 336 patiënten die NEURONTIN kregen en 9% van de 227 patiënten die placebo kregen de behandeling vanwege een bijwerking. De bijwerkingen die het vaakst tot ontwenning leidden bij met NEURONTIN behandelde patiënten waren duizeligheid, slaperigheid en misselijkheid.
Tabel 3 geeft een overzicht van bijwerkingen die voorkwamen bij ten minste 1% van de met NEURONTIN behandelde patiënten met postherpetische neuralgie die deelnamen aan placebogecontroleerde onderzoeken en die numeriek vaker voorkwamen in de NEURONTIN-groep dan in de placebogroep.
TABEL 3: Bijwerkingen in gepoolde placebo-gecontroleerde onderzoeken bij postherpetische neuralgie
Andere reacties bij meer dan 1% van de patiënten, maar even vaak of vaker in de placebogroep, waren pijn, tremor, neuralgie, rugpijn, dyspepsie, dyspneu en griepsyndroom.
Er waren geen klinisch belangrijke verschillen tussen mannen en vrouwen in de soorten en incidentie van bijwerkingen. Omdat er maar weinig patiënten waren van wie het ras als ander dan blank werd gemeld, zijn er onvoldoende gegevens om een uitspraak te doen over de verdeling van bijwerkingen naar ras.
Epilepsie met gedeeltelijk beginnende aanvallen (adjuvante therapie)
De meest voorkomende bijwerkingen met NEURONTIN 300 mg in combinatie met andere anti-epileptica bij patiënten >12 jaar, die niet met een vergelijkbare frequentie werden gezien bij met placebo behandelde patiënten, waren slaperigheid, duizeligheid, ataxie, vermoeidheid en nystagmus.
De meest voorkomende bijwerkingen van NEURONTIN in combinatie met andere anti-epileptica bij pediatrische patiënten van 3 tot 12 jaar, die niet met dezelfde frequentie werden gezien bij met placebo behandelde patiënten, waren virale infectie, koorts, misselijkheid en/of braken, slaperigheid en vijandigheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ongeveer 7% van de 2074 patiënten >12 jaar en ongeveer 7% van de 449 pediatrische patiënten van 3 tot 12 jaar die NEURONTIN kregen in klinische premarketingonderzoeken stopten met de behandeling vanwege een bijwerking. De bijwerkingen die het vaakst werden geassocieerd met ontwenning bij patiënten >12 jaar waren slaperigheid (1,2%), ataxie (0,8%), vermoeidheid (0,6%), misselijkheid en/of braken (0,6%) en duizeligheid (0,6%) . De bijwerkingen die het vaakst werden geassocieerd met ontwenning bij pediatrische patiënten waren emotionele labiliteit (1,6%), vijandigheid (1,3%) en hyperkinesie (1,1%).
Tabel 4 geeft de bijwerkingen weer die voorkwamen bij ten minste 1% van de met NEURONTIN behandelde patiënten >12 jaar met epilepsie die deelnamen aan placebogecontroleerde onderzoeken en die numeriek vaker voorkwamen in de NEURONTIN-groep. In deze onderzoeken werd NEURONTIN 300 mg of placebo toegevoegd aan de huidige anti-epileptische medicamenteuze behandeling van de patiënt.
TABEL 4: Bijwerkingen in gepoolde placebo-gecontroleerde add-on onderzoeken bij epilepsiepatiënten >12 jaar
Van de bijwerkingen die optraden met een incidentie van ten minste 10% bij met NEURONTIN behandelde patiënten, leken slaperigheid en ataxie een positieve dosis-responsrelatie te vertonen.
De totale incidentie van bijwerkingen en de soorten waargenomen bijwerkingen waren vergelijkbaar bij mannen en vrouwen die met NEURONTIN werden behandeld. De incidentie van bijwerkingen nam licht toe met toenemende leeftijd bij patiënten die werden behandeld met NEURONTIN of placebo. Omdat slechts 3% van de patiënten (28/921) in placebogecontroleerde onderzoeken als niet-blanke (zwarte of andere) werd geïdentificeerd, zijn er onvoldoende gegevens om een uitspraak te ondersteunen over de verdeling van bijwerkingen per ras.
Tabel 5 geeft de bijwerkingen weer die voorkwamen bij ten minste 2% van de met NEURONTIN behandelde patiënten in de leeftijd van 3 tot 12 jaar met epilepsie die deelnamen aan placebogecontroleerde onderzoeken, en die numeriek vaker voorkwamen in de NEURONTIN-groep.
TABEL 5: Bijwerkingen in een placebogecontroleerde aanvullende studie bij pediatrische epilepsiepatiënten in de leeftijd van 3 tot 12 jaar
Andere reacties bij meer dan 2% van de pediatrische patiënten van 3 tot 12 jaar, maar even vaak of frequenter in de placebogroep, waren: faryngitis, infectie van de bovenste luchtwegen, hoofdpijn, rhinitis, convulsies, diarree, anorexia, hoesten en middenoorontsteking.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens postmarketinggebruik van NEURONTIN. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lever- en galaandoeningen: geelzucht
onderzoeken: verhoogde creatinekinase, verhoogde leverfunctietesten
Metabolisme en voedingsstoornissen: hyponatriëmie
Skeletspierstelsel- en bindweefselaandoening: rabdomyolyse
Zenuwstelselaandoeningen: bewegingsstoornis
Psychische stoornissen: agitatie
Voortplantingsstelsel- en borstaandoeningen: borstvergroting, veranderingen in libido, ejaculatiestoornissen en anorgasmie
Huid- en onderhuidaandoeningen: angio-oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], bulleus pemfigoïd, erythema multiforme, Stevens-Johnson-syndroom.
Er zijn postmarketingmeldingen van levensbedreigende of fatale ademhalingsdepressie bij patiënten die NEURONTIN gebruiken met opioïden of andere CZS-depressiva, of in de setting van een onderliggende ademhalingsstoornis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bijwerkingen na abrupt stoppen met gabapentine zijn ook gemeld. De meest gemelde reacties waren angst, slapeloosheid, misselijkheid, pijn en zweten.
DRUG-INTERACTIES
opioïden
Ademhalingsdepressie en sedatie, soms met de dood tot gevolg, zijn gemeld na gelijktijdige toediening van gabapentine met opioïden (bijv. morfine, hydrocodon, oxycodon, buprenorfine) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hydrocodon
Gelijktijdige toediening van NEURONTIN 300 mg met hydrocodon vermindert de blootstelling aan hydrocodon [zie: KLINISCHE FARMACOLOGIE ]. De mogelijkheid van verandering in blootstelling en effect aan hydrocodon moet worden overwogen wanneer NEURONTIN 100 mg wordt gestart of stopgezet bij een patiënt die hydrocodon gebruikt.
Morfine
Wanneer gabapentine wordt toegediend met morfine, moeten patiënten worden geobserveerd op tekenen van depressie van het CZS, zoals slaperigheid, sedatie en ademhalingsdepressie [zie KLINISCHE FARMACOLOGIE ].
Andere anti-epileptica
Gabapentine wordt niet merkbaar gemetaboliseerd en interfereert ook niet met het metabolisme van vaak gelijktijdig toegediende anti-epileptica [zie KLINISCHE FARMACOLOGIE ].
Maalox® (aluminiumhydroxide, magnesiumhydroxide)
De gemiddelde biologische beschikbaarheid van gabapentine werd met ongeveer 20% verminderd bij gelijktijdig gebruik van een antacidum (Maalox) dat magnesium- en aluminiumhydroxide bevat. Het wordt aanbevolen om gabapentine ten minste 2 uur na toediening van Maalox in te nemen [zie: KLINISCHE FARMACOLOGIE ].
Geneesmiddel-/laboratoriumtestinteracties
Omdat bij de Ames N-Multistix SG-peilstoktest voor urine-eiwit fout-positieve metingen werden gerapporteerd wanneer gabapentine aan andere anti-epileptica werd toegevoegd, wordt de meer specifieke precipitatieprocedure met sulfosalicylzuur aanbevolen om de aanwezigheid van urine-eiwit te bepalen.
Drugsmisbruik en afhankelijkheid
Gecontroleerde stof
Gabapentine is geen gepland medicijn.
Misbruik
Misbruik is het opzettelijk, niet-therapeutisch gebruik van een medicijn, zelfs maar één keer, vanwege de gewenste psychologische of fysiologische effecten. Misbruik is het opzettelijk gebruik, voor therapeutische doeleinden, van een geneesmiddel door een persoon op een andere manier dan voorgeschreven door een zorgverlener of voor wie het niet is voorgeschreven.
Gabapentine vertoont geen affiniteit voor benzodiazepine-, opioïde (mu, delta of kappa) of cannabinoïde 1-receptorplaatsen. Misbruik en misbruik van gabapentine zijn gemeld in de postmarketingsetting en gepubliceerde literatuur. De meeste personen die in deze rapporten worden beschreven, hadden een voorgeschiedenis van polydrugsmisbruik. Sommige van deze personen gebruikten hogere dan aanbevolen doses gabapentine voor niet-goedgekeurd gebruik. Wanneer u NEURONTIN voorschrijft, moet u patiënten zorgvuldig evalueren op een voorgeschiedenis van drugsmisbruik en hen observeren op tekenen en symptomen van misbruik of misbruik van gabapentine (bijv. verhoging van de eigen dosis en gedrag bij het zoeken naar drugs). Het misbruikpotentieel van gabapentine is niet geëvalueerd in studies bij mensen.
Afhankelijkheid
Lichamelijke afhankelijkheid is een toestand die zich ontwikkelt als gevolg van fysiologische aanpassing als reactie op herhaald medicijngebruik, die zich manifesteert door ontwenningsverschijnselen en -symptomen na abrupt stoppen of een significante dosisverlaging van een medicijn. Er zijn zeldzame postmarketingmeldingen van personen die ontwenningsverschijnselen ervaren kort na het staken van de dosering van gabapentine die hoger is dan de aanbevolen dosering voor de behandeling van ziekten waarvoor het geneesmiddel niet is goedgekeurd. Dergelijke symptomen waren onder meer agitatie, desoriëntatie en verwardheid na plotseling stoppen met gabapentine, die verdwenen na het hervatten van gabapentine. Het afhankelijkheidspotentieel van gabapentine is niet geëvalueerd in studies bij mensen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS)/overgevoeligheid voor meerdere organen
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS), ook bekend als overgevoeligheid voor meerdere organen, is opgetreden met NEURONTIN. Sommige van deze reacties waren fataal of levensbedreigend. DRESS presenteert zich doorgaans, hoewel niet uitsluitend, met koorts, huiduitslag en/of lymfadenopathie, in combinatie met andere orgaansystemen, zoals hepatitis, nefritis, hematologische afwijkingen, myocarditis of myositis die soms lijkt op een acute virale infectie. Eosinofilie is vaak aanwezig. Deze aandoening is variabel in zijn expressie, en andere orgaansystemen die hier niet zijn vermeld, kunnen hierbij betrokken zijn.
Het is belangrijk op te merken dat vroege manifestaties van overgevoeligheid, zoals koorts of lymfadenopathie, aanwezig kunnen zijn, ook al is huiduitslag niet duidelijk. Als dergelijke tekenen of symptomen aanwezig zijn, moet de patiënt onmiddellijk worden geëvalueerd. NEURONTIN moet worden stopgezet als er geen alternatieve etiologie voor de tekenen of symptomen kan worden vastgesteld.
Anafylaxie en angio-oedeem
NEURONTIN kan anafylaxie en angio-oedeem veroorzaken na de eerste dosis of op elk moment tijdens de behandeling. Tekenen en symptomen in gemelde gevallen waren onder meer ademhalingsmoeilijkheden, zwelling van de lippen, keel en tong en hypotensie die een spoedbehandeling vereist. Patiënten moeten worden geïnstrueerd om te stoppen met NEURONTIN 300 mg en onmiddellijk medische hulp in te roepen als ze tekenen of symptomen van anafylaxie of angio-oedeem krijgen.
Effecten op het rijden en bedienen van zware machines
Patiënten die NEURONTIN gebruiken, mogen niet autorijden totdat ze voldoende ervaring hebben opgedaan om te beoordelen of NEURONTIN 100 mg hun rijvaardigheid beïnvloedt. Rijvaardigheidsonderzoeken uitgevoerd met een prodrug van gabapentine (gabapentine enacarbil tablet, verlengde afgifte) geven aan dat gabapentine een significante rijstoornis kan veroorzaken. Voorschrijvers en patiënten moeten zich ervan bewust zijn dat patiënten' het vermogen om hun eigen rijvaardigheid te beoordelen, evenals hun vermogen om de mate van slaperigheid veroorzaakt door NEURONTIN te beoordelen, kan onvolmaakt zijn. De duur van de rijstoornis na het starten van de behandeling met NEURONTIN 300 mg is niet bekend. Of de beperking verband houdt met slaperigheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] of andere effecten van NEURONTIN is niet bekend.
Bovendien, omdat NEURONTIN 300 mg slaperigheid en duizeligheid veroorzaakt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], moeten patiënten worden geadviseerd geen complexe machines te bedienen totdat ze voldoende ervaring hebben opgedaan met NEURONTIN om te beoordelen of NEURONTIN 300 mg hun vermogen om dergelijke taken uit te voeren schaadt.
Slaperigheid/sedatie en duizeligheid
Tijdens de gecontroleerde epilepsieonderzoeken bij patiënten ouder dan 12 jaar die doses NEURONTIN 100 mg tot 1800 mg per dag kregen, werden slaperigheid, duizeligheid en ataxie vaker gemeld bij patiënten die NEURONTIN kregen in vergelijking met placebo: dwz 19% in versus 9% bij placebo voor slaperigheid, 17% bij geneesmiddel versus 7% bij placebo voor duizeligheid en 13% bij geneesmiddel versus 6% bij placebo voor ataxie. In deze onderzoeken waren slaperigheid, ataxie en vermoeidheid vaak voorkomende bijwerkingen die leidden tot stopzetting van NEURONTIN bij patiënten ouder dan 12 jaar, waarbij respectievelijk 1,2%, 0,8% en 0,6% stopten voor deze voorvallen.
Tijdens de gecontroleerde onderzoeken bij patiënten met postherpetische neuralgie werden slaperigheid en duizeligheid vaker gemeld dan bij placebo bij patiënten die NEURONTIN kregen, in doseringen tot 3600 mg per dag: dwz 21% bij met NEURONTIN behandelde patiënten versus 5 % bij met placebo behandelde patiënten voor slaperigheid en 28% bij met NEURONTIN behandelde patiënten versus 8% bij met placebo behandelde patiënten voor duizeligheid. Duizeligheid en slaperigheid behoorden tot de meest voorkomende bijwerkingen die leidden tot stopzetting van NEURONTIN.
Patiënten moeten zorgvuldig worden geobserveerd op tekenen van depressie van het centrale zenuwstelsel (CZS), zoals slaperigheid en sedatie, wanneer NEURONTIN 400 mg wordt gebruikt met andere geneesmiddelen met sedatieve eigenschappen vanwege mogelijke synergie. Bovendien kunnen patiënten die gelijktijdige behandeling met morfine nodig hebben, verhogingen van de gabapentineconcentraties ervaren en kunnen dosisaanpassingen nodig zijn [zie DRUG-INTERACTIES ].
Ontwenning Versnelde aanval, status epilepticus
Anti-epileptica mogen niet abrupt worden gestaakt vanwege de mogelijkheid om de frequentie van aanvallen te verhogen.
In de placebogecontroleerde epilepsiestudies bij patiënten >12 jaar was de incidentie van status epilepticus bij patiënten die NEURONTIN kregen 0,6% (3 van 543) versus 0,5% bij patiënten die placebo kregen (2 van 378). Van de 2074 patiënten >12 jaar die werden behandeld met NEURONTIN 300 mg in alle epilepsieonderzoeken (gecontroleerd en niet-gecontroleerd), hadden 31 (1,5%) status epilepticus. Hiervan hadden 14 patiënten geen voorgeschiedenis van status epilepticus, noch vóór de behandeling, noch tijdens het gebruik van andere medicijnen. Omdat er geen adequate historische gegevens beschikbaar zijn, is het onmogelijk om te zeggen of behandeling met NEURONTIN al dan niet gepaard gaat met een hoger of lager percentage status epilepticus dan zou worden verwacht bij een vergelijkbare populatie die niet met NEURONTIN wordt behandeld.
Suïcidaal gedrag en ideeën
Anti-epileptica (AED's), waaronder NEURONTIN 100 mg, verhogen het risico op zelfmoordgedachten of zelfmoordgedrag bij patiënten die deze geneesmiddelen voor welke indicatie dan ook gebruiken. Patiënten die voor welke indicatie dan ook met een AED worden behandeld, moeten worden gecontroleerd op het optreden of verergeren van depressie, zelfmoordgedachten of -gedrag en/of ongewone veranderingen in stemming of gedrag.
Gepoolde analyses van 199 placebogecontroleerde klinische onderzoeken (mono- en aanvullende therapie) van 11 verschillende anti-epileptica toonden aan dat patiënten die waren gerandomiseerd naar een van de anti-epileptica ongeveer tweemaal het risico hadden (aangepast relatief risico 1,8, 95% BI: 1,2, 2,7) op suïcidale denken of gedrag vergeleken met patiënten gerandomiseerd naar placebo. In deze onderzoeken, die een mediane behandelingsduur van 12 weken hadden, was de geschatte incidentie van suïcidaal gedrag of suïcidale gedachten onder 27.863 AED-behandelde patiënten 0,43%, vergeleken met 0,24% onder 16.029 met placebo behandelde patiënten, wat neerkomt op een toename van ongeveer één geval van zelfmoordgedachten of suïcidaal gedrag voor elke 530 behandelde patiënten. Er waren vier zelfmoorden bij met geneesmiddelen behandelde patiënten in de onderzoeken en geen bij met placebo behandelde patiënten, maar het aantal is te klein om enige conclusie te kunnen trekken over het effect van het geneesmiddel op zelfmoord.
Het verhoogde risico op zelfmoordgedachten of -gedrag met anti-epileptica werd al één week na het starten van de medicamenteuze behandeling met anti-epileptica waargenomen en hield aan gedurende de beoordeelde behandelingsduur. Omdat de meeste onderzoeken die in de analyse waren opgenomen, niet langer dan 24 weken duurden, kon het risico op zelfmoordgedachten of -gedrag na 24 weken niet worden beoordeeld.
Het risico op zelfmoordgedachten of -gedrag was over het algemeen consistent tussen drugs in de geanalyseerde gegevens. De bevinding van een verhoogd risico bij AED's met verschillende werkingsmechanismen en voor een reeks indicaties suggereert dat het risico van toepassing is op alle AED's die voor elke indicatie worden gebruikt. Het risico varieerde niet wezenlijk naar leeftijd (5-100 jaar) in de geanalyseerde klinische onderzoeken. Tabel 2 toont het absolute en relatieve risico per indicatie voor alle geëvalueerde AED's.
TABEL 2: Risico per indicatie voor anti-epileptica in de gepoolde analyse
Het relatieve risico op zelfmoordgedachten of zelfmoordgedrag was hoger in klinische studies voor epilepsie dan in klinische studies voor psychiatrische of andere aandoeningen, maar de absolute risicoverschillen waren vergelijkbaar voor de epilepsie en psychiatrische indicaties.
Iedereen die overweegt NEURONTIN 100 mg of een andere AED voor te schrijven, moet het risico op zelfmoordgedachten of -gedrag afwegen tegen het risico op onbehandelde ziekte. Epilepsie en vele andere ziekten waarvoor AED's worden voorgeschreven, zijn zelf geassocieerd met morbiditeit en mortaliteit en een verhoogd risico op zelfmoordgedachten en -gedrag. Mochten er tijdens de behandeling zelfmoordgedachten en -gedrag naar voren komen, dan moet de voorschrijver overwegen of het optreden van deze symptomen bij een bepaalde patiënt verband kan houden met de ziekte die wordt behandeld.
Patiënten, hun verzorgers en families moeten worden geïnformeerd dat anti-epileptica het risico op zelfmoordgedachten en -gedrag verhogen en moeten worden geïnformeerd over de noodzaak om alert te zijn op het optreden of verergeren van de tekenen en symptomen van depressie, ongewone veranderingen in stemming of gedrag , of de opkomst van zelfmoordgedachten, -gedrag of gedachten over zelfbeschadiging. Zorgwekkend gedrag moet onmiddellijk aan zorgverleners worden gemeld.
Ademhalingsdepressie
Er zijn aanwijzingen uit casusrapporten, studies bij mensen en dierstudies die gabapentine in verband brengen met ernstige, levensbedreigende of fatale ademhalingsdepressie bij gelijktijdige toediening met CZS-depressiva, waaronder opioïden, of bij een onderliggende ademhalingsstoornis. Wanneer wordt besloten om NEURONTIN 100 mg gelijktijdig voor te schrijven met een ander CZS-depressivum, met name een opioïde, of om NEURONTIN 100 mg voor te schrijven aan patiënten met een onderliggende ademhalingsstoornis, controleer de patiënten dan op symptomen van ademhalingsdepressie en sedatie en overweeg om NEURONTIN in een lage dosis te starten . De behandeling van ademhalingsdepressie kan nauwkeurige observatie, ondersteunende maatregelen en vermindering of stopzetting van CZS-depressiva (inclusief NEURONTIN) omvatten.
Neuropsychiatrische bijwerkingen (pediatrische patiënten van 3 tot 12 jaar oud)
Het gebruik van gabapentine bij pediatrische patiënten met epilepsie van 3 tot 12 jaar wordt in verband gebracht met het optreden van CZS-gerelateerde bijwerkingen. De belangrijkste hiervan kunnen worden ingedeeld in de volgende categorieën: 1) emotionele labiliteit (voornamelijk gedragsproblemen), 2) vijandigheid, inclusief agressief gedrag, 3) denkstoornis, inclusief concentratieproblemen en verandering in schoolprestaties, en 4) hyperkinesie ( voornamelijk rusteloosheid en hyperactiviteit). Bij de met gabapentine behandelde patiënten waren de meeste reacties licht tot matig van intensiteit.
In gecontroleerde klinische epilepsieonderzoeken bij pediatrische patiënten van 3 tot 12 jaar was de incidentie van deze bijwerkingen: emotionele labiliteit 6% (patiënten behandeld met gabapentine) versus 1,3% (patiënten behandeld met placebo); vijandigheid 5,2% versus 1,3%; hyperkinesie 4,7% versus 2,9%; en denkstoornis 1,7% versus 0%. Een van deze reacties, een melding van vijandigheid, werd als ernstig beschouwd. Stopzetting van de behandeling met gabapentine kwam voor bij 1,3% van de patiënten die emotionele labiliteit en hyperkinesie rapporteerden en bij 0,9% van de met gabapentine behandelde patiënten die vijandigheid en denkstoornissen rapporteerden. Eén met placebo behandelde patiënt (0,4%) trok zich terug vanwege emotionele labiliteit.
Tumorigene potentie
In een oraal carcinogeniteitsonderzoek verhoogde gabapentine de incidentie van acinaire celtumoren van de alvleesklier bij ratten [zie Niet-klinische toxicologie ]. De klinische betekenis van deze bevinding is niet bekend. Klinische ervaring tijdens de premarketingontwikkeling van gabapentine biedt geen directe manier om het potentieel voor het induceren van tumoren bij mensen te beoordelen.
In klinische onderzoeken naar adjuvante therapie bij epilepsie, met een blootstelling van 2085 patiëntjaren bij patiënten >12 jaar, werden nieuwe tumoren gemeld bij 10 patiënten (2 borsten, 3 hersenen, 2 longen, 1 bijnieren, 1 non-Hodgkin' s-lymfoom, 1 endometriumcarcinoom in situ) en reeds bestaande tumoren verslechterden bij 11 patiënten (9 hersenen, 1 borst, 1 prostaat) tijdens of tot 2 jaar na stopzetting van NEURONTIN. Zonder kennis van de achtergrondincidentie en herhaling in een vergelijkbare populatie die niet met NEURONTIN 100 mg wordt behandeld, is het onmogelijk om te weten of de incidentie die in dit cohort wordt gezien al dan niet wordt beïnvloed door de behandeling.
Plotselinge en onverklaarbare dood bij patiënten met epilepsie
Tijdens de premarketingontwikkeling van NEURONTIN 400 mg werden 8 plotselinge en onverklaarbare sterfgevallen geregistreerd bij een cohort van 2203 epilepsiepatiënten die werden behandeld (2103 patiëntjaren blootstelling) met NEURONTIN.
Sommige hiervan zouden kunnen duiden op aan een aanval gerelateerde sterfgevallen waarbij de aanval niet werd waargenomen, bijvoorbeeld 's nachts. Dit komt neer op een incidentie van 0,0038 sterfgevallen per patiëntjaar. Hoewel dit percentage hoger is dan verwacht in een gezonde populatie die overeenkomt met leeftijd en geslacht, ligt het binnen het bereik van schattingen voor de incidentie van plotselinge onverklaarbare sterfgevallen bij patiënten met epilepsie die geen NEURONTIN krijgen (variërend van 0,0005 voor de algemene populatie van epileptici tot 0,003 voor een klinische onderzoekspopulatie vergelijkbaar met die in het NEURONTIN-programma, tot 0,005 voor patiënten met refractaire epilepsie). Of deze cijfers geruststellend zijn of nog meer zorgen baren, hangt dus af van de vergelijkbaarheid van de populaties waarover gerapporteerd wordt aan het NEURONTIN-cohort en de nauwkeurigheid van de verstrekte schattingen.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Administratie Informatie
Informeer patiënten dat NEURONTIN oraal wordt ingenomen met of zonder voedsel. Informeer patiënten dat, als ze de tablet van 600 mg of 800 mg met breukstreep verdelen om een halve tablet toe te dienen, ze de ongebruikte halve tablet als de volgende dosis moeten innemen. Adviseer patiënten om niet-gebruikte halve tabletten weg te gooien binnen 28 dagen na het verdelen van de tablet met breukstreep.
Geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS)/overgevoeligheid voor meerdere organen
Instrueer patiënten vóór aanvang van de behandeling met NEURONTIN dat huiduitslag of andere tekenen of symptomen van overgevoeligheid (zoals koorts of lymfadenopathie) een ernstige medische gebeurtenis kunnen inluiden en dat de patiënt een dergelijk voorval onmiddellijk aan een arts moet melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Anafylaxie en angio-oedeem
Adviseer patiënten om te stoppen met NEURONTIN 300 mg en medische hulp in te roepen als ze tekenen of symptomen van anafylaxie of angio-oedeem krijgen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Duizeligheid en slaperigheid en effecten op het rijden en bedienen van zware machines
Adviseer patiënten dat NEURONTIN 100 mg duizeligheid, slaperigheid en andere symptomen en tekenen van CZS-depressie kan veroorzaken. Andere geneesmiddelen met kalmerende eigenschappen kunnen deze symptomen versterken. Dienovereenkomstig, hoewel patiënten' het vermogen om hun mate van beperking te bepalen onbetrouwbaar kan zijn, hen adviseren geen auto te besturen of andere complexe machines te bedienen totdat ze voldoende ervaring hebben opgedaan met NEURONTIN om te beoordelen of het hun mentale en/of motorische prestaties nadelig beïnvloedt. Informeer patiënten dat het niet bekend is hoe lang dit effect aanhoudt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Suïcidaal denken en gedrag
Vertel de patiënt, hun verzorgers en familie dat AED's, waaronder NEURONTIN, het risico op zelfmoordgedachten en zelfmoordgedrag kunnen vergroten. Adviseer patiënten dat ze alert moeten zijn op het optreden of verergeren van symptomen van depressie, ongewone veranderingen in stemming of gedrag, of het optreden van zelfmoordgedachten, -gedrag of gedachten over zelfbeschadiging. Instrueer patiënten om zorgwekkend gedrag onmiddellijk aan zorgverleners te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ademhalingsdepressie
Informeer patiënten over het risico op ademhalingsdepressie. Voeg informatie toe dat het risico het grootst is voor diegenen die gelijktijdig CZS-depressiva gebruiken (zoals opioïde analgetica) of voor diegenen met een onderliggende ademhalingsstoornis. Leer patiënten hoe ze ademhalingsdepressie kunnen herkennen en adviseer hen om onmiddellijk medische hulp in te roepen als deze zich voordoet [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gebruik tijdens de zwangerschap
Instrueer patiënten om hun arts op de hoogte te stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de therapie, en om hun arts te informeren als ze borstvoeding geven of van plan zijn borstvoeding te geven tijdens de therapie [zie Gebruik bij specifieke populaties ].
Moedig patiënten aan om zich in te schrijven in het NAAED Zwangerschapsregister als ze zwanger worden. Dit register verzamelt informatie over de veiligheid van anti-epileptica tijdens de zwangerschap. Om zich in te schrijven, kunnen patiënten het gratis nummer 1-888-233-2334 bellen [zie Gebruik bij specifieke populaties ].
De etikettering van dit product is mogelijk bijgewerkt. Ga voor de meest recente voorschrijfinformatie naar www.pfizer.com.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Gabapentine werd oraal toegediend aan muizen en ratten in carcinogeniteitsonderzoeken van 2 jaar. Er werd geen bewijs van geneesmiddelgerelateerde carcinogeniteit waargenomen bij muizen die werden behandeld met doses tot 2000 mg/kg/dag. Bij 2000 mg/kg was de plasma-blootstelling aan gabapentine (AUC) bij muizen ongeveer 2 keer die bij mensen bij de MRHD van 3600 mg/dag. Bij ratten werd een toename van de incidentie van acinaire adenoom en carcinoom van de pancreas gevonden bij mannelijke ratten die de hoogste dosis kregen (2000 mg/kg), maar niet bij doses van 250 of 1000 mg/kg/dag. Bij 1000 mg/kg was de plasma-blootstelling aan gabapentine (AUC) bij ratten ongeveer 5 keer die bij mensen bij de MRHD.
Studies die zijn opgezet om het mechanisme van gabapentine-geïnduceerde pancreascarcinogenese bij ratten te onderzoeken, geven aan dat gabapentine de DNA-synthese in acinaire cellen van de pancreas van de rat in vitro stimuleert en dus kan werken als een tumorpromotor door de mitogene activiteit te versterken. Het is niet bekend of gabapentine de celproliferatie kan verhogen in andere celtypen of bij andere soorten, waaronder de mens.
Mutagenese
Gabapentine vertoonde geen mutageen of genotoxisch potentieel in in vitro (Ames-test, HGPRT forward-mutatietest in longcellen van Chinese hamsters) en in vivo (chromosomale aberratie en micronucleustest in beenmerg van Chinese hamsters, micronucleus van muizen, ongeplande DNA-synthese in hepatocyten van ratten) testen.
Aantasting van de vruchtbaarheid
Er werden geen nadelige effecten op de vruchtbaarheid of de voortplanting waargenomen bij ratten bij doses tot 2000 mg/kg. Bij 2000 mg/kg is de plasma-blootstelling aan gabapentine (AUC) bij ratten ongeveer 8 keer die bij mensen bij de MRHD.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap zijn blootgesteld aan anti-epileptica (AED's), zoals NEURONTIN 300 mg. Moedig vrouwen die NEURONTIN gebruiken tijdens de zwangerschap aan om zich in te schrijven in het North American Anti-epileptic Drug (NAAED) Pregnancy Registry door het gratis nummer 1-888-233-2334 te bellen of http://www.aedpregnancyregistry.org/ te bezoeken.
Risico Samenvatting
Er zijn onvoldoende gegevens over de ontwikkelingsrisico's die samenhangen met het gebruik van NEURONTIN bij zwangere vrouwen. In niet-klinische onderzoeken bij muizen, ratten en konijnen was gabapentine toxisch voor de ontwikkeling (verhoogde foetale skelet- en viscerale afwijkingen en verhoogde embryofoetale mortaliteit) bij toediening aan drachtige dieren in doses die vergelijkbaar waren met of lager waren dan die welke klinisch werden gebruikt [zie Gegevens ].
In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%. Het achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend.
Gegevens
Dierlijke gegevens
Wanneer zwangere muizen orale doses gabapentine (500, 1000 of 3000 mg/kg/dag) kregen tijdens de periode van organogenese, werd embryofoetale toxiciteit (verhoogde incidentie van skeletafwijkingen) waargenomen bij de twee hoogste doses. De dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit bij muizen (500 mg/kg/dag) is minder dan de maximaal aanbevolen dosis voor de mens (MRHD) van 3600 mg op basis van het lichaamsoppervlak (mg/m²).
In onderzoeken waarbij ratten tijdens de dracht orale doses gabapentine (500 tot 2000 mg/kg/dag) kregen, werd bij alle doses een nadelig effect op de ontwikkeling van het nageslacht (verhoogde incidentie van hydroureter en/of hydronefrose) waargenomen. De laagste geteste dosis is vergelijkbaar met de MRHD op basis van mg/m².
Wanneer drachtige konijnen werden behandeld met gabapentine tijdens de periode van organogenese, werd een toename van de embryofoetale mortaliteit waargenomen bij alle geteste doses (60, 300 of 1500 mg/kg). De laagste geteste dosis is minder dan de MRHD op basis van mg/m².
In een gepubliceerde studie werd gabapentine (400 mg/kg/dag) via intraperitoneale injectie toegediend aan neonatale muizen tijdens de eerste postnatale week, een periode van synaptogenese bij knaagdieren (overeenkomend met het laatste trimester van de zwangerschap bij mensen). Gabapentine veroorzaakte een duidelijke afname van de vorming van neuronale synapsen in de hersenen van intacte muizen en abnormale vorming van neuronale synapsen in een muismodel van synaptisch herstel. In vitro is aangetoond dat gabapentine interfereert met de activiteit van de α2δ-subeenheid van door spanning geactiveerde calciumkanalen, een receptor die betrokken is bij neuronale synaptogenese. De klinische betekenis van deze bevindingen is niet bekend.
Borstvoeding
Risico Samenvatting
Gabapentine wordt uitgescheiden in de moedermelk na orale toediening. De effecten op de zuigeling die borstvoeding krijgt en op de melkproductie zijn niet bekend. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan NEURONTIN en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van NEURONTIN of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van NEURONTIN 600 mg bij de behandeling van postherpetische neuralgie bij pediatrische patiënten zijn niet vastgesteld.
De veiligheid en werkzaamheid als aanvullende therapie bij de behandeling van partiële aanvallen bij pediatrische patiënten jonger dan 3 jaar zijn niet vastgesteld [zie Klinische studies ].
Geriatrisch gebruik
Het totale aantal patiënten dat met NEURONTIN werd behandeld in gecontroleerde klinische onderzoeken bij patiënten met postherpetische neuralgie was 336, van wie 102 (30%) 65 tot 74 jaar oud waren en 168 (50%) 75 jaar en ouder. Er was een groter behandeleffect bij patiënten van 75 jaar en ouder in vergelijking met jongere patiënten die dezelfde dosering kregen. Aangezien gabapentine bijna uitsluitend wordt uitgescheiden door excretie via de nieren, kan het grotere behandelingseffect dat wordt waargenomen bij patiënten 75 jaar een gevolg zijn van een verhoogde blootstelling aan gabapentine voor een bepaalde dosis die het gevolg is van een leeftijdsgebonden afname van de nierfunctie. Andere factoren kunnen echter niet worden uitgesloten. De soorten en incidentie van bijwerkingen waren vergelijkbaar tussen leeftijdsgroepen, behalve voor perifeer oedeem en ataxie, die de neiging hadden om in incidentie toe te nemen met de leeftijd.
Klinische onderzoeken met NEURONTIN bij epilepsie omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageerden dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het selecteren van de dosis en moet de dosis worden aangepast op basis van de creatinineklaringswaarden bij deze patiënten [zie DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , en KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Aanpassing van de dosering bij volwassen patiënten met een verminderde nierfunctie is noodzakelijk [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ]. Pediatrische patiënten met nierinsufficiëntie zijn niet onderzocht.
Dosisaanpassing bij patiënten die hemodialyse ondergaan is noodzakelijk [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Tekenen van acute toxiciteit bij dieren waren onder meer ataxie, moeizame ademhaling, ptosis, sedatie, hypoactiviteit of opwinding.
Acute orale overdoses van NEURONTIN 300 mg zijn gemeld. Symptomen zijn dubbelzien, tremor, onduidelijke spraak, slaperigheid, veranderde mentale toestand, duizeligheid, lethargie en diarree. Fatale ademhalingsdepressie is gemeld bij een overdosis NEURONTIN 400 mg, alleen en in combinatie met andere CZS-depressiva.
Gabapentine kan worden verwijderd door hemodialyse.
Als er sprake is van overmatige blootstelling, bel dan uw antigifcentrum op 1-800-222-1222.
CONTRA-INDICATIES
NEURONTIN is gecontra-indiceerd bij patiënten die overgevoelig zijn gebleken voor het geneesmiddel of de ingrediënten ervan.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
De precieze mechanismen waardoor gabapentine zijn analgetische en anti-epileptische werking produceert, zijn onbekend. Gabapentine is structureel verwant aan de neurotransmitter gamma-aminoboterzuur (GABA), maar heeft geen effect op de binding, opname of afbraak van GABA. In vitro-onderzoeken hebben aangetoond dat gabapentine met hoge affiniteit bindt aan de α2δ-subeenheid van door spanning geactiveerde calciumkanalen; de relatie tussen deze binding en de therapeutische effecten van gabapentine is echter onbekend.
Farmacokinetiek
Alle farmacologische acties na toediening van gabapentine zijn te wijten aan de activiteit van de moederverbinding; gabapentine wordt niet merkbaar gemetaboliseerd bij de mens.
Orale biologische beschikbaarheid
De biologische beschikbaarheid van gabapentine is niet dosisproportioneel; dat wil zeggen, naarmate de dosis wordt verhoogd, neemt de biologische beschikbaarheid af. De biologische beschikbaarheid van gabapentine is ongeveer 60%, 47%, 34%, 33% en 27% na respectievelijk 900, 1200, 2400, 3600 en 4800 mg/dag, verdeeld over 3 doses. Voedsel heeft slechts een gering effect op de snelheid en mate van absorptie van gabapentine (14% toename van AUC en Cmax).
Verdeling
Minder dan 3% van gabapentine circuleert gebonden aan plasma-eiwit. Het schijnbare distributievolume van gabapentine na intraveneuze toediening van 150 mg is 58±6 l (gemiddelde ±SD). Bij patiënten met epilepsie waren de steady-state predosis (Cmin)-concentraties van gabapentine in cerebrospinale vloeistof ongeveer 20% van de overeenkomstige plasmaconcentraties.
Eliminatie
Gabapentine wordt als onveranderd geneesmiddel uit de systemische circulatie geëlimineerd door renale excretie. Gabapentine wordt niet merkbaar gemetaboliseerd bij de mens.
De eliminatiehalfwaardetijd van gabapentine is 5 tot 7 uur en verandert niet per dosis of na meervoudige dosering. De eliminatiesnelheidsconstante van gabapentine, de plasmaklaring en de renale klaring zijn recht evenredig met de creatinineklaring. Bij oudere patiënten en bij patiënten met een verminderde nierfunctie is de plasmaklaring van gabapentine verminderd. Gabapentine kan door hemodialyse uit het plasma worden verwijderd.
Specifieke populaties
Leeftijd
Het effect van leeftijd werd bestudeerd bij proefpersonen in de leeftijd van 20-80 jaar. De schijnbare orale klaring (CL/F) van gabapentine nam af naarmate de leeftijd vorderde, van ongeveer 225 ml/min bij personen jonger dan 30 jaar tot ongeveer 125 ml/min bij personen ouder dan 70 jaar. Nierklaring (CLr) en CLr gecorrigeerd voor lichaamsoppervlak namen ook af met de leeftijd; de afname van de renale klaring van gabapentine met de leeftijd kan echter grotendeels worden verklaard door de afname van de nierfunctie. [zien DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Geslacht
Hoewel er geen formeel onderzoek is uitgevoerd om de farmacokinetiek van gabapentine bij mannen en vrouwen te vergelijken, lijkt het erop dat de farmacokinetische parameters voor mannen en vrouwen vergelijkbaar zijn en dat er geen significante sekseverschillen zijn.
Ras
Farmacokinetische verschillen als gevolg van ras zijn niet onderzocht. Omdat gabapentine voornamelijk via de nieren wordt uitgescheiden en er geen belangrijke raciale verschillen zijn in de creatinineklaring, worden farmacokinetische verschillen als gevolg van ras niet verwacht.
pediatrisch
De farmacokinetiek van gabapentine werd bepaald bij 48 pediatrische proefpersonen in de leeftijd van 1 maand tot 12 jaar na een dosis van ongeveer 10 mg/kg. Piekplasmaconcentraties waren vergelijkbaar in de hele leeftijdsgroep en traden 2 tot 3 uur na de dosis op. In het algemeen bereikten pediatrische proefpersonen tussen 1 maand en
Een populatiefarmacokinetische analyse werd uitgevoerd bij 253 pediatrische proefpersonen tussen 1 maand en 13 jaar oud. Patiënten kregen driemaal daags 10 tot 65 mg/kg/dag toegediend. De schijnbare orale klaring (CL/F) was recht evenredig met de creatinineklaring en deze relatie was vergelijkbaar na een enkele dosis en bij steady-state. Hogere orale klaringswaarden werden waargenomen bij kinderen
Deze farmacokinetische gegevens geven aan dat de effectieve dagelijkse dosis bij pediatrische patiënten met epilepsie in de leeftijd van 3 en 4 jaar 40 mg/kg/dag moet zijn om gemiddelde plasmaconcentraties te bereiken die vergelijkbaar zijn met die welke worden bereikt bij patiënten van 5 jaar en ouder die gabapentine krijgen van 30 mg/dag. kg/dag [zie DOSERING EN ADMINISTRATIE ].
Volwassen patiënten met nierinsufficiëntie
Proefpersonen (N=60) met nierinsufficiëntie (gemiddelde creatinineklaring variërend van 13–114 ml/min) kregen enkelvoudige orale doses van 400 mg gabapentine toegediend. De gemiddelde halfwaardetijd van gabapentine varieerde van ongeveer 6,5 uur (patiënten met een creatinineklaring >60 ml/min) tot 52 uur (creatinineklaring 60 ml/min). groep) tot ongeveer 10 ml/min ( DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ]. Pediatrische patiënten met nierinsufficiëntie zijn niet onderzocht.
Hemodialyse
In een onderzoek bij volwassen proefpersonen met anurie (N=11) was de schijnbare eliminatiehalfwaardetijd van gabapentine op dagen zonder dialyse ongeveer 132 uur; tijdens dialyse werd de schijnbare halfwaardetijd van gabapentine teruggebracht tot 3,8 uur. Hemodialyse heeft dus een significant effect op de eliminatie van gabapentine bij patiënten met anurie [zie: DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Leverziekte
Omdat gabapentine niet wordt gemetaboliseerd, is er geen onderzoek uitgevoerd bij patiënten met leverinsufficiëntie.
Geneesmiddelinteracties
In vitro onderzoek
Er zijn in vitro-onderzoeken uitgevoerd om het vermogen van gabapentine te onderzoeken om de belangrijkste cytochroom P450-enzymen (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 en CYP3A4) te remmen die het geneesmiddel- en xenobiotisch metabolisme mediëren met behulp van isoform-selectieve markersubstraten en menselijke levermicrosomale preparaten . Alleen bij de hoogste geteste concentratie (171 mcg/ml; 1 mM) werd een lichte mate van remming (14% tot 30%) van isovorm CYP2A6 waargenomen. Er werd geen remming van een van de andere geteste isovormen waargenomen bij gabapentineconcentraties tot 171 mcg/ml (ongeveer 15 keer de Cmax bij 3600 mg/dag) van isovorm CYP2A6. Er werd geen remming van een van de andere geteste isovormen waargenomen bij gabapentineconcentraties tot 171 mcg/ml (ongeveer 15 keer de Cmax bij 3600 mg/dag).
In vivo-studies
De gegevens over geneesmiddelinteracties die in deze rubriek worden beschreven, zijn verkregen uit onderzoeken met gezonde volwassenen en volwassen patiënten met epilepsie.
fenytoïne
In een onderzoek met enkelvoudige (400 mg) en meervoudige dosis (400 mg driemaal daags) van NEURONTIN 400 mg bij epileptische patiënten (N=8) die gedurende ten minste 2 maanden op fenytoïne als monotherapie werden gehouden, had gabapentine geen effect op de steady-state dalspiegel. plasmaconcentraties van fenytoïne en fenytoïne hadden geen effect op de farmacokinetiek van gabapentine.
Carbamazepine
Steady-state dalplasmaconcentraties van carbamazepine en carbamazepine 10, 11 epoxide werden niet beïnvloed door gelijktijdige toediening van gabapentine (400 mg driemaal daags; N=12). Evenzo bleef de farmacokinetiek van gabapentine ongewijzigd door toediening van carbamazepine.
Valproïnezuur
De gemiddelde steady-state dalconcentraties van valproïnezuur in serum voor en tijdens gelijktijdige toediening van gabapentine (400 mg driemaal daags; N=17) waren niet verschillend en de farmacokinetische parameters van gabapentine werden evenmin beïnvloed door valproïnezuur.
fenobarbital
Schattingen van de farmacokinetische parameters bij steady-state voor fenobarbital of gabapentine (300 mg driemaal daags; N=12) zijn identiek, ongeacht of de geneesmiddelen alleen of samen worden toegediend.
Naproxen
Gelijktijdige toediening (N=18) van naproxen-natriumcapsules (250 mg) met NEURONTIN (125 mg) lijkt de geabsorbeerde hoeveelheid gabapentine met 12% tot 15% te verhogen. Gabapentine had geen effect op de farmacokinetische parameters van naproxen. Deze doses zijn lager dan de therapeutische doses voor beide geneesmiddelen. De omvang van de interactie binnen de aanbevolen dosisbereiken van beide geneesmiddelen is niet bekend.
Hydrocodon
Gelijktijdige toediening van NEURONTIN (125 tot 500 mg; N=48) verlaagt de Cmax- en AUC-waarden van hydrocodon (10 mg; N=50) op een dosisafhankelijke manier in vergelijking met toediening van hydrocodon alleen; De Cmax- en AUC-waarden zijn respectievelijk 3% tot 4% lager na toediening van 125 mg NEURONTIN en 21% tot 22% lager na toediening van 500 mg NEURONTIN. Het mechanisme voor deze interactie is onbekend. Hydrocodon verhoogt de AUC-waarden van gabapentine met 14%. De omvang van de interactie bij andere doses is niet bekend.
Morfine
Een literatuurartikel meldde dat wanneer een 60 mg morfine capsule met gecontroleerde afgifte 2 uur voorafgaand aan een 600 mg NEURONTIN capsule (N=12) werd toegediend, de gemiddelde gabapentine AUC met 44% toenam in vergelijking met gabapentine toegediend zonder morfine. De farmacokinetische parameterwaarden van morfine werden niet beïnvloed door toediening van NEURONTIN 2 uur na morfine. De omvang van de interactie bij andere doses is niet bekend.
cimetidine
In aanwezigheid van cimetidine van 300 mg viermaal daags (N=12), daalde de gemiddelde schijnbare orale klaring van gabapentine met 14% en de creatinineklaring met 10%. Zo bleek cimetidine de renale excretie van zowel gabapentine als creatinine, een endogene marker van de nierfunctie, te veranderen. Deze kleine afname van de uitscheiding van gabapentine door cimetidine is naar verwachting niet van klinisch belang. Het effect van gabapentine op cimetidine werd niet geëvalueerd.
Oraal anticonceptiemiddel
Op basis van de AUC en de halfwaardetijd waren de farmacokinetische profielen van meervoudige doses van norethindron en ethinylestradiol na toediening van tabletten met 2,5 mg norethindronacetaat en 50 mcg ethinylestradiol vergelijkbaar met en zonder gelijktijdige toediening van gabapentine (400 mg driemaal daags; N=13). De Cmax van norethindron was 13% hoger bij gelijktijdige toediening met gabapentine; deze interactie is naar verwachting niet van klinisch belang.
Antacida (Maalox®) (aluminiumhydroxide, magnesiumhydroxide)
Antacida (Maalox®) dat magnesium- en aluminiumhydroxide bevat, verminderde de gemiddelde biologische beschikbaarheid van gabapentine (N=16) met ongeveer 20%. Deze afname in biologische beschikbaarheid was ongeveer 10% wanneer gabapentine 2 uur na Maalox werd toegediend.
probenecide
Probenecide blokkeert de renale tubulaire secretie. De farmacokinetische parameters van gabapentine zonder en met probenecide waren vergelijkbaar. Dit geeft aan dat gabapentine geen renale tubulaire secretie ondergaat via de route die wordt geblokkeerd door probenecide.
Klinische studies
Postherpetische neuralgie
NEURONTIN werd geëvalueerd voor de behandeling van postherpetische neuralgie (PHN) in twee gerandomiseerde, dubbelblinde, placebogecontroleerde, multicenter onderzoeken. De intent-to-treat (ITT)-populatie bestond uit in totaal 563 patiënten met pijn gedurende meer dan 3 maanden na genezing van de huiduitslag met herpes zoster (tabel 6).
TABEL 6. Gecontroleerde PHN-onderzoeken: duur, doseringen en aantal patiënten
Elke studie omvatte een dubbelblinde fase van 7 of 8 weken (3 of 4 weken titratie en 4 weken vaste dosis). Patiënten startten de behandeling met titratie tot maximaal 900 mg/dag gabapentine gedurende 3 dagen. De doseringen moesten vervolgens worden getitreerd in stappen van 600 tot 1200 mg/dag met tussenpozen van 3 tot 7 dagen tot de beoogde dosis gedurende 3 tot 4 weken. Patiënten noteerden hun pijn in een dagelijks dagboek met behulp van een 11-punts numerieke pijnbeoordelingsschaal, variërend van 0 (geen pijn) tot 10 (ergst mogelijke pijn). Een gemiddelde pijnscore tijdens baseline van ten minste 4 was vereist voor randomisatie. Analyses werden uitgevoerd met behulp van de ITT-populatie (alle gerandomiseerde patiënten die ten minste één dosis onderzoeksmedicatie kregen).
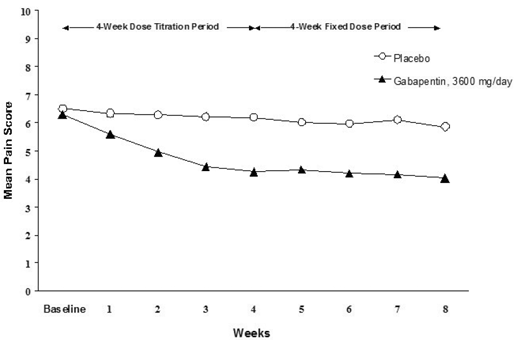
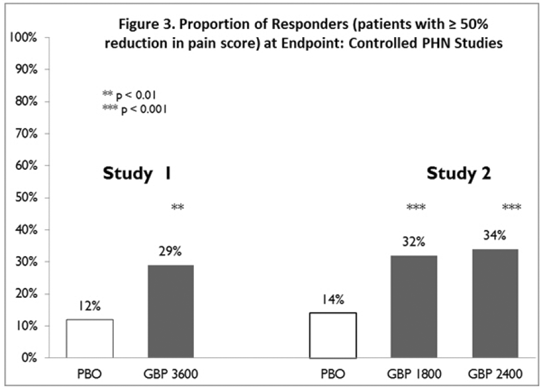
Beide onderzoeken toonden werkzaamheid aan in vergelijking met placebo bij alle geteste doses.
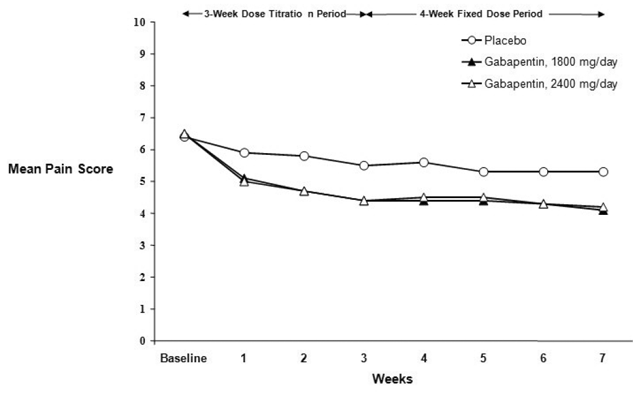
De afname van de wekelijkse gemiddelde pijnscores werd in beide onderzoeken in week 1 waargenomen en hield aan tot het einde van de behandeling. Vergelijkbare behandeleffecten werden waargenomen in alle actieve behandelarmen. Farmacokinetische/farmacodynamische modellering leverde bevestigend bewijs van werkzaamheid voor alle doses. Figuren 1 en 2 tonen pijnintensiteitsscores in de loop van de tijd voor onderzoeken 1 en 2.
Figuur 1. Wekelijkse gemiddelde pijnscores (geobserveerde gevallen in ITT-populatie): onderzoek 1.
Figuur 2. Wekelijkse gemiddelde pijnscores (geobserveerde gevallen in ITT-populatie): onderzoek 2.
Het percentage responders (de patiënten die een verbetering van ten minste 50% in de pijnscore op het eindpunt rapporteerden in vergelijking met baseline) werd voor elk onderzoek berekend (Figuur 3).
Afbeelding 3. Percentage responders (patiënten met ≥50% vermindering van pijnscore) bij eindpunt: gecontroleerde PHN-onderzoeken
Epilepsie voor gedeeltelijk beginnende aanvallen (adjuvante therapie)
De werkzaamheid van NEURONTIN 400 mg als aanvullende therapie (toegevoegd aan andere anti-epileptica) werd vastgesteld in multicenter placebogecontroleerde, dubbelblinde klinische onderzoeken met parallelle groepen bij volwassen en pediatrische patiënten (3 jaar en ouder) met refractaire partiële aanvallen.
Bewijs van werkzaamheid werd verkregen in drie onderzoeken bij 705 patiënten (12 jaar en ouder) en in één onderzoek bij 247 pediatrische patiënten (3 tot 12 jaar). De patiënten die deelnamen hadden een voorgeschiedenis van ten minste 4 partiële aanvallen per maand ondanks het ontvangen van een of meer anti-epileptica op therapeutische niveaus en werden geobserveerd op hun gevestigde anti-epilepticaregime gedurende een baselineperiode van 12 weken (6 weken in de studie van pediatrische patiënten). Bij patiënten die ten minste 2 (of 4 in sommige onderzoeken) aanvallen per maand bleven houden, werd NEURONTIN 300 mg of placebo vervolgens toegevoegd aan de bestaande therapie gedurende een behandelingsperiode van 12 weken. De effectiviteit werd voornamelijk beoordeeld op basis van het percentage patiënten met een vermindering van 50% of meer in aanvalsfrequentie van baseline tot behandeling (het "responderpercentage") en een afgeleide maatstaf die responsratio wordt genoemd, een maatstaf voor verandering gedefinieerd als (T - B)/(T + B), waarbij B de frequentie van aanvallen bij aanvang van de patiënt is en T de frequentie van aanvallen van de patiënt tijdens de behandeling. De responsratio wordt verdeeld binnen het bereik van -1 tot +1. Een nulwaarde geeft aan dat er geen verandering is, terwijl volledige eliminatie van aanvallen een waarde van -1 zou geven; verhoogde aanvalspercentages zouden positieve waarden opleveren. Een responsratio van -0,33 komt overeen met een vermindering van 50% van de aanvalsfrequentie. De onderstaande resultaten zijn voor alle partiële aanvallen in de intent-to-treat-populatie (alle patiënten die een dosis van de behandeling hebben gekregen) in elk onderzoek, tenzij anders aangegeven.
In één onderzoek werd NEURONTIN 1200 mg/dag, verdeeld over drie doses, vergeleken met placebo. Het responspercentage was 23% (14/61) in de NEURONTIN 600 mg-groep en 9% (6/66) in de placebogroep; het verschil tussen de groepen was statistisch significant. De responsratio was ook beter in de NEURONTIN-groep (-0,199) dan in de placebogroep (-0,044), een verschil dat ook statistische significantie bereikte.
Een tweede studie vergeleek voornamelijk NEURONTIN 1200 mg/dag, verdeeld over drie doses (N=101), met placebo (N=98). Aanvullende kleinere doseringsgroepen van 300 mg NEURONTIN (600 mg/dag, N=53; 1800 mg/dag, N=54) werden ook onderzocht voor informatie over de dosisrespons. Het responspercentage was hoger in de NEURONTIN 1200 mg/dag-groep (16%) dan in de placebogroep (8%), maar het verschil was niet statistisch significant. Het responspercentage bij 600 mg (17%) was ook niet significant hoger dan bij de placebo, maar het responspercentage in de 1800 mg-groep (26%) was statistisch significant beter dan het placebopercentage. De responsratio was beter in de NEURONTIN 1200 mg/dag-groep (-0,103) dan in de placebogroep (-0,022); maar dit verschil was ook niet statistisch significant (p = 0,224). Een betere respons werd gezien in de NEURONTIN 600 mg/dag-groep (-0,105) en 1800 mg/dag-groep (-0,222) dan in de 1200 mg/dag-groep, waarbij de 1800 mg/dag-groep statistische significantie bereikte in vergelijking met de placebo groep.
Een derde studie vergeleek NEURONTIN 900 mg/dag, verdeeld over drie doses (N=111), en placebo (N=109). Een extra doseringsgroep van 1200 mg/dag NEURONTIN (N=52) leverde dosis-responsgegevens. Een statistisch significant verschil in responspercentage werd gezien in de NEURONTIN 900 mg/dag-groep (22%) vergeleken met die in de placebogroep (10%). De responsratio was ook statistisch significant beter in de NEURONTIN 900 mg/dag-groep (-0,119) vergeleken met die in de placebogroep (-0,027), evenals de responsratio bij 1200 mg/dag NEURONTIN (-0,184) vergeleken met placebo.
In elk onderzoek werden ook analyses uitgevoerd om het effect van NEURONTIN 300 mg op het voorkomen van secundair gegeneraliseerde tonisch-clonische aanvallen te onderzoeken. Patiënten die in alle drie de placebogecontroleerde onderzoeken een secundair gegeneraliseerde tonisch-clonische aanval kregen in de baseline of in de behandelingsperiode, werden in deze analyses opgenomen. Er waren verschillende vergelijkingen van de responsratio die een statistisch significant voordeel voor NEURONTIN lieten zien in vergelijking met placebo en gunstige trends voor bijna alle vergelijkingen.
Analyse van het responspercentage met behulp van gecombineerde gegevens van alle drie de onderzoeken en alle doses (N=162, NEURONTIN; N=89, placebo) toonde ook een significant voordeel voor NEURONTIN ten opzichte van placebo bij het verminderen van de frequentie van secundair gegeneraliseerde tonisch-clonische aanvallen.
In twee van de drie gecontroleerde onderzoeken werd meer dan één dosis NEURONTIN gebruikt. Binnen elk onderzoek lieten de resultaten geen consistent verhoogde respons op de dosis zien. Als we echter over alle onderzoeken heen kijken, is er een trend naar toenemende werkzaamheid bij toenemende dosis duidelijk (zie figuur 4).
Figuur 4. Responderpercentage bij patiënten die NEURONTIN 600 mg kregen, uitgedrukt als een verschil met placebo per dosis en onderzoek: aanvullende therapiestudies bij patiënten ≥12 jaar met gedeeltelijke epileptische aanvallen
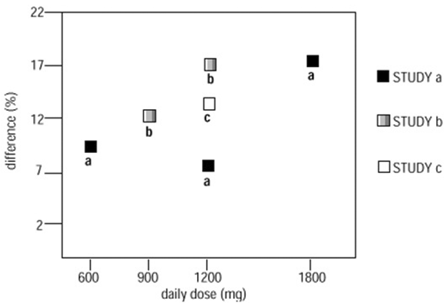
In de figuur is de grootte van het behandelingseffect, gemeten op de Y-as in termen van het verschil in het aandeel van gabapentine en placebo-toegewezen patiënten die een vermindering van 50% of meer in aanvalsfrequentie bereiken vanaf baseline, uitgezet tegen de dagelijkse dosis gabapentine die wordt toegediend (X-as).
Hoewel er geen formele analyse naar geslacht is uitgevoerd, geven schattingen van de respons (responsverhouding) die zijn afgeleid van klinische onderzoeken (398 mannen, 307 vrouwen) aan dat er geen belangrijke sekseverschillen bestaan. Er was geen consistent patroon dat erop wees dat leeftijd enig effect had op de respons op NEURONTIN. Er waren onvoldoende aantallen patiënten van andere rassen dan Kaukasisch om een vergelijking van de werkzaamheid tussen raciale groepen mogelijk te maken.
Een vierde onderzoek bij pediatrische patiënten in de leeftijd van 3 tot 12 jaar vergeleek 25 –35 mg/kg/dag NEURONTIN (N=118) met placebo (N=127). Voor alle partiële aanvallen in de intent-to-treat-populatie was de responsratio statistisch significant beter voor de NEURONTIN-groep (-0,146) dan voor de placebogroep (-0,079). Voor dezelfde populatie was het responspercentage voor NEURONTIN (21%) niet significant verschillend van placebo (18%).
Een onderzoek bij pediatrische patiënten in de leeftijd van 1 maand tot 3 jaar vergeleek 40 mg/kg/dag NEURONTIN (N=38) met placebo (N=38) bij patiënten die ten minste één in de handel verkrijgbaar anti-epilepticum kregen en ten minste één partiële aanval hadden tijdens de screeningsperiode (binnen 2 weken voorafgaand aan baseline). Patiënten hadden tot 48 uur baseline en tot 72 uur dubbelblinde video-EEG-monitoring om het optreden van aanvallen vast te leggen en te tellen. Er waren geen statistisch significante verschillen tussen behandelingen in responsratio of responspercentage.
PATIËNT INFORMATIE
NEURONTIN (Neu ron-tin) (Gabapentine) Capsules, tabletten en orale oplossing
Wat is de belangrijkste informatie die ik over NEURONTIN moet weten?
Stop niet met het innemen van NEURONTIN 300 mg zonder eerst met uw zorgverlener te overleggen.
Plotseling stoppen met NEURONTIN kan ernstige problemen veroorzaken.
NEURONTIN 400 mg kan ernstige bijwerkingen veroorzaken, waaronder:
1. Suïcidale gedachten. Net als andere anti-epileptica kan NEURONTIN 100 mg zelfmoordgedachten of zelfmoordacties veroorzaken bij een zeer klein aantal mensen, ongeveer 1 op 500.
Bel onmiddellijk een zorgverlener als u een van deze symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Hoe kan ik letten op vroege symptomen van zelfmoordgedachten en -acties?
- Besteed aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens.
- Houd alle vervolgbezoeken met uw zorgverlener zoals gepland.
Bel indien nodig uw zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Stop niet met het innemen van NEURONTIN zonder eerst met een zorgverlener te overleggen.
- Plotseling stoppen met NEURONTIN 100 mg kan ernstige problemen veroorzaken. Plotseling stoppen met een geneesmiddel tegen epilepsie bij een patiënt met epilepsie kan aanvallen veroorzaken die niet stoppen (status epilepticus).
- Suïcidale gedachten of acties kunnen worden veroorzaakt door andere dingen dan medicijnen. Als u zelfmoordgedachten of zelfmoordacties heeft, kan uw zorgverlener naar andere oorzaken zoeken.
2. Veranderingen in gedrag en denken - Het gebruik van NEURONTIN 100 mg bij kinderen van 3 tot 12 jaar kan emotionele veranderingen, agressief gedrag, concentratieproblemen, rusteloosheid, veranderingen in schoolprestaties en hyperactiviteit veroorzaken.
3. NEURONTIN kan ernstige of levensbedreigende allergische reacties veroorzaken die uw huid of andere delen van uw lichaam, zoals uw lever of bloedcellen, kunnen aantasten. Dit kan ertoe leiden dat u in het ziekenhuis wordt opgenomen of dat u met NEURONTIN stopt. U kunt al dan niet huiduitslag hebben met een allergische reactie veroorzaakt door NEURONTIN. Bel onmiddellijk een zorgverlener als u een van de volgende symptomen heeft:
- huiduitslag
- netelroos
- moeite met ademhalen
- koorts
- gezwollen klieren die niet weggaan
- zwelling van uw gezicht, lippen, keel of tong
- geel worden van uw huid of van het wit van de ogen
- ongebruikelijke blauwe plekken of bloedingen
- ernstige vermoeidheid of zwakte
- onverwachte spierpijn
- frequente infecties
Deze symptomen kunnen de eerste tekenen zijn van een ernstige reactie. Een zorgverlener moet u onderzoeken om te beslissen of u NEURONTIN moet blijven gebruiken.
4. Ernstige ademhalingsproblemen. Ernstige ademhalingsproblemen kunnen optreden wanneer NEURONTIN wordt ingenomen met andere geneesmiddelen die ernstige slaperigheid of verminderd bewustzijn kunnen veroorzaken, of wanneer het wordt ingenomen door iemand die al ademhalingsproblemen heeft. Let op verhoogde slaperigheid of verminderde ademhaling bij het starten van NEURONTIN 300 mg of wanneer de dosis wordt verhoogd. Schakel direct hulp in als er ademhalingsproblemen optreden.
Wat is NEURONTIN 400 mg?
NEURONTIN 400 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van:
- Pijn van beschadigde zenuwen (postherpetische pijn) die volgt op genezing van gordelroos (een pijnlijke uitslag die optreedt na een herpes zoster-infectie) bij volwassenen.
- Gedeeltelijke aanvallen bij gelijktijdig gebruik met andere geneesmiddelen bij volwassenen en kinderen van 3 jaar en ouder met epileptische aanvallen.
Wie mag NEURONTIN niet gebruiken?
Gebruik NEURONTIN niet als u allergisch bent voor gabapentine of voor één van de andere bestanddelen van NEURONTIN. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in NEURONTIN.
Wat moet ik mijn zorgverlener vertellen voordat ik NEURONTIN 300 mg inneem?
Vertel uw zorgverlener voordat u NEURONTIN 400 mg inneemt als u:
- nierproblemen heeft of heeft gehad of hemodialyse ondergaat
- een depressie, stemmingsproblemen of zelfmoordgedachten of -gedrag heeft of heeft gehad
- diabetes hebben
- ademhalingsproblemen hebben
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of NEURONTIN schadelijk kan zijn voor uw ongeboren baby. Vertel het uw zorgverlener meteen als u zwanger wordt terwijl u NEURONTIN gebruikt. U en uw zorgverlener beslissen of u NEURONTIN 100 mg mag gebruiken terwijl u zwanger bent. Zwangerschapsregister: Als u zwanger wordt terwijl u NEURONTIN gebruikt, overleg dan met uw zorgverlener over registratie bij de North American Antiepileptic Drug (NAAED) Pregnancy Registry. Het doel van dit register is om informatie te verzamelen over de veiligheid van anti-epileptica tijdens de zwangerschap. U kunt zich inschrijven voor dit register door te bellen naar 1-888-233-2334.
- borstvoeding geeft of van plan bent borstvoeding te geven. NEURONTIN kan in de moedermelk terechtkomen. U en uw zorgverlener moeten beslissen hoe u uw baby voedt terwijl u NEURONTIN gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het uw zorgverlener vooral als u opioïde pijnstillers (zoals oxycodon), geneesmiddelen tegen angst (zoals lorazepam) of slapeloosheid (zoals zolpidem) of geneesmiddelen die u slaperig maken, gebruikt.
U kunt een grotere kans hebben op duizeligheid, slaperigheid of ademhalingsproblemen als deze geneesmiddelen samen met NEURONTIN worden ingenomen.
Het gebruik van NEURONTIN 100 mg met bepaalde andere geneesmiddelen kan bijwerkingen veroorzaken of de werking ervan beïnvloeden. Start of stop niet met andere geneesmiddelen zonder overleg met uw zorgverlener.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij en toon deze aan uw zorgverlener en apotheker wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik NEURONTIN 400 mg innemen?
- Neem NEURONTIN precies zoals voorgeschreven. Uw zorgverlener zal u vertellen hoeveel NEURONTIN 600 mg u moet innemen.
- Verander uw dosis NEURONTIN niet zonder met uw zorgverlener te overleggen.
- Als u NEURONTIN-tabletten inneemt en een tablet doormidden breekt, moet de ongebruikte helft van de tablet bij uw volgende geplande dosis worden ingenomen. Halve tabletten die niet binnen 28 dagen na het breken zijn gebruikt, moeten worden weggegooid.
- Neem NEURONTIN-capsules in met water.
- NEURONTIN-tabletten kunnen met of zonder voedsel worden ingenomen. Als u een antacidum gebruikt dat aluminium en magnesium bevat, zoals Maalox®, Mylanta®, Gelusil®, Gaviscon® of Di-Gel®, moet u ten minste 2 uur wachten voordat u uw volgende dosis NEURONTIN inneemt. Als u te veel NEURONTIN 600 mg heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of uw plaatselijke Antigifcentrum op 1-800-222-1222.
Wat moet ik vermijden tijdens het gebruik van NEURONTIN?
- Drink geen alcohol en neem geen andere geneesmiddelen die u slaperig of duizelig maken tijdens het gebruik van NEURONTIN zonder eerst met uw zorgverlener te overleggen. Het gebruik van NEURONTIN 600 mg met alcohol of drugs die slaperigheid of duizeligheid veroorzaken, kan uw slaperigheid of duizeligheid verergeren.
- Rijd niet, bedien geen zware machines of voer geen andere gevaarlijke activiteiten uit totdat u weet welke invloed NEURONTIN 100 mg op u heeft. NEURONTIN 600 mg kan uw denk- en motoriek vertragen.
Wat zijn de mogelijke bijwerkingen van NEURONTIN 300 mg?
NEURONTIN 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
Zien “Wat is de belangrijkste informatie die ik over NEURONTIN moet weten?”
- problemen met autorijden tijdens het gebruik van NEURONTIN. Zie “Wat moet ik vermijden tijdens het gebruik van Neurontin 600 mg?”
- slaperigheid en duizeligheid, die het optreden van accidenteel letsel, waaronder vallen, kunnen vergroten
- De meest voorkomende bijwerkingen van NEURONTIN 100 mg zijn:
- gebrek aan coordinatie
- virale infectie
- zich slaperig voelen
- misselijkheid en overgeven
- moeite met spreken
- tremor
- zwelling, meestal van benen en voeten
- zich moe voelen
- koorts
- schokkerige bewegingen
- moeite met coördinatie
- dubbel zicht
- ongebruikelijke oogbeweging
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van NEURONTIN. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik NEURONTIN bewaren?
- Bewaar NEURONTIN 400 mg capsules en tabletten tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
- Bewaar NEURONTIN 400 mg drank in de koelkast tussen 36 ° F en 46 ° F (2 ° C tot 8 ° C).
Houd NEURONTIN 600 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van NEURONTIN
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik NEURONTIN 300 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef NEURONTIN niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over NEURONTIN samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over NEURONTIN 100 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Ga voor meer informatie naar http://www.pfizer.com of bel 1-800-438-1985.
Wat zijn de ingrediënten in NEURONTIN 400 mg?
Actief ingrediënt: gabapentine
Inactieve ingrediënten in de capsules: lactose, maizena, talk, gelatine, titaniumdioxide en FD&C Blue No. 2.
Het omhulsel van de capsule van 300 mg bevat ook: geel ijzeroxide.
Het capsuleomhulsel van 400 mg bevat ook: rood ijzeroxide en geel ijzeroxide.
Inactieve ingrediënten in de tabletten: poloxameer 407, copovidon, maïszetmeel, magnesiumstearaat, hydroxypropylcellulose, talk en candelillawas
Inactieve ingrediënten in de drank: glycerine, xylitol, gezuiverd water en kunstmatige smaakstoffen.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
