Imuran 50mg, 25mg Azathioprine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Imuran en hoe wordt het gebruikt?
Imuran 25 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van reumatoïde artritis te behandelen en om afstoting van transplantaten te voorkomen. Imuran kan alleen of in combinatie met andere medicijnen worden gebruikt.
Imuran 25 mg behoort tot een klasse geneesmiddelen die DMARD's, immunomodulatoren, worden genoemd; Immunosuppressiva.
Wat zijn de mogelijke bijwerkingen van Imuran?
Imuran 25 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- koorts,
- opgezwollen klieren,
- pijn in het lichaam,
- Nacht zweet,
- niet goed voelen,
- bleke huid,
- uitslag,
- gemakkelijk blauwe plekken of bloedingen,
- koude handen en voeten,
- duizeligheid,
- kortademigheid,
- pijn in uw bovenbuik die kan uitstralen naar uw schouder,
- een vol gevoel na het eten van slechts een kleine hoeveelheid,
- gewichtsverlies,
- tekenen van infectie (koorts, koude rillingen, zwakte, griepsymptomen, keelpijn, hoesten, pijn of een branderig gevoel bij het plassen),
- ernstige misselijkheid,
- braken,
- diarree,
- snelle hartslagen,
- donkere urine, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Imuran 50 mg zijn:
- misselijkheid,
- diarree,
- buikpijn,
- haaruitval, en
- huiduitslag
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Imuran. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
MALIGNITEIT
Chronische immunosuppressie met IMURAN, een purine-antimetaboliet, verhoogt het risico op maligniteit bij mensen. Meldingen van maligniteit omvatten lymfoom na transplantatie en hepatosplenisch T-cellymfoom (HSTCL) bij patiënten met inflammatoire darmaandoeningen. Artsen die dit medicijn gebruiken, moeten goed bekend zijn met dit risico, evenals met het mutagene potentieel voor zowel mannen als vrouwen en met mogelijke hematologische toxiciteiten. Artsen moeten patiënten informeren over het risico op maligniteit met IMURAN. Zien WAARSCHUWINGEN .
OMSCHRIJVING
IMURAN (azathioprine), een immunosuppressieve antimetaboliet, is verkrijgbaar in tabletvorm voor orale toediening. Elke tablet met breukgleuf bevat 50 mg azathioprine en de inactieve ingrediënten lactose, magnesiumstearaat, aardappelzetmeel, povidon en stearinezuur.
Azathioprine is chemisch 6-[(1-methyl-4-nitro-1H-imidazol-5-yl)thio]-1H-purine. De structuurformule van azathioprine is:
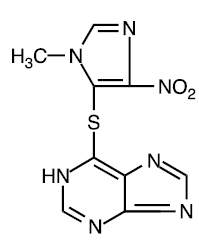
Het is een imidazolylderivaat van 6-mercaptopurine en veel van zijn biologische effecten zijn vergelijkbaar met die van de moederverbinding.
Azathioprine is onoplosbaar in water, maar kan worden opgelost door toevoeging van één molequivalent alkali. Azathioprine is stabiel in oplossing bij neutrale of zure pH, maar hydrolyse tot mercaptopurine vindt plaats in overmaat natriumhydroxide (0,1 N), vooral bij verwarming. Omzetting naar mercaptopurine vindt ook plaats in aanwezigheid van sulfhydrylverbindingen zoals cysteïne, glutathion en waterstofsulfide.
INDICATIES
IMURAN is geïndiceerd als adjuvans voor de preventie van afstoting bij renale homotransplantatie. Het is ook geïndiceerd voor de behandeling van actieve reumatoïde artritis om tekenen en symptomen te verminderen.
Nier homotransplantatie
IMURAN is geïndiceerd als adjuvans voor de preventie van afstoting bij renale homotransplantatie. Ervaring met meer dan 16.000 transplantaties toont een 5-jaarsoverleving van de patiënt van 35% tot 55%, maar dit is afhankelijk van donor, match voor HLA-antigenen, anti-donor of anti-B-cel alloantigeen antilichaam en andere variabelen. Het effect van IMURAN op deze variabelen is niet getest in gecontroleerde onderzoeken.
Reumatoïde artritis
IMURAN is geïndiceerd voor de behandeling van actieve reumatoïde artritis (RA) om tekenen en symptomen te verminderen. Aspirine, niet-steroïde anti-inflammatoire geneesmiddelen en/of lage dosis glucocorticoïden kunnen worden voortgezet tijdens de behandeling met IMURAN. Het gecombineerde gebruik van IMURAN 25 mg met disease modifying anti-reumatic drugs (DMARD's) is niet onderzocht op extra voordeel of onverwachte bijwerkingen. Het gebruik van IMURAN met deze middelen kan niet worden aanbevolen.
DOSERING EN ADMINISTRATIE
TPMT-TESTS KAN GEEN VOLLEDIGE BLOEDTELLER (CBC) MONITORING VERVANGEN BIJ PATINTEN DIE IMURAN ONTVANGEN. TPMT-genotypering of fenotypering kan worden gebruikt om patiënten met afwezige of verminderde TPMT-activiteit te identificeren. Patiënten met lage of afwezige TPMT-activiteit lopen een verhoogd risico op het ontwikkelen van ernstige, levensbedreigende myelotoxiciteit door IMURAN als conventionele doses worden gegeven. Artsen kunnen alternatieve therapieën overwegen voor patiënten met een lage of afwezige TPMT-activiteit (homozygoot voor niet-functionele allelen). IMURAN 25 mg moet met voorzichtigheid worden toegediend aan patiënten met één niet-functioneel allel (heterozygoot) die een risico lopen op verminderde TPMT-activiteit die kan leiden tot toxiciteit als conventionele doses worden gegeven. Dosisverlaging wordt aanbevolen bij patiënten met verminderde TPMT-activiteit. Vroegtijdige stopzetting van het geneesmiddel kan worden overwogen bij patiënten met abnormale CBC-resultaten die niet reageren op dosisverlaging.
Nier homotransplantatie
De dosis IMURAN 50 mg die nodig is om afstoting te voorkomen en toxiciteit tot een minimum te beperken, verschilt per patiënt; dit vereist zorgvuldig beheer. De aanvangsdosis is gewoonlijk 3 tot 5 mg/kg per dag, te beginnen op het moment van transplantatie. IMURAN wordt gewoonlijk als een enkele dagelijkse dosis gegeven op de dag van, en in een minderheid van de gevallen 1 tot 3 dagen vóór de transplantatie. Dosisverlaging tot onderhoudsniveaus van 1 tot 3 mg/kg per dag is gewoonlijk mogelijk. De dosis IMURAN 50 mg mag niet worden verhoogd tot toxische niveaus vanwege dreigende afstoting. Stopzetting kan nodig zijn voor ernstige hematologische of andere toxiciteit, zelfs als afstoting van het homotransplantaat een gevolg kan zijn van stopzetting van het geneesmiddel.
Reumatoïde artritis
IMURAN 50 mg wordt gewoonlijk dagelijks gegeven. De aanvangsdosis dient ongeveer 1,0 mg/kg (50 tot 100 mg) te zijn, gegeven als een enkele dosis of volgens een tweemaal daags schema. De dosis kan worden verhoogd, beginnend bij 6 tot 8 weken en daarna stapsgewijs met tussenpozen van 4 weken, als er geen ernstige toxiciteiten zijn en als de initiële respons onbevredigend is. De dosisverhogingen dienen 0,5 mg/kg per dag te zijn, tot een maximale dosis van 2,5 mg/kg per dag. Therapeutische respons treedt op na enkele weken behandeling, gewoonlijk 6 tot 8; een adequate proefperiode moet minimaal 12 weken duren. Patiënten die na 12 weken niet verbeterd zijn, kunnen als ongevoelig worden beschouwd. IMURAN 50 mg kan langdurig worden voortgezet bij patiënten met klinische respons, maar patiënten moeten zorgvuldig worden gecontroleerd en er moet worden geprobeerd de dosering geleidelijk te verlagen om het risico op toxiciteit te verminderen.
Onderhoudstherapie moet de laagste effectieve dosis zijn en de gegeven dosis kan stapsgewijs worden verlaagd met veranderingen van 0,5 mg/kg of ongeveer 25 mg per dag om de 4 weken, terwijl de andere therapie constant wordt gehouden. De optimale onderhoudsduur van IMURAN 50 mg is niet vastgesteld. IMURAN kan abrupt worden stopgezet, maar vertraagde effecten zijn mogelijk.
Gebruik bij nierfunctiestoornissen
Relatief oligurische patiënten, vooral die met tubulaire necrose in de periode onmiddellijk na de transplantatie, kunnen een vertraagde klaring van IMURAN of zijn metabolieten hebben, kunnen bijzonder gevoelig zijn voor dit geneesmiddel en krijgen gewoonlijk lagere doses.
Procedures voor de juiste hantering en verwijdering van dit immunosuppressieve antimetabolietgeneesmiddel moeten worden overwogen. Er zijn verschillende richtlijnen over dit onderwerp gepubliceerd.25-31 Er is geen algemene overeenstemming dat alle procedures die in de richtlijnen worden aanbevolen, noodzakelijk of passend zijn.
HOE GELEVERD
50 mg overlappende cirkelvormige, gele tot gebroken witte tabletten met breukgleuf bedrukt met "IMURAN" en "50" op elke tablet; fles van 100 ( NDC 65483-590-10).
Bewaren bij 15° tot 25°C (59° tot 77°F) op een droge plaats en beschermen tegen licht.
REFERENTIES
25. Aanbevelingen voor de veilige omgang met parenterale antineoplastische geneesmiddelen. Washington, DC: Afdeling Veiligheid; Klinisch Centrum Apotheekafdeling en Kankerverpleging, National Institute of Health; 1992. Amerikaanse ministerie van Volksgezondheid en Human Services. Public Health Service Publicatie NIH 92-2621.
26. AMA Raad voor Wetenschappelijke Zaken. Richtlijnen voor het omgaan met parenterale antineoplastische middelen. JAMA. 1985; 253:15901592.
27. Nationale studiecommissie voor cytotoxische blootstelling. Aanbevelingen voor het omgaan met cytotoxische middelen. 1987. Verkrijgbaar bij Louis P. Jeffrey, voorzitter, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Klinische Oncologische Vereniging van Australië. Richtlijnen en aanbevelingen voor het veilig omgaan met antineoplastische middelen. MedJ Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Veilig omgaan met chemotherapeutische middelen: een rapport van The Mount Sinai Medical Center. CA Cancer J voor clinici. 1983; 33:258-263.
30. American Society of ziekenhuisapothekers. ASHP-bulletin voor technische bijstand over het omgaan met cytotoxische en gevaarlijke geneesmiddelen. Ben J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA-werkpraktijkrichtlijnen voor personeel dat zich bezighoudt met cytotoxische (antineoplastische) geneesmiddelen. Am J Hosp Pharm, 1996; 43:1193-1204.
Gefabriceerd door Pharmaceutics International, Inc. Hunt Valley, MD 21031 voor Prometheus Laboratories Inc. San Diego, CA 92121. Herzien: februari 2014
BIJWERKINGEN
De belangrijkste en mogelijk ernstige toxische effecten van IMURAN zijn hematologische en gastro-intestinale effecten. De risico's van secundaire infectie en maligniteit zijn ook aanzienlijk (zie: WAARSCHUWINGEN ). De frequentie en ernst van bijwerkingen hangen af van de dosis en de duur van IMURAN, evenals van de onderliggende ziekte van de patiënt of van gelijktijdige therapieën. De incidentie van hematologische toxiciteit en neoplasie bij groepen ontvangers van nierhomotransplantaten is significant hoger dan die in onderzoeken waarbij IMURAN 25 mg werd gebruikt voor reumatoïde artritis. De relatieve incidenties in klinische onderzoeken worden hieronder samengevat:
hematologisch
Leukopenie en/of trombocytopenie zijn dosisafhankelijk en kunnen laat in de loop van de behandeling met IMURAN optreden. Dosisverlaging of tijdelijke stopzetting kan leiden tot omkering van deze toxiciteiten. Infectie kan optreden als secundaire manifestatie van beenmergsuppressie of leukopenie, maar de incidentie van infectie bij renale homotransplantatie is 30 tot 60 keer hoger dan bij reumatoïde artritis. Anemieën, waaronder macrocytische anemie, en/of bloedingen zijn gemeld.
TPMT-genotypering of fenotypering kan helpen bij het identificeren van patiënten met lage of afwezige TPMT-activiteit (homozygoot voor niet-functionele allelen) die een verhoogd risico lopen op ernstige, levensbedreigende myelosuppressie door IMURAN. Zien KLINISCHE FARMACOLOGIE , WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN : Laboratorium testen . Overlijden geassocieerd met pancytopenie is gemeld bij patiënten met afwezige TPMT-activiteit die azathioprine kregen.6,20
gastro-intestinaal
Misselijkheid en braken kunnen optreden binnen de eerste paar maanden van de behandeling met IMURAN 50 mg en kwamen voor bij ongeveer 12% van de 676 patiënten met reumatoïde artritis. De frequentie van maagstoornissen kan vaak worden verminderd door toediening van het geneesmiddel in verdeelde doses en/of na de maaltijd. Bij sommige patiënten kunnen misselijkheid en braken echter ernstig zijn en gepaard gaan met symptomen zoals diarree, koorts, malaise en spierpijn (zie PREVENTIEVE MAATREGELEN ). Braken met buikpijn kan zelden voorkomen bij een overgevoeligheids pancreatitis. Het is bekend dat hepatotoxiciteit, die zich manifesteert door verhoging van serumalkalinefosfatase, bilirubine en/of serumtransaminasen, optreedt na gebruik van azathioprine, voornamelijk bij ontvangers van allotransplantaten. Levertoxiciteit is soms (minder dan 1%) bij patiënten met reumatoïde artritis. Levertoxiciteit na transplantatie treedt meestal op binnen 6 maanden na transplantatie en is over het algemeen reversibel na onderbreking van IMURAN. Een zeldzame, maar levensbedreigende veno-occlusieve leverziekte geassocieerd met chronische toediening van azathioprine is beschreven bij transplantatiepatiënten en bij één patiënt die IMURAN kreeg voor panuveïtis.21,22,23 Periodieke meting van serumtransaminasen, alkalische fosfatase en bilirubine is geïndiceerd voor vroege detectie van hepatotoxiciteit. Als klinisch een veno-occlusieve leverziekte wordt vermoed, moet IMURAN permanent worden stopgezet.
anderen
Bijkomende bijwerkingen met een lage frequentie zijn gemeld. Deze omvatten huiduitslag, alopecia, koorts, artralgieën, diarree, steatorroe, negatieve stikstofbalans, reversibele interstitiële pneumonitis, hepatosplenisch T-cellymfoom (zie WAARSCHUWINGEN – maligniteit ), en Sweet's Syndroom (acute febriele neutrofiele dermatose).
DRUG-INTERACTIES
Gebruik met Allopurinol
Een van de routes voor inactivatie van azathioprine wordt geremd door allopurinol. Bij patiënten die gelijktijdig IMURAN 50 mg en allopurinol krijgen, moet de dosis IMURAN 50 mg worden verlaagd tot ongeveer 1/3 tot 1/4 van de gebruikelijke dosis. Het wordt aanbevolen om een verdere dosisverlaging of alternatieve therapieën te overwegen voor patiënten met lage of afwezige TPMT-activiteit die IMURAN 50 mg en allopurinol krijgen, omdat zowel de TPMT- als XO-inactiveringsroutes worden beïnvloed. Zien KLINISCHE FARMACOLOGIE , WAARSCHUWINGEN , PREVENTIEVE MAATREGELEN : Laboratorium testen en ONGEWENSTE REACTIES secties.
Gebruik met aminosalicylaten
Er is in vitro bewijs dat aminosalicylaatderivaten (bijv. sulfasalazine, mesalazine of olsalazine) het TPMT-enzym remmen. Gelijktijdig gebruik van deze middelen met IMURAN 50 mg moet met voorzichtigheid gebeuren.
Gebruik met andere middelen die myelopoëse beïnvloeden
Geneesmiddelen die de productie van leukocyten kunnen beïnvloeden, waaronder cotrimoxazol, kunnen leiden tot overdreven leukopenie, vooral bij ontvangers van een niertransplantatie.
Gebruik met angiotensine-converterende enzymremmers
Van het gebruik van angiotensine-converterende enzymremmers om hypertensie onder controle te houden bij patiënten die azathioprine gebruiken, is gemeld dat het anemie en ernstige leukopenie induceert.
Gebruik met Warfarine
IMURAN kan het anticoagulerende effect van warfarine remmen.
Gebruik met ribavirine
Van het gebruik van ribavirine voor hepatitis C bij patiënten die azathioprine krijgen, is gemeld dat het ernstige pancytopenie induceert en het risico op azathioprine-gerelateerde myelotoxiciteit kan verhogen. Inosinemonofosfaatdehydrogenase (IMDH) is vereist voor een van de metabole routes van azathioprine. Van ribavirine is bekend dat het IMDH remt, wat leidt tot accumulatie van een azathioprinemetaboliet, 6-methylthioionosinemonofosfaat (6MTITP), dat geassocieerd is met myelotoxiciteit (neutropenie, trombocytopenie en anemie). Bij patiënten die azathioprine met ribavirine krijgen, moet het volledige bloedbeeld, inclusief het aantal bloedplaatjes, wekelijks worden gecontroleerd gedurende de eerste maand, tweemaal per maand gedurende de tweede en derde maand van de behandeling, daarna maandelijks of vaker als de dosering of andere therapiewijzigingen nodig zijn.
REFERENTIES
6. Gegevens in het bestand, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Azathioprine-geïnduceerde myelosuppressie bij harttransplantatiepatiënten met thiopurinemethyltransferasedeficiëntie. Lancet. 1993; 341:436.
21. Lees AE, Wiesner RH, LaBrecque DR, et al. Hepatische veno-occlusieve ziekte geassocieerd met niertransplantatie en azathioprinetherapie. Ann Stagiair Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azathioprine en hepatische veno-occlusieve ziekte bij niertransplantatiepatiënten. Gastro-enterologie. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Veno-occlusieve leverziekte bij patiënten die immunosuppressieve therapie krijgen. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
WAARSCHUWINGEN
maligniteit
Patiënten die immunosuppressiva krijgen, waaronder IMURAN 50 mg, lopen een verhoogd risico op het ontwikkelen van lymfoom en andere maligniteiten, met name van de huid. Artsen moeten patiënten informeren over het risico op maligniteit met IMURAN. Zoals gebruikelijk bij patiënten met een verhoogd risico op huidkanker, moet blootstelling aan zonlicht en ultraviolet licht worden beperkt door het dragen van beschermende kleding en het gebruik van een zonnebrandcrème met een hoge beschermingsfactor.
Post-transplantatie
Van niertransplantatiepatiënten is bekend dat ze een verhoogd risico hebben op maligniteiten, voornamelijk huidkanker en reticulumcel- of lymfomateuze tumoren. Het risico op lymfomen na transplantatie kan verhoogd zijn bij patiënten die een agressieve behandeling krijgen met immunosuppressiva, waaronder IMURAN. Daarom moet immunosuppressieve medicamenteuze behandeling op de laagste effectieve niveaus worden gehouden.
Reumatoïde artritis
Er is informatie beschikbaar over het risico op maligniteit bij het gebruik van IMURAN 50 mg bij reumatoïde artritis (zie ONGEWENSTE REACTIES ). Het was niet mogelijk om het precieze risico op maligniteit als gevolg van IMURAN te definiëren. De gegevens suggereren dat het risico verhoogd kan zijn bij patiënten met reumatoïde artritis, hoewel lager dan bij niertransplantatiepatiënten. Acute myeloïde leukemie en solide tumoren zijn echter gemeld bij patiënten met reumatoïde artritis die IMURAN hebben gekregen.
Inflammatoire darmziekte
Postmarketinggevallen van hepatosplenisch T-cellymfoom (HSTCL), een zeldzaam type T-cellymfoom, zijn gemeld bij patiënten die met IMURAN werden behandeld. Deze gevallen hadden een zeer agressief ziekteverloop en waren fataal. De meeste gemelde gevallen zijn opgetreden bij patiënten met de ziekte van Crohn of colitis ulcerosa en de meerderheid was bij adolescenten en jongvolwassen mannen. Sommige patiënten werden behandeld met IMURAN als monotherapie en sommige waren gelijktijdig behandeld met een TNFα-blokker bij of voorafgaand aan de diagnose. De veiligheid en werkzaamheid van IMURAN 25 mg voor de behandeling van de ziekte van Crohn en colitis ulcerosa zijn niet vastgesteld.
Cytopenieën
Ernstige leukopenie, trombocytopenie, anemieën waaronder macrocytische anemie en/of pancytopenie kunnen optreden bij patiënten die met IMURAN worden behandeld. Ernstige beenmergsuppressie kan ook optreden. Patiënten met intermediaire thiopurine-S-methyltransferase (TPMT) -activiteit kunnen een verhoogd risico op myelotoxiciteit hebben als ze conventionele doses IMURAN krijgen. Patiënten met lage of afwezige TPMT-activiteit lopen een verhoogd risico op het ontwikkelen van ernstige, levensbedreigende myelotoxiciteit als ze conventionele doses IMURAN krijgen. TPMT-genotypering of fenotypering kan helpen bij het identificeren van patiënten met een verhoogd risico op het ontwikkelen van IMURAN 50 mg-toxiciteit.2-9 (Zie PREVENTIEVE MAATREGELEN : Laboratorium testen ). Hematologische toxiciteiten zijn dosisgerelateerd en kunnen ernstiger zijn bij niertransplantatiepatiënten bij wie de homotransplantaat afstoting ondergaat. Er wordt gesuggereerd dat patiënten die IMURAN gebruiken een volledig bloedbeeld hebben, inclusief het aantal bloedplaatjes, wekelijks gedurende de eerste maand, tweemaal per maand tijdens de tweede en derde maand van de behandeling, daarna maandelijks of vaker als dosisaanpassingen of andere therapiewijzigingen nodig zijn. Er kan een vertraagde hematologische onderdrukking optreden. Een snelle verlaging van de dosering of tijdelijke stopzetting van het geneesmiddel kan nodig zijn als er sprake is van een snelle daling van of een aanhoudend laag aantal leukocyten, of als er ander bewijs is van beenmergdepressie. Leukopenie correleert niet met therapeutisch effect; daarom mag de dosis niet opzettelijk worden verhoogd om het aantal witte bloedcellen te verlagen.
Ernstige infecties
Patiënten die immunosuppressiva krijgen, waaronder 25 mg Imuran, lopen een verhoogd risico op bacteriële, virale, schimmel-, protozoaire en opportunistische infecties, waaronder reactivering van latente infecties. Deze infecties kunnen leiden tot ernstige, waaronder fatale gevolgen.
Progressieve multifocale leuko-encefalopathie
Gevallen van JC-virus-geassocieerde infectie resulterend in progressieve multifocale leuko-encefalopathie (PML), soms fataal, zijn gemeld bij patiënten die werden behandeld met immunosuppressiva, waaronder Imuran. Risicofactoren voor PML zijn onder meer behandeling met immunosuppressieve therapieën en verslechtering van de immuunfunctie. Overweeg de diagnose van PML bij elke patiënt met nieuw optredende neurologische manifestaties en overweeg overleg met een neuroloog zoals klinisch geïndiceerd. Overweeg de hoeveelheid immunosuppressie te verminderen bij patiënten die PML ontwikkelen. Houd bij transplantatiepatiënten rekening met het risico dat de verminderde immunosuppressie vormt voor het transplantaat.
Effect op sperma bij dieren
Van IMURAN is gemeld dat het bij muizen een tijdelijke depressie van de spermatogenese en een vermindering van de levensvatbaarheid van het sperma en het aantal zaadcellen veroorzaakt bij doses die 10 keer hoger zijn dan de therapeutische dosis voor mensen;10 een verminderd percentage vruchtbare paringen trad op wanneer dieren 5 mg/kg kregen.11
Zwangerschap
Zwangerschap Categorie D
IMURAN kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. IMURAN 50 mg mag niet tijdens de zwangerschap worden gegeven zonder een zorgvuldige afweging van de risico's en voordelen. Indien mogelijk moet het gebruik van IMURAN bij zwangere patiënten worden vermeden. Dit medicijn mag niet worden gebruikt voor de behandeling van reumatoïde artritis bij zwangere vrouwen
IMURAN is teratogeen bij konijnen en muizen wanneer het wordt gegeven in doses die overeenkomen met de dosis voor de mens (5 mg/kg per dag). Afwijkingen omvatten misvormingen van het skelet en viscerale anomalieën
Beperkte immunologische en andere afwijkingen zijn opgetreden bij enkele zuigelingen geboren uit ontvangers van niertransplantaten op IMURAN. In een gedetailleerd casusrapport13 werden gedocumenteerde lymfopenie, verminderde IgG- en IgM-spiegels, CMV-infectie en een verminderde thymusschaduw opgemerkt bij een baby van een moeder die 150 mg azathioprine en 30 mg prednison per dag kreeg tijdens de zwangerschap. Na 10 weken waren de meeste kenmerken genormaliseerd. DeWitte et al. rapporteerden pancytopenie en ernstige immuundeficiëntie bij een premature baby wiens moeder dagelijks 125 mg azathioprine en 12,5 mg prednison kreeg.14 Er zijn twee gepubliceerde rapporten van abnormale lichamelijke bevindingen. Williamson en Karp beschreven een baby geboren met preaxiale polydactylie wiens moeder azathioprine 200 mg per dag kreeg en prednison 20 mg om de andere dag tijdens de zwangerschap.15 Tallent et al beschreven een baby met een grote myelomeningocele in de bovenste lumbale regio, bilaterale ontwrichte heupen en bilaterale talipes equinovarus. De vader kreeg langdurige azathioprinetherapie
Voordeel versus risico moeten zorgvuldig worden afgewogen vóór gebruik van IMURAN bij patiënten in de vruchtbare leeftijd. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus. Vrouwen in de vruchtbare leeftijd moeten worden geadviseerd niet zwanger te worden.
PREVENTIEVE MAATREGELEN
Algemeen
Er is melding gemaakt van een gastro-intestinale overgevoeligheidsreactie die wordt gekenmerkt door ernstige misselijkheid en braken. Deze symptomen kunnen ook gepaard gaan met diarree, huiduitslag, koorts, malaise, spierpijn, verhoogde leverenzymen en soms hypotensie. Symptomen van gastro-intestinale toxiciteit ontwikkelen zich meestal binnen de eerste paar weken van de behandeling met IMURAN 25 mg en zijn reversibel na stopzetting van het geneesmiddel. De reactie kan binnen enkele uren na hernieuwde blootstelling met een enkele dosis IMURAN terugkeren.
Laboratorium testen
Volledige bloedtelling (CBC) bewaking
Patiënten die IMURAN 25 mg gebruiken, moeten een volledig bloedbeeld hebben, inclusief het aantal bloedplaatjes, wekelijks gedurende de eerste maand, tweemaal per maand tijdens de tweede en derde maand van de behandeling, daarna maandelijks of vaker als dosisaanpassingen of andere therapiewijzigingen nodig zijn.
TPMT-testen
Het wordt aanbevolen om patiënten met genotype of fenotype te overwegen voor TPMT. Methoden voor fenotypering en genotypering zijn in de handel verkrijgbaar. De meest voorkomende niet-functionele allelen die geassocieerd zijn met verminderde niveaus van TPMT-activiteit zijn TPMT*2, TPMT*3A en TPMT*3C. Patiënten met twee niet-functionele allelen (homozygoot) hebben een lage of afwezige TPMT-activiteit en patiënten met één niet-functioneel allel (heterozygoot) hebben een tussenliggende activiteit. Nauwkeurige fenotypering (TPMT-activiteit van rode bloedcellen) is niet mogelijk bij patiënten die recentelijk een bloedtransfusie hebben gekregen. TPMT-testen kunnen ook worden overwogen bij patiënten met abnormale CBC-resultaten die niet reageren op dosisverlaging. Vroegtijdige stopzetting van het geneesmiddel bij deze patiënten is raadzaam. TPMT-TESTS KAN GEEN VOLLEDIGE BLOEDTELLER (CBC) MONITORING VERVANGEN BIJ PATINTEN DIE IMURAN ONTVANGEN. Zien KLINISCHE FARMACOLOGIE , WAARSCHUWINGEN , ONGEWENSTE REACTIES en DOSERING EN ADMINISTRATIE secties.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Zien WAARSCHUWINGEN sectie.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie D. Zien WAARSCHUWINGEN sectie.
Moeders die borstvoeding geven
Het gebruik van IMURAN 25 mg bij moeders die borstvoeding geven wordt niet aanbevolen. Azathioprine of zijn metabolieten worden in lage concentraties overgedragen, zowel via de placenta als in de moedermelk.17,18,19 Vanwege het potentieel voor tumorigeniciteit dat is aangetoond voor azathioprine, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met de belang van het medicijn voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid van azathioprine bij pediatrische patiënten zijn niet vastgesteld.
REFERENTIES
2. Weinshilboum R. Thiopurine farmacogenetica: klinische en moleculaire studies van thiopurine methyltransferase. Geneesmiddel Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. De thiopurine S-methyltransferase-genlocus - implicaties voor klinische farmacogenomica. Farmacogenomie. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopenie gerelateerd aan azathioprine - een enzymdeficiëntie veroorzaakt door een veel voorkomend genetisch polymorfisme: een overzicht. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Verminderde thiopurine-methyltransferase-activiteit en ontwikkeling van bijwerkingen van behandeling met azathioprine bij patiënten met reumatoïde artritis. Artritis Reum. 1998; 41:18581866.
6. Gegevens in het bestand, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Moleculaire diagnose van thiopurine S-methyltransferase-deficiëntie: genetische basis voor azathioprine- en mercaptopurine-intolerantie. Ann Stagiair Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Thiopurine-methyltransferase-genotype voorspelt therapiebeperkende ernstige toxiciteit van azathioprine. Ann Stagiair Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevantie van de thiopurine-methyltransferasestatus bij reumatologiepatiënten die azathioprine krijgen. Reumatologie. 2004; 43:13-18.
10. Clark JM. De mutageniteit van azathioprine bij muizen, Drosophila melanogaster en Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Gegevens in het bestand, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Zwangerschap na niertransplantatie. Ann Stagiair Med. 1975; 82:113-114. Redactienotities.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Effecten op de pasgeborene van prednison en azathioprine toegediend aan de moeder tijdens de zwangerschap. J Kinderarts. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatale pancytopenie en ernstige gecombineerde immunodeficiëntie geassocieerd met prenatale toediening van azathioprine en prednison. J Kinderarts. 1984; 105:625-628.
15. Williamson RA, Karp LE. Azathioprine teratogeniteit: literatuuroverzicht en casusrapport. Obstet Gynaec. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Geboorteafwijkingen bij kind van mannelijke ontvanger van niertransplantatie. JAMA. 1970; 211: 1854-1855.
17. Gegevens in het dossier, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunosuppressie tijdens de zwangerschap: overdracht van azathioprine en zijn metabolieten van de moeder op de foetus. Ben J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Borstvoeding na niertransplantatie. Transplantatieproc. 1982; 14: 605-609.
OVERDOSERING
De orale LD50's voor enkelvoudige doses IMURAN 50 mg bij muizen en ratten zijn respectievelijk 2500 mg/kg en 400 mg/kg. Zeer hoge doses van deze antimetaboliet kunnen leiden tot beenmerghypoplasie, bloeding, infectie en overlijden. Ongeveer 30% van IMURAN wordt gebonden aan serumeiwitten, maar ongeveer 45% wordt verwijderd tijdens een 8 uur durende hemodialyse.24 Er is een enkel geval gemeld van een niertransplantatiepatiënt die een enkele dosis van 7500 mg IMURAN had ingenomen. De onmiddellijke toxische reacties waren misselijkheid, braken en diarree, gevolgd door milde leukopenie en milde afwijkingen in de leverfunctie. Het aantal witte bloedcellen, SGOT en bilirubine waren 6 dagen na de overdosis weer normaal.
CONTRA-INDICATIES
IMURAN 25 mg mag niet worden gegeven aan patiënten die overgevoelig zijn gebleken voor het geneesmiddel. IMURAN mag niet worden gebruikt voor de behandeling van reumatoïde artritis bij zwangere vrouwen. Patiënten met reumatoïde artritis die eerder zijn behandeld met alkylerende middelen (cyclofosfamide, chloorambucil, melfalan of andere) kunnen een onbetaalbaar risico op maligniteit hebben als ze worden behandeld met IMURAN.
REFERENTIES
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmacokinetiek van azathioprine onder hemodialyse. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLINISCHE FARMACOLOGIE
Azathioprine wordt goed geabsorbeerd na orale toediening. Maximale serumradioactiviteit treedt op 1 tot 2 uur na oraal 35S-azathioprine en vervalt met een halfwaardetijd van 5 uur. Dit is geen schatting van de halfwaardetijd van azathioprine zelf, maar is de vervalsnelheid voor alle 35S-bevattende metabolieten van het geneesmiddel. Vanwege het uitgebreide metabolisme is slechts een fractie van de radioactiviteit aanwezig als azathioprine. Gebruikelijke doses produceren bloedspiegels van azathioprine en van daaruit afgeleide mercaptopurine, die laag zijn ( OVERDOSERING .
Azathioprine wordt gemetaboliseerd tot 6-mercaptopurine (6-MP). Beide verbindingen worden snel uit het bloed geëlimineerd en worden geoxideerd of gemethyleerd in erytrocyten en lever; na 8 uur is geen azathioprine of mercaptopurine in de urine aantoonbaar. Activering van 6-mercaptopurine vindt plaats via hypoxanthine-guanine-fosforibosyltransferase (HGPRT) en een reeks multi-enzymatische processen waarbij kinasen betrokken zijn om 6-thioguanine-nucleotiden (6-TGN's) als belangrijkste metabolieten te vormen (zie Metabolismeschema in figuur 1 ). De cytotoxiciteit van azathioprine is gedeeltelijk te wijten aan de opname van 6-TGN in DNA.
6-MP ondergaat twee belangrijke inactivatieroutes (Figuur 1). Een daarvan is thiolmethylering, die wordt gekatalyseerd door het enzym thiopurine S-methyltransferase (TPMT), om de inactieve metaboliet methyl-6-MP (6-MeMP) te vormen. TPMT-activiteit wordt gecontroleerd door een genetisch polymorfisme.1,2,3 Voor blanken en Afro-Amerikanen erft ongeveer 10% van de bevolking één niet-functioneel TPMT-allel (heterozygoot) dat intermediaire TPMT-activiteit verleent, en 0,3% erft twee niet-functionele TPMT-allel allelen (homozygoot) voor lage of afwezige TPMT-activiteit. Niet-functionele allelen komen minder vaak voor bij Aziaten. TPMT-activiteit correleert omgekeerd met 6-TGN-niveaus in erytrocyten en vermoedelijk andere hematopoëtische weefsels, aangezien deze cellen verwaarloosbare xanthine-oxidase (betrokken bij de andere inactivatieroute)-activiteiten hebben, waardoor TPMT-methylatie de enige inactivatieroute blijft. Patiënten met intermediaire TPMT-activiteit kunnen een verhoogd risico op myelotoxiciteit hebben als ze conventionele doses IMURAN krijgen. Patiënten met lage of afwezige TPMT-activiteit lopen een verhoogd risico op het ontwikkelen van ernstige, levensbedreigende myelotoxiciteit als ze conventionele doses IMURAN krijgen.4-9 TPMT-genotypering of -fenotypering (rode-bloedcel-TPMT-activiteit) kan helpen bij het identificeren van patiënten met een verhoogde risico op het ontwikkelen van toxiciteit van IMURAN 25 mg.2,3,7,8,9 Nauwkeurige fenotypering (TPMT-activiteit van rode bloedcellen) is niet mogelijk bij patiënten die recentelijk een bloedtransfusie hebben gekregen. Zien WAARSCHUWINGEN , PREVENTIEVE MAATREGELEN : DRUG-INTERACTIES , PREVENTIEVE MAATREGELEN : Laboratorium testen en ONGEWENSTE REACTIES secties.
Figuur 1 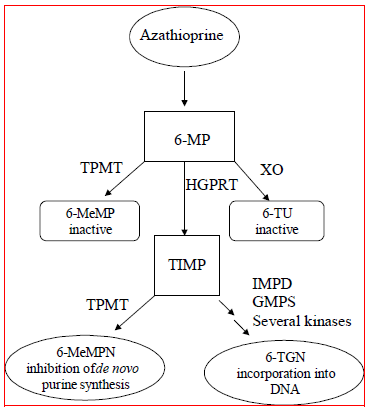 Figuur 1. Metabolismeroute van azathioprine: concurrerende routes resulteren in inactivatie door TPMT of XO, of incorporatie van cytotoxische nucleotiden in DNA.
Figuur 1. Metabolismeroute van azathioprine: concurrerende routes resulteren in inactivatie door TPMT of XO, of incorporatie van cytotoxische nucleotiden in DNA.
GMPS: Guanosinemonofosfaatsynthetase; HGPRT: Hypoxanthine-guanine-fosforibosyl-transferase; IMPD: Inosinemonofosfaatdehydrogenase; MeMP: Methylmercaptopurine; MeMPN: Methylmercaptopurine-nucleotide; TGN: Thioguanine-nucleotiden; TIMP: Thioinosinemonofosfaat; TPMT: Thiopurine S-methyltransferase; TU Thiuurzuur; XO: Xanthine-oxidase (aangepast van Pharmacogenomics 2002; 3:89-98; en Cancer Res 2001; 61:5810-5816.)
Een andere inactiveringsroute is oxidatie, die wordt gekatalyseerd door xanthine-oxidase (XO) om 6-thiourzuur te vormen. De remming van xanthine-oxidase bij patiënten die allopurinol (ZYLOPRIM®) krijgen, is de basis voor de vereiste dosisverlaging van azathioprine bij deze patiënten (zie PREVENTIEVE MAATREGELEN : DRUG-INTERACTIES ). De verhoudingen van metabolieten zijn verschillend bij individuele patiënten, en dit verklaart vermoedelijk de variabele omvang en duur van de geneesmiddeleffecten. Nierklaring is waarschijnlijk niet belangrijk bij het voorspellen van biologische werkzaamheid of toxiciteit, hoewel dosisverlaging wordt toegepast bij patiënten met een slechte nierfunctie.
Homograft Overleving
Het gebruik van azathioprine voor het remmen van de afstoting van niertransplantaten is goed ingeburgerd, de mechanismen voor deze werking zijn enigszins onduidelijk. Het medicijn onderdrukt overgevoeligheid van het celgemedieerde type en veroorzaakt variabele veranderingen in de productie van antilichamen. Onderdrukking van T-celeffecten, inclusief ablatie van T-celsuppressie, is afhankelijk van de tijdelijke relatie met antigene stimulus of implantatie. Dit middel heeft weinig effect op gevestigde transplantaatafstotingen of secundaire reacties.
Veranderingen in specifieke immuunresponsen of immunologische functies bij ontvangers van transplantaten zijn moeilijk specifiek te relateren aan immunosuppressie door azathioprine. Deze patiënten hebben subnormale reacties op vaccins, lage aantallen T-cellen en abnormale fagocytose door perifere bloedcellen, maar hun mitogene reacties, serumimmunoglobulinen en secundaire antilichaamreacties zijn gewoonlijk normaal.
Immuno-inflammatoire respons
Azathioprine onderdrukt ziekteverschijnselen en onderliggende pathologie in diermodellen van auto-immuunziekten. De ernst van adjuvante artritis wordt bijvoorbeeld verminderd door azathioprine.
De mechanismen waardoor azathioprine auto-immuunziekten beïnvloedt, zijn niet bekend. Azathioprine is immunosuppressief, vertraagde overgevoeligheid en cellulaire cytotoxiciteitstests worden in grotere mate onderdrukt dan antilichaamresponsen. In het rattenmodel van adjuvante artritis is aangetoond dat azathioprine de lymfeklierhyperplasie remt, die voorafgaat aan het begin van de tekenen van de ziekte. Zowel de immunosuppressieve als de therapeutische effecten in diermodellen zijn dosisgerelateerd. Azathioprine wordt beschouwd als een langzaam werkend geneesmiddel en de effecten kunnen aanhouden nadat het geneesmiddel is stopgezet.
REFERENTIES
1. Lennard L. De klinische farmacologie van 6-mercaptopurine. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Thiopurine farmacogenetica: klinische en moleculaire studies van thiopurine methyltransferase. Geneesmiddel Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. De thiopurine S-methyltransferase-genlocus - implicaties voor klinische farmacogenomica. Farmacogenomie. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopenie gerelateerd aan azathioprine - een enzymdeficiëntie veroorzaakt door een veel voorkomend genetisch polymorfisme: een overzicht. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Verminderde thiopurine-methyltransferase-activiteit en ontwikkeling van bijwerkingen van behandeling met azathioprine bij patiënten met reumatoïde artritis. Artritis Reum. 1998; 41:18581866.
6. Gegevens in het bestand, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Moleculaire diagnose van thiopurine S-methyltransferase-deficiëntie: genetische basis voor azathioprine- en mercaptopurine-intolerantie. Ann Stagiair Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Thiopurine-methyltransferase-genotype voorspelt therapiebeperkende ernstige toxiciteit van azathioprine. Ann Stagiair Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevantie van de thiopurine-methyltransferasestatus bij reumatologiepatiënten die azathioprine krijgen. Reumatologie. 2004; 43:13-18.
PATIËNT INFORMATIE
Patiënten die met IMURAN worden gestart, moeten worden geïnformeerd over de noodzaak van periodieke bloedtellingen terwijl ze het geneesmiddel krijgen en moeten worden aangemoedigd om ongebruikelijke bloedingen of blauwe plekken aan hun arts te melden. Ze moeten worden geïnformeerd over het infectiegevaar terwijl ze IMURAN krijgen en moeten worden gevraagd om tekenen en symptomen van infectie aan hun arts te melden. Zorgvuldige doseringsinstructies moeten aan de patiënt worden gegeven, vooral wanneer IMURAN wordt toegediend in aanwezigheid van een verminderde nierfunctie of gelijktijdig met allopurinol (zie DRUG-INTERACTIES subsectie en DOSERING EN ADMINISTRATIE ). Patiënten moeten worden geïnformeerd over de mogelijke risico's van het gebruik van IMURAN 50 mg tijdens de zwangerschap en tijdens de borstvoedingsperiode. Het verhoogde risico op maligniteit na behandeling met IMURAN moet aan de patiënt worden uitgelegd.
