Maxalt 5mg, 10mg Rizatriptan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Maxalt en hoe wordt het gebruikt?
Maxalt is een receptgeneesmiddel dat wordt gebruikt om de symptomen van migrainehoofdpijn te behandelen. Maxalt 10 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Maxalt behoort tot een klasse geneesmiddelen die serotonine 5-HT-receptoragonisten worden genoemd; Antimigraine middelen.
Het is niet bekend of Maxalt 5 mg veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Maxalt?
Maxalt kan ernstige bijwerkingen veroorzaken, waaronder:
- plotselinge en hevige buikpijn,
- bloederige diarree,
- koud gevoel,
- gevoelloosheid in uw voeten en handen,
- ernstige hoofdpijn,
- wazig zien,
- bonzen in je nek of oren,
- pijn op de borst of druk,
- pijn die zich uitbreidt naar uw kaak of schouder,
- misselijkheid,
- zweten,
- agitatie,
- hallucinaties,
- koorts,
- rillend,
- snelle hartslag,
- Spierstijfheid,
- spiertrekkingen,
- verlies van coördinatie,
- misselijkheid,
- verlies van coördinatie,
- braken,
- diarree,
- plotselinge gevoelloosheid of zwakte (vooral aan één kant van het lichaam),
- plotselinge ernstige hoofdpijn,
- onduidelijke spraak, en
- problemen met zicht of evenwicht
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Maxalt zijn:
- duizeligheid,
- slaperigheid,
- moe voelen, en
- pijn of een drukkend gevoel in uw keel of borst
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Maxalt. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
MAXALT 10 mg bevat rizatriptanbenzoaat, een selectieve 5-hydroxytryptamine1B/1D (5-HT1B/1D)-receptoragonist.
Rizatriptanbenzoaat wordt chemisch beschreven als: N,N-dimethyl-5-(1H-1,2,4-triazool-1-ylmethyl)-1Hindol-3-ethanaminemonobenzoaat en de structuurformule is:
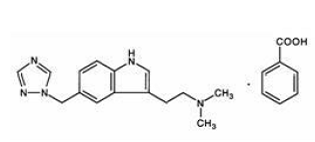
De empirische formule is C15H19N5•C7H6O2, wat een molecuulgewicht van de vrije base van 269,4 vertegenwoordigt. Rizatriptanbenzoaat is een witte tot gebroken witte, kristallijne vaste stof die oplosbaar is in water bij ongeveer 42 mg per ml (uitgedrukt als vrije base) bij 25°C.
MAXALT 5 mg tabletten en MAXALT-MLT oraal uiteenvallende tabletten zijn beschikbaar voor orale toediening in sterkten van 5 en 10 mg (respectievelijk 7,265 mg of 14,53 mg van het benzoaatzout). Elke samengeperste tablet bevat de volgende inactieve ingrediënten: lactosemonohydraat, microkristallijne cellulose, gepregelatiniseerd zetmeel, ijzeroxide (rood) en magnesiumstearaat. Elke gevriesdroogde oraal desintegrerende tablet bevat de volgende inactieve ingrediënten: gelatine, mannitol, glycine, aspartaam en pepermuntsmaak.
INDICATIES
MAXALT® en MAXALT-MLT® zijn geïndiceerd voor de acute behandeling van migraine met of zonder aura bij volwassenen en bij pediatrische patiënten van 6 tot 17 jaar.
Beperkingen van gebruik
- MAXALT mag alleen worden gebruikt als een duidelijke diagnose van migraine is vastgesteld. Als een patiënt niet reageert op de eerste migraineaanval die wordt behandeld met MAXALT 10 mg, moet de diagnose migraine worden heroverwogen voordat MAXALT 5 mg wordt toegediend om eventuele volgende aanvallen te behandelen.
- MAXALT 10 mg is niet geïndiceerd voor gebruik bij de behandeling van hemiplegische of basilaire migraine [zie: CONTRA-INDICATIES ].
- MAXALT 10 mg is niet geïndiceerd voor de preventie van migraineaanvallen.
- De veiligheid en werkzaamheid van MAXALT 5 mg zijn niet vastgesteld voor clusterhoofdpijn.
DOSERING EN ADMINISTRATIE
Doseringsinformatie bij volwassenen
De aanbevolen startdosering van MAXALT is 5 mg of 10 mg voor de acute behandeling van migraine bij volwassenen. De dosis van 10 mg kan een groter effect hebben dan de dosis van 5 mg, maar kan een groter risico op bijwerkingen hebben [zie: Klinische studies ].
Opnieuw doseren bij volwassenen
Hoewel de werkzaamheid van een tweede dosis of volgende doses niet is vastgesteld in placebogecontroleerde onderzoeken, kan een tweede dosis 2 uur na de eerste dosis worden toegediend als de migrainehoofdpijn terugkeert. De maximale dagelijkse dosis mag niet hoger zijn dan 30 mg in een periode van 24 uur. De veiligheid van de behandeling van gemiddeld meer dan vier hoofdpijnen in een periode van 30 dagen is niet vastgesteld.
Doseringsinformatie bij pediatrische patiënten (leeftijd 6 tot 17 jaar)
Dosering bij pediatrische patiënten is gebaseerd op het lichaamsgewicht van de patiënt. De aanbevolen dosis MAXALT 10 mg is 5 mg bij patiënten die minder dan 40 kg (88 lb) wegen en 10 mg bij patiënten die 40 kg (88 lb) of meer wegen.
De werkzaamheid en veiligheid van behandeling met meer dan één dosis MAXALT binnen 24 uur bij pediatrische patiënten van 6 tot 17 jaar zijn niet vastgesteld.
Toediening van MAXALT-MLT oraal uiteenvallende tabletten
Voor MAXALT-MLT oraal uiteenvallende tabletten is toediening met vloeistof niet nodig. Oraal uiteenvallende tabletten zijn verpakt in een blisterverpakking in een buitenste aluminium zakje en patiënten mogen de blister niet uit het buitenste zakje halen tot vlak voor de dosering. De blisterverpakking moet vervolgens met droge handen worden opengetrokken en de oraal uiteenvallende tablet moet op de tong worden gelegd, waar deze zal oplossen en met het speeksel doorgeslikt.
Doseringsaanpassing voor patiënten die propranolol gebruiken
Volwassen patiënten
Bij volwassen patiënten die propranolol gebruiken, wordt alleen de dosis van 5 mg MAXALT 5 mg aanbevolen, tot een maximum van 3 doses in een periode van 24 uur (15 mg) [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Pediatrische patiënten
Voor pediatrische patiënten die 40 kg (88 lb) of meer wegen en die propranolol gebruiken, wordt slechts een enkele dosis van 5 mg MAXALT aanbevolen (maximale dosis van 5 mg in een periode van 24 uur). MAXALT mag niet worden voorgeschreven aan met propranolol behandelde pediatrische patiënten die minder wegen dan 40 kg (88 lb) [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
MAXALT-tabletten
- mg tabletten zijn lichtroze, capsulevormige, samengeperste tabletten met de code MRK aan de ene kant en 266 aan de andere.
- 10 mg tabletten zijn lichtroze, capsulevormige, samengeperste tabletten met de code MAXALT 5 mg aan de ene kant en MRK 267 aan de andere.
MAXALT-MLT oraal uiteenvallende tabletten
- De oraal desintegrerende tabletten van 5 mg zijn witte tot gebroken witte, ronde gelyofiliseerde tabletten met aan één kant een gemodificeerde driehoek ingeslagen.
- 10 mg oraal uiteenvallende tabletten zijn witte tot gebroken witte, ronde, gelyofiliseerde tabletten met aan één kant een gemodificeerd vierkantje.
Opslag en behandeling
Nr. 3732 - MAXALT-tabletten, 5 mg , zijn lichtroze, capsulevormige, samengeperste tabletten gecodeerd
MRK aan de ene kant en 266 aan de andere kant:
NDC 0006-0266-18, doos met 18 tabletten.
Nr. 3733 - MAXALT 5 mg tabletten, 10 mg , zijn lichtroze, capsulevormige, samengeperste tabletten met de code MAXALT 10 mg aan de ene kant en MRK 267 aan de andere kant:
NDC 0006-0267-18, doos met 18 tabletten.
Nr. 3800 - MAXALT-MLT oraal uiteenvallende tabletten, 5 mg zijn witte tot gebroken witte, ronde, gevriesdroogde, oraal uiteenvallende tabletten met aan één kant een gemodificeerde driehoek ingeslagen en van 10,0-11,5 mm (van links naar rechts) met een pepermuntsmaak. Elke oraal uiteenvallende tablet is afzonderlijk verpakt in een blisterverpakking in een aluminium zakje (zakje). Ze worden als volgt geleverd:
NDC 0006-3800-18, 6 x gebruikseenheid draagtas van 3 oraal desintegrerende tabletten (18 tabletten in totaal).
Nr. 3801 - MAXALT-MLT oraal uiteenvallende tabletten, 10 mg , zijn witte tot gebroken witte, ronde, gelyofiliseerde, oraal uiteenvallende tabletten met aan één kant een gemodificeerd vierkant ingeslagen en van 12,0-13,8 mm (van links naar rechts) met een pepermuntsmaak. Elke oraal uiteenvallende tablet is afzonderlijk verpakt in een blisterverpakking in een aluminium zakje (zakje). Ze worden als volgt geleverd:
NDC 0006-3801-18, 6 x gebruikseenheid draagtas van 3 oraal desintegrerende tabletten (18 tabletten in totaal).
Opslag
Bewaar MAXALT 5 mg tabletten bij kamertemperatuur, 15 °C-30 °C (59 °F-86 °F).
Bewaar MAXALT-MLT oraal desintegrerende tabletten bij kamertemperatuur, 15 ° C-30 ° C (59 ° F-86 ° F).
Gedistribueerd door: Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO.,INC., Whitehouse Station, NJ 08889, VS. Herzien: okt 2019
BIJWERKINGEN
De volgende bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Myocardiale ischemie, myocardinfarct en Prinzmetal-angina [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Aritmieën [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Borst-, keel-, nek- en/of kaakpijn/strakheid/druk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Cerebrovasculaire gebeurtenissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Andere vasospasme-reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Medicatie Overmatig gebruik Hoofdpijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Verhoging van de bloeddruk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
volwassenen
Incidentie in gecontroleerde klinische onderzoeken
Bijwerkingen van MAXALT werden beoordeeld in gecontroleerde klinische onderzoeken met meer dan 3700 volwassen patiënten die enkelvoudige of meervoudige doses MAXALT-tabletten kregen. De meest voorkomende bijwerkingen tijdens behandeling met MAXALT (≥5% in beide behandelingsgroepen en meer dan placebo) waren asthenie/vermoeidheid, slaperigheid, pijn/drukgevoel en duizeligheid. Deze bijwerkingen leken dosisgerelateerd te zijn.
Tabel 1 geeft een overzicht van de bijwerkingen (incidentie ≥2% en meer dan placebo) na een enkele dosis MAXALT 5 mg bij volwassenen.
De frequenties van bijwerkingen in klinische onderzoeken namen niet toe wanneer maximaal drie doses binnen 24 uur werden ingenomen. De frequenties van bijwerkingen waren ook onveranderd bij gelijktijdig gebruik van geneesmiddelen die gewoonlijk worden gebruikt voor de profylaxe van migraine (inclusief propranolol), orale anticonceptiva of analgetica. De incidentie van bijwerkingen werd niet beïnvloed door leeftijd of geslacht. Er waren onvoldoende gegevens om de impact van ras op de incidentie van bijwerkingen te beoordelen.
Andere gebeurtenissen waargenomen in verband met de toediening van MAXALT bij volwassenen
In de volgende rubriek worden de frequenties van minder vaak gemelde bijwerkingen weergegeven die niet in andere rubrieken van de etikettering werden vermeld. Omdat de rapporten gebeurtenissen bevatten die zijn waargenomen in open onderzoeken, kan de rol van MAXALT 5 mg in hun oorzaak niet betrouwbaar worden vastgesteld. Bovendien beperkt de variabiliteit in verband met het melden van bijwerkingen, de terminologie die wordt gebruikt om bijwerkingen te beschrijven, de waarde van de kwantitatieve frequentieschattingen die worden verstrekt. De frequenties van voorvallen worden berekend als het aantal patiënten dat MAXALT heeft gebruikt en een voorval heeft gemeld, gedeeld door het totale aantal patiënten dat is blootgesteld aan MAXALT (N=3716). Alle gemelde voorvallen traden op met een incidentie ≥1%, of worden verondersteld redelijk verband te houden met het gebruik van het geneesmiddel. Gebeurtenissen worden verder ingedeeld in lichaamssysteemcategorieën en opgesomd in volgorde van afnemende frequentie met behulp van de volgende definities: frequente bijwerkingen zijn die gedefinieerd als die voorkomen bij ten minste (>)1/100 patiënten; zeldzame bijwerkingen komen voor bij 1/100 tot 1/1000 patiënten; en zeldzame bijwerkingen komen voor bij minder dan 1/1000 patiënten.
Algemeen: Zelden was gezichtsoedeem. Zelden waren syncope en oedeem/zwelling.
Atypische sensaties: Vaak waren warme gevoelens.
Cardiovasculair: Vaak was hartkloppingen. Zelden waren tachycardie, koude ledematen en bradycardie.
spijsvertering: Frequent waren diarree en braken. Zelden waren dyspepsie, tongoedeem en opgezette buik.
Musculoskeletaal: Zelden waren spierzwakte, stijfheid, myalgie en spierkramp/spasme.
Neurologisch/psychiatrisch: Frequent waren hypesthesie, euforie en tremor. Zelden waren duizeligheid, slapeloosheid, verwardheid/desoriëntatie, abnormale gang, geheugenstoornis en agitatie.
Ademhaling: Vaak was dyspnoe. Onregelmatig was farynxoedeem.
Speciale zintuigen: Onregelmatig waren wazig zien en tinnitus. Zelden was zwelling van de ogen.
Huid en huidaanhangsel: Frequent was blozen. Zelden waren zweten, jeuk, huiduitslag en urticaria. Zelden waren erytheem, opvliegers.
Het bijwerkingenprofiel dat werd gezien met MAXALT-MLT oraal uiteenvallende tabletten was vergelijkbaar met dat van MAXALT 10 mg tabletten.
Pediatrische patiënten van 6 tot 17 jaar oud
Incidentie in gecontroleerde klinische onderzoeken bij pediatrische patiënten
Bijwerkingen van MAXALT-MLT werden beoordeeld in een gecontroleerd klinisch onderzoek naar de acute behandeling van migraine (onderzoek 7) waaraan in totaal 1382 pediatrische patiënten van 6-17 jaar deelnamen, van wie 977 (72%) ten minste één dosis kregen toegediend. van onderzoeksbehandeling (MAXALT-MLT en/of placebo) [zie Klinische studies ]. De incidentie van bijwerkingen die werden gemeld voor pediatrische patiënten in de acute klinische studie was vergelijkbaar bij patiënten die MAXALT kregen als degenen die placebo kregen. Het bijwerkingenpatroon bij pediatrische patiënten is naar verwachting vergelijkbaar met dat bij volwassenen.
Andere voorvallen waargenomen in verband met de toediening van MAXALT-MLT bij pediatrische patiënten
In de volgende rubriek worden de frequenties van minder vaak gemelde bijwerkingen weergegeven. Omdat de rapporten gebeurtenissen bevatten die zijn waargenomen in open onderzoeken, kan de rol van MAXALT-MLT in hun oorzaak niet betrouwbaar worden vastgesteld. Bovendien beperkt de variabiliteit in verband met het melden van bijwerkingen, de terminologie die wordt gebruikt om bijwerkingen te beschrijven, de waarde van de kwantitatieve frequentieschattingen die worden verstrekt.
De frequenties van voorvallen worden berekend als het aantal pediatrische patiënten in de leeftijd van 6 tot 17 jaar die MAXALT-MLT gebruikten en een voorval meldden gedeeld door het totale aantal patiënten dat werd blootgesteld aan MAXALT-MLT (N=1068). Alle gemelde voorvallen traden op met een incidentie ≥1%, of worden verondersteld redelijk verband te houden met het gebruik van het geneesmiddel. Gebeurtenissen worden verder ingedeeld in systeem/orgaanklassen en opgesomd in volgorde van afnemende frequentie met behulp van de volgende definities: frequente bijwerkingen zijn die voorkomen bij (>)1/100 pediatrische patiënten; zeldzame bijwerkingen komen voor bij 1/100 tot 1/1000 pediatrische patiënten; en zeldzame bijwerkingen komen voor bij minder dan 1/1000 patiënten.
Algemeen: Vaak was vermoeidheid.
Oor- en labyrintaandoeningen: Onregelmatig was hypoacusis.
Maagdarmstelselaandoeningen: Vaak was buikpijn.
Zenuwstelselaandoeningen: Onregelmatig waren coördinatiestoornissen, aandachtsstoornissen en presyncope.
Psychische stoornissen: Een enkele keer was hallucinatie.
Postmarketingervaring
De volgende sectie somt mogelijk belangrijke bijwerkingen op die zich in de klinische praktijk hebben voorgedaan en die spontaan zijn gemeld aan verschillende bewakingssystemen. De opgesomde gebeurtenissen omvatten alle, behalve die welke al in andere secties van de etikettering zijn vermeld of die te algemeen zijn om informatief te zijn. Omdat de rapporten melding maken van spontaan gemelde voorvallen uit wereldwijde postmarketingervaring, kan de frequentie van de voorvallen en de rol van MAXALT 5 mg in hun oorzaak niet betrouwbaar worden bepaald.
Neurologisch/psychiatrisch: Hartinfarct.
Algemeen: Allergische aandoeningen waaronder anafylaxie/anafylactoïde reactie, angio-oedeem, piepende ademhaling en toxische epidermale necrolyse [zie CONTRA-INDICATIES ].
Speciale zintuigen: Dysgeusie.
DRUG-INTERACTIES
propranolol
De dosis MAXALT 5 mg moet worden aangepast bij patiënten die met propranolol worden behandeld, aangezien is aangetoond dat propranolol de plasma-AUC van rizatriptan met 70% verhoogt (zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Ergot-bevattende medicijnen
Er is gemeld dat ergot-bevattende geneesmiddelen langdurige vasospastische reacties veroorzaken. Omdat deze effecten additief kunnen zijn, is het gebruik van ergotaminebevattende of ergot-achtige medicijnen (zoals dihydro-ergotamine of methysergide) en MAXALT 5 mg binnen 24 uur gecontra-indiceerd [zie CONTRA-INDICATIES ].
Andere 5-HT1-agonisten
Omdat hun vasospastische effecten additief kunnen zijn, is gelijktijdige toediening van MAXALT 10 mg en andere 5-HT1-agonisten binnen 24 uur na elkaar gecontra-indiceerd [zie CONTRA-INDICATIES ].
SSRI's/SNRI's en serotoninesyndroom
Er zijn gevallen van serotoninesyndroom gemeld tijdens gelijktijdige toediening van triptanen en selectieve serotonineheropnameremmers (SSRI's) of serotonine-noradrenalineheropnameremmers (SNRI's) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Monoamineoxidaseremmers
MAXALT is gecontra-indiceerd bij patiënten die MAO-A-remmers en niet-selectieve MAO-remmers gebruiken. Een specifieke MAO-A-remmer verhoogde de systemische blootstelling aan rizatriptan en zijn metaboliet [zie: CONTRA-INDICATIES en KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Myocardiale ischemie, myocardinfarct en Prinzmetal-angina
MAXALT mag niet worden gegeven aan patiënten met ischemische of vasospastische coronaire hartziekte. Er zijn zeldzame meldingen geweest van ernstige cardiale bijwerkingen, waaronder acuut myocardinfarct, die optraden binnen enkele uren na toediening van MAXALT. Sommige van deze reacties traden op bij patiënten zonder bekende coronaire hartziekte (CAD). 5-HT1-agonisten, waaronder MAXALT 5 mg, kunnen coronaire arteriële vasospasme (Prinzmetal-angina) veroorzaken, zelfs bij patiënten zonder een voorgeschiedenis van CAD.
Triptaan-naïeve patiënten met meerdere cardiovasculaire risicofactoren (bijv. verhoogde leeftijd, diabetes, hypertensie, roken, obesitas, sterke familiegeschiedenis van CAD) moeten een cardiovasculaire evaluatie ondergaan voordat ze MAXALT krijgen. Als er aanwijzingen zijn voor CAD of vasospasme van de kransslagader, mag MAXALT niet worden toegediend [zie: CONTRA-INDICATIES ]. Bij patiënten met een negatieve cardiovasculaire evaluatie moet worden overwogen de eerste dosis MAXALT toe te dienen in een omgeving onder medisch toezicht en onmiddellijk na toediening van MAXALT 10 mg een elektrocardiogram (ECG) uit te voeren. Periodieke cardiovasculaire evaluatie moet worden overwogen bij intermitterende langdurige gebruikers van MAXALT met cardiovasculaire risicofactoren.
Aritmieën
Levensbedreigende hartritmestoornissen, waaronder ventriculaire tachycardie en ventriculaire fibrillatie die tot de dood leiden, zijn gemeld binnen enkele uren na toediening van 5-HT1-agonisten. Stop met MAXALT 10 mg als deze stoornissen optreden.
Borst, keel, nek en/of kaakpijn/strakheid/druk
Net als bij andere 5-HT1-agonisten komen beklemming, pijn, druk en zwaarte in het precordium, keel, nek en kaak vaak voor na behandeling met MAXALT 5 mg en zijn meestal niet-cardiaal van oorsprong. Als echter een cardiale oorsprong wordt vermoed, moeten patiënten worden geëvalueerd. Patiënten met CAD en patiënten met Prinzmetal-variant angina mogen geen 5-HT1-agonisten krijgen.
Cerebrovasculaire gebeurtenissen
Hersenbloeding, subarachnoïdale bloeding en beroerte zijn opgetreden bij patiënten die werden behandeld met 5-HT1-agonisten, en sommige hebben geleid tot dodelijke afloop. In een aantal gevallen lijkt het mogelijk dat de cerebrovasculaire gebeurtenissen primair waren, aangezien de 5-HT1-agonist werd toegediend in de onjuiste overtuiging dat de ervaren symptomen een gevolg waren van migraine, terwijl dat niet het geval was. Ook kunnen patiënten met migraine een verhoogd risico hebben op bepaalde cerebrovasculaire gebeurtenissen (bijv. beroerte, bloeding, voorbijgaande ischemische aanval). Stop met MAXALT als zich een cerebrovasculair voorval voordoet.
Net als bij andere acute migrainetherapieën, moet ervoor worden gezorgd dat, voordat hoofdpijn wordt behandeld bij patiënten die niet eerder als migrainepatiënt zijn gediagnosticeerd, en bij migrainepatiënten met atypische symptomen, andere mogelijk ernstige neurologische aandoeningen worden uitgesloten. MAXALT mag niet worden toegediend aan patiënten met een voorgeschiedenis van een beroerte of een voorbijgaande ischemische aanval [zie: CONTRA-INDICATIES ].
Andere vasospasme-reacties
5-HT1-agonisten, waaronder MAXALT, kunnen niet-coronaire vasospastische reacties veroorzaken, zoals perifere vasculaire ischemie, gastro-intestinale vasculaire ischemie en infarct (met buikpijn en bloederige diarree), miltinfarct en het syndroom van Raynaud. Bij patiënten die symptomen of tekenen ervaren die wijzen op een niet-coronaire vasospasmereactie na het gebruik van een 5-HT1-agonist, moet de vermoedelijke vasospasmereactie worden uitgesloten voordat aanvullende doses MAXALT 10 mg worden toegediend.
Bij gebruik van 5-HT1-agonisten zijn meldingen van voorbijgaande en permanente blindheid en aanzienlijk gedeeltelijk verlies van het gezichtsvermogen gemeld. Aangezien visuele stoornissen deel kunnen uitmaken van een migraineaanval, is een oorzakelijk verband tussen deze gebeurtenissen en het gebruik van 5-HT1-agonisten niet duidelijk vastgesteld.
Medicatie overmatig gebruik Hoofdpijn
Overmatig gebruik van geneesmiddelen tegen acute migraine (bijv. ergotamine, triptanen, opioïden of een combinatie van geneesmiddelen gedurende 10 of meer dagen per maand) kan leiden tot verergering van hoofdpijn (hoofdpijn door overmatig gebruik van medicijnen). Hoofdpijn door overmatig gebruik van medicijnen kan zich voordoen als migraine-achtige dagelijkse hoofdpijn, of als een duidelijke toename van de frequentie van migraineaanvallen. Het kan nodig zijn om patiënten te ontgiften, met inbegrip van het staken van de te veel gebruikte geneesmiddelen, en de behandeling van ontwenningsverschijnselen (waaronder vaak een voorbijgaande verergering van hoofdpijn).
serotonine syndroom
Het serotoninesyndroom kan optreden bij triptanen, waaronder MAXALT 10 mg, vooral bij gelijktijdige toediening met selectieve serotonineheropnameremmers (SSRI's), serotonine-noradrenalineheropnameremmers (SNRI's), tricyclische antidepressiva (TCA's) en MAO-remmers (zie DRUG-INTERACTIES ]. Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, hyperthermie), neuromusculaire aberraties (bijv. hyperreflexie, coördinatiestoornissen) en/of gastro-intestinale symptomen (bijv. misselijkheid , braken, diarree). Het begin van de symptomen kan optreden binnen enkele minuten tot uren na ontvangst van een nieuwe of een grotere dosis van een serotonerge medicatie. De behandeling met MAXALT moet worden stopgezet als het serotoninesyndroom wordt vermoed [zie: DRUG-INTERACTIES en PATIËNT INFORMATIE ].
Verhoging van de bloeddruk
Aanzienlijke verhoging van de bloeddruk, waaronder hypertensieve crisis met acute stoornis van orgaansystemen, is in zeldzame gevallen gemeld bij patiënten met en zonder een voorgeschiedenis van hypertensie die 5-HT1-agonisten kregen, waaronder MAXALT. Bij gezonde jonge volwassen mannelijke en vrouwelijke patiënten die maximale doses MAXALT kregen (10 mg om de 2 uur voor 3 doses), werden lichte verhogingen van de bloeddruk (ongeveer 2-3 mmHg) waargenomen. MAXALT is gecontra-indiceerd bij patiënten met ongecontroleerde hypertensie [zie: CONTRA-INDICATIES ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Risico op myocardischemie en/of infarct, Prinzmetal-angina, andere vasospasme-gerelateerde voorvallen en cerebrovasculaire voorvallen
Informeer patiënten dat MAXALT ernstige cardiovasculaire bijwerkingen kan veroorzaken, zoals een hartinfarct of beroerte. Hoewel ernstige cardiovasculaire voorvallen kunnen optreden zonder waarschuwingssymptomen, moeten patiënten alert zijn op de tekenen en symptomen van pijn op de borst, kortademigheid, zwakte, onduidelijke spraak en medisch advies inwinnen bij het waarnemen van een indicatief teken of symptomen. Patiënten moeten op de hoogte worden gesteld van het belang van deze follow-up [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
serotonine syndroom
Patiënten moeten worden gewaarschuwd voor het risico op het serotoninesyndroom bij gebruik van MAXALT 10 mg of andere triptanen, met name bij gecombineerd gebruik met selectieve serotonineheropnameremmers (SSRI's) of serotonine-noradrenalineheropnameremmers (SNRI's) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
Zwangerschap
Informeer patiënten dat MAXALT niet tijdens de zwangerschap mag worden gebruikt, tenzij het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze borstvoeding geven of van plan zijn borstvoeding te geven [zie Gebruik bij specifieke populaties ].
Mogelijkheid om complexe taken uit te voeren
Aangezien migraine of behandeling met MAXALT 10 mg slaperigheid en duizeligheid kunnen veroorzaken, dient u patiënten te instrueren hun vermogen om complexe taken uit te voeren tijdens migraineaanvallen en na toediening van MAXALT te evalueren.
Medicatie overmatig gebruik Hoofdpijn
Informeer patiënten dat het gebruik van geneesmiddelen tegen acute migraine gedurende 10 of meer dagen per maand kan leiden tot een verergering van hoofdpijn, en moedig patiënten aan om de hoofdpijnfrequentie en het medicijngebruik te registreren (bijv. door een hoofdpijndagboek bij te houden) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Behandeling van oraal uiteenvallende tablettenpakketten
Instrueer patiënten om de blister niet uit de buitenste aluminium zak te verwijderen totdat ze klaar zijn om de oraal uiteenvallende tablet erin te gebruiken [zie DOSERING EN ADMINISTRATIE ].
Patiënten met fenylketonurie
Informeer patiënten met fenylketonurie dat MAXALT-MLT oraal uiteenvallende tabletten fenylalanine (een bestanddeel van aspartaam) bevatten. Elke oraal desintegrerende tablet van 5 mg bevat 1,1 mg fenylalanine en elke oraal desintegrerende tablet van 10 mg bevat 2,1 mg fenylalanine [zie Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Orale carcinogeniteitsonderzoeken van rizatriptan zijn uitgevoerd bij muizen (100 weken) en ratten (106 weken) in doses tot 125 mg/kg/dag. Er waren bij geen van beide soorten aanwijzingen voor een toename van de incidentie van tumoren gerelateerd aan rizatriptan. Plasmablootstellingen (AUC) bij de hoogste geteste dosis waren ongeveer 150 (muizen) en 240 keer (ratten) die bij mensen bij de maximaal aanbevolen dosis voor de mens (MRHD) van 30 mg/dag.
Mutagenese
Rizatriptan was niet mutageen of clastogeen in een reeks in vitro en in vivo genetische toxiciteitsstudies, waaronder: de microbiële mutagenese (Ames) test, in vitro zoogdiercelmutagenese en chromosomale aberratietesten, en de in vivo chromosomale aberratietest bij muizen.
Aantasting van de vruchtbaarheid
Orale toediening van rizatriptan (0, 2, 10 of 100 mg/kg/dag) aan vrouwtjesratten voorafgaand aan en tijdens het paren en gedurende de gehele dracht en lactatie had geen effect op de vruchtbaarheid; bij de hoogste geteste dosis werden echter veranderde oestruscycli en vertragingen in de tijd tot paring waargenomen. Plasmablootstelling bij de dosis zonder effect (10 mg/kg/dag) voor reproductietoxiciteit was ongeveer 15 keer die bij mensen bij de MRHD.
Orale toediening van rizatriptan (0, 5, 35 of 250 mg/kg/dag) aan mannelijke ratten voor en tijdens het paren resulteerde niet in een verminderde vruchtbaarheid of reproductieve prestatie. Plasmablootstelling (AUC) bij de hoogste geteste dosis was ongeveer 550 keer die bij mensen bij de MRHD.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
De beschikbare gegevens bij de mens over het gebruik van MAXALT bij zwangere vrouwen zijn niet voldoende om conclusies te trekken over het geneesmiddelgerelateerde risico op ernstige geboorteafwijkingen en miskramen.
In dierstudies werd ontwikkelingstoxiciteit waargenomen na orale toediening van rizatriptan tijdens de zwangerschap (verlaagd foetaal lichaamsgewicht bij ratten) of tijdens de dracht en lactatie (verhoogde mortaliteit, verminderd lichaamsgewicht en neurologische gedragsstoornis bij rattennakomelingen) bij maternale plasmablootstellingen die groter waren dan die verwacht bij therapeutische doses bij mensen [zie Dierlijke gegevens ].
In de algemene bevolking van de VS is het geschatte achtergrondrisico op ernstige geboorteafwijkingen en op een miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%. Het gerapporteerde percentage ernstige geboorteafwijkingen bij bevallingen bij vrouwen met migraine varieert van 2,2% tot 2,9% en het gerapporteerde percentage miskraam was 17%, wat vergelijkbaar is met de percentages die zijn gemeld bij vrouwen zonder migraine.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Bij vrouwen met migraine is er een verhoogd risico op nadelige perinatale uitkomsten bij de moeder, waaronder pre-eclampsie en zwangerschapshypertensie.
Gegevens
Menselijke gegevens
Het zwangerschapsregister voor MAXALT identificeerde geen patroon van aangeboren afwijkingen of andere nadelige geboorte-uitkomsten in de periode van 1998 tot 2018. Het ontbreken van een patroon moet echter met de nodige voorzichtigheid worden bekeken, aangezien het aantal prospectieve rapporten met informatie over de uitkomst was laag en bood niet voldoende power om een verhoogd risico op individuele geboorteafwijkingen in verband met het gebruik van MAXALT te detecteren. Bovendien was er significant verlies voor follow-up in de prospectieve zwangerschapsrapporten, wat deze beoordeling van een verband tussen MAXALT en een patroon van aangeboren afwijkingen of andere nadelige geboorte-uitkomsten verder compliceerde.
In een onderzoek waarbij gebruik werd gemaakt van gegevens uit het Swedish Medical Birth Register, werden levendgeborenen van vrouwen die tijdens de zwangerschap rapporteerden triptanen of moederkoren gebruikt, vergeleken met die van vrouwen die dat niet deden. Van de 157 geboorten met blootstelling aan rizatriptan in het eerste trimester, werden 7 zuigelingen geboren met misvormingen (relatief risico 1,01 [95% BI: 0,40 tot 2,08]). Een onderzoek waarbij gebruik werd gemaakt van gekoppelde gegevens van de Medical Birth Registry of Norway aan de Norwegian Prescription Database vergeleek de zwangerschapsuitkomsten bij vrouwen die recepten voor triptanen tijdens de zwangerschap inwisselden, evenals een vergelijkingsgroep voor migraineziekte die recepten voor triptanen alleen vóór de zwangerschap inwisselde, vergeleken met een populatie controlegroep. Van de 310 vrouwen die tijdens het eerste trimester recepten voor rizatriptan inwisselden, hadden er 10 kinderen met ernstige aangeboren afwijkingen (OR 1,03 [95% BI: 0,55 tot 1,93]), terwijl van de 271 vrouwen die voor, maar niet tijdens , zwangerschap, 12 hadden kinderen met ernstige aangeboren afwijkingen (OR 1,48 [95% BI: 0,83 tot 2,64]), elk vergeleken met de populatievergelijkingsgroep.
Dierlijke gegevens
Wanneer rizatriptan (0, 2, 10 of 100 mg/kg/dag) oraal werd toegediend aan drachtige ratten gedurende de gehele organogenese, werd een afname van het foetale lichaamsgewicht waargenomen bij de hoogste geteste doses. Bij de middelste dosis (10 mg/kg/dag), wat een dosis zonder effect was voor bijwerkingen op de embryofoetale ontwikkeling, was de plasmablootstelling (AUC) ongeveer 15 keer die bij mensen bij de maximaal aanbevolen dosis voor de mens (MRHD) van 30 mg/dag. Wanneer rizatriptan (0, 5, 10 of 50 mg/kg/dag) oraal werd toegediend aan drachtige konijnen gedurende de gehele organogenese, werden geen nadelige foetale effecten waargenomen. Plasmablootstelling (AUC) bij de hoogste geteste dosis was 115 keer die bij mensen bij de MRHD. Overdracht van het geneesmiddel door de placenta naar de foetus werd bij beide soorten aangetoond.
Orale toediening van rizatriptan (0, 2, 10 of 100 mg/kg/dag) aan vrouwtjesratten voor en tijdens de paring en voortzetting van de dracht en lactatie resulteerde in een verminderd lichaamsgewicht bij de nakomelingen vanaf de geboorte en tijdens de lactatie, behalve de laagste. geteste dosis (2 mg/kg/dag). Plasmablootstelling (AUC) bij de dosis zonder effect (2 mg/kg/dag) voor bijwerkingen op de postnatale ontwikkeling was vergelijkbaar met die bij mensen bij de MRHD.
Orale toediening van rizatriptan (0, 5, 100 of 250 mg/kg/dag) gedurende de gehele organogenese en lactatie resulteerde in neonatale mortaliteit, verminderd lichaamsgewicht (dat aanhield tot in de volwassenheid) en verminderde neurologische gedragsfunctie bij nakomelingen, behalve bij de laagste dosis getest. Plasmablootstelling (AUC) bij de dosis zonder effect voor bijwerkingen op de postnatale ontwikkeling (5 mg/kg/dag) was ongeveer 8 keer zo hoog als bij mensen bij de MRHD.
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens over de aanwezigheid van rizatriptan of actieve metabolieten in moedermelk, of over de effecten van rizatriptan op de zuigeling die borstvoeding krijgt, of op de melkproductie.
Rizatriptan werd uitgescheiden in de melk van de rat, met spiegels in de melk die ongeveer 6 keer zo hoog waren als die in het plasma van de moeder.
Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan MAXALT of MAXALT-MLT en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van MAXALT of MAXALT-MLT of van de onderliggende maternale aandoening.
Gegevens
Na orale toediening van rizatriptan aan zogende ratten in een dosis van 100 mg/kg/dag, waren de geneesmiddelconcentraties van rizatriptan in melkmonsters ongeveer 6 keer hoger dan de maternale plasmaconcentraties van het geneesmiddel.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 6 jaar zijn niet vastgesteld. De werkzaamheid en veiligheid van MAXALT 5 mg bij de acute behandeling van migraine bij patiënten van 6 tot 17 jaar werd vastgesteld in een adequaat en goed gecontroleerd onderzoek [zie Klinische studies ].
De incidentie van bijwerkingen die werden gemeld voor pediatrische patiënten in de acute klinische studie was vergelijkbaar bij patiënten die MAXALT 5 mg kregen als degenen die placebo kregen. Het bijwerkingenpatroon bij pediatrische patiënten is naar verwachting vergelijkbaar met dat bij volwassenen.
Geriatrisch gebruik
Klinische onderzoeken met MAXALT 5 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond.
Hoewel de farmacokinetiek van rizatriptan vergelijkbaar was bij ouderen (in de leeftijd 65 jaar) en bij jongere volwassenen (n=17), moet in het algemeen de dosiskeuze voor een oudere patiënt voorzichtig zijn, beginnend aan de lage kant van het doseringsbereik. Dit weerspiegelt de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Geriatrische patiënten met andere cardiovasculaire risicofactoren (bijv. diabetes, hypertensie, roken, obesitas, sterke familiegeschiedenis van coronaire hartziekte) moeten een cardiovasculaire evaluatie ondergaan voordat ze MAXALT krijgen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten met fenylketonurie
Oraal uiteenvallende tabletten bevatten fenylalanine (een bestanddeel van aspartaam). De oraal desintegrerende tabletten van 5 en 10 mg bevatten respectievelijk 1,1 en 2,1 mg fenylalanine.
OVERDOSERING
Tijdens klinische onderzoeken bij volwassenen zijn geen overdoses van MAXALT gemeld.
Sommige volwassen patiënten die 40 mg MAXALT 5 mg kregen, hetzij een enkele dosis, hetzij als twee doses met een interval van 2 uur, hadden duizeligheid en slaperigheid.
In een klinisch farmacologisch onderzoek waarbij 12 volwassen proefpersonen MAXALT 5 mg kregen, in totale cumulatieve doses van 80 mg (toegediend binnen vier uur), ondervonden twee van de proefpersonen syncope, duizeligheid, bradycardie inclusief derdegraads AV-blok, braken en/of incontinentie .
In het open-label langetermijnonderzoek, waarbij 606 behandelde pediatrische migrainepatiënten van 12 tot 17 jaar (waarvan 432 werden behandeld gedurende ten minste 12 maanden) betrokken waren, namen 151 patiënten (25%) twee doses van 10 mg MAXALT-MLT in. binnen een periode van 24 uur. Bijwerkingen voor 3 van deze patiënten waren abdominaal ongemak, vermoeidheid en dyspneu.
Bovendien kan, op basis van de farmacologie van MAXALT 10 mg, hypertensie of myocardischemie optreden na overdosering. Gastro-intestinale decontaminatie (dwz maagspoeling gevolgd door actieve kool) moet worden overwogen bij patiënten die verdacht worden van een overdosis met MAXALT. Klinische en elektrocardiografische monitoring moet gedurende ten minste 12 uur worden voortgezet, zelfs als er geen klinische symptomen worden waargenomen.
De effecten van hemo- of peritoneale dialyse op de serumconcentraties van rizatriptan zijn niet bekend.
CONTRA-INDICATIES
MAXALT 5 mg is gecontra-indiceerd bij patiënten met:
- Ischemische coronaire hartziekte (angina pectoris, voorgeschiedenis van myocardinfarct of gedocumenteerde stille ischemie), of andere significante onderliggende cardiovasculaire ziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Coronaire arteriële vasospasme inclusief Prinzmetal-angina [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Geschiedenis van een beroerte of een voorbijgaande ischemische aanval (TIA) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Perifere vaatziekte (PVD) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Ischemische darmziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Ongecontroleerde hypertensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Recent gebruik (dwz binnen 24 uur) van een andere 5-HT1-agonist, ergotaminebevattende medicatie of ergot-achtige medicatie (zoals dihydro-ergotamine of methysergide) [zie DRUG-INTERACTIES ].
- Hemiplegie of basilaire migraine [zie INDICATIES ].
- Gelijktijdige toediening of recente stopzetting (dwz binnen 2 weken) van een MAO-A-remmer [zie: DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
- Overgevoeligheid voor rizatriptan of voor één van de hulpstoffen (angio-oedeem en anafylaxie waargenomen) (zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Rizatriptan bindt met hoge affiniteit aan menselijke gekloonde 5-HT1B/1D-receptoren. MAXALT 10 mg oefent vermoedelijk zijn therapeutische effecten uit bij de behandeling van migrainehoofdpijn door binding aan 5-HT1B/1D-receptoren die zich op intracraniële bloedvaten en sensorische zenuwen van het trigeminussysteem bevinden.
Farmacokinetiek
Absorptie
Rizatriptan wordt volledig geabsorbeerd na orale toediening. De gemiddelde orale absolute biologische beschikbaarheid van de MAXALT 10 mg tablet is ongeveer 45% en de gemiddelde piekplasmaconcentraties (Cmax) worden bereikt in ongeveer 1-1,5 uur (Tmax). De aanwezigheid van migrainehoofdpijn leek de absorptie of farmacokinetiek van rizatriptan niet te beïnvloeden. Voedsel heeft geen significant effect op de biologische beschikbaarheid van rizatriptan, maar vertraagt de tijd om de piekconcentratie te bereiken met een uur. In klinische onderzoeken werd MAXALT 10 mg toegediend zonder rekening te houden met voedsel.
De biologische beschikbaarheid en Cmax van rizatriptan waren vergelijkbaar na toediening van MAXALT-tabletten en MAXALT-MLT oraal uiteenvallende tabletten, maar de absorptiesnelheid is iets langzamer met MAXALT-MLT, waarbij de Tmax tot 0,7 uur wordt vertraagd. De AUC van rizatriptan is ongeveer 30% hoger bij vrouwen dan bij mannen. Er trad geen accumulatie op bij meerdere doseringen.
Verdeling
Het gemiddelde distributievolume is ongeveer 140 liter bij mannelijke proefpersonen en 110 liter bij vrouwelijke proefpersonen. Rizatriptan is minimaal (14%) gebonden aan plasma-eiwitten.
Metabolisme
De primaire route van het metabolisme van rizatriptan is via oxidatieve deaminering door monoamineoxidase-A (MAO-A) tot de indolazijnzuurmetaboliet, die niet actief is op de 5-HT1B/1D-receptor. N-monodesmethyl-rizatriptan, een metaboliet met een activiteit die vergelijkbaar is met die van de moederverbinding op de 5-HT1B/1D-receptor, wordt in mindere mate gevormd. De plasmaconcentraties van N-monodesmethyl-rizatriptan zijn ongeveer 14% van die van de moederverbinding en het wordt met een vergelijkbare snelheid geëlimineerd. Andere minder belangrijke metabolieten, het N-oxide, de 6-hydroxyverbinding en het sulfaatconjugaat van de 6-hydroxymetaboliet zijn niet actief op de 5-HT1B/1D-receptor.
Eliminatie
De totale radioactiviteit van de toegediende dosis die in 120 uur werd teruggevonden in urine en feces was respectievelijk 82% en 12% na een enkelvoudige orale toediening van 10 mg 14C-rizatriptan. Na orale toediening van 14C-rizatriptan was rizatriptan verantwoordelijk voor ongeveer 17% van de circulerende plasmaradioactiviteit. Ongeveer 14% van een orale dosis wordt uitgescheiden in de urine als onveranderd rizatriptan, terwijl 51% wordt uitgescheiden als indolazijnzuurmetaboliet, wat wijst op een aanzienlijk first-pass-metabolisme.
De plasmahalfwaardetijd van rizatriptan bij mannen en vrouwen is gemiddeld 2-3 uur.
Cytochroom P450 isovormen
Rizatriptan is geen remmer van de activiteit van humane levercytochroom P450-isovormen 3A4/5, 1A2, 2C9, 2C19 of 2E1; rizatriptan is een competitieve remmer (Ki=1400 nM) van cytochroom P450 2D6, maar alleen bij hoge, klinisch irrelevante concentraties.
Speciale populaties
geriatrische
De farmacokinetiek van rizatriptan bij gezonde oudere vrijwilligers zonder migraine (leeftijd 65-77 jaar) was vergelijkbaar met die bij jongere vrijwilligers zonder migraine (leeftijd 18-45 jaar).
pediatrisch
De farmacokinetiek van rizatriptan werd bepaald bij pediatrische migrainepatiënten van 6 tot 17 jaar. Blootstellingen na toediening van een enkelvoudige dosis van 5 mg MAXALT-MLT aan pediatrische patiënten met een gewicht van 20-39 kg (44-87 lb) of 10 mg MAXALT-MLT aan pediatrische patiënten die ≥40 kg (88 lb) wogen, waren vergelijkbaar met die waargenomen na een enkelvoudige dosis toediening van 10 mg MAXALT-MLT aan volwassenen.
Geslacht
De gemiddelde AUC0-∞ en Cmax van rizatriptan (10 mg oraal) waren respectievelijk ongeveer 30% en 11% hoger bij vrouwen dan bij mannen, terwijl de Tmax ongeveer op hetzelfde moment optrad.
Leverfunctiestoornis
Na orale toediening aan patiënten met leverinsufficiëntie veroorzaakt door lichte tot matige alcoholische cirrose van de lever, waren de plasmaconcentraties van rizatriptan vergelijkbaar bij patiënten met lichte leverinsufficiëntie in vergelijking met een controlegroep van proefpersonen met een normale leverfunctie; de plasmaconcentraties van rizatriptan waren ongeveer 30% hoger bij patiënten met matige leverinsufficiëntie.
Nierfunctiestoornis
Bij patiënten met een nierfunctiestoornis (creatinineklaring 10-60 ml/min/1,73 m2) was de AUC0-∞ van rizatriptan niet significant verschillend van die bij proefpersonen met een normale nierfunctie. Bij hemodialysepatiënten (creatinineklaring
Ras
Farmacokinetische gegevens lieten geen significante verschillen zien tussen Afro-Amerikaanse en blanke proefpersonen.
Geneesmiddelinteracties
[Zie ook DRUG-INTERACTIES ]
Monoamineoxidaseremmers
Rizatriptan wordt voornamelijk gemetaboliseerd via monoamineoxidase, subtype 'A' (MAO-A). Plasmaconcentraties van rizatriptan kunnen worden verhoogd door geneesmiddelen die selectieve MAO-A-remmers zijn (bijv. moclobemide) of niet-selectieve MAO-remmers [type A en B] (bijv. isocarboxazide, fenelzine, tranylcypromine en pargyline). In een geneesmiddelinteractieonderzoek, toen MAXALT 10 mg werd toegediend aan proefpersonen (n=12) die gelijktijdig werden behandeld met de selectieve, reversibele MAO-A-remmer, moclobemide 150 mg driemaal daags, waren er gemiddelde verhogingen van de AUC en Cmax van rizatriptan van 119% en 41% respectievelijk; en de AUC van de actieve N-monodesmethylmetaboliet van rizatriptan was met meer dan 400% verhoogd. De interactie zou naar verwachting groter zijn met irreversibele MAO-remmers. Er wordt geen farmacokinetische interactie verwacht bij patiënten die selectieve MAO-B-remmers krijgen [zie: CONTRA-INDICATIES en DRUG-INTERACTIES ].
propranolol
In een onderzoek naar gelijktijdige toediening van propranolol 240 mg/dag en een enkele dosis rizatriptan 10 mg bij gezonde volwassen proefpersonen (n=11), was de gemiddelde plasma-AUC voor rizatriptan verhoogd met 70% tijdens de toediening van propranolol en een viervoudige toename werd waargenomen bij één onderwerp. De AUC van de actieve N-monodesmethylmetaboliet van rizatriptan werd niet beïnvloed door propranolol [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
Nadolol/Metoprolol
In een onderzoek naar geneesmiddelinteracties werden de effecten van meerdere doses nadolol 80 mg of metoprolol 100 mg om de 12 uur op de farmacokinetiek van een enkele dosis 10 mg rizatriptan geëvalueerd bij gezonde proefpersonen (n=12). Er werden geen farmacokinetische interacties waargenomen.
Paroxetine
In een onderzoek naar de interactie tussen de selectieve serotonineheropnameremmer (SSRI) paroxetine 20 mg/dag gedurende twee weken en een enkele dosis MAXALT 10 mg bij gezonde proefpersonen (n=12), waren noch de plasmaconcentraties van rizatriptan, noch het veiligheidsprofiel ervan werden aangetast door paroxetine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en PATIËNT INFORMATIE ].
Orale anticonceptiva
In een onderzoek naar gelijktijdige toediening van een oraal anticonceptivum gedurende 6 dagen toediening van MAXALT (10-30 mg/dag) bij gezonde vrouwelijke vrijwilligers (n=18), had rizatriptan geen invloed op de plasmaconcentraties van ethinylestradiol of norethindron.
Klinische studies
volwassenen
De werkzaamheid van MAXALT 5 mg tabletten werd vastgesteld in vier multicenter, gerandomiseerde, placebogecontroleerde onderzoeken. De patiënten die deelnamen aan deze onderzoeken waren voornamelijk vrouwen (84%) en blanken (88%), met een gemiddelde leeftijd van 40 jaar (bereik van 18 tot 71). Patiënten werden geïnstrueerd om matige tot ernstige hoofdpijn te behandelen. Hoofdpijnrespons, gedefinieerd als een vermindering van matige of ernstige hoofdpijnpijn tot geen of milde hoofdpijnpijn, werd beoordeeld tot 2 uur (onderzoek 1) of tot 4 uur na toediening (onderzoek 2, 3 en 4). Geassocieerde symptomen van misselijkheid, fotofobie en fonofobie en het aanhouden van de respons tot 24 uur na de dosis werden geëvalueerd. Een tweede dosis MAXALT 10 mg tabletten werd 2 tot 24 uur na toediening toegestaan voor de behandeling van terugkerende hoofdpijn in onderzoeken 1 en 2. Aanvullende pijnstillers en/of anti-emetica werden in alle vier onderzoeken 2 uur na de eerste behandeling toegestaan voor rescue.
In alle onderzoeken was het percentage patiënten dat 2 uur na de behandeling een hoofdpijnrespons bereikte significant groter bij patiënten die MAXALT 5 of 10 mg kregen dan bij degenen die placebo kregen. In een afzonderlijke studie verschilden doses van 2,5 mg niet van placebo. Doses hoger dan 10 mg werden in verband gebracht met een verhoogde incidentie van bijwerkingen. De resultaten van de vier gecontroleerde onderzoeken zijn samengevat in tabel 2.
Vergelijkingen van geneesmiddelprestaties op basis van resultaten verkregen in verschillende klinische onderzoeken zijn mogelijk niet betrouwbaar. Omdat onderzoeken worden uitgevoerd op verschillende tijdstippen, met verschillende steekproeven van patiënten, door verschillende onderzoekers, waarbij verschillende criteria en/of verschillende interpretaties van dezelfde criteria worden gebruikt, onder verschillende omstandigheden (dosis, doseringsschema, enz.), kwantitatieve schattingen van de respons op de behandeling en de timing van de respons kan naar verwachting aanzienlijk variëren van onderzoek tot onderzoek.
De geschatte kans op het bereiken van een eerste hoofdpijnrespons binnen 2 uur na behandeling in gepoolde onderzoeken 1, 2, 3 en 4 is weergegeven in figuur 1.
Afbeelding 1: Geschatte waarschijnlijkheid van het bereiken van een eerste respons op hoofdpijn na 2 uur in gepoolde onderzoeken 1, 2, 3 en 4* 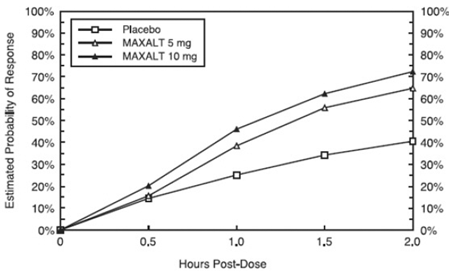
Bij patiënten met migraine-geassocieerde fotofobie, fonofobie en misselijkheid bij aanvang, was er een verminderde incidentie van deze symptomen na toediening van MAXALT in vergelijking met placebo.
Twee tot 24 uur na de aanvangsdosis van de onderzoeksbehandeling mochten patiënten een aanvullende behandeling voor pijnrespons gebruiken in de vorm van een tweede dosis onderzoeksbehandeling of andere medicatie. De geschatte kans dat patiënten een tweede dosis of andere medicatie voor migraine nemen gedurende de 24 uur na de initiële dosis van de onderzoeksbehandeling is samengevat in figuur 2.
Afbeelding 2: Geschatte waarschijnlijkheid van patiënten die een tweede dosis MAXALT 10 mg tabletten of andere medicatie voor migraine nemen gedurende de 24 uur na de initiële dosis van onderzoeksbehandeling in gepoolde onderzoeken 1, 2, 3 en 4* 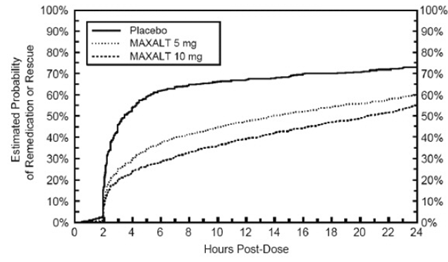
De werkzaamheid werd niet beïnvloed door de aanwezigheid van aura; door het geslacht of de leeftijd van de patiënt; of door gelijktijdig gebruik van veel voorkomende profylactische geneesmiddelen tegen migraine (bijv. bètablokkers, calciumkanaalblokkers, tricyclische antidepressiva) of orale anticonceptiva. In twee aanvullende vergelijkbare onderzoeken werd de werkzaamheid niet beïnvloed door het verband met menstruatie. Er waren onvoldoende gegevens om de invloed van ras op de werkzaamheid te beoordelen.
MAXALT-MLT oraal uiteenvallende tabletten
De werkzaamheid van MAXALT-MLT werd vastgesteld in twee multicenter, gerandomiseerde, placebogecontroleerde onderzoeken die qua opzet vergelijkbaar waren met de onderzoeken met MAXALT-tabletten (onderzoek 5 en 6). Patiënten werden geïnstrueerd om matige tot ernstige hoofdpijn te behandelen. De patiënten die in deze onderzoeken werden behandeld, waren voornamelijk vrouwen (88%) en blanken (95%), met een gemiddelde leeftijd van 42 jaar (bereik 18-72).
In beide onderzoeken was het percentage patiënten dat 2 uur na de behandeling een hoofdpijnrespons bereikte significant groter bij patiënten die MAXALT-MLT 5 of 10 mg kregen dan bij degenen die placebo kregen. De resultaten van onderzoeken 5 en 6 zijn samengevat in tabel 3.
De geschatte kans op het bereiken van een eerste hoofdpijnrespons 2 uur na behandeling met MAXALT-MLT in gepoolde onderzoeken 5 en 6 wordt weergegeven in figuur 3.
Afbeelding 3: Geschatte kans op het bereiken van een initiële hoofdpijnrespons met MAXALT-MLT na 2 uur in gepoolde onderzoeken 5 en 6* 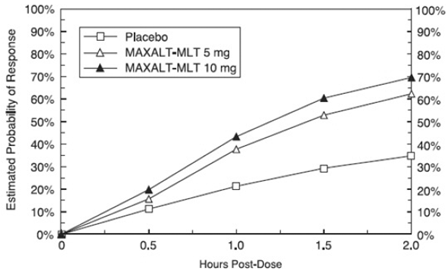
Bij patiënten met migraine-geassocieerde fotofobie en fonofobie bij aanvang, was er een verminderde incidentie van deze symptomen na toediening van MAXALT-MLT in vergelijking met placebo.
Twee tot 24 uur na de aanvangsdosis van de onderzoeksbehandeling mochten patiënten een aanvullende behandeling voor pijnrespons gebruiken in de vorm van een tweede dosis onderzoeksbehandeling of andere medicatie. De geschatte kans dat patiënten een tweede dosis of andere medicatie voor migraine nemen gedurende de 24 uur na de initiële dosis van de onderzoeksbehandeling is samengevat in figuur 4.
Afbeelding 4: Geschatte waarschijnlijkheid van patiënten die een tweede dosis MAXALT-MLT of ander medicijn tegen migraine nemen gedurende de 24 uur na de initiële dosis van onderzoeksbehandeling in gepoolde onderzoeken 5 en 6* 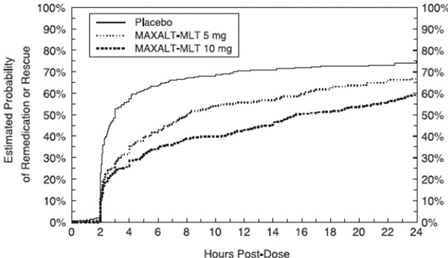
Pediatrische patiënten van 6 tot 17 jaar oud
De werkzaamheid van MAXALT-MLT bij pediatrische patiënten van 6 tot 17 jaar werd geëvalueerd in een multicenter, gerandomiseerd, dubbelblind, placebogecontroleerd klinisch onderzoek met parallelle groepen (onderzoek 7). Patiënten moesten een voorgeschiedenis van ten minste 6 maanden hebben van migraineaanvallen (met of zonder aura) die gewoonlijk 3 uur of langer duurden (indien onbehandeld). De patiëntenpopulatie reageerde in het verleden niet op NSAID's en paracetamoltherapie.
Patiënten werden geïnstrueerd om een enkele migraineaanval te behandelen met hoofdpijn van matige tot ernstige intensiteit. De behandelingsfase van het onderzoek bestond uit twee fasen. Stadium 1 werd gebruikt om placebo-non-responders te identificeren, die vervolgens in Stadium 2 kwamen, waarin patiënten werden gerandomiseerd naar MAXALT-MLT of placebo. Bij gebruik van een op gewicht gebaseerde doseringsstrategie kregen patiënten van 20 kg tot
De gemiddelde leeftijd voor de onderzochte patiëntenpopulatie was 13 jaar. Eenenzestig procent van de patiënten was blank en zesenvijftig procent van de patiënten was vrouw. Het percentage patiënten dat het primaire werkzaamheidseindpunt van geen hoofdpijnpijn bereikte 2 uur na de behandeling was significant groter bij patiënten die MAXALT-MLT kregen, vergeleken met degenen die placebo kregen (33% vs. 24%). De resultaten van Studie 7 zijn samengevat in Tabel 4.
Het waargenomen percentage pediatrische patiënten dat binnen 2 uur na de eerste behandeling met MAXALT-MLT geen hoofdpijnpijn kreeg, wordt weergegeven in afbeelding 5.
Figuur 5: Waargenomen percentage patiënten dat 2 uur na de dosis geen hoofdpijn meldt in onderzoek 7 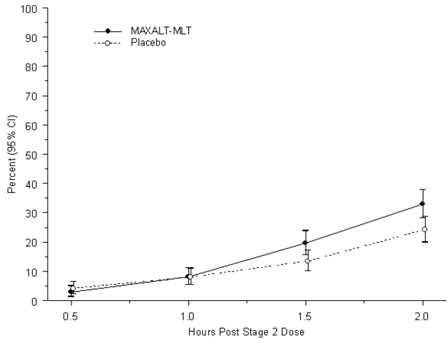
De prevalentie van de verkennende eindpunten van afwezigheid van migraine-geassocieerde symptomen (misselijkheid, fotofobie en fonofobie) 2 uur na inname van de dosis was niet statistisch significant verschillend tussen patiënten die MAXALT-MLT kregen en degenen die placebo kregen.
PATIËNT INFORMATIE
MAXALT® (max-awlt)
MAXALT-MLT® (rizatriptanbenzoaat) Tabletten en oraal uiteenvallende tabletten
Lees deze patiënteninformatie voordat u begint met het innemen van MAXALT® en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of uw behandeling.
Tenzij anders vermeld, is de informatie in deze patiëntenbijsluiter van toepassing op zowel MAXALT 10 mg tabletten als MAXALT-MLT® oraal uiteenvallende tabletten.
Wat is MAXALT?
MAXALT is een receptgeneesmiddel dat behoort tot een klasse geneesmiddelen die triptanen worden genoemd. MAXALT is verkrijgbaar als traditionele tablet (MAXALT) en als oraal uiteenvallende tablet (MAXALT-MLT).
MAXALT 5 mg en MAXALT-MLT worden gebruikt voor de behandeling van migraineaanvallen met of zonder aura bij volwassenen en bij kinderen van 6 tot 17 jaar.
MAXALT 5 mg mag niet worden gebruikt om migraineaanvallen te voorkomen.
MAXALT is niet voor de behandeling van hemiplegische of basilaire migraine.
Het is niet bekend of MAXALT veilig en effectief is voor de behandeling van clusterhoofdpijn.
Het is niet bekend of het innemen van meer dan 1 dosis MAXALT per 24 uur veilig en effectief is bij kinderen van 6 tot 17 jaar.
Het is niet bekend of MAXALT veilig en effectief is bij kinderen jonger dan 6 jaar.
Wie mag MAXALT niet gebruiken?
Gebruik MAXALT niet als u:
- hartproblemen heeft of heeft gehad
- een beroerte of een voorbijgaande ischemische aanval (TIA) heeft of heeft gehad
- bloedvatproblemen heeft of heeft gehad, waaronder ischemische darmziekte
- een ongecontroleerde hoge bloeddruk hebben
- andere Triptan-geneesmiddelen heeft gebruikt in de afgelopen 24 uur
- in de afgelopen 24 uur ergot-bevattende geneesmiddelen heeft gebruikt
- hemiplegische of basilaire migraine hebben
- monoamineoxidase (MAO)-remmer nemen of in de afgelopen 2 weken een MAO-remmer hebben gebruikt
- allergisch bent voor rizatriptanbenzoaat of voor één van de bestanddelen van MAXALT. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in MAXALT.
Neem contact op met uw arts voordat u dit geneesmiddel inneemt als u een van de bovengenoemde aandoeningen heeft of als u niet zeker weet of u een van deze geneesmiddelen gebruikt.
Wat moet ik mijn arts vertellen voordat ik MAXALT inneem?
Voordat u MAXALT inneemt, vertel het uw arts als u:
- hartproblemen, hoge bloeddruk, pijn op de borst of kortademigheid heeft of heeft gehad
- risicofactoren heeft voor hartproblemen of bloedvatproblemen, zoals:
- hoge bloeddruk
- hoge cholesterol
- roken
- zwaarlijvigheid
- suikerziekte
- familiegeschiedenis van hartproblemen
- je bent na de menopauze
- je bent een man boven de 40
- fenylketonurie (PKU) heeft. MAXALT-MLT oraal uiteenvallende tabletten bevatten fenylalanine.
- nier- of leverproblemen heeft
- een andere medische aandoening hebben
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of MAXALT schadelijk is voor uw ongeboren baby. Als u zwanger wordt terwijl u MAXALT 5 mg gebruikt, neem dan contact op met uw zorgverlener.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of MAXALT 10 mg in uw moedermelk terechtkomt. Praat met uw arts over de beste manier om uw baby te voeden als u MAXALT gebruikt.
Vertel uw arts over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen.
MAXALT 10 mg en andere geneesmiddelen kunnen elkaar beïnvloeden en bijwerkingen veroorzaken. MAXALT kan de werking van andere geneesmiddelen beïnvloeden, en andere geneesmiddelen kunnen de werking van MAXALT 5 mg beïnvloeden.
Vertel het uw arts vooral als u:
- propranolol-bevattende geneesmiddelen zoals Inderal®, Inderal® LA of Innopran® XL
- geneesmiddelen voor de behandeling van stemmingsstoornissen, waaronder selectieve serotonineheropnameremmers (SSRI's) of serotonine-noradrenalineheropnameremmers (SNRI's).
Vraag uw arts of apotheker om een lijst van deze geneesmiddelen als u het niet zeker weet.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw arts en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik MAXALT gebruiken?
- Neem MAXALT precies in zoals uw arts u zegt dat u het moet innemen.
- Uw arts zal u vertellen hoeveel MAXALT 5 mg u moet innemen en wanneer u het moet innemen.
- Om MAXALT-MLT in te nemen:
- Laat MAXALT-MLT oraal desintegrerende tabletten in de verpakking waarin het zit totdat u klaar bent om het in te nemen. Wanneer u klaar bent om het te nemen:
- Haal de blister uit het foliezakje. Duw de MAXALT-MLT oraal uiteenvallende tablet niet door de blisterverpakking.
- Trek de blisterverpakking open met droge handen en plaats de MAXALT-MLT oraal uiteenvallende tablet op uw tong. De tablet zal oplossen en met uw speeksel worden ingeslikt. Er is geen vloeistof nodig om de oraal uiteenvallende tablet in te nemen.
- Laat MAXALT-MLT oraal desintegrerende tabletten in de verpakking waarin het zit totdat u klaar bent om het in te nemen. Wanneer u klaar bent om het te nemen:
- Als uw hoofdpijn terugkomt na uw eerste dosis MAXALT 10 mg:
- Voor volwassenen: een tweede dosis kan 2 uur na de eerste dosis worden ingenomen. Neem niet meer dan 30 mg MAXALT in een periode van 24 uur (neem bijvoorbeeld niet meer dan 3 tabletten van 10 mg in een periode van 24 uur).
- Voor kinderen van 6 tot 17 jaar: Het is niet bekend of het veilig en effectief is om meer dan 1 dosis MAXALT 5 mg per 24 uur in te nemen. Praat met uw arts over wat u moet doen als uw hoofdpijn niet weggaat of terugkomt.
- Als u te veel MAXALT 5 mg heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga naar de eerste hulpafdeling van het dichtstbijzijnde ziekenhuis.
Wat moet ik vermijden tijdens het gebruik van MAXALT?
MAXALT 5 mg kan duizeligheid, zwakte of flauwvallen veroorzaken. Als u deze symptomen heeft, bestuur dan geen auto, gebruik geen machines en doe niets waarvoor u alert moet zijn.
Wat zijn de mogelijke bijwerkingen van MAXALT 5 mg?
MAXALT 5 mg kan ernstige bijwerkingen veroorzaken. Bel uw arts of ga direct naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis als u denkt dat u een van de ernstige bijwerkingen van MAXALT heeft, waaronder:
- hartaanval. Symptomen van een hartaanval kunnen zijn:
- ongemak op de borst in het midden van uw borstkas dat langer dan een paar minuten aanhoudt of dat weggaat en terugkomt
- ongemak op de borst dat aanvoelt als oncomfortabele druk, knijpen, volheid of pijn
- pijn of ongemak in uw armen, rug, nek, kaak of maag
- kortademigheid met of zonder ongemak op de borst
- uitbrekend in het koude zweet
- misselijkheid of braken
- zich licht in het hoofd voelen
- hartinfarct. Symptomen van een beroerte kunnen de volgende plotselinge symptomen zijn:
- gevoelloosheid of zwakte in uw gezicht, arm of been, vooral aan één kant van uw lichaam
- verwarring, problemen met spreken of begrijpen
- problemen met zien in 1 of beide ogen
- problemen met lopen, duizeligheid, verlies van evenwicht of coördinatie
- ernstige hoofdpijn zonder bekende oorzaak
- problemen met bloedvaten. Symptomen van bloedvatproblemen kunnen zijn:
- buikpijn
- bloederige diarree
- zichtproblemen
- koude en gevoelloosheid van handen en voeten
- serotonine syndroom. Een aandoening die serotoninesyndroom wordt genoemd, kan optreden wanneer geneesmiddelen van Triptan, zoals MAXALT, samen met bepaalde andere geneesmiddelen worden ingenomen. Symptomen van het serotoninesyndroom kunnen zijn:
- agitatie
- hallucinaties
- coma
- snelle hartslag
- snelle veranderingen in uw bloeddruk
- verhoogde lichaamstemperatuur
- spierspasmen
- verlies van coördinatie
- misselijkheid, braken of diarree
- verhoogde bloeddruk.
De meest voorkomende bijwerkingen van MAXALT bij volwassenen zijn:
- slaperig of moe voelen
- pijn of druk in uw borst of keel
- duizeligheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Als u MAXALT 10 mg te vaak inneemt, kan dit ertoe leiden dat u chronische hoofdpijn krijgt. In dergelijke gevallen dient u contact op te nemen met uw arts, aangezien u mogelijk moet stoppen met het gebruik van MAXALT.
Dit zijn niet alle mogelijke bijwerkingen van MAXALT. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA1088.
Hoe moet ik MAXALT bewaren?
- Bewaar MAXALT bij kamertemperatuur tussen 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Gooi medicijnen die over de datum zijn of niet meer nodig zijn, veilig weg.
Houd MAXALT 10 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van MAXALT.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik MAXALT niet voor een aandoening waarvoor het niet is voorgeschreven. Geef MAXALT niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze bijsluiter voor patiënten vat de belangrijkste informatie over MAXALT samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw apotheker of arts om informatie vragen over MAXALT die is geschreven voor gezondheidswerkers.
Ga voor meer informatie naar www.maxalt.com.
Wat zijn de ingrediënten in MAXALT?
Werkzaam bestanddeel in MAXALT 10 mg en MAXALT-MLT oraal uiteenvallende tabletten:
rizatriptan benzoaat.
Inactieve ingrediënten in MAXALT: lactosemonohydraat, microkristallijne cellulose, gepregelatiniseerd zetmeel, ijzeroxide (rood) en magnesiumstearaat.
Inactieve ingrediënten in MAXALT-MLT oraal uiteenvallende tabletten: gelatine, mannitol, glycine, aspartaam en pepermuntsmaak.
MAXALT-MLT oraal uiteenvallende tabletten bevatten aspartaam, een bron van fenylalanine.
Fenylketonurie:
MAXALT-MLT oraal uiteenvallende tabletten van 5 mg bevatten 1,1 mg fenylalanine. MAXALT-MLT oraal uiteenvallende tabletten van 10 mg bevatten 2,1 mg fenylalanine.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
