Imitrex 100mg, 25mg, 50mg Sumatriptan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Imitrex 25 mg en hoe wordt het gebruikt?
Imitrex 100 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van migrainehoofdpijn en clusterhoofdpijn te behandelen. Imitrex kan alleen of in combinatie met andere medicijnen worden gebruikt.
Imitrex 50 mg is een antimigrainemiddel, seratonine 5-HT-receptoragonist.
Het is niet bekend of Imitrex 50 mg veilig en effectief is bij kinderen jonger dan 18 jaar en het gebruik wordt niet aanbevolen voor geriatrische patiënten.
Wat zijn de mogelijke bijwerkingen van Imitrex 50 mg?
Imitrex 25 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- plotselinge, hevige buikpijn,
- diarree met of zonder de aanwezigheid van bloed,
- ernstige pijn op de borst,
- pijn in uw kaak of schouder,
- kortademigheid,
- onregelmatige hartslagen,
- toevallen (convulsies),
- beenkrampen,
- gevoelloosheid of tintelingen in uw benen of voeten,
- brandende pijn in uw benen of voeten,
- koud gevoel in uw benen of voeten,
- kleurveranderingen in uw benen of voeten,
- heuppijn,
- misselijkheid,
- braken,
- zweten of rillen,
- agitatie,
- hallucinaties,
- koorts,
- Spierstijfheid,
- verlies van coördinatie,
- plotselinge gevoelloosheid of zwakte aan één kant van het lichaam,
- onduidelijke spraak,
- moeite met zien,
- slecht evenwicht, en
- plotselinge ernstige hoofdpijn
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Imitrex zijn:
- pijn of beklemd gevoel in uw borst, keel of kaak,
- druk in een deel van uw lichaam,
- gevoelloosheid of tintelingen ,
- warm of koud voelen,
- duizeligheid,
- slaperigheid,
- zwakheid,
- onaangename smaak na gebruik van het neusgeneesmiddel,
- pijn, branderig gevoel, gevoelloosheid of tintelingen in uw neus of keel na gebruik van het neusgeneesmiddel, en
- loopneus of verstopte neus na gebruik van het neusgeneesmiddel
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Imitrex. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
IMITREX 50 mg injectie bevat sumatriptansuccinaat, een selectieve 5-HT1B/1D-receptoragonist. Sumatriptansuccinaat wordt chemisch aangeduid als 3-[2-(dimethylamino)ethyl]-N-methyl-indole5-methaansulfonamidesuccinaat (1:1) en heeft de volgende structuur:
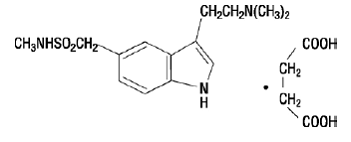
De empirische formule is C14H21N3O2S•C4H6O4, wat een molecuulgewicht van 413,5 vertegenwoordigt. Sumatriptansuccinaat is een wit tot gebroken wit poeder dat gemakkelijk oplosbaar is in water en zoutoplossing.
IMITREX-injectie is een heldere, kleurloze tot lichtgele, steriele, niet-pyrogene oplossing voor subcutane injectie. Elke 0, 5 ml IMITREX-injectieoplossing van 8 mg / ml bevat 4 mg sumatriptan (base) als het succinaatzout en 3, 8 mg natriumchloride, USP in water voor injectie, USP. Elke 0, 5 ml IMITREX-injectie van 12 mg / ml oplossing bevat 6 mg sumatriptan (base) als het succinaatzout en 3, 5 mg natriumchloride, USP in water voor injectie, USP. Het pH-bereik van beide oplossingen is ongeveer 4,2 tot 5,3. De osmolaliteit van beide injecties is 291 mOsmol.
INDICATIES
IMITREX®-injectie is geïndiceerd bij volwassenen voor (1) de acute behandeling van migraine, met of zonder aura, en (2) de acute behandeling van clusterhoofdpijn.
Beperkingen van gebruik
- Alleen gebruiken als een duidelijke diagnose van migraine of clusterhoofdpijn is vastgesteld. Als een patiënt niet reageert op de eerste aanval van migraine of clusterhoofdpijn die met IMITREX 50 mg wordt behandeld, heroverweeg dan de diagnose voordat IMITREX wordt toegediend om eventuele volgende aanvallen te behandelen.
- IMITREX-injectie is niet geïndiceerd voor de preventie van migraine- of clusterhoofdpijnaanvallen.
DOSERING EN ADMINISTRATIE
Doseringsinformatie
De maximale enkelvoudige aanbevolen dosis voor volwassenen van IMITREX 25 mg voor de acute behandeling van migraine of clusterhoofdpijn is 6 mg subcutaan geïnjecteerd. Voor de behandeling van migraine kunnen, als de bijwerkingen dosisbeperkend zijn, lagere doses (1 mg tot 5 mg) worden gebruikt [zie: Klinische studies ]. Voor de behandeling van clusterhoofdpijn is de werkzaamheid van lagere doses niet vastgesteld.
De maximale cumulatieve dosis die in 24 uur mag worden gegeven, is 12 mg, twee injecties van 6 mg met een tussenpoos van ten minste 1 uur. Een tweede dosis van 6 mg mag alleen worden overwogen als er enige respons op een eerste injectie is waargenomen.
Toediening met de IMITREX STATdose Pen®
Er is een auto-injector (IMITREX 25 mg STATdose Pen) beschikbaar voor gebruik met voorgevulde spuitpatronen van 4 mg en 6 mg. Met dit apparaat penetreert de naald ongeveer 1/4 inch (5 tot 6 mm). De injectie is bedoeld om subcutaan te worden toegediend en intramusculaire of intravasculaire toediening moet worden vermeden. Instrueer patiënten over het juiste gebruik van IMITREX 100 mg STATdose Pen en wijs hen op injectieplaatsen met een voldoende huid- en onderhuiddikte om de lengte van de naald aan te passen.
Toediening van doses IMITREX anders dan 4 of 6 mg
Gebruik bij patiënten die andere doses dan 4 mg of 6 mg krijgen de flacon met een enkelvoudige dosis van 6 mg; gebruik de IMITREX 50 mg STATdose Pen niet. Inspecteer de injectieflacon visueel op deeltjes en verkleuring vóór toediening. Niet gebruiken als deeltjes en verkleuringen worden opgemerkt.
HOE GELEVERD
Doseringsvormen en sterke punten
- Injectie: voorgevulde spuitpatronen van 4 mg en 6 mg voor gebruik met de IMITREX STATdose Pen.
- Injectie: injectieflacon met een enkele dosis van 6 mg.
Opslag en behandeling
IMITREX 100 mg injectie bevat sumatriptan (base) als het succinaatzout en wordt als volgt geleverd als een heldere, kleurloze tot lichtgele, steriele, niet-pyrogene oplossing:
Voorgevulde spuit en/of auto-injectorpen
Elke verpakking bevat een bijsluiter met patiënteninformatie en gebruiksaanwijzing voor de patiënt.
IMITREX 100 mg STATdose System®, 4 mg , met 1 IMITREX 25 mg STATdose Pen, 2 voorgevulde spuitpatronen voor eenmalig gebruik en 1 draagtas ( NDC 0173-0739-00).
IMITREX 100 mg STAT-dosissysteem, 6 mg met 1 IMITREX STATdose Pen, 2 voorgevulde patronen voor een enkelvoudige injectiespuit en 1 draagtas ( NDC 0173-0479-00).
Twee voorgevulde spuiten van 4 mg voor eenmalig gebruik patronen voor gebruik met IMITREX STATdose System ( NDC 0173-0739-02).
Twee voorgevulde spuiten van 6 mg voor eenmalig gebruik patronen voor gebruik met IMITREX 25 mg STATdose System ( NDC 0173-0478-00).
Injectieflacon voor eenmalig gebruik
IMITREX 25 mg injectieflacon voor eenmalig gebruik (6 mg/0,5 ml) in dozen met 5 injectieflacons ( NDC 01730449-02).
Bewaren tussen 2 ° en 30 ° C (36 ° en 86 ° F). Bescherm tegen licht.
GlaxoSmithKline, Research Triangle Park, NC 27709
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Myocardischemie, myocardinfarct en Prinzmetal-angina [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Aritmieën [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Borst-, keel-, nek- en/of kaakpijn/ beklemd gevoel/druk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cerebrovasculaire gebeurtenissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Andere vasospasme-reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Medicatieoverbelastingshoofdpijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoging van de bloeddruk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Migraine
Tabel 1 geeft de bijwerkingen weer die optraden in 2 Amerikaanse placebogecontroleerde klinische onderzoeken bij migrainepatiënten (onderzoeken 2 en 3) na een enkele dosis van 6 mg IMITREX 100 mg injectie of placebo. Alleen reacties die optraden met een frequentie van 2% of meer in groepen die werden behandeld met IMITREX-injectie 6 mg en die optraden met een frequentie die hoger was dan de placebogroep, zijn opgenomen in Tabel 1.
De incidentie van bijwerkingen in gecontroleerde klinische onderzoeken werd niet beïnvloed door het geslacht of de leeftijd van de patiënten. Er waren onvoldoende gegevens om de impact van ras op de incidentie van bijwerkingen te beoordelen.
Clusterhoofdpijn
In de gecontroleerde klinische onderzoeken naar de werkzaamheid van IMITREX 50 mg injectie als behandeling van clusterhoofdpijn (onderzoeken 4 en 5), werden geen nieuwe significante bijwerkingen gedetecteerd die nog niet waren vastgesteld in onderzoeken met IMITREX 100 mg bij patiënten met migraine.
Over het algemeen was de frequentie van bijwerkingen die werden gemeld in de onderzoeken naar clusterhoofdpijn over het algemeen lager dan in de migraineonderzoeken. Uitzonderingen zijn onder meer meldingen van paresthesie (5% IMITREX, 0% placebo), misselijkheid en braken (4% IMITREX, 0% placebo) en bronchospasme (1% IMITREX 50 mg, 0% placebo).
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van IMITREX 50 mg tabletten, IMITREX neusspray en IMITREX 50 mg injectie na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Cardiovasculair
Hypotensie, hartkloppingen.
neurologisch
Dystonie, tremor.
DRUG-INTERACTIES
Ergot-bevattende medicijnen
Er is gemeld dat ergot-bevattende geneesmiddelen langdurige vasospastische reacties veroorzaken. Omdat deze effecten additief kunnen zijn, is het gebruik van ergotaminebevattende of ergot-achtige medicijnen (zoals dihydro-ergotamine of methysergide) en IMITREX 25 mg injectie binnen 24 uur na elkaar gecontra-indiceerd.
Monoamineoxidase-A-remmers
MAO-A-remmers verhogen de systemische blootstelling met een factor twee. Daarom is het gebruik van IMITREX-injectie bij patiënten die MAO-A-remmers krijgen gecontra-indiceerd [zie: KLINISCHE FARMACOLOGIE ].
Andere 5-HT1-agonisten
Omdat hun vasospastische effecten additief kunnen zijn, is gelijktijdige toediening van IMITREX-injectie en andere 5-HT1-agonisten (bijv. triptanen) binnen 24 uur na elkaar gecontra-indiceerd.
Selectieve serotonineheropnameremmers/serotonine Noradrenalineheropnameremmers en serotoninesyndroom
Er zijn gevallen van serotoninesyndroom gemeld tijdens gelijktijdige toediening van triptanen en SSRI's, SNRI's, TCA's en MAO-remmers (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Myocardiale ischemie, myocardinfarct en Prinzmetal-angina
Het gebruik van IMITREX-injectie is gecontra-indiceerd bij patiënten met ischemische of vasospastische CAD. Er zijn zeldzame meldingen geweest van ernstige cardiale bijwerkingen, waaronder acuut myocardinfarct, die optraden binnen een paar uur na toediening van IMITREX-injectie. Sommige van deze reacties traden op bij patiënten zonder bekende CAD. IMITREX 100 mg injectie kan coronaire arteriële vasospasme (Prinzmetal-angina) veroorzaken, zelfs bij patiënten zonder een voorgeschiedenis van CAD.
Voer een cardiovasculaire evaluatie uit bij triptan-naïeve patiënten die meerdere cardiovasculaire risicofactoren hebben (bijv. verhoogde leeftijd, diabetes, hypertensie, roken, obesitas, sterke familiegeschiedenis van CAD) voordat ze IMITREX-injectie krijgen. Als er aanwijzingen zijn voor CAD of vasospasme van de kransslagader, is IMITREX 100 mg injectie gecontra-indiceerd. Voor patiënten met meerdere cardiovasculaire risicofactoren die een negatieve cardiovasculaire evaluatie hebben, overweeg om de eerste dosis IMITREX-injectie toe te dienen in een omgeving onder medisch toezicht en een elektrocardiogram (ECG) uit te voeren onmiddellijk na toediening van IMITREX-injectie. Overweeg voor dergelijke patiënten een periodieke cardiovasculaire evaluatie bij intermitterende langdurige gebruikers van IMITREX 100 mg injectie.
Aritmieën
Levensbedreigende hartritmestoornissen, waaronder ventriculaire tachycardie en ventriculaire fibrillatie die tot de dood leiden, zijn gemeld binnen enkele uren na toediening van 5-HT1-agonisten. Stop met IMITREX-injectie als deze stoornissen optreden. IMITREX-injectie is gecontra-indiceerd bij patiënten met het Wolff-Parkinson-White-syndroom of aritmieën geassocieerd met andere cardiale accessoire geleidingsstoornissen.
Borst, keel, nek en/of kaakpijn/strakheid/druk
Gevoelens van beklemming, pijn, druk en zwaarte in het precordium, keel, nek en kaak komen vaak voor na behandeling met IMITREX-injectie en zijn meestal niet-cardiaal van oorsprong. Voer echter een hartevaluatie uit als deze patiënten een hoog hartrisico hebben. Het gebruik van IMITREX-injectie is gecontra-indiceerd bij patiënten met CAD en bij patiënten met angina van de Prinzmetal-variant.
Cerebrovasculaire gebeurtenissen
Hersenbloeding, subarachnoïdale bloeding en beroerte zijn opgetreden bij patiënten die werden behandeld met 5-HT1-agonisten, en sommige hebben geleid tot dodelijke afloop. In een aantal gevallen lijkt het mogelijk dat de cerebrovasculaire gebeurtenissen primair waren, aangezien de 5-HT1-agonist werd toegediend in de onjuiste overtuiging dat de ervaren symptomen een gevolg waren van migraine terwijl dat niet het geval was. Ook kunnen patiënten met migraine een verhoogd risico hebben op bepaalde cerebrovasculaire gebeurtenissen (bijv. beroerte, bloeding, TIA). Stop met IMITREX-injectie als zich een cerebrovasculaire gebeurtenis voordoet.
Alvorens hoofdpijn te behandelen bij patiënten die niet eerder zijn gediagnosticeerd met migraine of clusterhoofdpijn of bij patiënten met atypische symptomen, moet u andere potentieel ernstige neurologische aandoeningen uitsluiten. IMITREX-injectie is gecontra-indiceerd bij patiënten met een voorgeschiedenis van een beroerte of TIA.
Andere vasospasme-reacties
IMITREX 25 mg injectie kan niet-coronaire vasospastische reacties veroorzaken, zoals perifere vasculaire ischemie, gastro-intestinale vasculaire ischemie en infarct (met buikpijn en bloederige diarree), miltinfarct en het syndroom van Raynaud. Bij patiënten die symptomen of tekenen ervaren die wijzen op een niet-coronaire vasospasmereactie na het gebruik van een 5-HT1-agonist, sluit een vasospastische reactie uit voordat ze aanvullende IMITREX-injecties krijgen.
Bij gebruik van 5-HT1-agonisten zijn meldingen van voorbijgaande en permanente blindheid en aanzienlijk gedeeltelijk verlies van het gezichtsvermogen gemeld. Aangezien visuele stoornissen deel kunnen uitmaken van een migraineaanval, is een oorzakelijk verband tussen deze gebeurtenissen en het gebruik van 5-HT1-agonisten niet duidelijk vastgesteld.
Medicatie overmatig gebruik Hoofdpijn
Overmatig gebruik van geneesmiddelen tegen acute migraine (bijv. ergotamine, triptanen, opioïden of een combinatie van deze geneesmiddelen gedurende 10 of meer dagen per maand) kan leiden tot verergering van hoofdpijn (hoofdpijn door overmatig gebruik van medicijnen). Hoofdpijn door overmatig gebruik van medicijnen kan zich voordoen als migraine-achtige dagelijkse hoofdpijn, of als een duidelijke toename van de frequentie van migraineaanvallen. Het kan nodig zijn om patiënten te ontgiften, met inbegrip van het staken van de te veel gebruikte geneesmiddelen, en de behandeling van ontwenningsverschijnselen (waaronder vaak een voorbijgaande verergering van hoofdpijn).
serotonine syndroom
Serotoninesyndroom kan optreden bij IMITREX-injectie, met name bij gelijktijdige toediening met selectieve serotonineheropnameremmers (SSRI's), serotonine-norepinefrineheropnameremmers (SNRI's), tricyclische antidepressiva (TCA's) en MAO-remmers (zie DRUG-INTERACTIES ]. Symptomen van het serotoninesyndroom kunnen veranderingen in de mentale toestand omvatten (bijv. agitatie, hallucinaties, coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, hyperthermie), neuromusculaire aberraties (bijv. hyperreflexie, coördinatiestoornissen) en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Het begin van de symptomen treedt meestal op binnen minuten tot uren na ontvangst van een nieuwe of een grotere dosis van een serotonerge medicatie. Stop met IMITREX-injectie als het serotoninesyndroom wordt vermoed.
Verhoging van de bloeddruk
Aanzienlijke verhoging van de bloeddruk, waaronder hypertensieve crisis met acute beschadiging van orgaansystemen, is in zeldzame gevallen gemeld bij patiënten die werden behandeld met 5-HT1-agonisten, waaronder patiënten zonder een voorgeschiedenis van hypertensie. Controleer de bloeddruk bij patiënten die met IMITREX worden behandeld. IMITREX-injectie is gecontra-indiceerd bij patiënten met ongecontroleerde hypertensie.
Anafylactische/anafylactoïde reacties
Anafylactische/anafylactoïde reacties zijn opgetreden bij patiënten die IMITREX kregen. Dergelijke reacties kunnen levensbedreigend of dodelijk zijn. Over het algemeen komen anafylactische reacties op geneesmiddelen vaker voor bij personen met een voorgeschiedenis van gevoeligheid voor meerdere allergenen. IMITREX 50 mg injectie is gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheidsreactie op IMITREX.
epileptische aanvallen
Er zijn epileptische aanvallen gemeld na toediening van IMITREX. Sommige zijn opgetreden bij patiënten met een voorgeschiedenis van convulsies of gelijktijdige aandoeningen die predisponeren voor convulsies. Er zijn ook meldingen bij patiënten bij wie dergelijke predisponerende factoren niet aanwezig zijn. IMITREX-injectie moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van epilepsie of aandoeningen die gepaard gaan met een verlaagde aanvalsdrempel.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATINTINFORMATIE en gebruiksaanwijzing ).
Risico op myocardischemie en/of infarct, Prinzmetal-angina, andere vasospasme-gerelateerde voorvallen, aritmieën en cerebrovasculaire voorvallen
Informeer patiënten dat IMITREX 50 mg injectie ernstige cardiovasculaire bijwerkingen kan veroorzaken, zoals een hartinfarct of beroerte. Hoewel ernstige cardiovasculaire voorvallen kunnen optreden zonder waarschuwingssymptomen, moeten patiënten alert zijn op de tekenen en symptomen van pijn op de borst, kortademigheid, onregelmatige hartslag, significante stijging van de bloeddruk, zwakte en onduidelijke spraak, en moeten ze medisch advies vragen als enig indicatief teken of symptomen worden waargenomen. Breng patiënten op de hoogte van het belang van deze follow-up [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Anafylactische/anafylactoïde reacties
Informeer patiënten dat anafylactische/anafylactoïde reacties zijn opgetreden bij patiënten die IMITREX 100 mg injectie kregen. Dergelijke reacties kunnen levensbedreigend of dodelijk zijn. Over het algemeen komen anafylactische reacties op geneesmiddelen vaker voor bij personen met een voorgeschiedenis van gevoeligheid voor meerdere allergenen [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelijktijdig gebruik met andere triptanen of ergotmedicijnen
Informeer patiënten dat het gebruik van IMITREX 50 mg injectie binnen 24 uur na een ander triptan- of ergot-type medicatie (inclusief dihydro-ergotamine of methysergide) gecontra-indiceerd is [zie CONTRA-INDICATIES , DRUG-INTERACTIES ].
serotonine syndroom
Pas op voor patiënten met het risico op serotoninesyndroom bij het gebruik van IMITREX-injectie of andere triptanen, vooral tijdens gecombineerd gebruik met SSRI's, SNRI's, TCA's en MAO-remmers [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Medicatie overmatig gebruik Hoofdpijn
Informeer patiënten dat het gebruik van geneesmiddelen tegen acute migraine gedurende 10 of meer dagen per maand kan leiden tot een verergering van hoofdpijn en moedig patiënten aan om de hoofdpijnfrequentie en het medicijngebruik te registreren (bijv. door een hoofdpijndagboek bij te houden) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
Informeer patiënten dat IMITREX 25 mg injectie niet tijdens de zwangerschap mag worden gebruikt, tenzij het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus [zie Gebruik bij specifieke populaties ].
Moeders die borstvoeding geven
Adviseer patiënten om hun zorgverlener op de hoogte te stellen als ze borstvoeding geven of van plan zijn borstvoeding te geven [zie Gebruik in specifieke populaties ].
Mogelijkheid om complexe taken uit te voeren
Behandeling met IMITREX 25 mg injectie kan slaperigheid en duizeligheid veroorzaken; instrueer patiënten om hun vermogen om complexe taken uit te voeren te evalueren na toediening van IMITREX 25 mg injectie.
Hoe IMITREX 100 mg injectie te gebruiken?
Geef patiënten instructies over het juiste gebruik van IMITREX 100 mg injectie als ze in staat zijn om IMITREX 50 mg injectie zelf toe te dienen in medisch ongecontroleerde situaties.
Informeer patiënten dat de naald in de IMITREX STATdose Pen ongeveer 1/4 inch (5 tot 6 mm) doordringt. Informeer patiënten dat de injectie bedoeld is om subcutaan te worden toegediend en dat intramusculaire of intravasculaire toediening moet worden vermeden. Instrueer patiënten om injectieplaatsen te gebruiken met een geschikte huid en onderhuidse dikte om de lengte van de naald aan te passen.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
In carcinogeniteitsonderzoeken bij muizen en ratten waarbij sumatriptan oraal werd toegediend gedurende respectievelijk 78 weken en 104 weken, in doses tot 160 mg/kg/dag (de hoogste dosis bij ratten werd verlaagd van 360 mg/kg/dag in week 21 ). De hoogste dosis voor muizen en ratten was ongeveer 130 en 260 keer de enkele MRHD van 6 mg subcutaan toegediend op basis van mg/m². Er was bij geen van beide soorten bewijs van een toename van tumoren gerelateerd aan de toediening van sumatriptan.
Mutagenese
Sumatriptan was negatief in in vitro (bacteriële omgekeerde mutatie [Ames], gencelmutatie in Chinese hamster V79/HGPRT, chromosomale aberratie in menselijke lymfocyten) en in vivo (rat micronucleus) testen.
Aantasting van de vruchtbaarheid
Wanneer sumatriptan via subcutane injectie werd toegediend aan mannelijke en vrouwelijke ratten vóór en tijdens de paringsperiode, was er geen bewijs van verminderde vruchtbaarheid bij doses tot 60 mg/kg/dag of ongeveer 100 maal de enkelvoudige dosis voor de mens van 6 mg op een mg/m² basis. Wanneer sumatriptan (5, 50, 500 mg/kg/dag) oraal werd toegediend aan mannelijke en vrouwelijke ratten vóór en tijdens de paringsperiode, was er een behandelingsgerelateerde afname in vruchtbaarheid secundair aan een afname in paring bij dieren die werden behandeld met doses meer dan 5 mg/kg/dag. Het is niet duidelijk of deze bevinding het gevolg was van een effect op mannen of vrouwen of beide.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie C
Er zijn geen adequate en goed gecontroleerde onderzoeken met IMITREX 50 mg injectie bij zwangere vrouwen. In ontwikkelingstoxiciteitsonderzoeken bij ratten en konijnen werd orale toediening van sumatriptan aan drachtige dieren geassocieerd met embryoletaliteit, foetale afwijkingen en sterfte van de jongen. Bij intraveneuze toediening aan drachtige konijnen was sumatriptan embryoletaal. IMITREX 100 mg injectie mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Orale toediening van sumatriptan aan drachtige ratten tijdens de periode van organogenese resulteerde in een verhoogde incidentie van foetale bloedvatafwijkingen (cervicothoracale en navelstreng). De hoogste dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit was 60 mg/kg/dag, of ongeveer 100 keer de enkelvoudige maximale aanbevolen dosis voor de mens (MRHD) van 6 mg subcutaan toegediend op basis van mg/m². Orale toediening van sumatriptan aan drachtige konijnen tijdens de periode van organogenese resulteerde in een verhoogde incidentie van embryoletaliteit en foetale cervicothoracale vasculaire en skeletafwijkingen. Intraveneuze toediening van sumatriptan aan drachtige konijnen tijdens de periode van organogenese resulteerde in een verhoogde incidentie van embryoletaliteit. De hoogste orale en intraveneuze doses zonder effect voor ontwikkelingstoxiciteit bij konijnen waren respectievelijk 15 en 0,75 mg/kg/dag, of ongeveer 50 en 2 keer de enkelvoudige MRHD van 6 mg subcutaan toegediend op basis van mg/m².
Orale toediening van sumatriptan aan ratten voor en tijdens de dracht resulteerde in embryofoetale toxiciteit (verminderd lichaamsgewicht, verminderde ossificatie, verhoogde incidentie van skeletafwijkingen). De hoogste dosis zonder effect was 50 mg/kg/dag, of ongeveer 80 keer de enkelvoudige MRHD van 6 mg subcutaan toegediend op basis van mg/m². Bij nakomelingen van drachtige ratten die oraal werden behandeld met sumatriptan tijdens de organogenese, was er een afname van de overleving van de jongen. De hoogste dosis zonder effect voor dit effect was 60 mg/kg/dag, of ongeveer 100 keer de enkelvoudige MRHD van 6 mg subcutaan toegediend op basis van mg/m². Orale behandeling van drachtige ratten met sumatriptan tijdens het laatste deel van de dracht en tijdens de lactatie resulteerde in een afname van de overleving van de jongen. De hoogste dosis zonder effect voor deze bevinding was 100 mg/kg/dag, of ongeveer 160 keer de enkelvoudige MRHD van 6 mg subcutaan toegediend op basis van mg/m².
Moeders die borstvoeding geven
Sumatriptan wordt uitgescheiden in de moedermelk na subcutane toediening. Blootstelling van zuigelingen aan sumatriptan kan worden geminimaliseerd door borstvoeding te vermijden gedurende 12 uur na behandeling met IMITREX 50 mg injectie.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld. IMITREX 100 mg injectie wordt niet aanbevolen voor gebruik bij patiënten jonger dan 18 jaar.
Twee gecontroleerde klinische onderzoeken evalueerden IMITREX-neusspray (5 tot 20 mg) bij 1.248 pediatrische migrainepatiënten van 12 tot 17 jaar die een enkele aanval behandelden. De onderzoeken hebben de werkzaamheid van IMITREX-neusspray niet vastgesteld in vergelijking met placebo bij de behandeling van migraine bij pediatrische patiënten. Bijwerkingen die in deze klinische onderzoeken werden waargenomen, waren vergelijkbaar met de bijwerkingen die werden gemeld in klinische onderzoeken bij volwassenen.
Vijf gecontroleerde klinische onderzoeken (2 onderzoeken met een enkele aanval, 3 onderzoeken met meerdere aanvallen) ter evaluatie van oraal IMITREX (25 tot 100 mg) bij pediatrische patiënten van 12 tot 17 jaar namen in totaal 701 pediatrische migrainepatiënten op. Deze onderzoeken hebben de werkzaamheid van oraal IMITREX 25 mg niet vastgesteld in vergelijking met placebo bij de behandeling van migraine bij pediatrische patiënten. Bijwerkingen die in deze klinische onderzoeken werden waargenomen, waren vergelijkbaar met de bijwerkingen die werden gemeld in klinische onderzoeken bij volwassenen. De frequentie van alle bijwerkingen bij deze patiënten bleek zowel dosis- als leeftijdsafhankelijk te zijn, waarbij jongere patiënten vaker reacties meldden dan oudere pediatrische patiënten.
Postmarketingervaring toont aan dat ernstige bijwerkingen zijn opgetreden bij pediatrische patiënten na gebruik van subcutaan, oraal en/of intranasaal IMITREX. Deze meldingen omvatten reacties die qua aard vergelijkbaar zijn met de reacties die zelden bij volwassenen worden gemeld, waaronder beroerte, verlies van gezichtsvermogen en overlijden. Een myocardinfarct is gemeld bij een 14-jarige man na het gebruik van oraal IMITREX; klinische symptomen traden op binnen 1 dag na toediening van het geneesmiddel. Klinische gegevens om de frequentie van ernstige bijwerkingen te bepalen bij pediatrische patiënten die mogelijk subcutaan, oraal of intranasaal IMITREX krijgen, zijn momenteel niet beschikbaar.
Geriatrisch gebruik
Klinische onderzoeken met IMITREX 100 mg injectie omvatten niet voldoende aantallen patiënten van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Een cardiovasculaire evaluatie wordt aanbevolen voor geriatrische patiënten die andere cardiovasculaire risicofactoren hebben (bijv. diabetes, hypertensie, roken, obesitas, sterke familiegeschiedenis van CAD) voordat ze IMITREX-injectie krijgen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OVERDOSERING
Coronair vasospasme werd waargenomen na intraveneuze toediening van IMITREX 50 mg injectie (zie: CONTRA-INDICATIES ]. Op basis van gegevens over dieren (honden 0,1 g/kg, ratten 2 g/kg) zou worden verwacht dat ze convulsies, tremor, inactiviteit, erytheem van de extremiteiten, verminderde ademhalingsfrequentie, cyanose, ataxie, mydriasis, reacties op de injectieplaats ( afschilfering, haaruitval en korstvorming) en verlamming.
De eliminatiehalfwaardetijd van sumatriptan is ongeveer 2 uur [zie: KLINISCHE FARMACOLOGIE ]; daarom moet de monitoring van patiënten na overdosering met IMITREX-injectie worden voortgezet gedurende ten minste 10 uur of zolang de symptomen of tekenen aanhouden.
Het is niet bekend welk effect hemodialyse of peritoneale dialyse heeft op de serumconcentraties van sumatriptan.
CONTRA-INDICATIES
IMITREX-injectie is gecontra-indiceerd bij patiënten met:
- Ischemische coronaire hartziekte (CAD) (angina pectoris, voorgeschiedenis van myocardinfarct, of gedocumenteerde stille ischemie) of coronaire vaatspasme, inclusief Prinzmetal-angina [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Wolff-Parkinson-White-syndroom of aritmieën geassocieerd met andere cardiale accessoire geleidingsstoornissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Voorgeschiedenis van beroerte of transient ischemic attack (TIA) of voorgeschiedenis van hemiplegische of basilaire migraine omdat deze patiënten een hoger risico lopen op een beroerte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Perifere vaatziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Ischemische darmziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Ongecontroleerde hypertensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Recent gebruik (dwz binnen 24 uur) van ergotaminebevattende medicatie, ergot-achtige medicatie (zoals dihydro-ergotamine of methysergide), of een andere 5-hydroxytryptamine1 (5-HT1) agonist [zie DRUG-INTERACTIES ].
- Gelijktijdige toediening van een monoamineoxidase (MAO)-A-remmer of recent (binnen 2 weken) gebruik van een MAO-A-remmer [zie DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
- Overgevoeligheid voor IMITREX (angio-oedeem en anafylaxie gezien) [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Ernstige leverfunctiestoornis [zie KLINISCHE FARMACOLOGIE ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Sumatriptan bindt met hoge affiniteit aan menselijke gekloonde 5-HT1B/1D-receptoren. Sumatriptan oefent vermoedelijk zijn therapeutische effecten uit bij de behandeling van migraine en clusterhoofdpijn door middel van agonistische effecten op de 5-HT1B/1D-receptoren op intracraniale bloedvaten en sensorische zenuwen van het trigeminussysteem, wat resulteert in vernauwing van de schedelvaten en remming van pro-inflammatoire neuropeptiden. laat los.
farmacodynamiek
Bloeddruk
Aanzienlijke verhoging van de bloeddruk, waaronder hypertensieve crisis, is gemeld bij patiënten met en zonder een voorgeschiedenis van hypertensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Perifere (kleine) slagaders
Bij gezonde vrijwilligers (N = 18) kon in een onderzoek naar de effecten van sumatriptan op de perifere (kleine bloedvaten) arteriële reactiviteit geen klinisch significante toename van de perifere weerstand worden gedetecteerd.
Hartslag
Voorbijgaande stijgingen van de bloeddruk die bij sommige patiënten werden waargenomen in klinische onderzoeken die werden uitgevoerd tijdens de ontwikkeling van sumatriptan als behandeling voor migraine, gingen niet gepaard met klinisch significante veranderingen in de hartslag.
Farmacokinetiek
Absorptie en biologische beschikbaarheid
De biologische beschikbaarheid van sumatriptan via subcutane injectie op de plaats bij 18 gezonde mannelijke proefpersonen was 97% ± 16% van die verkregen na intraveneuze injectie.
Na een eenmalige subcutane handmatige injectie van 6 mg in het deltaspiergebied van de arm bij 18 gezonde mannen (leeftijd: 24 ± 6 jaar, gewicht: 70 kg), was de maximale serumconcentratie (Cmax) van sumatriptan (gemiddelde ± standaarddeviatie) 74 ± 15 ng/ml en de tijd tot piekconcentratie (Tmax) was 12 minuten na injectie (bereik: 5 tot 20 minuten). In dit onderzoek gaf dezelfde dosis die subcutaan in de dij werd geïnjecteerd een Cmax van 61 ± 15 ng/ml door handmatige injectie versus 52 ± 15 ng/ml door auto-injectortechnieken. De Tmax of de geabsorbeerde hoeveelheid werd niet significant veranderd door de injectieplaats of techniek.
Verdeling
Eiwitbinding, bepaald door evenwichtsdialyse over het concentratiebereik van 10 tot 1.000 ng/ml, is laag, ongeveer 14% tot 21%. Het effect van sumatriptan op de eiwitbinding van andere geneesmiddelen is niet onderzocht.
Na een subcutane injectie van 6 mg in het deltaspiergebied van de arm bij 9 mannen (gemiddelde leeftijd: 33 jaar, gemiddeld gewicht: 77 kg) was het distributievolume van het centrale compartiment van sumatriptan 50 ± 8 liter en de distributiehalfwaardetijd was 15 ± 2 minuten.
Metabolisme
In vitro-onderzoeken met humane microsomen suggereren dat sumatriptan wordt gemetaboliseerd door MAO, voornamelijk het A-iso-enzym. Het grootste deel van een radioactief gelabelde dosis sumatriptan die in de urine wordt uitgescheiden, is de belangrijkste metaboliet indoolazijnzuur (IAA) of de IAA-glucuronide, die beide inactief zijn.
Eliminatie
Na een enkelvoudige subcutane dosis van 6 mg werd 22% ± 4% in de urine uitgescheiden als onveranderd sumatriptan en 38% ± 7% als de IAA-metaboliet.
Na een subcutane injectie van 6 mg in het deltaspiergebied van de arm was de systemische klaring van sumatriptan 1.194 ± 149 ml/min en de terminale halfwaardetijd 115 ± 19 minuten.
Specifieke populaties
Leeftijd
De farmacokinetiek van sumatriptan bij ouderen (gemiddelde leeftijd: 72 jaar, 2 mannen en 4 vrouwen) en bij proefpersonen met migraine (gemiddelde leeftijd: 38 jaar, 25 mannen en 155 vrouwen) was vergelijkbaar met die bij gezonde mannelijke proefpersonen (gemiddelde leeftijd: 30 jaar).
Leverfunctiestoornis
Het effect van lichte tot matige leverziekte op de farmacokinetiek van subcutaan toegediende sumatriptan is onderzocht. Er waren geen significante verschillen in de farmacokinetiek van subcutaan toegediende sumatriptan bij proefpersonen met een matige leverfunctiestoornis in vergelijking met gezonde controlepersonen. De farmacokinetiek van subcutaan toegediend sumatriptan bij patiënten met een ernstige leverfunctiestoornis is niet onderzocht. Het gebruik van IMITREX-injectie bij deze populatie is gecontra-indiceerd [zie: CONTRA-INDICATIES ].
Ras
De systemische klaring en Cmax van subcutaan sumatriptan waren vergelijkbaar bij zwarte (n = 34) en blanke (n = 38) gezonde mannelijke proefpersonen.
Geneesmiddelinteractiestudies
Monoamineoxidase-A-remmers
In een onderzoek met 14 gezonde vrouwen verminderde voorbehandeling met een MAO-A-remmer de klaring van subcutaan sumatriptan, wat resulteerde in een 2-voudige toename van het gebied onder de plasmaconcentratie-tijdcurve (AUC) van sumatriptan, wat overeenkomt met een toename van 40% in de eliminatiehalfwaardetijd.
Dierlijke toxicologie en/of farmacologie
Opaciteiten van het hoornvlies
Honden die oraal sumatriptan kregen, ontwikkelden troebelheid van het hoornvlies en defecten in het hoornvliesepitheel. Opaciteit van het hoornvlies werd gezien bij de laagste geteste dosis, 2 mg/kg/dag, en was aanwezig na 1 maand behandeling. Defecten in het hoornvliesepitheel werden opgemerkt in een 60 weken durende studie. Eerdere onderzoeken naar deze toxiciteiten werden niet uitgevoerd en doses zonder effect werden niet vastgesteld; de relatieve plasmablootstelling bij de laagste geteste dosis was echter ongeveer 3 keer de blootstelling bij de mens na een subcutane dosis van 6 mg.
Klinische studies
Migraine
In gecontroleerde klinische onderzoeken met meer dan 1.000 patiënten tijdens migraineaanvallen die matige of ernstige pijn ervaarden en 1 of meer van de symptomen opgesomd in tabel 3, begon de verlichting al binnen 10 minuten na een injectie van 6 mg IMITREX 50 mg. Lagere doses IMITREX 100 mg injectie kunnen ook effectief blijken te zijn, hoewel het aantal patiënten dat voldoende verlichting kreeg, was afgenomen en de latentie tot die verlichting groter is bij lagere doses.
In onderzoek 1 werden 6 verschillende doses IMITREX 100 mg injectie (n = 30 elke groep) vergeleken met placebo (n = 62), in een ontwerp met een enkele aanval met parallelle groepen, bleek de dosis-responsrelatie te zijn zoals weergegeven in tabel 2.
In 2 gerandomiseerde, placebogecontroleerde klinische onderzoeken met IMITREX 25 mg injectie 6 mg bij 1.104 patiënten met matige of ernstige migrainepijn (onderzoeken 2 en 3), begon de verlichting minder dan 10 minuten. Verlichting van de hoofdpijn, zoals gedefinieerd door een vermindering van pijn van ernstige of matig ernstige tot milde of geen hoofdpijn, werd bij 70% van de patiënten bereikt binnen 1 uur na een enkelvoudige subcutane dosis van 6 mg IMITREX-injectie. Ongeveer 82% en 65% van de patiënten die werden behandeld met IMITREX 6 mg hadden verlichting van de hoofdpijn en waren binnen 2 uur pijnvrij.
Tabel 3 toont de werkzaamheidsresultaten van 1 en 2 uur voor IMITREX-injectie 6 mg in onderzoeken 2 en 3.
IMITREX 100 mg injectie verlichtte ook fotofobie, fonofobie (geluidsgevoeligheid), misselijkheid en braken geassocieerd met migraineaanvallen. Een vergelijkbare werkzaamheid werd waargenomen wanneer patiënten IMITREX 50 mg injectie zelf toedient met behulp van de IMITREX 100 mg STATdose Pen.
De werkzaamheid van IMITREX-injectie werd niet beïnvloed door het feit of de migraine al dan niet gepaard ging met aura, duur van de aanval, geslacht of leeftijd van de patiënt, of gelijktijdig gebruik van veel voorkomende profylactische geneesmiddelen tegen migraine (bijv. bètablokkers).
Clusterhoofdpijn
De werkzaamheid van IMITREX-injectie bij de acute behandeling van clusterhoofdpijn werd aangetoond in 2 gerandomiseerde, dubbelblinde, placebogecontroleerde cross-over-onderzoeken met 2 perioden (onderzoeken 4 en 5). Patiënten van 21 tot 65 jaar werden geïncludeerd en kregen de instructie om een matige tot zeer ernstige hoofdpijn binnen 10 minuten na het begin te behandelen. Verlichting van hoofdpijn werd gedefinieerd als een vermindering van de ernst van de hoofdpijn tot milde of geen pijn. In beide onderzoeken was het aantal personen dat verlichting kreeg na 10 of 15 minuten significant groter bij patiënten die 6 mg IMITREX-injectie kregen in vergelijking met degenen die placebo kregen (zie tabel 4).
Een schatting van de cumulatieve kans dat een patiënt met clusterhoofdpijn verlichting krijgt na behandeling met IMITREX 25 mg injectie of placebo wordt weergegeven in figuur 1.
Figuur 1: Tijd tot verlichting van clusterhoofdpijn vanaf het moment van injectiea 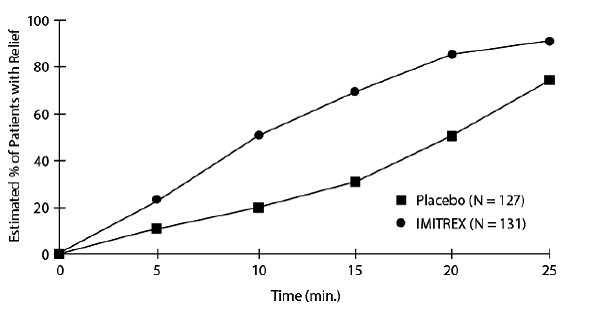
aDe figuur gebruikt Kaplan-Meier (productlimiet) Survivorship Plot. Patiënten die noodmedicatie gebruikten, werden na 15 minuten gecensureerd.
De plot werd geconstrueerd met gegevens van patiënten die ofwel verlichting ervoeren of geen noodmedicatie nodig hadden binnen een periode van 2 uur na de behandeling. Als gevolg hiervan zijn de gegevens in de grafiek afgeleid van slechts een subset van de 258 behandelde hoofdpijnen (reddingsmedicatie was vereist bij 52 van de 127 met placebo behandelde hoofdpijnen en 18 van de 131 hoofdpijnen die werden behandeld met IMITREX 50 mg injectie).
Andere gegevens suggereren dat behandeling met IMITREX 25 mg injectie niet gepaard gaat met een toename van vroege herhaling van hoofdpijn en weinig effect heeft op de incidentie van later optredende hoofdpijn (dwz hoofdpijn die optreedt na 2, maar vóór 18 of 24 uur).
PATIËNT INFORMATIE
IMITREX® (IM-i-trex) (sumatriptansuccinaat) Injectie
Lees deze patiënteninformatie voordat u IMITREX gaat gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling.
Wat is de belangrijkste informatie die ik over IMITREX moet weten?
IMITREX kan ernstige bijwerkingen veroorzaken, waaronder:
Hartaanval en andere hartproblemen. Hartproblemen kunnen tot de dood leiden.
Stop met het innemen van IMITREX 25 mg en roep onmiddellijk medische hulp in als u een van de volgende symptomen van een hartaanval heeft:
- ongemak in het midden van uw borstkas dat langer dan een paar minuten aanhoudt, of dat weggaat en terugkomt
- ernstige beklemming, pijn, druk of zwaarte in uw borst, keel, nek of kaak
- pijn of ongemak in uw armen, rug, nek, kaak of maag
- kortademigheid met of zonder ongemak op de borst
- uitbrekend in het koude zweet
- misselijkheid of braken
- zich licht in het hoofd voelen
IMITREX is niet bedoeld voor mensen met risicofactoren voor hartaandoeningen, tenzij er een hartonderzoek is gedaan en er geen probleem is. U heeft een hoger risico op hartaandoeningen als u:
- hoge bloeddruk hebben
- een hoog cholesterolgehalte hebben
- rook
- zijn te zwaar
- diabetes hebben
- een familiegeschiedenis van hartaandoeningen hebben
Wat is IMITREX?
IMITREX-injectie is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van acute migrainehoofdpijn met of zonder aura en acute clusterhoofdpijn bij volwassenen bij wie de diagnose migraine of clusterhoofdpijn is gesteld.
IMITREX 50 mg wordt niet gebruikt voor de behandeling van andere soorten hoofdpijn, zoals hemiplegische (waardoor u niet in staat bent om naar één kant van uw lichaam te bewegen) of basilaire (zeldzame vorm van migraine met aura) migraine.
IMITREX 100 mg wordt niet gebruikt om het aantal migraine of clusterhoofdpijn dat u heeft te voorkomen of te verminderen.
Het is niet bekend of IMITREX 100 mg veilig en effectief is bij kinderen jonger dan 18 jaar.
Wie mag IMITREX 100 mg niet gebruiken?
Gebruik IMITREX 50 mg niet als u:
- hartproblemen of een voorgeschiedenis van hartproblemen
- vernauwing van bloedvaten naar uw benen, armen, maag of nieren (perifere vaatziekte)
- ongecontroleerde hoge bloeddruk
- ernstige leverproblemen
- hemiplegische migraine of basilaire migraine. Als u niet zeker weet of u dit soort migraine heeft, vraag het dan aan uw zorgverlener.
- een beroerte, voorbijgaande ischemische aanvallen (TIA's) of problemen met uw bloedcirculatie heeft gehad
- de afgelopen 24 uur een van de volgende geneesmiddelen heeft ingenomen:
- almotriptan (AXERT®)
- eletriptan (RELPAX®)
- frovatriptan (FROVA®)
- naratriptan (AMERGE®)
- rizatriptan (MAXALT®, MAXALT-MLT®)
- sumatriptan en naproxen (TREXIMET®)
- ergotaminen (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydro-ergotamine (DHE 45®, MIGRANAL®) Vraag uw zorgverlener als u niet zeker weet of uw geneesmiddel hierboven wordt vermeld.
- een allergie voor sumatriptan of voor een van de bestanddelen van IMITREX. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in IMITREX.
Wat moet ik mijn zorgverlener vertellen voordat ik IMITREX inneem?
Voordat u IMITREX inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- hoge bloeddruk hebben
- een hoog cholesterolgehalte hebben
- diabetes hebben
- rook
- zijn te zwaar
- hartproblemen of een familiegeschiedenis van hartproblemen of een beroerte heeft
- nierproblemen hebben
- leverproblemen hebben
- epilepsie of toevallen heeft gehad
- gebruiken geen effectieve anticonceptie
- zwanger worden terwijl u IMITREX® gebruikt
- borstvoeding geeft of van plan bent borstvoeding te geven. IMITREX 25 mg gaat over in uw moedermelk en kan schadelijk zijn voor uw baby. Praat met uw zorgverlener over de beste manier om uw baby te voeden als u IMITREX gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen.
IMITREX en bepaalde andere geneesmiddelen kunnen elkaar beïnvloeden en ernstige bijwerkingen veroorzaken.
Vertel uw zorgverlener vooral als: u neemt antidepressiva genaamd:
- selectieve serotonineheropnameremmers (SSRI's)
- serotonine noradrenaline heropname remmers (SNRI's)
- tricyclische antidepressiva (TCA's)
- monoamineoxidaseremmers (MAO-remmers)
Vraag uw zorgverlener of apotheker om een lijst van deze geneesmiddelen als u het niet zeker weet.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener of apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik IMITREX 100 mg innemen?
- Bepaalde mensen dienen hun eerste dosis IMITREX 25 mg in te nemen in het kantoor van hun zorgverlener of in een andere medische setting. Vraag uw zorgverlener of u uw eerste dosis in een medische setting moet nemen.
- Gebruik IMITREX 50 mg precies zoals uw zorgverlener u zegt dat u het moet gebruiken.
- Uw zorgverlener kan uw dosis wijzigen. Verander uw dosis niet zonder eerst met uw zorgverlener te overleggen.
- Voor volwassenen is de gebruikelijke dosis een enkele injectie net onder de huid.
- U moet een injectie geven zodra de symptomen van uw hoofdpijn beginnen, maar het kan op elk moment worden gegeven tijdens een aanval van migraine of clusterhoofdpijn.
- Als u na de eerste injectie geen verlichting heeft gekregen, geef dan geen tweede injectie zonder eerst met uw zorgverlener te overleggen.
- Als uw hoofdpijn terugkomt of als u pas enige verlichting krijgt na uw eerste injectie, kunt u 1 uur na de eerste injectie een tweede injectie nemen, maar niet eerder.
- Neem niet meer dan 12 mg in een periode van 24 uur.
- Als u te veel IMITREX 25 mg heeft gebruikt, neem dan direct contact op met uw zorgverlener of ga naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
- U moet noteren wanneer u hoofdpijn heeft en wanneer u IMITREX inneemt, zodat u met uw zorgverlener kunt praten over hoe IMITREX 25 mg voor u werkt.
Wat moet ik vermijden tijdens het gebruik van IMITREX?
IMITREX kan duizeligheid, zwakte of slaperigheid veroorzaken. Als u deze symptomen heeft, bestuur dan geen auto, gebruik geen machines en doe niets waarbij u alert moet zijn.
Wat zijn de mogelijke bijwerkingen van IMITREX 25 mg?
IMITREX kan ernstige bijwerkingen veroorzaken. Zie "Wat is de belangrijkste informatie die ik moet weten over IMITREX?"
Deze ernstige bijwerkingen zijn onder meer:
- veranderingen in kleur of gevoel in uw vingers en tenen (syndroom van Raynaud)
- maag- en darmproblemen (gastro-intestinale en colonische ischemische gebeurtenissen). Symptomen van gastro-intestinale en colonische ischemische gebeurtenissen zijn onder meer:
- plotselinge of ernstige maagpijn
- maagpijn na de maaltijd
- gewichtsverlies
- misselijkheid of braken
- constipatie of diarree
- bloederige diarree
- koorts
- problemen met de bloedcirculatie naar uw benen en voeten (perifere vasculaire ischemie). Symptomen van perifere vasculaire ischemie zijn onder meer:
- krampen en pijn in uw benen of heupen
- gevoel van zwaarte of beklemming in uw beenspieren
- brandende of pijnlijke pijn in uw voeten of tenen tijdens het rusten
- gevoelloosheid, tintelingen of zwakte in uw benen
- koud gevoel of kleurveranderingen in 1 of beide benen of voeten
- netelroos (jeukende bultjes); zwelling van uw tong, mond of keel
- hoofdpijn door overmatig gebruik van medicijnen. Sommige mensen die te veel IMITREX 100 mg-injecties gebruiken, kunnen ergere hoofdpijn krijgen (hoofdpijn door overmatig gebruik van medicijnen). Als uw hoofdpijn erger wordt, kan uw zorgverlener besluiten uw behandeling met IMITREX stop te zetten.
- serotonine syndroom. Serotoninesyndroom is een zeldzaam maar ernstig probleem dat kan optreden bij mensen die IMITREX gebruiken, vooral als IMITREX 50 mg wordt gebruikt in combinatie met antidepressiva die SSRI's of SNRI's worden genoemd. Bel onmiddellijk uw zorgverlener als u een van de volgende symptomen van het serotoninesyndroom heeft:
- mentale veranderingen zoals dingen zien die er niet zijn (hallucinaties), opwinding of coma
- snelle hartslag
- veranderingen in bloeddruk
- hoge lichaamstemperatuur
- strakke spieren
- moeite met lopen
- toevallen. Er zijn epileptische aanvallen opgetreden bij mensen die IMITREX gebruikten en nog nooit eerder een aanval hebben gehad. Praat met uw zorgverlener over uw kans op epileptische aanvallen terwijl u IMITREX gebruikt.
De meest voorkomende bijwerkingen van IMITREX 50 mg injectie zijn:
- pijn of roodheid op uw injectieplaats
- tintelingen of gevoelloosheid in uw vingers of tenen
- duizeligheid
- warm, heet, branderig gevoel in je gezicht (blozen)
- ongemak of stijfheid in uw nek
- zich zwak, slaperig of moe voelen
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van IMITREX. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik IMITREX-injectie bewaren?
- Bewaar IMITREX tussen 36 ° F tot 86 ° F (2 ° C tot 30 ° C).
- Bewaar uw geneesmiddel uit de buurt van licht.
- Bewaar uw geneesmiddel in de meegeleverde verpakking of draagtas.
Houd IMITREX en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van IMITREX
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in de patiëntenbijsluiters. Gebruik IMITREX niet voor een aandoening waarvoor het niet is voorgeschreven. Geef IMITREX 25 mg niet aan andere mensen, ook niet als ze dezelfde symptomen hebben als u. Het kan hen schaden.
Deze bijsluiter voor patiënten vat de belangrijkste informatie over IMITREX samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over IMITREX die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Ga voor meer informatie naar www.gsk.com of bel 1-888-825-5249.
Wat zijn de ingrediënten in IMITREX-injectie?
Actief bestanddeel: sumatriptansuccinaat
Inactieve ingrediënten: natriumchloride, water voor injectie
Deze patiënteninformatie en gebruiksaanwijzing zijn goedgekeurd door de Amerikaanse Food and Drug Administration.
Instructies voor gebruik van de patiënt
IMITREX STAT-dosissysteem
Lees deze gebruiksaanwijzing voor de patiënt voordat u het IMITREX STATdose-systeem gaat gebruiken. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling. U en uw zorgverlener moeten praten over IMITREX 25 mg injectie wanneer u begint met het innemen en bij regelmatige controles.
Houd het IMITREX STATdose-systeem buiten het bereik van kinderen.
Voordat u het IMITREX STATdose-systeem gebruikt
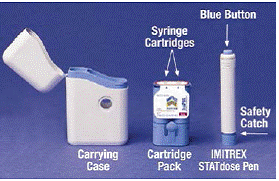
Wanneer u de doos van het IMITREX 25 mg STATdose-systeem voor het eerst opent, bevinden de patroonverpakking en de IMITREX STATdose Pen® zich voor uw gemak al in de draagtas.
Het grijs en blauw Koffer wordt gebruikt om de lege pen en de patroonverpakking op te bergen wanneer ze niet worden gebruikt.
De Patroonpakket houdt 2 individueel verzegeld Spuitpatronen Elke spuitpatroon bevat 1 dosis IMITREX® (sumatriptansuccinaat) injectie. De patroonverpakking voor de sterkte van 4 mg van dit geneesmiddel is geel en de patroonverpakking voor de sterkte van 6 mg is blauw (zoals afgebeeld). Navulpatroonpakketten zijn beschikbaar.
Het grijs en blauw Pen wordt gebruikt om automatisch 1 dosis geneesmiddel uit een spuitpatroon te injecteren. Raak de niet aan Blauwe knop totdat u de pen tegen uw huid heeft gedrukt om een dosis toe te dienen. Als u er op een ander moment op drukt, kunt u een dosis verliezen. De Veiligheidsvanger zorgt ervoor dat de pen niet per ongeluk afvuurt totdat u er klaar voor bent. De Pen werkt alleen als je het grijze deel van de houder naar beneden schuift naar het blauwe deel. Controleer altijd of de witte vulstaaf niet uit het uiteinde van de pen steekt (zoals weergegeven in afbeelding B) voordat u een nieuwe spuitpatroon plaatst. Als het uitsteekt, ben je die dosis kwijt.
Hoe de IMITREX STATdose Pen te laden
Laad de pen pas als u klaar bent om uzelf een injectie te geven. Raak de blauwe knop bovenop de pen niet aan (zie afbeelding A) terwijl u de pen laadt.
Afbeelding A 
Figuur B 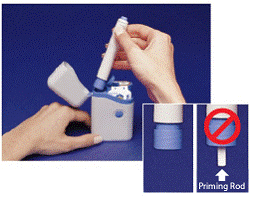
1. Open het deksel van de draagtas. De verzegelde zegels over de 2 spuitpatronen zijn gelabeld met “A” en “B” (zie Afbeelding A inzet ).
Gebruik altijd de spuitpatroon gemarkeerd met "A" voor die met "B" om u te helpen uw doses bij te houden. Niet gebruiken als een van de verzegelingen is verbroken of ontbreekt wanneer u de draagtas voor het eerst opent.
2. Scheur een van de verzegelde zegels af (zie Afbeelding A ). Gooi het zegel weg. Open het deksel over de spuitpatroon.
3. Houd de pen vast bij de ribbels aan de bovenkant. Haal de pen uit de draagtas (zie Figuur B ).
Controleer of de witte vulstaaf niet uit het onderste uiteinde van de pen steekt (zie Afbeelding B inzet ). Als deze uitsteekt, plaats de pen dan terug in de draagtas en druk hem stevig naar beneden totdat u hem voelt klikken. Haal de pen uit de draagtas.
Figuur C 
4. Plaats de pen in de patroonverpakking. Draai hem naar rechts (met de klok mee) totdat hij niet meer kan draaien (ongeveer een halve slag) (zie Figuur C ).
5. Houd de geladen pen vast bij de ribbels en trek hem recht naar buiten (zie Figuur D ). Het kan zijn dat u hard aan de pen moet trekken, maar dit is normaal. Druk nog niet op de blauwe knop.
Figuur D 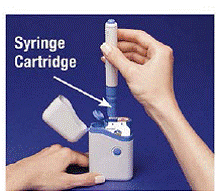
De pen is nu klaar voor gebruik. Niet doen plaats de geladen pen terug in de draagtas, want dat zal de naald beschadigen.
Hoe gebruikt u de IMITREX STAT doseerpen om uw geneesmiddel in te nemen?
Kies voordat u uw geneesmiddel injecteert een gebied met een vetlaag (zie afbeelding E of afbeelding F). Vraag uw zorgverlener als u een vraag heeft over waar u uw geneesmiddel moet injecteren.
Om het huidgebied waar IMITREX moet worden geïnjecteerd voor te bereiden, veegt u de injectieplaats af met een alcoholdoekje. Raak dit gebied niet meer aan voordat u de injectie toedient.
Afbeelding E of Afbeelding F Afbeelding G 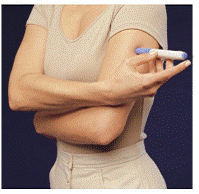
6. Druk, zonder op de blauwe knop te drukken, de geladen pen stevig tegen de huid zodat de grijze huls naar beneden schuift in de richting van het blauwe gedeelte dat de spuitpatroon vasthoudt (zie Figuur D ). (Hierdoor komt de veiligheidspal vrij die ervoor zorgt dat de pen niet per ongeluk afvuurt totdat u er klaar voor bent.)
7. Druk op de blauwe knop. Houd de pen stil voor minimaal 5 seconden . Als de pen te snel van de huid wordt verwijderd, komt niet al het geneesmiddel eruit.
8 Na 5 seconden , verwijder de pen voorzichtig van uw huid. De naald zal worden weergegeven (zie Figuur G ). Raak de naald niet aan.
Hoe de IMITREX STAT-dosispen uit de pen te halen nadat u uw geneesmiddel heeft ingenomen?
Direct nadat u een dosis met de pen heeft ingenomen, moet u de gebruikte spuitpatroon terugplaatsen in de patroonverpakking.
Figuur H Figuur I en Figuur J 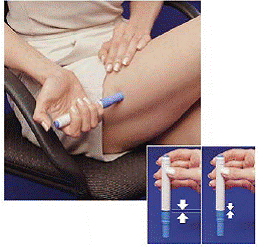
9. Duw de pen zo ver mogelijk naar beneden in de lege kant van de patroonverpakking (zie figuur H ).
10. Draai de pen ongeveer een halve slag naar links (tegen de klok in) totdat deze uit de spuitpatroon komt (zie Figuur I ).
11. Trek de lege pen uit de patroonverpakking (zie figuur J ).
Omdat de pen nu is gebruikt, steekt de witte vulstaaf uit het onderste uiteinde van de pen (zie figuur J ).
12. Sluit het deksel van de patroonverpakking over de gebruikte spuitpatroon. Wanneer de gebruikte spuitpatronen correct zijn geplaatst, is de patroonverpakking een beschermende wegwerpverpakking om naaldprikken te voorkomen en de spuiten op de juiste manier te gebruiken.
13. Plaats de pen terug in de draagtas en druk hem stevig naar beneden totdat u hem voelt klikken. Sluit het deksel van de draagtas. Hierdoor is de pen klaar voor het volgende gebruik.
Als het deksel niet sluit, duwt u de pen naar beneden totdat u een klik voelt. Sluit vervolgens het deksel.
Hoe een gebruikt Cartridge Pack eruit halen?
Nadat beide spuitpatronen zijn gebruikt, haalt u de patroonverpakking uit de draagtas. Gebruik of recycle een spuitpatroon nooit.
Figuur K Figuur L 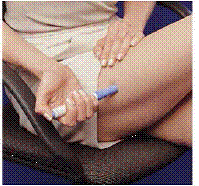
14. Open het deksel van de draagtas.
15. Houd de draagtas met één hand vast en druk op de 2 knoppen aan weerszijden van de draagtas (zie figuur K ).
16. Trek met de andere hand het patroonpakket voorzichtig naar buiten (zie Figuur L ).
17. Gooi de patroonverpakking weg of gooi deze weg volgens de instructies van uw zorgverlener. Er kunnen speciale staats- en lokale wetten zijn voor het weggooien van gebruikte naalden en spuiten. Altijd buiten het bereik van kinderen houden.
Een nieuw patroonpakket plaatsen
Figuur M Figuur N en Figuur O 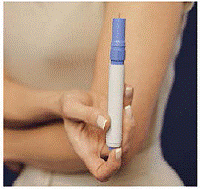
18. Haal het nieuwe Cartridge Pack uit de doos. Verwijder de verzegelde zegels niet (zie afbeelding M).
19. Plaats het patroonpakket in de draagtas. Schuif hem soepel naar beneden (zie Figuur nr ).
20. De Cartridge Pack klikt op zijn plaats wanneer de 2 knoppen door de gaten in de draagtas zichtbaar zijn (zie Figuur O ). Sluit het deksel.
Deze patiënteninformatie en gebruiksaanwijzing zijn goedgekeurd door de Amerikaanse Food and Drug Administration.
