Prometrium 100mg, 200mg Progesterone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Prometrium 100 mg en hoe wordt het gebruikt?
Prometrium 200 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van endometriumhyperplasie en de symptomen van secundaire amenorroe (afwezigheid van menstruatie of menstruatie) te voorkomen. Prometrium kan alleen of met andere medicijnen worden gebruikt.
Prometrium behoort tot een klasse geneesmiddelen die progestagenen worden genoemd.
Het is niet bekend of Prometrium 200 mg veilig en effectief is bij kinderen.
Wat zijn mogelijke bijwerkingen van Prometrium?
Prometrium kan ernstige bijwerkingen veroorzaken, waaronder:
- ongewone vaginale bloedingen,
- pijn of een branderig gevoel bij het plassen,
- knobbeltje in de borst,
- plotselinge zichtproblemen,
- ernstige hoofdpijn,
- pijn achter de ogen,
- depressie,
- slaapproblemen,
- zwakheid,
- stemmingswisselingen,
- ernstige duizeligheid,
- slaperigheid,
- ronddraaiend gevoel,
- verwardheid,
- kortademigheid,
- pijn op de borst of druk,
- pijn die zich uitbreidt naar de kaak of schouder,
- misselijkheid,
- zweten,
- pijn in de bovenbuik,
- jeuk,
- vermoeidheid,
- verlies van eetlust,
- donker gekleurde urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- plotselinge gevoelloosheid of zwakte,
- plotselinge ernstige hoofdpijn,
- onduidelijke spraak ,
- moeite met praten of balanceren,
- plotseling hoesten,
- piepende ademhaling,
- snel ademhalen,
- bloed ophoesten,
- Been pijn,
- zwelling in het been, en
- warmte of roodheid in een of beide benen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Prometrium 100 mg zijn:
- slaperigheid,
- duizeligheid,
- Borstpijn,
- stemmingswisselingen,
- hoofdpijn,
- constipatie,
- diarree,
- maagzuur,
- opgeblazen gevoel,
- zwelling in uw handen of voeten,
- gewrichtspijn,
- opvliegers, en
- vaginale afscheiding
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prometrium. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
CARDIOVASCULAIRE AANDOENINGEN, BORSTKANKER en MOGELIJKE DEMENTIE VOOR OESTROGEEN PLUS PROGESTIN-THERAPIE
Cardiovasculaire aandoeningen en waarschijnlijke dementie
Behandeling met oestrogenen plus progestageen mag niet worden gebruikt voor de preventie van hart- en vaatziekten of dementie. (Zien Klinische studies en WAARSCHUWINGEN , Cardiovasculaire aandoeningen en waarschijnlijke dementie. )
Het Women's Health Initiative (WHI) oestrogeen plus progestageen subonderzoek rapporteerde een verhoogd risico op diepe veneuze trombose, longembolie, beroerte en myocardinfarct bij postmenopauzale vrouwen (50 tot 79 jaar) gedurende 5,6 jaar behandeling met dagelijks oraal geconjugeerd oestrogenen (CE) [0,625 mg] gecombineerd met medroxyprogesteronacetaat (MPA) [2,5 mg], in vergelijking met placebo. (Zien Klinische studies en WAARSCHUWINGEN , Cardiovasculaire aandoeningen. )
De WHI Memory Study (WHIMS) oestrogeen plus progestageen aanvullende studie van de WHI rapporteerde een verhoogd risico op het ontwikkelen van waarschijnlijke dementie bij postmenopauzale vrouwen van 65 jaar of ouder gedurende 4 jaar behandeling met dagelijkse CE (0,625 mg) gecombineerd met MPA (2,5 mg ), in vergelijking met placebo. Het is niet bekend of deze bevinding van toepassing is op jongere postmenopauzale vrouwen. (Zien Klinische studies en WAARSCHUWINGEN , Vermoedelijke dementie en PREVENTIEVE MAATREGELEN , Geriatrisch gebruik .)
Borstkanker
De WHI oestrogeen plus progestageen substudie toonde ook een verhoogd risico op invasieve borstkanker aan. (Zien Klinische studies en WAARSCHUWINGEN , Maligne neoplasmata, Borstkanker .)
Bij gebrek aan vergelijkbare gegevens moet worden aangenomen dat deze risico's vergelijkbaar zijn voor andere doses CE en MPA, en andere combinaties en doseringsvormen van oestrogenen en progestagenen.
Progestagenen met oestrogenen moeten worden voorgeschreven in de laagste effectieve doses en voor de kortste duur in overeenstemming met de behandeldoelen en risico's voor de individuele vrouw.
OMSCHRIJVING
PROMETRIUM (progesteron, USP) Capsules bevatten gemicroniseerd progesteron voor orale toediening. Progesteron heeft een molecuulgewicht van 314,47 en een molecuulformule C21H30O2. Progesteron (pregn-4-een-3, 20-dion) is een wit of roomwit, geurloos, kristallijn poeder dat praktisch onoplosbaar is in water, oplosbaar in alcohol, aceton en dioxaan en matig oplosbaar in plantaardige oliën, stabiel in lucht, smeltend tussen 126° en 131°C. De structuurformule is:
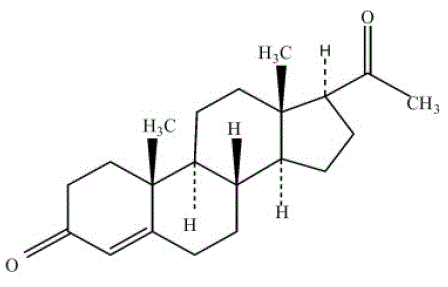
Progesteron wordt gesynthetiseerd uit een uitgangsmateriaal van een plantaardige bron en is chemisch identiek aan progesteron van menselijke eierstokoorsprong. PROMETRIUM-capsules zijn verkrijgbaar in meerdere sterktes om een flexibele dosering te bieden voor een optimaal beheer. PROMETRIUM-capsules bevatten 100 mg of 200 mg gemicroniseerd progesteron.
De inactieve ingrediënten voor PROMETRIUM Capsules 100 mg omvatten: pindaolie NF, gelatine NF, glycerine USP, lecithine NF, titaniumdioxide USP, FD&C Red No. 40 en D&C Yellow No. 10. De inactieve ingrediënten voor PROMETRIUM 100mg Capsules 200 mg omvatten : pindaolie NF, gelatine NF, glycerine USP, lecithine NF, titaniumdioxide USP, D&C Yellow No. 10 en FD&C Yellow No. 6.
INDICATIES
PROMETRIUM 200 mg capsules zijn geïndiceerd voor gebruik bij de preventie van endometriumhyperplasie bij niet-gehysterectomiseerde postmenopauzale vrouwen die tabletten met geconjugeerde oestrogenen krijgen. Ze zijn ook geïndiceerd voor gebruik bij secundaire amenorroe.
DOSERING EN ADMINISTRATIE
Preventie van endometriumhyperplasie
PROMETRIUM 100 mg capsules dienen te worden gegeven als een enkele dagelijkse dosis voor het slapengaan, 200 mg oraal gedurende 12 dagen achtereenvolgens per cyclus van 28 dagen, aan een postmenopauzale vrouw met een baarmoeder die dagelijks tabletten met geconjugeerde oestrogenen krijgt.
Behandeling van secundaire amenorroe
PROMETRIUM 100 mg capsules kunnen gedurende 10 dagen als een enkele dagelijkse dosis van 400 mg voor het slapengaan worden gegeven.
Sommige vrouwen kunnen moeite hebben met het slikken van PROMETRIUM-capsules. Voor deze vrouwen moet PROMETRIUM-capsules staand worden ingenomen met een glas water.
HOE GELEVERD
PROMETRIUM (progesteron, USP) Capsules 100 mg zijn ronde, perzikkleurige capsules met de zwarte opdruk "SV".
NDC 0032-1708-01 (Fles van 100)
PROMETRIUM (progesteron, USP) Capsules 200 mg zijn ovale, lichtgeel gekleurde capsules met de zwarte opdruk "SV2".
NDC 0032-1711-01 (Fles van 100)
Bewaren bij 25°C (77°F); excursies toegestaan tot 15 ° tot 30 ° C (59 ° tot 86 ° F) [Zie USP-gecontroleerde kamertemperatuur].
Beschermen tegen overmatig vocht.
Doseer in een strakke, lichtbestendige container zoals gedefinieerd in USP/NF, vergezeld van een patiëntenbijsluiter.
Buiten bereik van kinderen houden.
Gefabriceerd door: Catalent Pharma Solutions, St. Petersburg, FL 33716. Herzien: september 2013
BIJWERKINGEN
Zien DOOS WAARSCHUWING: , WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN .
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In een multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde klinische studie werden de effecten van PROMETRIUM 100 mg capsules op het endometrium onderzocht bij in totaal 875 postmenopauzale vrouwen. Tabel 6 geeft een overzicht van bijwerkingen groter dan of gelijk aan 2 procent van de vrouwen die cyclische PROMETRIUM-capsules 200 mg per dag kregen (12 dagen per kalendermaandcyclus) met 0,625 mg geconjugeerde oestrogenen of placebo.
TABEL 6. Bijwerkingen (≥ 2%) Gerapporteerd in een placebogecontroleerd onderzoek met 875 patiënten bij postmenopauzale vrouwen gedurende een periode van 3 jaar [percentage (%) van de gerapporteerde patiënten]
Effecten op secundaire amenorroe
In een multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde klinische studie werden de effecten van PROMETRIUM-capsules op secundaire amenorroe onderzocht bij 49 postmenopauzale vrouwen met oestrogeen-priming. Tabel 7 geeft een overzicht van bijwerkingen groter dan of gelijk aan 5 procent van de vrouwen die PROMETRIUM 100 mg capsules of placebo kregen.
TABEL 7. Bijwerkingen (≥ 5%) Gerapporteerd bij patiënten die 400 mg/dag gebruikten in een placebogecontroleerd onderzoek bij postmenopauzale vrouwen met oestrogeenpriming
In een multicenter, open-label postmarketing-doseringsonderzoek met parallelle groepen, bestaande uit drie opeenvolgende behandelcycli van 28 dagen, werden 220 premenopauzale vrouwen met secundaire amenorroe gerandomiseerd naar dagelijkse therapie met geconjugeerde oestrogenen (0,625 mg geconjugeerde oestrogenen) en PROMETRIUM 100 mg capsules, 300 mg per dag (n=13) of PROMETRIUM-capsules, 400 mg per dag (n=107) gedurende 10 dagen van elke behandelcyclus. Over het algemeen waren de meest gemelde bijwerkingen tijdens de behandeling, gemeld bij meer dan of gelijk aan 5 procent van de proefpersonen, misselijkheid, vermoeidheid, vaginale mycose, nasofaryngitis, bovenste luchtweginfectie, hoofdpijn, duizeligheid, gevoelige borsten, opgezette buik, acne , dysmenorroe, stemmingswisselingen en urineweginfectie.
Postmarketingervaring
De volgende aanvullende bijwerkingen zijn gemeld met PROMETRIUM 200 mg capsules. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om de frequentie op betrouwbare wijze te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Urogenitaal systeem
endometriumcarcinoom, hypospadie, intra-uteriene dood, menorragie, menstruatiestoornis, metrorragie, ovariumcyste, spontane abortus.
Cardiovasculair
collaps van de bloedsomloop, aangeboren hartziekte (inclusief ventrikelseptumdefect en open ductus arteriosus), hypertensie, hypotensie, tachycardie.
gastro-intestinaal
acute pancreatitis, cholestase, cholestatische hepatitis, dysfagie, leverfalen, levernecrose, hepatitis, verhoogde leverfunctietesten (inclusief alanineaminotransferase verhoogd, aspartaataminotransferase verhoogd, gamma-glutamyltransferase verhoogd), geelzucht, gezwollen tong.
Huid
alopecia, jeuk, urticaria.
Ogen
wazig zien, diplopie, visuele stoornis.
Centraal zenuwstelsel
agressie, convulsie, depersonalisatie, depressief bewustzijn, desoriëntatie, dysartrie, bewustzijnsverlies, paresthesie, sedatie, stupor, syncope (met en zonder hypotensie), voorbijgaande ischemische aanval, zelfmoordgedachten.
Tijdens de initiële therapie hebben enkele vrouwen een constellatie van veel of alle van de volgende symptomen ervaren: extreme duizeligheid en/of slaperigheid, wazig zien, onduidelijke spraak, moeite met lopen, bewustzijnsverlies, duizeligheid, verwardheid, desoriëntatie, dronken gevoel en kortademigheid.
Diversen
abnormale gang, anafylactische reactie, artralgie, verhoogde bloedglucose, verstikking, hazenlip, gespleten gehemelte, moeite met lopen, kortademigheid, gezichtsoedeem, abnormaal gevoel, dronken gevoel, overgevoeligheid, astma, spierkramp, beklemd gevoel in de keel, tinnitus, duizeligheid, gewichtsafname , gewicht verhoogd.
DRUG-INTERACTIES
Geneesmiddel-laboratoriumtestinteracties
De volgende laboratoriumresultaten kunnen worden gewijzigd door het gebruik van oestrogeen plus progestageentherapie:
- Verhoogde retentie van sulfobromoftaleïne en andere leverfunctietesten.
- Stollingstests: verhoging van protrombinefactoren VII, VIII, IX en X.
- Pregnaandiol bepaling.
- Schildklierfunctie: toename van PBI en butanol-extraheerbaar eiwitgebonden jodium en afname van T3 waarden opnemen.
WAARSCHUWINGEN
Zien DOOS WAARSCHUWING: .
Cardiovasculaire aandoeningen
Een verhoogd risico op longembolie, diepe veneuze trombose (DVT), beroerte en myocardinfarct is gemeld bij behandeling met oestrogeen plus progestageen. Als een van deze symptomen optreedt of wordt vermoed, moet de behandeling met oestrogeen met progestageen onmiddellijk worden stopgezet.
Risicofactoren voor arteriële vaatziekte (bijvoorbeeld hypertensie, diabetes mellitus, tabaksgebruik, hypercholesterolemie en obesitas) en/of veneuze trombo-embolie (bijvoorbeeld persoonlijke voorgeschiedenis of familiegeschiedenis van veneuze trombo-embolie [VTE], obesitas en systemische lupus erythematosus ) moet op de juiste manier worden beheerd.
Hartinfarct
In het Women's Health Initiative (WHI) oestrogeen plus progestageen-subonderzoek werd een statistisch significant verhoogd risico op een beroerte gemeld bij vrouwen van 50 tot 79 jaar die dagelijks CE (0,625 mg) plus MPA (2,5 mg) kregen in vergelijking met vrouwen van dezelfde leeftijd groep die placebo kreeg (33 versus 25 per 10.000 vrouwjaren). De toename van het risico werd aangetoond na het eerste jaar en hield aan. (Zien Klinische studies .) Als een beroerte optreedt of wordt vermoed, moet de behandeling met oestrogeen plus progestageen onmiddellijk worden stopgezet.
Coronaire hartziekte
In het WHI oestrogeen plus progestageen subonderzoek werd een statistisch niet-significant verhoogd risico op coronaire hartziekte (CHD) (gedefinieerd als niet-fataal myocardinfarct [MI], stille MI of CHD overlijden) gemeld bij vrouwen die dagelijks CE kregen (0,625). mg) plus MPA (2,5 mg) vergeleken met vrouwen die placebo kregen (41 versus 34 per 10.000 vrouwjaren). Een toename van het relatieve risico werd aangetoond in jaar 1 en een trend in de richting van een afnemend relatief risico werd gerapporteerd in de jaren 2 tot en met 5. (Zie Klinische studies .)
Bij postmenopauzale vrouwen met gedocumenteerde hartziekte (n = 2763, gemiddelde leeftijd 66,7 jaar), in een gecontroleerd klinisch onderzoek naar secundaire preventie van hart- en vaatziekten (Heart and Estrogen/Progestin Replacement Study [HERS]), behandeling met dagelijkse CE (0,625 mg) plus MPA (2,5 mg) toonde geen cardiovasculair voordeel. Tijdens een gemiddelde follow-up van 4,1 jaar verminderde behandeling met CE plus MPA het totale aantal CHD-voorvallen bij postmenopauzale vrouwen met vastgestelde coronaire hartziekte niet. Er waren meer CHD-voorvallen in de met CE plus MPA behandelde groep dan in de placebogroep in jaar 1, maar niet in de daaropvolgende jaren. Tweeduizend driehonderdeenentwintig (2321) vrouwen uit de oorspronkelijke HERS-studie stemden ermee in om deel te nemen aan een open-label extensie van HERS, HERS II. De gemiddelde follow-up in HERS II was nog eens 2,7 jaar, voor een totaal van 6,8 jaar in totaal. De percentages van CHD-voorvallen waren vergelijkbaar bij vrouwen in de CE plus MPA-groep en de placebogroep in HERS, HERS II en in het algemeen.
Veneuze trombo-embolie
In het WHI-onderzoek naar oestrogeen plus progestageen werd een statistisch significant 2-voudig hoger percentage VTE (DVT en longembolie [PE]) gemeld bij vrouwen die dagelijks CE (0,625 mg) plus MPA (2,5 mg) kregen in vergelijking met vrouwen die placebo kregen ( 35 versus 17 per 10.000 vrouwjaren). Statistisch significante risicoverhogingen voor zowel DVT (26 versus 13 per 10.000 vrouwjaren) als PE (18 versus 8 per 10.000 vrouwjaren) werden ook aangetoond. De toename van het VTE-risico werd gedurende het eerste jaar aangetoond en hield aan. (Zien Klinische studies .) Als een VTE optreedt of wordt vermoed, moet de behandeling met oestrogeen plus progestageen onmiddellijk worden stopgezet.
Indien mogelijk moeten oestrogenen met progestagenen worden stopgezet ten minste 4 tot 6 weken vóór een operatie van het type dat gepaard gaat met een verhoogd risico op trombo-embolie, of tijdens perioden van langdurige immobilisatie.
Kwaadaardige neoplasma's
Borstkanker
De belangrijkste gerandomiseerde klinische studie die informatie geeft over borstkanker bij gebruikers van oestrogeen plus progestageen is de Women's Health Initiative (WHI) substudie van dagelijkse CE (0,625 mg) plus MPA (2,5 mg). Na een gemiddelde follow-up van 5,6 jaar rapporteerde de substudie oestrogeen plus progestageen een verhoogd risico op invasieve borstkanker bij vrouwen die dagelijks CE plus MPA gebruikten. In dit deelonderzoek werd eerder gebruik van oestrogeen-alone of oestrogeen plus progestageentherapie gemeld door 26 procent van de vrouwen. Het relatieve risico op invasieve borstkanker was 1,24 (95 procent nCI, 1,01-1,54), en het absolute risico was 41 versus 33 gevallen per 10.000 vrouwjaren, voor CE plus MPA in vergelijking met placebo. Onder vrouwen die eerder hormoontherapie hadden gebruikt, was het relatieve risico op invasieve borstkanker 1,86, en het absolute risico was 46 versus 25 gevallen per 10.000 vrouwjaren, voor oestrogeen plus progestageen vergeleken met placebo. Onder vrouwen die geen eerdere hormoontherapie hadden gebruikt, was het relatieve risico op invasieve borstkanker 1,09 en het absolute risico was 40 versus 36 gevallen per 10.000 vrouwjaren voor CE plus MPA in vergelijking met placebo. In dezelfde substudie waren invasieve borstkankers groter, hadden ze meer kans op klierpositief en werden ze in een verder gevorderd stadium gediagnosticeerd in de CE (0,625 mg) plus MPA (2,5 mg) groep in vergelijking met de placebogroep. Gemetastaseerde ziekte was zeldzaam, zonder duidelijk verschil tussen de twee groepen. Andere prognostische factoren zoals histologisch subtype, graad en hormoonreceptorstatus verschilden niet tussen de groepen. (Zien Klinische studies .)
In overeenstemming met de klinische WHI-onderzoeken, hebben observationele onderzoeken ook een verhoogd risico op borstkanker gemeld voor behandeling met oestrogeen plus progestageen, en een kleiner verhoogd risico voor therapie met alleen oestrogeen, na meerdere jaren van gebruik. Het risico nam toe met de duur van het gebruik en leek ongeveer 5 jaar na het stoppen van de behandeling terug te keren naar de uitgangswaarde (alleen de observationele onderzoeken hebben substantiële gegevens over het risico na het stoppen). Observationele studies suggereren ook dat het risico op borstkanker groter was en eerder duidelijk werd bij behandeling met oestrogeen plus progestageen dan bij behandeling met alleen oestrogeen. Deze onderzoeken hebben echter over het algemeen geen significante variatie gevonden in het risico op borstkanker tussen verschillende combinaties, doses of toedieningswegen van oestrogeen en progestageen.
Van het gebruik van oestrogeen plus progestageen is gemeld dat het resulteert in een toename van abnormale mammogrammen die verdere evaluatie vereisen. Alle vrouwen dienen jaarlijks borstonderzoek te ondergaan door een zorgverlener en maandelijks zelfonderzoek van de borsten uit te voeren. Bovendien moeten mammografische onderzoeken worden gepland op basis van de leeftijd van de patiënt, risicofactoren en eerdere mammogramresultaten.
Endometriumkanker
Een verhoogd risico op endometriumkanker is gemeld bij het gebruik van ongehinderde oestrogeentherapie bij een vrouw met een baarmoeder. Het gerapporteerde risico op endometriumkanker bij oestrogeengebruikers zonder tegenstand is ongeveer 2 tot 12 keer groter dan bij niet-gebruikers en lijkt afhankelijk van de duur van de behandeling en van de oestrogeendosis. De meeste onderzoeken laten geen significant verhoogd risico zien in verband met het gebruik van oestrogenen gedurende minder dan 1 jaar. Het grootste risico lijkt geassocieerd te zijn met langdurig gebruik, met verhoogde risico's van 15- tot 24-voudig gedurende 5 tot 10 jaar of langer en dit risico blijkt aan te houden gedurende ten minste 8 tot 15 jaar nadat de oestrogeentherapie is stopgezet.
Klinische bewaking van alle vrouwen die oestrogeen- en progestageentherapie gebruiken, is belangrijk. In alle gevallen van niet-gediagnosticeerde aanhoudende of terugkerende abnormale genitale bloeding moeten adequate diagnostische maatregelen worden genomen, waaronder gerichte of willekeurige endometriumafname indien geïndiceerd, om maligniteit uit te sluiten. Er is geen bewijs dat het gebruik van natuurlijke oestrogenen resulteert in een ander endometriumrisicoprofiel dan synthetische oestrogenen met een equivalente oestrogeendosis. Het is aangetoond dat het toevoegen van een progestageen aan oestrogeentherapie bij postmenopauzale vrouwen het risico op endometriumhyperplasie vermindert, wat een voorloper kan zijn van endometriumkanker.
Eierstokkanker
De WHI oestrogeen plus progestageen substudie rapporteerde een statistisch niet significant verhoogd risico op eierstokkanker. Na een gemiddelde follow-up van 5,6 jaar was het relatieve risico op eierstokkanker voor CE plus MPA versus placebo 1,58 (95 procent nCI, 0,77 – 3,24). Het absolute risico voor CE plus MPA versus placebo was 4 versus 3 gevallen per 10.000 vrouwjaren. In sommige epidemiologische onderzoeken is het gebruik van oestrogeen plus progestageen en producten met alleen oestrogeen, in het bijzonder gedurende 5 jaar of langer, in verband gebracht met een verhoogd risico op eierstokkanker. De duur van de blootstelling die gepaard gaat met een verhoogd risico is echter niet consistent in alle epidemiologische onderzoeken en sommige rapporteren geen verband.
Waarschijnlijke dementie
In de oestrogeen plus progestageen Women's Health Initiative Memory Study (WHIMS), een aanvullende studie van WHI, werd een populatie van 4.532 postmenopauzale vrouwen van 65 tot 79 jaar gerandomiseerd naar dagelijkse CE (0,625 mg) plus MPA (2,5 mg) of placebo.
In de aanvullende studie WHIMS oestrogeen plus progestageen werd na een gemiddelde follow-up van 4 jaar bij 40 vrouwen in de CE plus MPA-groep en bij 21 vrouwen in de placebogroep waarschijnlijke dementie vastgesteld. Het relatieve risico van waarschijnlijke dementie voor oestrogeen plus progestageen versus placebo was 2,05 (95 procent BI, 1,21-3,48). Het absolute risico op waarschijnlijke dementie voor CE plus MPA versus placebo was 45 versus 22 gevallen per 10.000 vrouwjaren. Het is niet bekend of deze bevindingen van toepassing zijn op jongere postmenopauzale vrouwen. (Zien Klinische studies en PREVENTIEVE MAATREGELEN , Geriatrisch gebruik .)
Visusafwijkingen
Retinale vasculaire trombose is gemeld bij patiënten die oestrogeen kregen. Stop de behandeling met oestrogeen plus progestageen in afwachting van onderzoek als er plotseling gedeeltelijk of volledig verlies van het gezichtsvermogen is, of als er een plotseling begin van proptosis, diplopie of migraine is. Als onderzoek papiloedeem of retinale vasculaire laesies aan het licht brengt, moet de behandeling met oestrogeen plus progestageen permanent worden stopgezet.
PREVENTIEVE MAATREGELEN
Algemeen
Toevoeging van een progestageen wanneer een vrouw geen hysterectomie heeft gehad
Studies naar de toevoeging van een progestageen gedurende 10 of meer dagen van een cyclus van oestrogeentoediening, of dagelijks met oestrogeen in een continu regime, hebben een lagere incidentie van endometriumhyperplasie gerapporteerd dan zou worden veroorzaakt door oestrogeenbehandeling alleen. Endometriumhyperplasie kan een voorloper zijn van endometriumkanker.
Er zijn echter mogelijke risico's die kunnen worden geassocieerd met het gebruik van progestagenen met oestrogenen in vergelijking met regimes met alleen oestrogeen. Deze omvatten een verhoogd risico op borstkanker.
Vloeistofretentie
Progesteron kan enige mate van vochtretentie veroorzaken. Vrouwen met aandoeningen die door deze factor kunnen worden beïnvloed, zoals hart- of nierdisfunctie, verdienen zorgvuldige observatie.
Duizeligheid en slaperigheid
PROMETRIUM-capsules kunnen voorbijgaande duizeligheid en slaperigheid veroorzaken en moeten met voorzichtigheid worden gebruikt bij het besturen van een motorvoertuig of het bedienen van machines. PROMETRIUM-capsules moeten als een enkele dagelijkse dosis voor het slapengaan worden ingenomen.
Patiënt informatie
Algemeen
Dit product bevat arachideolie en mag niet worden gebruikt als u allergisch bent voor pinda's.
Artsen wordt aangeraden de inhoud van de patiëntenbijsluiter te bespreken met patiënten voor wie zij PROMETRIUM 100 mg capsules voorschrijven.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Progesteron is niet getest op carcinogeniteit bij dieren via de orale toedieningsweg. Bij implantatie in vrouwelijke muizen produceerde progesteron borstcarcinomen, granulosaceltumoren van de eierstokken en stromale sarcomen van het endometrium. Bij honden veroorzaakten langdurige intramusculaire injecties nodulaire hyperplasie en goedaardige en kwaadaardige borsttumoren. Subcutane of intramusculaire injecties van progesteron verkortten de latentieperiode en verhoogden de incidentie van borsttumoren bij ratten die eerder waren behandeld met een chemisch carcinogeen.
Progesteron vertoonde geen bewijs van genotoxiciteit in in vitro-onderzoeken voor puntmutaties of voor chromosomale schade. In vivo-onderzoeken naar chromosoombeschadiging hebben positieve resultaten opgeleverd bij muizen bij orale doses van 1000 mg/kg en 2000 mg/kg. Van exogeen toegediend progesteron is aangetoond dat het de ovulatie remt bij een aantal soorten en het is te verwachten dat hoge doses die gedurende langere tijd worden gegeven, de vruchtbaarheid zullen verminderen tot de stopzetting van de behandeling.
Zwangerschap
PROMETRIUM-capsules mogen niet tijdens de zwangerschap worden gebruikt. (Zien CONTRA-INDICATIES ).
Zwangerschap Categorie B
Er zijn reproductiestudies uitgevoerd bij muizen met doses tot 9 maal de orale dosis voor de mens, bij ratten met doses tot 44 maal de orale dosis voor de mens, bij konijnen met een dosis van 10 mcg/dag die lokaal in de baarmoeder werd afgeleverd door een geïmplanteerd apparaat , bij cavia's in doses van ongeveer de helft van de orale dosis voor de mens en bij resusapen in doses die ongeveer de dosis voor de mens zijn, allemaal gebaseerd op het lichaamsoppervlak, en er zijn weinig of geen aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van progesteron.
Verpleegkundigen
Detecteerbare hoeveelheden progestageen zijn geïdentificeerd in de melk van zogende vrouwen die progestagenen krijgen. Voorzichtigheid is geboden wanneer PROMETRIUM 100 mg capsules worden toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
PROMETRIUM-capsules zijn niet geïndiceerd voor kinderen. Er zijn geen klinische onderzoeken uitgevoerd bij pediatrische patiënten.
Geriatrisch gebruik
Er zijn onvoldoende geriatrische vrouwen betrokken geweest bij klinische onderzoeken met PROMETRIUM-capsules om te bepalen of personen ouder dan 65 jaar verschillen van jongere proefpersonen in hun reactie op PROMETRIUM 200 mg capsules.
De studie over het gezondheidsinitiatief voor vrouwen
In het Women's Health Initiative (WHI) oestrogeen plus progestageen subonderzoek (dagelijkse CE [0,625 mg] plus MPA [2,5 mg] versus placebo), was er een hoger relatief risico op niet-fatale beroerte en invasieve borstkanker bij vrouwen ouder dan 65 jaar . (Zien Klinische studies en WAARSCHUWINGEN , Cardiovasculaire aandoeningen en Kwaadaardige neoplasma's. )
Het geheugenonderzoek van het Women's Health Initiative
In de Women's Health Initiative Memory Study (WHIMS) van postmenopauzale vrouwen in de leeftijd van 65 tot 79 jaar was er een verhoogd risico op het ontwikkelen van waarschijnlijke dementie in de aanvullende studie oestrogeen plus progestageen in vergelijking met placebo. (Zien Klinische studies en WAARSCHUWINGEN , Vermoedelijke dementie. )
OVERDOSERING
Er zijn geen onderzoeken naar overdosering bij mensen uitgevoerd. In geval van overdosering moet de behandeling met PROMETRIUM-capsules worden stopgezet en moet de patiënt symptomatisch worden behandeld.
CONTRA-INDICATIES
PROMETRIUM-capsules mogen niet worden gebruikt bij vrouwen met een van de volgende aandoeningen:
KLINISCHE FARMACOLOGIE
PROMETRIUM 200 mg capsules zijn een orale doseringsvorm van gemicroniseerd progesteron dat chemisch identiek is aan progesteron van ovariële oorsprong. De orale biologische beschikbaarheid van progesteron wordt verhoogd door micronisatie.
Farmacokinetiek
Absorptie
Na orale toediening van progesteron als gemicroniseerde capsuleformulering van zachte gelatine, werden binnen 3 uur maximale serumconcentraties bereikt. De absolute biologische beschikbaarheid van gemicroniseerd progesteron is niet bekend. Tabel 1 geeft een samenvatting van de gemiddelde farmacokinetische parameters bij postmenopauzale vrouwen na vijf orale dagelijkse doses PROMETRIUM-capsules 100 mg als een gemicroniseerde capsuleformulering met zachte gelatine.
TABEL 1. Farmacokinetische parameters van PROMETRIUM 200 mg capsules
Serumprogesteronconcentraties leken lineair en dosisproportioneel na toediening van meerdere doses PROMETRIUM 200 mg capsules 100 mg over het dosisbereik van 100 mg per dag tot 300 mg per dag bij postmenopauzale vrouwen. Hoewel doses hoger dan 300 mg per dag niet werden onderzocht bij vrouwen, leken serumconcentraties van een onderzoek bij mannelijke vrijwilligers lineair en dosisproportioneel tussen 100 mg per dag en 400 mg per dag. De farmacokinetische parameters bij mannelijke vrijwilligers waren over het algemeen consistent met die waargenomen bij postmenopauzale vrouwen.
Verdeling
Progesteron is voor ongeveer 96 tot 99 procent gebonden aan serumeiwitten, voornamelijk aan serumalbumine (50 tot 54 procent) en transcortine (43 tot 48 procent).
Metabolisme
Progesteron wordt voornamelijk door de lever gemetaboliseerd tot pregnanediolen en pregnanolonen. Pregnanediolen en pregnanolonen worden in de lever geconjugeerd tot glucuronide- en sulfaatmetabolieten. Progesteronmetabolieten die in de gal worden uitgescheiden, kunnen worden gedeconjugeerd en kunnen verder worden gemetaboliseerd in de darm via reductie, dehydroxylering en epimerisatie.
uitscheiding
De glucuronide- en sulfaatconjugaten van pregnanediol en pregnanolon worden uitgescheiden in de gal en urine. Progesteronmetabolieten worden voornamelijk door de nieren geëlimineerd. Progesteronmetabolieten die in de gal worden uitgescheiden, kunnen enterohepatische recycling ondergaan of kunnen worden uitgescheiden in de feces.
Speciale populaties
De farmacokinetiek van PROMETRIUM-capsules is niet beoordeeld bij patiënten met een laag lichaamsgewicht of obesitas.
Leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van PROMETRIUM 100 mg capsules is niet onderzocht.
Nierinsufficiëntie
Het effect van nierinsufficiëntie op de farmacokinetiek van PROMETRIUM-capsules is niet onderzocht.
Voedsel-geneesmiddelinteractie
Gelijktijdige inname van voedsel verhoogde de biologische beschikbaarheid van PROMETRIUM 100 mg capsules in vergelijking met een nuchtere toestand bij toediening aan postmenopauzale vrouwen in een dosis van 200 mg.
Geneesmiddelinteracties
Het metabolisme van progesteron door menselijke levermicrosomen werd geremd door ketoconazol (IC50
Gelijktijdige toediening van geconjugeerde oestrogenen en PROMETRIUM 200 mg capsules aan 29 postmenopauzale vrouwen gedurende een periode van 12 dagen resulteerde in een verhoging van de totale oestronconcentraties (Cmax 3,68 ng/ml tot 4,93 ng/ml) en de totale equilineconcentraties (Cmax 2,27 ng/ml tot 3,22). ng/ml) en een afname van de circulerende 17β-oestradiolconcentraties (Cmax 0,037 ng/ml tot 0,030 ng/ml). De halfwaardetijd van de geconjugeerde oestrogenen was vergelijkbaar bij gelijktijdige toediening van PROMETRIUM-capsules. Tabel 2 vat de farmacokinetische parameters samen.
TABEL 2. Gemiddelde (± SD) farmacokinetische parameters voor estradiol, oestron en equiline na gelijktijdige toediening van geconjugeerde oestrogenen 0,625 mg en PROMETRIUM capsules 200 mg gedurende 12 dagen aan postmenopauzale vrouwen
Klinische studies
Effecten op het endometrium
In een gerandomiseerde, dubbelblinde klinische studie kregen 358 postmenopauzale vrouwen, elk met een intacte baarmoeder, een behandeling tot 36 maanden. De behandelingsgroepen waren: PROMETRIUM-capsules in een dosis van 200 mg per dag gedurende 12 dagen per cyclus van 28 dagen in combinatie met geconjugeerde oestrogenen 0,625 mg per dag (n=120); geconjugeerde oestrogenen slechts 0,625 mg per dag (n=119); of placebo (n=19). De proefpersonen in alle drie de behandelingsgroepen waren voornamelijk blanke vrouwen (87 procent of meer van elke groep). De resultaten voor de incidentie van endometriumhyperplasie bij vrouwen die tot 3 jaar behandeling kregen, worden weergegeven in Tabel 3. Een vergelijking van de groep die behandeld werd met PROMETRIUM-capsules plus geconjugeerde oestrogenen met de groep met alleen geconjugeerde oestrogenen toonde een significant lager percentage hyperplasie (6 procent). combinatieproduct versus 64 procent oestrogeen alleen) in de behandelingsgroep met PROMETRIUM-capsules plus geconjugeerde oestrogenen gedurende 36 maanden behandeling.
TABEL 3. Incidentie van endometriumhyperplasie bij vrouwen die 3 jaar behandeling krijgen
De tijden tot diagnose van endometriumhyperplasie gedurende 36 maanden behandeling worden weergegeven in figuur 1. Deze figuur illustreert grafisch dat het aandeel patiënten met hyperplasie significant groter was voor de groep met geconjugeerde oestrogenen (64 procent) in vergelijking met de groep met geconjugeerde oestrogenen plus PROMETRIUM-capsules (6 procent).
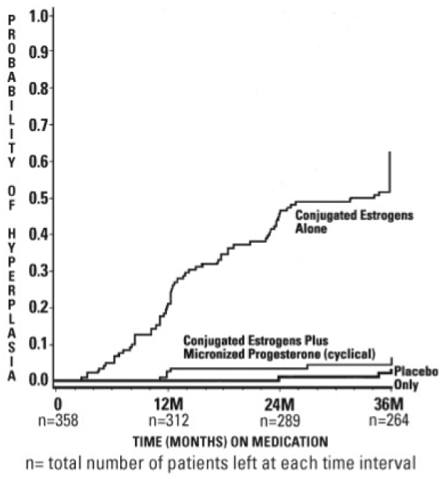
Afbeelding 1. Tijd tot hyperplasie bij vrouwen die tot 36 maanden behandeling krijgen
De stopzettingspercentages als gevolg van hyperplasie gedurende de 36 maanden van de behandeling zijn zoals weergegeven in tabel 4. Voor elke mate van hyperplasie was het stopzettingspercentage voor patiënten die geconjugeerde oestrogenen plus PROMETRIUM 100 mg capsules kregen vergelijkbaar met dat van de groep met alleen placebo, terwijl de het stopzettingspercentage voor patiënten die alleen geconjugeerde oestrogenen kregen, was significant hoger. Vrouwen die de behandeling definitief stopzetten vanwege hyperplasie waren qua demografie vergelijkbaar met de totale onderzoekspopulatie.
TABEL 4. Stopzettingspercentage als gevolg van hyperplasie gedurende 36 maanden behandeling
Effecten op secundaire amenorroe
In een single-center, gerandomiseerde, dubbelblinde klinische studie met premenopauzale vrouwen met secundaire amenorroe gedurende ten minste 90 dagen, leidde toediening van 10 dagen behandeling met PROMETRIUM 200 mg capsules ertoe dat 80 procent van de vrouwen onttrekkingsbloedingen kreeg binnen 7 dagen na de laatste dosis PROMETRIUM 100 mg capsules, 300 mg per dag (n=20), vergeleken met 10 procent van de vrouwen die onttrekkingsbloedingen kregen in de placebogroep (n=21).
In een multicenter, open-label postmarketing doseringsonderzoek met parallelle groepen, waarbij premenopauzale vrouwen met secundaire amenorroe gedurende ten minste 90 dagen werden geïncludeerd, toediening van 10 dagen PROMETRIUM 100 mg capsules gedurende twee 28-daagse behandelingscycli, 300 mg per dag (n= 107) of 400 mg per dag (n=99), resulteerde in respectievelijk 73,8 procent en 76,8 procent van de vrouwen die onttrekkingsbloedingen kregen.
De snelheid van secretoire transformatie werd geëvalueerd in een multicenter, gerandomiseerde, dubbelblinde klinische studie bij postmenopauzale vrouwen met oestrogeen-priming. PROMETRIUM 100 mg capsules, oraal toegediend gedurende 10 dagen met 400 mg per dag (n=22) veroorzaakten volledige secretoire veranderingen in het endometrium bij 45 procent van de vrouwen vergeleken met 0 procent in de placebogroep (n=23).
Een tweede multicenter, parallelle groep, open-label postmarketing doseringsonderzoek bij premenopauzale vrouwen met secundaire amenorroe gedurende ten minste 90 dagen evalueerde ook de snelheid van secretoire transformatie. Alle proefpersonen kregen dagelijks orale geconjugeerde oestrogenen gedurende 3 opeenvolgende behandelcycli van 28 dagen en PROMETRIUM-capsules, 300 mg per dag (n=107) of 400 mg per dag (n=99) gedurende 10 dagen van elke behandelingscyclus. De snelheid van volledige secretietransformatie was respectievelijk 21,5 procent en 28,3 procent.
Onderzoek naar gezondheidsinitiatieven voor vrouwen
Het Women's Health Initiative (WHI) nam ongeveer 27.000 overwegend gezonde postmenopauzale vrouwen op in twee substudies om de risico's en voordelen van dagelijkse orale geconjugeerde oestrogenen (CE) [0,625 mg]-alleen of in combinatie met medroxyprogesteronacetaat (MPA) [2,5 mg] te beoordelen. vergeleken met placebo bij de preventie van bepaalde chronische ziekten. Het primaire eindpunt was de incidentie van coronaire hartziekte [(CHD) gedefinieerd als niet-fataal myocardinfarct (MI), stille MI en overlijden door CHD], met invasieve borstkanker als de primaire nadelige uitkomst. Een "globale index" omvatte het vroegste optreden van CHD, invasieve borstkanker, beroerte, longembolie (PE), endometriumkanker (alleen in de CE plus MPA-substudie), colorectale kanker, heupfractuur of overlijden door een andere oorzaak. Deze substudies evalueerden niet de effecten van CE-alleen of CE plus MPA op symptomen van de menopauze.
WHI Oestrogeen Plus Progestageen Substudie
De WHI-substudie oestrogeen plus progestageen werd vroegtijdig stopgezet. Volgens de vooraf gedefinieerde stopregel overtrof na een gemiddelde follow-up van 5,6 jaar behandeling het verhoogde risico op borstkanker en cardiovasculaire voorvallen de gespecificeerde voordelen die zijn opgenomen in de 'globale index'. Het absolute overmatige risico op gebeurtenissen in de “globale index” was 19 per 10.000 vrouwjaren.
Voor die uitkomsten opgenomen in de WHI “global index” die statistische significantie bereikten na 5,6 jaar follow-up, waren de absolute extra risico’s per 10.000 vrouwjaren in de groep behandeld met CE plus MPA 7 extra CHD-voorvallen, 8 extra beroertes, 10 meer PE's en 8 meer invasieve borstkankers, terwijl de absolute risicoreducties per 10.000 vrouwjaren 6 minder colorectale kankers en 5 heupfracturen minder waren.
De resultaten van de substudie oestrogeen plus progestageen, waaraan 16.608 vrouwen deelnamen (gemiddeld 63 jaar, variërend van 50 tot 79; 83,9 procent blank, 6,8 procent zwart, 5,4 procent Latijns-Amerikaans, 3,9 procent overig) worden weergegeven in tabel 5. Deze resultaten weerspiegelen centraal beoordeelde gegevens na een gemiddelde follow-up van 5,6 jaar.
TABEL 5. Relatief en absoluut risico waargenomen in de oestrogeen plus progestageen-substudie van WHI met een gemiddelde van 5,6 jaar a, b
Het tijdstip van de start van de behandeling met oestrogeen plus progestageen ten opzichte van het begin van de menopauze kan het algehele risico-batenprofiel beïnvloeden. Het WHI oestrogeen plus progestageen subonderzoek, gestratificeerd naar leeftijd, toonde bij vrouwen van 50 tot 59 jaar een niet-significante trend in de richting van het verminderen van het risico op algehele mortaliteit [hazard ratio (HR) 0,69 (95 procent BI, 0,44-1,07)].
Geheugenonderzoek van het gezondheidsinitiatief voor vrouwen
De oestrogeen plus progestageen Women's Health Initiative Memory Study (WHIMS), een aanvullende studie van WHI, omvatte 4.532 overwegend gezonde postmenopauzale vrouwen van 65 jaar en ouder (47 procent was 65 tot 69 jaar oud; 35 procent was 70 tot 74 jaar oud). leeftijd; en 18 procent was 75 jaar en ouder) om de effecten van dagelijkse CE (0,625 mg) plus MPA (2,5 mg) op de incidentie van waarschijnlijke dementie (primaire uitkomst) te evalueren in vergelijking met placebo.
Na een gemiddelde follow-up van 4 jaar was het relatieve risico op waarschijnlijke dementie voor CE plus MPA versus placebo 2,05 (95 procent BI, 1,21 – 3,48). Het absolute risico op waarschijnlijke dementie voor CE plus MPA versus placebo was 45 versus 22 per 10.000 vrouwjaren. Waarschijnlijke dementie zoals gedefinieerd in deze studie omvatte de ziekte van Alzheimer (AD), vasculaire dementie (VaD) en gemengd type (met kenmerken van zowel AD als VaD). De meest voorkomende classificatie van waarschijnlijke dementie in de behandelingsgroep en de placebogroep was AD. Aangezien het aanvullende onderzoek werd uitgevoerd bij vrouwen van 65 tot 79 jaar, is het niet bekend of deze bevindingen van toepassing zijn op jongere postmenopauzale vrouwen. (Zien WAARSCHUWINGEN , Waarschijnlijke dementie en PREVENTIEVE MAATREGELEN , Geriatrisch gebruik .)
PATIËNT INFORMATIE
PROMETRIUM® (progesteron, USP) Capsules 100 mg en 200 mg
Lees deze PATINTINFORMATIE voordat u begint met het innemen van PROMETRIUM 200 mg capsules en lees wat u krijgt elke keer dat u uw recept voor PROMETRIUM 100 mg capsules bijvult. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
WAT IS DE BELANGRIJKSTE INFORMATIE DIE IK MOET WETEN OVER PROMETRIUM 100 mg CAPSULES (een progesteronhormoon)?
- Progestagenen met oestrogenen mogen niet worden gebruikt om hartaandoeningen, hartaanvallen, beroertes of dementie te voorkomen.
- Het gebruik van progestagenen met oestrogenen kan uw kans op hartaanvallen, beroertes, borstkanker en bloedstolsels vergroten.
- Het gebruik van progestagenen met oestrogenen kan uw kans op dementie vergroten, zo blijkt uit een onderzoek bij vrouwen van 65 jaar en ouder.
- U en uw zorgverlener moeten regelmatig bespreken of u nog steeds moet worden behandeld met PROMETRIUM 100 mg capsules.
DIT PRODUCT BEVAT PINDAOLIE EN MAG NIET WORDEN GEBRUIKT ALS U ALLERGISCH BENT VOOR PINDA'S.
Wat is PROMETRIUM 200 mg capsules?
PROMETRIUM 100 mg capsules bevatten het vrouwelijke hormoon progesteron.
Waarvoor wordt PROMETRIUM 100 mg capsules gebruikt?
Behandeling van menstruele onregelmatigheden
PROMETRIUM 200 mg capsules worden gebruikt voor de behandeling van secundaire amenorroe (afwezigheid van menstruatie bij vrouwen die eerder een menstruatie hebben gehad) als gevolg van een afname van progesteron. Wanneer u niet genoeg progesteron aanmaakt, kunnen er onregelmatige menstruaties ontstaan. Als uw zorgverlener heeft vastgesteld dat uw lichaam zelf niet genoeg progesteron aanmaakt, kan PROMETRIUM 200 mg capsules worden voorgeschreven om u van de progesteron te voorzien die u nodig heeft.
Bescherming van het endometrium (voering van de baarmoeder)
PROMETRIUM 200 mg capsules worden gebruikt in combinatie met oestrogeenbevattende medicijnen bij een postmenopauzale vrouw met een baarmoeder (baarmoeder). Het gebruik van alleen oestrogeen verhoogt de kans op het ontwikkelen van een aandoening die endometriumhyperplasie wordt genoemd en die kan leiden tot kanker van het baarmoederslijmvlies (baarmoeder). De toevoeging van een progestageen wordt over het algemeen aanbevolen voor een vrouw met een baarmoeder om de kans op het krijgen van baarmoederkanker (baarmoeder) te verkleinen.
Wie mag PROMETRIUM-capsules niet gebruiken?
Begin niet met het innemen van PROMETRIUM-capsules als u:
- Zijn allergisch voor pinda's
- Heb ongewone vaginale bloedingen
- Momenteel bepaalde vormen van kanker heeft of heeft gehad Behandeling met oestrogeen plus progestageen kan de kans op het krijgen van bepaalde soorten kanker vergroten, waaronder kanker van de borst of baarmoeder. Als u kanker heeft of heeft gehad, overleg dan met uw zorgverlener of u PROMETRIUM-capsules moet gebruiken.
- Een beroerte of hartaanval gehad
- Momenteel bloedstolsels heeft of heeft gehad
- Momenteel leverproblemen heeft of heeft gehad
- Zijn allergisch voor PROMETRIUM-capsules of een van de ingrediënten? Zie de lijst van ingrediënten in PROMETRIUM 200 mg capsules aan het einde van deze bijsluiter.
- Denk je dat je zwanger bent
Vertel uw zorgverlener:
- Als u borstvoeding geeft. Het hormoon in PROMETRIUM 100 mg capsules kan in de moedermelk terechtkomen.
- Over al uw medische problemen. Uw zorgverlener moet u mogelijk nauwkeuriger controleren als u bepaalde aandoeningen heeft, zoals astma (piepende ademhaling), epilepsie (aanvallen), diabetes, migraine, endometriose, lupus, problemen met uw hart, lever, schildklier of nieren, of hoge calciumspiegels in uw bloed.
- Over alle medicijnen die u neemt. Dit omvat geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Sommige geneesmiddelen kunnen de werking van PROMETRIUM 100 mg capsules beïnvloeden. PROMETRIUM-capsules kunnen ook de werking van uw andere geneesmiddelen beïnvloeden.
Hoe moet ik PROMETRIUM 200 mg capsules innemen?
Wat zijn de mogelijke bijwerkingen van PROMETRIUM-capsules?
Bijwerkingen zijn gegroepeerd op hoe ernstig ze zijn en hoe vaak ze optreden wanneer u wordt behandeld:
Ernstige, maar minder vaak voorkomende bijwerkingen zijn onder meer:
- Risico voor de foetus: Gevallen van gespleten gehemelte, gespleten lip, hypospadie, ventrikelseptumdefect, open ductus arteriosus en andere aangeboren hartafwijkingen.
- Abnormale bloedstolling: Beroerte, hartaanval, longembolie, verlies van gezichtsvermogen of blindheid.
Enkele van de waarschuwingssignalen van ernstige bijwerkingen zijn:
- Veranderingen in visie of spraak
- Plotselinge nieuwe ernstige hoofdpijn
- Ernstige pijn in uw borst of benen met of zonder kortademigheid, zwakte en vermoeidheid
- Duizeligheid en flauwvallen
- Braken
Bel onmiddellijk uw zorgverlener als u een van deze waarschuwingssignalen of andere ongewone symptomen krijgt die u zorgen baren.
Minder ernstige, maar vaak voorkomende bijwerkingen zijn:
- Hoofdpijn
- Borstpijn
- Onregelmatige vaginale bloedingen of spotting
- Maag- of buikkrampen, opgeblazen gevoel
- Misselijkheid en overgeven
- Haaruitval
- Vloeistofretentie
- Vaginale schimmelinfectie
Dit zijn niet alle mogelijke bijwerkingen van PROMETRIUM 200 mg capsules. Vraag voor meer informatie uw zorgverlener of apotheker om advies over bijwerkingen. U kunt bijwerkingen melden aan AbbVie Inc. op 1-800-633-9110 of aan FDA op 1-800-FDA-1088.
Wat kan ik doen om mijn kans op het krijgen van een ernstige bijwerking met PROMETRIUM 100 mg capsules te verkleinen?
- Bespreek regelmatig met uw zorgverlener of u door moet gaan met het innemen van PROMETRIUM 100 mg capsules.
- Raadpleeg onmiddellijk uw zorgverlener als u ongewone vaginale bloedingen krijgt tijdens het gebruik van PROMETRIUM-capsules.
- Laat elk jaar een bekkenonderzoek, borstonderzoek en mammogram (borströntgenfoto) uitvoeren, tenzij uw zorgverlener u iets anders vertelt. Als leden van uw familie borstkanker hebben gehad of als u ooit borstknobbels of een abnormaal mammogram heeft gehad, moet u mogelijk vaker borstonderzoeken ondergaan.
- Als u een hoge bloeddruk, een hoog cholesterolgehalte (vet in het bloed), diabetes heeft, overgewicht heeft of als u tabak gebruikt, heeft u mogelijk een grotere kans op het krijgen van een hartaandoening. Vraag uw zorgverlener naar manieren om uw kansen op het krijgen van een hartaandoening te verkleinen.
Algemene informatie over veilig en effectief gebruik van PROMETRIUM-capsules
- Soms worden medicijnen voorgeschreven voor aandoeningen die niet in de patiëntenbijsluiter staan. Gebruik PROMETRIUM-capsules niet voor aandoeningen waarvoor het niet is voorgeschreven.
- Uw zorgverlener heeft u en u alleen dit medicijn voorgeschreven. Geef PROMETRIUM capsules niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
- PROMETRIUM 200 mg capsules dienen als een enkele dagelijkse dosis voor het slapengaan te worden ingenomen. Sommige vrouwen kunnen tijdens de initiële therapie extreme duizeligheid en/of slaperigheid ervaren. In enkele gevallen kunnen de symptomen wazig zien, moeite met spreken, moeite met lopen en een abnormaal gevoel zijn. Als u deze symptomen ervaart, bespreek ze dan meteen met uw zorgverlener.
- Wees voorzichtig bij het besturen van een motorvoertuig of het bedienen van machines, aangezien duizeligheid of slaperigheid kan optreden.
Houd PROMETRIUM-capsules buiten het bereik van kinderen.
Deze bijsluiter geeft een samenvatting van de belangrijkste informatie over PROMETRIUM 100 mg capsules. Als u meer informatie wilt, neem dan contact op met uw zorgverlener of apotheker. U kunt informatie opvragen over PROMETRIUM 100 mg capsules die is geschreven voor gezondheidswerkers. U kunt meer informatie krijgen door het gratis nummer 1-800-633-9110 te bellen.
Wat zijn de ingrediënten in PROMETRIUM-capsules?
Actief bestanddeel: 100 mg of 200 mg gemicroniseerd progesteron
De inactieve ingrediënten voor PROMETRIUM-capsules 100 mg omvatten: pindaolie NF, gelatine NF, glycerine USP, lecithine NF, titaniumdioxide USP, FD&C Red No. 40 en D&C Yellow No. 10.
De inactieve ingrediënten voor PROMETRIUM-capsules 200 mg omvatten: pindaolie NF, gelatine NF, glycerine USP, lecithine NF, titaniumdioxide USP, D&C Yellow No. 10 en FD&C Yellow No. 6.
HOE GELEVERD
PROMETRIUM 200 mg capsules 100 mg zijn ronde, perzikkleurige capsules met de zwarte opdruk 'SV'.
PROMETRIUM 100 mg capsules 200 mg zijn ovale, lichtgele capsules met de zwarte opdruk 'SV2'.
Bewaren bij 25°C (77°F); excursies toegestaan tot 15 ° tot 30 ° C (59 ° tot 86 ° F) [Zie USP-gecontroleerde kamertemperatuur].
