Ponstel 250mg, 500mg Mefenamic Acid Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
PONSTEL® (mefenaminezuur) Capsules, USP 250 mg
Cardiovasculair risico
- NSAID's kunnen een verhoogd risico op ernstige cardiovasculaire trombotische voorvallen, myocardinfarct en beroerte veroorzaken, die fataal kunnen zijn. Dit risico kan toenemen met de duur van het gebruik. Patiënten met hart- en vaatziekten of risicofactoren voor hart- en vaatziekten lopen mogelijk een groter risico (zie: WAARSCHUWINGEN ).
- PONSTEL® (mefenaminezuur) is gecontra-indiceerd voor de behandeling van peri-operatieve pijn in de setting van coronaire bypass-transplantaat (CABG) -chirurgie (zie WAARSCHUWINGEN ).
Gastro-intestinaal risico
- NSAID's veroorzaken een verhoogd risico op ernstige gastro-intestinale bijwerkingen, waaronder bloedingen, ulceratie en perforatie van de maag of darmen, die fataal kunnen zijn. Deze gebeurtenissen kunnen op elk moment tijdens het gebruik en zonder waarschuwingssymptomen optreden. Oudere patiënten lopen een groter risico op ernstige gastro-intestinale gebeurtenissen (zie: WAARSCHUWINGEN ).
OMSCHRIJVING
Ponstel® (mefenaminezuur) is een lid van de fenamaatgroep van niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's). Elke blauwgestreepte, ivoren capsule bevat 250 mg mefenaminezuur voor orale toediening. Mefenaminezuur is een wit tot grijswit, geurloos, microkristallijn poeder met een smeltpunt van 230°-231°C en een oplosbaarheid in water van 0,004% bij pH 7,1. De chemische naam is N-2,3-xylylantranilzuur. Het molecuulgewicht is 241,29. De molecuulformule is C15H15NO2 en de structuurformule van mefenaminezuur is:
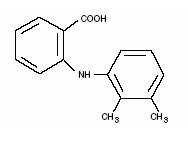
Elke capsule bevat ook lactose, NF. Het omhulsel en/of de band van de capsule bevat citroenzuur, USP; D&C geel nr. 10; FD&C blauw nr. 1; FD&C rood nr. 3; FD&C geel nr. 6; gelatine, NF; glycerolmonooleaat; siliciumdioxide, NF; natriumbenzoaat, NF; natriumlaurylsulfaat, NF; titaandioxide, USP.
INDICATIES
Overweeg zorgvuldig de mogelijke voordelen en risico's van PONSTEL (mefenaminezuur) en andere behandelingsopties voordat u besluit PONSTEL (mefenaminezuur) te gebruiken. Gebruik de laagste effectieve dosis voor de kortste duur in overeenstemming met de individuele behandeldoelen van de patiënt (zie: WAARSCHUWINGEN ).
PONSTEL (mefenaminezuur) is geïndiceerd:
- Voor verlichting van milde tot matige pijn bij patiënten van 14 jaar en ouder, wanneer de behandeling niet langer duurt dan een week (7 dagen).
- Voor de behandeling van primaire dysmenorroe.
DOSERING EN ADMINISTRATIE
Overweeg zorgvuldig de mogelijke voordelen en risico's van PONSTEL (mefenaminezuur) en andere behandelingsopties voordat u besluit PONSTEL (mefenaminezuur) te gebruiken. Gebruik de laagste effectieve dosis voor de kortste duur in overeenstemming met de individuele behandeldoelen van de patiënt (zie: WAARSCHUWINGEN ).
Na het observeren van de respons op de initiële therapie met PONSTEL (mefenaminezuur), moeten de dosis en frequentie worden aangepast aan de behoeften van een individuele patiënt.
Voor de verlichting van acute pijn bij volwassenen en adolescenten =14 jaar is de aanbevolen dosis 500 mg als startdosis gevolgd door 250 mg om de 6 uur indien nodig, gewoonlijk niet langer dan een week.4
Voor de behandeling van primaire dysmenorroe is de aanbevolen dosis 500 mg als startdosis, gevolgd door 250 mg om de 6 uur, oraal toegediend, te beginnen met het begin van bloedingen en bijbehorende symptomen. Klinische onderzoeken geven aan dat een effectieve behandeling kan worden gestart bij het begin van de menstruatie en niet langer dan 2 tot 3 dagen nodig zou moeten zijn.5
HOE GELEVERD
Ponstel (mefenaminezuur) is verkrijgbaar als 250 mg blauwgestreepte, ivoorkleurige capsules, bedrukt met "FHPC 400" en "PONSTEL® (mefenaminezuur)".
BIJWERKINGEN
Bij patiënten die Ponstel (mefenaminezuur) of andere NSAID's gebruiken, zijn de meest gemelde bijwerkingen die optreden bij ongeveer 1-10% van de patiënten:
Gastro-intestinale ervaringen, waaronder - buikpijn, obstipatie, diarree, dyspepsie, winderigheid, grove bloeding/perforatie, brandend maagzuur, misselijkheid, maagdarmzweren (maag/twaalfvingerige darm), braken, abnormale nierfunctie, bloedarmoede, duizeligheid, oedeem, verhoogde leverenzymen, hoofdpijn, verhoogde bloedingstijd, pruritus, huiduitslag, tinnitus
Aanvullende bijwerkingen die af en toe worden gemeld en hier per lichaamssysteem worden vermeld, zijn onder meer:
Lichaam als geheel - koorts, infectie, sepsis
Cardiovasculair systeem - congestief hartfalen, hypertensie, tachycardie, syncope
Spijsverteringsstelsel - droge mond, oesofagitis, maag-/maagzweren, gastritis, gastro-intestinale bloeding, glossitis, hematemesis, hepatitis, geelzucht
Hemic en lymfatisch systeem - ecchymose, eosinofilie, leukopenie, melena, purpura, rectale bloeding, stomatitis, trombocytopenie
Metabolisch en nutritioneel - gewichtsveranderingen
Zenuwstelsel angst, asthenie, verwardheid, depressie, droomafwijkingen, slaperigheid; slapeloosheid, malaise, nervositeit, paresthesie, slaperigheid, tremoren, duizeligheid
Ademhalingssysteem - astma, dyspnoe
Huid en aanhangsels - alopecia, lichtgevoeligheid, pruritus, zweet
Speciale zintuigen - wazig zicht
Urogenitaal systeem - cystitis, dysurie, hematurie, interstitiële nefritis, oligurie/polyurie, proteïnurie, nierfalen
Andere bijwerkingen die zelden voorkomen zijn:
Lichaam als geheel - anafylactoïde reacties, veranderingen in eetlust, overlijden
Cardiovasculair systeem - aritmie, hypotensie, myocardinfarct, hartkloppingen, vasculitis
Spijsverteringsstelsel - oprispingen, leverfalen, pancreatitis
Hemic en lymfatisch systeem - agranulocytose, hemolytische anemie, aplastische anemie, lymfadenopathie, pancytopenie
Metabolisch en nutritioneel - hyperglykemie
Zenuwstelsel - convulsies, coma, hallucinaties, meningitis.
Ademhaling ademhalingsdepressie, longontsteking
Huid en aanhangsels - angio-oedeem, toxische epidermale necrose, erythema multiforme, exfoliatieve dermatitis, Stevens-Johnson-syndroom, urticaria
Speciale zintuigen - conjunctivitis, slechthorendheid
DRUG-INTERACTIES
Een aantal verbindingen zijn remmers van CYP2C9. Onderzoek naar geneesmiddelinteracties van mefenaminezuur en deze verbindingen zijn niet uitgevoerd. De mogelijkheid van veranderde veiligheid en werkzaamheid moet worden overwogen wanneer Ponstel (mefenaminezuur) gelijktijdig met deze geneesmiddelen wordt gebruikt.
ACE-remmers
Rapporten suggereren dat NSAID's het antihypertensieve effect van ACE-remmers kunnen verminderen. Met deze interactie moet rekening worden gehouden bij patiënten die NSAID's gelijktijdig met ACE-remmers gebruiken.
Aspirine
Wanneer PONSTEL (mefenaminezuur) wordt toegediend met aspirine, is de eiwitbinding verminderd, hoewel de klaring van vrij PONSTEL (mefenaminezuur) niet verandert. De klinische betekenis van deze interactie is niet bekend; echter, net als bij andere NSAID's, wordt gelijktijdige toediening van MEFENAMIC ACID en aspirine over het algemeen niet aanbevolen vanwege het potentieel van verhoogde bijwerkingen.
diuretica
Klinische onderzoeken, evenals observaties na het in de handel brengen, hebben aangetoond dat PONSTEL (mefenaminezuur) het natriuretische effect van furosemide en thiaziden bij sommige patiënten kan verminderen. Deze reactie is toegeschreven aan remming van de renale prostaglandinesynthese. Tijdens gelijktijdige behandeling met NSAID's moet de patiënt nauwlettend worden geobserveerd op tekenen van nierfalen (zie: VOORZORGSMAATREGELEN, effecten op de nieren ), en om de diuretische werkzaamheid te verzekeren.
Lithium
NSAID's hebben geleid tot een verhoging van de lithiumspiegels in het plasma en een verlaging van de renale lithiumklaring. De gemiddelde minimale lithiumconcentratie nam met 15% toe en de renale klaring nam met ongeveer 20% af. Deze effecten zijn toegeschreven aan remming van de renale prostaglandinesynthese door de NSAID. Dus, wanneer NSAID's en lithium gelijktijdig worden toegediend, moeten proefpersonen zorgvuldig worden geobserveerd op tekenen van lithiumtoxiciteit.
Methotrexaat
Van NSAID's is gemeld dat ze de accumulatie van methotrexaat in plakjes konijnennier competitief remmen. Dit kan erop wijzen dat ze de toxiciteit van methotrexaat zouden kunnen versterken. Voorzichtigheid is geboden wanneer NSAID's gelijktijdig met methotrexaat worden toegediend.
Warfarine
De effecten van warfarine en NSAID's op GI-bloedingen zijn synergetisch, zodat gebruikers van beide geneesmiddelen samen een hoger risico op ernstige GI-bloedingen hebben dan gebruikers van beide geneesmiddelen afzonderlijk.
Antacida
In een onderzoek met een enkele dosis (n=6) verhoogde inname van een antacidum dat 1,7 gram magnesiumhydroxide bevat met 500 mg mefenaminezuur de Cmax en AUC van mefenaminezuur met respectievelijk 125% en 36%.1
Geneesmiddel-/laboratoriumtestinteracties
Ponstel (mefenaminezuur) kan de protrombinetijd verlengen.4 Daarom is frequente controle van de protrombinetijd noodzakelijk wanneer het geneesmiddel wordt toegediend aan patiënten die orale anticoagulantia krijgen.
Een vals-positieve reactie voor urinegal, met behulp van de diazo-tablettest, kan het gevolg zijn na toediening van mefenaminezuur. Als biliurie wordt vermoed, moeten andere diagnostische procedures, zoals de Harrison-spottest, worden uitgevoerd.
REFERENTIES
4. Glazko AJ: Experimentele waarnemingen van flufenaminezuur, mefenaminezuur en meclofenaminezuur. Deel III. Metabole dispositie, in Fenamates in Medicine. A Symposium, Londen, 1966. Annals of Physical Medicine, Supplement, pp 23-36, 1967.
WAARSCHUWINGEN
Cardiovasculaire effecten
Cardiovasculaire trombotische gebeurtenissen
Klinische onderzoeken met verschillende COX-2-selectieve en niet-selectieve NSAID's met een duur tot drie jaar hebben een verhoogd risico aangetoond op ernstige cardiovasculaire (CV) trombotische voorvallen, myocardinfarct en beroerte, die fataal kunnen zijn. Alle NSAID's, zowel COX-2-selectief als niet-selectief, kunnen een vergelijkbaar risico hebben. Patiënten met bekende CV ziekte of risicofactoren voor CV ziekte lopen mogelijk een groter risico. Om het potentiële risico op een bijwerking van CV's bij patiënten die met een NSAID worden behandeld te minimaliseren, moet de laagst mogelijke effectieve dosis worden gebruikt voor de kortst mogelijke duur. Artsen en patiënten moeten alert blijven op de ontwikkeling van dergelijke gebeurtenissen, zelfs als er geen eerdere CV-symptomen zijn. Patiënten moeten worden geïnformeerd over de tekenen en/of symptomen van ernstige CV-gebeurtenissen en de stappen die moeten worden genomen als ze zich voordoen.
Er is geen consistent bewijs dat gelijktijdig gebruik van aspirine het verhoogde risico op ernstige CV trombotische voorvallen geassocieerd met NSAID-gebruik vermindert. Het gelijktijdig gebruik van aspirine en een NSAID verhoogt het risico op ernstige GI-gebeurtenissen (zie: GI WAARSCHUWINGEN ).
In twee grote, gecontroleerde, klinische onderzoeken met een COX-2-selectieve NSAID voor de behandeling van pijn in de eerste 10-14 dagen na CABG-chirurgie werd een verhoogde incidentie van myocardinfarct en beroerte gevonden (zie CONTRA-INDICATIES ).
Hypertensie
NSAID's, waaronder PONSTEL (mefenaminezuur), kunnen leiden tot het ontstaan van nieuwe hypertensie of verergering van reeds bestaande hypertensie, die beide kunnen bijdragen aan de verhoogde incidentie van CV-voorvallen. Patiënten die thiaziden of lisdiuretica gebruiken, kunnen een verminderde respons op deze therapieën hebben wanneer ze NSAID's gebruiken. NSAID's, waaronder PONSTEL (mefenaminezuur), moeten met voorzichtigheid worden gebruikt bij patiënten met hypertensie. De bloeddruk (BP) moet nauwlettend worden gecontroleerd tijdens de start van de behandeling met NSAID's en tijdens de behandeling.
Congestief hartfalen en oedeem
Vochtretentie en oedeem zijn waargenomen bij sommige patiënten die NSAID's gebruiken. PONSTEL (mefenaminezuur) moet met voorzichtigheid worden gebruikt bij patiënten met vochtretentie of hartfalen.
Gastro-intestinale effecten - Risico op ulceratie, bloeding en perforatie
NSAID's, waaronder PONSTEL (mefenaminezuur), kunnen ernstige gastro-intestinale (GI) bijwerkingen veroorzaken, waaronder ontsteking, bloeding, ulceratie en perforatie van de maag, dunne darm of dikke darm, die fataal kan zijn. Deze ernstige bijwerkingen kunnen op elk moment optreden, met of zonder waarschuwingssymptomen, bij patiënten die worden behandeld met NSAID's. Slechts één op de vijf patiënten, die een ernstige bijwerking van het bovenste deel van het maagdarmkanaal ontwikkelen bij behandeling met NSAID's, is symptomatisch. Zweren van het bovenste deel van het maagdarmkanaal, grove bloeding of perforatie veroorzaakt door NSAID's komen voor bij ongeveer 1% van de patiënten die gedurende 3-6 maanden worden behandeld en bij ongeveer 2-4% van de patiënten die gedurende een jaar worden behandeld. Deze trends zetten zich voort bij een langere gebruiksduur, waardoor de kans op het ontwikkelen van een ernstige gastro-intestinale gebeurtenis ergens in de loop van de therapie toeneemt. Zelfs kortdurende therapie is echter niet zonder risico.
NSAID's dienen met uiterste voorzichtigheid te worden voorgeschreven aan personen met een voorgeschiedenis van ulcusziekte of gastro-intestinale bloedingen. Patiënten met een voorgeschiedenis van ulcus pepticum en/of gastro-intestinale bloedingen die NSAID's gebruiken, hebben een meer dan 10-voudig verhoogd risico op het ontwikkelen van een gastro-intestinale bloeding in vergelijking met patiënten met geen van deze risicofactoren. Andere factoren die het risico op gastro-intestinale bloedingen verhogen bij patiënten die met NSAID's worden behandeld, zijn onder meer gelijktijdig gebruik van orale corticosteroïden of anticoagulantia, een langere behandeling met NSAID's, roken, alcoholgebruik, hogere leeftijd en een slechte algemene gezondheidstoestand. De meeste spontane meldingen van fatale GI-voorvallen zijn bij oudere of verzwakte patiënten en daarom moet bij de behandeling van deze populatie extra voorzichtigheid worden betracht.
Om het potentiële risico op een GI-bijwerking bij patiënten die met een NSAID worden behandeld, te minimaliseren, moet de laagste effectieve dosis voor de kortst mogelijke duur worden gebruikt. Patiënten en artsen moeten alert blijven op tekenen en symptomen van gastro-intestinale ulceratie en bloeding tijdens behandeling met NSAID's en onmiddellijk een aanvullende evaluatie en behandeling starten als een ernstige gastro-intestinale bijwerking wordt vermoed. Dit moet stopzetting van de NSAID omvatten totdat een ernstige GI-bijwerking is uitgesloten. Voor patiënten met een hoog risico moeten alternatieve therapieën zonder NSAID's worden overwogen.
Niereffecten
Langdurige toediening van NSAID's heeft geresulteerd in papillaire necrose van de nieren en ander nierletsel. Niertoxiciteit is ook waargenomen bij patiënten bij wie renale prostaglandines een compenserende rol spelen bij het in stand houden van de nierperfusie. Bij deze patiënten kan toediening van een niet-steroïde anti-inflammatoir geneesmiddel een dosisafhankelijke vermindering van de vorming van prostaglandine veroorzaken en, in tweede instantie, van de renale bloedstroom, wat een duidelijke nierdecompensatie kan veroorzaken. Patiënten met het grootste risico op deze reactie zijn patiënten met een verminderde nierfunctie, hartfalen, leverdisfunctie, patiënten die diuretica en ACE-remmers gebruiken en ouderen. Stopzetting van de NSAID-therapie wordt meestal gevolgd door herstel naar de toestand van voor de behandeling.
Gevorderde nierziekte
Er is geen informatie beschikbaar voor gecontroleerde onderzoeken met betrekking tot het gebruik van PONSTEL (mefenaminezuur) bij patiënten met gevorderde nierziekte. Daarom wordt behandeling met PONSTEL (mefenaminezuur) niet aanbevolen bij deze patiënten met gevorderde nierziekte (zie: CONTRA-INDICATIES ).
Anafylactoïde reacties
Net als bij andere NSAID's kunnen anafylactoïde reacties optreden bij patiënten zonder bekende eerdere blootstelling aan PONSTEL (mefenaminezuur). PONSTEL (mefenaminezuur) mag niet worden gegeven aan patiënten met de aspirine-triade. Dit symptoomcomplex komt meestal voor bij astmatische patiënten die rhinitis ervaren met of zonder neuspoliepen, of die ernstige, mogelijk fatale bronchospasmen vertonen na inname van aspirine of andere NSAID's (zie CONTRA-INDICATIES en VOORZORGSMAATREGELEN - Reeds bestaand astma ). Noodhulp moet worden gezocht in gevallen waarin een anafylactoïde reactie optreedt.
Huidreacties
NSAID's, waaronder PONSTEL (mefenaminezuur), kunnen ernstige huidbijwerkingen veroorzaken, zoals exfoliatieve dermatitis, Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), die fataal kan zijn. Deze ernstige gebeurtenissen kunnen zonder waarschuwing plaatsvinden. Patiënten moeten worden geïnformeerd over de tekenen en symptomen van ernstige huidverschijnselen en het gebruik van het geneesmiddel moet worden gestaakt bij het eerste optreden van huiduitslag of enig ander teken van overgevoeligheid.
Zwangerschap
In de late zwangerschap, net als bij andere NSAID's, moet PONSTEL (mefenaminezuur) worden vermeden omdat dit voortijdige sluiting van de ductus arteriosus kan veroorzaken.
PREVENTIEVE MAATREGELEN
Algemeen
Van PONSTEL (mefenaminezuur) kan niet worden verwacht dat het corticosteroïden vervangt of corticosteroïde-insufficiëntie behandelt. Abrupt staken van de behandeling met corticosteroïden kan leiden tot verergering van de ziekte. Patiënten die een langdurige behandeling met corticosteroïden ondergaan, dienen hun therapie langzaam af te bouwen als wordt besloten om te stoppen met corticosteroïden.
De farmacologische activiteit van PONSTEL (mefenaminezuur) bij het verminderen van koorts en ontsteking kan het nut van deze diagnostische symptomen bij het opsporen van complicaties van vermoedelijke niet-infectieuze, pijnlijke aandoeningen verminderen.
Levereffecten
Borderline-verhogingen van een of meer levertesten kunnen optreden bij maximaal 15% van de patiënten die NSAID's gebruiken, waaronder PONSTEL (mefenaminezuur). Deze laboratoriumafwijkingen kunnen toenemen, onveranderd blijven of van voorbijgaande aard zijn bij voortzetting van de therapie. Opmerkelijke verhogingen van ALAT of ASAT (ongeveer drie of meer keer de bovengrens van de normaalwaarde) zijn gemeld bij ongeveer 1% van de patiënten in klinische onderzoeken met NSAID's. Daarnaast zijn zeldzame gevallen gemeld van ernstige leverreacties, waaronder geelzucht en fatale fulminante hepatitis, levernecrose en leverfalen, waarvan sommige met fatale afloop.
Een patiënt met symptomen en / of tekenen die wijzen op leverdisfunctie, of bij wie een abnormale levertest is opgetreden, moet worden beoordeeld op tekenen van de ontwikkeling van een ernstigere leverreactie tijdens de behandeling met PONSTEL (mefenaminezuur). Als zich klinische tekenen en symptomen ontwikkelen die overeenkomen met een leverziekte, of als systemische manifestaties optreden (bijv. Eosinofilie, huiduitslag, enz.), Moet PONSTEL (mefenaminezuur) worden stopgezet.

Hematologische effecten
Bloedarmoede wordt soms gezien bij patiënten die NSAID's krijgen, waaronder PONSTEL (mefenaminezuur). Dit kan te wijten zijn aan vochtretentie, GI-bloedverlies of een onvolledig beschreven effect op erytropoëse. Patiënten die langdurig worden behandeld met NSAID's, waaronder PONSTEL (mefenaminezuur), moeten hun hemoglobine of hematocriet laten controleren als ze tekenen of symptomen van bloedarmoede vertonen. NSAID's remmen de bloedplaatjesaggregatie en het is aangetoond dat ze bij sommige patiënten de bloedingstijd verlengen. In tegenstelling tot aspirine is hun effect op de bloedplaatjesfunctie kwantitatief minder, van kortere duur en omkeerbaar. Patiënten die PONSTEL (mefenaminezuur) krijgen en die nadelig kunnen worden beïnvloed door veranderingen in de bloedplaatjesfunctie, zoals patiënten met stollingsstoornissen of patiënten die anticoagulantia krijgen, moeten zorgvuldig worden gecontroleerd.
Reeds bestaand astma
Patiënten met astma kunnen aspirinegevoelig astma hebben. Het gebruik van aspirine bij patiënten met aspirinegevoelig astma is in verband gebracht met ernstige bronchospasmen die fataal kunnen zijn. Aangezien kruisreactiviteit, waaronder bronchospasme, tussen aspirine en andere niet-steroïde anti-inflammatoire geneesmiddelen is gemeld bij dergelijke aspirinegevoelige patiënten, mag PONSTEL (mefenaminezuur) niet worden toegediend aan patiënten met deze vorm van aspirinegevoeligheid en moet met voorzichtigheid worden gebruikt bij patiënten met reeds bestaande astma.
Informatie voor patiënten
Patiënten moeten worden geïnformeerd over de volgende informatie voordat de behandeling met een NSAID wordt gestart en periodiek tijdens de lopende therapie. Patiënten moeten ook worden aangemoedigd om de NSAID te lezen Medicatiegids bij elk verstrekt recept.
Laboratorium testen
Omdat ernstige ulceraties en bloedingen van het maagdarmkanaal kunnen optreden zonder waarschuwingssymptomen, moeten artsen controleren op tekenen of symptomen van gastro-intestinale bloedingen. Patiënten die langdurig met NSAID's worden behandeld, moeten hun CBC en een chemieprofiel periodiek laten controleren. Als zich klinische tekenen en symptomen ontwikkelen die overeenkomen met een lever- of nierziekte, systemische manifestaties optreden (bijv. eosinofilie, huiduitslag, enz.) Of als abnormale levertesten aanhouden of verergeren, moet Ponstel (mefenaminezuur) worden stopgezet.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Reproductiestudies uitgevoerd bij ratten en konijnen hebben geen aanwijzingen voor ontwikkelingsafwijkingen aangetoond. Reproductiestudies bij dieren zijn echter niet altijd voorspellend voor de menselijke reactie. Er zijn geen adequate of goed gecontroleerde onderzoeken bij zwangere vrouwen. Postel mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Nietteratogene effecten
Vanwege de bekende effecten van niet-steroïde anti-inflammatoire geneesmiddelen op het cardiovasculaire systeem van de foetus (sluiting van de ductus arteriosus), moet het gebruik tijdens de zwangerschap (met name de late zwangerschap) worden vermeden.
Bevalling
In studies bij ratten met NSAID's, zoals met andere geneesmiddelen waarvan bekend is dat ze de prostaglandinesynthese remmen, trad een verhoogde incidentie van dystokie, vertraagde partus en verminderde overleving van de jongen op. De effecten van Ponstel (mefenaminezuur) op de bevalling en bevalling bij zwangere vrouwen zijn niet bekend.
Moeders die borstvoeding geven
Sporenhoeveelheden Ponstel (mefenaminezuur) kunnen aanwezig zijn in de moedermelk en worden overgedragen aan de zuigeling.7 Vanwege het potentieel voor ernstige bijwerkingen bij zuigelingen die borstvoeding geven van PONSTEL (mefenaminezuur), moet worden besloten of de borstvoeding moet worden gestaakt of om te stoppen met het medicijn, rekening houdend met het belang van het medicijn voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 14 jaar zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met Ponstel (mefenaminezuur) omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Zoals bij alle NSAID's is voorzichtigheid geboden bij de behandeling van ouderen (65 jaar en ouder).
Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren (zie KLINISCHE FARMACOLOGIE en ONGEWENSTE GEBEURTENISSEN).
REFERENTIES
7. Buchanan RA, et al. De uitscheiding van mefenaminezuur in de moedermelk. Curr Ther Res. 10:592, 1968.
OVERDOSERING
Symptomen na overdosering van acute NSAID's zijn meestal beperkt tot lethargie, slaperigheid, misselijkheid, braken en epigastrische pijn, die over het algemeen omkeerbaar zijn met ondersteunende zorg. Gastro-intestinale hypertensie, acuut nierfalen, ademhalingsdepressie en coma kunnen voorkomen, maar zijn zeldzaam. Anafylactoïde reacties zijn gemeld bij therapeutische inname van NSAID's en kunnen optreden na een overdosis.
Patiënten moeten worden behandeld met symptomatische en ondersteunende zorg na een overdosis NSAID's. Er zijn geen specifieke antidota. Emesis en/of actieve kool (60 tot 100 g bij volwassenen, 1 tot 2 g/kg bij kinderen) en/of osmotisch cathartisch middel kunnen geïndiceerd zijn bij patiënten die binnen 4 uur na inname symptomen vertonen of na een grote overdosis (5 tot 10 maal de gebruikelijke dosis). Geforceerde diurese, alkalisering van urine, hemodialyse of hemoperfusie zijn mogelijk niet nuttig vanwege de hoge eiwitbinding.
CONTRA-INDICATIES
PONSTEL (mefenaminezuur) is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor mefenaminezuur.
PONSTEL (mefenaminezuur) mag niet worden gegeven aan patiënten die astma, urticaria of allergische reacties hebben gehad na inname van aspirine of andere NSAID's. Bij dergelijke patiënten zijn ernstige, zelden fatale, anafylactische reacties op NSAID's gemeld (zie: WAARSCHUWINGEN - Anafylactoïde reacties en VOORZORGSMAATREGELEN - Reeds bestaand astma ).
PONSTEL (mefenaminezuur) is gecontra-indiceerd voor de behandeling van peri-operatieve pijn in de setting van coronaire bypass-transplantaat (CABG) -chirurgie (zie WAARSCHUWINGEN ).
Ponstel (mefenaminezuur) is gecontra-indiceerd bij patiënten met acute actieve ulceratie of chronische ontsteking van het bovenste of onderste maagdarmkanaal.
Ponstel (mefenaminezuur) mag niet worden gebruikt bij patiënten met een reeds bestaande nierziekte.
KLINISCHE FARMACOLOGIE
farmacodynamiek
Ponstel (mefenaminezuur) is een niet-steroïde anti-inflammatoir geneesmiddel (NSAID) dat ontstekingsremmende, analgetische en antipyretische activiteiten vertoont in diermodellen. Het werkingsmechanisme van Ponstel (mefenaminezuur) is, net als dat van andere NSAID's, niet volledig bekend, maar kan verband houden met remming van prostaglandinesynthetase.
Farmacokinetiek
Absorptie
Mefenaminezuur wordt snel geabsorbeerd na orale toediening. In twee onderzoeken met een enkelvoudige orale dosis van 500 mg was de gemiddelde mate van absorptie 30,5 mcg/uur/ml (17% CV).1,2 De biologische beschikbaarheid van de capsule ten opzichte van een IV-dosis of een orale oplossing is niet onderzocht.
Na een enkelvoudige orale dosis van 1 gram zijn gemiddelde piekplasmaspiegels van 10-20 mcg/ml3 gemeld. Piekplasmaspiegels worden bereikt in 2 tot 4 uur en de eliminatiehalfwaardetijd is ongeveer 2 uur. Na meerdere doses zijn de plasmaspiegels evenredig met de dosis zonder aanwijzingen voor accumulatie van het geneesmiddel. In een onderzoek met meerdere doses bij normale volwassen proefpersonen (n=6) die viermaal daags een dosis van 1 gram mefenaminezuur kregen, werden op de tweede dag van toediening steady-state-concentraties van 20 mcg/ml bereikt, consistent met de korte halfwaardetijd. leven.
Het effect van voedsel op de snelheid en mate van absorptie van mefenaminezuur is niet onderzocht. Het is aangetoond dat gelijktijdige inname van antacida die magnesiumhydroxide bevatten de snelheid en mate van absorptie van mefenaminezuur aanzienlijk verhoogt (zie VOORZORGSMAATREGELEN: DRUG-INTERACTIES ).1
Verdeling
Van mefenaminezuur is gemeld dat het voor meer dan 90% gebonden is aan albumine.9 De relatie tussen de ongebonden fractie en de geneesmiddelconcentratie is niet onderzocht. Het schijnbare distributievolume (Vzss/F) geschat na een orale dosis van 500 mg mefenaminezuur was 1,06 l/kg.2
Op basis van de fysische en chemische eigenschappen wordt verwacht dat Ponstel (mefenaminezuur) wordt uitgescheiden in de moedermelk.
Metabolisme
Mefenaminezuur wordt gemetaboliseerd door het cytochroom P450-enzym CYP2C9 tot 3-hydroxymethylmefenaminezuur (metaboliet I). Verdere oxidatie tot een 3-carboxymefenaminezuur (metaboliet II) kan optreden.10 De activiteit van deze metabolieten is niet onderzocht. De metabolieten kunnen glucuronidering ondergaan en mefenaminezuur wordt ook direct geglucuronideerd. Een piekplasmaspiegel van ongeveer 20 mcg/ml werd waargenomen na 3 uur voor de hydroxymetaboliet en zijn glucuronide (n=6) na een enkele dosis van 1 gram. Evenzo werd een piekplasmaspiegel van 8 mcg/ml waargenomen na 6-8 uur voor de carboxymetaboliet en zijn glucuronide.3
uitscheiding
Ongeveer tweeënvijftig procent van een dosis mefenaminezuur wordt voornamelijk in de urine uitgescheiden als glucuroniden van mefenaminezuur (6%), 3-hydroxymefenaminezuur (25%) en 3-carboxymefenaminezuur (21%). De fecale eliminatieroute is goed voor maximaal 20% van de dosis, voornamelijk in de vorm van ongeconjugeerd 3-carboxymefenaminezuur.3
De eliminatiehalfwaardetijd van mefenaminezuur is ongeveer twee uur. Halfwaardetijden van metabolieten I en II zijn niet precies gerapporteerd, maar lijken langer te zijn dan die van de moederverbinding.3 De metabolieten kunnen accumuleren bij patiënten met nier- of leverfalen. Het mefenaminezuurglucuronide kan onomkeerbaar binden aan plasma-eiwitten. Omdat zowel renale als leverexcretie significante eliminatieroutes zijn, kunnen dosisaanpassingen bij patiënten met nier- of leverdisfunctie noodzakelijk zijn. Ponstel (mefenaminezuur) mag niet worden toegediend aan patiënten met een reeds bestaande nierziekte of aan patiënten met een significant verminderde nierfunctie.
TABEL 1: Schattingen van farmacokinetische parameters voor mefenaminezuur
Speciale populaties
pediatrisch
Ponstel (mefenaminezuur) is niet voldoende onderzocht bij pediatrische patiënten jonger dan 14 jaar. Een onderzoek bij 17 te vroeg geboren baby's die 2 mg/kg kregen, gaf aan dat de halfwaardetijd ongeveer vijf keer zo lang was als bij volwassenen, wat overeenkomt met de lage activiteit van metabole enzymen bij pasgeboren baby's. De gemiddelde Cmax in dit onderzoek was 4 mcg/ml (bereik 2,9-6,1). De gemiddelde tijd tot maximale concentratie (Tmax) was 8 uur (bereik 2-18 uur).
Ras
Farmacokinetische verschillen als gevolg van ras zijn niet vastgesteld.
Leverinsufficiëntie
De farmacokinetiek van mefenaminezuur is niet onderzocht bij patiënten met leverdisfunctie. Aangezien levermetabolisme een significante route is voor de eliminatie van mefenaminezuur, kunnen patiënten met acute en chronische leverziekte verlaagde doses Ponstel (mefenaminezuur) nodig hebben in vergelijking met patiënten met een normale leverfunctie.
Nierinsufficiëntie
De farmacokinetiek van mefenaminezuur is niet onderzocht bij personen met nierinsufficiëntie. Aangezien mefenaminezuur, zijn metabolieten en conjugaten voornamelijk door de nieren worden uitgescheiden, bestaat de mogelijkheid dat mefenaminezuurmetabolieten zich ophopen. Ponstel (mefenaminezuur) mag niet worden toegediend aan patiënten met een reeds bestaande nierziekte of aan patiënten met een significant verminderde nierfunctie.
Klinische studies
In gecontroleerde, dubbelblinde, klinische onderzoeken werd Ponstel (mefenaminezuur) geëvalueerd voor de behandeling van primaire krampachtige dysmenorroe. De parameters die werden gebruikt bij het bepalen van de werkzaamheid omvatten pijnbeoordeling door zowel patiënt als onderzoeker; de noodzaak van gelijktijdige pijnstillende medicatie; en evaluatie van verandering in frequentie en ernst van symptomen die kenmerkend zijn voor krampachtige dysmenorroe. Patiënten kregen ofwel Ponstel (mefenaminezuur), 500 mg (2 capsules) als een aanvangsdosis van 250 mg om de 6 uur, of placebo bij het begin van bloeding of pijn, afhankelijk van wat het eerst begon. Na drie menstruatiecycli werden de patiënten voor nog eens drie cycli overgezet op de alternatieve behandeling. Ponstel (mefenaminezuur) was in alle parameters significant superieur aan placebo en beide behandelingen (geneesmiddel en placebo) werden even goed verdragen.
REFERENTIES
1. Neuvonen PJ, Kivisto KT: verbetering van de absorptie van geneesmiddelen door antacida. Een niet-herkende geneesmiddelinteractie. Clin Farmacokinet. 27:120-8, augustus 1994.
2. Tall AR, Mistilits SP: Studies over Ponstan (mefenaminezuur): I. Gastro-intestinaal bloedverlies; II. Absorptie en uitscheiding van een nieuwe formulering. J Int Med Res (VK). 1975, 3 (3) blz. 176-82.
3. Winder CV, Kaump DH, Glazko et al: Experimentele waarnemingen van flufenaminezuur, mefenaminezuur en meclofenaminezuur. AnnPhys Med (Eng), Suppl p7-49.1967.
9. Champion GD, Graham GG: Farmacokinetiek van niet-steroïde anti-inflammatoire middelen. Aust NZ J Med. 8 (Supp. 1): 94-100, juni 1978.
10. McGurk KA, Remmel RP, Hosagrahara VP, Tosh D, Burchell B: reactiviteit van mefenaminezuur 1-o-acylglucuronide met eiwitten in vitro en ex vivo. Geneesmiddel Metab Dispos. Augustus 1996, 24 (8) p842-9.
11. Ito K, Niida Y, Sato J et al: Farmacokinetiek van mefenaminezuur bij premature baby's met patente ductus arteriosus. Acta Pediatr JPN. 36 (4): 387-91, 1994.
PATIËNT INFORMATIE
Medicatiegids voor niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)
(Zie het einde van deze medicatiehandleiding voor een lijst met NSAID-geneesmiddelen op recept.)
Wat is de belangrijkste informatie die ik moet weten over geneesmiddelen die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd?
NSAID-geneesmiddelen kunnen de kans op een hartaanval of beroerte vergroten die tot de dood kan leiden. Deze kans neemt toe:
- bij langer gebruik van NSAID-geneesmiddelen
- bij mensen met een hartaandoening
NSAID-geneesmiddelen mogen nooit worden gebruikt vlak voor of na een hartoperatie die een 'coronaire bypass-transplantaat (CABG)' wordt genoemd.
NSAID-geneesmiddelen kunnen op elk moment tijdens de behandeling zweren en bloedingen in de maag en darmen veroorzaken.
Zweren en bloedingen:
- kan gebeuren zonder waarschuwingssymptomen
- kan de dood veroorzaken
De kans dat een persoon een maagzweer of bloeding krijgt, neemt toe met:
- geneesmiddelen gebruiken die "corticosteroïden" en "anticoagulantia" worden genoemd
- langer gebruik
- roken
- alcohol drinken
- oudere leeftijd
- een slechte gezondheid hebben
NSAID-geneesmiddelen mogen alleen worden gebruikt:
- precies zoals voorgeschreven
- in de laagst mogelijke dosis voor uw behandeling
- voor de kortst benodigde tijd
Wat zijn niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)?
NSAID-geneesmiddelen worden gebruikt voor de behandeling van pijn en roodheid, zwelling en hitte (ontsteking) door medische aandoeningen zoals:
- verschillende soorten artritis
- menstruatiekrampen en andere soorten kortdurende pijn
Wie mag geen niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) gebruiken?
Gebruik geen NSAID-medicijn:
- als u een astma-aanval, netelroos of een andere allergische reactie heeft gehad met aspirine of een ander NSAID-geneesmiddel
- voor pijn vlak voor of na een bypassoperatie aan het hart
Vertel uw zorgverlener:
- over al uw medische aandoeningen.
- over alle medicijnen die u gebruikt. NSAID's en sommige andere geneesmiddelen kunnen met elkaar interageren en ernstige bijwerkingen veroorzaken. Houd een lijst bij van uw geneesmiddelen die u aan uw zorgverlener en apotheker moet laten zien.
- als u zwanger bent. NSAID-geneesmiddelen mogen laat in de zwangerschap niet door zwangere vrouwen worden gebruikt.
- als u borstvoeding geeft. Praat met uw arts.
Wat zijn de mogelijke bijwerkingen van niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)?
Schakel onmiddellijk noodhulp in als u een van de volgende symptomen heeft:
- kortademigheid of moeite met ademhalen
- pijn op de borst
- zwakte in een deel of zijkant van uw lichaam
- onduidelijke spraak
- zwelling van het gezicht of de keel
Stop met uw NSAID-medicijn en bel onmiddellijk uw zorgverlener als u een van de volgende symptomen heeft:
Dit zijn niet alle bijwerkingen van NSAID-geneesmiddelen. Neem contact op met uw zorgverlener of apotheker voor meer informatie over NSAID-geneesmiddelen.
Overige informatie over niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)
- Aspirine is een NSAID-medicijn, maar het verhoogt de kans op een hartaanval niet. Aspirine kan bloedingen in de hersenen, maag en darmen veroorzaken. Aspirine kan ook zweren in de maag en darmen veroorzaken.
- Sommige van deze NSAID-geneesmiddelen worden zonder recept in lagere doseringen verkocht (zonder recept verkrijgbaar). Praat met uw zorgverlener voordat u vrij verkrijgbare NSAID's langer dan 10 dagen gebruikt.
NSAID-geneesmiddelen waarvoor een recept nodig is
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration. Ingangsdatum: 19/02/2008
