Fosamax 35mg, 70mg Alendronate Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Fosamax 70 mg en hoe wordt het gebruikt?
Fosamax 35 mg is een receptgeneesmiddel dat wordt gebruikt om bepaalde vormen van botverlies (osteoporose) bij volwassenen te voorkomen en te behandelen. Fosamax 70 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Fosamax is een modificator van het calciummetabolisme, bisfosfonaatderivaten.
Het is niet bekend of Fosamax veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Fosamax?
Fosamax kan ernstige bijwerkingen veroorzaken, waaronder:
- pijn op de borst
- nieuw of verergerend brandend maagzuur
- pijn of branderig gevoel onder de ribben of in de rug
- ernstig brandend maagzuur
- brandende pijn in de bovenbuik of bloed ophoesten
- nieuwe of ongebruikelijke pijn in uw dij of heup
- kaakpijn
- doof gevoel
- zwelling
- ernstige gewrichts-, bot- of spierpijn
- spierspasmen of krampen
- gevoelloosheid of tintelingen rond uw mond of in uw vingers of tenen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Fosamax zijn:
- maagzuur
- maagklachten
- buikpijn
- misselijkheid
- diarree
- constipatie
- bot pijn
- spierpijn
- gewrichtspijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Fosamax. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
FOSAMAX (alendronaatnatrium) is een bisfosfonaat dat werkt als een specifieke remmer van door osteoclast gemedieerde botresorptie. Bisfosfonaten zijn synthetische analogen van pyrofosfaat die binden aan het hydroxyapatiet dat in bot wordt aangetroffen.
Alendronaatnatrium wordt chemisch beschreven als (4-amino-1-hydroxybutylideen) bisfosfonzuurmononatriumzouttrihydraat.
De empirische formule van natriumalendronaat is C4H12NNaO7P2 •3H2O en het formulegewicht is 325,12. De structuurformule is:
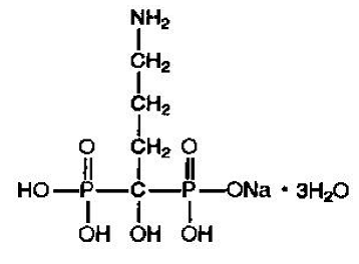
Alendronaatnatrium is een wit, kristallijn, niet-hygroscopisch poeder. Het is oplosbaar in water, zeer slecht oplosbaar in alcohol en praktisch onoplosbaar in chloroform.
FOSAMAX 70 mg tabletten voor orale toediening bevatten 91,37 mg alendronaat mononatriumzouttrihydraat, wat het molaire equivalent is van 70 mg vrij zuur, en de volgende inactieve ingrediënten: microkristallijne cellulose, watervrije lactose, croscarmellosenatrium en magnesiumstearaat.
INDICATIES
Treatment® van osteoporose bij postmenopauzale vrouwen
FOSAMAX is geïndiceerd voor de behandeling van osteoporose bij postmenopauzale vrouwen. Bij postmenopauzale vrouwen verhoogt FOSAMAX 70 mg de botmassa en vermindert het de incidentie van fracturen, waaronder die van de heup en de wervelkolom (wervelcompressiefracturen). [Zien Klinische studies ]
Preventie van osteoporose bij postmenopauzale vrouwen
FOSAMAX 70 mg is geïndiceerd voor de preventie van postmenopauzale osteoporose [zie: Klinische studies ].
Behandeling om de botmassa te vergroten bij mannen met osteoporose
FOSAMAX is geïndiceerd voor behandeling om de botmassa te verhogen bij mannen met osteoporose [zie: Klinische studies ].
Behandeling van door glucocorticoïden geïnduceerde osteoporose
FOSAMAX is geïndiceerd voor de behandeling van door glucocorticoïden geïnduceerde osteoporose bij mannen en vrouwen die glucocorticoïden krijgen in een dagelijkse dosering gelijk aan 7,5 mg of meer prednison en die een lage botmineraaldichtheid hebben [zie Klinische studies ].
Behandeling van de botziekte van Paget
FOSAMAX 35 mg is geïndiceerd voor de behandeling van de botziekte van Paget bij mannen en vrouwen. Behandeling is geïndiceerd bij patiënten met de botziekte van Paget die alkalische fosfatase hebben die ten minste twee keer de bovengrens van normaal is, of bij patiënten die symptomatisch zijn, of bij patiënten die risico lopen op toekomstige complicaties door hun ziekte. [Zien Klinische studies ]
Belangrijke gebruiksbeperkingen
De optimale gebruiksduur is niet vastgesteld. De veiligheid en werkzaamheid van FOSAMAX voor de behandeling van osteoporose zijn gebaseerd op klinische gegevens van vier jaar. Bij alle patiënten die een behandeling met bisfosfonaten ondergaan, moet de noodzaak van voortzetting van de therapie periodiek opnieuw worden geëvalueerd. Bij patiënten met een laag risico op fracturen moet worden overwogen om het geneesmiddel na 3 tot 5 jaar gebruik te staken. Bij patiënten die de behandeling stopzetten, moet het risico op fracturen periodiek opnieuw worden geëvalueerd.
DOSERING EN ADMINISTRATIE
Hoewel alendronaattabletten 5 mg, 10 mg, 35 mg en 40 mg op de markt verkrijgbaar zijn, wordt FOSAMAX 35 mg niet langer op de markt gebracht in de sterkten 5 mg, 10 mg, 35 mg en 40 mg.
Hoewel er mogelijk een orale oplossing van alendronaat op de markt verkrijgbaar is, wordt FOSAMAX 35 mg drank niet langer op de markt gebracht.
Behandeling van osteoporose bij postmenopauzale vrouwen
De aanbevolen dosering is:
- één tablet van 70 mg eenmaal per week of
- één fles van 70 mg drank eenmaal per weekof
- eenmaal daags één tablet van 10 mg
Preventie van osteoporose bij postmenopauzale vrouwen
De aanbevolen dosering is:
- één tablet van 35 mg eenmaal per week of
- eenmaal daags één tablet van 5 mg
Behandeling om de botmassa te vergroten bij mannen met osteoporose
De aanbevolen dosering is:
- één tablet van 70 mg eenmaal per week of
- één fles van 70 mg drank eenmaal per weekof
- eenmaal daags één tablet van 10 mg
Behandeling van door glucocorticoïden geïnduceerde osteoporose
De aanbevolen dosering is eenmaal daags één tablet van 5 mg, behalve voor postmenopauzale vrouwen die geen oestrogeen krijgen, voor wie de aanbevolen dosering één tablet van 10 mg eenmaal daags is.
Behandeling van de botziekte van Paget
Het aanbevolen behandelingsschema is 40 mg eenmaal daags gedurende zes maanden.
Herbehandeling van de ziekte van Paget
Herbehandeling met FOSAMAX 35 mg kan worden overwogen, na een evaluatieperiode van zes maanden na de behandeling bij patiënten met een recidief, op basis van verhogingen van serumalkalinefosfatase, die periodiek moeten worden gemeten. Herbehandeling kan ook worden overwogen bij diegenen die hun serum alkalische fosfatase niet hebben genormaliseerd.
Belangrijke administratie-instructies
Instrueer patiënten om het volgende te doen:
- Neem FOSAMAX ten minste een half uur voor het eerste eten, drinken of medicijn van de dag alleen met gewoon water in [zie Informatie over patiëntbegeleiding ]. Andere dranken (inclusief mineraalwater), voedsel en sommige medicijnen zullen waarschijnlijk de absorptie van FOSAMAX verminderen [zie: DRUG-INTERACTIES ]. Als u minder dan 30 minuten wacht of FOSAMAX 70 mg inneemt met voedsel, dranken (anders dan gewoon water) of andere medicijnen, zal het effect van FOSAMAX 70 mg verminderen door de opname in het lichaam te verminderen.
- Neem FOSAMAX bij het opstaan voor de dag. Om de levering aan de maag te vergemakkelijken en zo de kans op slokdarmirritatie te verminderen, moet een FOSAMAX 35 mg tablet worden doorgeslikt met een vol glas water (6-8 ounces). Om de maaglediging te vergemakkelijken, moet FOSAMAX 70 mg drank worden gevolgd door ten minste 2 ounce (een kwart kopje) water. Patiënten mogen niet gaan liggen gedurende ten minste 30 minuten en tot na hun eerste voedsel van de dag. FOSAMAX mag niet voor het slapengaan of voor het opstaan voor de dag worden ingenomen. Het niet opvolgen van deze instructies kan het risico op bijwerkingen van de slokdarm vergroten [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Informatie over patiëntbegeleiding ].
Aanbevelingen voor calcium- en vitamine D-suppletie
Instrueer patiënten om extra calcium in te nemen als de inname via de voeding onvoldoende is [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Patiënten met een verhoogd risico op vitamine D-insufficiëntie (bijvoorbeeld ouder dan 70 jaar, verpleeghuisgebonden of chronisch ziek) kunnen vitamine D-suppletie nodig hebben. Patiënten met gastro-intestinale malabsorptiesyndromen kunnen hogere doses vitamine D-suppletie nodig hebben en meting van 25-hydroxyvitamine D moet worden overwogen.
Patiënten die met glucocorticoïden worden behandeld, moeten voldoende calcium en vitamine D krijgen.
Toedieningsinstructies voor gemiste doses
Als een eenmaal-wekelijkse dosis FOSAMAX wordt gemist, instrueer de patiënten dan om één dosis in te nemen op de ochtend nadat ze het zich hebben herinnerd. Ze mogen geen twee doses op dezelfde dag innemen, maar moeten terugkeren naar eenmaal per week één dosis, zoals oorspronkelijk gepland op de door hen gekozen dag.
HOE GELEVERD
Doseringsvormen en sterke punten
- 70 mg tabletten zijn witte, ovale, niet-omhulde tabletten met aan de ene kant code 31 en aan de andere kant een afbeelding van een bot.
Opslag en behandeling
3814 - FOSAMAX-tabletten, 70 mg, zijn witte, ovale, niet-omhulde tabletten met aan de ene kant code 31 en aan de andere kant een afbeelding van een bot:
NDC 0006-0031-44 eenheidsblisterverpakking van 4.
Opslag
FOSAMAX-tabletten
Bewaren in een goed gesloten container bij kamertemperatuur, 15-30 ° C (59-86 ° F).
Gedistribueerd door: Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO., INC., Whitehouse Station, NJ 08889, VS. Herzien: aug. 2019
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Behandeling van osteoporose bij postmenopauzale vrouwen
Dagelijkse dosering
De veiligheid van FOSAMAX 35 mg bij de behandeling van postmenopauzale osteoporose werd beoordeeld in vier klinische onderzoeken waaraan 7453 vrouwen in de leeftijd van 44-84 jaar deelnamen. Studie 1 en Studie 2 waren identiek ontworpen, driejarige, placebogecontroleerde, dubbelblinde, multicenter studies (Verenigde Staten en Multinational n=994); Onderzoek 3 was het driejarige wervelfractuurcohort van de Fracture Intervention Trial [FIT] (n=2027) en onderzoek 4 was het vierjarige klinische fractuurcohort van FIT (n=4432). In totaal werden 3620 patiënten blootgesteld aan placebo en 3432 patiënten aan FOSAMAX. Patiënten met een reeds bestaande gastro-intestinale aandoening en gelijktijdig gebruik van niet-steroïde anti-inflammatoire geneesmiddelen werden in deze klinische onderzoeken opgenomen. In onderzoek 1 en onderzoek 2 kregen alle vrouwen 500 mg elementair calcium als carbonaat. In onderzoek 3 en onderzoek 4 kregen alle vrouwen met een calciuminname van minder dan 1000 mg per dag 500 mg calcium en 250 internationale eenheden vitamine D per dag.
Van de patiënten die werden behandeld met alendronaat 10 mg of placebo in onderzoek 1 en onderzoek 2, en alle patiënten in onderzoek 3 en onderzoek 4, was de incidentie van mortaliteit door alle oorzaken 1,8% in de placebogroep en 1,8% in de FOSAMAX 35 mg-groep. De incidentie van ernstige bijwerkingen was 30,7% in de placebogroep en 30,9% in de FOSAMAX-groep. Het percentage patiënten dat stopte met het onderzoek vanwege een klinische bijwerking was 9,5% in de placebogroep en 8,9% in de FOSAMAX 70 mg-groep. Bijwerkingen van deze onderzoeken die door de onderzoekers als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden beschouwd bij meer dan of gelijk aan 1% van de patiënten die werden behandeld met FOSAMAX 35 mg of placebo, worden weergegeven in Tabel 1.
Er zijn huiduitslag en erytheem opgetreden.
Gastro-intestinale bijwerkingen
Eén patiënt die werd behandeld met FOSAMAX (10 mg/dag), die een voorgeschiedenis had van ulcus pepticum en gastrectomie en die gelijktijdig aspirine gebruikte, ontwikkelde een anastomotische zweer met een lichte bloeding, die als geneesmiddelgerelateerd werd beschouwd. Aspirine en FOSAMAX werden stopgezet en de patiënt herstelde. In de populaties van onderzoek 1 en onderzoek 2 had 49-54% een voorgeschiedenis van gastro-intestinale aandoeningen bij aanvang en gebruikte 54-89% op enig moment tijdens de onderzoeken niet-steroïde anti-inflammatoire geneesmiddelen of aspirine. [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Laboratoriumtestresultaten
In dubbelblinde, multicenter, gecontroleerde onderzoeken werden asymptomatische, milde en voorbijgaande verlagingen van serumcalcium en -fosfaat waargenomen bij respectievelijk ongeveer 18% en 10% van de patiënten die FOSAMAX gebruikten versus ongeveer 12% en 3% van degenen die placebo gebruikten. De incidenties van verlagingen van serumcalcium tot minder dan 8,0 mg/dL (2,0 mM) en serumfosfaat tot minder dan of gelijk aan 2,0 mg/dL (0,65 mM) waren echter vergelijkbaar in beide behandelingsgroepen.
Wekelijkse dosering
De veiligheid van FOSAMAX 70 mg eenmaal per week voor de behandeling van postmenopauzale osteoporose werd beoordeeld in een eenjarig, dubbelblind, multicenter onderzoek waarin FOSAMAX 70 mg eenmaal per week en FOSAMAX 10 mg per dag werd vergeleken. De algemene veiligheids- en verdraagbaarheidsprofielen van eenmaal per week FOSAMAX 70 mg en FOSAMAX 10 mg per dag waren vergelijkbaar. De bijwerkingen die door de onderzoekers als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden beschouwd bij meer dan of gelijk aan 1% van de patiënten in beide behandelingsgroepen worden weergegeven in Tabel 2.
Preventie van osteoporose bij postmenopauzale vrouwen
Dagelijkse dosering
De veiligheid van FOSAMAX 5 mg/dag bij postmenopauzale vrouwen in de leeftijd van 40-60 jaar is geëvalueerd in drie dubbelblinde, placebogecontroleerde onderzoeken met meer dan 1400 patiënten die gerandomiseerd waren om FOSAMAX gedurende twee of drie jaar te krijgen. In deze onderzoeken waren de algemene veiligheidsprofielen van FOSAMAX 5 mg/dag en placebo vergelijkbaar. Stopzetting van de behandeling vanwege een klinische bijwerking trad op bij 7,5% van de 642 patiënten die werden behandeld met FOSAMAX 5 mg/dag en bij 5,7% van de 648 patiënten die werden behandeld met placebo.
Wekelijkse dosering
De veiligheid van FOSAMAX 35 mg eenmaal per week in vergelijking met FOSAMAX 5 mg per dag werd geëvalueerd in een eenjarig, dubbelblind, multicenter onderzoek onder 723 patiënten. De algemene veiligheids- en verdraagbaarheidsprofielen van eenmaal per week FOSAMAX 35 mg en FOSAMAX 5 mg per dag waren vergelijkbaar.
De bijwerkingen van deze onderzoeken die door de onderzoekers als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden beschouwd bij meer dan of gelijk aan 1% van de patiënten die werden behandeld met FOSAMAX 35 mg eenmaal per week, FOSAMAX 5 mg/dag of placebo, worden weergegeven in Tabel 3. .
Gelijktijdig gebruik met oestrogeen/hormoonvervangende therapie
In twee onderzoeken (van één en twee jaar) bij postmenopauzale osteoporotische vrouwen (totaal: n=853) werd het veiligheids- en verdraagbaarheidsprofiel van gecombineerde behandeling met FOSAMAX 10 mg eenmaal daags en oestrogeen ± progestageen (n=354) consistent met die van de individuele behandelingen.
Osteoporose bij mannen
In twee placebogecontroleerde, dubbelblinde, multicenter onderzoeken bij mannen (een twee jaar durend onderzoek met FOSAMAX 10 mg/dag en een één jaar durend onderzoek met FOSAMAX 70 mg eenmaal per week) waren de percentages van stopzetting van de behandeling vanwege klinische bijwerkingen voorvallen waren 2,7% voor FOSAMAX 10 mg/dag versus 10,5% voor placebo en 6,4% voor FOSAMAX 70 mg eenmaal per dag versus 8,6% voor placebo. De bijwerkingen die door de onderzoekers als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden beschouwd bij meer dan of gelijk aan 2% van de patiënten die werden behandeld met FOSAMAX 70 mg of placebo, worden weergegeven in Tabel 4.
Door glucocorticoïden geïnduceerde osteoporose
In twee, een jaar durende, placebogecontroleerde, dubbelblinde, multicenter onderzoeken bij patiënten die een behandeling met glucocorticoïden kregen, waren de algemene veiligheids- en verdraagbaarheidsprofielen van FOSAMAX 5 en 10 mg/dag over het algemeen vergelijkbaar met die van placebo. De bijwerkingen die door de onderzoekers als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd werden beschouwd bij meer dan of gelijk aan 1% van de patiënten die werden behandeld met FOSAMAX 5 of 10 mg/dag of placebo, worden weergegeven in Tabel 5.
Het algemene veiligheids- en verdraagbaarheidsprofiel bij de populatie van door glucocorticoïden geïnduceerde osteoporose die de behandeling voortzette gedurende het tweede jaar van de onderzoeken (FOSAMAX: n=147) was consistent met het profiel dat werd waargenomen in het eerste jaar.
De botziekte van Paget
In klinische onderzoeken (osteoporose en de ziekte van Paget) waren de bijwerkingen die werden gemeld bij 175 patiënten die FOSAMAX 40 mg/dag gebruikten gedurende 3-12 maanden vergelijkbaar met die bij postmenopauzale vrouwen die werden behandeld met FOSAMAX 10 mg/dag. Er was echter een duidelijk verhoogde incidentie van bijwerkingen van het bovenste deel van het maagdarmkanaal bij patiënten die FOSAMAX 40 mg/dag gebruikten (17,7% FOSAMAX versus 10,2% placebo). Eén geval van oesofagitis en twee gevallen van gastritis leidden tot stopzetting van de behandeling.
Bovendien werd musculoskeletale (bot-, spier- of gewrichts)pijn, die is beschreven bij patiënten met de ziekte van Paget die met andere bisfosfonaten werden behandeld, door de onderzoekers bij ongeveer 6% van de patiënten als mogelijk, waarschijnlijk of zeker geneesmiddelgerelateerd beschouwd. behandeld met FOSAMAX 40 mg/dag versus ongeveer 1% van de met placebo behandelde patiënten, maar leidde zelden tot stopzetting van de therapie. Stopzetting van de behandeling vanwege klinische bijwerkingen trad op bij 6,4% van de patiënten met de ziekte van Paget die werden behandeld met FOSAMAX 40 mg/dag en bij 2,4% van de patiënten die werden behandeld met placebo.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van FOSAMAX na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: overgevoeligheidsreacties waaronder urticaria en angio-oedeem. Voorbijgaande symptomen van myalgie, malaise, asthenie en koorts zijn gemeld met FOSAMAX, meestal in verband met het starten van de behandeling. Symptomatische hypocalciëmie is opgetreden, meestal in verband met predisponerende aandoeningen. Perifeer oedeem.
Gastro-intestinaal: oesofagitis, oesofageale erosies, slokdarmzweren, slokdarmvernauwing of -perforatie en orofaryngeale ulceratie. Maag- of darmzweren, sommige ernstig en met complicaties, zijn ook gemeld [zie DOSERING EN ADMINISTRATIE ; WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gelokaliseerde osteonecrose van de kaak, in het algemeen geassocieerd met tandextractie en/of lokale infectie met vertraagde genezing, is gemeld [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Musculoskeletaal: bot-, gewrichts- en/of spierpijn, soms ernstig en invaliderend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]; zwelling van de gewrichten; lage-energetische femurschacht en subtrochantere fracturen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zenuwstelsel: duizeligheid en duizeligheid.
pulmonaal: acute astma-exacerbaties.
Huid: huiduitslag (soms met lichtgevoeligheid), pruritus, alopecia, ernstige huidreacties, waaronder Stevens-Johnson-syndroom en toxische epidermale necrolyse.
Speciale zintuigen: uveïtis, scleritis of episcleritis. Cholesteatoom van de uitwendige gehoorgang (focale osteonecrose).
DRUG-INTERACTIES
Calciumsupplementen/antacida
Gelijktijdige toediening van FOSAMAX en calcium, antacida of orale medicatie die multivalente kationen bevat, zal de absorptie van FOSAMAX verstoren. Instrueer patiënten daarom om ten minste een half uur te wachten na inname van FOSAMAX 35 mg voordat ze andere orale medicatie nemen.
Aspirine
In klinische onderzoeken was de incidentie van bijwerkingen van het bovenste deel van het maagdarmkanaal verhoogd bij patiënten die gelijktijdig werden behandeld met dagelijkse doses FOSAMAX 35 mg hoger dan 10 mg en aspirine-bevattende producten.
Steroïdeloze ontstekingsremmers
FOSAMAX 35 mg kan worden toegediend aan patiënten die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) gebruiken. In een 3 jaar durende, gecontroleerde, klinische studie (n=2027) waarin een meerderheid van de patiënten gelijktijdig NSAID's kreeg, was de incidentie van bijwerkingen van het bovenste deel van het maagdarmkanaal vergelijkbaar bij patiënten die FOSAMAX 5 of 10 mg/dag gebruikten in vergelijking met degenen die placebo gebruikten. Aangezien het gebruik van NSAID's echter gepaard gaat met gastro-intestinale irritatie, is voorzichtigheid geboden bij gelijktijdig gebruik met FOSAMAX.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Bovenste gastro-intestinale bijwerkingen
FOSAMAX 35 mg kan, net als andere oraal toegediende bisfosfonaten, lokale irritatie van het slijmvlies van het bovenste deel van het maagdarmkanaal veroorzaken. Vanwege deze mogelijke irriterende effecten en een potentieel voor verergering van de onderliggende ziekte, is voorzichtigheid geboden wanneer FOSAMAX wordt gegeven aan patiënten met actieve problemen met het bovenste deel van het maagdarmkanaal (zoals bekende Barrett's-slokdarm, dysfagie, andere slokdarmaandoeningen, gastritis, duodenitis of zweren).
Bijwerkingen van de slokdarm, zoals oesofagitis, oesofageale ulcera en oesofageale erosies, soms met bloeding en zelden gevolgd door oesofageale strictuur of perforatie, zijn gemeld bij patiënten die werden behandeld met orale bisfosfonaten, waaronder FOSAMAX. In sommige gevallen waren deze ernstig en moesten ze in het ziekenhuis worden opgenomen. Artsen moeten daarom alert zijn op tekenen of symptomen die wijzen op een mogelijke slokdarmreactie en patiënten moeten worden geïnstrueerd om te stoppen met FOSAMAX 70 mg en medische hulp in te roepen als ze dysfagie, odynofagie, retrosternale pijn of nieuw of verergerend brandend maagzuur ontwikkelen.
Het risico op ernstige oesofageale bijwerkingen lijkt groter te zijn bij patiënten die gaan liggen na inname van orale bisfosfonaten, waaronder 70 mg FOSAMAX en/of die orale bisfosfonaten, waaronder FOSAMAX 35 mg, niet doorslikken met het aanbevolen volle glas (6-8 ounce) water, en /of die orale bisfosfonaten inclusief FOSAMAX 70 mg blijven gebruiken nadat symptomen zijn ontstaan die wijzen op slokdarmirritatie. Daarom is het erg belangrijk dat de volledige doseringsinstructies worden verstrekt aan en begrepen worden door de patiënt [zie DOSERING EN ADMINISTRATIE ]. Bij patiënten die zich vanwege een mentale handicap niet aan de doseringsinstructies kunnen houden, dient de behandeling met FOSAMAX onder passend toezicht te worden toegepast.
Er zijn post-marketing meldingen geweest van maag- en darmzweren bij gebruik van orale bisfosfonaten, sommige ernstig en met complicaties, hoewel er geen verhoogd risico werd waargenomen in gecontroleerde klinische onderzoeken [zie ONGEWENSTE REACTIES ].
Mineraal metabolisme
Hypocalciëmie moet worden gecorrigeerd voordat de behandeling met FOSAMAX wordt gestart [zie: CONTRA-INDICATIES ]. Andere aandoeningen die het mineraalmetabolisme beïnvloeden (zoals vitamine D-tekort) moeten ook effectief worden behandeld. Bij patiënten met deze aandoeningen moeten serumcalcium en symptomen van hypocalciëmie worden gecontroleerd tijdens de behandeling met FOSAMAX.
Vermoedelijk als gevolg van de effecten van FOSAMAX op het verhogen van het botmineraal, kunnen kleine, asymptomatische dalingen van serumcalcium en fosfaat optreden, vooral bij patiënten met de ziekte van Paget, bij wie de snelheid van botturnover vóór de behandeling sterk verhoogd kan zijn, en bij patiënten die glucocorticoïden krijgen, bij wie de calciumabsorptie verminderd kan zijn.
Zorgen voor voldoende calcium- en vitamine D-inname is vooral belangrijk bij patiënten met de botziekte van Paget en bij patiënten die glucocorticoïden krijgen.
Musculoskeletale pijn
Tijdens postmarketingervaring is ernstige en soms invaliderende bot-, gewrichts- en/of spierpijn gemeld bij patiënten die bisfosfonaten gebruikten die zijn goedgekeurd voor de preventie en behandeling van osteoporose [zie ONGEWENSTE REACTIES ]. Deze categorie geneesmiddelen omvat FOSAMAX (alendronaat). De meeste patiënten waren postmenopauzale vrouwen. De tijd tot het begin van de symptomen varieerde van één dag tot enkele maanden na het starten van het medicijn. Beëindig het gebruik als zich ernstige symptomen ontwikkelen. De meeste patiënten hadden verlichting van de symptomen na het stoppen. Een subgroep had terugkerende symptomen bij hernieuwde behandeling met hetzelfde medicijn of een ander bisfosfonaat.
In placebogecontroleerde klinische onderzoeken met FOSAMAX waren de percentages patiënten met deze symptomen vergelijkbaar in de FOSAMAX 35 mg- en placebogroep.
Osteonecrose van de kaak
Osteonecrose van de kaak (ONJ), die spontaan kan optreden, wordt over het algemeen geassocieerd met tandextractie en/of lokale infectie met vertraagde genezing, en is gemeld bij patiënten die bisfosfonaten gebruiken, waaronder FOSAMAX. Bekende risicofactoren voor osteonecrose van de kaak zijn onder meer invasieve tandheelkundige ingrepen (bijv. tandextractie, tandheelkundige implantaten, botchirurgie), diagnose van kanker, gelijktijdige therapieën (bijv. chemotherapie, corticosteroïden, angiogeneseremmers), slechte mondhygiëne en comorbiditeit aandoeningen (bijv. parodontale en/of andere reeds bestaande tandheelkundige aandoeningen, bloedarmoede, coagulopathie, infectie, slecht passend kunstgebit). Het risico op ONJ kan toenemen met de duur van de blootstelling aan bisfosfonaten.
Voor patiënten die invasieve tandheelkundige ingrepen nodig hebben, kan stopzetting van de behandeling met bisfosfonaten het risico op ONJ verminderen. Het klinische oordeel van de behandelend arts en/of kaakchirurg dient als leidraad te dienen voor het behandelplan van elke patiënt op basis van een individuele baten/risicobeoordeling.
Patiënten die osteonecrose van de kaak ontwikkelen tijdens behandeling met bisfosfonaten, moeten door een kaakchirurg worden behandeld. Bij deze patiënten kan een uitgebreide tandheelkundige ingreep om ONJ te behandelen de aandoening verergeren. Stopzetting van de behandeling met bisfosfonaten moet worden overwogen op basis van een individuele baten-risicobeoordeling.
Atypische subtrochantere en diafysaire femurfracturen
Bij met bisfosfonaat behandelde patiënten zijn atypische, laag-energetische of laag-traumafracturen van de femurschacht gemeld. Deze fracturen kunnen overal in de femurschacht optreden, van net onder de trochanter minor tot boven de supracondylaire flare en zijn transversaal of kort schuin in oriëntatie zonder tekenen van verbrijzeling. Causaliteit is niet vastgesteld, aangezien deze fracturen ook voorkomen bij osteoporotische patiënten die niet zijn behandeld met bisfosfonaten.
Atypische femurfracturen komen het meest voor met minimaal of geen trauma aan het getroffen gebied. Ze kunnen bilateraal zijn en veel patiënten melden prodromale pijn in het getroffen gebied, die zich gewoonlijk uit als doffe, pijnlijke dijpijn, weken tot maanden voordat een volledige fractuur optreedt. In een aantal rapporten wordt opgemerkt dat patiënten op het moment van de fractuur ook werden behandeld met glucocorticoïden (bijv. prednison).
Elke patiënt met een voorgeschiedenis van blootstelling aan bisfosfonaten die zich presenteert met dij- of liespijn, moet worden verdacht van een atypische fractuur en moet worden onderzocht om een onvolledige femurfractuur uit te sluiten. Patiënten met een atypische fractuur moeten ook worden beoordeeld op symptomen en tekenen van fracturen in het contralaterale lidmaat. Onderbreking van de behandeling met bisfosfonaten moet op individuele basis worden overwogen, in afwachting van een risico-batenbeoordeling.
Nierfunctiestoornis
FOSAMAX 35 mg wordt niet aanbevolen voor patiënten met een creatinineklaring van minder dan 35 ml/min.
Door glucocorticoïden geïnduceerde osteoporose
Het risico versus voordeel van FOSAMAX voor behandeling bij dagelijkse doseringen van glucocorticoïden van minder dan 7,5 mg prednison of equivalent is niet vastgesteld [zie AANWIJZINGEN EN GEBRUIK ]. Alvorens met de behandeling te beginnen, moet de gonadale hormonale status van zowel mannen als vrouwen worden vastgesteld en moet een passende vervanging worden overwogen.
Een meting van de botmineraaldichtheid moet worden uitgevoerd bij het begin van de therapie en moet worden herhaald na 6 tot 12 maanden gecombineerde behandeling met FOSAMAX en glucocorticoïden.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Instrueer patiënten om de medicatiehandleiding te lezen voordat ze beginnen met de behandeling met FOSAMAX en deze elke keer dat het recept wordt vernieuwd, opnieuw te lezen.
Aanbevelingen voor osteoporose, inclusief calcium- en vitamine D-suppletie
Instrueer patiënten om extra calcium en vitamine D in te nemen als de dagelijkse inname via de voeding onvoldoende is. Gewichtdragende oefening moet worden overwogen samen met de wijziging van bepaalde gedragsfactoren, zoals het roken van sigaretten en/of overmatig alcoholgebruik, als deze factoren bestaan.
Doseringsinstructies:
Instrueer patiënten dat de verwachte voordelen van FOSAMAX 70 mg alleen kunnen worden verkregen wanneer het wordt ingenomen met gewoon water, het eerste wat op de dag komt, ten minste 30 minuten vóór het eerste eten, drinken of medicatie van de dag. Het is aangetoond dat zelfs dosering met sinaasappelsap of koffie de absorptie van FOSAMAX aanzienlijk vermindert [zie KLINISCHE FARMACOLOGIE ].
Instrueer patiënten om niet op de tablet te kauwen of te zuigen vanwege de kans op orofaryngeale ulceratie.
Instrueer patiënten om elke tablet FOSAMAX door te slikken met een vol glas water (6-8 ounces) om de levering aan de maag te vergemakkelijken en zo de kans op slokdarmirritatie te verminderen. Instrueer patiënten om ten minste 2 ons (een kwart kopje) water te drinken na het innemen van FOSAMAX 70 mg drank, om de maaglediging te vergemakkelijken.
Instrueer patiënten om niet te gaan liggen gedurende ten minste 30 minuten en tot na hun eerste voedsel van de dag.
Instrueer patiënten om FOSAMAX niet in te nemen voor het slapengaan of voor het opstaan voor de dag. Patiënten moeten worden geïnformeerd dat het niet opvolgen van deze instructies hun risico op slokdarmproblemen kan vergroten.
Instrueer patiënten dat als ze symptomen van slokdarmziekte ontwikkelen (zoals moeite of pijn bij het slikken, retrosternale pijn of nieuw of verergerend brandend maagzuur), ze moeten stoppen met het gebruik van FOSAMAX en hun arts moeten raadplegen.
Als patiënten een dosis van FOSAMAX 70 mg eenmaal per week overslaan, instrueer patiënten dan om één dosis in te nemen op de ochtend nadat ze het zich hebben herinnerd. Ze mogen geen twee doses op dezelfde dag innemen, maar moeten terugkeren naar eenmaal per week één dosis, zoals oorspronkelijk gepland op de door hen gekozen dag.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Harderische klier (een retro-orbitale klier die niet aanwezig is bij mensen) adenomen waren verhoogd in hoge doses vrouwelijke muizen (p=0,003) in een 92 weken durende orale carcinogeniteitsstudie bij doses alendronaat van 1, 3 en 10 mg/kg/ dag (mannen) of 1, 2 en 5 mg/kg/dag (vrouwen). Deze doses komen overeen met ongeveer 0,1 tot 1 maal de hoogste aanbevolen klinische dagelijkse dosis van 40 mg op basis van oppervlakte, mg/m². De relevantie van deze bevinding voor de mens is niet bekend.
Parafolliculaire celadenomen (schildklieradenoom) waren verhoogd bij hoge doses mannelijke ratten (p=0,003) in een 2 jaar durende orale carcinogeniteitsstudie bij doses van 1 en 3,75 mg/kg lichaamsgewicht. Deze doses komen overeen met ongeveer 0,3 en 1 maal de klinische dagelijkse dosis van 40 mg op basis van oppervlakte, mg/m². De relevantie van deze bevinding voor mensen is niet bekend.
Alendronaat was niet genotoxisch in de in vitro microbiële mutagenesetest met en zonder metabole activering, in een in vitro zoogdiercelmutagenesetest, in een in vitro alkalische elutietest in rattenhepatocyten en in een in vivo chromosomale aberratietest bij muizen. In een in vitro chromosoomafwijkingstest in ovariumcellen van Chinese hamsters gaf alendronaat echter twijfelachtige resultaten.
Alendronaat had geen effect op de vruchtbaarheid (mannelijk of vrouwelijk) bij ratten bij orale doses tot 5 mg/kg/dag (ongeveer 1 maal de klinische dagelijkse dosis van 40 mg op basis van oppervlakte, mg/m²).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
De beschikbare gegevens over het gebruik van FOSAMAX bij zwangere vrouwen zijn onvoldoende om een geneesmiddelgerelateerd risico op ongunstige maternale of foetale uitkomsten te melden. Stop met FOSAMAX 35 mg wanneer zwangerschap wordt herkend.
In reproductieonderzoeken bij dieren liet de dagelijkse orale toediening van alendronaat aan ratten van vóór de paring tot het einde van de dracht of lactatie een verminderde overleving na implantatie en een verminderde toename van het lichaamsgewicht van de pup zien, beginnend bij doses die overeenkomen met minder dan de helft van de hoogste aanbevolen klinische dagelijkse dosis van 40 mg ( op basis van lichaamsoppervlak, mg/m²). Orale toediening van alendronaat aan ratten tijdens de organogenese resulteerde in verminderde foetale ossificatie vanaf doses die 3 maal hoger waren dan de klinische dagelijkse dosis van 40 mg. Er werden geen vergelijkbare foetale effecten waargenomen bij drachtige konijnen die oraal werden gedoseerd tijdens de organogenese in doses gelijk aan ongeveer 10 maal de klinische dagelijkse dosis van 40 mg.
Vertraagde of mislukte geboorte van het nageslacht, langdurige partus en late sterfte van moeders en foetussen als gevolg van maternale hypocalciëmie kwamen voor bij ratten bij orale doses van slechts een tiende van de klinische dagelijkse dosis van 40 mg (zie Gegevens ).
Bisfosfonaten worden opgenomen in de botmatrix, waaruit ze geleidelijk over een periode van jaren vrijkomen. De hoeveelheid bisfosfonaat die in volwassen bot wordt opgenomen en beschikbaar is voor afgifte in de systemische circulatie is direct gerelateerd aan de dosis en duur van het gebruik van bisfosfonaten. Bijgevolg is er, op basis van het werkingsmechanisme van bisfosfonaten, een potentieel risico op schade aan de foetus, voornamelijk aan het skelet, als een vrouw zwanger wordt na het voltooien van een kuur met bisfosfonaten. De impact van variabelen zoals de tijd tussen het staken van de behandeling met bisfosfonaten en de conceptie, het specifieke gebruikte bisfosfonaat en de toedieningsweg (intraveneus versus oraal) op het risico is niet onderzocht.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie(s) is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijkingen, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS zijn de geschatte achtergrondrisico's van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Gegevens
Dierlijke gegevens
Voortplantingsstudies bij ratten die oraal werden gedoseerd van voor de paring tot het einde van de dracht of lactatie, toonden een verminderde overleving na implantatie vanaf 2 mg/kg/dag en een verminderde toename van het lichaamsgewicht vanaf 1 mg/kg/dag, doses gelijk aan minder dan de helft van de 40 mg klinische dagelijkse dosis op basis van lichaamsoppervlak, mg/m². De incidentie van onvolledige foetale ossificatie in wervel-, schedel- en sternebrale botten was verhoogd bij ratten die oraal werden gedoseerd tijdens de organogenese vanaf 10 mg/kg/dag (ongeveer 3 maal de klinische dagelijkse dosis van 40 mg). Er werden geen vergelijkbare foetale effecten waargenomen bij drachtige konijnen die oraal werden gedoseerd tijdens de organogenese tot 35 mg/kg/dag (overeenkomend met ongeveer 10 maal de klinische dagelijkse dosis van 40 mg).
Zowel totaal als geïoniseerd calcium nam af bij drachtige ratten die oraal 15 mg/kg/dag alendronaat kregen (ongeveer 4 maal de klinische dagelijkse dosis van 40 mg), wat leidde tot vertragingen en mislukken van de bevalling. Langdurige partus als gevolg van maternale hypocalciëmie werd waargenomen wanneer ratten werden behandeld van vóór de paring tot aan de dracht vanaf 0,5 mg/kg/dag (ongeveer een tiende van de klinische dagelijkse dosis van 40 mg). Maternotoxiciteit (sterfgevallen tijdens de late zwangerschap) trad ook op bij vrouwelijke ratten die oraal werden behandeld met 15 mg/kg/dag (ongeveer 4 maal de klinische dagelijkse dosis van 40 mg) gedurende verschillende zwangerschapsperioden. Deze maternale sterfte werd verminderd, maar niet geëlimineerd door stopzetting van de behandeling. Calciumsuppletie in het drinkwater of door middel van een subcutane minipomp aan ratten die oraal 15 mg/kg/dag alendronaat kregen toegediend, kon de hypocalciëmie niet verbeteren of de dystokie-gerelateerde maternale en neonatale sterfte voorkomen. Intraveneuze calciumsuppletie voorkwam echter maternale, maar niet neonatale sterfte.
Borstvoeding
Risico Samenvatting
Het is niet bekend of alendronaat aanwezig is in moedermelk, de productie van moedermelk beïnvloedt of effecten heeft op de zuigeling die borstvoeding krijgt. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan FOSAMAX 70 mg en eventuele nadelige effecten op het kind dat borstvoeding krijgt van FOSAMAX of van de onderliggende maternale aandoening.
Pediatrisch gebruik
FOSAMAX 70 mg is niet geïndiceerd voor gebruik bij pediatrische patiënten.
De veiligheid en werkzaamheid van FOSAMAX werden onderzocht in een gerandomiseerde, dubbelblinde, placebogecontroleerde studie van twee jaar bij 139 pediatrische patiënten in de leeftijd van 4-18 jaar met ernstige osteogenesis imperfecta (OI). Honderdnegen patiënten werden gerandomiseerd naar 5 mg FOSAMAX 35 mg per dag (gewicht minder dan 40 kg) of 10 mg FOSAMAX 70 mg per dag (gewicht groter dan of gelijk aan 40 kg) en 30 patiënten naar placebo. De gemiddelde baseline BMD Z-score van de lumbale wervelkolom van de patiënten was -4,5. De gemiddelde verandering in de BMD Z-score van de lumbale wervelkolom vanaf baseline tot maand 24 was 1,3 bij de met FOSAMAX 35 mg behandelde patiënten en 0,1 bij de met placebo behandelde patiënten. Behandeling met FOSAMAX 35 mg verminderde het risico op fracturen niet. Zestien procent van de FOSAMAX-patiënten die een radiologisch bevestigde fractuur hadden opgelopen tegen maand 12 van het onderzoek, had een vertraagde fractuurgenezing (callus-remodellering) of fractuur non-union bij radiografisch onderzoek in maand 24, vergeleken met 9% van de met placebo behandelde patiënten. Bij met FOSAMAX behandelde patiënten vertoonden bothistomorfometriegegevens verkregen op maand 24 een verminderde botturnover en vertraagde mineralisatietijd; er waren echter geen mineralisatiedefecten. Er waren geen statistisch significante verschillen tussen de FOSAMAX 35 mg- en de placebogroep in vermindering van botpijn. De orale biologische beschikbaarheid bij kinderen was vergelijkbaar met die waargenomen bij volwassenen.
Het algemene veiligheidsprofiel van FOSAMAX bij patiënten met osteogenesis imperfecta die tot 24 maanden werden behandeld, was over het algemeen vergelijkbaar met dat van volwassenen met osteoporose die met FOSAMAX werden behandeld. Er was echter een toegenomen optreden van braken bij patiënten met osteogenesis imperfecta die werden behandeld met FOSAMAX in vergelijking met placebo. Tijdens de behandelingsperiode van 24 maanden werd braken waargenomen bij 32 van de 109 (29,4%) patiënten die werden behandeld met FOSAMAX 70 mg en bij 3 van de 30 (10%) patiënten die werden behandeld met placebo.
In een farmacokinetisch onderzoek ontwikkelden 6 van de 24 pediatrische patiënten met osteogenesis imperfecta die een enkelvoudige orale dosis FOSAMAX 35 of 70 mg kregen binnen 24 tot 48 uur na toediening koorts, griepachtige symptomen en/of milde lymfocytopenie. Deze voorvallen, die niet langer dan 2 tot 3 dagen duren en reageren op paracetamol, komen overeen met een acutefaserespons die is gemeld bij patiënten die bisfosfonaten kregen, waaronder FOSAMAX. [Zien ONGEWENSTE REACTIES ]
Geriatrisch gebruik
Van de patiënten die FOSAMAX kregen in de Fracture Intervention Trial (FIT), was 71% (n=2302) ouder dan of gelijk aan 65 jaar en 17% (n=550) was ouder dan of gelijk aan 75 jaar. Van de patiënten die FOSAMAX 70 mg kregen in de Verenigde Staten en multinationale onderzoeken naar de behandeling van osteoporose bij vrouwen, onderzoeken naar osteoporose bij mannen, onderzoeken naar door glucocorticoïden geïnduceerde osteoporose en onderzoeken naar de ziekte van Paget [zie Klinische studies ], respectievelijk 45%, 54%, 37% en 70% waren 65 jaar of ouder. Er werden geen algemene verschillen in werkzaamheid of veiligheid waargenomen tussen deze patiënten en jongere patiënten, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Nierfunctiestoornis
FOSAMAX 70 mg wordt niet aanbevolen voor patiënten met een creatinineklaring van minder dan 35 ml/min. Er is geen dosisaanpassing nodig bij patiënten met creatinineklaringswaarden tussen 35-60 ml/min [zie: KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Aangezien er aanwijzingen zijn dat alendronaat niet wordt gemetaboliseerd of uitgescheiden in de gal, zijn er geen onderzoeken uitgevoerd bij patiënten met een leverfunctiestoornis. Er is geen dosisaanpassing nodig [zie KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Aanzienlijke letaliteit na enkelvoudige orale doses werd waargenomen bij vrouwelijke ratten en muizen bij respectievelijk 552 mg/kg (3256 mg/m²) en 966 mg/kg (2898 mg/m²). Bij mannen waren deze waarden iets hoger, respectievelijk 626 en 1280 mg/kg. Er was geen letaliteit bij honden bij orale doses tot 200 mg/kg (4000 mg/m²).
Er is geen specifieke informatie beschikbaar over de behandeling van overdosering met FOSAMAX. Hypocalciëmie, hypofosfatemie en bijwerkingen van het bovenste deel van het maagdarmkanaal, zoals maagklachten, brandend maagzuur, oesofagitis, gastritis of zweer, kunnen het gevolg zijn van orale overdosering. Melk of maagzuurremmers moeten worden gegeven om alendronaat te binden. Vanwege het risico op slokdarmirritatie mag geen braken worden opgewekt en moet de patiënt volledig rechtop blijven.
Dialyse zou niet gunstig zijn.
CONTRA-INDICATIES
FOSAMAX 35 mg is gecontra-indiceerd bij patiënten met de volgende aandoeningen:
- Afwijkingen van de slokdarm die het ledigen van de slokdarm vertragen, zoals strictuur of achalasie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Onvermogen om gedurende ten minste 30 minuten rechtop te staan of te zitten [zie DOSERING EN ADMINISTRATIE ; WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Dien FOSAMAX 35 mg drank niet toe aan patiënten met een verhoogd risico op aspiratie.
- Hypocalciëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheid voor een van de bestanddelen van dit product. Overgevoeligheidsreacties waaronder urticaria en angio-oedeem zijn gemeld [zie: ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Dierstudies hebben het volgende werkingsmechanisme aangetoond. Op cellulair niveau vertoont alendronaat preferentiële lokalisatie op plaatsen van botresorptie, met name onder osteoclasten. De osteoclasten hechten normaal aan het botoppervlak, maar missen de gegolfde rand die wijst op actieve resorptie. Alendronaat interfereert niet met de rekrutering of hechting van osteoclasten, maar remt de activiteit van osteoclasten wel. Studies bij muizen naar de lokalisatie van radioactief [3H]alendronaat in bot toonden een ongeveer 10 keer hogere opname op osteoclastoppervlakken dan op osteoblastoppervlakken. Botten die 6 en 49 dagen na toediening van [3H]alendronaat bij respectievelijk ratten en muizen werden onderzocht, toonden aan dat bovenop het alendronaat, dat in de matrix was opgenomen, normaal bot werd gevormd. Hoewel opgenomen in de botmatrix, is alendronaat niet farmacologisch actief. Alendronaat moet dus continu worden toegediend om osteoclasten op nieuw gevormde resorptieoppervlakken te onderdrukken. Histomorfometrie bij bavianen en ratten toonde aan dat behandeling met alendronaat de botombouw vermindert (dwz het aantal plaatsen waarop bot wordt geremodelleerd). Bovendien overschrijdt de botvorming de botresorptie op deze hermodelleringsplaatsen, wat leidt tot progressieve toename van de botmassa.

farmacodynamiek
Alendronaat is een bisfosfonaat dat zich bindt aan bothydroxyapatiet en specifiek de activiteit van osteoclasten, de botresorberende cellen, remt. Alendronaat vermindert botresorptie zonder direct effect op botvorming, hoewel dit laatste proces uiteindelijk wordt verminderd omdat botresorptie en -vorming tijdens botturnover gekoppeld zijn.
Osteoporose bij postmenopauzale vrouwen
Osteoporose wordt gekenmerkt door een lage botmassa die leidt tot een verhoogd risico op fracturen. De diagnose kan worden bevestigd door de vondst van een lage botmassa, bewijs van een fractuur op röntgenfoto's, een voorgeschiedenis van osteoporotische fracturen, of lengteverlies of kyfose, indicatief voor een wervelfractuur (spinale fractuur). Osteoporose komt voor bij zowel mannen als vrouwen, maar komt het meest voor bij vrouwen na de menopauze, wanneer de botturnover toeneemt en de snelheid van botresorptie die van botvorming overschrijdt. Deze veranderingen leiden tot progressief botverlies en leiden tot osteoporose bij een aanzienlijk deel van de vrouwen ouder dan 50 jaar. Breuken, meestal van de wervelkolom, heup en pols, zijn de meest voorkomende gevolgen. Van 50 tot 90 jaar is het risico op een heupfractuur bij blanke vrouwen 50 keer groter en het risico op een wervelfractuur 15 tot 30 keer. Geschat wordt dat ongeveer 40% van de 50-jarige vrouwen tijdens hun resterende leven een of meer osteoporose-gerelateerde fracturen van de wervelkolom, heup of pols zal krijgen. Vooral heupfracturen zijn geassocieerd met aanzienlijke morbiditeit, invaliditeit en mortaliteit.
Dagelijkse orale doses alendronaat (5, 20 en 40 mg gedurende zes weken) bij postmenopauzale vrouwen veroorzaakten biochemische veranderingen die wijzen op een dosisafhankelijke remming van botresorptie, waaronder afname van calcium in de urine en urinemarkers van botcollageenafbraak (zoals deoxypyridinoline en kruis- gekoppelde N-telopeptiden van type I collageen). Deze biochemische veranderingen hadden de neiging om al 3 weken na het stopzetten van de behandeling met alendronaat terug te keren naar de uitgangswaarden en verschilden niet van placebo na 7 maanden.
Langdurige behandeling van osteoporose met FOSAMAX 10 mg/dag (tot vijf jaar) verminderde de urinaire excretie van markers voor botresorptie, deoxypyridinoline en verknoopte N-telopeptiden van type I collageen, met respectievelijk ongeveer 50% en 70% , om niveaus te bereiken die vergelijkbaar zijn met die bij gezonde premenopauzale vrouwen. Vergelijkbare afnames werden gezien bij patiënten in onderzoeken naar osteoporosepreventie die FOSAMAX 5 mg/dag kregen. De door deze markers aangegeven afname van de snelheid van botresorptie was al na één maand duidelijk en bereikte na drie tot zes maanden een plateau dat gedurende de gehele behandeling met FOSAMAX aanhield. In onderzoeken naar de behandeling van osteoporose verminderde FOSAMAX 10 mg/dag de markers van botvorming, osteocalcine en botspecifieke alkalische fosfatase met ongeveer 50%, en totaal serum alkalische fosfatase met ongeveer 25 tot 30% om een plateau te bereiken na 6 tot 12 maanden. In studies ter preventie van osteoporose verminderde FOSAMAX 5 mg/dag osteocalcine en totaal serum alkalische fosfatase met respectievelijk ongeveer 40% en 15%. Vergelijkbare verlagingen van de snelheid van botvernieuwing werden waargenomen bij postmenopauzale vrouwen tijdens een jaar durende studies met FOSAMAX 70 mg eenmaal per week voor de behandeling van osteoporose en eenmaal per week FOSAMAX 35 mg voor de preventie van osteoporose. Deze gegevens geven aan dat de snelheid van botombouw een nieuwe steady-state bereikte, ondanks de progressieve toename van de totale hoeveelheid alendronaat die in het bot wordt afgezet.
Als gevolg van remming van botresorptie werden ook asymptomatische verlagingen van de serumcalcium- en fosfaatconcentraties waargenomen na behandeling met FOSAMAX. In de langetermijnstudies waren verlagingen van serumcalcium (ongeveer 2%) en fosfaat (ongeveer 4 tot 6%) vanaf baseline zichtbaar in de eerste maand na de start van FOSAMAX 10 mg. Er werden geen verdere verlagingen van het serumcalcium waargenomen gedurende de vijfjarige behandeling; serumfosfaat keerde echter terug naar de niveaus van vóór de studie gedurende de jaren drie tot en met vijf. Soortgelijke verlagingen werden waargenomen met FOSAMAX 5 mg/dag. In studies van een jaar met eenmaal per week FOSAMAX 35 en 70 mg werden vergelijkbare verlagingen waargenomen na 6 en 12 maanden. De verlaging van serumfosfaat kan niet alleen een weerspiegeling zijn van de positieve botmineraalbalans als gevolg van FOSAMAX 70 mg, maar ook van een afname van de renale fosfaatreabsorptie.
Osteoporose bij mannen
Behandeling van mannen met osteoporose met FOSAMAX 10 mg/dag gedurende twee jaar verminderde de urinaire excretie van verknoopte N-telopeptiden van type I collageen met ongeveer 60% en botspecifieke alkalische fosfatase met ongeveer 40%. Vergelijkbare verlagingen werden waargenomen in een eenjarig onderzoek bij mannen met osteoporose die eenmaal per week FOSAMAX 70 mg kregen.
Door glucocorticoïden geïnduceerde osteoporose
Aanhoudend gebruik van glucocorticoïden wordt vaak geassocieerd met de ontwikkeling van osteoporose en resulterende fracturen (vooral wervel-, heup- en ribbe). Het komt zowel bij mannen als bij vrouwen van alle leeftijden voor. Osteoporose treedt op als gevolg van geremde botvorming en verhoogde botresorptie, wat resulteert in netto botverlies. Alendronaat vermindert de botresorptie zonder de botvorming direct te remmen.
In klinische onderzoeken van maximaal twee jaar' duur, verminderde FOSAMAX 5 en 10 mg/dag gecrosslinkte N-telopeptiden van type I collageen (een marker van botresorptie) met ongeveer 60% en verminderde botspecifieke alkalische fosfatase en totale serum alkalische fosfatase (markers van botvorming) met respectievelijk ongeveer 15 tot 30% en 8 tot 18%. Als gevolg van remming van botresorptie induceerden FOSAMAX 5 en 10 mg/dag asymptomatische verlagingen van serumcalcium (ongeveer 1 tot 2%) en serumfosfaat (ongeveer 1 tot 8%).
De botziekte van Paget
De botziekte van Paget is een chronische, focale skeletaandoening die wordt gekenmerkt door een sterk toegenomen en wanordelijke botremodellering. Overmatige osteoclastische botresorptie wordt gevolgd door osteoblastische nieuwe botvorming, wat leidt tot de vervanging van de normale botarchitectuur door een ongeorganiseerde, vergrote en verzwakte botstructuur.
Klinische manifestaties van de ziekte van Paget variëren van geen symptomen tot ernstige morbiditeit als gevolg van botpijn, botdeformiteit, pathologische fracturen en neurologische en andere complicaties. Serum alkalische fosfatase, de meest gebruikte biochemische index van ziekteactiviteit, biedt een objectieve maatstaf voor de ernst van de ziekte en de respons op therapie.
FOSAMAX 70 mg verlaagt direct de snelheid van botresorptie, wat leidt tot een indirecte afname van botvorming. In klinische onderzoeken veroorzaakte FOSAMAX 40 mg eenmaal daags gedurende zes maanden significante verlagingen van serumalkalinefosfatase en van urinemarkers van botcollageenafbraak. Als gevolg van de remming van botresorptie veroorzaakte FOSAMAX over het algemeen milde, voorbijgaande en asymptomatische verlagingen van serumcalcium en -fosfaat.
Farmacokinetiek
Absorptie
Ten opzichte van een intraveneuze referentiedosis was de gemiddelde orale biologische beschikbaarheid van alendronaat bij vrouwen 0,64% voor doses variërend van 5 tot 70 mg bij toediening na een nacht vasten en twee uur vóór een gestandaardiseerd ontbijt. De orale biologische beschikbaarheid van de tablet van 10 mg bij mannen (0,59%) was vergelijkbaar met die bij vrouwen bij toediening na een nacht vasten en 2 uur voor het ontbijt.
FOSAMAX 70 mg drank en FOSAMAX 70 mg tablet zijn even biologisch beschikbaar.
Bij 49 postmenopauzale vrouwen werd een onderzoek uitgevoerd naar het effect van het tijdstip van een maaltijd op de biologische beschikbaarheid van alendronaat. De biologische beschikbaarheid nam af (met ongeveer 40%) wanneer 10 mg alendronaat 0,5 of 1 uur vóór een gestandaardiseerd ontbijt werd toegediend, in vergelijking met dosering 2 uur voor het eten. In onderzoeken naar de behandeling en preventie van osteoporose was alendronaat werkzaam wanneer het ten minste 30 minuten vóór het ontbijt werd toegediend.
De biologische beschikbaarheid was verwaarloosbaar, ongeacht of alendronaat werd toegediend met of tot twee uur na een gestandaardiseerd ontbijt. Gelijktijdige toediening van alendronaat met koffie of sinaasappelsap verminderde de biologische beschikbaarheid met ongeveer 60%.
Verdeling
Preklinische onderzoeken (bij mannetjesratten) tonen aan dat alendronaat tijdelijk wordt gedistribueerd naar zachte weefsels na intraveneuze toediening van 1 mg/kg, maar vervolgens snel wordt herverdeeld naar het bot of uitgescheiden in de urine. Het gemiddelde distributievolume bij steady-state, exclusief bot, is bij mensen ten minste 28 l. De concentraties van het geneesmiddel in plasma na therapeutische orale doses zijn te laag (minder dan 5 ng/ml) voor analytische detectie. De eiwitbinding in humaan plasma is ongeveer 78%.
Metabolisme
Er is geen bewijs dat alendronaat wordt gemetaboliseerd bij dieren of mensen.
uitscheiding
Na een enkelvoudige intraveneuze dosis [14C]alendronaat werd ongeveer 50% van de radioactiviteit binnen 72 uur in de urine uitgescheiden en werd er weinig of geen radioactiviteit teruggevonden in de feces. Na een enkelvoudige intraveneuze dosis van 10 mg was de renale klaring van alendronaat 71 ml/min (64, 78; 90% betrouwbaarheidsinterval [BI]) en de systemische klaring was niet hoger dan 200 ml/min. De plasmaconcentraties daalden met meer dan 95% binnen 6 uur na intraveneuze toediening. De terminale halfwaardetijd bij de mens wordt geschat op meer dan 10 jaar, waarschijnlijk als gevolg van het vrijkomen van alendronaat uit het skelet. Op basis van het bovenstaande wordt geschat dat na 10 jaar orale behandeling met FOSAMAX (10 mg per dag) de hoeveelheid alendronaat die dagelijks door het skelet wordt afgegeven ongeveer 25% is van de hoeveelheid die wordt geabsorbeerd uit het maagdarmkanaal.
Specifieke populaties
Geslacht
De biologische beschikbaarheid en de fractie van een intraveneuze dosis die in de urine wordt uitgescheiden, waren vergelijkbaar bij mannen en vrouwen.
geriatrische
De biologische beschikbaarheid en dispositie (uitscheiding via de urine) waren vergelijkbaar bij oudere en jongere patiënten. Bij oudere patiënten is geen dosisaanpassing nodig.
Ras
Farmacokinetische verschillen als gevolg van ras zijn niet onderzocht.
Nierfunctiestoornis
Preklinische studies tonen aan dat bij ratten met nierfalen toenemende hoeveelheden geneesmiddel aanwezig zijn in plasma, nier, milt en scheenbeen. Bij gezonde controles wordt het geneesmiddel dat niet in het bot wordt afgezet snel uitgescheiden in de urine. Er werd geen bewijs gevonden van verzadiging van botopname na 3 weken dosering met cumulatieve intraveneuze doses van 35 mg/kg bij jonge mannelijke ratten. Hoewel er geen formeel farmacokinetisch onderzoek naar nierinsufficiëntie is uitgevoerd bij patiënten, is het waarschijnlijk dat, net als bij dieren, de eliminatie van alendronaat via de nieren verminderd zal zijn bij patiënten met een verminderde nierfunctie. Daarom kan bij patiënten met een verminderde nierfunctie een iets grotere accumulatie van alendronaat in het bot worden verwacht.
Er is geen dosisaanpassing nodig voor patiënten met een creatinineklaring van 35 tot 60 ml/min. FOSAMAX 35 mg wordt niet aanbevolen voor patiënten met een creatinineklaring van minder dan 35 ml/min vanwege een gebrek aan ervaring met alendronaat bij nierfalen.
Leverfunctiestoornis
Aangezien er aanwijzingen zijn dat alendronaat niet wordt gemetaboliseerd of uitgescheiden in de gal, zijn er geen onderzoeken uitgevoerd bij patiënten met een leverfunctiestoornis. Er is geen dosisaanpassing nodig.
Geneesmiddelinteracties
Intraveneus ranitidine bleek de biologische beschikbaarheid van oraal alendronaat te verdubbelen. De klinische betekenis van deze verhoogde biologische beschikbaarheid en of vergelijkbare verhogingen zullen optreden bij patiënten die orale H2-antagonisten krijgen, is niet bekend.
Bij gezonde proefpersonen veroorzaakte oraal prednison (20 mg driemaal daags gedurende vijf dagen) geen klinisch betekenisvolle verandering in de orale biologische beschikbaarheid van alendronaat (een gemiddelde toename variërend van 20 tot 44%).
Producten die calcium en andere multivalente kationen bevatten, kunnen de absorptie van alendronaat waarschijnlijk verstoren.
Dierlijke toxicologie en/of farmacologie
De relatieve remmende activiteiten op botresorptie en mineralisatie van alendronaat en etidronaat werden vergeleken in de Schenk-assay, die is gebaseerd op histologisch onderzoek van de epifysen van groeiende ratten. In deze test was de laagste dosis alendronaat die botmineralisatie verstoorde (leidend tot osteomalacie) 6000 maal de antiresorptieve dosis. De overeenkomstige verhouding voor etidronaat was één op één. Deze gegevens suggereren dat het zeer onwaarschijnlijk is dat alendronaat toegediend in therapeutische doses osteomalacie veroorzaakt.
Klinische studies
Behandeling van osteoporose bij postmenopauzale vrouwen
Dagelijkse dosering
De werkzaamheid van FOSAMAX 10 mg per dag werd beoordeeld in vier klinische onderzoeken. Studie 1, een driejarige, multicenter, dubbelblinde, placebogecontroleerde, Amerikaanse klinische studie waaraan 478 patiënten deelnamen met een BMD T-score van min 2,5 of lager met of zonder een eerdere wervelfractuur; Studie 2, een driejarige, multicenter, dubbelblinde, placebogecontroleerde multinationale klinische studie waaraan 516 patiënten deelnamen met een BMD T-score van min 2,5 of lager met of zonder een eerdere wervelfractuur; Studie 3, de driejarige studie van de Fracture Intervention Trial (FIT), een studie waarin 2027 postmenopauzale patiënten met ten minste één wervelfractuur bij aanvang deelnamen; en Studie 4, de vierjarige studie van FIT: een studie waaraan 4432 postmenopauzale patiënten deelnamen met een lage botmassa maar zonder een wervelfractuur bij aanvang.
Effect op breukincidentie
Om de effecten van FOSAMAX op de incidentie van wervelfracturen te beoordelen (gedetecteerd door gedigitaliseerde radiografie; ongeveer een derde hiervan was klinisch symptomatisch), werden de Amerikaanse en multinationale onderzoeken gecombineerd in een analyse waarin placebo werd vergeleken met de gepoolde doseringsgroepen van FOSAMAX (5 of 10 mg gedurende drie jaar of 20 mg gedurende twee jaar gevolgd door 5 mg gedurende één jaar). Er was een statistisch significante afname in het aantal patiënten behandeld met FOSAMAX 70 mg die een of meer nieuwe wervelfracturen kregen in vergelijking met degenen die werden behandeld met placebo (3,2% vs. 6,2%; een relatieve risicovermindering van 48%). Er werd ook een afname van het totale aantal nieuwe wervelfracturen (4,2 vs. 11,3 per 100 patiënten) waargenomen. In de gepoolde analyse hadden patiënten die FOSAMAX kregen een verlies in gestalte dat statistisch significant minder was dan werd waargenomen bij degenen die placebo kregen (-3,0 mm versus -4,6 mm).
De Fracture Intervention Trial (FIT) bestond uit twee onderzoeken bij postmenopauzale vrouwen: de driejarige studie van patiënten die ten minste één radiografische wervelfractuur bij aanvang hadden en de vierjarige studie bij patiënten met een lage botmassa maar zonder een wervelfractuur bij aanvang. In beide FIT-onderzoeken voltooide 96% van de gerandomiseerde patiënten de onderzoeken (dwz hadden een close-outbezoek aan het geplande einde van de studie); ongeveer 80% van de patiënten slikte na voltooiing nog steeds studiemedicatie.
Fracture Intervention Trial: drie jaar durend onderzoek (patiënten met ten minste één radiografische wervelfractuur bij aanvang)
Dit gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoek bij 2027 patiënten (FOSAMAX 70 mg, n=1022; placebo, n=1005) toonde aan dat behandeling met FOSAMAX resulteerde in een statistisch significante vermindering van de incidentie van fracturen na drie jaar, zoals weergegeven in Tabel 6 .
Bovendien verminderde behandeling met FOSAMAX in deze populatie van patiënten met een wervelfractuur bij aanvang de incidentie van ziekenhuisopnames significant (25,0% vs. 30,7%).
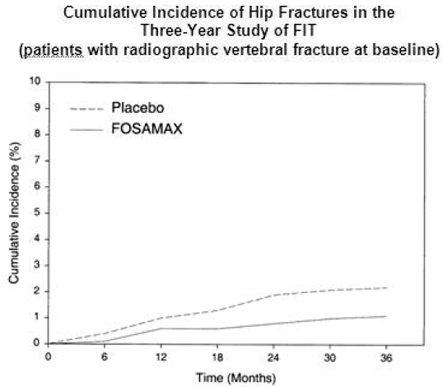
In de driejarige FIT-studie kwamen heupfracturen voor bij 22 (2,2%) van de 1005 patiënten die placebo kregen en bij 11 (1,1%) van de 1022 patiënten die FOSAMAX kregen, p=0,047. Figuur 1 toont de cumulatieve incidentie van heupfracturen in deze studie.
Figuur 1: Cumulatieve incidentie van heupfracturen in de driejarige studie van FIT (patiënten met radiografische wervelfractuur bij baseline)
Fracture Intervention Trial: vier jaar durend onderzoek (patiënten met een lage botmassa maar zonder een baseline radiografische wervelfractuur)
Deze gerandomiseerde, dubbelblinde, placebogecontroleerde studie met 4432 patiënten (FOSAMAX 70 mg, n=2214; placebo, n=2218) onderzocht verder de vermindering van de incidentie van fracturen als gevolg van FOSAMAX. De bedoeling van het onderzoek was om vrouwen te rekruteren met osteoporose, gedefinieerd als een baseline femurhals-BMD die ten minste twee standaarddeviaties onder het gemiddelde voor jongvolwassen vrouwen ligt. Echter, als gevolg van latere herzieningen van de normatieve waarden voor femurhals BMD, bleek 31% van de patiënten niet aan dit toelatingscriterium te voldoen en daarom omvatte deze studie zowel osteoporotische als niet-osteoporotische vrouwen. De resultaten worden getoond in Tabel 7 voor de patiënten met osteoporose.
Fractuurresultaten in alle onderzoeken
In de driejarige FIT-studie verminderde FOSAMAX 35 mg het percentage vrouwen dat ten minste één nieuwe radiografische wervelfractuur doormaakte van 15,0% tot 7,9% (47% relatieve risicoreductie, p
FOSAMAX verminderde het percentage vrouwen met meerdere (twee of meer) nieuwe wervelfracturen van 4,2% tot 0,6% (87% relatieve risicoreductie, p
Zo verminderde FOSAMAX 35 mg de incidentie van radiografische wervelfracturen bij osteoporotische vrouwen, ongeacht of ze al dan niet een eerdere radiografische wervelfractuur hadden.
Effect op botmineraaldichtheid
De werkzaamheid van de botmineraaldichtheid van FOSAMAX 10 mg eenmaal daags bij postmenopauzale vrouwen in de leeftijd van 44 tot 84 jaar met osteoporose (botmineraaldichtheid van de lumbale wervelkolom [BMD] van ten minste 2 standaarddeviaties onder het premenopauzale gemiddelde) werd aangetoond in vier dubbel- blinde, placebo-gecontroleerde klinische studies van twee of drie jaar' looptijd.
Figuur 2 toont de gemiddelde toename in BMD van de lumbale wervelkolom, femurhals en trochanter bij patiënten die FOSAMAX 10 mg/dag kregen in vergelijking met met placebo behandelde patiënten na drie jaar voor elk van deze onderzoeken.
Figuur 2: Onderzoek naar osteoporosebehandeling bij postmenopauzale vrouwen Toename van BMD FOSAMAX 10 mg/dag na drie jaar
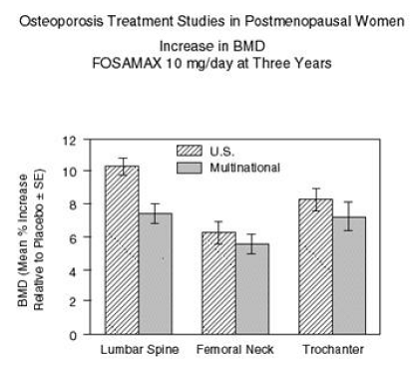
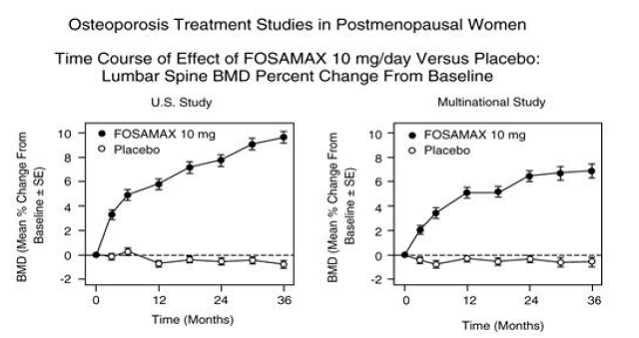
Na drie jaar werden significante verhogingen van de BMD waargenomen, zowel ten opzichte van baseline als placebo, op elke meetplaats in elk onderzoek bij patiënten die FOSAMAX 10 mg/dag kregen. De BMD van het totale lichaam nam in elk onderzoek ook significant toe, wat suggereert dat de toename van de botmassa van de wervelkolom en de heup niet ten koste ging van andere skeletplaatsen. Verhogingen van de BMD waren al na drie maanden duidelijk en hielden aan gedurende de drie jaar van de behandeling. (Zie afbeelding 3 voor resultaten van de lumbale wervelkolom.) In de tweejarige verlenging van deze onderzoeken resulteerde de behandeling van 147 patiënten met FOSAMAX 10 mg/dag in een aanhoudende toename van de BMD ter hoogte van de lumbale wervelkolom en de trochanter (absolute extra toename tussen jaar 3 en 5: lumbale wervelkolom, 0,94%; trochanter, 0,88%). BMD ter hoogte van de femurhals, onderarm en het gehele lichaam werden gehandhaafd. FOSAMAX was even effectief, ongeacht leeftijd, ras, uitgangssnelheid van botturnover en baseline BMD in het bestudeerde bereik (ten minste 2 standaarddeviaties onder het premenopauzale gemiddelde).
Figuur 3: Onderzoek naar osteoporosebehandeling bij postmenopauzale vrouwen Tijdsverloop van FOSAMAX 10 mg/dag versus placebo: lumbale wervelkolom BMD procentuele verandering t.o.v. baseline
Bij patiënten met postmenopauzale osteoporose die gedurende één of twee jaar werden behandeld met FOSAMAX 10 mg/dag, werden de effecten van stopzetting van de behandeling beoordeeld. Na stopzetting was er geen verdere toename van de botmassa en de mate van botverlies was vergelijkbaar met die van de placebogroepen.
Bot histologie
Bothistologie bij 270 postmenopauzale patiënten met osteoporose die werden behandeld met FOSAMAX in doses variërend van 1 tot 20 mg/dag gedurende één, twee of drie jaar, onthulde normale mineralisatie en structuur, evenals de verwachte afname van de botturnover in vergelijking met placebo. Deze gegevens, samen met de normale bothistologie en verhoogde botsterkte die werden waargenomen bij ratten en bavianen die werden blootgesteld aan langdurige behandeling met alendronaat, ondersteunen de conclusie dat bot gevormd tijdens behandeling met FOSAMAX 35 mg van normale kwaliteit is.
Effect op hoogte
FOSAMAX werd, over een periode van drie of vier jaar, in verband gebracht met statistisch significante verminderingen in lengteverlies versus placebo bij patiënten met en zonder radiografische wervelfracturen op baseline. Aan het einde van de FIT-onderzoeken waren de verschillen tussen de behandelingsgroepen 3,2 mm in de driejarige studie en 1,3 mm in de vierjarige studie.
Wekelijkse dosering
De therapeutische equivalentie van eenmaal per week FOSAMAX 70 mg (n=519) en FOSAMAX 10 mg per dag (n=370) werd aangetoond in een eenjarig, dubbelblind, multicenter onderzoek bij postmenopauzale vrouwen met osteoporose. In de primaire analyse van voltooide patiënten was de gemiddelde toename vanaf baseline in BMD van de lumbale wervelkolom na één jaar 5,1% (4,8; 5,4%; 95% BI) in de groep met 70 mg eenmaal per week (n=440) en 5,4% ( 5,0, 5,8%; 95% BI) in de groep van 10 mg per dag (n=330). De twee behandelingsgroepen waren ook vergelijkbaar wat betreft BMD-verhogingen op andere skeletplaatsen. De resultaten van de intention-to-treat-analyse waren consistent met de primaire analyse van voltooiers.
Gelijktijdig gebruik met oestrogeen/hormoonvervangende therapie (HST)
De effecten op de BMD van behandeling met FOSAMAX 10 mg eenmaal daags en geconjugeerd oestrogeen (0,625 mg/dag), alleen of in combinatie, werden beoordeeld in een twee jaar durend, dubbelblind, placebogecontroleerd onderzoek bij postmenopauzale osteoporotische vrouwen die een hysterectomie hadden ondergaan (n= 425) Na twee jaar was de toename van de BMD van de lumbale wervelkolom vanaf baseline significant groter met de combinatie (8,3%) dan met oestrogeen of alleen FOSAMAX (beide 6,0%).
De effecten op de BMD wanneer FOSAMAX 35 mg werd toegevoegd aan stabiele doses (gedurende ten minste één jaar) HST (oestrogeen ± progestageen) werden beoordeeld in een eenjarige, dubbelblinde, placebogecontroleerde studie bij postmenopauzale osteoporotische vrouwen (n=428). De toevoeging van FOSAMAX 10 mg eenmaal daags aan HST produceerde na één jaar een significant grotere toename van de BMD van de lumbale wervelkolom (3,7%) versus HST alleen (1,1%).
In deze onderzoeken werden significante verhogingen of gunstige trends in BMD voor gecombineerde therapie vergeleken met HST alleen gezien bij de totale heup, femurhals en trochanter. Er werd geen significant effect gezien voor de totale lichaams-BMD.
Histomorfometrische studies van trans-iliacale biopsieën bij 92 proefpersonen lieten een normale botarchitectuur zien. Vergeleken met placebo was er na 18 maanden gecombineerde behandeling met FOSAMAX 35 mg en HST een onderdrukking van 98% van de botombouw (beoordeeld door mineraliserend oppervlak), 94% op FOSAMAX 35 mg alleen en 78% op HST alleen. De langetermijneffecten van gecombineerd FOSAMAX 35 mg en HST op het optreden van fracturen en de genezing van fracturen zijn niet onderzocht.
Preventie van osteoporose bij postmenopauzale vrouwen
Dagelijkse dosering
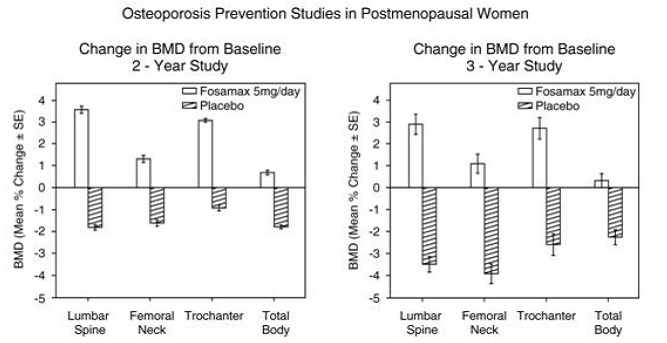
Preventie van botverlies werd aangetoond in twee dubbelblinde, placebogecontroleerde onderzoeken bij postmenopauzale vrouwen in de leeftijd van 40-60 jaar. Duizenden zeshonderd negen patiënten (FOSAMAX 5 mg/dag; n=498) die ten minste zes maanden postmenopauzaal waren, werden opgenomen in een tweejarig onderzoek zonder rekening te houden met hun baseline BMD. In het andere onderzoek werden 447 patiënten (FOSAMAX 5 mg/dag; n=88), die tussen zes maanden en drie jaar na de menopauze waren, tot drie jaar behandeld. Bij de met placebo behandelde patiënten werden BMD-verliezen van ongeveer 1% per jaar waargenomen in de wervelkolom, heup (femurhals en trochanter) en het hele lichaam. Daarentegen voorkwam FOSAMAX 5 mg/dag botverlies bij de meeste patiënten en veroorzaakte het een significante toename van de gemiddelde botmassa op elk van deze plaatsen (zie figuur 4). Bovendien verminderde FOSAMAX 5 mg/dag de snelheid van botverlies in de onderarm met ongeveer de helft in vergelijking met placebo. FOSAMAX 5 mg/dag was even effectief in deze populatie, ongeacht leeftijd, tijd sinds de menopauze, ras en uitgangssnelheid van botvernieuwing.
Figuur 4: Onderzoek naar preventie van osteoporose bij postmenopauzale vrouwen
Bot histologie
Bothistologie was normaal bij de 28 patiënten die aan het eind van drie jaar een biopsie hadden ondergaan en die FOSAMAX kregen in doses tot 10 mg/dag.
Wekelijkse dosering
De therapeutische equivalentie van eenmaal per week FOSAMAX 35 mg (n=362) en FOSAMAX 5 mg per dag (n=361) werd aangetoond in een eenjarig, dubbelblind, multicenter onderzoek bij postmenopauzale vrouwen zonder osteoporose. In de primaire analyse van voltooide patiënten was de gemiddelde toename vanaf baseline in BMD van de lumbale wervelkolom na één jaar 2,9% (2,6, 3,2%; 95% BI) in de groep met 35 mg eenmaal per week (n=307) en 3,2% ( 2,9; 3,5%; 95% BI) in de groep van 5 mg per dag (n=298). De twee behandelingsgroepen waren ook vergelijkbaar wat betreft BMD-verhogingen op andere skeletplaatsen. De resultaten van de intention-to-treat-analyse waren consistent met de primaire analyse van voltooiers.
Behandeling om de botmassa te vergroten bij mannen met osteoporose
De werkzaamheid van FOSAMAX 35 mg bij mannen met hypogonadale of idiopathische osteoporose werd aangetoond in twee klinische onderzoeken.
Dagelijkse dosering
Een twee jaar durende, dubbelblinde, placebogecontroleerde, multicenter studie van FOSAMAX 10 mg eenmaal daags omvatte in totaal 241 mannen in de leeftijd van 31 tot 87 jaar (gemiddeld 63). Alle patiënten in het onderzoek hadden ofwel een BMD T-score lager dan of gelijk aan -2 bij de femurhals en lager dan of gelijk aan -1 bij de lumbale wervelkolom, of een osteoporotische fractuur bij aanvang en een BMD T-score lager dan of gelijk aan -1 bij de femurhals. Na twee jaar waren de gemiddelde verhogingen in BMD ten opzichte van placebo bij mannen die FOSAMAX 10 mg/dag kregen significant op de volgende plaatsen: lumbale wervelkolom, 5,3%; femurhals, 2,6%; trochanter, 3,1%; en totale lichaam, 1,6%. Behandeling met FOSAMAX 70 mg verminderde ook het lengteverlies (FOSAMAX, -0,6 mm vs. placebo, -2,4 mm).
Wekelijkse dosering
Een eenjarige, dubbelblinde, placebogecontroleerde, multicenter studie van FOSAMAX 70 mg eenmaal per week omvatte in totaal 167 mannen in de leeftijd van 38 tot 91 (gemiddeld 66). De patiënten in het onderzoek hadden ofwel een BMD T-score van minder dan of gelijk aan -2 bij de femurhals en lager dan of gelijk aan -1 in de lumbale wervelkolom, of een BMD T-score van minder dan of gelijk aan -2 bij de lumbale wervelkolom en kleiner dan of gelijk aan -1 bij de femurhals, of een osteoporotische fractuur bij aanvang en een BMD T-score kleiner dan of gelijk aan -1 bij de femurhals. Na één jaar waren de gemiddelde BMD-verhogingen ten opzichte van placebo bij mannen die eenmaal per week 70 mg FOSAMAX kregen, significant op de volgende plaatsen: lumbale wervelkolom, 2,8%; femurhals, 1,9%; trochanter, 2,0%; en totale lichaam, 1,2%. Deze verhogingen van de BMD waren vergelijkbaar met de verhogingen die na één jaar werden gezien in de studie van 10 mg eenmaal daags.
In beide onderzoeken waren de BMD-responsen vergelijkbaar, ongeacht leeftijd (groter dan of gelijk aan 65 jaar versus minder dan 65 jaar), gonadale functie (baseline testosteron minder dan 9 ng/dL versus groter dan of gelijk aan 9 ng/dL) , of baseline BMD (femurhals en lumbale wervelkolom T-score kleiner dan of gelijk aan -2,5 vs. groter dan -2,5).
Behandeling van door glucocorticoïden geïnduceerde osteoporose
De werkzaamheid van FOSAMAX 5 en 10 mg eenmaal daags bij mannen en vrouwen die glucocorticoïden kregen (ten minste 7,5 mg/dag prednison of equivalent) werd aangetoond in twee, eenjarige, dubbelblinde, gerandomiseerde, placebogecontroleerde, multicenter studies van vrijwel identiek ontwerp, één uitgevoerd in de Verenigde Staten en de andere in 15 verschillende landen (Multinational [waaronder ook FOSAMAX 2,5 mg/dag]). Aan deze onderzoeken namen respectievelijk 232 en 328 patiënten deel in de leeftijd tussen 17 en 83 met een verscheidenheid aan glucocorticoïde-vereisende ziekten. Patiënten kregen aanvullend calcium en vitamine D. Figuur 5 toont de gemiddelde verhogingen ten opzichte van placebo in BMD van de lumbale wervelkolom, femurhals en trochanter bij patiënten die FOSAMAX 5 mg/dag kregen voor elk onderzoek.
Figuur 5: Studies bij met glucocorticoïden behandelde patiënten Toename in BMD FOSAMAX 5 mg/dag na één jaar
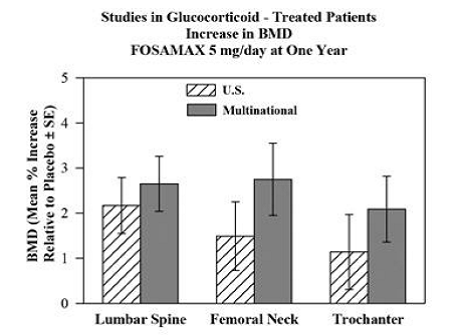
Na één jaar werden in de gecombineerde onderzoeken op elk van deze plaatsen bij patiënten die FOSAMAX 5 mg/dag kregen, significante verhogingen van de BMD gezien in vergelijking met placebo. Bij de met placebo behandelde patiënten trad een significante afname van de BMD op ter hoogte van de femurhals (-1,2%) en kleinere afnamen werden gezien ter hoogte van de lumbale wervelkolom en de trochanter. De totale lichaams-BMD werd gehandhaafd met FOSAMAX 5 mg/dag. De verhogingen in BMD met FOSAMAX 10 mg/dag waren vergelijkbaar met die met FOSAMAX 5 mg/dag bij alle patiënten, behalve bij postmenopauzale vrouwen die geen oestrogeentherapie kregen. Bij deze vrouwen waren de verhogingen (ten opzichte van placebo) met FOSAMAX 10 mg/dag groter dan die met FOSAMAX 5 mg/dag ter hoogte van de lumbale wervelkolom (4,1% vs. 1,6%) en trochanter (2,8% vs. 1,7%), maar niet op andere sites. FOSAMAX 35 mg was effectief ongeacht de dosis of duur van het gebruik van glucocorticoïden. Bovendien was FOSAMAX even effectief ongeacht leeftijd (jonger dan 65 vs. ouder dan of gelijk aan 65 jaar), ras (Kaukasisch vs. andere rassen), geslacht, onderliggende ziekte, baseline BMD, baseline botturnover en gebruik met een verscheidenheid aan veel voorkomende medicijnen.
Bothistologie was normaal bij de 49 patiënten die aan het eind van een jaar een biopsie hadden ondergaan en die FOSAMAX kregen in doses tot 10 mg/dag.
Van de oorspronkelijke 560 patiënten in deze onderzoeken, gingen 208 patiënten die op ten minste 7,5 mg/dag prednison of equivalent bleven door in een dubbelblinde verlenging van een jaar. Na twee jaar behandeling nam de BMD van de wervelkolom toe met respectievelijk 3,7% en 5,0% in vergelijking met placebo met FOSAMAX 5 en 10 mg/dag. Significante verhogingen van de BMD (ten opzichte van placebo) werden ook waargenomen bij de femurhals, de trochanter en het hele lichaam.
Na één jaar ondervond 2,3% van de patiënten die werden behandeld met FOSAMAX 5 of 10 mg/dag (samengevoegd) versus 3,7% van degenen die met placebo werden behandeld, een nieuwe wervelfractuur (niet significant). In de populatie die gedurende twee jaar werd onderzocht, verminderde behandeling met FOSAMAX (gepoolde doseringsgroepen: 5 of 10 mg gedurende twee jaar of 2,5 mg gedurende één jaar gevolgd door 10 mg gedurende één jaar) echter de incidentie van patiënten met een nieuwe wervelfractuur significant. (FOSAMAX 0,7% versus placebo 6,8%).
Behandeling van de botziekte van Paget
De werkzaamheid van FOSAMAX 40 mg eenmaal daags gedurende zes maanden werd aangetoond in twee dubbelblinde klinische onderzoeken bij mannelijke en vrouwelijke patiënten met matige tot ernstige ziekte van Paget (alkalische fosfatase ten minste tweemaal de bovengrens van normaal): een placebo -gecontroleerd, multinationaal onderzoek en een Amerikaans vergelijkend onderzoek met etidronaatdinatrium 400 mg/dag. Figuur 6 toont de gemiddelde procentuele veranderingen vanaf baseline in serum alkalische fosfatase gedurende maximaal zes maanden gerandomiseerde behandeling.
Figuur 6: Onderzoek naar de botziekte van Paget Effect op serum alkalische fosfatase van FOSAMAX 40 mg/dag versus placebo of etidronaat 400 mg/dag
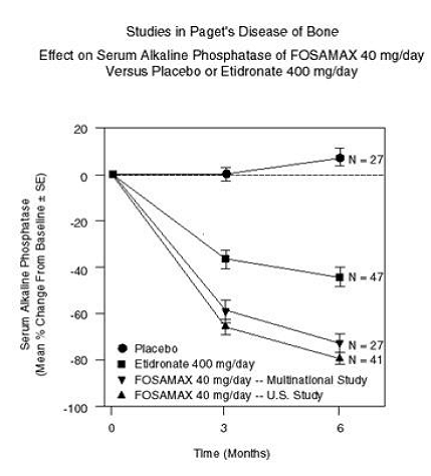
Na zes maanden was de onderdrukking van alkalische fosfatase bij patiënten behandeld met FOSAMAX significant groter dan die bereikt met etidronaat en contrasteerde met het volledige gebrek aan respons bij met placebo behandelde patiënten. Respons (gedefinieerd als normalisatie van serumalkalinefosfatase of afname vanaf baseline groter dan of gelijk aan 60%) trad op bij ongeveer 85% van de patiënten die met FOSAMAX werden behandeld in de gecombineerde onderzoeken versus 30% in de etidronaatgroep en 0% in de placebo groep. FOSAMAX 70 mg was even effectief, ongeacht leeftijd, geslacht, ras, eerder gebruik van andere bisfosfonaten of baseline alkalische fosfatase binnen het bestudeerde bereik (ten minste tweemaal de bovengrens van normaal).
Bothistologie werd geëvalueerd bij 33 patiënten met de ziekte van Paget die gedurende 6 maanden werden behandeld met FOSAMAX 40 mg/dag. Zoals bij patiënten die worden behandeld voor osteoporose [zie Klinische studies ], had FOSAMAX geen nadelige invloed op de mineralisatie en werd de verwachte afname van de botombouw waargenomen. Tijdens de behandeling met FOSAMAX werd normaal lamellair bot geproduceerd, zelfs wanneer reeds bestaand bot geweven en gedesorganiseerd was. Over het algemeen ondersteunen bothistologische gegevens de conclusie dat bot gevormd tijdens behandeling met FOSAMAX 35 mg van normale kwaliteit is.
PATIËNT INFORMATIE
FOSAMAX® (FOSS-ah-max)(alendronaatnatrium) Tabletten
Lees de medicatiehandleiding die bij FOSAMAX 70 mg wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze medicatiehandleiding vervangt niet het praten met uw arts over uw medische toestand of behandeling. Neem contact op met uw arts als u vragen heeft over FOSAMAX.
Wat is de belangrijkste informatie die ik moet weten over FOSAMAX 70 mg?
FOSAMAX 70 mg kan ernstige bijwerkingen veroorzaken, waaronder:
1. Slokdarmproblemen.
Sommige mensen die FOSAMAX 35 mg gebruiken, kunnen problemen krijgen in de slokdarm (de buis die de mond en de maag met elkaar verbindt).
Deze problemen omvatten irritatie, ontsteking of zweren van de slokdarm die soms kunnen bloeden.
- Het is belangrijk dat u FOSAMAX 70 mg precies volgens voorschrift inneemt om uw kans op slokdarmproblemen te verkleinen. (Zie de rubriek “Hoe moet ik FOSAMAX gebruiken?”)
- Stop met het innemen van FOSAMAX en bel onmiddellijk uw arts als u pijn op de borst krijgt, als u last krijgt van nieuw brandend maagzuur of als u last krijgt van pijn bij het slikken.
2. Lage calciumspiegels in uw bloed (hypocalciëmie).
FOSAMAX kan de calciumspiegels in uw bloed verlagen. Als u een laag calciumgehalte in het bloed heeft voordat u FOSAMAX begint te gebruiken, kan dit tijdens de behandeling verergeren. Uw lage calciumgehalte in het bloed moet worden behandeld voordat u FOSAMAX inneemt. De meeste mensen met een laag calciumgehalte in het bloed hebben geen symptomen, maar sommige mensen kunnen symptomen hebben. Bel onmiddellijk uw arts als u symptomen heeft van een laag calciumgehalte in het bloed, zoals:
- Spasmen, spiertrekkingen of krampen in uw spieren
- Gevoelloosheid of tintelingen in uw vingers, tenen of rond uw mond
Uw arts kan calcium en vitamine D voorschrijven om een laag calciumgehalte in uw bloed te voorkomen terwijl u FOSAMAX gebruikt. Neem calcium en vitamine D in zoals uw arts u dat heeft verteld.
3. Bot-, gewrichts- of spierpijn.
Sommige mensen die FOSAMAX gebruiken, krijgen ernstige bot-, gewrichts- of spierpijn.
4. Ernstige kaakbotproblemen (osteonecrose).
Ernstige kaakbotproblemen kunnen optreden als u FOSAMAX gebruikt. Uw arts moet uw mond onderzoeken voordat u met FOSAMAX begint. Uw arts kan u vertellen uw tandarts te raadplegen voordat u met FOSAMAX begint. Het is belangrijk dat u tijdens de behandeling met FOSAMAX goede mondzorg toepast.
5. Ongebruikelijke dijbeenbreuken.
Sommige mensen hebben ongebruikelijke breuken in hun dijbeen ontwikkeld. Symptomen van een fractuur kunnen nieuwe of ongebruikelijke pijn in uw heup, lies of dijbeen zijn.
Bel onmiddellijk uw arts als u een van deze bijwerkingen heeft.
Wat is FOSAMAX 70 mg?
- FOSAMAX 70 mg is een receptgeneesmiddel dat wordt gebruikt om:
- Behandel of voorkom osteoporose bij vrouwen na de menopauze. Het helpt de kans op een heup- of wervelfractuur (breuk) te verkleinen.
- Verhoog de botmassa bij mannen met osteoporose.
- Behandel osteoporose bij mannen of vrouwen die corticosteroïden gebruiken.
Behandel bepaalde mannen en vrouwen die de botziekte van Paget hebben.
Het is niet bekend hoe lang FOSAMAX 70 mg werkt voor de behandeling en preventie van osteoporose. U dient uw arts regelmatig te raadplegen om te bepalen of FOSAMAX 70 mg nog steeds geschikt voor u is.
FOSAMAX is niet bedoeld voor gebruik bij kinderen.
Wie mag FOSAMAX 70 mg niet gebruiken?
Gebruik FOSAMAX niet als u:
- Bepaalde problemen heeft met uw slokdarm, de buis die uw mond met uw maag verbindt
- Kan niet minstens 30 minuten rechtop staan of zitten
- Een laag calciumgehalte in uw bloed heeft
- Zijn allergisch voor FOSAMAX 70 mg of een van de ingrediënten. Een lijst met ingrediënten staat aan het einde van deze bijsluiter.
Wat moet ik mijn arts vertellen voordat ik FOSAMAX 35 mg inneem?
Voordat u met FOSAMAX begint, moet u uw arts raadplegen als u:
- Problemen hebben met slikken
- Maag- of spijsverteringsproblemen hebben
- Een laag calciumgehalte in het bloed hebben
- Plan om een tandheelkundige ingreep of tanden te laten verwijderen
- nierproblemen hebben
- Er is mij verteld dat u moeite heeft met het opnemen van mineralen in uw maag of darmen (malabsorptiesyndroom)
- Bent u zwanger, probeert u zwanger te worden of vermoedt u dat u zwanger bent. Als u zwanger wordt terwijl u FOSAMAX gebruikt, stop dan met het gebruik en neem contact op met uw arts. Het is niet bekend of FOSAMAX schadelijk kan zijn voor uw ongeboren baby.
- Geef je borstvoeding of ben je van plan borstvoeding te geven. Het is niet bekend of FOSAMAX in uw melk terechtkomt en schadelijk kan zijn voor uw baby.
Vertel het uw arts vooral als u:
- maagzuurremmers
- aspirine
- Niet-steroïde anti-inflammatoire (NSAID) medicijnen
Vertel uw arts over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Bepaalde geneesmiddelen kunnen de werking van FOSAMAX 70 mg beïnvloeden.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij en toon deze elke keer dat u een nieuw geneesmiddel krijgt aan uw arts en apotheker.
Hoe moet ik FOSAMAX 35 mg innemen?
- Neem FOSAMAX 35 mg precies in zoals uw arts u dat heeft verteld.
- FOSAMAX werkt alleen als het op een lege maag wordt ingenomen.
- Neem FOSAMAX 35 mg in nadat u een dag bent opgestaan en voordat u voor het eerst gaat eten, drinken of een ander geneesmiddel.
- Neem FOSAMAX in terwijl u zit of staat.
- Kauw of zuig niet op een tablet FOSAMAX.
- Slik de FOSAMAX-tablet alleen door met een vol glas (6-8 oz) gewoon water.
- Niet doen neem FOSAMAX in met mineraalwater, koffie, thee, frisdrank of sap.
- Als u Alendronaat Dagelijks gebruikt:
- Neem één keer per dag 1 tablet alendronaat, elke dag nadat u opstaat en voordat u voor het eerst gaat eten, drinken of een ander geneesmiddel.
- Als u eenmaal per week FOSAMAX inneemt:
- Kies de dag van de week die het beste bij uw schema past.
- Neem elke week 1 dosis FOSAMAX op de door u gekozen dag nadat u bent opgestaan en voordat u uw eerste eten, drinken of ander geneesmiddel inneemt.
- Als u Alendronaat Dagelijks gebruikt:
Wacht ten minste 30 minuten na het doorslikken van een FOSAMAX 35 mg-tablet:
- Voordat je gaat liggen. U mag zitten, staan of lopen en normale activiteiten doen, zoals lezen.
- Voordat u uw eerste eten of drinken inneemt, behalve gewoon water.
- Voordat u andere geneesmiddelen gebruikt, waaronder maagzuurremmers, calcium en andere supplementen en vitamines.
Ga niet liggen gedurende ten minste 30 minuten nadat u FOSAMAX heeft ingenomen en nadat u uw eerste voedsel van de dag heeft gegeten.
Als u een dosis FOSAMAX 70 mg heeft overgeslagen, neem deze dan niet later op de dag in. Neem uw gemiste dosis de volgende ochtend in nadat u het zich herinnert en ga dan terug naar uw normale schema. Neem geen 2 doses op dezelfde dag.
Als u te veel FOSAMAX 70 mg heeft ingenomen, neem dan contact op met uw arts. Probeer niet te braken. Ga niet liggen.
Wat zijn de mogelijke bijwerkingen van FOSAMAX 70 mg?
FOSAMAX kan ernstige bijwerkingen veroorzaken.
- Zie "Wat is de belangrijkste informatie die ik moet weten over FOSAMAX?"
De meest voorkomende bijwerkingen van FOSAMAX 70 mg zijn:
- Maag (buik) pijn
- Maagzuur
- Constipatie
- Diarree
- maagklachten
- Pijn in uw botten, gewrichten of spieren
- Misselijkheid
kunt allergische reacties krijgen, zoals netelroos of zwelling van uw gezicht, lippen, tong of keel.
Verergering van astma is gemeld.
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van FOSAMAX. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe bewaar ik FOSAMAX?
- Bewaar FOSAMAX 35 mg bij kamertemperatuur, 59 ° F tot 86 ° F (15 ° C tot 30 ° C).
- Bewaar FOSAMAX in een goed gesloten container.
Houd FOSAMAX en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van FOSAMAX.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik FOSAMAX 35 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef FOSAMAX 35 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over FOSAMAX samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over FOSAMAX die is geschreven voor gezondheidswerkers. Ga voor meer informatie naar: www.FOSAMAX.com of bel 1-800-622-4477 (gratis).
Wat zijn de ingrediënten in FOSAMAX?
Actief bestanddeel: alendronaatnatrium
Inactieve ingrediënten: microkristallijne cellulose, watervrije lactose, croscarmellosenatrium, magnesiumstearaat.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
