Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Diflucan en hoe wordt het gebruikt?
Diflucan is een receptgeneesmiddel dat wordt gebruikt om de symptomen van schimmelinfecties te behandelen. Diflucan 50 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Diflucan 100 mg behoort tot een klasse geneesmiddelen die antischimmelmiddelen worden genoemd.
Wat zijn bijwerkingen van Diflucan 150 mg?
Diflucan 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- snelle of bonzende hartslag,
- fladderen in je borst,
- kortademigheid,
- plotselinge duizeligheid,
- koorts,
- rillingen,
- pijn in het lichaam,
- griep symptomen,
- gemakkelijk blauwe plekken of bloedingen,
- ongebruikelijke zwakte,
- toevallen (convulsies),
- huiduitslag of laesies,
- verlies van eetlust,
- pijn in de bovenbuik,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van ogen of huid (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Diflucan zijn:
- misselijkheid,
- buikpijn,
- diarree,
- maagklachten,
- hoofdpijn,
- duizeligheid, en
- veranderingen in uw smaakzin
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Diflucan. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
DIFLUCAN® (fluconazol), de eerste van een nieuwe subklasse van synthetische triazol-antischimmelmiddelen, is verkrijgbaar als tabletten voor orale toediening, als poeder voor orale suspensie.
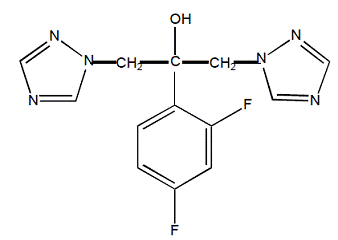
Fluconazol wordt chemisch aangeduid als 2,4-difluor-α,α1-bis(1H-1,2,4-triazool-1-ylmethyl)benzylalcohol met een empirische formule van C13H12F2N6O en een molecuulgewicht van 306,3. De structuurformule is:
Fluconazol is een witte kristallijne vaste stof die enigszins oplosbaar is in water en zoutoplossing.
DIFLUCAN-tabletten bevatten 50, 100, 150 of 200 mg fluconazol en de volgende inactieve ingrediënten: microkristallijne cellulose, watervrij dibasisch calciumfosfaat, povidon, croscarmellosenatrium, FD&C Red No. 40 aluminiumlakkleurstof en magnesiumstearaat.
DIFLUCAN voor orale suspensie bevat 350 mg of 1400 mg fluconazol en de volgende inactieve ingrediënten: sucrose, natriumcitraatdihydraat, watervrij citroenzuur, natriumbenzoaat, titaniumdioxide, colloïdaal siliciumdioxide, xanthaangom en natuurlijke sinaasappelsmaak. Na reconstitutie met 24 ml gedestilleerd water of gezuiverd water (USP), bevat elke ml gereconstitueerde suspensie 10 mg of 40 mg fluconazol.
INDICATIES
DIFLUCAN (fluconazol) is geïndiceerd voor de behandeling van:
- Vaginale candidiasis (vaginale schimmelinfecties door Candida).
- Orofaryngeale en oesofageale candidiasis. In open niet-vergelijkende onderzoeken met relatief kleine aantallen patiënten was DIFLUCAN ook effectief voor de behandeling van Candida-urineweginfecties, peritonitis en systemische Candida-infecties, waaronder candidemie, gedissemineerde candidiasis en pneumonie.
- Cryptokokkenmeningitis. Voordat u DIFLUCAN (fluconazol) voorschrijft aan AIDS-patiënten met cryptokokkenmeningitis, zie Klinische studies sectie. Er zijn geen onderzoeken uitgevoerd waarin DIFLUCAN 150 mg werd vergeleken met amfotericine B bij niet-hiv-geïnfecteerde patiënten.
profylaxe
DIFLUCAN is ook geïndiceerd om de incidentie van candidiasis te verminderen bij patiënten die een beenmergtransplantatie ondergaan en die cytotoxische chemotherapie en/of bestralingstherapie krijgen.
Monsters voor schimmelkweek en andere relevante laboratoriumonderzoeken (serologie, histopathologie) moeten voorafgaand aan de therapie worden verkregen om veroorzakende organismen te isoleren en te identificeren. Therapie kan worden ingesteld voordat de resultaten van de kweken en andere laboratoriumonderzoeken bekend zijn; zodra deze resultaten echter beschikbaar zijn, moet de anti-infectieuze therapie dienovereenkomstig worden aangepast.
DOSERING EN ADMINISTRATIE
Dosering en toediening bij volwassenen
Enkele dosis
Vaginale candidiasis
De aanbevolen dosering van DIFLUCAN voor vaginale candidiasis is 150 mg als een enkelvoudige orale dosis.
Meerdere doses
AANGEZIEN ORALE ABSORPTIE SNEL EN BIJNA VOLLEDIG IS, IS DE DAGELIJKSE DOSIS VAN DIFLUCAN (FLUCONAZOOL) HETZELFDE VOOR ORALE (TABLETTEN EN SCHORSING) EN INTRAVENEUZE TOEDIENING. Over het algemeen wordt een oplaaddosis van tweemaal de dagelijkse dosis aanbevolen op de eerste dag van de behandeling om op de tweede dag van de behandeling te resulteren in plasmaconcentraties die dicht bij de steady-state liggen.
De dagelijkse dosis DIFLUCAN 100 mg voor de behandeling van andere infecties dan vaginale candidiasis moet gebaseerd zijn op het infecterende organisme en de reactie van de patiënt op de therapie. De behandeling moet worden voortgezet totdat klinische parameters of laboratoriumtests aangeven dat de actieve schimmelinfectie is verdwenen. Een ontoereikende behandelingsperiode kan leiden tot herhaling van een actieve infectie. Patiënten met aids en cryptokokkenmeningitis of recidiverende orofaryngeale candidiasis hebben gewoonlijk onderhoudstherapie nodig om terugval te voorkomen.
Orofaryngeale candidiasis
De aanbevolen dosering van DIFLUCAN voor orofaryngeale candidiasis is 200 mg op de eerste dag, gevolgd door 100 mg eenmaal daags. Klinisch bewijs van orofaryngeale candidiasis verdwijnt over het algemeen binnen enkele dagen, maar de behandeling moet gedurende ten minste 2 weken worden voortgezet om de kans op terugval te verkleinen.
Slokdarmcandidiasis
De aanbevolen dosering van DIFLUCAN 200 mg voor oesofageale candidiasis is 200 mg op de eerste dag, gevolgd door 100 mg eenmaal daags. Doses tot 400 mg/dag kunnen worden gebruikt, op basis van medisch oordeel over de reactie van de patiënt op de therapie. Patiënten met oesofageale candidiasis dienen minimaal drie weken en minimaal twee weken na het verdwijnen van de symptomen te worden behandeld.
Systemische Candida-infecties
Voor systemische Candida-infecties, waaronder candidemie, gedissemineerde candidiasis en pneumonie, zijn geen optimale therapeutische dosering en duur van de therapie vastgesteld. In open, niet-vergelijkende onderzoeken met kleine aantallen patiënten zijn doses tot 400 mg per dag gebruikt.
Urineweginfecties en peritonitis
Voor de behandeling van Candida-urineweginfecties en peritonitis zijn dagelijkse doses van 50 tot 200 mg gebruikt in open, niet-vergelijkende onderzoeken bij kleine aantallen patiënten.
Cryptokokkenmeningitis
De aanbevolen dosering voor de behandeling van acute cryptokokkenmeningitis is 400 mg op de eerste dag, gevolgd door 200 mg eenmaal daags. Een dosering van 400 mg eenmaal daags kan worden gebruikt, op basis van een medisch oordeel over de reactie van de patiënt op de therapie. De aanbevolen behandelingsduur voor initiële therapie van cryptokokkenmeningitis is 10 tot 12 weken nadat de cerebrospinale vloeistof kweeknegatief is geworden. De aanbevolen dosering van DIFLUCAN 150 mg voor het onderdrukken van terugval van cryptokokkenmeningitis bij patiënten met aids is 200 mg eenmaal daags.
Profylaxe bij patiënten die een beenmergtransplantatie ondergaan
De aanbevolen dagelijkse dosering van DIFLUCAN voor de preventie van candidiasis bij patiënten die een beenmergtransplantatie ondergaan, is eenmaal daags 400 mg. Patiënten van wie wordt verwacht dat ze ernstige granulocytopenie hebben (minder dan 500 neutrofielencellen/mm³) moeten enkele dagen voor het verwachte begin van neutropenie beginnen met DIFLUCAN-profylaxe en doorgaan gedurende 7 dagen nadat het aantal neutrofielen boven de 1000 cellen/mm is gestegen.
Dosering en toediening bij kinderen
Het volgende dosisequivalentieschema zou in het algemeen een equivalente blootstelling moeten bieden bij pediatrische en volwassen patiënten:
Ervaring met DIFLUCAN bij pasgeborenen is beperkt tot farmacokinetische onderzoeken bij premature pasgeborenen. (Zien KLINISCHE FARMACOLOGIE .) Op basis van de verlengde halfwaardetijd die wordt waargenomen bij premature pasgeborenen (zwangerschapsduur 26 tot 29 weken), moeten deze kinderen in de eerste twee levensweken dezelfde dosering (mg/kg) krijgen als bij oudere kinderen, maar dan elke 72 uur. Na de eerste twee weken moeten deze kinderen eenmaal daags worden gedoseerd. Er is geen informatie beschikbaar over de farmacokinetiek van DIFLUCAN bij voldragen pasgeborenen.
Orofaryngeale candidiasis
De aanbevolen dosering van DIFLUCAN 150 mg voor orofaryngeale candidiasis bij kinderen is 6 mg/kg op de eerste dag, gevolgd door 3 mg/kg eenmaal daags. De behandeling moet gedurende ten minste 2 weken worden toegediend om de kans op terugval te verkleinen.
Slokdarmcandidiasis
Voor de behandeling van oesofageale candidiasis is de aanbevolen dosering van DIFLUCAN bij kinderen 6 mg/kg op de eerste dag, gevolgd door 3 mg/kg eenmaal daags. Doses tot 12 mg/kg/dag kunnen worden gebruikt, op basis van medisch oordeel over de reactie van de patiënt op de therapie. Patiënten met oesofageale candidiasis moeten worden behandeld gedurende minimaal drie weken en gedurende ten minste 2 weken nadat de symptomen zijn verdwenen.
Systemische Candida-infecties
Voor de behandeling van candidemie en gedissemineerde Candida-infecties zijn dagelijkse doses van 6 tot 12 mg/kg/dag gebruikt in een open, niet-vergelijkend onderzoek bij een klein aantal kinderen.
Cryptokokkenmeningitis
Voor de behandeling van acute cryptokokkenmeningitis is de aanbevolen dosering 12 mg/kg op de eerste dag, gevolgd door 6 mg/kg eenmaal daags. Een dosering van 12 mg/kg eenmaal daags kan worden gebruikt, op basis van een medisch oordeel over de reactie van de patiënt op de therapie. De aanbevolen behandelingsduur voor initiële therapie van cryptokokkenmeningitis is 10 tot 12 weken nadat de cerebrospinale vloeistof kweeknegatief is geworden. Voor het onderdrukken van een recidief van cryptokokkenmeningitis bij kinderen met AIDS is de aanbevolen dosis DIFLUCAN 6 mg/kg eenmaal daags.
Dosering bij patiënten met een verminderde nierfunctie
Fluconazol wordt voornamelijk geklaard door uitscheiding via de nieren als onveranderd geneesmiddel. Het is niet nodig om de behandeling met een enkelvoudige dosis voor vaginale candidiasis aan te passen vanwege een verminderde nierfunctie. Bij patiënten met een verminderde nierfunctie die meerdere doses DIFLUCAN zullen krijgen, moet een initiële oplaaddosis van 50 mg tot 400 mg worden gegeven. Na de oplaaddosis dient de dagelijkse dosis (volgens indicatie) te worden gebaseerd op de volgende tabel:
Patiënten die hemodialyse ondergaan, dienen na elke hemodialyse 100% van de aanbevolen dosis te krijgen; op niet-dialysedagen dienen patiënten een verlaagde dosis te krijgen op basis van hun creatinineklaring.
Dit zijn voorgestelde dosisaanpassingen op basis van farmacokinetiek na toediening van meerdere doses. Afhankelijk van de klinische toestand kan verdere aanpassing nodig zijn.
Wanneer serumcreatinine de enige beschikbare maatstaf voor de nierfunctie is, moet de volgende formule (op basis van geslacht, gewicht en leeftijd van de patiënt) worden gebruikt om de creatinineklaring bij volwassenen te schatten:
mannen: Gewicht (kg) × (140 – leeftijd)/ 72 × serumcreatinine (mg/100 ml)
vrouwtjes: 0,85 × boven waarde
Hoewel de farmacokinetiek van fluconazol niet is onderzocht bij kinderen met nierinsufficiëntie, dient de dosisverlaging bij kinderen met nierinsufficiëntie parallel te lopen met de aanbevolen dosering voor volwassenen. De volgende formule kan worden gebruikt om de creatinineklaring bij kinderen te schatten:
lineaire lengte of hoogte (cm)/serumcreatinine (mg/100 ml)
(Waar K=0,55 voor kinderen ouder dan 1 jaar en 0,45 voor zuigelingen.)
Administratie
DIFLUCAN 100 mg wordt oraal toegediend. DIFLUCAN kan met of zonder voedsel worden ingenomen.
Aanwijzingen voor het mengen van de orale suspensie
Bereid een suspensie op het moment van afgifte als volgt: tik op de fles totdat al het poeder vrij kan stromen. Om te reconstitueren, voegt u 24 ml gedistilleerd water of gezuiverd water (USP) toe aan de fluconazolfles en schudt u krachtig om het poeder te suspenderen. Elke fles levert 35 ml suspensie. De concentraties van de gereconstitueerde suspensies zijn als volgt:
Opmerking: Schud de orale suspensie goed voor gebruik. Bewaar de gereconstitueerde suspensie tussen 86 °F (30 °C) en 41 °F (5 °C) en gooi de ongebruikte portie na 2 weken weg. Beschermen tegen bevriezing.
HOE GELEVERD
DIFLUCAN 100 mg tabletten Roze trapeziumvormige tabletten die 50, 100 of 200 mg fluconazol bevatten, zijn verpakt in flessen of blisterverpakkingen met eenheidsdosis. De 150 mg fluconazol tabletten zijn roze en ovaal van vorm, verpakt in een eenheidsblisterverpakking voor eenmalig gebruik.
DIFLUCAN-tabletten worden als volgt geleverd:
DIFLUCAN 50 mg tabletten : Gegraveerd met "DIFLUCAN" en "50" op de voorkant en "ROERIG" op de achterkant.
NDC 0049-3410-30 Flessen van 30
DIFLUCAN 100 mg tabletten : Gegraveerd met "DIFLUCAN" en "100" op de voorkant en "ROERIG" op de achterkant.
NDC 0049-3420-30 Flessen van 30 NDC 0049-3420-41 Eenheidsdosisverpakking van 100
DIFLUCAN 150 mg tabletten : Gegraveerd met "DIFLUCAN" en "150" op de voorkant en "ROERIG" op de achterkant.
NDC 0049-3500-79 Eenheidsdosisverpakking van 1
DIFLUCAN 200 mg tabletten : Gegraveerd met "DIFLUCAN" en "200" op de voorkant en "ROERIG" op de achterkant.
NDC 0049-3430-30 Flessen van 30 NDC 0049-3430-41 Eenheidsdosisverpakking van 100
Opslag
Bewaar tabletten onder 86 ° F (30 ° C).
DIFLUCAN 100 mg voor orale suspensie : DIFLUCAN voor orale suspensie wordt als volgt geleverd als een poeder met sinaasappelsmaak om 35 ml per fles te leveren:
NDC 0049-3440-19 Fluconazol 350 mg per fles NDC 0049-3450-19 Fluconazol 1400 mg per fles
Opslag
Bewaar droog poeder onder 86 ° F (30 ° C). Bewaar de gereconstitueerde suspensie tussen 86 °F (30 °C) en 41 °F (5 °C) en gooi de ongebruikte portie na 2 weken weg. Beschermen tegen bevriezing.
Gedistribueerd door: Roerig Division of Pfizer Inc., NY, NY 10017. Herzien: okt 2021
BIJWERKINGEN
DIFLUCAN wordt over het algemeen goed verdragen.
Bij sommige patiënten, met name die met ernstige onderliggende ziekten zoals AIDS en kanker, zijn veranderingen in de resultaten van nier- en hematologische functietests en leverafwijkingen waargenomen tijdens behandeling met fluconazol en vergelijkende middelen, maar de klinische significantie en relatie met de behandeling is onzeker.
Bij patiënten die een enkele dosis voor vaginale candidiasis krijgen
Tijdens vergelijkende klinische onderzoeken in de Verenigde Staten werden 448 patiënten met vaginale candidiasis behandeld met DIFLUCAN, een enkele dosis van 150 mg. De totale incidentie van bijwerkingen die mogelijk verband houden met DIFLUCAN was 26%. Bij 422 patiënten die actieve vergelijkende middelen kregen, was de incidentie 16%. De meest voorkomende behandelingsgerelateerde bijwerkingen die werden gemeld bij de patiënten die 150 mg fluconazol in een enkele dosis voor vaginitis kregen, waren hoofdpijn (13%), misselijkheid (7%) en buikpijn (6%). Andere gemelde bijwerkingen met een incidentie gelijk aan of groter dan 1% waren diarree (3%), dyspepsie (1%), duizeligheid (1%) en smaakperversie (1%). De meeste gemelde bijwerkingen waren licht tot matig van ernst. Zelden zijn angio-oedeem en anafylactische reactie gemeld tijdens marketingervaringen.
Bij patiënten die meerdere doses krijgen voor andere infecties
Zestien procent van de meer dan 4000 patiënten die met DIFLUCAN (fluconazol) werden behandeld in klinische onderzoeken van 7 dagen of meer ondervond bijwerkingen. De behandeling werd stopgezet bij 1,5% van de patiënten vanwege klinische bijwerkingen en bij 1,3% van de patiënten vanwege afwijkingen in laboratoriumtests.
Klinische bijwerkingen werden vaker gemeld bij met hiv geïnfecteerde patiënten (21%) dan bij niet met hiv geïnfecteerde patiënten (13%); de patronen bij HIV-geïnfecteerde en niet-HIV-geïnfecteerde patiënten waren echter vergelijkbaar. Het percentage patiënten dat stopte met de behandeling vanwege klinische bijwerkingen was vergelijkbaar in de twee groepen (1,5%).
De volgende behandelingsgerelateerde klinische bijwerkingen traden op met een incidentie van 1% of meer bij 4048 patiënten die DIFLUCAN 50 mg kregen gedurende 7 of meer dagen in klinische onderzoeken: misselijkheid 3,7%, hoofdpijn 1,9%, huiduitslag 1,8%, braken 1,7%, abdominale pijn 1,7% en diarree 1,5%.
Hepato-Biliaire
In gecombineerde klinische onderzoeken en marketingervaring zijn er zeldzame gevallen geweest van ernstige leverreacties tijdens de behandeling met DIFLUCAN. (Zien WAARSCHUWINGEN .) Het spectrum van deze leverreacties varieerde van milde, voorbijgaande verhogingen van transaminasen tot klinische hepatitis, cholestase en acuut leverfalen, inclusief dodelijke afloop. Gevallen van fatale leverreacties kwamen voornamelijk voor bij patiënten met ernstige onderliggende medische aandoeningen (voornamelijk AIDS of maligniteit) en vaak bij gelijktijdig gebruik van meerdere geneesmiddelen. Voorbijgaande leverreacties, waaronder hepatitis en geelzucht, zijn opgetreden bij patiënten zonder andere identificeerbare risicofactoren. In elk van deze gevallen keerde de leverfunctie terug naar de uitgangswaarde na stopzetting van DIFLUCAN.
In twee vergelijkende onderzoeken die de werkzaamheid van DIFLUCAN voor de onderdrukking van terugval van cryptokokkenmeningitis evalueerden, werd een statistisch significante toename waargenomen in de mediane AST (SGOT)-spiegels van een uitgangswaarde van 30 IE/L tot 41 IE/L in één onderzoek en 34 IE/L tot 66 IE/L in de andere. De totale snelheid van serumtransaminaseverhogingen van meer dan 8 keer de bovengrens van normaal was ongeveer 1% bij met fluconazol behandelde patiënten in klinische onderzoeken. Deze verhogingen traden op bij patiënten met een ernstige onderliggende ziekte, voornamelijk aids of maligniteiten, van wie de meesten meerdere gelijktijdige medicatie kregen, waaronder vele waarvan bekend is dat ze hepatotoxisch zijn. De incidentie van abnormaal verhoogde serumtransaminasen was groter bij patiënten die DIFLUCAN gelijktijdig gebruikten met een of meer van de volgende geneesmiddelen: rifampicine, fenytoïne, isoniazide, valproïnezuur of orale hypoglycemische middelen met sulfonylureumderivaten.
Postmarketingervaring
Daarnaast zijn de volgende bijwerkingen opgetreden tijdens postmarketingervaring.
Immunologisch: In zeldzame gevallen is anafylaxie (waaronder angio-oedeem, gezichtsoedeem en pruritus) gemeld.
Lichaam als geheel: Asthenie, vermoeidheid, koorts, malaise.
Cardiovasculair: QT-verlenging, torsade de pointes. (Zien PREVENTIEVE MAATREGELEN .)
Centraal zenuwstelsel: Toevallen, duizeligheid.
Hematopoëtisch en lymfatisch: Leukopenie, waaronder neutropenie en agranulocytose, trombocytopenie.
Metabolisch: Hypercholesterolemie, hypertriglyceridemie, hypokaliëmie.
Gastro-intestinaal: Cholestase, droge mond, hepatocellulaire schade, dyspepsie, braken.
Andere zintuigen: Smaak perversie.
Musculoskeletaal systeem: spierpijn.
Zenuwstelsel: Slapeloosheid, paresthesie, slaperigheid, tremor, duizeligheid.
Huid en aanhangsels: Acute gegeneraliseerde exanthemateuze pustulosis, geneesmiddeluitbarsting inclusief vaste geneesmiddeluitbarsting, toegenomen zweten, exfoliatieve huidaandoeningen waaronder Stevens-Johnson-syndroom en toxische epidermale necrolyse, geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) (zie WAARSCHUWINGEN ), alopecia.
Bijwerkingen bij kinderen
Het patroon en de incidentie van bijwerkingen en laboratoriumafwijkingen die tijdens pediatrische klinische onderzoeken zijn geregistreerd, zijn vergelijkbaar met die bij volwassenen.
In klinische fase II/III-onderzoeken, uitgevoerd in de Verenigde Staten en in Europa, werden 577 pediatrische patiënten in de leeftijd van 1 dag tot 17 jaar behandeld met DIFLUCAN in doses tot 15 mg/kg/dag gedurende maximaal 1.616 dagen. Dertien procent van de kinderen ondervond aan de behandeling gerelateerde bijwerkingen. De meest gemelde voorvallen waren braken (5%), buikpijn (3%), misselijkheid (2%) en diarree (2%). De behandeling werd stopgezet bij 2,3% van de patiënten vanwege klinische bijwerkingen en bij 1,4% van de patiënten vanwege afwijkingen in laboratoriumtests. De meeste behandelingsgerelateerde laboratoriumafwijkingen waren verhogingen van transaminasen of alkalische fosfatase.
Percentage patiënten met behandelingsgerelateerde bijwerkingen
DRUG-INTERACTIES
(Zien CONTRA-INDICATIES .) Fluconazol is een matige CYP2C9- en CYP3A4-remmer. Fluconazol is ook een sterke remmer van CYP2C19. Patiënten die worden behandeld met DIFLUCAN en die ook gelijktijdig worden behandeld met geneesmiddelen met een smal therapeutisch venster die worden gemetaboliseerd via CYP2C9 en CYP3A4, moeten worden gecontroleerd op bijwerkingen die verband houden met de gelijktijdig toegediende geneesmiddelen. Naast de waargenomen/gedocumenteerde interacties die hieronder worden vermeld, bestaat er een risico op verhoogde plasmaconcentraties van andere verbindingen die worden gemetaboliseerd door CYP2C9, CYP2C19 en CYP3A4 samen met fluconazol. Daarom is voorzichtigheid geboden bij het gebruik van deze combinaties en dienen de patiënten zorgvuldig te worden gecontroleerd. Het enzymremmende effect van fluconazol houdt 4 tot 5 dagen na stopzetting van de behandeling met fluconazol aan vanwege de lange halfwaardetijd van fluconazol. Klinisch of mogelijk significante geneesmiddelinteracties tussen DIFLUCAN 200 mg en de volgende middelen/klassen zijn waargenomen en worden hieronder in meer detail beschreven:
alfentanil
In een onderzoek werd een vermindering van de klaring en het distributievolume waargenomen, evenals een verlenging van de t½ van alfentanil na gelijktijdige behandeling met fluconazol. Een mogelijk werkingsmechanisme is de remming van CYP3A4 door fluconazol. Aanpassing van de dosering van alfentanil kan nodig zijn.
Amiodaron
Gelijktijdige toediening van fluconazol met amiodaron kan de QT-verlenging verhogen. Voorzichtigheid is geboden als gelijktijdig gebruik van fluconazol en amiodaron noodzakelijk is, met name met een hoge dosis fluconazol (800 mg).
Amitriptyline, Nortriptyline
Fluconazol versterkt het effect van amitriptyline en nortriptyline. 5-Nortriptyline en/of S-amitriptyline kunnen worden gemeten bij de start van de combinatietherapie en na 1 week. Indien nodig dient de dosering van amitriptyline/nortriptyline te worden aangepast.
Amfotericine B
Gelijktijdige toediening van fluconazol en amfotericine B aan geïnfecteerde normale en immunosuppressieve muizen toonde de volgende resultaten: een klein additief antischimmeleffect bij systemische infectie met Candida albicans, geen interactie bij intracraniële infectie met Cryptococcus neoformans en antagonisme van de twee geneesmiddelen bij systemische infectie met A fumigatus. De klinische betekenis van de in deze onderzoeken verkregen resultaten is niet bekend.
Azithromycine
Een open-label, gerandomiseerde, drieweg cross-over studie bij 18 gezonde proefpersonen beoordeelde het effect van een enkelvoudige orale dosis van 1200 mg azitromycine op de farmacokinetiek van een enkelvoudige orale dosis van 800 mg fluconazol, evenals de effecten van fluconazol op de farmacokinetiek van azithromycine. Er was geen significante farmacokinetische interactie tussen fluconazol en azitromycine.
Calciumkanaalblokkers
Bepaalde calciumantagonisten (nifedipine, isradipine, amlodipine, verapamil en felodipine) worden gemetaboliseerd door CYP3A4. Fluconazol heeft het potentieel om de systemische blootstelling aan de calciumkanaalantagonisten te verhogen. Frequente controle op bijwerkingen wordt aanbevolen.
Carbamazepine
Fluconazol remt het metabolisme van carbamazepine en er is een stijging van het serumcarbamazepine van 30% waargenomen. Er bestaat een risico op het ontwikkelen van carbamazepine-toxiciteit. Aanpassing van de dosering van carbamazepine kan nodig zijn, afhankelijk van concentratiemetingen/effect.
celecoxib
Tijdens gelijktijdige behandeling met fluconazol (200 mg per dag) en celecoxib (200 mg) namen de Cmax en AUC van celecoxib toe met respectievelijk 68% en 134%. De helft van de celecoxib-dosis kan nodig zijn in combinatie met fluconazol.
Coumarine-type anticoagulantia
De protrombinetijd kan worden verlengd bij patiënten die gelijktijdig DIFLUCAN 150 mg en anticoagulantia van het cumarine-type krijgen. In postmarketingervaring zijn, net als met andere azol-antischimmelmiddelen, bloedingen (blauwe plekken, epistaxis, gastro-intestinale bloedingen, hematurie en melena) gemeld in verband met een toename van de protrombinetijd bij patiënten die fluconazol gelijktijdig met warfarine kregen. Zorgvuldige controle van de protrombinetijd bij patiënten die DIFLUCAN 50 mg en anticoagulantia van het coumarine-type krijgen, wordt aanbevolen. Dosisaanpassing van warfarine kan nodig zijn. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Cyclofosfamide
Combinatietherapie met cyclofosfamide en fluconazol resulteert in een verhoging van serumbilirubine en serumcreatinine. De combinatie kan worden gebruikt met meer aandacht voor het risico op een verhoogd serumbilirubine en serumcreatinine.
Cyclosporine
DIFLUCAN 100 mg verhoogt significant de ciclosporinespiegels bij niertransplantatiepatiënten met of zonder nierfunctiestoornis. Zorgvuldige controle van de ciclosporineconcentraties en serumcreatinine wordt aanbevolen bij patiënten die DIFLUCAN en ciclosporine krijgen. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .) Deze combinatie kan worden gebruikt door de dosering van cyclosporine te verlagen, afhankelijk van de cyclosporineconcentratie.
fentanyl
Er werd één fataal geval van mogelijke interactie tussen fentanyl en fluconazol gemeld. De auteur oordeelde dat de patiënt stierf aan fentanyl-intoxicatie. Verder werd in een gerandomiseerde cross-over studie met 12 gezonde vrijwilligers aangetoond dat fluconazol de eliminatie van fentanyl significant vertraagde. Een verhoogde fentanylconcentratie kan leiden tot ademhalingsdepressie.
HMG-CoA-reductaseremmers
Het risico op myopathie en rabdomyolyse neemt toe wanneer fluconazol gelijktijdig wordt toegediend met HMG-CoA-reductaseremmers die worden gemetaboliseerd via CYP3A4, zoals atorvastatine en simvastatine, of via CYP2C9, zoals fluvastatine. Als gelijktijdige therapie noodzakelijk is, moet de patiënt worden geobserveerd op symptomen van myopathie en rabdomyolyse en moet creatininekinase worden gecontroleerd. HMG-CoA-reductaseremmers moeten worden gestaakt als een duidelijke toename van creatininekinase wordt waargenomen of als myopathie/rabdomyolyse wordt gediagnosticeerd of vermoed.
Hydrochloorthiazide
In een farmacokinetische interactiestudie verhoogde gelijktijdige toediening van meervoudige doses hydrochloorthiazide aan gezonde vrijwilligers die fluconazol kregen de plasmaconcentraties van fluconazol met 40%. Een effect van deze omvang zou geen wijziging van het fluconazol-doseringsschema moeten vereisen bij personen die gelijktijdig diuretica krijgen.
Ibrutinib
Matige remmers van CYP3A4 zoals fluconazol kunnen de plasmaconcentraties van ibrutinib verhogen en het risico op bijwerkingen geassocieerd met ibrutinib verhogen. Als ibrutinib en fluconazol gelijktijdig worden toegediend, verlaag dan de dosis ibrutinib volgens de instructies in de voorschrijfinformatie van ibrutinib en de patiënt moet regelmatig worden gecontroleerd op eventuele bijwerkingen die verband houden met ibrutinib.
Lemborexant
Gelijktijdige toediening van fluconazol verhoogde de Cmax en AUC van lemborexant met respectievelijk ongeveer 1,6- en 4,2-voudig, wat naar verwachting het risico op bijwerkingen, zoals slaperigheid, verhoogt. Vermijd gelijktijdig gebruik van DIFLUCAN met lemborexant.
Losartan
Fluconazol remt het metabolisme van losartan tot zijn actieve metaboliet (E-31 74), die verantwoordelijk is voor het grootste deel van het angiotensine II-receptorantagonisme dat optreedt tijdens de behandeling met losartan. Patiënten dienen hun bloeddruk continu te laten controleren.
methadon
Fluconazol kan de serumconcentratie van methadon verhogen. Aanpassing van de dosering van methadon kan nodig zijn.
Steroïdeloze ontstekingsremmers
De Cmax en AUC van flurbiprofen waren met respectievelijk 23% en 81% verhoogd bij gelijktijdige toediening met fluconazol in vergelijking met toediening van alleen flurbiprofen. Evenzo namen de Cmax en AUC van de farmacologisch actieve isomeer [S-(+)-ibuprofen] toe met respectievelijk 15% en 82% wanneer fluconazol gelijktijdig werd toegediend met racemisch ibuprofen (400 mg) in vergelijking met toediening van alleen racemisch ibuprofen.
Hoewel niet specifiek onderzocht, kan fluconazol de systemische blootstelling verhogen van andere niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) die worden gemetaboliseerd door CYP2C9 (bijv. naproxen, lornoxicam, meloxicam, diclofenac). Frequente controle op bijwerkingen en toxiciteit gerelateerd aan NSAID's wordt aanbevolen. Aanpassing van de dosering van NSAID's kan nodig zijn.
Olaparib
Matige remmers van CYP3A4 zoals fluconazol verhogen de plasmaconcentraties van olaparib; gelijktijdig gebruik wordt niet aanbevolen. Als de combinatie niet kan worden vermeden, verlaag dan de dosis olaparib volgens de instructies in de voorschrijfinformatie van LYNPARZA® (Olaparib).
Orale anticonceptiva
Er zijn twee farmacokinetische onderzoeken met een gecombineerd oraal anticonceptivum uitgevoerd met meerdere doses fluconazol. Er waren geen relevante effecten op de hormoonspiegels in de studie met 50 mg fluconazol, terwijl bij 200 mg per dag de AUC's van ethinylestradiol en levonorgestrel met respectievelijk 40% en 24% waren gestegen. Het is dus onwaarschijnlijk dat het gebruik van meerdere doses fluconazol in deze doses een effect heeft op de werkzaamheid van het gecombineerde orale anticonceptivum.
Orale hypoglykemie
Klinisch significante hypoglykemie kan worden versneld door het gebruik van DIFLUCAN met orale hypoglykemische middelen; één sterfgeval is gemeld door hypoglykemie in verband met gecombineerd gebruik van DIFLUCAN 150 mg en glyburide. DIFLUCAN vermindert het metabolisme van tolbutamide, glyburide en glipizide en verhoogt de plasmaconcentratie van deze middelen. Wanneer DIFLUCAN 100 mg gelijktijdig wordt gebruikt met deze of andere orale hypoglycemische middelen met sulfonylureumderivaten, moeten de bloedglucoseconcentraties zorgvuldig worden gecontroleerd en moet de dosis van het sulfonylureumderivaat zo nodig worden aangepast. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
fenytoïne
DIFLUCAN verhoogt de plasmaconcentraties van fenytoïne. Zorgvuldige controle van de fenytoïneconcentraties bij patiënten die DIFLUCAN 50 mg en fenytoïne krijgen, wordt aanbevolen. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Pimozide
Hoewel het niet in vitro of in vivo is onderzocht, kan gelijktijdige toediening van fluconazol met pimozide leiden tot remming van het pimozidemetabolisme. Verhoogde plasmaconcentraties van pimozide kunnen leiden tot QT-verlenging en zeldzame gevallen van torsade de pointes. Gelijktijdige toediening van fluconazol en pimozide is gecontra-indiceerd.
prednison
Er was een casusrapport dat een met prednison behandelde levertransplantatiepatiënt acute bijnierschorsinsufficiëntie ontwikkelde toen een 3 maanden durende behandeling met fluconazol werd stopgezet. De stopzetting van fluconazol veroorzaakte vermoedelijk een verhoogde CYP3A4-activiteit die leidde tot een verhoogd metabolisme van prednison. Patiënten die langdurig worden behandeld met fluconazol en prednison moeten zorgvuldig worden gecontroleerd op bijnierschorsinsufficiëntie wanneer fluconazol wordt stopgezet.
kinidine
Hoewel niet in vitro of in vivo onderzocht, kan gelijktijdige toediening van fluconazol met kinidine leiden tot remming van het kinidinemetabolisme. Het gebruik van kinidine is in verband gebracht met QT-verlenging en zeldzame gevallen van torsade de pointes. Gelijktijdige toediening van fluconazol en kinidine is gecontra-indiceerd. (Zien CONTRA-INDICATIES .)
Rifabutine
Er zijn meldingen geweest dat er een interactie bestaat wanneer fluconazol gelijktijdig met rifabutine wordt toegediend, wat leidt tot verhoogde serumspiegels van rifabutine tot 80%. Er zijn meldingen geweest van uveïtis bij patiënten aan wie fluconazol en rifabutine gelijktijdig werden toegediend. Patiënten die gelijktijdig rifabutine en fluconazol krijgen, moeten zorgvuldig worden gecontroleerd. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
rifampicijn
Rifampicine verhoogt het metabolisme van gelijktijdig toegediend DIFLUCAN. Afhankelijk van de klinische omstandigheden moet worden overwogen om de dosis DIFLUCAN 200 mg te verhogen wanneer het wordt toegediend met rifampicine. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Saquinavir
Fluconazol verhoogt de AUC van saquinavir met ongeveer 50%, de Cmax met ongeveer 55% en verlaagt de klaring van saquinavir met ongeveer 50% als gevolg van remming van het levermetabolisme van saquinavir door CYP3A4 en remming van P-glycoproteïne. Aanpassing van de dosering van saquinavir kan nodig zijn.
Kortwerkende benzodiazepinen
Na orale toediening van midazolam resulteerde fluconazol in aanzienlijke verhogingen van de midazolamconcentraties en psychomotorische effecten. Dit effect op midazolam lijkt meer uitgesproken te zijn na orale toediening van fluconazol dan bij intraveneuze toediening van fluconazol. Als kortwerkende benzodiazepinen, die worden gemetaboliseerd door het cytochroom P450-systeem, gelijktijdig worden toegediend met fluconazol, moet worden overwogen de dosering van de benzodiazepines te verlagen en moeten de patiënten adequaat worden gecontroleerd. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Sirolimus
Fluconazol verhoogt de plasmaconcentraties van sirolimus vermoedelijk door remming van het metabolisme van sirolimus via CYP3A4 en P-glycoproteïne. Deze combinatie kan worden gebruikt met een dosisaanpassing van sirolimus afhankelijk van de effect-/concentratiemetingen.
Tacrolimus
Fluconazol kan de serumconcentraties van oraal toegediende tacrolimus tot 5 keer verhogen als gevolg van remming van het tacrolimusmetabolisme via CYP3A4 in de darmen. Er zijn geen significante farmacokinetische veranderingen waargenomen bij intraveneuze toediening van tacrolimus. Verhoogde tacrolimusspiegels zijn in verband gebracht met nefrotoxiciteit. De dosering van oraal toegediende tacrolimus dient te worden verlaagd afhankelijk van de tacrolimusconcentratie. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
theofylline
DIFLUCAN 50 mg verhoogt de serumconcentraties van theofylline. Zorgvuldige controle van de serumtheofyllineconcentraties bij patiënten die DIFLUCAN 100 mg en theofylline krijgen, wordt aanbevolen. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Tofacitinib
Systemische blootstelling aan tofacitinib is verhoogd wanneer tofacitinib gelijktijdig met fluconazol wordt toegediend. Verlaag de dosis tofacitinib bij gelijktijdige toediening met fluconazol (dwz van 5 mg tweemaal daags naar 5 mg eenmaal daags volgens de instructies op het etiket van XELJANZ [tofacitinib]). (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Tolvaptan
Plasmablootstelling aan tolvaptan is significant verhoogd (200% in AUC; 80% in Cmax) wanneer tolvaptan, een CYP3A4-substraat, gelijktijdig wordt toegediend met fluconazol, een matige CYP3A4-remmer. Deze interactie kan resulteren in het risico van een significante toename van bijwerkingen geassocieerd met tolvaptan, met name significante diurese, dehydratie en acuut nierfalen. Als tolvaptan en fluconazol gelijktijdig worden toegediend, moet de dosis tolvaptan worden verlaagd zoals aangegeven in de voorschrijfinformatie van tolvaptan en moet de patiënt regelmatig worden gecontroleerd op eventuele bijwerkingen die verband houden met tolvaptan.
triazolam
Fluconazol verhoogt de AUC van triazolam (enkele dosis) met ongeveer 50%, de Cmax met 20% tot 32% en verhoogt de t½ met 25% tot 50% als gevolg van de remming van het metabolisme van triazolam. Dosisaanpassingen van triazolam kunnen nodig zijn.
Vinca Alkaloïden
Hoewel niet onderzocht, kan fluconazol de plasmaspiegels van de vinca-alkaloïden (bijv. vincristine en vinblastine) verhogen en leiden tot neurotoxiciteit, wat mogelijk te wijten is aan een remmend effect op CYP3A4.
Vitamine A
Op basis van een casusrapport bij één patiënt die een combinatietherapie kreeg met all-trans-retinoïdezuur (een zuurvorm van vitamine A) en fluconazol, hebben zich aan het centraal zenuwstelsel (CZS) gerelateerde bijwerkingen ontwikkeld in de vorm van pseudotumor cerebri, die verdwenen na stopzetting van de fluconazolbehandeling. Deze combinatie kan worden gebruikt, maar houd rekening met de incidentie van CZS-gerelateerde bijwerkingen.
Voriconazol
Vermijd gelijktijdige toediening van voriconazol en fluconazol. Monitoring op bijwerkingen en toxiciteit gerelateerd aan voriconazol wordt aanbevolen; vooral als met voriconazol wordt gestart binnen 24 uur na de laatste dosis fluconazol. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies .)
Zidovudine
Fluconazol verhoogt de Cmax en AUC van zidovudine met respectievelijk 84% en 74% als gevolg van een afname van ongeveer 45% van de orale zidovudineklaring. De halfwaardetijd van zidovudine was eveneens verlengd met ongeveer 128% na combinatietherapie met fluconazol. Patiënten die deze combinatie krijgen, moeten worden gecontroleerd op de ontwikkeling van zidovudine-gerelateerde bijwerkingen. Dosisverlaging van zidovudine kan worden overwogen.

Artsen moeten zich ervan bewust zijn dat er geen interactiestudies zijn uitgevoerd met andere geneesmiddelen dan die vermeld in de rubriek KLINISCHE FARMACOLOGIE, maar dergelijke interacties kunnen optreden.
WAARSCHUWINGEN
PREVENTIEVE MAATREGELEN
Algemeen
Sommige azolen, waaronder fluconazol, zijn in verband gebracht met verlenging van het QT-interval op het elektrocardiogram. Fluconazol veroorzaakt QT-verlenging door remming van de gelijkrichter-kaliumkanaalstroom (Ikr). De QT-verlenging veroorzaakt door andere geneesmiddelen (zoals amiodaron) kan worden versterkt door de remming van cytochroom P450 (CYP) 3A4. (Zien PREVENTIEVE MAATREGELEN : Geneesmiddelinteracties .) Tijdens postmarketingsurveillance zijn er zeldzame gevallen geweest van QT-verlenging en torsade de pointes bij patiënten die fluconazol gebruikten. De meeste van deze meldingen hadden betrekking op ernstig zieke patiënten met meerdere verstorende risicofactoren, zoals structurele hartziekte, elektrolytafwijkingen en gelijktijdige medicatie die hieraan heeft bijgedragen. Patiënten met hypokaliëmie en gevorderd hartfalen hebben een verhoogd risico op het optreden van levensbedreigende ventriculaire aritmieën en torsade de pointes.
Fluconazol dient met voorzichtigheid te worden toegediend aan patiënten met deze mogelijk pro-aritmische aandoeningen.
Gelijktijdig gebruik van fluconazol en erytromycine kan het risico op cardiotoxiciteit (verlengd QT-interval, torsade de pointes) en bijgevolg plotselinge hartdood verhogen. Deze combinatie moet worden vermeden.
Fluconazol dient met voorzichtigheid te worden toegediend aan patiënten met nierfunctiestoornissen.
Bijnierinsufficiëntie is gemeld bij patiënten die azolen kregen, waaronder fluconazol. Omkeerbare gevallen van bijnierinsufficiëntie zijn gemeld bij patiënten die fluconazol kregen.
DIFLUCAN 100 mg poeder voor orale suspensie bevat sucrose en mag niet worden gebruikt bij patiënten met erfelijke fructose, glucose/galactose malabsorptie en sucrase-isomaltasedeficiëntie.
Bij het besturen van voertuigen of het bedienen van machines moet er rekening mee worden gehouden dat af en toe duizeligheid of toevallen kunnen optreden.
Enkele dosis
Het gemak en de werkzaamheid van het orale fluconazol-schema met een enkele dosis voor de behandeling van vaginale schimmelinfecties moet worden afgewogen tegen de aanvaardbaarheid van een hogere incidentie van geneesmiddelgerelateerde bijwerkingen met DIFLUCAN (26%) versus intravaginale middelen (16%) in de VS. vergelijkende klinische studies. (Zien ONGEWENSTE REACTIES en Klinische studies .)
Niet-klinische toxicologie
Carcinogenese, mutagenese en verminderde vruchtbaarheid
Fluconazol vertoonde geen bewijs van carcinogeen potentieel bij muizen en ratten die gedurende 24 maanden oraal werden behandeld met doses van 2,5 mg/kg/dag, 5 mg/kg/dag of 10 mg/kg/dag (ongeveer 2 tot 7 maal de aanbevolen dosis voor de mens ). Mannelijke ratten die werden behandeld met 5 mg/kg/dag en 10 mg/kg/dag hadden een verhoogde incidentie van hepatocellulaire adenomen.
Fluconazol, met of zonder metabolische activering, was negatief in tests voor mutageniteit in vier stammen van S. typhimurium en in het muizenlymfoom L5178Y-systeem. Cytogenetische studies in vivo (muizen beenmergcellen, na orale toediening van fluconazol) en in vitro (menselijke lymfocyten blootgesteld aan fluconazol bij 1000 mcg/ml) toonden geen bewijs van chromosomale mutaties.
Fluconazol had geen invloed op de vruchtbaarheid van mannelijke of vrouwelijke ratten die oraal werden behandeld met dagelijkse doses van 5 mg/kg, 10 mg/kg of 20 mg/kg of met parenterale doses van 5 mg/kg, 25 mg/kg of 75 mg /kg, hoewel het begin van de partus enigszins vertraagd was bij 20 mg/kg PO. In een intraveneuze perinatale studie bij ratten bij 5 mg/kg, 20 mg/kg en 40 mg/kg werden dystokie en verlenging van de partus waargenomen bij enkele moederdieren bij 20 mg/kg (ongeveer 5 tot 15 maal de aanbevolen dosis voor mensen ) en 40 mg/kg, maar niet bij 5 mg/kg. De verstoringen in de partus werden weerspiegeld door een lichte toename van het aantal doodgeboren jongen en een afname van de neonatale overleving bij deze dosisniveaus. De effecten op de partus bij ratten komen overeen met de soortspecifieke oestrogeenverlagende eigenschap die wordt geproduceerd door hoge doses fluconazol. Een dergelijke hormoonverandering is niet waargenomen bij vrouwen die met fluconazol werden behandeld. (Zien KLINISCHE FARMACOLOGIE .)
Zwangerschap
Teratogene effecten
Potentieel voor foetale schade
Gebruik tijdens de zwangerschap moet worden vermeden, behalve bij patiënten met ernstige of mogelijk levensbedreigende schimmelinfecties bij wie fluconazol kan worden gebruikt als het verwachte voordeel opweegt tegen het mogelijke risico voor de foetus. Enkele gepubliceerde casusrapporten beschrijven een patroon van duidelijke aangeboren afwijkingen bij zuigelingen die in utero zijn blootgesteld aan hoge doses fluconazol van de moeder (400 tot 800 mg/dag) gedurende het grootste deel of het hele eerste trimester. Deze gemelde afwijkingen zijn vergelijkbaar met die in dierstudies. Effectieve anticonceptiemaatregelen moeten worden overwogen bij vrouwen in de vruchtbare leeftijd die worden behandeld met DIFLUCAN 400 tot 800 mg/dag en moeten worden voortgezet gedurende de hele behandelingsperiode en gedurende ongeveer 1 week (5 tot 6 halfwaardetijden) na de laatste dosis. Als DIFLUCAN tijdens de zwangerschap wordt gebruikt of als de patiënte zwanger wordt tijdens het gebruik van het geneesmiddel, moet de patiënt worden geïnformeerd over het mogelijke gevaar voor de foetus. Op basis van retrospectieve epidemiologische onderzoeken zijn spontane abortussen en aangeboren afwijkingen gesuggereerd als mogelijke risico's van 150 mg fluconazol als enkelvoudige of herhaalde dosis in het eerste trimester van de zwangerschap. Er zijn geen adequate en goed gecontroleerde onderzoeken met DIFLUCAN 150 mg bij zwangere vrouwen. (Zien WAARSCHUWINGEN : Potentieel voor foetale schade .)
Menselijke gegevens
Casusrapporten beschrijven een onderscheidend en zeldzaam patroon van geboorteafwijkingen bij zuigelingen van wie de moeder een hoge dosis (400 tot 800 mg/dag) fluconazol heeft gekregen gedurende het grootste deel van of het hele eerste trimester van de zwangerschap. De kenmerken die bij deze zuigelingen worden waargenomen, zijn onder meer brachycefalie, abnormaal gelaat, abnormale ontwikkeling van de calvaria, gespleten gehemelte, femurbuiging, dunne ribben en lange botten, artrogryposis en aangeboren hartaandoeningen. Deze effecten zijn vergelijkbaar met die in dierstudies.
Epidemiologische onderzoeken wijzen op een mogelijk risico op spontane abortus en aangeboren afwijkingen bij zuigelingen van wie de moeder in het eerste trimester met 150 mg fluconazol als eenmalige of herhaalde dosis is behandeld, maar deze epidemiologische onderzoeken hebben beperkingen en deze bevindingen zijn niet bevestigd in gecontroleerde klinische onderzoeken. proeven.
Dierlijke gegevens
Fluconazol werd oraal toegediend aan drachtige konijnen tijdens de organogenese in twee onderzoeken in doses van respectievelijk 5 mg/kg, 10 mg/kg en 20 mg/kg en 5 mg/kg, 25 mg/kg en 75 mg/kg. De gewichtstoename van de moeder was verminderd bij alle dosisniveaus (ongeveer 0,25 tot 4 maal de klinische dosis van 400 mg op basis van vergelijking van het lichaamsoppervlak [BSA]), en abortussen traden op bij 75 mg/kg (ongeveer 4 maal de klinische dosis van 400 mg op basis van BSA); er werden geen nadelige foetale effecten waargenomen.
In verschillende onderzoeken waarbij zwangere ratten fluconazol oraal kregen tijdens de organogenese, was de gewichtstoename van de moeder verminderd en nam het gewicht van de placenta toe met 25 mg/kg. Er waren geen foetale effecten bij 5 mg/kg of 10 mg/kg; toename van foetale anatomische varianten (overtollige ribben, nierbekkendilatatie) en vertragingen in ossificatie werden waargenomen bij doses van 25 mg/kg en 50 mg/kg en hoger. Bij doses variërend van 80 tot 320 mg/kg (ongeveer 2 tot 8 maal de klinische dosis van 400 mg op basis van lichaamsoppervlakte), was de embryoletaliteit bij ratten verhoogd en foetale afwijkingen omvatten golvende ribben, gespleten gehemelte en abnormale craniofaciale ossificatie. Deze effecten komen overeen met de remming van de oestrogeensynthese bij ratten en kunnen het gevolg zijn van bekende effecten van verlaagd oestrogeen op zwangerschap, organogenese en bevalling.
Moeders die borstvoeding geven
Fluconazol was in lage concentraties aanwezig in de moedermelk na toediening van een enkelvoudige dosis van 150 mg, gebaseerd op gegevens van een onderzoek bij 10 vrouwen die borstvoeding gaven en die tijdelijk of permanent stopten met borstvoeding 5 dagen tot 19 maanden postpartum. De geschatte dagelijkse zuigelingendosis fluconazol uit moedermelk (uitgaande van een gemiddelde melkconsumptie van 150 ml/kg/dag) op basis van de gemiddelde piekmelkconcentratie (2,61 mcg/ml [bereik: 1,57 tot 3,65 mcg/ml] 5,2 uur na dosis) was 0,39 mg/kg/dag, wat ongeveer 13% is van de aanbevolen pediatrische dosis voor orofaryngeale candidiasis. (Gelabelde pediatrische dosis is 6 mg/kg/dag op de eerste dag gevolgd door 3 mg/kg/dag; geschatte zuigelingendosis is 13% van de onderhoudsdosis van 3 mg/kg/dag). Er zijn geen gegevens over fluconazolspiegels in melk na herhaald gebruik of na een hoge dosis fluconazol. Een gepubliceerd onderzoek onder 96 vrouwen die borstvoeding gaven en die werden behandeld met 150 mg fluconazol om de andere dag (gemiddeld 7,3 capsules [bereik 1 tot 29 capsules]) voor lactatiegerelateerde candida van de borsten, rapporteerde geen ernstige bijwerkingen bij zuigelingen. Voorzichtigheid is geboden wanneer DIFLUCAN wordt toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
Een open-label, gerandomiseerde, gecontroleerde studie heeft aangetoond dat DIFLUCAN 100 mg effectief is bij de behandeling van orofaryngeale candidiasis bij kinderen van 6 maanden tot 13 jaar. (Zien Klinische studies .)
Het gebruik van DIFLUCAN 200 mg bij kinderen met cryptokokkenmeningitis, Candida-oesofagitis of systemische Candida-infecties wordt ondersteund door de werkzaamheid die is aangetoond voor deze indicaties bij volwassenen en door de resultaten van verschillende kleine niet-vergelijkende klinische onderzoeken bij kinderen. Daarnaast zijn farmacokinetische studies bij kinderen (zie: KLINISCHE FARMACOLOGIE ) hebben een dosisproportionaliteit tussen kinderen en volwassenen vastgesteld. (Zien DOSERING EN ADMINISTRATIE .)
In een niet-vergelijkende studie bij kinderen met ernstige systemische schimmelinfecties, waarvan de meeste candidemie waren, was de werkzaamheid van DIFLUCAN vergelijkbaar met die gerapporteerd voor de behandeling van candidemie bij volwassenen. Van de 17 proefpersonen met door kweek bevestigde candidemie, waren 11 van de 14 (79%) met symptomen op baseline (3 waren asymptomatisch) klinisch genezen; 13/15 (87%) van de evalueerbare patiënten had een mycologische genezing aan het einde van de behandeling, maar twee van deze patiënten hervielen respectievelijk 10 en 18 dagen na stopzetting van de therapie.
De werkzaamheid van DIFLUCAN voor de onderdrukking van cryptokokkenmeningitis was succesvol bij 4 van de 5 kinderen die werden behandeld in een 'compassionate-use'-studie met fluconazol voor de behandeling van levensbedreigende of ernstige mycose. Er is geen informatie over de werkzaamheid van fluconazol voor de primaire behandeling van cryptokokkenmeningitis bij kinderen.
Het veiligheidsprofiel van DIFLUCAN 200 mg bij kinderen is onderzocht bij 577 kinderen in de leeftijd van 1 dag tot 17 jaar die doses kregen variërend van 1 tot 15 mg/kg/dag gedurende 1 tot 1.616 dagen. (Zien ONGEWENSTE REACTIES .)
De werkzaamheid van DIFLUCAN is niet vastgesteld bij zuigelingen jonger dan 6 maanden. (Zien KLINISCHE FARMACOLOGIE .) Een klein aantal patiënten (29) variërend in leeftijd van 1 dag tot 6 maanden is veilig behandeld met DIFLUCAN.
Geriatrisch gebruik
Bij niet-aidspatiënten werden bijwerkingen gemeld die mogelijk verband hielden met de behandeling met fluconazol bij minder patiënten van 65 jaar en ouder (9%, n = 339) dan bij jongere patiënten (14%, n = 2240). Er was echter geen consistent verschil tussen de oudere en jongere patiënten met betrekking tot individuele bijwerkingen. Van de meest gemelde (>1%) bijwerkingen, kwamen huiduitslag, braken en diarree voor bij grotere aantallen oudere patiënten. Een vergelijkbaar percentage van oudere patiënten (2,4%) en jongere patiënten (1,5%) stopte met de behandeling met fluconazol vanwege bijwerkingen. Tijdens postmarketingervaring kwamen spontane meldingen van anemie en acuut nierfalen vaker voor bij patiënten van 65 jaar of ouder dan bij patiënten tussen 12 en 65 jaar. Vanwege het vrijwillige karakter van de meldingen en de natuurlijke toename van de incidentie van bloedarmoede en nierfalen bij ouderen, is het echter niet mogelijk om een causaal verband met blootstelling aan geneesmiddelen vast te stellen.
Gecontroleerde klinische onderzoeken met fluconazol omvatten niet voldoende aantallen patiënten van 65 jaar en ouder om te beoordelen of zij voor elke indicatie anders reageren dan jongere patiënten. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond.
Fluconazol wordt voornamelijk geklaard door renale excretie als onveranderd geneesmiddel. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet de dosis worden aangepast op basis van de creatinineklaring. Het kan nuttig zijn om de nierfunctie te controleren. (Zien KLINISCHE FARMACOLOGIE en DOSERING EN ADMINISTRATIE .)
OVERDOSERING
Er zijn meldingen geweest van overdosering met fluconazol die gepaard ging met hallucinaties en paranoïde gedrag.
In geval van overdosering moet een symptomatische behandeling (met ondersteunende maatregelen en maagspoeling indien klinisch geïndiceerd) worden ingesteld.
Fluconazol wordt grotendeels uitgescheiden in de urine. Een hemodialysesessie van 3 uur verlaagt de plasmaspiegels met ongeveer 50%.
Bij muizen en ratten die zeer hoge doses fluconazol kregen, omvatten de klinische effecten bij beide soorten verminderde motiliteit en ademhaling, ptosis, tranenvloed, speekselvloed, urine-incontinentie, verlies van oprichtreflex en cyanose; de dood werd soms voorafgegaan door clonische convulsies.
CONTRA-INDICATIES
DIFLUCAN (fluconazol) is gecontra-indiceerd bij patiënten die overgevoelig zijn gebleken voor fluconazol of voor een van de hulpstoffen. Er is geen informatie over kruisovergevoeligheid tussen fluconazol en andere azol-antischimmelmiddelen. Voorzichtigheid is geboden bij het voorschrijven van DIFLUCAN aan patiënten met overgevoeligheid voor andere azolen. Gelijktijdige toediening van andere geneesmiddelen waarvan bekend is dat ze het QT-interval verlengen en die worden gemetaboliseerd via het enzym CYP3A4, zoals erytromycine, pimozide en kinidine, is gecontra-indiceerd bij patiënten die fluconazol krijgen. (Zien KLINISCHE FARMACOLOGIE : Geneesmiddelinteractiestudies en PREVENTIEVE MAATREGELEN .)
KLINISCHE FARMACOLOGIE
Farmacokinetiek en metabolisme
De farmacokinetische eigenschappen van fluconazol zijn vergelijkbaar na intraveneuze of orale toediening. Bij normale vrijwilligers is de biologische beschikbaarheid van oraal toegediend fluconazol meer dan 90% in vergelijking met intraveneuze toediening. Bio-equivalentie werd vastgesteld tussen de tablet van 100 mg en beide suspensies bij toediening als een enkelvoudige dosis van 200 mg.
Piekplasmaconcentraties (Cmax) bij nuchtere, normale vrijwilligers treden op tussen 1 en 2 uur met een terminale plasma-eliminatiehalfwaardetijd van ongeveer 30 uur (bereik: 20 tot 50 uur) na orale toediening.
Bij nuchtere, normale vrijwilligers leidt toediening van een enkelvoudige orale dosis van 400 mg DIFLUCAN (fluconazol) tot een gemiddelde Cmax van 6,72 mcg/ml (bereik: 4,12 tot 8,08 mcg/ml) en na enkelvoudige orale doses van 50 tot 400 mg fluconazol plasmaconcentraties en oppervlakte onder de plasmaconcentratie-tijdcurve (AUC) zijn dosisproportioneel.
De Cmax- en AUC-gegevens van een voedseleffectonderzoek waarbij DIFLUCAN (fluconazol) tabletten werden toegediend aan gezonde vrijwilligers onder nuchtere omstandigheden en met een vetrijke maaltijd, gaven aan dat blootstelling aan het geneesmiddel niet wordt beïnvloed door voedsel. Daarom kan DIFLUCAN worden ingenomen zonder rekening te houden met maaltijden. (Zien DOSERING EN ADMINISTRATIE .)
Steady-state concentraties worden bereikt binnen 5 tot 10 dagen na orale doses van 50 tot 400 mg eenmaal daags. Toediening van een oplaaddosis (op dag 1) van tweemaal de gebruikelijke dagelijkse dosis resulteert in plasmaconcentraties die op de tweede dag dicht bij de steady-state liggen. Het schijnbare distributievolume van fluconazol benadert dat van het totale lichaamswater. De plasma-eiwitbinding is laag (11 tot 12%). Na enkelvoudige of meervoudige orale doses gedurende maximaal 14 dagen dringt fluconazol door in alle onderzochte lichaamsvloeistoffen (zie tabel hieronder ). Bij normale vrijwilligers waren de speekselconcentraties van fluconazol gelijk aan of iets hoger dan de plasmaconcentraties, ongeacht de dosis, route of duur van de dosering. Bij patiënten met bronchiëctasie waren de sputumconcentraties van fluconazol na een enkelvoudige orale dosis van 150 mg zowel 4 als 24 uur na de dosis gelijk aan de plasmaconcentraties. Bij patiënten met schimmelmeningitis zijn de fluconazolconcentraties in de cerebrospinale vloeistof (CSF) ongeveer 80% van de overeenkomstige plasmaconcentraties.
Een enkelvoudige orale dosis van 150 mg fluconazol toegediend aan 27 patiënten drong door in het vaginale weefsel, resulterend in weefsel:plasmaverhoudingen variërend van 0,94 tot 1,14 gedurende de eerste 48 uur na toediening.
Een enkelvoudige orale dosis van 150 mg fluconazol toegediend aan 14 patiënten drong door in vaginaal vocht, resulterend in een vloeistof:plasmaverhouding variërend van 0,36 tot 0,71 gedurende de eerste 72 uur na toediening.
Bij normale vrijwilligers wordt fluconazol voornamelijk geklaard door uitscheiding via de nieren, waarbij ongeveer 80% van de toegediende dosis als onveranderd geneesmiddel in de urine verschijnt. Ongeveer 11% van de dosis wordt als metabolieten in de urine uitgescheiden.
De farmacokinetiek van fluconazol wordt duidelijk beïnvloed door een verminderde nierfunctie. Er is een omgekeerd verband tussen de eliminatiehalfwaardetijd en de creatinineklaring. De dosis DIFLUCAN moet mogelijk worden verlaagd bij patiënten met een verminderde nierfunctie. (Zien DOSERING EN ADMINISTRATIE .) Een hemodialysesessie van 3 uur verlaagt de plasmaconcentraties met ongeveer 50%.
Bij normale vrijwilligers ging de toediening van DIFLUCAN (doses variërend van 200 mg tot 400 mg eenmaal daags gedurende maximaal 14 dagen) gepaard met kleine en inconsistente effecten op de testosteronconcentraties, endogene corticosteroïdconcentraties en de door adrenocorticotroop hormoon (ACTH) gestimuleerde cortisolrespons.
Farmacokinetiek bij kinderen
Bij kinderen zijn de volgende farmacokinetische gegevens {Gemiddelde (%cv)} gemeld:
De voor lichaamsgewicht gecorrigeerde klaring werd in deze onderzoeken niet beïnvloed door leeftijd. De gemiddelde lichaamsklaring bij volwassenen is naar verluidt 0,23 (17%) ml/min/kg.
Bij premature pasgeborenen (zwangerschapsduur 26 tot 29 weken) was de gemiddelde (%cv) klaring binnen 36 uur na de geboorte 0,180 (35%, N=7) ml/min/kg, die met de tijd toenam tot een gemiddelde van 0,218 ( 31%, N=9) ml/min/kg zes dagen later en 0,333 (56%, N=4) ml/min/kg 12 dagen later. Evenzo was de halfwaardetijd 73,6 uur, die na verloop van tijd afnam tot gemiddeld 53,2 uur zes dagen later en 46,6 uur 12 dagen later.
Farmacokinetiek bij ouderen
Er werd een farmacokinetisch onderzoek uitgevoerd bij 22 proefpersonen van 65 jaar of ouder die een enkelvoudige orale dosis fluconazol van 50 mg kregen. Tien van deze patiënten kregen gelijktijdig diuretica. De Cmax was 1,54 mcg/ml en trad op 1,3 uur na de dosis. De gemiddelde AUC was 76,4 ± 20,3 mcg•h/ml en de gemiddelde terminale halfwaardetijd was 46,2 uur. Deze farmacokinetische parameterwaarden zijn hoger dan analoge waarden gerapporteerd voor normale jonge mannelijke vrijwilligers. Gelijktijdige toediening van diuretica veranderde de AUC of Cmax niet significant. Bovendien waren de creatinineklaring (74 ml/min), het percentage geneesmiddel dat onveranderd in de urine werd teruggevonden (0 tot 24 uur, 22%) en de schattingen van de nierklaring van fluconazol (0,124 ml/min/kg) voor ouderen over het algemeen lager. dan die van jongere vrijwilligers. De verandering in de dispositie van fluconazol bij ouderen lijkt dus verband te houden met een verminderde nierfunctie die kenmerkend is voor deze groep. Een grafiek van de terminale eliminatiehalfwaardetijd van elke proefpersoon versus de creatinineklaring vergeleken met de voorspelde halfwaardetijd - creatinineklaringscurve afgeleid van normale proefpersonen en proefpersonen met verschillende gradaties van nierinsufficiëntie gaf aan dat 21 van de 22 proefpersonen binnen de 95%-betrouwbaarheidslimiet van de voorspelde halfwaardetijd-creatinineklaringscurven. Deze resultaten komen overeen met de hypothese dat hogere waarden voor de farmacokinetische parameters waargenomen bij oudere proefpersonen in vergelijking met normale jonge mannelijke vrijwilligers te wijten zijn aan de verminderde nierfunctie die bij ouderen wordt verwacht.
Geneesmiddelinteractiestudies
(Zien DRUG-INTERACTIES )
Orale anticonceptiva
Orale anticonceptiva werden toegediend als een enkele dosis zowel voor als na de orale toediening van DIFLUCAN 50 mg eenmaal daags gedurende 10 dagen bij 10 gezonde vrouwen. Er was geen significant verschil in de AUC van ethinylestradiol of levonorgestrel na toediening van 50 mg DIFLUCAN. De gemiddelde stijging van de AUC van ethinylestradiol was 6% (spreiding: -47 tot 108%) en de AUC van levonorgestrel nam toe met 17% (spreiding: -33 tot 141%).
In een tweede onderzoek kregen vijfentwintig normale vrouwen dagelijkse doses van zowel 200 mg DIFLUCAN 150 mg tabletten als placebo gedurende twee perioden van tien dagen. De behandelingscycli waren één maand uit elkaar, waarbij alle proefpersonen DIFLUCAN kregen tijdens de ene cyclus en placebo tijdens de andere. De volgorde van de onderzoeksbehandeling was willekeurig. Op de laatste behandelingsdag (dag 10) van beide cycli werden enkelvoudige doses van een orale anticonceptietablet met levonorgestrel en ethinylestradiol toegediend. Na toediening van 200 mg DIFLUCAN was de gemiddelde procentuele stijging van de AUC voor levonorgestrel vergeleken met placebo 25% (spreiding: -12 tot 82%) en de gemiddelde procentuele stijging voor ethinylestradiol in vergelijking met placebo was 38% (spreiding: –11 tot 101%). Beide verhogingen waren statistisch significant verschillend van placebo.
Een derde studie evalueerde de mogelijke interactie van een wekelijkse dosering van 300 mg fluconazol aan 21 normale vrouwen die een oraal anticonceptivum gebruiken dat ethinylestradiol en norethindron bevat. In dit placebogecontroleerde, dubbelblinde, gerandomiseerde, tweeweg-crossover-onderzoek, uitgevoerd over drie cycli van orale anticonceptiebehandeling, resulteerde de dosering van fluconazol in kleine verhogingen van de gemiddelde AUC's van ethinylestradiol en norethindron in vergelijking met vergelijkbare placebodosering. De gemiddelde AUC's van ethinylestradiol en norethindron namen toe met respectievelijk 24% (95% BI-bereik: 18 tot 31%) en 13% (95% CI-bereik: 8 tot 18%), vergeleken met placebo. Behandeling met fluconazol veroorzaakte bij geen enkele individuele proefpersoon in dit onderzoek een verlaging van de AUC van ethinylestradiol in vergelijking met dosering met placebo. De individuele AUC-waarden van norethindron daalden zeer licht (
cimetidine
DIFLUCAN 100 mg werd toegediend als een enkele orale dosis alleen en twee uur na een enkele dosis cimetidine 400 mg aan zes gezonde mannelijke vrijwilligers. Na toediening van cimetidine was er een significante afname van de AUC en Cmax van fluconazol. Er was een gemiddelde ± SD-afname van de AUC van fluconazol van 13% ± 11% (bereik: -3,4 tot -31%) en de Cmax nam af met 19% ± 14% (bereik: -5 tot -40 %). Echter, de intraveneuze toediening van cimetidine 600 mg tot 900 mg gedurende een periode van vier uur (van één uur vóór tot 3 uur na een enkelvoudige orale dosis DIFLUCAN 200 mg) had geen invloed op de biologische beschikbaarheid of farmacokinetiek van fluconazol bij 24 gezonde mannelijke vrijwilligers. .
maagzuurremmer
Toediening van Maalox® (20 ml) aan 14 normale mannelijke vrijwilligers onmiddellijk voorafgaand aan een enkele dosis DIFLUCAN 100 mg had geen effect op de absorptie of eliminatie van fluconazol.
Hydrochloorthiazide
Gelijktijdige orale toediening van 100 mg DIFLUCAN en 50 mg hydrochloorthiazide gedurende 10 dagen bij 13 normale vrijwilligers resulteerde in een significante verhoging van de AUC en Cmax van fluconazol in vergelijking met alleen DIFLUCAN. Er was een gemiddelde ± SD toename van de AUC en Cmax van fluconazol van respectievelijk 45% ± 31% (bereik: 19 tot 114%) en 43% ± 31% (bereik: 19 tot 122%). Deze veranderingen worden toegeschreven aan een gemiddelde ± SD verlaging van de renale klaring van 30% ± 12% (bereik: –10 tot –50%).
rifampicijn
Toediening van een enkelvoudige orale dosis van 200 mg DIFLUCAN 200 mg na 15 dagen rifampicine, toegediend als 600 mg per dag aan acht gezonde mannelijke vrijwilligers, resulteerde in een significante afname van de AUC van fluconazol en een significante toename van de schijnbare orale klaring van fluconazol. Er was een gemiddelde ± SD-verlaging van de AUC van fluconazol van 23% ± 9% (bereik: -13 tot -42%). De schijnbare orale klaring van fluconazol nam toe met 32% ± 17% (bereik: 16 tot 72%). De halfwaardetijd van fluconazol nam af van 33,4 ± 4,4 uur tot 26,8 ± 3,9 uur. (Zien PREVENTIEVE MAATREGELEN .)
Warfarine
Er was een significante toename van de protrombinetijdrespons (gebied onder de protrombinetijd-curve) na een enkele dosis warfarine (15 mg) toegediend aan 13 normale mannelijke vrijwilligers na orale DIFLUCAN 200 mg dagelijks toegediend gedurende 14 dagen in vergelijking met de toediening van warfarine alleen. Er was een gemiddelde ± SD toename in de protrombinetijdrespons (gebied onder de protrombinetijd-tijdcurve) van 7% ± 4% (bereik: -2 tot 13%). (Zien PREVENTIEVE MAATREGELEN .) Het gemiddelde is gebaseerd op gegevens van 12 proefpersonen, aangezien een van de 13 proefpersonen een 2-voudige toename van zijn protrombinetijdrespons ervoer.
fenytoïne
De AUC van fenytoïne werd bepaald na 4 dagen toediening van fenytoïne (200 mg per dag, oraal gedurende 3 dagen gevolgd door 250 mg intraveneus voor één dosis), zowel met als zonder toediening van fluconazol (oraal DIFLUCAN 200 mg per dag gedurende 16 dagen) bij 10 normale mannelijke vrijwilligers. Er was een significante toename van de AUC van fenytoïne. De gemiddelde ± SD toename van de AUC van fenytoïne was 88% ± 68% (bereik: 16 tot 247%). De absolute omvang van deze interactie is onbekend vanwege de intrinsiek niet-lineaire dispositie van fenytoïne. (Zien PREVENTIEVE MAATREGELEN .)
Cyclosporine
De AUC en Cmax van ciclosporine werden voor en na toediening van fluconazol 200 mg per dag gedurende 14 dagen bepaald bij acht niertransplantatiepatiënten die gedurende ten minste 6 maanden ciclosporinetherapie hadden ondergaan en gedurende ten minste 6 weken een stabiele dosis ciclosporine gebruikten. Er was een significante toename van de AUC, Cmax, Cmin (24-uursconcentratie) van ciclosporine en een significante afname van de schijnbare orale klaring na toediening van fluconazol. De gemiddelde ± SD toename in AUC was 92% ± 43% (bereik: 18 tot 147%). De Cmax nam toe met 60% ± 48% (bereik: -5 tot 133%). De Cmax nam toe met 157% ± 96% (bereik: 33 tot 360%). De schijnbare orale klaring nam af met 45% ± 15% (bereik: –15 tot –60%). (Zien PREVENTIEVE MAATREGELEN .)
Zidovudine
De plasmaconcentraties van zidovudine werden bij twee gelegenheden bepaald (vóór en na fluconazol 200 mg per dag gedurende 15 dagen) bij 13 vrijwilligers met aids of ARC die gedurende ten minste twee weken een stabiele dosis zidovudine gebruikten. Er was een significante toename van de AUC van zidovudine na toediening van fluconazol. De gemiddelde ± SD toename in AUC was 20% ± 32% (bereik: -27 tot 104%). De verhouding van metaboliet, GZDV, tot oudergeneesmiddel nam significant af na toediening van fluconazol, van 7,6 ± 3,6 tot 5,7 ± 2,2.
theofylline
De farmacokinetiek van theofylline werd bepaald aan de hand van een enkele intraveneuze dosis aminofylline (6 mg/kg) voor en na de orale toediening van fluconazol 200 mg per dag gedurende 14 dagen bij 16 normale mannelijke vrijwilligers. Er waren significante verhogingen van de AUC, Cmax en halfwaardetijd van theofylline met een overeenkomstige afname van de klaring. De gemiddelde ± SD theofylline AUC nam toe met 21% ± 16% (bereik: -5 tot 48%). De Cmax nam toe met 13% ± 17% (bereik: -13 tot 40%). De theofyllineklaring nam af met 16% ± 11% (bereik: -32 tot 5%). De halfwaardetijd van theofylline nam toe van 6,6 ± 1,7 uur tot 7,9 ± 1,5 uur. (Zien PREVENTIEVE MAATREGELEN .)
kinidine
Hoewel niet in vitro of in vivo onderzocht, kan gelijktijdige toediening van fluconazol met kinidine leiden tot remming van het kinidinemetabolisme. Het gebruik van kinidine is in verband gebracht met QT-verlenging en zeldzame gevallen van torsade de pointes. Gelijktijdige toediening van fluconazol en kinidine is gecontra-indiceerd. (Zien CONTRA-INDICATIES en PREVENTIEVE MAATREGELEN .)
Orale hypoglykemie
De effecten van fluconazol op de farmacokinetiek van de orale hypoglycemische sulfonylureummiddelen tolbutamide, glipizide en glyburide werden geëvalueerd in drie placebogecontroleerde onderzoeken bij normale vrijwilligers. Alle proefpersonen kregen het sulfonylureumderivaat alleen als een enkele dosis en opnieuw als een enkele dosis na toediening van DIFLUCAN 100 mg per dag gedurende 7 dagen. In deze drie onderzoeken ondervonden 22/46 (47,8%) van de met DIFLUCAN behandelde patiënten en 9/22 (40,1%) van de met placebo behandelde patiënten symptomen die overeenkomen met hypoglykemie. (Zien PREVENTIEVE MAATREGELEN .)
Tolbutamide
Bij 13 normale mannelijke vrijwilligers was er een significante toename van de AUC en Cmax van tolbutamide (eenmalige dosis van 500 mg) na toediening van fluconazol. Er was een gemiddelde ± SD toename van de tolbutamide AUC van 26% ± 9% (bereik: 12 tot 39%). De Cmax van tolbutamide nam toe met 11% ± 9% (bereik: -6 tot 27%). (Zien PREVENTIEVE MAATREGELEN .)
Glipizide
De AUC en Cmax van glipizide (2,5 mg enkelvoudige dosis) waren significant verhoogd na toediening van fluconazol bij 13 normale mannelijke vrijwilligers. Er was een gemiddelde ± SD toename in AUC van 49% ± 13% (bereik: 27 tot 73%) en een toename in Cmax van 19% ± 23% (bereik: -11 tot 79%). (Zien PREVENTIEVE MAATREGELEN .)
Glyburide
De AUC en Cmax van glyburide (5 mg enkelvoudige dosis) waren significant verhoogd na toediening van fluconazol bij 20 normale mannelijke vrijwilligers. Er was een gemiddelde ± SD toename in AUC van 44% ± 29% (bereik: -13 tot 115%) en Cmax nam toe met 19% ± 19% (bereik: -23 tot 62%). Vijf proefpersonen hadden orale glucose nodig na de inname van glyburide na 7 dagen toediening van fluconazol. (Zien PREVENTIEVE MAATREGELEN .)
Rifabutine
Er zijn gepubliceerde rapporten dat er een interactie bestaat wanneer fluconazol gelijktijdig met rifabutine wordt toegediend, wat leidt tot verhoogde serumspiegels van rifabutine. (Zien PREVENTIEVE MAATREGELEN .)
Tacrolimus
Er zijn gepubliceerde rapporten dat er een interactie bestaat wanneer fluconazol gelijktijdig met tacrolimus wordt toegediend, wat leidt tot verhoogde serumspiegels van tacrolimus. (Zien PREVENTIEVE MAATREGELEN .)
midazolam
Het effect van fluconazol op de farmacokinetiek en farmacodynamiek van midazolam werd onderzocht in een gerandomiseerde, cross-over studie bij 12 vrijwilligers. In het onderzoek namen proefpersonen placebo of 400 mg fluconazol op dag 1 in, gevolgd door 200 mg per dag van dag 2 tot dag 6. Bovendien werd op de eerste dag een dosis midazolam van 7,5 mg oraal ingenomen, 0,05 mg/kg werd intraveneus toegediend. op de vierde dag en 7,5 mg oraal op de zesde dag. Fluconazol verminderde de klaring van IV midazolam met 51%. Op de eerste dag van toediening verhoogde fluconazol de AUC en Cmax van midazolam met respectievelijk 259% en 150%. Op de zesde dag van toediening verhoogde fluconazol de AUC en Cmax van midazolam met respectievelijk 259% en 74%. De psychomotorische effecten van midazolam waren significant verhoogd na orale toediening van midazolam, maar waren niet significant beïnvloed na intraveneuze midazolam.
Een tweede gerandomiseerde, dubbel-dummy, placebogecontroleerde, cross-over studie in drie fasen werd uitgevoerd om het effect van de toedieningsweg van fluconazol op de interactie tussen fluconazol en midazolam te bepalen. In elke fase kregen de proefpersonen oraal fluconazol 400 mg en intraveneuze zoutoplossing; orale placebo en intraveneus fluconazol 400 mg; en orale placebo en IV zoutoplossing. Een orale dosis van 7,5 mg midazolam werd ingenomen na fluconazol/placebo. De AUC en Cmax van midazolam waren significant hoger na orale dan IV toediening van fluconazol. Oraal fluconazol verhoogde de AUC en Cmax van midazolam met respectievelijk 272% en 129%. IV fluconazol verhoogde de AUC en Cmax van midazolam met respectievelijk 244% en 79%. Zowel oraal als intraveneus fluconazol verhoogde de farmacodynamische effecten van midazolam. (Zien PREVENTIEVE MAATREGELEN .)
Azithromycine
Een open-label, gerandomiseerde, drieweg cross-over studie bij 18 gezonde proefpersonen beoordeelde het effect van een enkele orale dosis van 800 mg fluconazol op de farmacokinetiek van een enkelvoudige orale dosis van 1200 mg azitromycine, evenals de effecten van azitromycine op de farmacokinetiek van fluconazol. Er was geen significante farmacokinetische interactie tussen fluconazol en azitromycine.
Voriconazol
Voriconazol is een substraat voor zowel CYP2C9- als CYP3A4-iso-enzymen. Gelijktijdige toediening van orale toediening van voriconazol (400 mg om de 12 uur gedurende 1 dag, daarna 200 mg om de 12 uur gedurende 2,5 dag) en orale fluconazol (400 mg op dag 1, daarna 200 mg om de 24 uur gedurende 4 dagen) aan 6 gezonde mannelijke proefpersonen leidde tot een verhoging van de Cmax en AUCτ van voriconazol met gemiddeld respectievelijk 57% (90% BI: 20% tot 107%) en 79% (90% BI: 40% tot 128%). In een vervolg klinisch onderzoek met 8 gezonde mannelijke proefpersonen, elimineerde of verminderde een verminderde dosering en/of frequentie van voriconazol en fluconazol dit effect niet. Gelijktijdige toediening van voriconazol en fluconazol in welke dosis dan ook wordt niet aanbevolen. Nauwlettende controle op bijwerkingen gerelateerd aan voriconazol wordt aanbevolen als voriconazol sequentieel na fluconazol wordt gebruikt, vooral binnen 24 uur na de laatste dosis fluconazol. (Zien PREVENTIEVE MAATREGELEN .)
Tofacitinib
Gelijktijdige toediening van fluconazol (400 mg op dag 1 en 200 mg eenmaal daags gedurende 6 dagen [dag 2-7]) en tofacitinib (30 mg enkelvoudige dosis op dag 5) bij gezonde proefpersonen resulteerde in verhoogde gemiddelde tofacitinib AUC- en Cmax-waarden van ongeveer respectievelijk 79% (90% BI: 64% tot 96%) en 27% (90% BI: 12% tot 44%), vergeleken met toediening van alleen tofacitinib. (Zien PREVENTIEVE MAATREGELEN .)
Microbiologie
Werkingsmechanisme
Fluconazol is een zeer selectieve remmer van het schimmelcytochroom P450-afhankelijke enzym lanosterol 14-α-demethylase. Dit enzym zet lanosterol om in ergosterol. Het daaropvolgende verlies van normale sterolen correleert met de accumulatie van 14-α-methylsterolen in schimmels en kan verantwoordelijk zijn voor de fungistatische activiteit van fluconazol. Zoogdierceldemethylering is veel minder gevoelig voor remming van fluconazol.
Weerstand
Een potentieel voor ontwikkeling van resistentie tegen fluconazol is algemeen bekend. Schimmelisolaten die een verminderde gevoeligheid voor andere azolen vertonen, kunnen ook een verminderde gevoeligheid voor fluconazol vertonen. De frequentie van de ontwikkeling van geneesmiddelresistentie voor de verschillende schimmels waarvoor dit geneesmiddel is geïndiceerd, is niet bekend.
Fluconazolresistentie kan het gevolg zijn van een wijziging in de kwaliteit of kwantiteit van het doelenzym (lanosterol 14-α-demethylase), verminderde toegang tot het geneesmiddeldoelwit of een combinatie van deze mechanismen.
Puntmutaties in het gen (ERG11) dat codeert voor het doelenzym leiden tot een gewijzigd doel met verminderde affiniteit voor azolen. Overexpressie van ERG11 resulteert in de productie van hoge concentraties van het doelenzym, waardoor de behoefte ontstaat aan hogere intracellulaire geneesmiddelconcentraties om alle enzymmoleculen in de cel te remmen.
Het tweede belangrijke mechanisme van geneesmiddelresistentie omvat actieve efflux van fluconazol uit de cel door de activering van twee soorten multidrug-effluxtransporters; de belangrijkste facilitators (gecodeerd door MDR-genen) en die van de ATP-bindende cassettesuperfamilie (gecodeerd door CDR-genen). Opregulatie van het MDR-gen leidt tot resistentie tegen fluconazol, terwijl opregulatie van CDR-genen kan leiden tot resistentie tegen meerdere azolen.
Resistentie bij Candida glabrata omvat gewoonlijk opregulatie van CDR-genen, resulterend in resistentie tegen meerdere azolen. Voor een isolaat waarbij de minimale remmende concentratie (MIC) is gecategoriseerd als gemiddeld (16 tot 32 mcg/ml), wordt de hoogste dosis fluconazol aanbevolen.
Candida krusei moet worden beschouwd als resistent tegen fluconazol. Resistentie bij C. krusei lijkt te worden gemedieerd door verminderde gevoeligheid van het doelenzym voor remming door het middel.
Er zijn gevallen gemeld van superinfectie met andere Candida-soorten dan C. albicans, die vaak inherent niet gevoelig zijn voor DIFLUCAN (bijv. Candida krusei). In dergelijke gevallen kan een alternatieve antischimmeltherapie nodig zijn.
Antimicrobiale activiteit
Van fluconazol is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen: zowel in vitro als bij klinische infecties.
Candida albicans Candida glabrata (Veel isolaten zijn middelmatig gevoelig) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is onbekend. Ten minste 90% van de volgende schimmels vertoont een in vitro MIC die kleiner is dan of gelijk is aan het gevoelige breekpunt voor fluconazol (https://www.fda.gov/STIC) tegen isolaten van een vergelijkbaar geslacht of een vergelijkbare organismegroep. De werkzaamheid van fluconazol bij de behandeling van klinische infecties veroorzaakt door deze schimmels is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei moet worden beschouwd als resistent tegen fluconazol. Resistentie bij C. krusei lijkt te worden gemedieerd door verminderde gevoeligheid van het doelenzym voor remming door het middel.
Er zijn gevallen gemeld van superinfectie met andere Candida-soorten dan C. albicans, die vaak inherent niet gevoelig zijn voor DIFLUCAN (bijv. Candida krusei). In dergelijke gevallen kan een alternatieve antischimmeltherapie nodig zijn.
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Klinische studies
Cryptokokkenmeningitis
In een multicenter onderzoek waarin DIFLUCAN (200 mg/dag) werd vergeleken met amfotericine B (0,3 mg/kg/dag) voor de behandeling van cryptokokkenmeningitis bij patiënten met aids, bracht een multivariate analyse drie factoren aan het licht die vóór de behandeling overlijden tijdens de therapie voorspelden: abnormaal mentale toestand, cryptokokkenantigeentiter in het hersenvocht hoger dan 1:1024 en het aantal witte bloedcellen in het hersenvocht lager dan 20 cellen/mm³. De mortaliteit onder patiënten met een hoog risico was respectievelijk 33% en 40% voor amfotericine B- en DIFLUCAN-patiënten (p=0,58), met totale sterfte 14% (9 van de 63 proefpersonen) en 18% (24 van de 131 proefpersonen) voor de 2 armen van de studie (p=0,48). Optimale doses en regimes voor patiënten met acute cryptokokkenmeningitis en met een hoog risico op falen van de behandeling moeten nog worden bepaald. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Vaginale candidiasis
Er zijn in de VS twee adequate en goed gecontroleerde onderzoeken uitgevoerd met de tablet van 150 mg. In beide gevallen waren de resultaten van het fluconazolschema vergelijkbaar met het controleschema (clotrimazol of miconazol intravaginaal gedurende 7 dagen), zowel klinisch als statistisch bij de evaluatie één maand na de behandeling.
Het therapeutische genezingspercentage, gedefinieerd als een volledige oplossing van tekenen en symptomen van vaginale candidiasis (klinische genezing), samen met een negatief KOH-onderzoek en een negatieve kweek voor Candida (microbiologische uitroeiing), was 55% in zowel de fluconazolgroep als de vaginale producten groep.
Ongeveer driekwart van de geïncludeerde patiënten had acute vaginitis (
In de fluconazolgroep werden aanzienlijk meer gastro-intestinale voorvallen gemeld dan in de vaginale productgroep. De meeste voorvallen waren licht tot matig. Omdat fluconazol als een enkele dosis werd gegeven, vonden er geen stopzettingen plaats.
Pediatrische studies
Orofaryngeale candidiasis
Er werd een open-label vergelijkend onderzoek uitgevoerd naar de werkzaamheid en veiligheid van DIFLUCAN (2 tot 3 mg/kg/dag) en orale nystatine (400.000 IE 4 maal daags) bij immuungecompromitteerde kinderen met orofaryngeale candidiasis. De klinische en mycologische responspercentages waren hoger bij de kinderen die met fluconazol werden behandeld.
Klinische genezing aan het einde van de behandeling werd gemeld voor 86% van de met fluconazol behandelde patiënten vergeleken met 46% van de met nystatine behandelde patiënten. Mycologisch gezien was bij 76% van de met fluconazol behandelde patiënten het infecterende organisme uitgeroeid, vergeleken met 11% bij de met nystatine behandelde patiënten.
Het percentage patiënten met klinische terugval 2 weken na het einde van de behandeling was 14% voor proefpersonen die DIFLUCAN kregen en 16% voor proefpersonen die nystatine kregen. 4 weken na het einde van de behandeling waren de percentages patiënten met klinische terugval 22% voor DIFLUCAN 150 mg en 23% voor nystatine.
PATIËNT INFORMATIE
DIFLUCAN® (kleurstof-FLEW-kan) (fluconazol) Tabletten
Deze bijsluiter bevat belangrijke informatie over DIFLUCAN. Het is niet bedoeld om de instructies van uw zorgverlener te vervangen. Lees deze informatie zorgvuldig door voordat u DIFLUCAN inneemt. Vraag uw zorgverlener als u deze informatie niet begrijpt of als u meer wilt weten over DIFLUCAN.
Wat is DIFLUCAN 100 mg?
DIFLUCAN is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van vaginale schimmelinfecties die worden veroorzaakt door een gist die Candida wordt genoemd. DIFLUCAN 150 mg helpt de groei van te veel gist in de vagina te stoppen, zodat de schimmelinfectie verdwijnt.
DIFLUCAN 150 mg verschilt van andere behandelingen voor vaginale schimmelinfecties omdat het een tablet is die via de mond wordt ingenomen. DIFLUCAN wordt ook gebruikt voor andere aandoeningen. Deze bijsluiter gaat echter alleen over het gebruik van DIFLUCAN 50 mg voor vaginale schimmelinfecties. Vraag uw zorgverlener om informatie over het gebruik van DIFLUCAN 200 mg om andere redenen. Zie de rubriek van deze bijsluiter voor informatie over vaginale schimmelinfecties.
Wat is een vaginale schimmelinfectie?
Het is normaal dat er een bepaalde hoeveelheid gist in de vagina wordt aangetroffen. Soms begint er teveel gist in de vagina te groeien en dit kan een schimmelinfectie veroorzaken. Vaginale schimmelinfecties komen vaak voor. Ongeveer drie op de vier volwassen vrouwen zullen tijdens hun leven minstens één vaginale schimmelinfectie hebben.
Sommige medicijnen en medische aandoeningen kunnen uw kans op het krijgen van een schimmelinfectie vergroten. Als u zwanger bent, diabetes heeft, anticonceptiepillen gebruikt of antibiotica gebruikt, kunt u vaker schimmelinfecties krijgen dan andere vrouwen. Persoonlijke hygiëne en bepaalde soorten kleding kunnen uw kansen op het krijgen van een schimmelinfectie vergroten. Vraag uw zorgverlener om tips over wat u kunt doen om vaginale schimmelinfecties te voorkomen. Als u een vaginale schimmelinfectie krijgt, kunt u een van de volgende symptomen hebben:
- jeuk
- een branderig gevoel bij het plassen
- roodheid
- pijn
- een dikke witte vaginale afscheiding die eruitziet als kwark
Gebruik DIFLUCAN niet als u.
- neem de volgende medicijnen:
- kinidine
- erytromycine
- pimozide
- allergisch bent voor fluconazol, de werkzame stof in DIFLUCAN 50 mg of voor één van de bestanddelen in DIFLUCAN. Zie het einde van deze patiëntenbijsluiter voor een volledige lijst van ingrediënten in DIFLUCAN.
Vertel uw zorgverlener over al uw medische aandoeningen voordat u DIFLUCAN gebruikt, als u:
- leverproblemen hebben
- nierproblemen hebben
- hartproblemen heeft, waaronder hartritmestoornissen
- hypokaliëmie hebben (laag kalium)
- zwanger bent of van plan bent zwanger te worden. Vertel het uw zorgverlener meteen als u zwanger wordt terwijl u DIFLUCAN gebruikt. U en uw zorgverlener zullen beslissen of DIFLUCAN 100 mg geschikt voor u is. Als u zwanger zou kunnen worden, moet u een anticonceptiemethode (anticonceptie) gebruiken tijdens het gebruik van DIFLUCAN en gedurende 1 week na uw laatste dosis.
- borstvoeding geeft of van plan bent borstvoeding te geven. DIFLUCAN kan in uw moedermelk terechtkomen. Praat met uw zorgverlener over de beste manier om uw baby te voeden terwijl u DIFLUCAN gebruikt.
Voordat u begint met het innemen van DIFLUCAN, moet u uw zorgverlener op de hoogte stellen van alle geneesmiddelen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het uw zorgverlener vooral als u:
- diabetesgeneesmiddelen zoals glyburide, tolbutamide, glipizide
- bloeddruk medicijnen zoals hydrochloorthiazide, losartan, amlodipine, verapamil nifedipine of felodipine
- bloedverdunners zoals warfarine
- ciclosporine, tacrolimus of sirolimus (gebruikt om afstoting van orgaantransplantaten te voorkomen)
- rifampicine of rifabutine voor tuberculose
- fenytoïne of carbamazepine om aanvallen onder controle te houden
- theofylline om astma onder controle te houden
- kinidine (gebruikt om stoornissen in het hartritme te corrigeren)
- amiodaron (gebruikt voor de behandeling van onregelmatige hartslagen "aritmieën")
- amitriptyline of nortriptyline voor depressie
- pimozide voor psychiatrische aandoeningen
- amfotericine B of voriconazol voor schimmelinfecties
- erytromycine voor bacteriële infecties
- olaparib, cyclofosfamide of vinca-alkaloïden zoals vincristine of vinblastine voor de behandeling van kanker
- fentanyl, alfentanil of methadon voor chronische pijn
- ibrutinib gebruikt voor de behandeling van bloedkanker
- lemborexant, gebruikt voor de behandeling van slapeloosheid
- lipidenverlagende geneesmiddelen zoals atorvastatine, simvastatine en fluvastatine
- niet-steroïde anti-inflammatoire geneesmiddelen, waaronder celecoxib, ibuprofen en naproxen
- prednison, een steroïde gebruikt voor de behandeling van huid-, gastro-intestinale, hematologische of ademhalingsstoornissen
- antivirale geneesmiddelen die worden gebruikt om hiv te behandelen, zoals saquinavir of zidovudine
- tofacitinib voor reumatoïde artritis
- vitamine A voedingssupplement
- tolvaptan gebruikt voor de behandeling van hyponatriëmie (laag natriumgehalte in uw bloed) of om de achteruitgang van de nierfunctie te vertragen
Aangezien er veel merknamen zijn voor deze geneesmiddelen, moet u contact opnemen met uw zorgverlener of apotheker als u vragen heeft.
Hoe moet ik DIFLUCAN gebruiken?
- Gebruik DIFLUCAN precies zoals uw zorgverlener u dat vertelt.
- Neem DIFLUCAN 100 mg via de mond met of zonder voedsel.
- Als u te veel DIFLUCAN 50 mg heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of ga naar de dichtstbijzijnde eerste hulpafdeling.
Wat moet ik vermijden tijdens het gebruik van DIFLUCAN 150 mg?
DIFLUCAN kan duizeligheid en toevallen veroorzaken. Rijd niet en bedien geen machines totdat u weet welke invloed DIFLUCAN op u heeft.
Wat zijn de mogelijke bijwerkingen van DIFLUCAN 150 mg?
DIFLUCAN 50 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige leverproblemen. Sommige mensen met ernstige medische problemen hebben ernstige leverproblemen ontwikkeld die levensbedreigend werden of de dood veroorzaakten tijdens het gebruik van DIFLUCAN. Soms kunnen deze leverproblemen worden verholpen als u stopt met het innemen van DIFLUCAN. Vertel het uw zorgverlener meteen als u symptomen van ernstige leverproblemen heeft, waaronder:
- donker gekleurde urine
- ernstige jeuk aan de huid
- geel worden van de huid en ogen (geelzucht)
- lichtgekleurde ontlasting
- vermoeidheid
- braken
- verlies van eetlust
- ernstige allergische reacties: In zeldzame gevallen zijn er ernstige allergische reacties (anafylaxie) opgetreden tijdens het gebruik van DIFLUCAN. Stop met het innemen van DIFLUCAN 50 mg, bel uw zorgverlener of ga onmiddellijk naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis als u tekenen of symptomen van een allergische reactie krijgt, waaronder:
- kortademigheid
- koorts
- zwelling van de oogleden
- hoesten
- huiduitslag, netelroos, blaren of vervelling van de huid
- gezicht, mond, nek of enig ander deel van het lichaam
- piepende ademhaling
- kloppend hart of oren
- rillingen
- ernstige huidproblemen. Sommige mensen met ernstige medische problemen hebben ernstige huidproblemen ontwikkeld die de dood hebben veroorzaakt tijdens het gebruik van DIFLUCAN. Vertel het uw zorgverlener meteen als u huiduitslag krijgt terwijl u DIFLUCAN gebruikt.
De meest voorkomende bijwerkingen van DIFLUCAN 200 mg zijn:
- hoofdpijn
- duizeligheid
- diarree
- buikpijn
- misselijkheid of maagklachten
- veranderingen in de smaak van eten
Andere bijwerkingen zijn onder meer:
- bijnierinsufficiëntie: Sommige mensen die DIFLUCAN hebben gebruikt, ontwikkelden bijnierinsufficiëntie die omkeerbaar was. Vertel het uw zorgverlener meteen als u symptomen van bijnierinsufficiëntie heeft, waaronder:
- langdurige vermoeidheid
- spier zwakte
- verlies van eetlust
- gewichtsverlies
- buikpijn
- duizeligheid
- misselijkheid
- braken
- duizeligheid of toevallen.
Dit zijn niet alle mogelijke bijwerkingen van DIFLUCAN.
Bel uw zorgverlener voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik DIFLUCAN bewaren?
Bewaar DIFLUCAN-tabletten onder 86 ° F (30 ° C).
Houd DIFLUCAN 50 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van DIFLUCAN.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik DIFLUCAN 50 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef DIFLUCAN niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw zorgverlener om informatie vragen over DIFLUCAN 200 mg die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in DIFLUCAN 150 mg?
Actief ingrediënt: fluconazol
Inactieve ingredienten: microkristallijne cellulose, watervrij dibasisch calciumfosfaat, povidon, croscarmellosenatrium, FD&C Red No. 40 aluminiumlakkleurstof en magnesiumstearaat.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration
