Parlodel 2.5mg Bromocriptine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Parlodel en hoe wordt het gebruikt?
Parlodel 2,5 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van hyperprolactinemie-geassocieerde disfuncties, de ziekte van Parkinson, acromegalie. Parlodel 2,5 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Parlodel 2,5 mg behoort tot een klasse geneesmiddelen die antiparkinsonmiddelen, dopamine-agonisten worden genoemd; Hyperprolactinemie; Metabool en endocriene, andere.
Het is niet bekend of Parlodel 2,5 mg veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn de mogelijke bijwerkingen van Parlodel?
Parlodel kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- zichtproblemen,
- constante loopneus,
- pijn op de borst,
- pijn bij het ademen,
- snelle hartslag,
- snel ademhalen,
- kortademigheid,
- rugpijn,
- zwelling in uw enkels of voeten,
- minder of helemaal niet plassen,
- verwardheid,
- hallucinaties,
- duizeligheid,
- hoofdpijn,
- honger,
- zwakheid,
- zweten,
- trillingen,
- prikkelbaarheid,
- moeite met concentreren,
- onwillekeurige spierbewegingen,
- verlies van evenwicht of coördinatie,
- bloederige of teerachtige ontlasting,
- bloed ophoesten,
- braaksel dat op koffiedik lijkt,
- ernstige hoofdpijn,
- wazig zien,
- zoemend in je oren,
- ongerustheid,
- verwardheid,
- pijn op de borst,
- kortademigheid,
- ongelijke hartslagen, en
- toevallen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Parlodel 2,5 mg zijn:
- duizeligheid,
- ronddraaiend gevoel,
- lichte slaperigheid,
- vermoeidheid,
- lichte hoofdpijn,
- depressieve bui,
- slaapproblemen (slapeloosheid),
- droge mond,
- verstopte neus,
- maagklachten,
- misselijkheid,
- braken,
- buikpijn,
- verlies van eetlust,
- diarree,
- constipatie, en
- koud gevoel of gevoelloosheid in uw vingers
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Parlodel. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
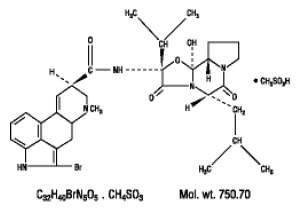
Parlodel® (bromocriptinemesylaat) is een moederkorenderivaat met krachtige dopaminereceptoragonistische activiteit. Elke SnapTabs®-tablet van Parlodel® (bromocriptinemesylaat) voor orale toediening bevat 2½ mg en elke capsule bevat 5 mg bromocriptine (als mesylaat). Bromocriptinemesylaat wordt chemisch aangeduid als Ergotaman-3',6',18-trione, 2-broom-12'-hydroxy-2'-(1-methylethyl)-5'-( 2-methylpropyl)-, (5'α)-monomethaansulfonaat (zout).
De structuurformule is:
2½ mg SnapTabs®
Actief ingrediënt: bromocriptinemesylaat, USP
Inactieve ingredienten: colloïdaal siliciumdioxide, lactose, magnesiumstearaat, povidon, zetmeel en een ander ingrediënt
5 mg-capsules
Actief ingrediënt: bromocriptinemesylaat, USP
Inactieve ingredienten: colloïdaal siliciumdioxide, gelatine, lactose, magnesiumstearaat, rood ijzeroxide, siliciumdioxide, natriumlaurylsulfaat, zetmeel, titaniumdioxide, geel ijzeroxide en een ander ingrediënt
INDICATIES
Hyperprolactinemie-geassocieerde disfuncties
Parlodel (bromocriptinemesylaat) is geïndiceerd voor de behandeling van disfuncties die verband houden met: hyperprolactinemie inclusief amenorroe met of zonder galactorroe, onvruchtbaarheid of hypogonadisme . Behandeling met Parlodel 2,5 mg is geïndiceerd bij patiënten met: prolactine-afscheidende adenomen , wat de fundamentele onderliggende endocrinopathie kan zijn die bijdraagt aan de bovenstaande klinische presentaties. Vermindering in tumorgrootte is aangetoond bij zowel mannelijke als vrouwelijke patiënten met macroadenomen. In gevallen waarin gekozen wordt voor adenectomie, kan een behandeling met Parlodel 2,5 mg worden gebruikt om de tumormassa voorafgaand aan de operatie te verminderen.
acromegalie
Parlodel 2,5 mg therapie is geïndiceerd bij de behandeling van acromegalie. Parlodel-therapie, alleen of als aanvullende therapie met bestraling van de hypofyse of chirurgie, vermindert het serumgroeihormoon met 50% of meer bij ongeveer ½ van de behandelde patiënten, hoewel gewoonlijk niet tot normale niveaus.
Aangezien de effecten van uitwendige hypofysebestraling mogelijk niet gedurende meerdere jaren maximaal worden, biedt aanvullende therapie met Parlodel 2,5 mg potentieel voordeel voordat de effecten van bestraling zich manifesteren.
Ziekte van Parkinson
Parlodel 2,5 mg SnapTabs of capsules zijn geïndiceerd voor de behandeling van de tekenen en symptomen van de idiopathische of postencephalitische ziekte van Parkinson. Als aanvullende behandeling bij levodopa (alleen of met een perifere decarboxylaseremmer), kan behandeling met Parlodel aanvullende therapeutische voordelen bieden bij die patiënten die momenteel op optimale doseringen van levodopa worden gehouden, degenen die beginnen te verslechteren (tolerantie ontwikkelen) voor de behandeling met levodopa, en degenen bij wie de behandeling met levodopa "het einde van de dosis" heeft ondergaan. Behandeling met Parlodel 2,5 mg kan een verlaging van de onderhoudsdosering van levodopa mogelijk maken en kan dus het optreden en/of de ernst van bijwerkingen die verband houden met langdurige levodopa-therapie, zoals abnormale onwillekeurige bewegingen (bijv. dyskinesieën) en de duidelijke schommelingen in motorische functie (“aan-uit”-fenomeen). Aanhoudende werkzaamheid van de behandeling met Parlodel 2,5 mg gedurende een behandeling van meer dan 2 jaar is niet vastgesteld.
Er zijn onvoldoende gegevens om het potentiële voordeel van de behandeling van nieuw gediagnosticeerde ziekte van Parkinson met Parlodel te evalueren. Studies hebben echter significant meer bijwerkingen aangetoond (met name misselijkheid, hallucinaties, verwardheid en hypotensie) bij met Parlodel behandelde patiënten dan bij met levodopa/carbidopa behandelde patiënten. Patiënten die niet reageren op levodopa zijn slechte kandidaten voor Parlodel-therapie.
DOSERING EN ADMINISTRATIE
Algemeen
Het wordt aanbevolen om Parlodel (bromocriptinemesylaat) met voedsel in te nemen. Patiënten moeten regelmatig worden geëvalueerd tijdens dosisverhogingen om de laagste dosering te bepalen die een therapeutische respons oplevert.
Hyperprolactinemische indicaties
De aanvangsdosering van Parlodel SnapTabs bij volwassenen is één tot één 2½ mg tablet met breukstreep per dag. Elke 2 tot 7 dagen kan een extra tablet van 2½ mg aan het behandelingsschema worden toegevoegd totdat een optimale therapeutische respons is bereikt. De therapeutische dosering varieerde van 2,5-15 mg per dag bij klinisch onderzochte volwassenen.
Gebaseerd op beperkte gegevens bij kinderen van 11 tot 15 jaar (zie: Pediatrisch gebruik ) de aanvangsdosis is één tot één 2½ mg tablet met breukstreep per dag. Het kan nodig zijn de dosering te verhogen naarmate deze wordt verdragen totdat een therapeutische respons is bereikt. De therapeutische dosering varieerde van 2,5-10 mg per dag bij kinderen met prolactine-afscheidende hypofyseadenomen.
Om de kans op langdurige blootstelling aan Parlodel te verkleinen, mocht er een onverwachte zwangerschap optreden, moet een mechanisch anticonceptiemiddel worden gebruikt in combinatie met Parlodel 2,5 mg therapie totdat de normale ovulatoire menstruatiecycli zijn hersteld. Anticonceptie kan dan worden gestaakt bij patiënten die zwanger willen worden.
Als de menstruatie daarna niet binnen 3 dagen na de verwachte datum optreedt, moet de behandeling met Parlodel 2,5 mg worden stopgezet en moet een zwangerschapstest worden uitgevoerd.
acromegalie
Vrijwel alle acromegaliepatiënten die therapeutische voordelen van Parlodel 2,5 mg krijgen, hebben ook verlagingen van de circulerende groeihormoonspiegels. Daarom zal een periodieke beoordeling van de circulerende groeihormoonspiegels in de meeste gevallen als richtlijn dienen bij het bepalen van het therapeutisch potentieel van Parlodel. Als er na een korte proef met Parlodel-therapie geen significante verlaging van de groeihormoonspiegels heeft plaatsgevonden, moet een zorgvuldige beoordeling van de klinische kenmerken van de ziekte worden gemaakt en als er geen verandering is opgetreden, moet dosisaanpassing of stopzetting van de therapie worden overwogen .
De aanbevolen initiële dosering is één tot één 2½ mg Parlodel SnapTabs tablet bij het stoppen (met voedsel) gedurende 3 dagen. Elke 3 tot 7 dagen moet een extra ½ tot 1 SnapTabs-tablet aan het behandelingsschema worden toegevoegd, totdat de patiënt een optimaal therapeutisch voordeel heeft bereikt. Patiënten moeten maandelijks opnieuw worden geëvalueerd en de dosering moet worden aangepast op basis van verlagingen van het groeihormoon of klinische respons. Het gebruikelijke optimale therapeutische doseringsbereik van Parlodel varieert bij de meeste patiënten van 20-30 mg/dag. De maximale dosering mag niet hoger zijn dan 100 mg/dag.
Patiënten die worden behandeld met bestraling van de hypofyse, moeten de behandeling met Parlodel 2,5 mg jaarlijks stopzetten om zowel de klinische effecten van bestraling op het ziekteproces als de effecten van de behandeling met Parlodel te beoordelen. Meestal is hiervoor een wachttijd van 4 tot 8 weken voldoende. Herhaling van de tekenen/symptomen of verhogingen van het groeihormoon duiden erop dat het ziekteproces nog steeds actief is en verdere kuren met Parlodel moeten worden overwogen.
Ziekte van Parkinson
Het basisprincipe van de behandeling met Parlodel 2,5 mg is om de behandeling met een lage dosering te starten en, op individuele basis, de dagelijkse dosering langzaam te verhogen totdat een maximale therapeutische respons is bereikt. De dosering van levodopa tijdens deze introductieperiode moet, indien mogelijk, worden gehandhaafd. De aanvangsdosis Parlodel 2,5 mg is tweemaal daags één van een 2½ mg SnapTabs-tablet bij de maaltijd. Beoordelingen worden geadviseerd met tussenpozen van 2 weken tijdens dosistitratie om ervoor te zorgen dat de laagste dosering die een optimale therapeutische respons oplevert, niet wordt overschreden. Indien nodig kan de dosering elke 14 tot 28 dagen worden verhoogd met 2½ mg/dag bij de maaltijd. Mocht het raadzaam zijn om de dosering van levodopa te verlagen vanwege bijwerkingen, dan moet de dagelijkse dosering van Parlodel, indien verhoogd, geleidelijk worden bereikt in kleine stappen (2½ mg).
De veiligheid van Parlodel is niet aangetoond bij doseringen hoger dan 100 mg/dag.
HOE GELEVERD
Parlodel (Bromocriptine Mesylaat) SnapTabs
2½ mg
Parlodel is verkrijgbaar in een fles met 30 en 100 tabletten van 2 ½ mg, elke fles bevat een droogmiddel.
Ronde, gebroken witte SnapTabs met afgeschuinde randen, elk met 2½ mg bromocriptine (als het mesylaat). Gegraveerd "PARLODEL 2½" aan de ene kant en "017" aan de gescoorde kant. Voldoet aan USP-oplostest 1.
Pakketten van 30 - NDC 30698-202-30 Pakketten van 100 - NDC 30698-202-01
Parlodel (Bromocriptine Mesylaat) Capsules
5 mg
Karamel en witte capsules, die elk 5 mg bromocriptine (als mesylaat) bevatten. In rode inkt bedrukt met "PARLODEL 5 mg" op de ene helft en "102" op de andere helft.
Pakketten van 30 - NDC 30698-201-30 Pakketten van 100 - NDC 30698-201-01
Opslaan en afgeven
Bewaren bij 68 ° tot 77 ° F (20 tot 25 ° C); excursies toegestaan tot 59 ° tot 86 ° F (15 ° tot 30 ° C) [Zie USP-gecontroleerde kamertemperatuur].
Doseer in een strakke, lichtbestendige container.
Gefabriceerd voor en gedistribueerd door: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Herzien: juli 2021
BIJWERKINGEN
Bijwerkingen van klinische onderzoeken
Hyperprolactinemische indicaties
De incidentie van bijwerkingen is vrij hoog (69%), maar deze zijn over het algemeen licht tot matig van aard. De therapie werd stopgezet bij ongeveer 5% van de patiënten vanwege bijwerkingen. Deze in afnemende volgorde van frequentie zijn: misselijkheid (49%), hoofdpijn (19%), duizeligheid (17%), vermoeidheid (7%), licht gevoel in het hoofd (5%), braken (5%), buikkrampen (4%) , verstopte neus (3%), constipatie (3%), diarree (3%) en slaperigheid (3%).
Een licht hypotensief effect kan gepaard gaan met de behandeling met Parlodel (bromocriptinemesylaat). Het optreden van bijwerkingen kan worden verminderd door de dosering tijdelijk te verlagen tot ½ SnapTabs tablet 2 of 3 maal daags. Er zijn enkele gevallen van cerebrospinale vloeistofrinorroe gemeld bij patiënten die Parlodel 2,5 mg kregen voor de behandeling van grote prolactinomen. Dit is zelden voorgekomen, meestal alleen bij patiënten die eerder een transsfenoïdale operatie, hypofyse-bestraling of beide hebben ondergaan en die Parlodel 2,5 mg kregen voor het terugkeren van de tumor. Het kan ook voorkomen bij niet eerder behandelde patiënten bij wie de tumor zich uitstrekt tot in de sinus sphenoid.
acromegalie
De meest voorkomende bijwerkingen bij acromegaliepatiënten die werden behandeld met Parlodel 2,5 mg waren: misselijkheid (18%), obstipatie (14%), orthostatische hypotensie (6%), anorexia (4%), droge mond/verstopte neus (4 %), indigestie/dyspepsie (4%), digitale vasospasme (3%), slaperigheid/vermoeidheid (3%) en braken (2%).
Minder frequente bijwerkingen (minder dan 2%) waren: gastro-intestinale bloeding, duizeligheid, verergering van het syndroom van Raynaud, hoofdpijn en syncope. Zelden (minder dan 1%) haaruitval, alcoholpotentiëring, flauwte, duizeligheid, aritmie, ventriculaire tachycardie, verminderde slaapbehoefte, visuele hallucinaties, vermoeidheid, kortademigheid, bradycardie, duizeligheid, paresthesie, traagheid, vasovagale aanval, waanpsychose, paranoia , slapeloosheid, zwaar gevoel in het hoofd, verminderde tolerantie voor kou, tintelingen in de oren, bleekheid van het gezicht en spierkrampen zijn gemeld.
Ziekte van Parkinson
In klinische onderzoeken waarin Parlodel 2,5 mg werd toegediend met gelijktijdige verlaging van de dosis levodopa/carbidopa, waren de meest voorkomende nieuw optredende bijwerkingen: misselijkheid, abnormale onwillekeurige bewegingen, hallucinaties, verwardheid, 'aan-uit'-fenomeen, duizeligheid, slaperigheid, flauwvallen/flauwvallen, braken, asthenie, abdominaal ongemak, visusstoornis, ataxie, slapeloosheid, depressie, hypotensie, kortademigheid, constipatie en duizeligheid.
Minder vaak voorkomende bijwerkingen die kunnen optreden zijn: anorexie, angst, blefarospasme, droge mond, dysfagie, oedeem van de voeten en enkels, erythromelalgie, epileptiforme aanvallen, vermoeidheid, hoofdpijn, lethargie, vlekken op de huid, verstopte neus, nervositeit, nachtmerries, paresthesie, huiduitslag, frequent urineren, urine-incontinentie, urineretentie en in zeldzame gevallen tekenen en symptomen van ergotisme zoals tintelingen in de vingers, koude voeten, gevoelloosheid, spierkrampen van voeten en benen of verergering van het syndroom van Raynaud.
Afwijkingen in laboratoriumtests kunnen verhogingen in bloedureumstikstof, SGOT, SGPT, GGPT, CPK, alkalische fosfatase en urinezuur omvatten, die gewoonlijk van voorbijgaande aard zijn en niet van klinische betekenis.
Bijwerkingen van postmarketingervaring
De volgende bijwerkingen zijn gemeld tijdens het gebruik van Parlodel na goedkeuring (alle indicaties gecombineerd). Omdat bijwerkingen van spontane meldingen vrijwillig worden gemeld door een populatie van onbekende grootte, is het over het algemeen niet mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Psychische stoornissen: Verwarring, psychomotorische agitatie/opwinding, hallucinaties, psychotische stoornissen, slapeloosheid, verhoogd libido, hyperseksualiteit en impulscontrole/compulsief gedrag (inclusief gokken, geld uitgeven en andere intense driften).
Zenuwstelselaandoeningen: Hoofdpijn, slaperigheid, duizeligheid, dyskinesie, slaperigheid, paresthesie, overmatige slaperigheid overdag, plotseling in slaap vallen.
Oogaandoeningen: Visuele stoornis, wazig zien.
Oor- en labyrintaandoeningen: Tinnitus.
Hartaandoeningen: Pericardiale effusie, constrictieve pericarditis, tachycardie, bradycardie, aritmie, hartklepfibrose.
Bloedvataandoeningen: Hypotensie, orthostatische hypotensie (zeer zelden leidend tot syncope), reversibele bleekheid van vingers en tenen veroorzaakt door verkoudheid (vooral bij patiënten met een voorgeschiedenis van het fenomeen van Raynaud).
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: Neusverstopping, pleurale effusie, pleurale fibrose, pleuritis, longfibrose, dyspneu.
Maagdarmstelselaandoeningen: Misselijkheid, constipatie, braken, droge mond, diarree, buikpijn, retroperitoneale fibrose, gastro-intestinale zweer, gastro-intestinale bloeding.
Huid- en onderhuidaandoeningen: Allergische huidreacties, haaruitval.
Skeletspierstelsel- en bindweefselaandoeningen: Beenkrampen.
Algemene aandoeningen en toedieningsplaatsstoornissen: Vermoeidheid, perifeer oedeem, een syndroom dat lijkt op Maligne Neurolepticasyndroom bij abrupt staken van Parlodel, ontwenningsverschijnselen (waaronder apathie, angst, depressie, vermoeidheid, slapeloosheid, zweten en pijn) met afbouw of na stopzetting (zie PREVENTIEVE MAATREGELEN ).
Bijwerkingen waargenomen in andere omstandigheden
Postpartumpatiënten (zie hierboven) WAARSCHUWINGEN )
In postpartumonderzoeken met Parlodel 2,5 mg had 23 procent van de behandelde postpartumpatiënten ten minste 1 bijwerking, maar deze waren over het algemeen licht tot matig van aard. De therapie werd bij ongeveer 3% van de patiënten stopgezet. De meest voorkomende bijwerkingen waren: hoofdpijn (10%), duizeligheid (8%), misselijkheid (7%), braken (3%), vermoeidheid (1,0%), syncope (0,7%), diarree (0,4%) en krampen (0,4%). Verlaging van de bloeddruk (≥ 20 mm Hg systolisch en ≥ 10 mm Hg diastolisch) trad bij 28% van de patiënten minstens één keer op tijdens de eerste 3 dagen na de bevalling; deze waren meestal van voorbijgaande aard. Meldingen van flauwvallen in de kraamperiode kunnen mogelijk verband houden met dit effect. Tijdens postmarketingervaring in de VS werden onder meer 72 gevallen van epileptische aanvallen (waaronder 4 gevallen van status epilepticus), 30 gevallen van beroerte en 9 gevallen van myocardinfarct bij postpartumpatiënten gemeld. Gevallen van epileptische aanvallen gingen niet noodzakelijk gepaard met de ontwikkeling van hypertensie. Een niet aflatende en vaak progressief ernstige hoofdpijn, soms gepaard gaande met gezichtsstoornissen, vaak voorafgegaan door uren tot dagen veel gevallen van epileptische aanvallen en/of beroertes. De meeste patiënten hadden geen aanwijzingen voor een van de hypertensieve aandoeningen van de zwangerschap, waaronder eclampsie, pre-eclampsie of door zwangerschap veroorzaakte hypertensie. Eén geval van een beroerte was geassocieerd met sagittale sinustrombose en een ander was geassocieerd met cerebrale en cerebellaire vasculitis. Eén geval van een myocardinfarct ging gepaard met onverklaarde gedissemineerde intravasculaire stolling en een tweede geval trad op in combinatie met het gebruik van een ander ergotalkaloïde. De relatie tussen deze bijwerkingen en de toediening van Parlodel is niet vastgesteld.
In zeldzame gevallen zijn ernstige bijwerkingen gemeld, waaronder hypertensie, myocardinfarct, toevallen, beroerte of psychische stoornissen bij postpartumvrouwen die met Parlodel werden behandeld. Bij sommige patiënten werd de ontwikkeling van epileptische aanvallen of beroerte voorafgegaan door ernstige hoofdpijn en/of voorbijgaande visusstoornissen. Hoewel het oorzakelijk verband tussen deze gebeurtenissen en het geneesmiddel onzeker is, is periodieke controle van de bloeddruk raadzaam bij postpartumvrouwen die Parlodel krijgen. Als zich hypertensie, ernstige, progressieve of aanhoudende hoofdpijn (met of zonder visuele stoornissen) of tekenen van CZS-toxiciteit ontwikkelen, moet de toediening van Parlodel 2,5 mg worden gestaakt en moet de patiënt onmiddellijk worden geëvalueerd.
Bijzondere voorzichtigheid is geboden bij patiënten die recentelijk zijn behandeld of die gelijktijdig worden behandeld met geneesmiddelen die de bloeddruk kunnen veranderen, bijv. vasoconstrictoren zoals sympathicomimetica of ergotalkaloïden, waaronder ergometrine of methylergometrine, en gelijktijdig gebruik in de kraamperiode wordt niet aanbevolen.
Om VERMOEDELIJKE BIJWERKINGEN te melden, neemt u contact op met Validus Pharmaceuticals LLC op 1-866-982-5438 of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
DRUG-INTERACTIES
Het risico van het gebruik van Parlodel in combinatie met andere geneesmiddelen is niet systematisch geëvalueerd, maar alcohol kan de bijwerkingen van Parlodel versterken. Parlodel 2,5 mg kan een wisselwerking hebben met dopamine-antagonisten, butyrofenonen en bepaalde andere middelen. Verbindingen in deze categorieën resulteren in een verminderde werkzaamheid van Parlodel: fenothiazinen, haloperidol, metoclopramide en pimozide. Bromocriptine is een substraat van CYP3A4. Voorzichtigheid is daarom geboden bij gelijktijdige toediening van geneesmiddelen die sterke remmers van dit enzym zijn (zoals azol-antimycotica, HIV-proteaseremmers). Het gelijktijdige gebruik van macrolide-antibiotica zoals erytromycine bleek de plasmaspiegels van bromocriptine te verhogen (de gemiddelde AUC- en Cmax-waarden stegen respectievelijk 3,7- en 4,6-voudig).1 De gelijktijdige behandeling van acromegaliepatiënten met bromocriptine en octreotide leidde tot verhoogde plasmaconcentraties niveaus van bromocriptine (de AUC van bromocriptine steeg met ongeveer 38%).4 Gelijktijdig gebruik van Parlodel met andere ergot-alkaloïden wordt niet aanbevolen. Dosisaanpassing kan nodig zijn in die gevallen waarin hoge doses bromocriptine worden gebruikt (zoals indicatie voor de ziekte van Parkinson).
WAARSCHUWINGEN
Aangezien hyperprolactinemie met amenorroe/galactorroe en onvruchtbaarheid is gevonden bij patiënten met hypofysetumoren, is een volledige evaluatie van de hypofyse geïndiceerd vóór behandeling met Parlodel (bromocriptinemesylaat).
Als zwangerschap optreedt tijdens de toediening van Parlodel, is zorgvuldige observatie van deze patiënten verplicht. Prolactine-afscheidende adenomen kunnen zich uitbreiden en compressie van de optische of andere hersenzenuwen kan optreden, waardoor een spoedoperatie van de hypofyse noodzakelijk wordt. In de meeste gevallen verdwijnt de compressie na de bevalling. Er is gemeld dat het opnieuw starten van de behandeling met Parlodel 2,5 mg leidt tot verbetering van het gezichtsveld van patiënten bij wie zenuwcompressie is opgetreden tijdens de zwangerschap. De veiligheid van behandeling met Parlodel 2,5 mg tijdens de zwangerschap voor de moeder en de foetus is niet vastgesteld.
Parlodel 2,5 mg is in verband gebracht met slaperigheid en plotseling in slaap vallen, vooral bij patiënten met de ziekte van Parkinson. Plotseling in slaap vallen tijdens dagelijkse activiteiten, in sommige gevallen zonder bewustzijn of waarschuwingssignalen, is gemeld. Patiënten moeten hierover geïnformeerd worden en geadviseerd worden om geen voertuigen te besturen of machines te bedienen tijdens de behandeling met bromocriptine. Patiënten die slaperigheid hebben ervaren en/of een episode van plotseling in slaap vallen, mogen niet autorijden of machines bedienen. Verder kan een verlaging van de dosering of beëindiging van de therapie worden overwogen.
Symptomatische hypotensie kan optreden bij patiënten die voor elke indicatie met Parlodel worden behandeld. In postpartumonderzoeken met Parlodel zijn verlagingen van de systolische en diastolische druk in rugligging van respectievelijk meer dan 20 mm en 10 mm Hg waargenomen bij bijna 30% van de patiënten die Parlodel kregen. Soms was de daling van de systolische druk in rugligging wel 50-59 mm Hg.
Aangezien, vooral tijdens de eerste dagen van de behandeling, hypotensieve reacties af en toe kunnen optreden en resulteren in verminderde alertheid, is bijzondere voorzichtigheid geboden bij het besturen van een voertuig of het bedienen van machines.
Hoewel hypotensie tijdens het begin van de behandeling met Parlodel 2,5 mg optreedt bij sommige patiënten, zijn in zeldzame gevallen ernstige bijwerkingen, waaronder hypertensie, myocardinfarct, toevallen, beroerte, gemeld bij postpartum vrouwen die werden behandeld met Parlodel 2,5 mg voor de remming van borstvoeding. Hypertensie is gemeld, soms bij het begin van de therapie, maar vaak in de tweede week van de therapie; aanvallen zijn ook gemeld, zowel met als zonder de eerdere ontwikkeling van hypertensie; beroerte zijn meestal gemeld bij postpartumpatiënten bij wie het prenatale en obstetrische verloop ongecompliceerd was. Veel van deze patiënten die epileptische aanvallen (inclusief gevallen van status epilepticus) en/of beroertes kregen, meldden uren tot dagen voorafgaand aan het acute voorval een constante en vaak progressief ernstige hoofdpijn te ontwikkelen. Sommige gevallen van beroertes en epileptische aanvallen werden ook voorafgegaan door visuele stoornissen (wazig zien en voorbijgaande corticale blindheid). Er zijn ook gevallen van acuut myocardinfarct gemeld.
Hoewel een causaal verband tussen toediening van Parlodel en hypertensie, toevallen, beroertes en myocardinfarct bij postpartum vrouwen niet is vastgesteld, wordt het gebruik van het geneesmiddel voor de preventie van fysiologische borstvoeding of bij patiënten met ongecontroleerde hypertensie niet aanbevolen. Bij patiënten die worden behandeld voor hyperprolactinemie, moet Parlodel 2,5 mg worden gestaakt wanneer zwangerschap wordt vastgesteld (zie: PREVENTIEVE MAATREGELEN , Hyperprolactinemische toestanden ). In het geval dat Parlodel 2,5 mg opnieuw wordt ingesteld om een zich snel uitbreidend macroadenoom onder controle te houden (zie: PREVENTIEVE MAATREGELEN , Hyperprolactinemische toestanden en een patiënt tijdens de zwangerschap een hypertensieve aandoening ervaart, moet het voordeel van voortzetting van Parlodel worden afgewogen tegen het mogelijke risico van het gebruik ervan tijdens een hypertensieve aandoening tijdens de zwangerschap. Wanneer Parlodel wordt gebruikt voor de behandeling van acromegalie of de ziekte van Parkinson bij patiënten die vervolgens zwanger worden, moet worden besloten of de therapie medisch noodzakelijk blijft of kan worden stopgezet. Als het wordt voortgezet, moet het geneesmiddel worden gestaakt bij diegenen die mogelijk last hebben van hypertensieve stoornissen tijdens de zwangerschap (waaronder eclampsie, pre-eclampsie of door zwangerschap veroorzaakte hypertensie), tenzij het staken van Parlodel medisch gecontra-indiceerd wordt geacht. Vanwege de mogelijkheid van een interactie tussen Parlodel en andere ergotalkaloïden, wordt het gelijktijdig gebruik van deze geneesmiddelen niet aanbevolen. Periodieke controle van de bloeddruk, vooral tijdens de eerste weken van de therapie, is verstandig. Als hypertensie, ernstige, progressieve of aanhoudende hoofdpijn (met of zonder visuele stoornis) of tekenen van CZS-toxiciteit optreden, moet de medicamenteuze behandeling worden stopgezet en moet de patiënt onmiddellijk worden geëvalueerd. Bijzondere aandacht moet worden besteed aan patiënten die onlangs zijn behandeld of die gelijktijdig worden behandeld met geneesmiddelen die de bloeddruk kunnen veranderen. Het gelijktijdige gebruik ervan in het kraambed wordt niet aanbevolen.
Bij patiënten die Parlodel kregen, met name bij langdurige behandeling met hoge doses, zijn pleurale en pericardiale effusies, evenals pleurale en pulmonale fibrose en constrictieve pericarditis gemeld. Patiënten met onverklaarbare pleuropulmonale aandoeningen moeten grondig worden onderzocht en stopzetting van de behandeling met Parlodel 2,5 mg moet worden overwogen. In die gevallen waarin de behandeling met Parlodel 2,5 mg werd stopgezet, keerden de veranderingen langzaam terug naar normaal.
Bij enkele patiënten die Parlodel kregen, met name bij langdurige behandeling met hoge doses, is retroperitoneale fibrose gemeld. Om ervoor te zorgen dat retroperitoneale fibrose in een vroeg reversibel stadium wordt herkend, wordt aanbevolen om de manifestaties (bijv. rugpijn, oedeem van de onderste ledematen, verminderde nierfunctie) in deze categorie patiënten in de gaten te houden. Parlodel-medicatie moet worden stopgezet als fibrotische veranderingen in het retroperitoneum worden gediagnosticeerd of vermoed.
PREVENTIEVE MAATREGELEN
Algemeen
Er zijn meldingen geweest van patiënten met intense drang om te gokken, verhoogde seksuele drang, intense drang om ongecontroleerd geld uit te geven en/of andere intense drang, en het onvermogen om deze drang onder controle te houden tijdens het gebruik van een of meer van de medicijnen, waaronder Parlodel 2,5 mg , die de centrale dopaminerge tonus verhogen. In sommige gevallen, hoewel niet alle, werd gemeld dat deze aandrang was gestopt toen de dosis werd verlaagd of de medicatie werd stopgezet. Omdat patiënten dit gedrag mogelijk niet als abnormaal herkennen, is het belangrijk dat voorschrijvers patiënten of hun verzorgers specifiek vragen naar de ontwikkeling van nieuwe of toegenomen gokdrang, seksuele driften, ongecontroleerde uitgaven of andere driften tijdens de behandeling met Parlodel 2,5 mg voor de ziekte van Parkinson. of hyperprolactinemie-geassocieerde disfuncties. Artsen dienen een dosisverlaging of stopzetting van de medicatie te overwegen als een patiënt dergelijke neigingen ontwikkelt tijdens het gebruik van Parlodel.
De veiligheid en werkzaamheid van Parlodel (bromocriptinemesylaat) zijn niet vastgesteld bij patiënten met nier- of leveraandoeningen. Voorzichtigheid is geboden bij gelijktijdige toediening van Parlodel-therapie met andere geneesmiddelen waarvan bekend is dat ze de bloeddruk verlagen.
Het medicijn moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van psychose of hart- en vaatziekten. Als acromegaliepatiënten of patiënten met prolactinoom of de ziekte van Parkinson tijdens de zwangerschap worden behandeld met Parlodel 2,5 mg, moeten ze voorzichtig worden geobserveerd, vooral tijdens de postpartumperiode als ze een voorgeschiedenis van hart- en vaatziekten hebben.
Patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, ernstige lactasedeficiëntie of glucose-galactosemalabsorptie dienen dit geneesmiddel niet te gebruiken.
Hyperprolactinemische toestanden
Verslechtering van het gezichtsveld is een bekende complicatie van macroprolactinoom. Een effectieve behandeling met Parlodel 2,5 mg leidt tot een vermindering van hyperprolactinemie en vaak tot een oplossing van de visuele beperking. Bij sommige patiënten kan zich echter een secundaire verslechtering van de gezichtsvelden ontwikkelen ondanks genormaliseerde prolactinespiegels en tumorkrimp, wat het gevolg kan zijn van tractie op het optische chiasma dat naar beneden wordt getrokken in de nu gedeeltelijk lege sella. In deze gevallen kan het gezichtsvelddefect verbeteren bij verlaging van de bromocriptinedosering, terwijl er sprake is van enige verhoging van prolactine en enige herexpansie van de tumor. Monitoring van gezichtsvelden bij patiënten met macroprolactinoom wordt daarom aanbevolen voor een vroege herkenning van secundair veldverlies als gevolg van chiasmale hernia en aanpassing van de dosering van het geneesmiddel.
De relatieve werkzaamheid van Parlodel versus chirurgie bij het behoud van gezichtsvelden is niet bekend. Patiënten met snel progressief gezichtsveldverlies moeten worden beoordeeld door een neurochirurg om te helpen beslissen over de meest geschikte therapie.
Aangezien zwangerschap vaak het therapeutische doel is bij veel hyperprolactinemische patiënten met amenorroe/galactorroe en hypogonadisme (onvruchtbaarheid), is een zorgvuldige beoordeling van de hypofyse essentieel om de aanwezigheid van een prolactine-afscheidend adenoom te detecteren. Patiënten die niet zwanger willen worden of patiënten met grote adenomen moeten worden geadviseerd om andere anticonceptiemaatregelen dan orale anticonceptiva te gebruiken tijdens de behandeling met Parlodel. Aangezien zwangerschap kan optreden voordat de menstruatie weer begint, wordt aanbevolen om tijdens de amenorroeperiode ten minste elke 4 weken een zwangerschapstest uit te voeren en, zodra de menstruatie is hervat, elke keer dat een patiënt een menstruatie mist. Behandeling met Parlodel SnapTabs of capsules moet worden gestaakt zodra zwangerschap is vastgesteld. Patiënten moeten tijdens de zwangerschap nauwlettend worden gecontroleerd op tekenen en symptomen die kunnen wijzen op de vergroting van een voorheen niet-gedetecteerde of bestaande prolactine-afscheidende tumor. Stopzetting van de behandeling met Parlodel bij patiënten met bekende macroadenomen is in de meeste gevallen in verband gebracht met snelle hergroei van de tumor en toename van serumprolactine.
Cerebrospinale vloeistof rinorroe is waargenomen bij sommige patiënten met prolactine-afscheidende adenomen die werden behandeld met Parlodel.
acromegalie
Bij sommige acromegaliepatiënten die met Parlodel werden behandeld, is koudegevoelig digitaal vasospasme waargenomen. De reactie, mocht deze optreden, kan worden omgekeerd door de dosis Parlodel 2,5 mg te verlagen en kan worden voorkomen door de vingers warm te houden. Er zijn gevallen gemeld van ernstige gastro-intestinale bloedingen door maagzweren, waarvan sommige fataal. Hoewel er geen bewijs is dat Parlodel 2,5 mg de incidentie van maagzweren bij acromegaliepatiënten verhoogt, moeten symptomen die wijzen op een maagzweer grondig worden onderzocht en op de juiste manier worden behandeld. Patiënten met een voorgeschiedenis van ulcus pepticum of gastro-intestinale bloeding moeten zorgvuldig worden geobserveerd tijdens de behandeling met Parlodel.
Mogelijke tumoruitbreiding tijdens behandeling met Parlodel is bij enkele patiënten gemeld. Aangezien het natuurlijk beloop van groeihormoon-afscheidende tumoren niet bekend is, dienen alle patiënten zorgvuldig te worden gecontroleerd en, als er aanwijzingen zijn voor tumoruitbreiding, stopzetting van de behandeling en alternatieve procedures in overweging te nemen.
Ziekte van Parkinson
De veiligheid bij langdurig gebruik gedurende meer dan 2 jaar bij de doses die nodig zijn voor parkinsonisme is niet vastgesteld.
Zoals bij elke chronische therapie, wordt een periodieke evaluatie van de lever-, hematopoëtische, cardiovasculaire en nierfunctie aanbevolen. Symptomatische hypotensie kan optreden en daarom is voorzichtigheid geboden bij de behandeling van patiënten die antihypertensiva krijgen.
Hoge doses Parlodel 2,5 mg kunnen gepaard gaan met verwardheid en mentale stoornissen. Aangezien parkinsonpatiënten milde vormen van dementie kunnen vertonen, is voorzichtigheid geboden bij de behandeling van dergelijke patiënten.
Parlodel, alleen of gelijktijdig met levodopa toegediend, kan hallucinaties veroorzaken (visueel of auditief). Hallucinaties verdwijnen meestal met verlaging van de dosering; af en toe is stopzetting van Parlodel 2,5 mg vereist. Zelden, na hoge doses, hielden hallucinaties enkele weken aan na stopzetting van Parlodel.
Net als bij levodopa moet voorzichtigheid worden betracht bij het toedienen van Parlodel aan patiënten met een voorgeschiedenis van een myocardinfarct die een resterende atriale, nodale of ventriculaire aritmie hebben.
Retroperitoneale fibrose is gemeld bij enkele patiënten die langdurig (2 tot 10 jaar) werden behandeld met Parlodel 2,5 mg in doses variërend van 30-140 mg per dag.
Epidemiologische studies hebben aangetoond dat patiënten met de ziekte van Parkinson een hoger risico hebben (ongeveer 6 keer hoger) om melanoom te ontwikkelen dan de algemene bevolking. Of het waargenomen verhoogde risico te wijten was aan de ziekte van Parkinson of aan andere factoren, zoals geneesmiddelen die worden gebruikt om de ziekte van Parkinson te behandelen, is onduidelijk. Om de hierboven genoemde redenen wordt patiënten en zorgverleners geadviseerd om regelmatig en regelmatig op melanomen te controleren wanneer Parlodel voor welke indicatie dan ook wordt gebruikt. Idealiter zouden periodieke huidonderzoeken moeten worden uitgevoerd door daartoe gekwalificeerde personen (bijv. dermatologen).
Stopzetting van Parlodel dient waar mogelijk geleidelijk te gebeuren, zelfs als de patiënt levodopa moet blijven gebruiken. Een symptoomcomplex dat lijkt op het maligne neuroleptisch syndroom (gekenmerkt door verhoogde temperatuur, spierstijfheid, veranderd bewustzijn en autonome instabiliteit), zonder andere duidelijke etiologie, is gemeld in verband met snelle dosisverlaging, stopzetting van of veranderingen in antiparkinsontherapie.
Symptomen, waaronder apathie, angst, depressie, vermoeidheid, slapeloosheid, zweten en pijn zijn gemeld tijdens het afbouwen of na stopzetten van dopamine-agonisten, waaronder Parlodel. Deze symptomen reageren over het algemeen niet op levodopa. Voordat de behandeling met Parlodel wordt stopgezet, moeten patiënten worden geïnformeerd over mogelijke ontwenningsverschijnselen en nauwlettend worden gecontroleerd tijdens en na het stoppen met Parlodel. In geval van ernstige ontwenningsverschijnselen kan hertoediening van een dopamine-agonist met de laagste effectieve dosis worden overwogen.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd een onderzoek van 74 weken uitgevoerd bij muizen waarbij gebruik werd gemaakt van broomcriptinemesylaat in de voeding, overeenkomend met orale doses van 10 en 50 mg/kg/dag. Een 100 weken durend onderzoek bij ratten werd uitgevoerd met voedingsniveaus die overeenkomen met orale doses van 1,7, 9,8 en 44 mg/kg/dag. De hoogste doses die bij muizen en ratten werden getest, waren respectievelijk ongeveer 2,5 en 4,4 maal de maximale dosis bij de mens die werd toegediend in gecontroleerde klinische onderzoeken (100 mg/dag) op basis van het lichaamsoppervlak. Kwaadaardige baarmoedertumoren, endometrium en myometrium, werden als volgt gevonden bij ratten: 0/50 vrouwtjes in de controlegroep, 2/50 vrouwtjes kregen dagelijks 1,7 mg/kg, 7/49 vrouwtjes kregen dagelijks 9,8 mg/kg en 9/50 vrouwtjes kregen 44 mg/kg per dag. Het optreden van deze neoplasmata is waarschijnlijk toe te schrijven aan de hoge oestrogeen/progesteronverhouding die optreedt bij ratten als gevolg van de prolactineremmende werking van bromocriptinemesylaat. De endocriene mechanismen waarvan wordt aangenomen dat ze bij ratten betrokken zijn, zijn niet aanwezig bij mensen. Er is geen bekende correlatie tussen uteriene maligniteiten die optreden bij met bromocriptine behandelde ratten en het risico bij de mens. In tegenstelling tot de bevindingen bij ratten vertoonden de baarmoeders van muizen die na 74 weken behandeling waren gedood geen bewijs van geneesmiddelgerelateerde veranderingen.
Bromocriptinemesylaat werd geëvalueerd op mutageen potentieel in de reeks tests, waaronder Ames-bacteriële mutatietest, mutagene activiteit in vitro op V79-fibroblasten van Chinese hamsters, cytogenetische analyse van beenmergcellen van Chinese hamsters na in vivo behandeling en een in vivo micronucleustest voor mutageen potentieel bij muizen.
Bij geen van deze tests werden mutagene effecten verkregen.
Vruchtbaarheid en reproductieprestaties bij vrouwelijke ratten werden niet nadelig beïnvloed door behandeling met bromocriptine boven de voorspelde afname van het gewicht van jongen als gevolg van onderdrukking van de lactatie. Bij mannen die met 50 mg/kg van dit geneesmiddel werden behandeld, lagen de paring en vruchtbaarheid binnen het normale bereik. Verhoogd perinataal verlies werd geproduceerd in de subgroepen van moederdieren, opgeofferd op dag 21 postpartum (pp) na paring met mannetjes behandeld met de hoogste dosis (50 mg/kg).
Zwangerschap
Categorie B
Toediening van 10-30 mg/kg bromocriptine aan 2 rattenstammen op dag 6 tot 15 postcoitum (pc) evenals een enkele dosis van 10 mg/kg op dag 5 pc interfereerde met nidatie. Drie mg/kg gegeven op dag 6 tot 15 had geen effect op de nidatie en veroorzaakte geen afwijkingen. Bij dieren die werden behandeld vanaf dag 8-15 pc, dwz na implantatie, veroorzaakte 30 mg/kg een verhoogde prenatale mortaliteit in de vorm van een verhoogde incidentie van embryonale resorptie. Eén anomalie, aplasie van ruggengraatwervels en ribben, werd gevonden in de groep van 262 foetussen afkomstig van de moederdieren die waren behandeld met 30 mg/kg bromocriptine. Er werden geen foetotoxische effecten gevonden bij nakomelingen van moederdieren die tijdens de peri- of postnatale periode werden behandeld.
Er zijn twee onderzoeken uitgevoerd bij konijnen (2 stammen) om de mogelijke interferentie met nidatie te bepalen. Doseringen van 100 of 300 mg/kg/dag van dag 1 tot dag 6 pc hadden geen nadelige invloed op de nidatie. De hoge dosis was ongeveer 63 keer de maximale dosis voor de mens die werd toegediend in gecontroleerde klinische onderzoeken (100 mg/dag), gebaseerd op het lichaamsoppervlak. Bij witte konijnen uit Nieuw-Zeeland trad enige embryosterfte op bij 300 mg/kg, wat een weerspiegeling was van openlijke maternale toxiciteit. Er zijn drie onderzoeken uitgevoerd bij 2 konijnenstammen om het teratologische potentieel van bromocriptine te bepalen bij doseringen van 3, 10, 30, 100 en 300 mg/kg, gegeven van dag 6 tot dag 18 pc. In 2 onderzoeken met de geelzilverstam , gespleten gehemelte werd gevonden bij 3 en 2 foetussen bij maternale toxische doses van respectievelijk 100 en 300 mg/kg. Een controlefoetus vertoonde ook deze anomalie. In de derde studie uitgevoerd met Nieuw-Zeelandse witte konijnen met een identiek protocol, werden geen gespleten gehemelte geproduceerd.
Er werden geen teratologische of embryotoxische effecten van bromocriptine geproduceerd bij een van de 6 nakomelingen van 6 apen bij een dosisniveau van 2 mg/kg.
Er is informatie verzameld over 1276 zwangerschappen bij vrouwen die Parlodel gebruiken. In de meeste gevallen werd Parlodel stopgezet binnen 8 weken zwangerschap (gemiddeld 28,7 dagen), maar 8 patiënten kregen het geneesmiddel continu tijdens de zwangerschap. De gemiddelde dagelijkse dosis voor alle patiënten was 5,8 mg (bereik 1-40 mg).
Van deze 1276 zwangerschappen waren er 1088 voldragen bevallingen (4 doodgeboren), 145 spontane abortussen (11,4%) en 28 geïnduceerde abortussen (2,2%). Bovendien veroorzaakten 12 extra-uteriene zwangerschappen en 3 hydatidiforme moedervlekken (tweemaal bij dezelfde patiënt) een vroegtijdige zwangerschapsafbreking. Deze gegevens steken gunstig af bij het abortuspercentage (11% -25%) dat wordt genoemd voor zwangerschappen veroorzaakt door clomifeencitraat, menopauzale gonadotropine en choriongonadotrofine.
Hoewel spontane abortussen vaak niet worden gemeld, vooral vóór 20 weken zwangerschap, wordt de frequentie geschat op 15%.
De incidentie van geboorteafwijkingen in de algemene bevolking varieert van 2% -4,5%. De incidentie bij 1109 levendgeborenen van patiënten die bromocriptine kregen, is 3,3%.
Er is geen suggestie dat Parlodel 2,5 mg heeft bijgedragen aan het type of de incidentie van geboorteafwijkingen bij deze groep zuigelingen.
Moeders die borstvoeding geven
Parlodel 2,5 mg mag niet worden gebruikt tijdens het geven van borstvoeding bij postpartum vrouwen.
Pediatrisch gebruik
De veiligheid en werkzaamheid van bromocriptine voor de behandeling van prolactine-afscheidende hypofyseadenomen zijn vastgesteld bij patiënten in de leeftijd van 16 tot volwassen. Er zijn geen gegevens beschikbaar over het gebruik van bromocriptine bij pediatrische patiënten jonger dan 8 jaar. Een enkele 8-jarige patiënt die werd behandeld met bromocriptine voor een prolactine-afscheidend hypofyse-macroadenoom is gemeld zonder therapeutische respons.
Het gebruik van bromocriptine voor de behandeling van prolactine-afscheidende adenomen bij pediatrische patiënten in de leeftijdsgroep van 11 tot onder de 16 jaar wordt ondersteund door gegevens uit goed gecontroleerde onderzoeken bij volwassenen, met aanvullende gegevens bij een beperkt aantal (n=14) kinderen en adolescenten van 11 tot 15 jaar met prolactine-afscheidende hypofyse-macro- en microadenomen die zijn behandeld met bromocriptine. Van de 14 gerapporteerde patiënten hadden 9 succesvolle resultaten, 3 gedeeltelijke reacties en 2 reageerden niet op bromocriptinebehandeling. Chronisch hypopituïtarisme bemoeilijkte de behandeling van macroadenoom bij 5 van de responders, zowel bij patiënten die alleen bromocriptine kregen als bij degenen die bromocriptine kregen in combinatie met chirurgische behandeling en/of bestraling van de hypofyse.
De veiligheid en werkzaamheid van bromocriptine bij pediatrische patiënten zijn niet vastgesteld voor enige andere indicatie die wordt vermeld in de rubriek INDICATIES EN GEBRUIK.
Geriatrisch gebruik
Klinische onderzoeken met Parlodel 2,5 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of ouderen anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen, waaronder postmarketingmeldingen van bijwerkingen, hebben echter geen verschillen in respons of verdraagbaarheid tussen oudere en jongere patiënten aangetoond. Hoewel er geen variatie in werkzaamheid of bijwerkingenprofiel is waargenomen bij geriatrische patiënten die Parlodel 2,5 mg gebruiken, kan een grotere gevoeligheid van sommige oudere personen niet categorisch worden uitgesloten. Over het algemeen dient de dosiskeuze voor een oudere patiënt voorzichtig te zijn, beginnend aan de onderkant van het dosisbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling bij deze populatie.
OVERDOSERING
De meest gemelde tekenen en symptomen die gepaard gaan met een acute overdosering van Parlodel (bromocriptinemesylaat) zijn: misselijkheid, braken, constipatie, diaforese, duizeligheid, bleekheid, ernstige hypotensie, malaise, verwardheid, lethargie, slaperigheid, wanen, hallucinaties en herhaaldelijk geeuwen. De dodelijke dosis is niet vastgesteld en het medicijn heeft een zeer brede veiligheidsmarge. Er vond echter één overlijden plaats bij een patiënt die zelfmoord pleegde met een onbekende hoeveelheid Parlodel 2,5 mg en chloroquine.
Behandeling van overdosering bestaat uit verwijdering van het geneesmiddel door braken (indien bij bewustzijn), maagspoeling, geactiveerde kool of zoutoplossing. Zorgvuldig toezicht en registratie van vochtinname en -afgifte is essentieel. Hypotensie moet worden behandeld door de patiënt in de Trendelenburg-positie te plaatsen en IV-vloeistoffen toe te dienen. Als een bevredigende verlichting van hypotensie niet kan worden bereikt door de bovenstaande maatregelen volledig te gebruiken, moeten vasopressoren worden overwogen.
Er zijn geïsoleerde meldingen van kinderen die per ongeluk Parlodel hebben ingenomen. Braken, slaperigheid en koorts werden gemeld als bijwerkingen. Patiënten herstelden spontaan binnen een paar uur of na de juiste behandeling.
CONTRA-INDICATIES
Overgevoeligheid voor bromocriptine of voor een van de hulpstoffen van Parlodel (bromocriptinemesylaat), ongecontroleerde hypertensie en gevoeligheid voor ergotalkaloïden. Bij patiënten die worden behandeld voor hyperprolactinemie, moet Parlodel 2,5 mg worden gestaakt wanneer zwangerschap wordt vastgesteld (zie: PREVENTIEVE MAATREGELEN , Hyperprolactinemische toestanden ). In het geval dat Parlodel 2,5 mg opnieuw wordt ingesteld om een zich snel uitbreidend macroadenoom onder controle te houden (zie: PREVENTIEVE MAATREGELEN , Hyperprolactinemische toestanden en een patiënt tijdens de zwangerschap een hypertensieve aandoening ervaart, moet het voordeel van voortzetting van Parlodel worden afgewogen tegen het mogelijke risico van het gebruik ervan tijdens een hypertensieve aandoening tijdens de zwangerschap. Wanneer Parlodel wordt gebruikt voor de behandeling van acromegalie, prolactinoom of de ziekte van Parkinson bij patiënten die vervolgens zwanger worden, moet worden besloten of de therapie medisch noodzakelijk blijft of kan worden stopgezet. Als het wordt voortgezet, moet het geneesmiddel worden gestaakt bij diegenen die mogelijk last hebben van hypertensieve stoornissen tijdens de zwangerschap (waaronder eclampsie, pre-eclampsie of door zwangerschap veroorzaakte hypertensie), tenzij het staken van Parlodel medisch gecontra-indiceerd wordt geacht.
Het geneesmiddel mag niet worden gebruikt tijdens de postpartumperiode bij vrouwen met een voorgeschiedenis van coronaire hartziekte en andere ernstige cardiovasculaire aandoeningen, tenzij ontwenning als medisch gecontra-indiceerd wordt beschouwd. Als het medicijn in de postpartumperiode wordt gebruikt, moet de patiënt met de nodige voorzichtigheid worden geobserveerd.
KLINISCHE FARMACOLOGIE
Parlodel (bromocriptinemesylaat) is een dopaminereceptoragonist, die postsynaptische dopaminereceptoren activeert. De dopaminerge neuronen in het tuberoinfundibulaire proces moduleren de secretie van prolactine uit de hypofysevoorkwab door een prolactineremmende factor uit te scheiden (waarvan wordt aangenomen dat het dopamine is); in het corpus striatum zijn de dopaminerge neuronen betrokken bij de controle van de motorische functie. Klinisch verlaagt Parlodel 2,5 mg de plasmaspiegels van prolactine significant bij patiënten met fysiologisch verhoogde prolactine en bij patiënten met hyperprolactinemie. De remming van fysiologische lactatie en galactorroe bij pathologische hyperprolactinemische toestanden wordt verkregen bij dosisniveaus die de secretie van andere tropische hormonen uit de hypofysevoorkwab niet beïnvloeden. Experimenten hebben aangetoond dat bromocriptine langdurig stereotiep gedrag bij knaagdieren en draaigedrag bij ratten met eenzijdige laesies in de substantia nigra induceert. Deze werkingen, die kenmerkend zijn voor die welke door dopamine worden geproduceerd, worden geremd door dopamineantagonisten en suggereren een directe werking van bromocriptine op striatale dopaminereceptoren.
Bromocriptinemesylaat is een niet-hormonaal, niet-oestrogene stof die de secretie van prolactine bij mensen remt, met weinig of geen effect op andere hypofysehormonen, behalve bij patiënten met acromegalie, waar het bij de meeste patiënten verhoogde bloedspiegels van groeihormoon verlaagt.
Bromocriptinemesylaat heeft een therapeutisch effect bij de behandeling van de ziekte van Parkinson, een klinische aandoening die wordt gekenmerkt door een progressieve deficiëntie in de dopaminesynthese in de substantia nigra, door de dopaminereceptoren in het corpus striatum direct te stimuleren. Daarentegen oefent levodopa zijn therapeutisch effect pas uit na omzetting in dopamine door de neuronen van de substantia nigra, waarvan bekend is dat ze numeriek zijn verminderd bij deze patiëntenpopulatie.
Farmacokinetiek
Absorptie
Na toediening van een enkelvoudige dosis Parlodel 2,5 mg tabletten, 2 x 2,5 mg aan 5 gezonde vrijwilligers in nuchtere toestand, waren de gemiddelde piekplasmaspiegels van bromocriptine, tijd om piekplasmaconcentraties te bereiken en eliminatiehalfwaardetijd 465 pg/ml ± 226, 2,5 respectievelijk uur ± 2 en 4,85 uur.1 Er werd een lineair verband gevonden tussen enkelvoudige doses Parlodel 2,5 mg en Cmax en AUC in het dosisbereik van 1 tot 7,5 mg.2 De farmacokinetiek van bromocriptinemetabolieten is niet gemeld.
Voedsel had geen significante invloed op de systemische blootstelling aan bromocriptine na toediening van Parlodel-tabletten, 2,5 mg.3 Het wordt aanbevolen Parlodel 2,5 mg met voedsel in te nemen vanwege het hoge percentage proefpersonen dat moet braken na toediening van bromocriptine in nuchtere toestand.
Na toediening van Parlodel 5 mg tweemaal daags gedurende 14 dagen, waren de bromocriptine Cmax en AUC bij steady-state respectievelijk 628 ± 375 pg/ml en 2377 ± 1186 pg*uur/ml.4
Verdeling
In vitro-experimenten toonden aan dat bromocriptine voor 90% -96% gebonden was aan serumalbumine.
Metabolisme
Bromocriptine ondergaat een uitgebreide first-pass biotransformatie, wat wordt weerspiegeld door complexe metabolietprofielen en door de bijna volledige afwezigheid van het oorspronkelijke geneesmiddel in urine en feces.
In-vitro-onderzoeken met humane levermicrosomen hebben aangetoond dat bromocriptine een hoge affiniteit heeft voor CYP3A en dat hydroxylaties aan de proline-ring van de cyclopeptidegroep een belangrijke metabole route vormen.5 Remmers en/of krachtige substraten voor CYP3A4 zouden daarom de klaring van bromocriptine en lood kunnen remmen. tot verhoogde niveaus. (zien PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES sectie). De deelname van andere belangrijke CYP-enzymen zoals 2D6, 2C8 en 2C19 aan het metabolisme van bromocriptine is niet onderzocht. Bromocriptine is ook een remmer van CYP3A4 met een berekende IC50-waarde van 1,69 M.6 Gezien de lage therapeutische concentraties van bromocriptine bij patiënten (Cmax=0,82 nM), zou een significante verandering van het metabolisme van een tweede geneesmiddel waarvan de klaring wordt gemedieerd door CYP3A4 niet wordt verwacht. Het mogelijke effect van bromocriptine en zijn metabolieten om te werken als inductoren van CYP-enzymen is niet gemeld.
uitscheiding
Ongeveer 82% en 5,6% van de oraal toegediende radioactieve dosis werd respectievelijk teruggevonden in feces en urine. Broomlyserginezuur en broomisolyserginezuur waren verantwoordelijk voor de helft van de radioactiviteit in de urine.5
Specifieke populaties
Effect van nierinsufficiëntie
Het effect van de nierfunctie op de farmacokinetiek van bromocriptine is niet onderzocht.
Aangezien het oorspronkelijke geneesmiddel en de metabolieten bijna volledig via het metabolisme worden uitgescheiden en slechts 6% via de nieren, is het mogelijk dat nierinsufficiëntie geen significante invloed heeft op de farmacokinetiek van bromocriptine en zijn metabolieten (zie PREVENTIEVE MAATREGELEN , Algemeen ).
Effect van leverinsufficiëntie
Het effect van leverinsufficiëntie op de farmacokinetiek van Parlodel en zijn metabolieten is niet onderzocht. Aangezien Parlodel voornamelijk wordt uitgescheiden door metabolisme, kan een leverfunctiestoornis de plasmaspiegels van bromocriptine verhogen, daarom kan voorzichtigheid geboden zijn (zie PREVENTIEVE MAATREGELEN , Algemeen ).
Het effect van leeftijd, ras en geslacht op de farmacokinetiek van bromocriptine en zijn metabolieten is niet onderzocht.
Klinische studies
In ongeveer 75% van de gevallen van amenorroe en galactorroe onderdrukt Parlodel 2,5 mg therapie de galactorroe volledig of bijna volledig, en herstart de normale ovulatoire menstruatiecycli.
De menstruatie wordt meestal opnieuw gestart voordat de galactorroe volledig is onderdrukt; de tijd hiervoor is gemiddeld 6 tot 8 weken. Sommige patiënten reageren echter binnen een paar dagen en bij andere kan het tot 8 maanden duren.
Galactorroe kan langer duren om onder controle te krijgen, afhankelijk van de mate van stimulatie van het borstweefsel voorafgaand aan de therapie. Na 8 tot 12 weken wordt gewoonlijk een vermindering van de secretie van ten minste 75% waargenomen. Sommige patiënten kunnen zelfs na 12 maanden therapie niet reageren.
Bij veel acromegaliepatiënten veroorzaakt Parlodel 2,5 mg een snelle en aanhoudende verlaging van de circulerende serumgroeihormoonspiegels.
1 Nelson, M. et. al. (1990). Farmacokinetische evaluatie van erytromycine en cafeïne toegediend met bromocriptine. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz, et al. (1980). De farmacokinetiek van bromocriptine bij de mens. In: Golstein, M. Calne, DB, et. Al (red.). Moederkorenverbinding en hersenfunctie: Neuro-endocriene en neuropsychiatrische aspecten, blz. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). Het effect van voedsel en metoclopramide op de farmacokinetiek en bijwerkingen van bromocriptine. Eur J Geneesmiddel Metab Farmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E., en Jervell, J., (1994). Een vergelijking van octreotide, bromocriptine of een combinatie van beide geneesmiddelen bij acromegalie. Journal of Clinical Endocrinology & Metabolism; Deel 79, 461-465
5 Peyronneau MA, Delaforge M, Riviere R et al. 1994. Hoge affiniteit van ergopeptiden voor CYP P450 3A. Belang van hun peptidegroep voor P450-herkenning en hydroxylering van bromocriptine. Eur J Biochem 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Beoordeling van mogelijke interacties tussen dopaminereceptoragonisten en verschillende humane cytochroom P450-enzymen met behulp van een eenvoudig in vitro remmingsscherm. Drug Metab Dispos; 25:1211-14.
PATIËNT INFORMATIE
Tijdens klinische onderzoeken zijn duizeligheid, slaperigheid, flauwvallen, flauwvallen en syncope gemeld aan het begin van de behandeling met Parlodel 2,5 mg. In postmarketingrapporten is Parlodel in verband gebracht met slaperigheid en plotseling in slaap vallen, vooral bij patiënten met de ziekte van Parkinson. Plotseling in slaap vallen tijdens dagelijkse activiteiten, in sommige gevallen zonder bewustzijn of waarschuwingssignalen, is zeer zelden gemeld. Alle patiënten die Parlodel krijgen, moeten worden gewaarschuwd voor activiteiten die een snelle en nauwkeurige reactie vereisen, zoals autorijden of machines bedienen. Patiënten die worden behandeld met Parlodel 2,5 mg en die slaperigheid en/of plotselinge slaapperioden vertonen, moeten worden geadviseerd niet te rijden of activiteiten uit te voeren waarbij een verminderde alertheid henzelf of anderen in gevaar kan brengen op ernstig letsel of overlijden (bijv. bij het bedienen van machines).
Patiënten die Parlodel 2,5 mg krijgen voor hyperprolactinemische toestanden geassocieerd met macroadenoom of patiënten die eerder een transsfenoïdale operatie hebben ondergaan, moeten worden verteld dat ze aanhoudende waterige loopneus moeten melden aan hun arts. Patiënten die Parlodel 2,5 mg krijgen voor de behandeling van een macroadenoom, moeten worden verteld dat stopzetting van het geneesmiddel gepaard kan gaan met snelle hergroei van de tumor en terugkeer van hun oorspronkelijke symptomen.
Patiënten en hun verzorgers moeten worden gewaarschuwd voor de mogelijkheid dat patiënten intense drang ervaren om ongecontroleerd geld uit te geven, intense drang om te gokken, verhoogde seksuele drang en andere intense drang en het onvermogen om deze drang te beheersen tijdens het gebruik van Parlodel. Adviseer patiënten en hun zorgverleners om hun zorgverlener te informeren als ze nieuwe of verhoogde ongecontroleerde uitgaven, gokdrang, seksuele driften of andere driften ontwikkelen terwijl ze worden behandeld met Parlodel [zie PREVENTIEVE MAATREGELEN ].
Vooral tijdens de eerste dagen van de behandeling kunnen af en toe hypotensieve reacties optreden en resulteren in verminderde alertheid. Bijzondere voorzichtigheid is geboden bij het besturen van een voertuig of het bedienen van machines.
Adviseer patiënten om contact op te nemen met hun zorgverlener als ze willen stoppen met Parlodel of de dosis Parlodel willen verlagen. Adviseer patiënten aan wie een lagere dosis is voorgeschreven of die zijn gestopt met het medicijn om hun zorgverlener op de hoogte te stellen als ze ontwenningsverschijnselen hebben zoals koorts, spierstijfheid, veranderd bewustzijn, apathie, angst, depressie, vermoeidheid, slapeloosheid, zweten of pijn (zie PREVENTIEVE MAATREGELEN ).
