Behandeling van pijn: Lioresal 10mg, 25mg Baclofen Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Lioresal 10 mg Intrathecaal en hoe wordt het gebruikt?
Lioresal Intrathecaal is een receptgeneesmiddel dat wordt gebruikt om de symptomen van spasticiteit te behandelen. Lioresal Intrathecaal kan alleen of in combinatie met andere medicijnen worden gebruikt.
Lioresal Intrathecaal behoort tot een klasse geneesmiddelen die skeletspierrelaxanten worden genoemd.
Het is niet bekend of Lioresal Intrathecaal veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Lioresal 25 mg intrathecaal?
Lioresal 10 mg Intrathecaal kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- ernstige slaperigheid,
- zwakke of oppervlakkige ademhaling,
- verwardheid,
- hallucinaties,
- jeuk, tintelingen of spiertrekkingen in uw handen, armen, voeten of benen,
- koorts, en
- hartinfarct
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Lioresal 25 mg Intrathecaal zijn:
- slaperigheid,
- duizeligheid,
- zwakheid,
- vermoeidheid,
- hoofdpijn,
- slaapproblemen (slapeloosheid),
- misselijkheid,
- constipatie, en
- vaker plassen dan normaal
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Lioresal Intrathecal. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Abrupte stopzetting van intrathecaal baclofen, ongeacht de oorzaak, heeft geresulteerd in gevolgen zoals hoge koorts, veranderde mentale toestand, overdreven rebound-spasticiteit en spierstijfheid, die in zeldzame gevallen is verergerd tot rabdomyolyse, falen van meerdere orgaansystemen en overlijden.
Preventie van abrupte stopzetting van intrathecaal baclofen vereist zorgvuldige aandacht voor de programmering en bewaking van het infusiesysteem, de planning en procedures voor bijvullen en pompalarmen. Patiënten en zorgverleners moeten worden geïnformeerd over het belang van het houden van geplande navulbezoeken en moeten worden voorgelicht over de vroege symptomen van ontwenning van baclofen. Speciale aandacht moet worden besteed aan patiënten met een duidelijk risico (bijv. ruggenmergletsel op T-6 of hoger, communicatieproblemen, voorgeschiedenis van ontwenningsverschijnselen van oraal of intrathecaal baclofen). Raadpleeg de technische handleiding van het implanteerbare infuussysteem voor aanvullende post-implantaire clinicus- en patiëntinformatie (zie WAARSCHUWINGEN ).
OMSCHRIJVING
LIORESAL INTRATHECAL (baclofen-injectie) is een spierverslapper en antispastisch. De chemische naam is 4-amino-3-(4-chloorfenyl)butaanzuur en de structuurformule is:
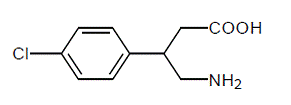
Baclofen is een wit tot gebroken wit, geurloos of praktisch geurloos kristallijn poeder, met een molecuulgewicht van 213,66. Het is slecht oplosbaar in water, zeer slecht oplosbaar in methanol en onoplosbaar in chloroform.
LIORESAL INTRATHECAL is een steriele, pyrogeenvrije, isotone oplossing die vrij is van antioxidanten, conserveermiddelen of andere potentieel neurotoxische additieven en alleen bedoeld is voor intrathecale toediening. Het geneesmiddel is stabiel in oplossing bij 37°C en verenigbaar met CSF. Elke milliliter LIORESAL INTRATHECAL bevat baclofen USP 50 mcg, 500 mcg of 2000 mcg en natriumchloride 9 mg in water voor injectie; pH-bereik is 5,0 - 7,0. Elke ampul is UITSLUITEND bedoeld voor EENMALIG GEBRUIK. Gooi elk ongebruikt deel weg. NIET AUTOCLAVEN.
INDICATIES
LIORESAL 10 mg INTRATHECAL (baclofen-injectie) is geïndiceerd voor gebruik bij de behandeling van ernstige spasticiteit. Patiënten dienen eerst te reageren op een screeningsdosis intrathecaal baclofen voordat een langdurige infusie via een implanteerbare pomp wordt overwogen. Voor spasticiteit van oorsprong uit het ruggenmerg dient chronische infusie van LIORESAL INTRATHECAL via een implanteerbare pomp te worden gereserveerd voor patiënten die niet reageren op orale baclofentherapie, of voor patiënten die bij effectieve doses ondraaglijke bijwerkingen op het CZS ervaren. Patiënten met spasticiteit als gevolg van traumatisch hersenletsel dienen ten minste een jaar na het letsel te wachten voordat een langdurige intrathecale behandeling met baclofen wordt overwogen. LIORESAL INTRATHECAL is bedoeld voor gebruik via de intrathecale route in enkelvoudige bolustestdoses (via spinale katheter of lumbaalpunctie) en, voor chronisch gebruik, alleen in implanteerbare pompen die door de FDA zijn goedgekeurd, specifiek voor de toediening van LIORESAL INTRATHECAL in de intrathecale ruimte.
Spasticiteit van de oorsprong van het ruggenmerg
Bewijs dat de werkzaamheid van LIORESAL INTRATHECAL ondersteunt, werd verkregen in gerandomiseerde, gecontroleerde onderzoeken waarin de effecten van ofwel een enkele intrathecale dosis of een driedaagse intrathecale infusie van LIORESAL INTRATHECAL werden vergeleken met placebo bij patiënten met ernstige spasticiteit en spasmen als gevolg van trauma aan het ruggenmerg of meerdere sclerose. LIORESAL 10 mg INTRATHECAL was superieur aan placebo voor beide belangrijkste gebruikte uitkomstmaten: verandering ten opzichte van baseline in de Ashworth-beoordeling van spasticiteit en de frequentie van spasmen.
Spasticiteit van cerebrale oorsprong
De werkzaamheid van LIORESAL INTRATHECAL werd onderzocht in drie gecontroleerde klinische onderzoeken; twee ingeschreven patiënten met hersenverlamming en één ingeschreven patiënten met spasticiteit als gevolg van eerder hersenletsel. De eerste studie, een gerandomiseerde, gecontroleerde cross-over studie bij 51 patiënten met hersenverlamming, leverde sterke, statistisch significante resultaten op; LIORESAL INTRATHECAL was superieur aan placebo bij het verminderen van spasticiteit, gemeten met de Ashworth-schaal. Een tweede cross-over-onderzoek werd uitgevoerd bij 11 patiënten met spasticiteit als gevolg van hersenletsel. Ondanks de kleine steekproefomvang leverde de studie een bijna significante teststatistiek op (p=0,066) en leverde het richtingsgunstige resultaten op. De laatste studie leverde echter geen gegevens op die betrouwbaar konden worden geanalyseerd.
LIORESAL 10 mg INTRATHECAL-therapie kan worden beschouwd als een alternatief voor destructieve neurochirurgische procedures. Voorafgaand aan implantatie van een hulpmiddel voor chronische intrathecale infusie van LIORESAL 10 mg INTRATHECAL, moeten patiënten een respons op LIORESAL 10 mg INTRATHECAL laten zien in een screeningsonderzoek (zie DOSERING EN ADMINISTRATIE ).
DOSERING EN ADMINISTRATIE
Raadpleeg de handleiding van de fabrikant van de implanteerbare pomp die is goedgekeurd voor intrathecale infusie voor specifieke instructies en voorzorgsmaatregelen voor het programmeren van de pomp en/of het bijvullen van het reservoir. Er zijn diverse pompen met wisselende reservoirvolumes en er zijn diverse navulsets verkrijgbaar. Het is belangrijk om bekend te zijn met al deze producten om de juiste navulset te selecteren voor de specifieke pomp die wordt gebruikt.
Screeningsfase
Voordat de pomp wordt geïmplanteerd en de chronische infusie van LIORESAL INTRATHECAL (baclofen-injectie) wordt gestart, moeten patiënten een positieve klinische respons vertonen op een intrathecaal toegediende LIORESAL INTRATHECAL-bolusdosis in een screeningsonderzoek. De screeningstudie maakt gebruik van LIORESAL INTRATHECAL in een concentratie van 50 mcg/ml. Een ampul van 1 ml (50 mcg/ml) is beschikbaar voor gebruik in het screeningsonderzoek. De screeningsprocedure is als volgt. Een initiële bolus van 50 microgram in een volume van 1 milliliter wordt toegediend in de intrathecale ruimte door middel van barbotage gedurende een periode van niet minder dan één minuut. De patiënt wordt gedurende de volgende 4 tot 8 uur geobserveerd. Een positieve respons bestaat uit een significante afname van de spiertonus en/of frequentie en/of ernst van spasmen. Als de initiële respons minder is dan gewenst, kan een tweede bolusinjectie 24 uur na de eerste worden toegediend. De tweede screeningbolusdosis bestaat uit 75 microgram in 1,5 milliliter. Nogmaals, de patiënt moet gedurende een interval van 4 tot 8 uur worden geobserveerd. Als de respons nog steeds onvoldoende is, kan 24 uur later een laatste screeningsbolusdosis van 100 microgram in 2 milliliter worden toegediend.
Pediatrische patiënten
De startdosis voor screening bij pediatrische patiënten is dezelfde als bij volwassen patiënten, namelijk 50 mcg. Voor zeer kleine patiënten kan echter eerst een screeningdosis van 25 mcg worden geprobeerd. Patiënten die niet reageren op een intrathecale bolus van 100 mcg mogen niet in aanmerking komen voor een geïmplanteerde pomp voor chronische infusie.
Periode van dosistitratie na implantatie
Om de initiële totale dagelijkse dosis LIORESAL INTRATHECAL na implantatie te bepalen, moet de screeningdosis die een positief effect gaf, worden verdubbeld en over een periode van 24 uur worden toegediend, tenzij de werkzaamheid van de bolusdosis langer dan 8 uur werd gehandhaafd, waarbij in het geval dat de dagelijkse startdosis de screeningdosis moet zijn die over een periode van 24 uur wordt toegediend. De eerste 24 uur (dwz totdat de steady-state is bereikt) mogen geen dosisverhogingen worden gegeven.
Volwassen patiënten met spasticiteit van oorsprong van het ruggenmerg
Na de eerste 24 uur moet voor volwassen patiënten de dagelijkse dosering langzaam worden verhoogd met stappen van 10-30% en slechts eenmaal per 24 uur, totdat het gewenste klinische effect is bereikt.
Volwassen patiënten met spasticiteit van cerebrale oorsprong
Na de eerste 24 uur dient de dagelijkse dosis slechts eenmaal per 24 uur langzaam met 5-15% te worden verhoogd, totdat het gewenste klinische effect is bereikt.
Pediatrische patiënten
Na de eerste 24 uur dient de dagelijkse dosis slechts eenmaal per 24 uur langzaam met 5-15% te worden verhoogd, totdat het gewenste klinische effect is bereikt. Als er geen substantiële klinische respons is op verhogingen van de dagelijkse dosis, controleer dan of de pomp goed werkt en de katheter doorgankelijk is. Patiënten moeten nauwlettend worden gevolgd in een volledig uitgeruste en bemande omgeving tijdens de screeningfase en de dosistitratieperiode onmiddellijk na implantatie. Reanimatieapparatuur moet onmiddellijk beschikbaar zijn voor gebruik in geval van levensbedreigende of ondraaglijke bijwerkingen.
Onderhoudstherapie
Spasticiteit van patiënten met ruggenmergoorsprong
Het klinische doel is om de spiertonus zo normaal mogelijk te houden en de frequentie en ernst van spasmen zoveel mogelijk te minimaliseren, zonder ondraaglijke bijwerkingen te veroorzaken. Heel vaak moet de onderhoudsdosis tijdens de eerste paar maanden van de behandeling worden aangepast, terwijl patiënten zich aanpassen aan veranderingen in levensstijl als gevolg van de verlichting van spasticiteit. Tijdens het periodiek bijvullen van de pomp mag de dagelijkse dosis worden verhoogd met 10-40%, maar niet meer dan 40%, om adequate symptoomcontrole te behouden. De dagelijkse dosis kan met 10-20% worden verlaagd als patiënten bijwerkingen ervaren. De meeste patiënten hebben een geleidelijke verhoging van de dosis in de loop van de tijd nodig om een optimale respons te behouden tijdens chronische therapie. Een plotselinge grote behoefte aan dosisverhoging suggereert een kathetercomplicatie (dwz katheterknik of losraken).
De onderhoudsdosering voor langdurige continue infusie van LIORESAL 10 mg INTRATHECAL (baclofen-injectie) varieerde van 12 mcg/dag tot 2003 mcg/dag, waarbij de meeste patiënten voldoende werden gehandhaafd op 300 microgram tot 800 microgram per dag. Er is beperkte ervaring met dagelijkse doses hoger dan 1000 mcg/dag. Voor het bepalen van de optimale LIORESAL INTRATHECAL-dosis is individuele titratie vereist. De laagste dosis met een optimale respons moet worden gebruikt.
Spasticiteit van patiënten met cerebrale oorsprong
Het klinische doel is om de spiertonus zo normaal mogelijk te houden en de frequentie en ernst van spasmen zoveel mogelijk te minimaliseren, zonder onaanvaardbare bijwerkingen te veroorzaken, of om de dosis te titreren tot de gewenste mate van spiertonus voor optimale functies. Heel vaak moet de onderhoudsdosis tijdens de eerste paar maanden van de behandeling worden aangepast, terwijl patiënten zich aanpassen aan veranderingen in levensstijl als gevolg van de verlichting van spasticiteit. Tijdens het periodiek bijvullen van de pomp mag de dagelijkse dosis worden verhoogd met 5-20%, maar niet meer dan 20%, om adequate symptoomcontrole te behouden. De dagelijkse dosis kan met 10-20% worden verlaagd als patiënten bijwerkingen ervaren. Veel patiënten hebben in de loop van de tijd een geleidelijke dosisverhoging nodig om een optimale respons te behouden tijdens chronische therapie. Een plotselinge grote behoefte aan dosisverhoging suggereert een kathetercomplicatie (dwz katheterknik of losraken).
De onderhoudsdosering voor langdurige continue infusie van LIORESAL 25 mg INTRATHECAL (injectie met baclofen) varieerde van 22 mcg/dag tot 1400 mcg/dag, waarbij de meeste patiënten adequaat werden gehandhaafd op 90 microgram tot 703 microgram per dag. In klinische onderzoeken hadden slechts 3 van de 150 patiënten dagelijkse doses nodig van meer dan 1000 mcg/dag.
Pediatrische patiënten
Gebruik dezelfde doseringsaanbevelingen voor patiënten met spasticiteit van cerebrale oorsprong. In klinische onderzoeken leken pediatrische patiënten jonger dan 12 jaar een lagere dagelijkse dosis nodig te hebben. De gemiddelde dagelijkse dosis voor patiënten jonger dan 12 jaar was 274 mcg/dag, met een spreiding van 24 tot 1199 mcg/dag. De vereiste dosering voor pediatrische patiënten ouder dan 12 jaar lijkt niet te verschillen van die voor volwassen patiënten. Voor het bepalen van de optimale LIORESAL INTRATHECAL-dosis is individuele titratie vereist. De laagste dosis met een optimale respons moet worden gebruikt.
Mogelijke behoefte aan dosisaanpassingen bij chronisch gebruik
Tijdens langdurige behandeling wordt ongeveer 5% (28/627) van de patiënten ongevoelig voor toenemende doses. Er is onvoldoende ervaring om harde aanbevelingen te doen voor tolerantiebehandeling; deze "tolerantie" is echter af en toe, in het ziekenhuis, behandeld door een "drugsvakantie" bestaande uit de geleidelijke vermindering van LIORESAL 25 mg INTRATHECAL over een periode van 2 tot 4 weken en het overschakelen naar alternatieve methoden voor spasticiteitsbehandeling. Na de "drugsvakantie" kan LIORESAL INTRATHECAL opnieuw worden gestart met de initiële continue infusiedosis.
Stabiliteit
Parenterale geneesmiddelen moeten vóór toediening worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de container dit toelaten.
Leveringsspecificaties
De specifieke concentratie die moet worden gebruikt, hangt af van de totale benodigde dagelijkse dosis en van de afgiftesnelheid van de pomp. LIORESAL 10 mg INTRATHECAL kan verdunning vereisen bij gebruik met bepaalde implanteerbare pompen. Raadpleeg de handleiding van de fabrikant voor specifieke aanbevelingen.
Voorbereidingsinstructie
screening
Gebruik alleen de screeningampul van 1 ml (50 mcg/ml) voor bolusinjectie in de subarachnoïdale ruimte. Gebruik voor een bolusdosis van 50 mcg 1 ml van de ampul voor screening. Gebruik 1,5 ml baclofeninjectie van 50 mcg/ml voor een bolusdosis van 75 mcg. Gebruik voor de maximale screeningdosis van 100 mcg 2 ml baclofeninjectie van 50 mcg/ml (2 screeningampullen).
Onderhoud
Voor patiënten die andere concentraties nodig hebben dan 500 mcg/ml of 2000 mcg/ml, LIORESAL INTRATHECAL moet worden verdund .
LIORESAL 10 mg INTRATHECAAL moet worden verdund met steriel conserveermiddelvrij natriumchloride voor injectie, USP
Leveringsschema
LIORESAL 10 mg INTRATHECAL wordt meestal onmiddellijk na implantatie toegediend in een continue infusiemodus. Voor die patiënten bij wie programmeerbare pompen zijn geïmplanteerd en die een relatief bevredigende controle over continue infusie hebben bereikt, kan verder voordeel worden bereikt met behulp van complexere schema's van LIORESAL INTRATHECAL-toediening. Patiënten die 's nachts meer spasmen hebben, kunnen bijvoorbeeld een verhoging van 20% van hun infusiesnelheid per uur nodig hebben. Veranderingen in de stroomsnelheid moeten zo worden geprogrammeerd dat ze twee uur vóór het gewenste klinische effect beginnen.
HOE GELEVERD
LIORESAL INTRATHECAL (baclofen-injectie) is verpakt in ampullen voor eenmalig gebruik met 0,05 mg/1 ml (50 mcg/ml), 10 mg/20 ml (500 mcg/ml), 10 mg/5 ml (2000 mcg/ml) of 40 mg/20 ml ( 2000 mcg/ml) als volgt geleverd:
Screeningsdosis (model 8563s): vijf ampullen met elk 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (baclofen-injectie) Navulsets Elke navulset bevat de aangegeven hoeveelheid LIORESAL INTRATHECAL, een medicijnbereidingsset, een pompnavulset met accessoires die compatibel zijn met Medtronic SynchroMed®-infusiesystemen en bijbehorende instructies.
Model 8561 : één ampul met 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-01).
Model 8562 : twee ampullen, elk bevat 10 mg/5 ml (2000 mcg/ml) ( NDC 70257-561-02).
Model 8564 : één ampul met 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Model 8565 : twee ampullen, elk bevat 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-02).
Model 8566 : twee ampullen, elk bevat 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-02).
Opslag
Heeft geen koeling nodig.
Niet bewaren boven 86 ° F (30 ° C).
Niet bevriezen.
Niet verhitten steriliseren.
Gedistribueerd door: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Herzien: januari 2019
BIJWERKINGEN
Spasticiteit van de oorsprong van het ruggenmerg - Klinische studies
Vaak waargenomen bij patiënten met spasticiteit van spinale oorsprong
In klinische onderzoeken vóór en na het in de handel brengen waren de meest waargenomen bijwerkingen die verband hielden met het gebruik van LIORESAL 25 mg INTRATHECAL (injectie met baclofen) die niet met een equivalente incidentie werden gezien bij met placebo behandelde patiënten: slaperigheid, duizeligheid, misselijkheid, hypotensie, hoofdpijn, convulsies en hypotonie.
Geassocieerd met stopzetting van de behandeling
8/474 patiënten met spasticiteit van oorsprong uit het ruggenmerg die een langdurige infusie van LIORESAL 25 mg INTRATHECAL kregen in klinische pre- en postmarketingstudies in de VS, stopten met de behandeling vanwege bijwerkingen. Deze omvatten: pomppocketinfecties (3), meningitis (2), wonddehiscentie (1), gynaecologische vleesbomen (1) en pompoverdruk (1) met onbekende of geen gevolgen. Bij elf patiënten die een coma ontwikkelden als gevolg van een overdosis, werd hun behandeling tijdelijk stopgezet, maar ze werden allemaal opnieuw gestart en werden daarom niet als een echte stopzetting beschouwd.
dodelijke slachtoffers
Zien WAARSCHUWINGEN .
Incidentie in gecontroleerde onderzoeken
Ervaring met LIORESAL INTRATHECAL (injectie met baclofen) verkregen in parallelle, placebogecontroleerde, gerandomiseerde onderzoeken biedt slechts een beperkte basis voor het schatten van de incidentie van bijwerkingen, omdat de onderzoeken van zeer korte duur waren (tot drie dagen infusie) en slechts een totaal 63 patiënten. De volgende gebeurtenissen deden zich voor bij de 31 patiënten die LIORESAL INTRATHECAL (baclofen-injectie) kregen in twee gerandomiseerde, placebogecontroleerde onderzoeken: hypotensie (2), duizeligheid (2), hoofdpijn (2), dyspneu (1). Er werden geen bijwerkingen gemeld bij de 32 patiënten die placebo kregen in deze onderzoeken.
Gebeurtenissen waargenomen tijdens de pre- en postmarketingevaluatie van LIORESAL INTRATHECAL
Bijwerkingen die verband houden met het gebruik van LIORESAL 25 mg INTRATHECAL weerspiegelen de ervaring die is opgedaan met 576 patiënten die prospectief werden gevolgd in de Verenigde Staten. Ze kregen LIORESAL INTRATHECAL voor een periode van één dag (screening) (N = 576) tot meer dan acht jaar (onderhoud) (N = 10). De gebruikelijke screeningbolusdosis die voorafgaand aan pompimplantatie in deze onderzoeken werd toegediend, was typisch 50 mcg. De onderhoudsdosis varieerde van 12 mcg tot 2003 mcg per dag. Vanwege de open, ongecontroleerde aard van de ervaring, kan een causaal verband tussen de waargenomen gebeurtenissen en de toediening van LIORESAL INTRATHECAL in veel gevallen niet betrouwbaar worden beoordeeld en het is bekend dat veel van de gemelde bijwerkingen optreden in verband met de onderliggende aandoeningen die worden behandeld. Desalniettemin lijken veel van de vaker gemelde reacties - hypotonie, slaperigheid, duizeligheid, paresthesie, misselijkheid/braken en hoofdpijn - duidelijk gerelateerd aan het geneesmiddel.
Bijwerkingen gemeld tijdens alle Amerikaanse onderzoeken (zowel gecontroleerd als ongecontroleerd) worden weergegeven in de volgende tabel. Acht van de 474 patiënten die chronische infusie kregen via geïmplanteerde pompen, hadden nadelige ervaringen die leidden tot stopzetting van de langdurige behandeling in de pre- en postmarketingstudies.
INCIDENTITEIT VAN DE MEEST FREQUENTE (≥1%) BIJWERKINGEN BIJ PATINTEN MET SPASTICITEIT VAN DE SPINALE OORSPRONG IN PROSPECTIEF GECONTROLEERDE KLINISCHE ONDERZOEKEN
Naast de vaker voorkomende (1% of meer) bijwerkingen die zijn gemeld in de prospectief gevolgde 576 binnenlandse patiënten in pre- en postmarketingonderzoeken, heeft de ervaring van nog eens 194 patiënten die zijn blootgesteld aan LIORESAL 25 mg INTRATHECAL (injectie met baclofen) uit buitenlandse onderzoeken gemeld. De volgende bijwerkingen, niet beschreven in de tabel, en gerangschikt in afnemende volgorde van frequentie, en ingedeeld naar lichaamssysteem, werden gemeld:
Zenuwstelsel: Abnormaal lopen, abnormaal denken, tremor, geheugenverlies, spiertrekkingen, vasodilitatie, cerebrovasculair accident, nystagmus, persoonlijkheidsstoornis, psychotische depressie, cerebrale ischemie, emotionele labiliteit, euforie, hypertonie, ileus, drugsverslaving, incoördinatie, paranoïde reactie en ptosis.
Spijsverteringsstelsel: Winderigheid, dysfagie, dyspepsie en gastro-enteritis.
Cardiovasculair: Posturale hypotensie, bradycardie, hartkloppingen, syncope, ventriculaire aritmie, diepe tromboflebitis, bleekheid en tachycardie.
Ademhaling: Ademhalingsstoornis, aspiratiepneumonie, hyperventilatie, longembolie en rhinitis.
Urogenitaal: Hematurie en nierfalen.
Huid en aanhangsels: Alopecia en zweten.
Metabole en voedingsstoornissen: Gewichtsverlies, albuminurie, uitdroging en hyperglykemie.
Speciale zintuigen: Abnormaal zicht, abnormale accommodatie, fotofobie, smaakverlies en tinnitus.
Lichaam als geheel: Zelfmoord, gebrek aan medicijneffect, buikpijn, onderkoeling, nekstijfheid, pijn op de borst, koude rillingen, gezichtsoedeem, griepsyndroom en overdosering.
Hemic en lymfatisch systeem: Bloedarmoede.
Spasticiteit van cerebrale oorsprong - Klinische studies
algemeen waargenomen
In pre-marketing klinische onderzoeken waren de meest waargenomen bijwerkingen die verband hielden met het gebruik van LIORESAL 25 mg INTRATHECAL (injectie met baclofen) die niet met een equivalente incidentie werden gezien bij met placebo behandelde patiënten: agitatie, constipatie, slaperigheid, leukocytose, koude rillingen, urine retentie en hypotonie.
Geassocieerd met stopzetting van de behandeling
Negen van de 211 patiënten die LIORESAL INTRATHECAL kregen in pre-marketing klinische onderzoeken in de VS stopten met de langdurige infusie vanwege bijwerkingen die verband hielden met intrathecale therapie.
De negen bijwerkingen die leidden tot stopzetting waren: infectie (3), CSF-lekken (2), meningitis (2), drainage (1) en onhandelbare rompcontrole (1).
dodelijke slachtoffers
Drie sterfgevallen, waarvan geen enkele werd toegeschreven aan LIORESAL 10 mg INTRATHECAL, werden gemeld bij patiënten in klinische onderzoeken met patiënten met spasticiteit van cerebrale oorsprong. Zien Waarschuwingen over andere sterfgevallen gemeld bij patiënten met spinale spasticiteit .
Incidentie in gecontroleerde onderzoeken
Ervaring met LIORESAL INTRATHECAL (baclofen-injectie) verkregen in parallelle, placebogecontroleerde, gerandomiseerde onderzoeken biedt slechts een beperkte basis voor het schatten van de incidentie van bijwerkingen, omdat bij de onderzoeken in totaal 62 patiënten betrokken waren die werden blootgesteld aan een enkele intrathecale bolus van 50 mcg. De volgende gebeurtenissen deden zich voor bij de 62 patiënten die LIORESAL 10 mg INTRATHECAL kregen in twee gerandomiseerde, placebogecontroleerde onderzoeken waarbij respectievelijk patiënten met hersenverlamming en hoofdletsel betrokken waren: agitatie, constipatie, slaperigheid, leukocytose, misselijkheid, braken, nystagmus, koude rillingen, urineretentie en hypotonie.
Gebeurtenissen waargenomen tijdens de pre-marketing evaluatie van LIORESAL 25 mg INTRATHECAL
Bijwerkingen die verband houden met het gebruik van LIORESAL INTRATHECAL weerspiegelen de ervaring die is opgedaan met in totaal 211 Amerikaanse patiënten met spasticiteit van cerebrale oorsprong, van wie 112 pediatrische patiënten (jonger dan 16 jaar bij inschrijving). Ze kregen LIORESAL INTRATHECAL gedurende een periode van één dag (screening) (N= 211) tot 84 maanden (onderhoud) (N=1). De gebruikelijke screeningbolusdosis die voorafgaand aan pompimplantatie in deze onderzoeken werd toegediend, was 50-75 mcg. De onderhoudsdosering varieerde van 22 mcg tot 1400 mcg per dag. De doses die bij deze patiëntenpopulatie voor langdurige infusie worden gebruikt, zijn over het algemeen lager dan die nodig zijn voor patiënten met spasticiteit van oorsprong uit het ruggenmerg.
Vanwege de open, ongecontroleerde aard van de ervaring, kan een causaal verband tussen de waargenomen gebeurtenissen en de toediening van LIORESAL INTRATHECAL in veel gevallen niet betrouwbaar worden beoordeeld. Desalniettemin lijken veel van de vaker gemelde reacties - slaperigheid, duizeligheid, hoofdpijn, misselijkheid, hypotensie, hypotonie en coma - duidelijk gerelateerd aan het geneesmiddel.
De meest voorkomende (≥1%) bijwerkingen die tijdens alle klinische onderzoeken zijn gemeld, worden weergegeven in de volgende tabel. Negen patiënten staakten langdurige behandeling vanwege bijwerkingen.
INCIDENCE VAN DE MEEST FREQUENTE (≥ 1%) BIJWERKINGEN BIJ PATINTEN MET SPASTICITEIT VAN CEREBRALE OORSPRONG IN PROSPECTIEF GECONTROLEERDE KLINISCHE ONDERZOEKEN
De meer voorkomende (1% of meer) bijwerkingen die werden gemeld bij de prospectief gevolgde 211 patiënten die werden blootgesteld aan LIORESAL 25 mg INTRATHECAL (injectie met baclofen), zijn gemeld. In het totale cohort werden de volgende bijwerkingen, niet beschreven in de tabel, en gerangschikt in afnemende volgorde van frequentie, en ingedeeld naar lichaamssysteem, gemeld:
Zenuwstelsel: Acathisie, ataxie, verwardheid, depressie, opisthotonos, geheugenverlies, angst, hallucinaties, hysterie, slapeloosheid, nystagmus, persoonlijkheidsstoornis, verminderde reflexen en vasodilitatie.
Spijsverteringsstelsel: Dysfagie, fecale incontinentie, gastro-intestinale bloeding en tongaandoening.
Cardiovasculair: Bradycardie.
Ademhaling: Apneu, dyspnoe en hyperventilatie.
Urogenitaal: Abnormale ejaculatie, nierstenen, oligurie en vaginitis.
Huid en aanhangsels: Huiduitslag, zweten, alopecia, contactdermatitis en huidzweer.
Speciale zintuigen: Afwijking van de accommodatie.
Lichaam als geheel: Dood, koorts, buikpijn, carcinoom, malaise en onderkoeling.
Hemic en lymfatisch systeem: Leukocytose en petechiale uitslag.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld tijdens het gebruik van LIORESAL INTRATHECAL na goedkeuring. Omdat deze gebeurtenissen vrijwillig worden gerapporteerd vanuit een populatie van onbekende grootte, is het niet mogelijk om een betrouwbare schatting te maken van hun frequentie.
Musculoskeletaal
Het ontstaan van scoliose of verergering van een reeds bestaande scoliose is gemeld.
Urogenitaal
Er is melding gemaakt van seksuele disfunctie bij mannen en vrouwen, waaronder verminderd libido en orgasmestoornissen. Erectiestoornissen bij mannen zijn ook gemeld. Priapisme is gemeld na het stoppen met baclofen.
DRUG-INTERACTIES
Er is onvoldoende systematische ervaring met het gebruik van LIORESAL INTRATHECAL in combinatie met andere medicijnen om specifieke geneesmiddelinteracties te voorspellen. Interacties die worden toegeschreven aan het gecombineerde gebruik van LIORESAL INTRATHECAL en epidurale morfine omvatten hypotensie en dyspneu.
WAARSCHUWINGEN
LIORESAL INTRATHECAL is bestemd voor gebruik in intrathecale enkelvoudige bolusinjecties (via een katheter die in de lumbale intrathecale ruimte wordt geplaatst of injectie door middel van een lumbaalpunctie) en in implanteerbare pompen die door de FDA specifiek zijn goedgekeurd voor de intrathecale toediening van baclofen. Vanwege de mogelijkheid van mogelijk levensbedreigende depressie van het CZS, cardiovasculaire collaps en/of respiratoire insufficiëntie, moeten artsen adequaat worden opgeleid en opgeleid in chronische intrathecale infusietherapie.
Het pompsysteem mag pas worden geïmplanteerd als de respons van de patiënt op de bolus LIORESAL 10 mg INTRATHECAL-injectie adequaat is geëvalueerd. Evaluatie (bestaande uit een screeningsprocedure: zie DOSERING EN ADMINISTRATIE vereist dat LIORESAL 25 mg INTRATHECAL via een katheter of een lumbaalpunctie in de intrathecale ruimte wordt toegediend. Vanwege de risico's die gepaard gaan met de screeningprocedure en de aanpassing van de dosering na implantatie van de pomp, moeten deze fasen worden uitgevoerd in een medisch gecontroleerde en adequaat uitgeruste omgeving volgens de instructies die worden beschreven in de sectie Dosering en toediening.
Er moet beademingsapparatuur beschikbaar zijn.
Na chirurgische implantatie van de pomp, vooral tijdens de eerste fasen van het gebruik van de pomp, moet de patiënt nauwlettend worden gecontroleerd totdat het zeker is dat de reactie van de patiënt op de infusie acceptabel en redelijk stabiel is.
Elke keer dat de doseringssnelheid van de pomp en/of de concentratie van LIORESAL INTRATHECAL (baclofen-injectie) in het reservoir wordt aangepast, is nauwgezette medische controle vereist totdat het zeker is dat de reactie van de patiënt op de infusie acceptabel en redelijk stabiel is.
Het is verplicht dat de patiënt, alle zorgverleners van de patiënt en de artsen die verantwoordelijk zijn voor de patiënt adequate informatie krijgen over de risico's van deze behandelwijze. Alle medisch personeel en zorgverleners moeten worden geïnstrueerd in 1) de tekenen en symptomen van een overdosis, 2) de procedures die moeten worden gevolgd in geval van een overdosis en 3) de juiste thuiszorg van de pomp en de inbrengplaats.
Overdosis
Tekenen van een overdosis kunnen plotseling of sluipend optreden. Acute massale overdosering kan zich voordoen als coma. Minder plotselinge en/of minder ernstige vormen van overdosering kunnen zich voordoen met tekenen van slaperigheid, licht gevoel in het hoofd, duizeligheid, slaperigheid, ademhalingsdepressie, toevallen, rostrale progressie van hypotonie en bewustzijnsverlies dat overgaat in coma. Als overdosering waarschijnlijk lijkt, moet de patiënt onmiddellijk naar een ziekenhuis worden gebracht voor beoordeling en lediging van het pompreservoir. In gevallen die tot nu toe zijn gemeld, is een overdosis in het algemeen gerelateerd aan een pompstoring, onopzettelijke subcutane injectie of een doseringsfout. (Zien Symptomen en behandeling van overdosis drugs .)
Uiterste voorzichtigheid is geboden bij het vullen van een door de FDA goedgekeurde implanteerbare pomp. Dergelijke pompen mogen alleen worden bijgevuld via het bijvulseptum van het reservoir. Onbedoelde injectie in het onderhuidse weefsel kan optreden als het septum voor het bijvullen van het reservoir niet goed wordt bereikt. Sommige pompen zijn ook uitgerust met een kathetertoegangspoort die directe toegang tot de intrathecale katheter mogelijk maakt. Directe injectie in deze kathetertoegangspoort of onbedoelde injectie in het onderhuidse weefsel kan een levensbedreigende overdosis veroorzaken.
Opname
Abrupt staken van intrathecaal baclofen, ongeacht de oorzaak, heeft geresulteerd in gevolgen zoals hoge koorts, veranderde mentale toestand, overdreven rebound-spasticiteit en spierstijfheid die in zeldzame gevallen evolueerde tot rabdomyolyse, falen van meerdere orgaansystemen en overlijden. In de eerste 9 jaar van postmarketingervaring werden 27 gevallen van ontwenning gemeld die tijdelijk verband hielden met het staken van de behandeling met baclofen; zes patiënten overleden. In de meeste gevallen traden ontwenningsverschijnselen op binnen enkele uren tot enkele dagen na het onderbreken van de behandeling met baclofen. Veelvoorkomende redenen voor abrupte onderbreking van de intrathecale behandeling met baclofen waren onder meer een storing van de katheter (vooral loskoppeling), een laag volume in het pompreservoir en het einde van de levensduur van de pompbatterij; menselijke fouten kunnen in sommige gevallen een oorzakelijke of bijdragende rol hebben gespeeld. Gevallen van intrathecale massa aan het uiteinde van de geïmplanteerde katheter die leiden tot ontwenningsverschijnselen zijn ook gemeld, de meeste met in de apotheek samengestelde analgetische mengsels (zie PREVENTIEVE MAATREGELEN ).
Preventie van abrupte stopzetting van intrathecaal baclofen vereist zorgvuldige aandacht voor de programmering en bewaking van het infusiesysteem, de planning en procedures voor bijvullen en pompalarmen. Patiënten en zorgverleners moeten worden geïnformeerd over het belang van het houden van geplande navulbezoeken en moeten worden voorgelicht over de vroege symptomen van ontwenning van baclofen.
Alle patiënten die een intrathecale behandeling met baclofen krijgen, lopen mogelijk een risico op ontwenning. Vroege symptomen van ontwenning van baclofen kunnen zijn: terugkeer van spasticiteit bij aanvang, pruritus, hypotensie en paresthesieën. Priapisme kan optreden of terugkeren als de behandeling met intrathecaal baclofen wordt onderbroken. Sommige klinische kenmerken van het gevorderde intrathecale ontwenningssyndroom van baclofen kunnen lijken op autonome dysreflexie, infectie (sepsis), maligne hyperthermie, neuroleptica-maligne syndroom of andere aandoeningen die verband houden met een hypermetabolische toestand of wijdverbreide rabdomyolyse.
Snelle, nauwkeurige diagnose en behandeling op de eerste hulp of op de intensive care zijn belangrijk om de mogelijk levensbedreigende effecten op het centrale zenuwstelsel en de systemische effecten van intrathecale ontwenning van baclofen te voorkomen. De voorgestelde behandeling voor ontwenning van intrathecaal baclofen is het herstel van intrathecaal baclofen in of bijna dezelfde dosering als voordat de therapie werd onderbroken. Als herstel van intrathecale afgifte echter wordt vertraagd, kan behandeling met GABA-erge agonisten zoals orale of enterale baclofen, of orale, enterale of intraveneuze benzodiazepinen mogelijk fatale gevolgen voorkomen. Er mag niet worden vertrouwd op oraal of enteraal baclofen alleen om de progressie van intrathecale ontwenning van baclofen te stoppen.
Er zijn epileptische aanvallen gemeld tijdens overdosering en bij stopzetting van LIORESAL 25 mg INTRATHECAL, evenals bij patiënten die werden behandeld met therapeutische doses LIORESAL INTRATHECAL.
dodelijke slachtoffers
Spasticiteit van de oorsprong van het ruggenmerg
Er werden 16 sterfgevallen gemeld onder de 576 Amerikaanse patiënten die werden behandeld met LIORESAL 10 mg INTRATHECAL (injectie met baclofen) in pre- en postmarketingonderzoeken die in december 1992 werden geëvalueerd. Omdat deze patiënten werden behandeld in een ongecontroleerde klinische setting, is het onmogelijk om definitief te bepalen wat eventuele rol die LIORESAL INTRATHECAL speelde bij hun dood.
Als groep waren de patiënten die stierven relatief jong (gemiddelde leeftijd was 47 met een spreiding van 25 tot 63), maar de meerderheid leed aan ernstige spasticiteit van vele jaren, waren niet ambulant, hadden verschillende medische complicaties zoals longontsteking, urineweginfecties infecties, en decubiti, en/of meerdere gelijktijdige medicatie had gekregen. Een beoordeling per geval van het klinische beloop van de 16 overleden patiënten bracht geen unieke tekenen, symptomen of laboratoriumresultaten aan het licht die erop zouden wijzen dat behandeling met LIORESAL INTRATHECAL hun overlijden heeft veroorzaakt. Twee patiënten stierven echter plotseling en onverwachts binnen 2 weken na implantatie van de pomp en één patiënt stierf onverwachts na screening.
Eén patiënt, een 44-jarige man met MS, stierf in het ziekenhuis op de tweede dag na implantatie van de pomp. Een autopsie toonde ernstige fibrose van het coronaire geleidingssysteem aan. Een tweede patiënt, een 52-jarige vrouw met MS en een voorgeschiedenis van een myocardinfarct in de onderwand, werd 12 dagen na implantatie van de pomp dood in bed aangetroffen, 2 uur nadat ze normale vitale functies had gedocumenteerd. Een autopsie onthulde pulmonale congestie en bilaterale pleurale effusies. Het is onmogelijk vast te stellen of LIORESAL INTRATHECAL heeft bijgedragen aan deze sterfgevallen. De derde patiënt onderging drie screeningsonderzoeken naar baclofen. Zijn medische voorgeschiedenis omvatte dwarslaesie, aspiratiepneumonie, septische shock, gedissemineerde intravasculaire coagulopathie, ernstige metabole acidose, levertoxiciteit en status epilepticus. Twaalf dagen na screening (hij was niet geïmplanteerd) kreeg hij opnieuw status epilepticus met daaropvolgend significante neurologische achteruitgang. Op basis van voorafgaande instructies werden geen buitengewone reanimatiemaatregelen genomen en stierf de patiënt.
Spasticiteit van cerebrale oorsprong
Er waren drie sterfgevallen bij de 211 patiënten die met LIORESAL INTRATHECAL werden behandeld in premarketingonderzoeken vanaf maart 1996. Deze sterfgevallen werden niet toegeschreven aan de therapie.
Overinfusie
Toediening van meer geneesmiddelvolume dan de geprogrammeerde snelheid (overinfusie) kan leiden tot een onverwachte overdosis of onttrekking als gevolg van het vroegtijdig legen van het pompreservoir. Raadpleeg de handleiding van de fabrikant van de pomp en de instructies voor het bijvullen van het reservoir.
PREVENTIEVE MAATREGELEN
Kinderen moeten voldoende lichaamsgewicht hebben om plaats te bieden aan de implanteerbare pomp voor chronische infusie. Raadpleeg de handleiding van de pompfabrikant voor specifieke aanbevelingen.
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 4 jaar zijn niet vastgesteld.
screening
Patiënten dienen vóór het screeningsonderzoek met LIORESAL INTRATHECAL (injectie met baclofen) infectievrij te zijn, omdat de aanwezigheid van een systemische infectie de beoordeling van de respons van de patiënt op een bolus LIORESAL 10 mg INTRATHECAL kan verstoren.
Pompimplantatie
Patiënten moeten vóór de implantatie van de pomp infectievrij zijn, omdat de aanwezigheid van een infectie het risico op chirurgische complicaties kan verhogen. Bovendien kan een systemische infectie de dosering bemoeilijken.
Aanpassing en titratie van de pompdosis
Bij de meeste patiënten zal het nodig zijn om de dosis in de loop van de tijd geleidelijk te verhogen om de effectiviteit te behouden; een plotselinge behoefte aan substantiële dosisverhoging duidt typisch op een kathetercomplicatie (dwz katheterknik of losraken).
Het bijvullen van het reservoir moet worden uitgevoerd door volledig opgeleid en gekwalificeerd personeel volgens de instructies van de pompfabrikant. Onbedoelde injectie in het onderhuidse weefsel kan optreden als het septum voor het bijvullen van het reservoir niet goed wordt bereikt. Subcutane injectie kan leiden tot symptomen van een systemische overdosis of vroege uitputting van het reservoir. De bijvulintervallen moeten zorgvuldig worden berekend om te voorkomen dat het reservoir leeg raakt, aangezien dit zou leiden tot terugkeer van ernstige spasticiteit en mogelijk ontwenningsverschijnselen.
Strikte aseptische techniek bij het vullen is vereist om bacteriële contaminatie en ernstige infectie te voorkomen. Na elke bijvulling of manipulatie van het geneesmiddelreservoir moet een observatieperiode volgen die past bij de klinische situatie.
Uiterste voorzichtigheid is geboden bij het vullen van een door de FDA goedgekeurde implanteerbare pomp die is uitgerust met een injectiepoort die directe toegang tot de intrathecale katheter mogelijk maakt. Directe injectie in de katheter via de kathetertoegangspoort kan een levensbedreigende overdosis veroorzaken.
Aanvullende overwegingen met betrekking tot doseringsaanpassing
Het kan belangrijk zijn om de dosis te titreren om een zekere mate van spierspanning te behouden en af en toe spasmen toe te staan om: 1) de bloedsomloop te ondersteunen, 2) mogelijk de vorming van diepe veneuze trombose te voorkomen, 3) de dagelijkse activiteiten en het gemak van zorg te optimaliseren .
Behalve in noodsituaties die verband houden met een overdosis, moet de dosis LIORESAL 25 mg INTRATHECAL gewoonlijk langzaam worden verlaagd als het geneesmiddel om welke reden dan ook wordt stopgezet.
Er moet een poging worden gedaan om gelijktijdige orale antispasticiteitsmedicatie te staken om mogelijke overdosering of nadelige geneesmiddelinteracties te voorkomen, hetzij voorafgaand aan screening, hetzij na implantatie en aanvang van chronische LIORESAL INTRATHECAL-infusie. Vermindering en stopzetting van orale antispasmotica moet langzaam en onder zorgvuldige controle door de arts gebeuren. Abrupte vermindering of stopzetting van gelijktijdige antispastica moet worden vermeden.
Slaperigheid
Slaperigheid is gemeld bij patiënten die LIORESAL INTRATHECAL gebruiken. Patiënten moeten worden gewaarschuwd met betrekking tot de bediening van auto's of andere gevaarlijke machines en activiteiten die gevaarlijk worden door verminderde alertheid. Patiënten moeten ook worden gewaarschuwd dat de depressieve effecten van LIORESAL INTRATHECAL (injectie met baclofen) op het centrale zenuwstelsel kunnen worden toegevoegd aan die van alcohol en andere CZS-depressiva.
Intrathecale massa
Gevallen van intrathecale massa aan de punt van de geïmplanteerde katheter zijn gemeld, de meeste met in de apotheek samengestelde analgetische mengsels. De meest voorkomende symptomen die gepaard gaan met intrathecale massa zijn: 1) verminderde therapeutische respons (verergering van spasticiteit, terugkeer van spasticiteit wanneer deze voorheen goed onder controle was, ontwenningsverschijnselen, slechte respons op stijgende doses of frequente of grote dosisverhogingen), 2) pijn, 3) neurologische uitval/disfunctie. Artsen dienen patiënten die intraspinale therapie ondergaan zorgvuldig te controleren op nieuwe neurologische tekenen of symptomen. Overweeg bij patiënten met nieuwe neurologische tekenen of symptomen die wijzen op een intrathecale massa een neurochirurgisch consult, aangezien veel van de symptomen van inflammatoire massa niet verschillen van de symptomen die worden ervaren door patiënten met ernstige spasticiteit als gevolg van hun ziekte. In sommige gevallen kan het uitvoeren van een beeldvormende procedure geschikt zijn om de diagnose van een intrathecale massa te bevestigen of uit te sluiten.
Voorzorgsmaatregelen bij speciale patiëntenpopulaties
Zorgvuldige dosistitratie van LIORESAL 10 mg INTRATHECAL is nodig wanneer spasticiteit nodig is om de rechtopstaande houding en het evenwicht tijdens het voortbewegen te behouden of wanneer spasticiteit wordt gebruikt om een optimale functie en zorg te verkrijgen.
Patiënten die lijden aan psychotische stoornissen, schizofrenie of verwarde toestanden moeten voorzichtig worden behandeld met LIORESAL INTRATHECAL en onder zorgvuldig toezicht worden gehouden, omdat exacerbaties van deze aandoeningen zijn waargenomen bij orale toediening.
LIORESAL INTRATHECAL moet met voorzichtigheid worden gebruikt bij patiënten met een voorgeschiedenis van autonome dysreflexie. De aanwezigheid van nociceptieve stimuli of abrupte stopzetting van LIORESAL 10 mg INTRATHECAL (baclofen-injectie) kan een autonome dysreflexie-episode veroorzaken.
Omdat LIORESAL voornamelijk onveranderd door de nieren wordt uitgescheiden, moet het met voorzichtigheid worden gegeven aan patiënten met een verminderde nierfunctie en kan het nodig zijn de dosering te verlagen.
Laboratorium testen
Er worden geen specifieke laboratoriumtests essentieel geacht voor de behandeling van patiënten die LIORESAL INTRATHECAL gebruiken.
Carcinogenese, mutagenese en verminderde vruchtbaarheid
Er werd geen toename van tumoren waargenomen bij ratten die gedurende twee jaar oraal baclofen kregen. Adequate genotoxiciteitstesten van baclofen zijn niet uitgevoerd.
Zwangerschap
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. In dierstudies had baclofen nadelige effecten op de embryofoetale ontwikkeling bij orale toediening aan drachtige ratten. LIORESAL 25 mg INTRATHECAL mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Oraal toegediend baclofen verhoogde de incidentie van foetale structurele afwijkingen (omphaloceles) bij ratten. Bij de moederdieren werd een vermindering van de voedselinname en een toename van het lichaamsgewicht waargenomen. Foetale structurele afwijkingen werden niet waargenomen bij muizen of konijnen
Moeders die borstvoeding geven
Bij moeders die worden behandeld met oraal LIORESAL (baclofen USP) in therapeutische doses, gaat de werkzame stof over in de melk. Het is niet bekend of er detecteerbare niveaus van het geneesmiddel aanwezig zijn in de melk van moeders die borstvoeding geven, die LIORESAL 25 mg INTRATHECAL krijgen. Als algemene regel geldt dat borstvoeding gegeven moet worden terwijl een patiënt LIORESAL 25 mg INTRATHECAL krijgt, alleen als het mogelijke voordeel opweegt tegen de mogelijke risico's voor het kind.
Pediatrisch gebruik
Kinderen moeten voldoende lichaamsgewicht hebben om plaats te bieden aan de implanteerbare pomp voor chronische infusie. Raadpleeg de handleiding van de pompfabrikant voor specifieke aanbevelingen.
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 4 jaar zijn niet vastgesteld.
Overwegingen op basis van ervaring met oraal LIORESAL (baclofen USP)
Een dosisgerelateerde toename van de incidentie van ovariumcysten werd waargenomen bij vrouwelijke ratten die chronisch werden behandeld met oraal LIORESAL. Ovariumcysten zijn gevonden door palpatie bij ongeveer 4% van de patiënten met multiple sclerose die tot een jaar lang met orale LIORESAL 25 mg werden behandeld. In de meeste gevallen verdwenen deze cysten spontaan terwijl de patiënten het geneesmiddel bleven krijgen. Eierstokcysten komen naar schatting spontaan voor bij ongeveer 1% tot 5% van de normale vrouwelijke populatie.
OVERDOSERING
Er moet speciale aandacht worden besteed aan het herkennen van de tekenen en symptomen van overdosering, vooral tijdens de initiële screening- en dosistitratiefase van de behandeling, maar ook tijdens hernieuwde introductie van LIORESAL INTRATHECAL na een periode van onderbreking van de therapie.
Symptomen van LIORESAL INTRATHECALE overdosis
Slaperigheid, licht gevoel in het hoofd, duizeligheid, slaperigheid, ademhalingsdepressie, hypothermie, toevallen, rostrale progressie van hypotonie en bewustzijnsverlies dat zich ontwikkelt tot coma van maximaal 72 uur. looptijd. In de meeste gemelde gevallen was coma omkeerbaar zonder gevolgen nadat het geneesmiddel was stopgezet. Symptomen van een overdosis LIORESAL 25 mg INTRATHECAL werden gemeld bij een gevoelige volwassen patiënt na toediening van een intrathecale bolus van 25 mcg.
Behandelingssuggesties voor overdosering
Er is geen specifiek antidotum voor de behandeling van overdoses LIORESAL INTRATHECAL (baclofen-injectie); normaal gesproken moeten echter de volgende stappen worden ondernomen:
Als een lumbaalpunctie niet gecontra-indiceerd is, moet worden overwogen 30-40 ml CSF op te nemen om de baclofenconcentratie in CSF te verlagen.
CONTRA-INDICATIES
Overgevoeligheid voor baclofen. LIORESAL INTRATHECAL wordt niet aanbevolen voor intraveneuze, intramusculaire, subcutane of epidurale toediening.
KLINISCHE FARMACOLOGIE
Het precieze werkingsmechanisme van baclofen als spierverslapper en antispasticiteitsmiddel is niet volledig bekend. Baclofen remt zowel monosynaptische als polysynaptische reflexen op het ruggengraatniveau, mogelijk door de afgifte van excitatoire neurotransmitters uit de primaire afferente terminals te verminderen, hoewel acties op supraspinale plaatsen ook kunnen optreden en bijdragen aan het klinische effect. Baclofen is een structureel analoog van de remmende neurotransmitter gamma-aminoboterzuur (GABA) en kan zijn effecten uitoefenen door stimulatie van het GABAB-receptorsubtype.
Wanneer LIORESAL INTRATHECAL rechtstreeks in de intrathecale ruimte wordt geïntroduceerd, kunnen effectieve CSF-concentraties worden bereikt met resulterende plasmaconcentraties die 100 keer lager zijn dan die bij orale toediening.
Zowel bij mensen als bij dieren is aangetoond dat baclofen algemene CZS-onderdrukkende eigenschappen heeft, zoals blijkt uit de productie van sedatie met tolerantie, slaperigheid, ataxie en ademhalings- en cardiovasculaire depressie.
Farmacodynamiek van LIORESAL INTRATHECAL
Intrathecale bolus
Volwassen patiënten
Het begin van de werking is over het algemeen een half uur tot een uur na een intrathecale bolus. Het piekspasmolytische effect wordt ongeveer vier uur na toediening waargenomen en de effecten kunnen vier tot acht uur aanhouden. Het begin, de piekrespons en de werkingsduur kunnen per patiënt verschillen, afhankelijk van de dosis en de ernst van de symptomen.
Pediatrische patiënten
Het begin, de piekrespons en de werkingsduur zijn vergelijkbaar met die bij volwassen patiënten.
Continue infusie
De antispastische werking van LIORESAL 25 mg INTRATHECAL wordt voor het eerst waargenomen 6 tot 8 uur na het starten van de continue infusie. Maximale activiteit wordt waargenomen in 24 tot 48 uur.
Continue infusie
Er is geen aanvullende informatie beschikbaar voor pediatrische patiënten.
Farmacokinetiek van LIORESAL 25 mg INTRATHECAL
De farmacokinetiek van de CSF-klaring van LIORESAL 25 mg INTRATHECAL berekend op basis van intrathecale bolus- of continue infusiestudies benadert de CSF-turnover, wat suggereert dat eliminatie plaatsvindt door bulkstroomverwijdering van CSF.
Intrathecale bolus
Na een lumbale bolusinjectie van 50 of 100 mcg LIORESAL 10 mg INTRATHECAL bij zeven patiënten, was de gemiddelde CSF-eliminatiehalfwaardetijd 1,51 uur gedurende de eerste vier uur en was de gemiddelde CSF-klaring ongeveer 30 ml/uur.
Continue infusie
De gemiddelde CSF-klaring voor LIORESAL 10 mg INTRATHECAL (injectie met baclofen) was ongeveer 30 ml/uur in een onderzoek met tien patiënten op continue intrathecale infusie. Gelijktijdige plasmaconcentraties van baclofen tijdens intrathecale toediening zijn naar verwachting laag (0-5 ng/ml).
Beperkte farmacokinetische gegevens suggereren dat er tijdens de infusie van baclofen een lumbale-cisternale concentratiegradiënt van ongeveer 4:1 ontstaat langs de neuro-as. Dit is gebaseerd op gelijktijdige CSF-bemonstering via cisternale en lumbale tap bij 5 patiënten die continue baclofeninfusie op lumbaal niveau kregen in doses die verband houden met therapeutische werkzaamheid; de interpatiëntvariabiliteit was groot. Het verloop werd niet gewijzigd door de positie.
Zes pediatrische patiënten (leeftijd 8-18 jaar) die een continue intrathecale infusie van baclofen kregen in doses van 77-400 mcg/dag, hadden baclofenspiegels in het plasma van bijna of lager dan 10 ng/ml.
PATIËNT INFORMATIE
PrLIORESAL Intrathecaal (baclofen) Injectie 0,05 mg/ml, 0,5 mg/ml en 2 mg/ml
Alleen voor intrathecale injectie en infusie
Deze bijsluiter is deel III van een driedelige "Productmonografie" die werd gepubliceerd toen LIORESAL IT werd goedgekeurd voor verkoop in Canada en is speciaal ontworpen voor consumenten. Deze bijsluiter is een samenvatting en zal u niet alles vertellen over LIORESAL 10mg IT. Neem contact op met uw arts of apotheker als u vragen heeft over het geneesmiddel.
OVER DEZE MEDICIJN
Waar wordt het medicijn voor gebruikt:
LIORESAL 25 mg Intrathecaal behoort tot een groep geneesmiddelen die spierverslappers worden genoemd. Het wordt gebruikt om de overmatige stijfheid en/of spasmen die optreden bij verschillende ziekten, zoals bijvoorbeeld multiple sclerose, ziekten of verwondingen van het ruggenmerg en bepaalde hersenaandoeningen, te verminderen en te verlichten.
Wat het doet:
De oplossing wordt geïnjecteerd of geïnfundeerd in de vloeistofruimte rond het ruggenmerg met behulp van een speciale pomp die onder de huid van uw buik wordt geïmplanteerd. Vanuit de pomp wordt een constante hoeveelheid van de oplossing via een klein buisje in de vloeistofruimte rond het ruggenmerg gebracht.
Vanwege het gunstige effect op spiercontracties en de daaruit voortvloeiende pijnverlichting, verbetert LIORESAL Intrathecal uw mobiliteit en uw vermogen om uw dagelijkse activiteiten zonder hulp uit te voeren. LIORESAL 25 mg helpt u ook om meer profijt te hebben van fysiotherapie.
Wanneer het niet mag worden gebruikt:
U mag niet met LIORESALIT worden behandeld als u:
- allergisch (overgevoeligheid) bent voor LIORESAL 25 mg Intrathecaal of voor één van de andere bestanddelen van LIORESAL 10 mg Intrathecaal zoals hieronder vermeld.
Wat is het medicinale ingrediënt:
baclofen.
Wat de niet-medicinale ingrediënten zijn:
LIORESAL 25 mg IT bevat: natriumchloride en water voor injectie
In welke doseringsvormen komt het:
LIORESAL 25 mg Intrathecaal (baclofen-injectie) 0,05 mg/ml: Elke ampul van 1 ml bevat 0,05 mg baclofen voor intrathecale toediening.
LIORESAL Intrathecaal (baclofen-injectie) 0,5 mg/ml: Elke ampul van 20 ml bevat 10 mg baclofen voor intrathecale toediening.
LIORESAL 25 mg Intrathecaal (baclofen-injectie) 2 mg/ml: Elke ampul van 5 ml bevat 10 mg baclofen voor intrathecale toediening.
WAARSCHUWINGEN EN VOORZORGSMAATREGELEN
LIORESAL 10 mg Intrathecaal is geschikt voor veel, maar niet alle, patiënten met spierspasmen.
VOORDAT u LIORESAL 25 mgIT gebruikt, neem dan contact op met uw arts of apotheker als u:
- enige vorm van infectie hebben
- de ziekte van Parkinson of bepaalde psychische aandoeningen hebben die gepaard gaan met verwardheid
- epilepsie hebben (aanvallen)
- diabetes hebben
- ooit hartproblemen gehad
- ooit nierproblemen gehad
- ademhalingsproblemen hebben
- acute pijn in uw maag of darm heeft
- een verstoorde bloedcirculatie in uw hersenen heeft
- ooit plotselinge episodes van hoge bloeddruk, angst, overmatig zweten, "ganzenvlees", bonzende hoofdpijn en ongewoon trage hartslag als gevolg van een overreactie van uw zenuwstelsel op prikkels zoals opgezette blaas en darm, huidirritatie en pijn heeft gehad
Als een van deze waarschuwingen op u van toepassing is, kan het zijn dat uw arts u dit geneesmiddel niet wil geven of speciale voorzorgsmaatregelen wil nemen. Als u uw arts over een van deze dingen niet heeft verteld, vertel het hem/haar dan voordat u begint met LIORESAL 25 mg Intrathecale behandeling.
Als u denkt dat u allergisch bent, vraag dan uw arts om advies.
Rijvaardigheid en het gebruik van machines: LIORESAL Intrathecaal kan u slaperig of duizelig worden. Wees voorzichtig wanneer u een auto bestuurt of een machine gebruikt of dingen doet die zorgvuldige aandacht vereisen totdat u zich weer normaal voelt.
INTERACTIES MET DEZE MEDICIJN
Vertel het uw arts of apotheker als u andere geneesmiddelen gebruikt of kort geleden heeft gebruikt, inclusief kruidengeneesmiddelen en geneesmiddelen zonder recept (zonder recept verkrijgbaar). Sommige andere geneesmiddelen kunnen een wisselwerking hebben met LIORESAL 10 mgIT. Uw arts kan de dosering wijzigen of soms stoppen met een van de geneesmiddelen. Dit is vooral belangrijk voor de volgende geneesmiddelen:
- andere geneesmiddelen voor uw spastische aandoening
- geneesmiddelen voor de ziekte van Parkinson
- medicijnen tegen epilepsie
- geneesmiddelen die worden gebruikt om stemmingsstoornissen te behandelen, zoals antidepressiva en lithium
- medicijnen tegen hoge bloeddruk
- andere geneesmiddelen die de nieren aantasten, bijv. ibuprofen
- opiaten voor pijnverlichting
- geneesmiddelen die worden gebruikt om u te helpen slapen of om u te kalmeren
- geneesmiddelen die het centrale zenuwstelsel vertragen, bijv. antihistaminica en sedativa (sommige hiervan kunnen zonder recept worden gekocht)
Vertel uw arts of verpleegkundige altijd over alle medicijnen die u gebruikt. Dit betekent zowel medicijnen die u zelf heeft gekocht als geneesmiddelen op recept van uw arts.
Wees voorzichtig als u alcoholische dranken drinkt tijdens de behandeling met LIORESAL 25 mg Intrathecaal, aangezien u zich slaperiger of duizeliger kunt voelen dan normaal.
JUIST GEBRUIK VAN DEZE MEDICIJN
Gebruikelijke dosis
LIORESAL Intrathecaal mag alleen worden gegeven door ervaren artsen die speciale medische apparatuur gebruiken. U moet in het ziekenhuis blijven, in ieder geval aan het begin van de behandeling.
Uw arts zal een kleine hoeveelheid LIORESAL Intrathecal in uw ruggenmerg injecteren om te zien of het uw spierspasmen verbetert. Als dat zo is, wordt er een speciale pomp onder uw huid geïmplanteerd. De pomp zal u de hele tijd een kleine hoeveelheid geneesmiddel toedienen.
Het kan enkele dagen duren voordat u de hoeveelheid geneesmiddel weet die het beste bij u past, uw arts zal u gedurende deze tijd nauwlettend in de gaten houden.
Daarna zal uw arts u nog regelmatig willen zien om uw voortgang te controleren en ervoor te zorgen dat uw pomp goed werkt.
HET IS VAN HET UITERST BELANG DAT DE AFSPRAKEN OM DE POMP BIJ TE VULLEN WORDEN GEHOUDEN, ANDERS KUNNEN SPASMEN HERKOMEN OMDAT U GEEN HOGE GENOEG DOSERING LIORESAL INTRATHECAAL KRIJGT. ALS GEVOLG MOGELIJK NIET VERBETERD OF KAN VERERGEREN.
Als de spierspasticiteit niet verbetert of als u geleidelijk of plotseling weer spasmen krijgt, neem dan onmiddellijk contact op met uw arts.
Raadpleeg de documentatie van de pompfabrikant voor informatie over de juiste thuisverzorging van de pomp en de inbrengplaats.
Monitoring tijdens de behandeling met LIORESAL 10 mg Intrathecaal
U wordt nauwlettend gevolgd in een volledig uitgeruste en bemande omgeving tijdens de screeningfase en de dosistitratieperiode onmiddellijk na de implantatie van de pomp. U wordt regelmatig beoordeeld op uw doseringsvereisten, op mogelijke bijwerkingen of tekenen van infectie. Ook wordt de werking van het bezorgsysteem gecontroleerd.
Zwangerschap en borstvoeding
Vertel het uw arts als u zwanger bent of van plan bent zwanger te worden, aangezien LIORESAL 25 mg Intrathecaal niet mag worden gebruikt tijdens de zwangerschap of als u borstvoeding geeft. Vraag uw arts of apotheker om advies voordat u een geneesmiddel inneemt.
Uw arts zal met u het mogelijke risico bespreken van het gebruik van LIORESAL 25 mg intrathecaal tijdens de zwangerschap.
De arts zal beslissen of u in deze speciale situaties LIORESAL 10 mg intrathecaal mag krijgen. Slechts zeer kleine hoeveelheden LIORESAL 10 mg komen in de moedermelk terecht. Vraag uw arts of u borstvoeding wilt geven.
Overdosis
Neem in geval van een overdosis drugs onmiddellijk contact op met een arts uit de gezondheidszorg, de afdeling spoedeisende hulp van een ziekenhuis of een regionaal centrum voor vergiftigingsbestrijding, ook als er geen symptomen zijn.
Tekenen van overdosering kunnen plotseling of sluipend optreden, bijvoorbeeld door een storing van de pomp. Het is erg belangrijk dat u en degenen die voor u zorgen tekenen van overdosering herkennen. Als u één of een combinatie van de volgende symptomen ervaart, vertel dit dan onmiddellijk aan uw arts, aangezien de hoeveelheid geneesmiddel die u krijgt mogelijk te hoog is:
- ongebruikelijke spierzwakte (te weinig spierspanning)
- slaperigheid
- duizeligheid of duizeligheid
- overmatige speekselvloed
- misselijkheid of braken
- ademhalingsmoeilijkheden, toevallen of bewustzijnsverlies
- abnormaal lage lichaamstemperatuur
Gemiste dosis
Abrupt stoppen met LIORESAL 10 mg Intrathecaal kan leiden tot ernstige medische problemen en is in zeldzame gevallen fataal.
Tekenen dat uw pomp niet goed werkt of dat hij niet de juiste hoeveelheid medicatie afgeeft, zijn onder meer een toename of terugkeer van spasticiteit, jeuk, lage bloeddruk, licht gevoel in het hoofd, tintelend gevoel, hoge koorts, veranderde mentale toestand en spierstijfheid of nieuwe spierzwakte of verlamming. Het is belangrijk om het uw arts meteen te vertellen als u een van de bovenstaande symptomen ervaart.
BIJWERKINGEN EN WAT ER TE DOEN?
Zoals met alle geneesmiddelen kunnen patiënten die worden behandeld met LIORESAL 25 mg Intrathecaal bijwerkingen krijgen, hoewel niet iedereen ze krijgt. Deze komen vaker voor aan het begin van de behandeling tijdens uw verblijf in het ziekenhuis, maar ze kunnen ook later optreden en moeten met uw arts worden overlegd.
Heel gewoon: Slaperigheid, spierzwakte
Gemeenschappelijk: Gevoel van angst, sedatie en vermoeidheid (uitputting), zwakte in de benen, stijfheid in de spieren, duizeligheid/licht gevoel in het hoofd, hoofdpijn, slaperigheid, misselijkheid en/of braken, tintelingen in handen en voeten, slapeloosheid, onduidelijke spraak, longontsteking zwakte, koude rillingen, vermoeidheid, pijn, droge mond, huiduitslag en/of jeuk, zwelling van de enkels, voeten of onderbenen, gezwollen gezicht, ongewone nervositeit of rusteloosheid, verwardheid/desoriëntatie, constipatie, diarree, verminderde eetlust, overmatige speekselvloed, koorts/rillingen, urineproblemen, seksuele problemen.
Ongewoon: Stemmings- of mentale veranderingen, paranoia, extreem geluk voelen (euforie), verlies van spiercoördinatie (ataxie), abnormaal lage lichaamstemperatuur, geheugenverlies, continue oncontroleerbare oogbewegingen, verminderde smaakzin, moeite met slikken, buikpijn, haaruitval, overmatig zweten.
Bijzonder: Rusteloosheid, abnormaal langzame ademhaling.
Vertel het uw arts als u een ander effect opmerkt. Sommige bijwerkingen kunnen verband houden met het toedieningssysteem.
ERNSTIGE BIJWERKINGEN, HOE VAAK ZE GEBEUREN EN WAT TE DOEN
Dit is geen volledige lijst van bijwerkingen. Neem voor onverwachte effecten tijdens het gebruik van LIORESAL IT contact op met uw arts of apotheker.
HOE HET OP TE SLAAN?
Bewaar LIORESAL 10 mg IT-ampullen tussen 15-30°C (beschermen tegen hitte). Niet bevriezen. Niet verhitten steriliseren.
Houd alle geneesmiddelen buiten het bereik en zicht van kinderen.
Dit geneesmiddel wordt voorgeschreven voor uw specifieke medische probleem en alleen voor uw eigen gebruik. Geef niet aan andere mensen.
Gebruik geen verouderde medicijnen. Gooi ze veilig weg buiten het bereik van kinderen of breng ze naar uw apotheker, die ze voor u zal weggooien.
VERMOEDELIJKE BIJWERKINGEN MELDEN
U kunt alle vermoedelijke bijwerkingen die verband houden met het gebruik van gezondheidsproducten melden aan het Canada Vigilance Program op een van de volgende 3 manieren:
- Rapporteer online op www.healthcanada.gc.ca/medeffect
- Bel gratis op 1-866-234-2345
- Vul een Canada Vigilance Reporting Form in en:
- Fax gratis naar 1-866-678-6789, of
- Mail naar: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
Gefrankeerde etiketten, Canada Vigilance Reporting Form en de richtlijnen voor het melden van bijwerkingen zijn beschikbaar op de MedEffect™ Canada-website op www.healthcanada.gc.ca/medeffect.
OPMERKING: Als u informatie nodig heeft over de behandeling van bijwerkingen, neem dan contact op met uw gezondheidsprofessional. Het Canada Vigilance Program geeft geen medisch advies.
MEER INFORMATIE
Dit document plus de volledige productmonografie, opgesteld voor gezondheidswerkers, zijn te vinden op: http://www.novartis.ca of door contact op te nemen met de sponsor, Novartis Pharmaceuticals Canada Inc, op: 1-800-363-8883
