Behandeling voor vrouwen: Clomid 100mg, 25mg, 50mg Clomiphene Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Clomid 50 mg en hoe wordt het gebruikt?
Clomid 100 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van onvruchtbaarheid te behandelen bij vrouwen met ovulatoire insufficiëntie. Clomid kan alleen of met andere medicijnen worden gebruikt.
Clomid behoort tot een klasse geneesmiddelen die selectieve oestrogeenreceptormodulators worden genoemd.
Het is niet bekend of Clomid veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Clomid?
Clomid kan ernstige bijwerkingen veroorzaken, waaronder:
- buikpijn,
- opgeblazen gevoel,
- misselijkheid,
- braken,
- diarree,
- snelle gewichtstoename (vooral in uw gezicht en buik),
- weinig of geen plassen,
- pijn bij het ademen,
- snelle hartslag, en
- kortademigheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Clomid zijn:
- blozen (warmte, roodheid of tintelend gevoel),
- misselijkheid,
- braken,
- opgeblazen gevoel,
- borstpijn of gevoeligheid,
- hoofdpijn, en
- doorbraakbloeding of spotting
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Clomid. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
CLOMID (clomifeencitraattabletten USP) is een oraal toegediend, niet-steroïde, ovulatoir stimulerend middel dat chemisch wordt aangeduid als 2-[p-(2-chloor-1,2-difenylvinyl)fenoxy] triethylaminecitraat (1: 1). Het heeft de molecuulformule C26H28ClNO • C6H8O7 en een molecuulgewicht van 598,09. Het wordt structureel weergegeven als:
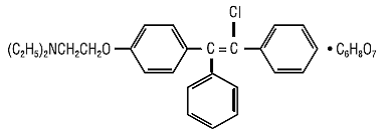
Clomifeencitraat is een wit tot lichtgeel, in wezen geurloos, kristallijn poeder. Het is vrij oplosbaar in methanol; oplosbaar in ethanol; enigszins oplosbaar in aceton, water en chloroform; en onoplosbaar in ether.
CLOMID 50 mg is een mengsel van twee geometrische isomeren [cis (zuclomifeen) en trans (enclomifeen)] die tussen 30% en 50% van het cis-isomeer bevatten.
Elke tablet met een witte breukstreep bevat 50 mg clomifeencitraat USP. De tablet bevat ook de volgende inactieve ingrediënten: maïszetmeel, lactose, magnesiumstearaat, gepregelatineerd maïszetmeel en sucrose.
INDICATIES
CLOMID 100 mg is geïndiceerd voor de behandeling van ovulatoire disfunctie bij vrouwen die zwanger willen worden. Belemmeringen voor het bereiken van zwangerschap moeten worden uitgesloten of adequaat worden behandeld voordat de behandeling met CLOMID 50 mg wordt gestart. Tot de patiënten met de meeste kans op succes met clomifeentherapie behoren patiënten met polycysteus ovariumsyndroom (zie: WAARSCHUWINGEN : Ovarieel hyperstimulatiesyndroom ), amenorroe-galactorroe-syndroom, psychogene amenorroe, post-orale anticonceptieve amenorroe en bepaalde gevallen van secundaire amenorroe van onbepaalde etiologie.
Een goed getimede coïtus in relatie tot de eisprong is belangrijk. Een basale lichaamstemperatuurgrafiek of andere geschikte tests kunnen de patiënt en haar arts helpen bepalen of de eisprong heeft plaatsgevonden. Zodra de eisprong is vastgesteld, moet elke kuur van 100 mg CLOMID worden gestart op of rond de 5e dag van de cyclus. Langdurige cyclische therapie wordt niet aanbevolen na een totaal van ongeveer zes cycli (inclusief drie ovulatoire cycli). (Zien DOSERING EN ADMINISTRATIE en PREVENTIEVE MAATREGELEN .)
CLOMID is alleen geïndiceerd bij patiënten met aangetoonde ovulatoire disfunctie die voldoen aan de hieronder beschreven voorwaarden:
Bovendien moeten patiënten die voor CLOMID-therapie zijn geselecteerd, worden beoordeeld op het volgende:
Er zijn geen adequate of goed gecontroleerde onderzoeken die de werkzaamheid van CLOMID 100 mg bij de behandeling van mannelijke onvruchtbaarheid aantonen. Bovendien zijn testiculaire tumoren en gynaecomastie gemeld bij mannen die clomifeen gebruiken. De oorzaak en gevolg-relatie tussen meldingen van testiculaire tumoren en de toediening van CLOMID 25 mg is niet bekend.
Hoewel de medische literatuur verschillende methoden suggereert, is er geen universeel geaccepteerd standaardregime voor gecombineerde therapie (dwz CLOMID in combinatie met andere ovulatie-inducerende geneesmiddelen). Evenzo is er geen standaard CLOMID-regime voor ovulatie-inductie in in-vitrofertilisatieprogramma's om eicellen te produceren voor bevruchting en herintroductie. Daarom wordt CLOMID 50 mg niet aanbevolen voor deze toepassingen.
DOSERING EN ADMINISTRATIE
Algemene Overwegingen
De opwerking en behandeling van kandidaten voor CLOMID 100 mg-therapie moet worden gecontroleerd door artsen die ervaring hebben met de behandeling van gynaecologische of endocriene aandoeningen. Patiënten mogen alleen worden gekozen voor therapie met CLOMID 50 mg na zorgvuldige diagnostische evaluatie (zie: INDICATIES ). Het behandelplan moet van tevoren worden geschetst. Belemmeringen voor het bereiken van het doel van de therapie moeten worden uitgesloten of adequaat worden behandeld voordat met CLOMID wordt begonnen. Het therapeutische doel moet worden afgewogen tegen mogelijke risico's en moet worden besproken met de patiënt en anderen die betrokken zijn bij het bereiken van een zwangerschap.
Ovulatie vindt meestal plaats van 5 tot 10 dagen na een CLOMID-kuur. Coïtus moet worden getimed om samen te vallen met de verwachte tijd van de eisprong. Passende tests om de ovulatie te bepalen kunnen in deze periode nuttig zijn.
Aanbevolen dosering
De behandeling van de geselecteerde patiënt moet beginnen met een lage dosis, 50 mg per dag (1 tablet) gedurende 5 dagen. De dosis mag alleen worden verhoogd bij patiënten die niet ovuleren als reactie op cyclisch 50 mg CLOMID. Een lage dosering of duur van de behandeling wordt met name aanbevolen als een ongebruikelijke gevoeligheid voor hypofysegonadotrofine wordt vermoed, zoals bij patiënten met polycysteus ovariumsyndroom (zie WAARSCHUWINGEN ; Ovarieel hyperstimulatiesyndroom ).
De patiënt moet zorgvuldig worden geëvalueerd om zwangerschap, vergroting van de eierstokken of vorming van cysten tussen elke behandelingscyclus uit te sluiten.
Als progestageen-geïnduceerde bloeding gepland is, of als spontane baarmoederbloeding optreedt voorafgaand aan de behandeling, moet het regime van 50 mg per dag gedurende 5 dagen worden gestart op of rond de 5e dag van de cyclus. De therapie kan op elk moment worden gestart bij de patiënt die geen recente baarmoederbloeding heeft gehad. Wanneer de eisprong bij deze dosering plaatsvindt, heeft het geen voordeel om de dosis in volgende behandelingscycli te verhogen.
Als er na de eerste kuur geen ovulatie lijkt op te treden, moet een tweede kuur van 100 mg per dag (twee tabletten van 50 mg gegeven als een enkele dagelijkse dosis) gedurende 5 dagen worden gegeven. Deze cursus kan al 30 dagen na de vorige worden gestart nadat voorzorgsmaatregelen zijn genomen om de aanwezigheid van zwangerschap uit te sluiten. Het wordt niet aanbevolen om de dosering of de duur van de therapie te verhogen tot meer dan 100 mg/dag gedurende 5 dagen.
De meerderheid van de patiënten die gaan ovuleren, doen dit na de eerste behandelingskuur. Als er geen ovulatie optreedt na drie therapiekuren, wordt verdere behandeling met CLOMID 50 mg niet aanbevolen en moet de patiënt opnieuw worden beoordeeld. Als er drie ovulatoire responsen optreden, maar er geen zwangerschap is bereikt, wordt verdere behandeling niet aanbevolen. Als de menstruatie niet optreedt na een ovulatoire respons, moet de patiënt opnieuw worden beoordeeld. Langdurige cyclische therapie wordt niet aanbevolen na in totaal ongeveer zes cycli (zie: PREVENTIEVE MAATREGELEN ).
HOE GELEVERD
NDC 0068-0226-30: 50 mg tabletten in dozen van 30 Tabletten zijn rond, wit, met een breukgleuf en de inscriptie CLOMID 50. Bewaar de tabletten bij een gecontroleerde kamertemperatuur 59-86 ° F (15-30 ° C). Beschermen tegen hitte, licht en overmatige vochtigheid en bewaren in gesloten containers.
Gefabriceerd door: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Herzien: juli 2017
BIJWERKINGEN
Bijwerkingen van klinische proeven.
CLOMID wordt in de aanbevolen doseringen over het algemeen goed verdragen. Bijwerkingen waren gewoonlijk licht en van voorbijgaande aard en de meeste verdwenen onmiddellijk nadat de behandeling werd stopgezet. Bijwerkingen die zijn gemeld bij patiënten die tijdens klinische onderzoeken met clomifeencitraat werden behandeld, worden weergegeven in tabel 2.
De volgende bijwerkingen zijn gemeld bij minder dan 1% van de patiënten in klinische onderzoeken: acute buik, toename van de eetlust, constipatie, dermatitis of uitslag, depressie, diarree, duizeligheid, vermoeidheid, haaruitval/droog haar, verhoogde frequentie/volume van urineren, slapeloosheid, licht gevoel in het hoofd, nerveuze spanning, vaginale droogheid, duizeligheid, gewichtstoename/-verlies.
Patiënten die langdurig met CLOMID 25 mg worden behandeld, kunnen verhoogde serumspiegels van desmosterol vertonen. Dit is hoogstwaarschijnlijk te wijten aan een directe interferentie met de cholesterolsynthese. De serumsterolen bij patiënten die de aanbevolen dosis CLOMID 50 mg krijgen, zijn echter niet significant veranderd. Eierstokkanker is zelden gemeld bij patiënten die vruchtbaarheidsmedicijnen hebben gekregen. Onvruchtbaarheid is een primaire risicofactor voor eierstokkanker; epidemiologische gegevens suggereren echter dat langdurig gebruik van clomifeen het risico op een borderline- of invasieve ovariumtumor kan verhogen.
Postmarketing bijwerkingen
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van Clomid na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: Koorts, tinnitus, zwakte
Cardiovasculair: Aritmie, pijn op de borst, oedeem, hypertensie, hartkloppingen, flebitis, longembolie, kortademigheid, tachycardie, tromboflebitis
Centraal zenuwstelsel: Migraine, hoofdpijn, paresthesie, toevallen, beroerte, syncope
dermatologisch: Acne, allergische reactie, erytheem, erythema multiforme, erythema nodosum, hypertrichose, pruritus, urticaria
Foetale/neonatale afwijkingen:
- Abnormale botontwikkeling: skeletmisvormingen van de schedel, het gezicht, de neusholtes, de kaak, de hand, de ledematen (ectromelia inclusief amelia, hemimelia en focomelia), voet (klompvoet), ruggengraat en gewrichten
- Hartafwijkingen: septum-hartafwijkingen, musculaire ventrikelseptumdefect, open ductus arteriosus, tetralogie van Fallot en coarctatie van de aorta
- Chromosomale aandoeningen: syndroom van Down
- Oorafwijkingen en doofheid
- Afwijkingen van het maagdarmkanaal: gespleten lip en gehemelte, imperforate anus, tracheo-oesofageale fistel, hernia diafragmatica, omphalocele
- Genitale afwijkingen: hypospadie, cloaca exstrofie
- Longweefsel misvormingen
- Misvormingen van het oog en de lens (cataract)
- Neoplasmata: neuroectodermale tumor, schildkliertumor, hepatoblastoom, lymfatische leukemie
- Zenuwstelselafwijkingen: neurale buisdefecten (anencefalie, meningomyelocele), microcefalie en hydrocephalus
- Nierafwijkingen: renale agenese en renale dysgenese
- Anderen: dwerggroei, mentale retardatie
Gastro-intestinaal: Pancreatitis
Urogenitaal: Endometriose, ovariumcyste (vergroting van de eierstokken of cysten kunnen als zodanig gecompliceerd worden door adnexale torsie), eierstokbloeding, eileiderszwangerschap, baarmoederbloeding, verminderde endometriumdikte
lever: Transaminasen verhoogd, hepatitis
Stofwisselingsstoornissen: Hypertriglyceridemie, in sommige gevallen met pancreatitis
Musculoskeletaal: Artralgie, rugpijn, myalgie
Neoplasmata: Lever (hepatisch hemangiosarcoom, leverceladenoom, hepatocellulair carcinoom); borst (fibrocystische ziekte, borstcarcinoom); endometrium (endometriumcarcinoom); zenuwstelsel (astrocytoom, hypofysetumor, prolactinoom, neurofibromatose, glioblastoom multiforme, hersenabces); eierstok (luteoma van zwangerschap, dermoid cyste van de eierstok, ovariumcarcinoom); trofoblastisch (hydatiforme mol, choriocarcinoom); diversen (melanoom, myeloom, perianale cysten, niercelcarcinoom, Hodgkin-lymfoom, tongcarcinoom, blaascarcinoom)
Psychiatrisch: Angst, prikkelbaarheid, stemmingswisselingen, psychose
Visuele stoornissen: Abnormale accommodatie, cataract, oogpijn, macula-oedeem, optische neuritis, fotopsie, achterste glasvochtloslating, retinale bloeding, retinale trombose, retinale vasculaire spasmen, tijdelijk of langdurig verlies van gezichtsvermogen, mogelijk onomkeerbaar.
Ander: Leukocytose, schildklieraandoening
DRUG-INTERACTIES
Geneesmiddelinteracties met CLOMID zijn niet gedocumenteerd.
Drugsmisbruik en afhankelijkheid
Tolerantie, misbruik of afhankelijkheid van CLOMID is niet gemeld.
WAARSCHUWINGEN
Visuele symptomen
Patiënten moeten erop worden gewezen dat tijdens de behandeling met CLOMID af en toe wazigheid of andere visuele symptomen zoals vlekken of flitsen (fonkelende scotomen) kunnen optreden. Deze visuele symptomen nemen toe in incidentie met toenemende totale dosis of therapieduur. Deze visuele stoornissen zijn meestal omkeerbaar; er zijn echter gevallen van langdurige visusstoornis gemeld, waarvan sommige optreden na stopzetting van CLOMID 50 mg. De visuele stoornissen kunnen onomkeerbaar zijn, vooral bij verhoogde dosering of duur van de therapie. Patiënten moeten worden gewaarschuwd dat deze visuele symptomen activiteiten als autorijden of het bedienen van machines gevaarlijker kunnen maken dan normaal, met name bij wisselende verlichting.
Deze visuele symptomen lijken het gevolg te zijn van intensivering en verlenging van nabeelden. Symptomen verschijnen vaak voor het eerst of worden geaccentueerd bij blootstelling aan een fel verlichte omgeving. Hoewel de gemeten gezichtsscherpte meestal niet werd beïnvloed, ontwikkelde een onderzoekspatiënt die dagelijks 200 mg CLOMID innam, wazig zien op de 7e dag van de behandeling, die zich op de 10e dag ontwikkelde tot ernstige vermindering van de gezichtsscherpte. Er werd geen andere afwijking gevonden en de gezichtsscherpte keerde terug naar normaal op de 3e dag nadat de behandeling was gestopt.
Oftalmologisch definieerbare scotomata en retinale celfunctie (elektroretinografische) veranderingen zijn ook gemeld. Een patiënt die tijdens klinische onderzoeken werd behandeld, ontwikkelde fosfenen en scotomata tijdens langdurige toediening van CLOMID 50 mg, die op de 32e dag na het stoppen van de therapie verdwenen.
Postmarketingsurveillance van bijwerkingen heeft ook andere visuele tekenen en symptomen aan het licht gebracht tijdens CLOMID-therapie (zie: ONGEWENSTE REACTIES ).
Hoewel de etiologie van deze visuele symptomen nog niet bekend is, moeten patiënten met visuele symptomen de behandeling stopzetten en onmiddellijk een volledige oftalmologische evaluatie laten uitvoeren.
Ovarieel hyperstimulatiesyndroom
Er is gemeld dat het ovarieel hyperstimulatiesyndroom (OHSS) optreedt bij patiënten die clomifeencitraattherapie krijgen voor ovulatie-inductie. OHSS kan snel verergeren (binnen 24 uur tot enkele dagen) en een ernstige medische aandoening worden. In sommige gevallen trad OHSS op na cyclisch gebruik van clomifeencitraattherapie of wanneer clomifeencitraat werd gebruikt in combinatie met gonadotropines. Voorbijgaande afwijkingen in leverfunctietesten die wijzen op leverdisfunctie, die gepaard kunnen gaan met morfologische veranderingen bij leverbiopsie, zijn gemeld in verband met OHSS.
OHSS is een medische gebeurtenis die verschilt van ongecompliceerde vergroting van de eierstokken. De klinische symptomen van dit syndroom in ernstige gevallen kunnen omvatten: grove vergroting van de eierstokken, gastro-intestinale symptomen, ascites, dyspneu, oligurie en pleurale effusie. Daarnaast zijn de volgende symptomen gemeld in verband met dit syndroom: pericardiale effusie, anasarca, hydrothorax, acute buik, hypotensie, nierfalen, longoedeem, intraperitoneale en eierstokbloeding, diepe veneuze trombose, torsie van de eierstok en acute respiratoire angst. De vroege waarschuwingssignalen van OHSS zijn buikpijn en opgezette buik, misselijkheid, braken, diarree en gewichtstoename. Verhoogde steroïde niveaus in de urine, verschillende gradaties van verstoring van de elektrolytenbalans, hypovolemie, hemoconcentratie en hypoproteïnemie kunnen voorkomen. Overlijden als gevolg van hypovolemische shock, hemoconcentratie of trombo-embolie is opgetreden. Vanwege de kwetsbaarheid van vergrote eierstokken in ernstige gevallen, moet buik- en bekkenonderzoek zeer voorzichtig worden uitgevoerd. Als de conceptie resulteert, kan een snelle progressie naar de ernstige vorm van het syndroom optreden.
Om het risico dat gepaard gaat met incidentele abnormale ovariumvergroting geassocieerd met CLOMID 100 mg-therapie te minimaliseren, moet de laagste dosis worden gebruikt die overeenkomt met de verwachte klinische resultaten. Maximale vergroting van de eierstok, fysiologisch of abnormaal, treedt mogelijk pas enkele dagen na stopzetting van de aanbevolen dosis CLOMID op. Sommige patiënten met polycysteus ovariumsyndroom die ongewoon gevoelig zijn voor gonadotropine, kunnen een overdreven respons hebben op de gebruikelijke doses CLOMID. Daarom moeten patiënten met polycysteus ovariumsyndroom worden gestart met de laagste aanbevolen dosis en de kortste behandelingsduur voor de eerste behandelingskuur (zie DOSERING EN ADMINISTRATIE ).
Als er een vergroting van de eierstok optreedt, mag geen aanvullende CLOMID-therapie worden gegeven totdat de eierstokken zijn teruggekeerd naar de grootte van voor de behandeling en moet de dosering of de duur van de volgende kuur worden verlaagd. Ovariumvergroting en cystevorming geassocieerd met CLOMID 50 mg-therapie nemen gewoonlijk spontaan af binnen enkele dagen of weken na stopzetting van de behandeling. Het potentiële voordeel van een daaropvolgende therapie met CLOMID 25 mg in deze gevallen zou groter moeten zijn dan het risico. Tenzij er een chirurgische indicatie voor laparotomie bestaat, moet een dergelijke cystische vergroting altijd conservatief worden behandeld.
Een causaal verband tussen ovariële hyperstimulatie en eierstokkanker is niet vastgesteld. Omdat echter een verband is gesuggereerd tussen eierstokkanker en nullipariteit, onvruchtbaarheid en leeftijd, moet een grondige evaluatie worden uitgevoerd om de aanwezigheid van ovariumneoplasie uit te sluiten als ovariumcysten niet spontaan achteruitgaan.
PREVENTIEVE MAATREGELEN
Algemeen
Er moet zorgvuldige aandacht worden besteed aan de selectie van kandidaten voor CLOMID-therapie. Bekkenonderzoek is noodzakelijk voorafgaand aan de CLOMID-behandeling en vóór elke volgende kuur (zie: CONTRA-INDICATIES en WAARSCHUWINGEN ).
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen toxiciteitsonderzoeken op lange termijn bij dieren uitgevoerd om het carcinogene of mutagene potentieel van clomifeencitraat te evalueren.
Orale toediening van CLOMID 25 mg aan mannelijke ratten in doses van 0,3 of 1 mg/kg/dag veroorzaakte verminderde vruchtbaarheid, terwijl hogere doses tijdelijke onvruchtbaarheid veroorzaakten. Orale doses van 0,1 mg/kg/dag bij vrouwelijke ratten onderbraken tijdelijk het normale cyclische vaginale uitstrijkpatroon en verhinderden conceptie. Doses van 0,3 mg/kg/dag verminderden het aantal geovuleerde eicellen en corpora lutea licht, terwijl 3 mg/kg/dag de ovulatie remde.
Zwangerschap
Samenvatting van het foetale risico
Het gebruik van CLOMID 100 mg bij zwangere vrouwen is gecontra-indiceerd, aangezien een behandeling met CLOMID 25 mg bij deze populatie geen voordeel biedt.
Beschikbare gegevens bij de mens duiden niet op een verhoogd risico op aangeboren afwijkingen boven het achtergrondpopulatierisico. Uit reproductietoxicologisch onderzoek bij dieren bleek echter toegenomen embryo-foetaal verlies en structurele misvormingen bij het nageslacht. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte zijn van de mogelijke risico's voor de foetus.
Klinische overwegingen
Om onbedoelde toediening van 25 mg CLOMID tijdens de vroege zwangerschap te voorkomen, moeten tijdens elke behandelingscyclus geschikte tests worden uitgevoerd om te bepalen of er ovulatie en/of zwangerschap optreedt. Patiënten moeten zorgvuldig worden geëvalueerd om vergroting van de eierstokken of vorming van cysten tussen elke behandelingscyclus uit te sluiten. De volgende kuur met CLOMID-therapie moet worden uitgesteld totdat deze aandoeningen zijn uitgesloten.
Menselijke gegevens
De beschikbare gegevens uit epidemiologische onderzoeken bij mensen laten geen duidelijke oorzaak-gevolgrelatie zien tussen periconceptuele blootstelling aan clomifeencitraat en een verhoogd risico op algemene geboorteafwijkingen of een specifieke afwijking. Vanwege het kleine aantal gevallen van aangeboren afwijkingen bij vrouwen die met clomifeencitraat werden behandeld, konden deze epidemiologische onderzoeken echter alleen grote risicoverschillen uitsluiten. De studies hielden geen rekening met factoren die verband houden met vrouwelijke subfertiliteit en konden niet corrigeren voor andere belangrijke confounders. Bovendien ondersteunen de beschikbare gegevens geen verhoogd aantal spontane abortussen bij subfertiele vrouwen die worden behandeld met clomifeencitraat voor ovulatie-inductie.
Diergegevens
Orale toediening van clomifeencitraat aan zwangere ratten tijdens organogenese in doses van 1 tot 2 mg/kg/dag resulteerde in hydramnion en zwakke, oedemateuze foetussen met golvende ribben en andere tijdelijke botveranderingen. Doses van 8 mg/kg/dag of meer veroorzaakten ook verhoogde resorpties en dode foetussen, dystokie en vertraagde partus, en 40 mg/kg/dag resulteerde in verhoogde maternale mortaliteit. Enkelvoudige doses van 50 mg/kg veroorzaakten foetale cataract, terwijl 200 mg/kg een gespleten gehemelte veroorzaakte. Na injectie van clomifeencitraat 2 mg/kg aan muizen en ratten tijdens de zwangerschap vertoonden de nakomelingen metaplastische veranderingen van het voortplantingsstelsel. Pasgeboren muizen en ratten die tijdens de eerste paar dagen van hun leven werden geïnjecteerd, ontwikkelden ook metaplastische veranderingen in de baarmoeder en vaginale mucosa, evenals voortijdige vaginale opening en anovulatoire eierstokken. Deze bevindingen zijn vergelijkbaar met het abnormale voortplantingsgedrag en de steriliteit beschreven met andere oestrogenen en anti-oestrogenen.
Bij konijnen werden enkele tijdelijke botveranderingen waargenomen bij foetussen van moederdieren die orale doses van 20 of 40 mg/kg/dag kregen tijdens de dracht, maar niet na 8 mg/kg/dag. In die onderzoeken werden geen blijvende misvormingen waargenomen. Ook hadden resusapen die orale doses van 1,5 tot 4,5 mg/kg/dag kregen gedurende verschillende perioden tijdens de zwangerschap geen abnormale nakomelingen.
Moeders die borstvoeding geven
Het is niet bekend of CLOMID wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, is voorzichtigheid geboden als CLOMID wordt toegediend aan een vrouw die borstvoeding geeft. Bij sommige patiënten kan CLOMID de lactatie verminderen.
Eierstokkanker
Langdurig gebruik van clomifeencitraattabletten USP kan het risico op een borderline- of invasieve ovariumtumor verhogen (zie ONGEWENSTE REACTIES ).
OVERDOSERING
Tekenen en symptomen
Toxische effecten die gepaard gaan met acute overdosering van CLOMID 50 mg zijn niet gemeld. Tekenen en symptomen van overdosering als gevolg van het gebruik van meer dan de aanbevolen dosis tijdens de behandeling met CLOMID 100 mg zijn misselijkheid, braken, vasomotorische flushes, wazig zien, vlekken of flitsen, scotomata, vergroting van de eierstokken met bekken- of buikpijn. (Zien CONTRA-INDICATIES : Ovariële cyste .)
Mondelinge LD50
De acute orale LD50 van CLOMID 25 mg is 1700 mg/kg bij muizen en 5750 mg/kg bij ratten. De toxische dosis bij mensen is niet bekend.
Dialyse
Het is niet bekend of CLOMID dialyseerbaar is.
Behandeling
In het geval van overdosering moeten naast maag-darmontsmetting passende ondersteunende maatregelen worden genomen.
CONTRA-INDICATIES
overgevoeligheid
CLOMID 100 mg is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid of allergie voor clomifeencitraat of voor een van de ingrediënten.
Zwangerschap
Het gebruik van CLOMID bij zwangere vrouwen is gecontra-indiceerd, aangezien CLOMID bij deze populatie geen voordeel biedt.
Beschikbare gegevens bij de mens duiden niet op een verhoogd risico op aangeboren afwijkingen boven het achtergrondpopulatierisico bij gebruik zoals aangegeven. Uit reproductietoxicologisch onderzoek bij dieren bleek echter toegenomen embryo-foetaal verlies en structurele misvormingen bij het nageslacht. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte zijn van de mogelijke risico's voor de foetus. (Zien PREVENTIEVE MAATREGELEN : Zwangerschap .)
Leverziekte
Behandeling met CLOMID 25 mg is gecontra-indiceerd bij patiënten met een leverziekte of een voorgeschiedenis van leverdisfunctie (zie ook: INDICATIES en ONGEWENSTE REACTIES ).
Abnormale baarmoederbloeding
CLOMID 25 mg is gecontra-indiceerd bij patiënten met abnormale uteriene bloedingen van onbepaalde oorsprong (zie INDICATIES ).
Ovariële cysten
CLOMID is gecontra-indiceerd bij patiënten met ovariumcysten of vergroting die niet het gevolg is van polycysteus ovariumsyndroom (zie INDICATIES en WAARSCHUWINGEN ).
Ander
CLOMID is gecontra-indiceerd bij patiënten met een ongecontroleerde schildklier- of bijnierdisfunctie of bij de aanwezigheid van een organische intracraniële laesie zoals een hypofysetumor (zie INDICATIES ).
KLINISCHE FARMACOLOGIE
Actie
CLOMID 25 mg is een geneesmiddel met een aanzienlijke farmacologische potentie. Met zorgvuldige selectie en goed beheer van de patiënt is aangetoond dat CLOMID 100 mg een nuttige therapie is voor de anovulatoire patiënt die zwanger wil worden.
Clomifeencitraat kan interageren met oestrogeenreceptorbevattende weefsels, waaronder de hypothalamus, hypofyse, eierstok, endometrium, vagina en baarmoederhals. Het kan concurreren met oestrogeen voor oestrogeenreceptorbindingsplaatsen en kan de aanvulling van intracellulaire oestrogeenreceptoren vertragen. Clomifeencitraat initieert een reeks endocriene gebeurtenissen die culmineren in een preovulatoire gonadotropinestijging en daaropvolgende folliculaire breuk. De eerste endocriene gebeurtenis als reactie op een kuur met clomifeentherapie is een toename van de afgifte van hypofyse-gonadotropines. Dit initieert steroïdogenese en folliculogenese, wat resulteert in groei van de ovariële follikel en een toename van het circulerende niveau van estradiol. Na de ovulatie stijgen en dalen plasmaprogesteron en estradiol zoals in een normale ovulatiecyclus.
Beschikbare gegevens suggereren dat zowel de oestrogene als de anti-oestrogene eigenschappen van clomifeen kunnen bijdragen aan het begin van de ovulatie. De twee clomifeen-isomeren blijken gemengde oestrogene en anti-oestrogene effecten te hebben, die van soort tot soort kunnen verschillen. Sommige gegevens suggereren dat zuclomifeen een grotere oestrogene activiteit heeft dan enclomifeen.
Clomifeencitraat heeft geen duidelijke progestationele, androgene of anti-androgene effecten en lijkt de hypofyse-bijnier- of hypofyse-schildklierfunctie niet te verstoren. Hoewel er geen bewijs is van een "overdrachtseffect" van CLOMID, zijn bij sommige patiënten spontane ovulatoire menstruatie waargenomen na behandeling met CLOMID 100 mg.
Farmacokinetiek
Op basis van vroege studies met 14C-gelabeld clomifeencitraat, werd aangetoond dat het geneesmiddel gemakkelijk oraal wordt geabsorbeerd door mensen en voornamelijk wordt uitgescheiden in de feces. De cumulatieve urinaire en fecale excretie van 14C bedroeg na 5 dagen gemiddeld ongeveer 50% van de orale dosis en 37% van een intraveneuze dosis. De gemiddelde excretie via de urine was ongeveer 8% met een fecale excretie van ongeveer 42%.
Er was 6 weken na toediening nog steeds een 14C-label in de feces aanwezig. Daaropvolgende onderzoeken met enkelvoudige doses bij normale vrijwilligers toonden aan dat zuclomifeen (cis) een langere halfwaardetijd heeft dan enclomifeen (trans). Detecteerbare niveaus van zuclomifeen hielden langer dan een maand aan bij deze proefpersonen. Dit kan wijzen op stereospecifieke enterohepatische recycling of sequestratie van het zuclomifeen. Het is dus mogelijk dat tijdens de vroege zwangerschap een actief geneesmiddel in het lichaam achterblijft bij vrouwen die tijdens de CLOMID-therapie zwanger worden in de menstruatiecyclus.
Klinische studies
Tijdens klinische onderzoeken kregen 7578 patiënten CLOMID, van wie sommigen andere belemmeringen voor de ovulatie hadden dan ovulatoire disfunctie (zie INDICATIES ). In die klinische onderzoeken vond bij ongeveer 30% van deze patiënten een succesvolle therapie, gekenmerkt door zwangerschap, plaats.
Er werden in totaal 2635 zwangerschappen gemeld tijdens de klinische proefperiode. Van die zwangerschappen was alleen informatie over de uitkomst beschikbaar voor 2369 van de gevallen. Tabel 1 vat de uitkomst van deze zaken samen.
Van de gemelde zwangerschappen was de incidentie van meerlingzwangerschappen 7,98%: 6,9% tweeling, 0,5% drieling, 0,3% vierling en 0,1% vijfling. Van de 165 tweelingzwangerschappen waarvoor voldoende informatie beschikbaar was, was de verhouding monozygote tot dizygote tweelingen ongeveer 1:5. Tabel 1 vermeldt de overlevingskans van de levende meerlingen.
Een zeslinggeboorte werd gemeld na voltooiing van oorspronkelijke klinische onderzoeken; geen van de sextuplets overleefde (elk wogen minder dan 400 g), hoewel ze er allemaal heel normaal uitzagen.
De totale overleving van zuigelingen van meerlingzwangerschappen, waaronder spontane abortussen, doodgeboorten en neonatale sterfte, is 73%.
Foetale/neonatale afwijkingen en sterfte
De volgende foetale afwijkingen zijn gemeld na zwangerschappen na ovulatie-inductietherapie met CLOMID tijdens klinische onderzoeken. Elk van de volgende foetale afwijkingen werd gemeld met een frequentie van
Daarnaast zijn er meldingen van aangeboren afwijkingen ontvangen tijdens postmarketingsurveillance van CLOMID (zie: ONGEWENSTE REACTIES ).
PATIËNT INFORMATIE
Het doel en de risico's van CLOMID-therapie moeten aan de patiënt worden voorgelegd voordat met de behandeling wordt begonnen. Benadrukt moet worden dat het doel van CLOMID-therapie de ovulatie is voor een volgende zwangerschap. De arts moet de patiënt adviseren met speciale aandacht voor de volgende mogelijke risico's:
Visuele symptomen
Adviseer dat wazigheid of andere visuele symptomen af en toe kunnen optreden tijdens of kort na de CLOMID-therapie. Het moet de patiënt duidelijk worden gemaakt dat in sommige gevallen de visuele stoornissen langer en mogelijk onomkeerbaar kunnen zijn, vooral bij een hogere dosering of duur van de behandeling. Waarschuw dat visuele symptomen activiteiten als autorijden of het bedienen van machines gevaarlijker kunnen maken dan normaal, vooral bij wisselende verlichting (zie WAARSCHUWINGEN ).
De patiënt moet worden geïnstrueerd om de arts te informeren wanneer zich ongebruikelijke visuele symptomen voordoen. Als de patiënt visuele symptomen heeft, moet de behandeling worden stopgezet en moet een volledige oftalmologische evaluatie worden uitgevoerd.
Buik-/bekkenpijn of uitzetting
Ovariumvergroting kan optreden tijdens of kort na de behandeling met CLOMID. Om de risico's van vergroting van de eierstokken tot een minimum te beperken, moet de patiënt de instructie krijgen om de arts te informeren over buikpijn, gewichtstoename, ongemak of zwelling na inname van CLOMID (zie WAARSCHUWINGEN ).
Meerlingzwangerschap
Informeer de patiënt dat er een verhoogde kans is op meerlingzwangerschap, inclusief bilaterale eileiderszwangerschap en naast elkaar bestaande eileiders en intra-uteriene zwangerschap, wanneer conceptie plaatsvindt in verband met CLOMID-therapie. De mogelijke complicaties en gevaren van meerlingzwangerschappen moeten worden uitgelegd.
Spontane abortus en aangeboren afwijkingen
Informeer de patiënt dat de beschikbare gegevens niet wijzen op een toename van het aantal spontane abortussen (miskraam) of aangeboren afwijkingen bij gebruik van 50 mg CLOMID door de moeder in vergelijking met de percentages in de algemene populatie.
Tijdens klinisch onderzoek blijkt uit de ervaring van patiënten met bekende zwangerschapsuitkomsten (tabel 1) een spontane abortus van 20,4% en een doodgeboorte van 1,0%. (Zien Klinische studies ). Van de geboorteafwijkingen die spontaan zijn gemeld als individuele gevallen sinds de commerciële beschikbaarheid van Clomid, was het aandeel neurale buisdefecten hoog bij zwangerschappen die verband hielden met door Clomid geïnduceerde ovulatie, maar dit werd niet ondersteund door gegevens uit populatiegebaseerde onderzoeken.
